攜帶人C基因型乙型肝炎病毒的表面抗原S基因的重組腺相關病毒載體及其構建方法與應用與流程
本發明涉及生物制藥領域,特別是涉及一種攜帶人C基因型乙型肝炎病毒的表面抗原(Hepatitis B virus surface antigen,HBsAg)基因(S基因)的重組腺相關病毒載體(rAAV)及其構建方法與其在制備抗人C基因型乙型肝炎病毒(Hepatitis B virus,HBV)感染性疾病的細胞免疫治療藥物中的應用。
背景技術:
目前,全球約有3.5億人患有慢性乙型病毒性肝炎(簡稱“乙肝”),僅在中國,每年約有50多萬人死于慢性乙型肝炎導致的肝臟損害和肝癌,每年因慢性乙肝(包括肝硬化、肝癌)直接經濟損失約9000億人民幣。乙肝的治療現狀尚不能令人滿意。對大多數慢性乙肝患者的治療主要以護肝降酶藥物為主,這類藥物并無抗病毒作用,只是輔助藥物。核苷類藥物抑制乙型肝炎病毒(Hepatitis B Virus,HBV)復制的作用很強,故能很快緩解肝臟炎癥,多數病人在數月內肝功能試驗就能正常。但這類藥物停藥后大多數病人將復發,而且停藥復發在少數病人可能導致災難性的后果。干擾素治療慢性乙肝能夠持續抑制HBV復制,使炎癥持續緩解,復發較少,抗病毒效果相當穩定。但達到這種治療效果的患者較少,其療效仍不理想。
目前,抗乙肝藥物療效不理想的主要原因之一是由于HBV DNA與患者的細胞染色體DNA整合,藥物無法清除整合的HBV DNA。因此,為達到徹底清除HBV,達到治愈乙肝的目的,必須清除存在于細胞中的HBV。為達到該目的,徹底清除受HBV感染的細胞是最主要的手段。細胞免疫反應的效應細胞,即細胞毒性T淋巴細胞(Cytotoxic T lymphocytes,CTL)可發揮這種作用。樹突狀細胞(Dedritic Cells,DC)是人體最重要、也是最主要的抗原提呈細胞。大量的研究已經證明無論在體內還是體外,DC細胞均可誘導或刺激產生具有抗病毒感染的細胞免疫反應,是靶向性細胞免疫治療的最主要的技術之一。
1984年,美國Paul L.Hermonat證明AAV載體可用于人類疾病的基因治療(Hermonat,P.L.,and Muzyczka,N.Use of adeno-associated virus as a mammalian DNA cloning vector:transduction of neomycin resistance into mammalian tissue culture cells.Proc.Natl.Acad.Sci.U.S.A.81:6466-6470.)。可將攜帶治療基因的AAV病毒注入患者體內,使其在體內表達治療基因,從而達到治療疾病的目的。2012年11月2日歐盟批準UniQure公司的Glybera產品在歐盟27個成員國使用,它是利用腺相關病毒I型(AAV-1)攜帶外源基因用于治療脂蛋白脂酶缺乏遺傳病(LPLD)的基因藥物。
腺相關病毒(Adeno-associated Virus,AAV)的基因結構已經被鑒定。1983年,Samulski等人描述了AAV的末端重復片段(上游5’端片段,下游3’端片段)(Samulski RJ,Srivastava A,Berns KI,Muzyczka N.Rescue of adeno-associated virus from recombinant plasmids:gene correction within the terminal repeats of AAV.Cell.33:135-143.)。1984年,Hermonat等人描述了AAV的低感染顆粒(Lip)基因和病毒衣殼(包膜,Cap)基因(Hermonat PL,Labow MA,Wright R,Berns KI,Muzyczka N.Genetics of adeno-associated virus:isolation and preliminary characterization of adeno-associated virus type 2mutants.J Virol.51:329-339.Hermonat,P.L.,and Muzyczka,N.Use of adeno-associated virus as a mammalian DNA cloning vector:transduction of neomycin resistance into mammalian tissue culture cells.Proc.Natl.Acad.Sci.U.S.A.81:6466-6470.)。1986年,Labow等人鑒定了位于上游5’端片段和復制蛋白(Rep)基因之間的p5啟動子(Labow MA,Hermonat PL,Berns KI.Positive and negative autoregulation of the adeno-associated virus type 2genome.J Virol.160:251-257.)。
AAV是一種非致病性的缺陷性病毒,需要其它病毒(如腺病毒)的基因產物輔助,才能裝配成為具有感染性的病毒顆粒。AAV基因組全長約4700堿基對(bp),兩端為重復末端片段(TR),中間為病毒的結構基因,結構基因包括與病毒復制有關的復制蛋白Rep基因和病毒衣殼(包膜)Cap基因。由于存在AAV病毒自身的不穩定性及其攜帶外源性基因(治療基因)長度有限等方面的缺陷,因此需要對其進行基因重組形成重組腺相關病毒(Recombinant Adeno-associated Virus,rAAV)。結合具有不同治療作用的外源性基因,rAAV的改造與選擇需要特殊考慮。目前,尚無基于腺相關病毒攜帶HBV相關基因的對抗乙型肝炎病毒的細胞免疫治療藥物。
技術實現要素:
本發明的第一個目的是提供一種攜帶人C基因型乙型肝炎病毒(簡稱“HBV-C”)的表面抗原基因(S基因),簡稱“HBV-C S基因”,的重組腺相關病毒載體。
本發明所提供的重組腺相關病毒載體,是將腺相關病毒(AAV)載體作為出發載體,將“HBV-C S基因”插入出發載體中,獲得一種全新的rAAV載體,即攜帶“HBV-C S基因”的重組腺相關病毒載體,簡稱“HBV-C S重組腺相關病毒載體”或“AAV/HBV-C S”。
所述HBV-C S基因的核苷酸序列如圖4所示。
所述的出發載體——腺相關病毒(AAV)載體是已經剔除腺相關病毒(AAV)結構基因Rep和Cap,并帶有AAV的p5啟動子(AAV p5)、巨噬細胞病毒(Cytomegalovirus,CMV)啟動子(CMVp)、猴空泡病毒40(Simian Vacuolating Virus40or Simian Virus 40,SV40)啟動子(SV40p)和beta肌動蛋白啟動子(β-actinp)中的任意一個啟動子的AAV載體。
所述四種出發載體已由本專利申請的發明人成功構建,構建方法參見中國專利ZL201110125683.X。
本發明的第二個目的是提供上述HBV-C S重組腺相關病毒載體(AAV/HBV-C S)的構建方法。
本發明所提供的構建方法,是將HBV-C S基因插入已將腺相關病毒結構基因Rep和Cap剔除并帶有啟動子的腺相關病毒(AAV)載體中,得到攜帶人C基因型乙型肝炎病毒表面抗原S基因的重組腺相關病毒載體(AAV/HBV-C S)。
在上述HBV-C S重組腺相關病毒載體的構建方法中,所述HBV-C S基因轉錄的啟動子可以選用AAV的p5啟動子(AAV p5)、巨噬細胞病毒(Cytomegalovirus,CMV)啟動子(CMVp)、猴空泡病毒40(Simian Vacuolating Virus 40or Simian Virus40,SV40)啟動子(SV40p)和beta肌動蛋白啟動子(β-actinp)中的任意一個。
本發明的第三個目的是提供與HBV-C S重組腺相關病毒載體(AAV/HBV-C S)相關的產品,包括重組腺相關病毒質粒、重組腺相關病毒和被本發明重組腺相關病毒載體感染或轉染的細胞系,所述細胞系為單核細胞-樹突狀細胞系。所述重組腺相關病毒載體中的相關基因—HBV-C S基因在單核細胞-樹突狀細胞系中在轉錄啟動子的作用下獲得表達,表達產物為人C基因型乙型肝炎病毒的表面抗原蛋白(HBsAg)。
所述與HBV-C S重組腺相關病毒載體(AAV/HBV-C S)相關的產品的制備方法,分別為:
攜帶HBV-C S基因的重組腺相關病毒質粒的制備:將HBV-C S重組腺相關病毒載體(AAV/HBV-C S)導入基因工程大腸桿菌(E.coli)DH5α感受態細胞,用含氨芐青霉素的LB平板進行抗性篩選,挑取白色單菌落,提取質粒并純化,得到HBV-C S重組腺相關病毒質粒;
攜帶HBV-C S基因的重組腺相關病毒的制備:以HBV-C S重組腺相關病毒載體質粒和pHelper質粒共轉染AAV-HEK293細胞得到重組腺相關病毒,命名為AAV/HBV-C S病毒;
攜帶HBV-C S基因的重組腺相關病毒載體感染或轉染的細胞系的制備:用重組腺相關病毒AAV/HBV-C S病毒分別或依次感染或轉染單核細胞和/或樹突狀細胞,得到被本發明HBV-C S重組腺相關病毒載體感染或轉染的細胞系。
實際用途方面,本發明的第四個目的是提供一種抗HBV-C病毒感染的細胞免疫治療的藥物及其相關技術。
本發明所提供的藥物的活性成分為上述HBV-C S重組腺相關病毒載體(AAV/HBV-C S)或與本發明HBV-C S重組腺相關病毒載體相關的產品,包括AAV/HBV-C S質粒、AAV/HBV-C S病毒、被AAV/HBV-C S病毒感染或轉染得到的單核細胞-樹突狀細胞。
以本發明的HBV-C S重組腺相關病毒為活性成分,可將HBV-C S重組腺相關病毒感染或轉染單核細胞(Mo),使HBV-C S基因導入單核細胞,并誘導產生樹突狀細胞(DC),亦可將HBV-C S重組腺相關病毒感染或轉染樹突狀細胞,使HBV-C S基因直接導入樹突狀細胞,表達人C基因型乙型肝炎病毒(HBV-C)的表面抗原(HBsAg)蛋白,從而能實現患者體外和體內免疫刺激,可用以治療HBV-C病毒感染所導致的疾病,或以該表達人C基因型乙型肝炎病毒(HBV-C)的表面抗原(HBsAg)蛋白的樹突狀細胞刺激產生的細胞毒性T淋巴細胞(CTL)治療HBV-C病毒感染所導致的疾病。
本發明所提供的藥物可采用溶劑或粉劑等劑型。
所述溶劑的選擇是多種多樣的,如細胞培養液(基)、生理鹽水或磷酸鹽緩沖液等均可。
需要的時候,在上述藥物中還可以加入一種或多種藥學上可接受的載體。所述載體包括藥學領域常規的稀釋劑、吸收促進劑和表面活性劑等。
用藥方式可為:先分離出患者體內的單核細胞,在體外將此藥感染或轉染患者的單核細胞(Mo),體外誘導單核細胞成為具有抗原提呈功能的樹突狀細胞(DC)。此藥亦可感染或轉染樹突狀細胞,但有可能導致樹突狀細胞對抗原的攝取或加工能力較差,從而導致療效不佳。所獲得的樹突狀細胞可回輸患者體內,達到治療目的。或將表達人C基因型乙型肝炎病毒(HBV-C)的表面抗原(HBsAg)的成熟的樹突狀細胞(DC)所刺激產生的細胞毒性T淋巴細胞(CTL)回輸患者,以取得更佳的療效,達到抗HBV-C病毒感染的目的。
上述藥物的用量一般為DC:1-5×108(個細胞)/每次,二周一次,療程通常為6次治療。劑量和療程可根據實際情況調整。
為提高療效,本發明的藥物還可以與抗生素、免疫刺激劑、靶向、核苷類以及化療等藥物等進行組合應用。
利用本發明能殺滅患者體內被HBV-C病毒感染的細胞。包括以下操作:
1)將患者體內自然產生的單核細胞(Mo)被重組腺相關病毒載體(AAV/HBV-C S)感染或轉染,再將單核細胞誘導成為樹突狀細胞(DC);或,先將單核細胞誘導成為樹突狀細胞(DC),再將樹突狀細胞被重組腺相關病毒載體(AAV/HBV-C S)感染或轉染;或,將所述樹突狀細胞(DC)被重組腺相關病毒載體相關的產品處理;各自得到處理后的細胞;
2)將步驟1)得到的DC輸入患者體內中,激活細胞毒性T淋巴細胞(CTL),該CTL殺滅被HBV-C病毒感染的細胞;或,將未被處理的T淋巴細胞與步驟1)得到的DC混合培養形成HBV-C HBsAg抗原特異性的細胞毒性T淋巴細胞(CTL),再將該CTL輸入患者體內殺滅被HBV-C病毒感染的細胞;或,將混合培養形成的HBV-C HBsAg抗原特異性的細胞毒性T淋巴細胞(CTL)和步驟1)得到的DC細胞輸入患者體內中,殺滅被HBV-C病毒感染的細胞。
殺滅被HBV-C病毒感染的細胞的方法可具體應用到臨床治療中,包括給予一個患者回輸具有HBV-C HBsAg抗原特異性的細胞毒性T淋巴細胞(CTL),該細胞由來源于患者或他人的自然產生的T淋巴細胞與來源于該患者的單核細胞-樹突狀細胞混合培養產生的。在混合培養之前,這些在單核細胞-樹突狀細胞已經被本發明攜帶HBV-C S基因的重組腺相關病毒抗原基因的重組腺相關病毒載體(AAV/HBV-C S)感染或者轉染,或被與本發明重組腺相關病毒載體(AAV/HBV-C S)相關的產品處理;
或者,給予一個患者回輸來源于患者或他人的單核細胞-樹突狀細胞。在回輸之前,這些在單核細胞-樹突狀細胞已經被本發明攜帶HBV-C S基因的重組腺相關病毒載體(AAV/HBV-C S)感染或者轉染,或被與本發明重組腺相關病毒載體(AAV/HBV-C S)相關的產品處理;
再或者,給予一個腫瘤患者回輸上述來源于患者的T淋巴細胞和來源于該患者或他人的自然產生的單核細胞-樹突狀細胞。在回輸之前,這些T淋巴細胞已經被本發明攜帶HBV-C S基因的重組腺相關病毒載體(AAV/HBV-C S)感染或者轉染的單核細胞-樹突狀細胞相關的產品處理;這些單核細胞-樹突狀細胞已經被本發明攜帶HBV-C S基因的重組腺相關病毒載體(AAV/HBV-C S)感染或者轉染。
本發明提供了一種攜帶人C基因型乙型肝炎病毒的表面抗原S基因的重組腺相關病毒載體(AAV/HBV-C S)及其構建方法。本發明的重組腺相關病毒載體(AAV/HBV-C S)可將其攜帶的HBV-C S基因輸送入單核細胞-樹突狀細胞系中,此細胞被用于刺激免疫系統的效應細胞(不局限于T淋巴細胞和B淋巴細胞)。體外實驗和初步的臨床試驗的結果證明,被本發明的AAV/HBV-C S病毒感染的單核細胞-樹突狀細胞和所誘導的細胞毒性T淋巴細胞(CTL)在體外或患者體內可有效地殺滅被HBV-C病毒感染的細胞。因而,本發明攜帶HBV-C S基因的重組腺相關病毒載體(AAV/HBV-C S)或與本發明重組腺相關病毒載體(AAV/HBV-C S)相關的產品可被用于制備抗HBV-C病毒感染的藥物,本發明在HBV-C的臨床治療和應用中具有重要的理論和實際意義,應用前景廣闊。
下面結合具體實施例對本發明做進一步詳細說明。
附圖說明
圖1為無AAV結構基因(Rep和Cap)并攜帶四種不同啟動子和HBV-C S基因的重組腺相關病毒載體AAV/HBV-C S的結構示意圖
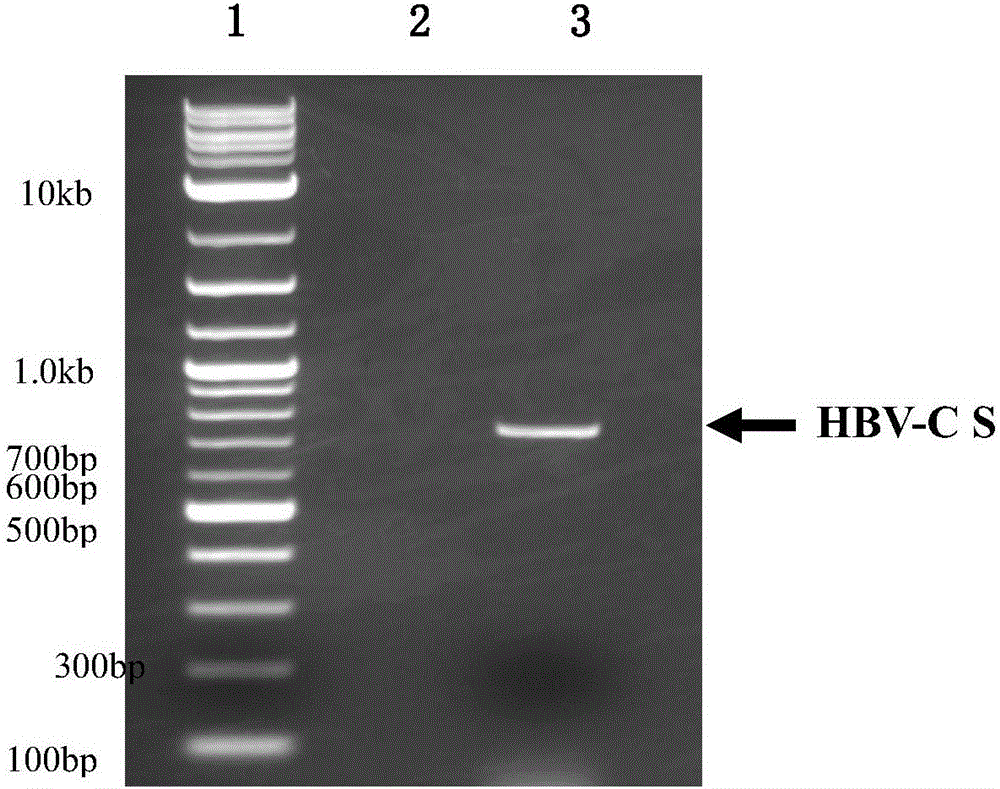
圖2為通過高保真PCR獲得的HBV-C S基因的1.5%瓊脂糖凝膠電泳檢測結果
圖3為重組腺相關病毒載體AAV/HBV-C S的酶切鑒定結果
圖4為重組腺相關病毒載體AAV/HBV-C S中HBV-C S基因的序列測定結果與基因庫中HBV-C S基因的序列比較結果
圖5為攜帶HBV-C S基因的重組腺相關病毒的制備方法流程圖
圖6為攜帶HBV-C S基因的重組腺相關病毒感染乙肝患者的單核細胞為基礎的殺滅HBV-C HBsAg抗原陽性細胞的實驗流程
圖7為攜帶四種不同啟動子(p5、CMVp、SV40p和β-actinp)和HBV-C S基因的AAV/HBV-C S重組腺相關病毒感染樹突狀細胞的前體細胞-單核細胞的效率的流式細胞技術檢測結果
圖8為攜帶CMVp啟動子和HBV-C S基因的AAV/CMVp/HBV-C S病毒感染的DC表達CD80和CD86水平的流式細胞技術檢測結果
圖9為分別攜帶CMVp啟動子和β-actinp啟動子的重組腺相關病毒感染的DC所誘導的CTL的IFN-γ表達水平的流式細胞技術檢測結果
圖10為AAV/HBV-C S重組腺相關病毒感染的DC所誘導的CTL體外殺傷HBV-C HBsAg陽性細胞和陰性細胞的51Cr(鉻-51)的殺傷率檢測結果
具體實施方式
本發明旨在提出一種基于腺相關病毒攜帶外源性基因的抗HBV病毒感染的細胞免疫治療藥物。
發明人意識到,對于一種基因治療藥物,關鍵之處在于特定外源性基因的確定以及rAAV的設計與選擇。
乙型肝炎病毒(Hepatitis B Virus,HBV)屬嗜肝DNA病毒科(hepadnaviridae),基因組長約3.2kb,為部分雙鏈環狀DNA。長的為負鏈,短的為正鏈。負鏈含3200個堿基,正鏈的長度可變。HBV基因組中4個開放讀碼框(ORF)均位于負鏈,其中的S區可分為S基因和前S基因二部分。S基因編碼的226個氨基酸組成的主要表面蛋白,就是乙型肝炎病毒表面抗原(Hepatitis B virus surface antigen,HBsAg),其具有較強的免疫原性。迄今為止,HBV可以分為A-H共8個基因型。HBV基因型分型依據全基因序列核苷酸同源性≥92%或S基因序列核苷酸同源性≥96%的標準,將不同病毒株分為不同基因型。不同的基因型的S基因編碼的氨基酸存在一定的差異,例如C基因型與B基因型的HBsAg存在10%左右的差異。發明人發現HBsAg在氨基酸的差異導致這兩種基因型的HBsAg所誘導的細胞免疫反應有所不同。例如HBV C基因型編碼的HBsAg誘導產生的人細胞毒性T淋巴細胞(Cytotoxic T Lymphocytes,CTL)攻擊HBV B基因型感染的肝細胞的能力較弱。
基于分析考慮,發明人在本發明提出的抗HBV病毒感染的細胞免疫治療藥物中明確:外源性基因為人C基因型乙型肝炎病毒(簡稱“HBV-C”)的表面抗原基因(S基因),簡稱“HBV-C S基因”;重組腺相關病毒載體的出發載體選擇發明人之前成功構建的已經剔除腺相關病毒(AAV)結構基因Rep和Cap,并帶有AAV的p5啟動子(AAV p5)、巨噬細胞病毒(Cytomegalovirus,CMV)啟動子(CMVp)、猴空泡病毒40(Simian Vacuolating Virus 40or Simian Virus 40,SV40)啟動子(SV40p)和beta肌動蛋白啟動子(β-actinp)中的任意一個啟動子的AAV載體。
以下對本發明做詳細描述。
下述實施例中所用方法如無特別說明均為常規方法,具體步驟可參見:《Molecular Cloning:A Laboratory Manual》(Sambrook,J.,Russell,David W.,Molecular Cloning:A Laboratory Manual,3rd edition,2001,NY,Cold Spring Harbor)。
所述百分比濃度如無特別說明均為質量/質量(W/W,單位g/100g)百分比濃度、質量/體積(W/V,單位g/100mL)百分比濃度或體積/體積(V/V,單位mL/100mL)百分比濃度。
實施例中描述到的各種生物材料的取得途徑僅是提供一種實驗獲取的途徑以達到具體公開的目的,不應成為對本發明生物材料來源的限制。事實上,所用到的生物材料的來源是廣泛的,任何不違反法律和道德倫理能夠獲取的生物材料都可以按照實施例中的提示替換使用。
所用引物合成及DNA序列測定均由美國Life Technology公司完成。
實施例在以本發明技術方案為前提下進行實施,給出了詳細的實施方式和具體的操作過程,實施例將有助于理解本發明,但是本發明的范圍不限于下述的實施例。
實施例1、重組腺相關病毒載體AAV/HBV-C S的構建和鑒定
一、材料及其來源:
A.出發載體:為四種分別具有不同啟動子的AAV 2型兩端完整的重復末端片斷(TR)序列,并在兩端TR的第75位核苷酸序列處均插入由9個核苷酸組成的序列片段[CGGCGCTGG,目的是提高重組AAV病毒(rAAV)的穩定性以及提高病毒的復制效率],且無任何AAV結構基因(Rep和Cap)的rAAV載體。該四種攜帶不同啟動子的rAAV載體中的啟動子分別是AAV p5啟動子(AAV p5)、巨噬細胞病毒(CMV)啟動子(CMVp)、SV40病毒早期啟動子(SV40p)以及人β-肌動蛋白(β-actin)啟動子(β-actinp)。該四種rAAV載體由本專利申請的發明人劉勇等構建(構建過程參見中國專利ZL201110125683.X)。
B.HBV-C DNA陽性血清:來源于HBV-C病毒感染的慢性乙肝患者的血清。
C.HBV-C S基因的PCR擴增引物:根據美國基因庫中公開發表的HBV-C S基因(美國NCI基因庫:AJ748098.1)的核苷酸序列進行設計,篩選確定上游引物:5’-gaatatggagagcacctca-3’,下游引物:5’-tggttttagcagggtttaaa-3’。此外,分別在上、下游引物的5’末端連接限制性內切酶EcoR V和Sal I的由6個核苷酸組成的堿基識別序列,以及3個堿基保護序列(GCC)。采用該對引物,通過PCR可擴增產生長度為720bp的HBV-C S基因。
用下述方法分別構建本發明攜帶HBV-C S基因的重組腺相關病毒載體AAV/HBV-C S(如圖1所示),具體過程包括以下步驟:
二、重組腺相關病毒載體的構建
A.獲取HBV-C S基因
采用酚/氯仿DNA抽提法提取DNA,方法為:取3mL HBV-C DNA陽性血清,與等體積的飽和酚劇烈混勻,低溫高速離心后,取上清液,再與等體積的氯仿劇烈混勻,低溫高速離心,獲取上清液后,用75%乙醇洗滌2次,再加入無水乙醇,離心沉淀,沉淀物即為DNA,用去離子水溶解沉淀物,將DNA濃度調至100ng/μL。以2μL DNA溶液為模板,在前述PCR擴增引物的引導下PCR擴增HBV-C S基因,PCR擴增條件為:先94℃4分鐘;再94℃30秒,60℃35秒,72℃45秒,共30個循環;最后72℃8分鐘,反應結束后,對PCR產物進行1.5%瓊脂糖凝膠電泳檢測,檢測結果如圖2(泳道1:DNA Marker;泳道2:陰性對照;泳道3:HBV-C S基因)所示,出現一條長度為720bp的特異性條帶,與預期結果相符。
B.構建rAAV載體
將獲得的HBV-C S基因插入分別攜帶啟動子AAV p5、CMVp、SV40p或β-actinp的四種rAAV載體中。方法為:首先進行限制性內切酶切反應,然后進行連接反應,其中,酶切反應體系為:100ng rAAV載體質粒、50ng HBV-C S基因、10U限制性內切酶EcoR V和Sal I(購自美國Promega公司)、2.5μL 10×緩沖液C以及19.5μL去離子水,酶切反應條件為:在37℃下水浴4小時;連接反應體系為:20ng酶切后的rAAV載體質粒、10ng HBV-C S基因、5U T4DNA連接酶(購自美國Promega公司)、1.5μL 10×T4DNA連接緩沖液以及11.5μL去離子水,連接反應條件為:4℃反應8小時,最后得到分別攜帶AAV p5、CMVp、SV40p或β-actinp啟動子及HBV-C S基因的四種重組腺相關病毒載體(分別命名為AAV/p5/HBV-C S、AAV/CMVp/HBV-C S、AAV/SV40p/HBV-C S和AAV/β-actinp/HBV-C S,統一命名為AAV/HBV-C S)。
C.將獲得的四種重組腺相關病毒載體AAV/HBV-C S分別導入基因工程大腸桿菌(E.coli)DH5α感受態細胞(美國Invitrogen公司),用含100μg/mL氨芐青霉素的LB平板進行抗性篩選,挑取白色單菌落,提取質粒并純化,得到AAV/HBV-C S質粒。
三、重組腺相關病毒載體的鑒定
A.限制性內切酶酶切鑒定
將獲得的四種AAV/HBV-C S質粒進行酶切鑒定,反應體系和反應條件如上所述,結果均如圖3(泳道1:DNA Marker;泳道2:EcoR V;泳道3:空白;泳道4:Sal I;泳道5:EcoR V+Sal I)所示,經EcoR V和Sal I酶切獲得了720bp的DNA條帶,與預期結果相符,表明HBV-C S基因成功插入載體,且位置正確。
B.DNA序列分析
將四種AAV/HBV-C S載體中HBV-C S基因的序列測定結果與基因庫中HBV-C S基因的序列進行比較,結果如圖4所示,表明99%的核苷酸同源(圖4中差異之處用加粗斜體表示),進一步證明獲得了HBV-C S基因序列及插入位置均正確的重組腺相關病毒載體AAV/HBV-C S。
實施例2、HBV-C S重組腺相關病毒的制備及病毒滴度測定
一、材料及其來源:
A.實施例1獲得的攜帶HBV-C S基因及四種不同啟動子的重組腺相關病毒質粒(AAV/p5/HBV-C S質粒、AAV/CMVp/HBV-C S質粒、AAV/SV40p/HBV-C S質粒和AAV/β-actinp/HBV-C S質粒,統稱AAV/HBV-C S質粒)。
B.含AAV的Rep基因和Lip/Cap基因的輔助質粒pHelper:由本專利申請的發明人劉勇等人構建(Liu,Y.,Chiriva-Internati,M.,Grizzi,F.Salati,E.,Roman,J.J.,Lim S.,and Hermonat,P.L.Rapid induction of cytotoxic T cell response against cervical cancer cells by human papillomavirus type 16E7antigen gene delivery into human dendritic cells by an adeno-associated virus vector.Cancer Gene Therapy 8:948-957.)。
C.含有整合于細胞染色體并表達的腺病毒基因(E1、E2A、E4、VAI和VAII基因)的AAV-HEK293細胞:由本專利申請的發明人劉勇等人建立(Liu,Y.,Chiriva-Internati,M.,Grizzi,F.Salati,E.,Roman,J.J.,Lim S.,and Hermonat,P.L.Rapid induction of cytotoxic T cell response against cervical cancer cells by human papillomavirus type 16E7antigen gene delivery into human dendritic cells by an adeno-associated virus vector.Cancer Gene Therapy 8:948-957.)。
D.脂質體轉染試劑Lipofectin:購自美國Life Technology公司。
E.DMEM培養基和胎牛血清(或小牛血清):購自美國Cellgro公司。
F.PCR DIG標記試劑盒和DIG雜交檢測試劑盒:購自瑞士Roche公司。
G.DNA拷貝數標準:分別為1012拷貝數(copies)/μL至108(copies)/μL,購自美國Promega公司。
二、制備HBV-C S重組腺相關病毒(AAV/HBV-C S病毒)
如圖5所示,用下述方法制備HBV-C S重組腺相關病毒。以制備一盤10.0cm細胞培養皿的病毒為例,當AAV-HEK293細胞在二氧化碳細胞培養箱中生長至約占培養皿面積70%時,進行如下操作:
A.按照Lipofectin的使用說明進行操作:將1.0μg AAV/HBV-C S質粒,1.0μg pHelper質粒,4.0μl Lipofectin和50.0μl含5%(V/V)胎牛血清(或小牛血清)的DMEM培養基混勻,室溫靜置20分鐘。
B.將混合液加入細胞培養皿中,繼續置于37℃、5%CO2恒溫二氧化碳細胞培養箱中培養。
C.72小時后,收獲培養皿中的所有細胞和培養液。
D.劇烈振蕩1分鐘后,離心,保留上清,即AAV/HBV-C S病毒液。
E.將收集的病毒液過濾除菌,分別得到AAV/p5/HBV-C S病毒、AAV/CMVp/HBV-C S病毒、AAV/SV40p/HBV-C S病毒和AAV/β-actinp/HBV-C S病毒,統稱AAV/HBV-C S病毒。
三、重組腺相關病毒(AAV/HBV-C S病毒)的病毒滴度測定
采用常規的斑點雜交法,對步驟一獲得的AAV/HBV-C S病毒進行病毒滴度測定,具體方法包括以下步驟:
A.采用常規的酚/氯仿提取法,提取AAV/HBV-C S病毒DNA。
B.將尼龍膜置于斑點印跡儀中,加入經堿變性的AAV/HBV-C S病毒DNA,并加入DNA拷貝數標準,抽真空。
C.取出尼龍膜干燥后,紫外線固定。
D.用PCR DIG標記試劑盒并參照試劑盒說明書制備DIG標記的特異性探針,探針為實施例1步驟C中獲得的HBV-C S DNA。PCR擴增結束后,對PCR擴增產物進行1.2%瓊脂糖凝膠電泳,在紫外線下檢測PCR擴增產物,結果出現720bp的陽性條帶,表明探針標記成功。
E.用DIG雜交檢測試劑盒并參照試劑盒說明書,在雜交爐中對各種AAV/HBV-C S病毒顆粒DNA進行DNA雜交。
結果四種重組腺相關病毒滴度在1011-1012拷貝(copies)/mL范圍內,表明獲得的AAV/HBV-C S病毒的病毒滴度較高,可以用于研究和臨床實踐。
實施例3、HBV-C S基因導入單核細胞-樹突狀細胞系為基礎的殺滅受HBV感染的細胞實驗
一、材料及其來源:
A.AAV/HBV-C S病毒:實施例2獲得的AAV/p5/HBV-C S病毒、AAV/CMVp/HBV-C S病毒、AAV/SV40p/HBV-C S病毒和AAV/β-actinp/HBV-C S病毒,統稱AAV/HBV-C S病毒。
B.AIM-V細胞培養基:購自美國Life Technology公司。
C.細胞因子:集落細胞刺激因子(GM-CSF)和白細胞介素2,4購自美國R&D公司。
D.原代HBV-C HBsAg陽性肝上皮細胞:由本專利申請的發明人劉勇等人使用已有技術從HBV-C感染的慢性乙肝患者的肝臟組織中分離獲得,已經證實其為HBsAg陽性。
E.原代HBV-C HBsAg陽性肝癌上皮細胞:由本專利申請的發明人劉勇等人使用已有技術從HBV-C感染的原發性肝癌患者的肝臟腫瘤組織組織中分離獲得,已經證實其為HBsAg陽性。
F.HBV-C HBsAg陰性的細胞:由本專利申請的發明人劉勇等使用已有技術從人的正常組織中分離獲得或從美國組織細胞保存中心(ATCC)獲得。包括肺、乳腺、肝臟和腎臟上皮細胞。
G.原代HBV B基因型(HBV-B)的HBsAg陽性肝上皮細胞:由本專利申請的發明人劉勇等人使用已有技術從HBV-B感染的慢性乙肝患者的肝臟組織中分離獲得,已經證實其為HBsAg陽性。
H.原代HBV-B的HBsAg陽性肝癌上皮細胞:由本專利申請的發明人劉勇等人使用已有技術從HBV-B感染的原發性肝癌患者的肝臟腫瘤組織組織中分離獲得,已經證實其為HBsAg陽性。
二、殺滅受HBV感染的細胞實驗
如圖6所示,以本發明AAV/HBV-C S病毒感染患者單核細胞為基礎的殺滅HBV-C HbsAg抗原陽性的細胞實驗過程包括以下步驟:
A.取肝炎患者約80mL-120外周血,采用淋巴細胞分離液,按常規方法獲取外周血單個核細胞(PBMC),也可采用血細胞分離儀分離PBMC,再與AIM-V培養基混勻后,加入細胞培養瓶,置于37℃、5%CO2恒溫二氧化碳培養箱中培養2小時。
B.除去懸浮細胞,保留貼壁細胞(單核細胞)。懸浮細胞即外周血淋巴細胞,將其與AIM-V培養基混勻后,繼續培養備用。
C.加入AAV/HBV-C S病毒,加入量約為100MOI,同時再加入GM-CSF(600IU/mL),繼續培養4小時。
D.除去舊培養基,補充含GM-CSF和IL-4(600IU/mL)的AIM-V培養基,繼續培養。
E.培養5天后,收獲成熟的樹突狀細胞(DC),并與所培養的外周血淋巴細胞混合,在AIM-V培養基中加入IL-2(10IU/mL),繼續培養。
F.培養至7-9天后,收獲激活的細胞毒性T淋巴細胞(CTL)進行檢測。
二、樹突狀細胞(DC)和細胞毒性T淋巴細胞(CTL)的檢測
A.AAV/HBV-C S病毒感染外周血單個核細胞的效率檢測
采用常規的熒光抗體標記染色法,用針對HBV-C HBsAg特異性熒光抗體(購自美國BD公司)標記步驟一獲得的被本發明AAV/HBV-C S感染的單核細胞或未成熟的DC,再進行流式細胞儀檢測陽性細胞的數量。其中,AAV/HBV-C S感染外周血單個核細胞的效率檢測結果如圖7所示,分別攜帶四種不同啟動子(p5、CMVp、SV40p和β-actinp)和HBV-C S基因的AAV/HBV-C S病毒感染外周血單核細胞的效率均在90%左右,即約90%的外周血單個核細胞可被AAV/HBV-C S病毒感染,證明本發明的AAV/HBV-C S病毒具有較高的感染效率。
B.樹突狀細胞(DC)的CD分子水平的檢測
樹突狀細胞(DC)表達CD80和CD86的水平與DC的功能呈正相關。用與步驟A相同的檢測方法,即分別采用熒光標記的針對這二種CD分子的抗體(購自美國BD公司)對步驟一獲得的DC表達CD80和CD86的水平進行檢測。其中,攜帶CMVp啟動子和HBV-C S基因的AAV/CMVp/HBV-C S病毒感染的DC表達CD80和CD86水平的檢測結果如圖8所示(以攜帶CMVp啟動子的重組腺相關病毒為代表),檢測結果表明DC可獲得高水平表達CD80(68.3%)和CD86(80.1%),表明本發明攜帶HBV-C S基因的重組腺相關病毒感染外周血單核細胞后,誘導的DC的激發細胞免疫反應的功能強大。
C.細胞毒性T淋巴細胞(CTL)表達的γ干擾素(IFN-γ)水平的檢測
細胞毒性T淋巴細胞(CTL)的功能及其殺傷靶細胞(受HBV感染的細胞)的能力與IFN-γ的表達水平呈正相關。用與步驟A類似的方法檢測被本發明的AAV/HBV-C S病毒感染的DC所誘導的CTL表達IFN-γ的水平。DC與外周血淋巴細胞混合培養結束后,收獲細胞,采用常規的胞內染色法進行細胞熒光染色標記,所用抗體為針對IFN-γ的熒光標記抗體(購自美國BD公司),最后利用流式細胞儀檢測結果。檢測結果如圖9所示,以分別攜帶CMVp啟動子和β-actinp啟動子的重組腺相關病毒為代表,被此二種rAAV感染的DC所誘導的CTL表達IFN-γ的水平均較高。表明被本發明的攜帶HBV-C S基因的r重組腺相關病毒感染的DC所誘導的CTL殺傷靶細胞(受HBV感染的細胞)的功能強大。
D.細胞毒性T淋巴細胞(CTL)殺傷靶細胞試驗
混合培養結束后,將步驟一中被AAV/HBV-C S病毒感染的樹突狀細胞(DC)所誘導的細胞毒性T淋巴細胞(CTL)按20:1(淋巴細胞:靶細胞)分別與HBV-C HBsAg陽性或陰性或HBV B基因型(HBV-B)HBsAg陽性的細胞混合后,采用傳統的51Cr(鉻-51)殺傷試驗,檢測CTL殺傷細胞的活性。被AAV/HBV-C S毒感染的DC所誘導的CTL對細胞殺傷率統計結果如圖10所示(縱坐標表示殺傷率),被本發明的AAV/HBV-C S病毒感染的DC所誘導的CTL能夠有效地裂解(殺傷)HBV-C HbsAg抗原陽性細胞(HBV-C HbsAg陽性的肝細胞和肝癌細胞,如圖10中左邊第1-2列),殺傷率為50%-60%范圍內。
以HBV-C HBsAg陰性細胞為對照,再用上述相同的方法檢測步驟一中被AAV/HBV-C S病毒感染的DC所誘導的細胞毒性T淋巴細胞(CTL)殺傷細胞的特異性。被AAV/HBV-C S病毒感染的DC所誘導的CTL對細胞殺傷率統計結果如圖10所示(縱坐標表示殺傷率),被本發明的AAV/HBV-C S病毒感染的DC所誘導的CTL對HBV-C HBsAg陰性細胞(腎、肺、乳腺、肝細胞,如圖10中右邊四列))無殺傷作用,證明被本發明的AAV/HBV-C S病毒感染的DC所誘導的CTL具有抗原特異性,即對HBV-C HBsAg抗原陰性的細胞無殺傷作用。
此外,還以HBV B基因型(HBV-B)的HBsAg陽性的肝上皮細胞和肝癌細胞為對照,再用上述相同的方法檢測步驟一中被AAV/HBV-C S病毒感染的DC所誘導的CTL殺傷HBV-B HBsAg陽性細胞的情況。被AAV/HBV-C S病毒感染的DC所誘導的CTL對細胞殺傷率統計結果如圖10所示(縱坐標表示殺傷率)。被本發明的AAV/HBV-C S病毒感染的DC所誘導的CTL對HBV-B HBsAg抗原陽性細胞(HBV-B HbsAg陽性的肝細胞和肝癌細胞,如圖10中左邊第3-4列)殺傷作用較低,殺傷率為15%-20%范圍內,表明被本發明的AAV/HBV-C S病毒感染的DC所誘導的CTL對非C基因型的HBV HBsAg陽性細胞的殺傷作用較低,即該殺傷作用具有HBV基因型的特異性,具有較強的抗原特異性。
上述檢測結果表明,被本發明的攜帶HBV-C S基因的重組腺相關病毒感染的DC所誘導的CTL對HBV-C HBsAg陽性細胞具有強大的殺傷(裂解)效果,可用于制備抗HBV-C病毒感染的藥物。
實施例4、靶向性抗HBV-C HBsAg陽性的乙型肝炎細胞免疫治療的初步臨床實驗
應用重組腺相關病毒-樹突狀細胞技術,即實施例3中被本發明的攜帶HBV-C S基因的重組腺相關病毒感染的樹突狀細胞(DC)所誘導的細胞毒性T淋巴細胞(CTL)回輸15例慢性乙型肝炎患者,所有患者已經被證實為HBV C基因型感染,且血清HBsAg和HBV-DNA陽性。CTL輸注量約為2×108(個細胞)/每次,二周一次,共6次。療程結束后,檢測患者的血清HBsAg和HBV-DNA,以判斷療效。治療過程中未觀察到嚴重不良反應及毒性反應。
4個月后的治療結果如下:
(1)血清HBsAg和HBV-DNA轉陰:1例;
(2)血清HBsAg滴度下降≥50%和HBV-DNA轉陰:5例;
(3)血清HBsAg下降<50%和HBV-DNA轉陰:4例;
(4)血清HBsAg下降≥50%和HBV-DNA仍為陽性:2例;
(5)血清HBsAg下降<50%和HBV-DNA仍為陽性:3例。
初步的臨床試驗結果進一步證明,被本發明的AAV/HBV-C S病毒感染的DC所誘導的CTL在患者體內能夠發揮一定療效,通過殺滅(裂解)被C基因型HBV(HBV-C)感染的細胞,從而殺滅C基因型HBV,且安全性較高,可用于制備抗C基因型HBV感染的藥物。
工業應用性
本發明提出了分別攜帶四種不同啟動子(AAV p5、CMVp、SV40p和β-actinp)和HBV-C S基因的重組腺相關病毒載體(AAV/HBV-C S)以及重組腺相關病毒(AAV/HBV-C S病毒),實驗證明,被AAV/HBV-C S病毒感染的樹突狀細胞(DC)所誘導的細胞毒性T淋巴細胞(CTL)在體內、外均可有效地通過裂解C基因型HBV(HBV-C)病毒感染的細胞,從而達到殺滅C基因型HBV病毒的目的。因而,本發明的四種不同啟動子(AAV p5、CMVp、SV40p和β-actinp)和HBV-C S基因的重組腺相關病毒載體(AAV/HBV-C S)及其相關的產品可被用于制備抗C基因型HBV(HBV-C)病毒感染的藥物,有應用價值。
- 還沒有人留言評論。精彩留言會獲得點贊!