一種靶向RegⅣ單鏈抗體的制作方法
本發明屬于生物技術領域,具體涉及一種靶向RegIV單鏈抗體的篩選,輕、重鏈可變區序列的獲得,表達載體的構建,RegIV單鏈抗體的制備、親和力的測定及其生物學活性驗證。
背景技術:
Reg蛋白家族屬于鈣依賴型植物凝集素超家族,根據其編碼蛋白的結構,Reg家族可分為四個亞型,即I、II、III、IV型,他們具有相似的基因結構,均含有5個內含子和6個外顯子,TATA盒和CCAAT盒位于轉錄起始位點上游的27和100bp處,編碼158-175個氨基酸長度不等的分泌蛋白。
RegIV是該基因家族的一員,其基因序列與Reg I部分同源,結構也有相似之處。人的RegIV基因位于1號染色體,屬于單拷貝基因,有5個內含子及6個外顯子,編碼158個氨基酸,包括22個氨基酸的信號肽及一個保守的鈣依賴碳氫化合物識別域。此碳水化合物識別域包括細胞識別、細胞遷移、細胞生長和細胞粘附在內多方面的生物學功能,從而使RegIV通過多種途徑在腫瘤的發展過程中起作用。
RegIV蛋白在結腸癌、胰腺癌、胃癌、前列腺癌等腫瘤細胞中呈過度表達,這種高表達能夠顯著促進腫瘤細胞增殖、侵襲和遷移,抵抗凋亡,加劇腫瘤細胞的未分化程度,并提高腫瘤細胞對化療藥物的耐受水平。RegIV蛋白對結腸癌細胞不僅有促有絲分裂作用,還有抗凋亡作用,并且有一部分是通過激活EGFR/Akt/AP-1信號通路發揮其作用。除此以外,RegIV蛋白也能加強腫瘤細胞對放射性殺傷的抵抗,其機制可能是通過上調Bcl-2、Bcl-xL和存活素等抗凋亡基因表達引起的。
RegIV蛋白能在多數癌癥患者中的血清中被檢出,且具有較高的準確性和靈敏度。在早期胃癌病人的血清中,RegIV的濃度顯著提高,血清RegIV的診斷靈敏度高于CEA和CA19-9兩個有效腫瘤標記物。此外,RegIV蛋白陽性的腫瘤患者存活時間顯著低于陰性患者(p=0.013)。血清RegIV蛋白水平檢測有助于癌癥患者的早期診斷和預后。
抗體庫技術為全人源抗體的篩選提供了良好的技術平臺,它繞過了以往單抗研制過程中必須的雜交瘤過程,甚至不需要經過免疫過程即可獲得各種抗體基因及抗體分子片段。1994年Winter等人創建了噬菌體抗體庫技術,是目前為止最成熟、應用最廣泛的制備抗體的技術。用人的外周血制備抗體文庫,將不同特異性的抗體或其功能片段(Fab、Fv、ScFv)表達在噬菌體表面,用固相化抗原對表達產物的載體進行淘篩,通過數輪“吸附-洗滌-洗脫-擴增”的 過程,直至得到高親和力的、特異性強的抗體。
技術實現要素:
發明目的:
本發明目的一在于提供一種靶向RegIV單鏈抗體的重鏈和輕鏈可變區核苷酸序列
本發明目的二在于提供一種靶向RegIV單鏈抗體的重鏈和輕鏈可變區氨基酸序列
本發明目的三在于提供一種具有潛在醫學和藥學價值的靶向RegIV單鏈抗體。
本發明的詳細描述:
本發明提供了靶向RegIV單鏈抗體的篩選,編碼此抗體的核酸和氨基酸序列,靶向RegIV單鏈抗體的構建、制備方法,親和力測定及其生物學活性的驗證。
在一個實施方案中,本發明提供了特異性結合RegIV的單鏈抗體,其特征在于:
所提供的抗體重鏈可變區和輕鏈可變區基因如SEQ ID NO:1~16所示;所提供的抗體重鏈可變區和輕鏈可變區氨基酸序列如SEQ ID NO:17~32所示。
在一個實施方案中,本發明提供了一種滲透壓休克法,用于分離純化上述抗體。
在一個實施方案中,本發明提供了一種生物膜干涉技術,用于檢測抗體的親和力。
本發明涉及高親和力特異性結合RegIV的單鏈抗體,包括但不限于例如單鏈抗體。在實施方案中,本發明的抗體包含特定的結構特征,例如包含特定氨基酸序列的CDR區。
在實施方案中,本發明的抗體是重組蛋白質,分離的蛋白質或基本上純的蛋白質。“分離的蛋白質至少伴隨一些其在天然狀態中所通常結合的物質,取決于情況,分離的蛋白質可構成總蛋白含量的5%至99.9%(按重量)。
在一個實施方案中,本發明涉及的抗體可以特異性結合RegIV蛋白,抑制高表達RegIV蛋白細胞的生長。
有益效果:
1.RegIV蛋白在胰腺癌細胞中高表達,能明顯促進腫瘤細胞的增殖、侵襲和遷移,抵抗細胞凋亡,加劇癌細胞的未分化程度,并促進腫瘤細胞對化療藥物產生耐受。因此,特異性阻斷RegIV蛋白功能的scFv在理論上具備抗腫瘤的作用。
2.抗體藥物在抗腫瘤領域的應用發展迅速,抗體藥物的特點是在于能特異性結合靶抗原,封閉靶分子功能或殺傷靶細胞。scFv作為新一代基因工程抗體,在封閉蛋白質分子功能方面具有極大的優越性。因此,利用scFv識別腫瘤高表達的RegIV蛋白,進而抑制RegIV蛋白功能的方法是可行的。
附圖說明
圖1為用噬菌體抗體庫對anti-RegIV scFv的篩選統計圖。其中圖1A描述篩選過程中,五輪回收率的統計柱狀圖;圖1B描述的是篩選的噬菌體單克隆Elisa柱狀圖。
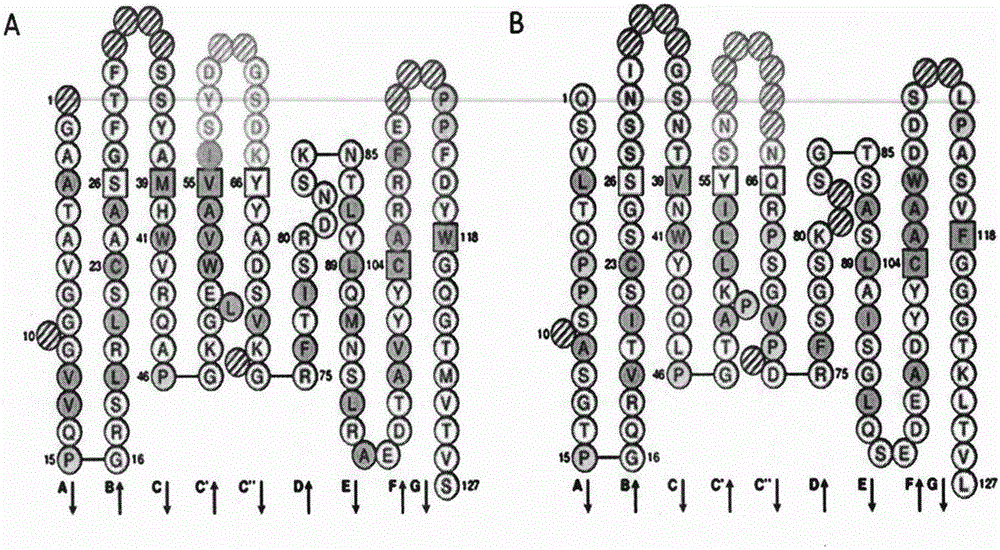
圖2為IMGT-VQUEST數據庫分析anti-RegIV scFv VH和VL的CDR區基因序列。其中圖2A描述的是anti-RegIV scFv VH的CDR區基因序列;圖2B描述的是anti-RegIV scFv VL的CDR區基因序列。
圖3為anti-RegIV scFv表達工程菌的構建電泳圖。其中圖3A為PCR擴增anti-RegIV scFv基因,目的基因大小約為750bp,泳道M為DNA Marker,泳道1、2為PCR擴增的目的基因,泳道3為pET-22b質粒;圖3B為anti-RegIV scFv基因插入pET-22b的表達質粒圖。
圖4為anti-RegIV scFv表達的SDS-PAGE圖。其中圖4A為SDS-PAGE檢測IPTG誘導大腸桿菌表達結果,泳道M為標準分子量蛋白,泳道1為IPTG誘導前的菌液樣品,泳道2為IPTG誘導后的菌液樣品;圖4B為SDS-PAGE檢測Ni親和層析柱純化產物結果,泳道M為標準分子量蛋白,泳道1為上樣前收集液,泳道2為上樣后收集液,泳道3為150mM咪唑洗脫液洗柱收集液。
圖5為Western Blot鑒定純化后anti-RegIV scFv,泳道M為標準分子量蛋白,泳道1為純化后的anti-RegIV scFv。
圖6為BLI技術檢測anti-RegIV scFv與RegIV蛋白之間的親和力。圖中描述了不同濃度(1500nM、750nM、375nM、187.5nM)的anti-RegIV scFv與RegIV之間的親和力,通過數據分析最終得到的Kd為8×10-9。
圖7為MTT檢測anti-RegIV scFv抑制PANC-1腫瘤細胞生長的折線圖。圖中描述了不同濃度(17nM、35nM、70nM、140nM、280nM、560nM)對PANC-1細胞的生長抑制率。
具體實施方式
為使本發明的上述目的、特點能夠更加明顯易懂,下面對本發明的具體實施方式做詳細的說明。
實施例1噬菌體抗體庫篩選抗RegIV的單鏈抗體
1.抗原RegIV
本發明使用的RegIV蛋白(NP_001152824.1)購于北京義翹神州生物技術有限公,含有158個氨基酸構成,純度>95%。
2.制備具有性纖毛的大腸桿菌宿主菌TG1
將TG1從甘油凍存管內平板劃線,接種于M9培養基平板,37℃倒置培養36h。挑取單克隆菌落,接種在5ml 2×YT培養基中,37℃搖床培養過夜。第二天,1/100稀釋接種于新鮮的2×YT培養基中,37℃搖床培養到對數期(OD600為0.4~0.6),然后感染噬菌體。
3.制備輔助噬菌體
將輔助噬菌體加入到200μL TG1菌培養液中(OD600為0.5),37℃水浴30分鐘后,加入到3mL融化的H-TOP瓊脂(42℃)中,然后鋪在溫熱的TYE平板上,冷卻后37℃培養過夜。挑取單個菌落接種到3~4mL處于對數期的TG1培養物中,37℃搖床培養2h。轉接到500mL 2×TY液體培養基(2L搖瓶)中,繼續培養1h,然后加入25mg/mL卡那霉素水溶液,至終濃度50~70μg/mL,繼續培養8~16h。10800g,4℃離心15分鐘,收集上清,加入1/5體積PEG/NaCl(20%PEG,2.5mol/LNaCl),冰上放置30分鐘。再次10800g,4℃離心15分鐘,沉淀重懸于2mLPBS緩沖液中,0.45μm膜過濾除菌。測定滴度,稀釋至1×1012p.f.u/mL。
4.擴增噬菌體抗體庫
a.取1mL保存的噬菌體抗體庫(大約1×1010p.f.u)接種到500mL2×TY培養基中(含有100μg/mL氨芐青霉素和1%葡萄糖)。37℃搖床培養到對數期(OD600為0.4~0.6),大約1.5~2h。
b.取25mL培養液(大約1×1010個細菌),用輔助噬菌體VCS-M13感染。感染比例為細菌數/輔助噬菌體數=1/20。于37℃水浴中,靜置30min。3300g,4℃離心10min,將沉淀重懸在30mL 2×TY培養基中(含有100μg/mL氨芐青霉素和25μg/mL卡那霉素)。將上述菌液添加到470mL已經37℃預溫的2×TY培養基中(含有100μg/mL氨芐青霉素和25μg/mL卡那霉素),30℃搖床培養過夜。
c.10800g,4℃離心10min或3300g,4℃離心30min。收集上清,加入1/5體積PEG/NaCl(20%PEG,2.5mol/LNaCl),徹底混合后4℃放置1h。再次10800g,4℃離心10min,沉淀重懸于40mL水和8mL PEG/NaCl(20%PEG,2.5mol/L NaCl)。10800g,4℃離心10min或3300g,4℃離心30min,吸棄離心上清。再次重懸沉淀,再次10800g,4℃離心10min,徹底吸棄上清。
d.將沉淀重懸于5mL PBS中,11600g,離心10min,去除細菌碎片(沉淀)。
5.固相親和篩選
a.取4mL CBS稀釋的蛋白(第1至第5輪淘選固定抗原的濃度分別為80,80,40,25,15μg/mL),加入到免疫試管中,室溫包被過夜。
b.棄上清,以PBS迅速洗管3次。免疫管中注滿3%BSA-PBS,37℃封閉2h。棄封閉液,用PBS迅速沖洗免疫管3次。將噬菌體抗體庫(1012~1013p.f.u)加入到免疫管中,再 加入3%BSA至4mL,。室溫反復倒轉30min后,于室溫靜置90min以上,
c.在進行第一輪篩選時,以含有0.1%Tween-20的PBS洗管10次,再以PBS洗管10次去除去污劑。第二輪以后的篩選,洗管次數增加(第二至第四輪淘選為20次,第五輪為30次)。將PBS吸干以后,加入1mL 100mmol/L三乙胺[700μL三乙胺(7.18mol/L)加入到50mL水中],室溫反復倒轉孵育10min,進行特異性洗脫。
d.用0.5mL 1mol/L Tris-HCl(pH7.4)迅速中和(7)特異洗脫下來的噬菌體。中和后的噬菌體可以直接4℃保存或用于(10)感染TG1菌。向免疫管中加入200μL 1mol/L Tris(pH7.4)中和殘余的噬菌體。取9.25mL處于對數期的TG1細菌培養物與0.75mL洗脫下來的噬菌體混合,另外向免疫管中加入4mL處于對數期TG1細菌培養物。兩者同時37℃水浴靜置30min。
e.從兩種已感染噬菌體的TG1細菌培養物中分別取100μL,并分別做4~5次100倍系列稀釋,然后將梯度稀釋物的噬菌體涂布TYE平板(含有100μg/mL氨芐青霉素和1%葡萄糖),37℃培養過夜。剩余的兩種已感染噬菌體的TG1細菌培養物3300g,4℃離心10min,菌體沉淀重懸于1mL 2×TY培養基中,使用Nunc Bio-Assay Dish鋪大型TYE平板(含有100μg/mL氨芐青霉素和1%葡萄糖)。30℃培養過夜或直至出現肉眼可見克隆。
f.向長滿細菌克隆的Nunc Bio-Assay Dish平板中加入5mL含有15%甘油2×TY培養基并用玻璃涂布棒刮取細菌并收集菌體懸液。取100μL菌體懸液加入到100mL 2×TY培養基中(含有100μg/mL氨芐青霉素和1%葡萄糖),37℃搖床培養至OD600≈0.5(約2h)。
g.加入輔助噬菌體VCS-M13感染,感染比例數為細菌數/輔助噬菌體數=1/20。37℃水浴靜置30min。將菌液3300g,4℃離心10min,菌體沉淀重懸于50mL 2×TY培養基中(含有100μg/mL氨芐青霉素和25μg/mL卡那霉素)。30℃搖床培養過夜。
h.取40mL過夜培養物,10800g,4℃離心10min或3300g,4℃離心30min。收集上清,加入1/5體積PEG/NaCl(20%PEG,2.5mol/L NaCl),徹底混合后4℃放置1h以上。再次10800g,4℃離心10min,沉淀重懸于40mL水和8mL PEG/NaCl。10800g,4℃離心10min或3300g,4℃離心30min,吸棄上清。沉淀重懸于2mL PBS中,11600g,4℃離心10min,盡量去除細菌碎片。取1mL噬菌體4℃保存,另1mL噬菌體用于下一輪親和篩選。
6.表一 五輪篩選回收率
7.單克隆噬菌體ELASA
a.從第5輪的平板上隨機挑區95株單克隆菌株和空白對照(只加培養基)到96孔U型細菌培養板中,37℃培養過夜。每孔取出菌液2μL,加入到另一塊新的96孔細菌培養板中;37℃培養1h后,每孔加入2×TY-AG培養基25μL和1×109pfu輔助噬菌體VCS-M13;在37℃靜止30min后,搖床培養1h。1800×g離心10min,棄上清液。將菌體沉淀重懸于200μL的2×TY-AG培養基中,30℃搖床培養過夜。1800×g離心10min,取上清液100μL用于ELISA實驗。
b.包被10μg·mL-1抗原,以3%BSA-PBS進行封閉(37℃封閉2h),用PBS洗3次后,每孔分別對應加入a中的上清液(以BSA為陰性對照)100μL,室溫放置90min;PBST(含有0.5%Tween-20的PBS)和PBS分別洗3次,每孔加入1∶5000稀釋的羊抗M13多克隆抗體100μL,37℃放置90min;PBST和PBS分別洗3次,沒孔加入1∶5000稀釋的HRP-兔抗羊IgG多克隆抗體100μL,37℃放置90min;PBST和PBS分別洗3次,加入TMB顯色30min后,每孔加入1M H2SO450μL終止反應。采用雙波長法于酶標儀上讀取數據。
實施例2anti-RegIV scFv的測序及分析
測序結果顯示,成功獲得兩種anti-RegIV scFv基因序列,利用IMGT/V-QUEST(http://www.imgt.org/)分析anti-RegIV scFv基因序列,分析結果表明:命名為D6的anti-RegIV scFv重、輕鏈可變區及其CDR1~3區基因序列如SEQ ID NO.1~8所示;命名為C9的anti-RegIV scFv重、輕鏈可變區及其CDR1~3區基因序列如SEQ ID NO.9~15所示。
實施例3anti-RegIV scFv的制備及純化
1.PCR擴增anti-RegIV scFv基因
利用從噬菌體庫篩選出的且測序分析正確的單克隆作為模板,對anti-RegIV scFv基因進行PCR擴增。分別選用EcoR I和Xho I作為上下游酶切位點,利用Primer5.0進行引物設計,其中D6F、C9F(上游引物)以及D6B、C9B(下游引物)序列為:
D6F:CCGGAATTCCCCAGGTGCAGCTACAGCAGT
D6B:CCGCTCGAGACCTAGGACGGTGAGCTTGGT
C9F:CCGGAATTCGCCCAGGTGCAGCTGCAG
C9B:CCGCTCGAGACGTTTGATATCCACTTTGGT
反應體系為50μL,反應條件為94℃4min,94℃30s,57℃45s,72℃1min,29個循環,72℃10min,4℃保存。取5μL終產物在1%瓊脂糖凝膠電泳上進行鑒定。PCR擴增獲得750bp左右的anti-RegIV scFv基因。用膠回收試劑盒(生工生物)對PCR產物進行純化回收。
2.PCR產物及載體雙酶切
用質粒小提試劑盒(生工生物)提取pET-22b質粒。再將PCR產物與pET-22b質粒分別進行雙酶切,所選用酶切位點為EcoR I和Xho I。反應體系為50μL。pET-22b質粒雙酶切反應條件:37℃4h;PCR產物雙酶切反應條件:37℃過夜。酶切產物經1%瓊脂糖凝膠電泳后用膠回收試劑盒(生工生物)進行純化回收。
3.酶切產物的連接
將回收的酶切產物anti-RegIV scFv基因片段與pET-22b質粒按摩爾比7∶1建立25μL連接體系,用T4連接酶16℃連接過夜。
4.連接產物的轉化及鑒定
采用CaCl2轉化法將連接產物轉化至感受態E.coli BL21中。具體操作如下:
a.在LB平板上挑取活化的E.coli BL21單菌落,接種于3mL LB液體培養基中,37℃、220rpm恒溫振蕩培養12小時左右,為對數生長后期。將該菌懸液以1∶100-1∶50的比例接種于100mL LB液體培養基中,37℃、220rpm恒溫振蕩培養1.5-2h,至測定OD600約為0.5。
b.將培養液轉入預冷無菌的2mL離心管中,放置于冰中放置10min,4℃、2400×g離心5min。
c.棄去上清,用2mL預冷的0.1M CaCl2輕輕重懸細胞沉淀,再次4℃、2400×g離心5min。
d.棄去上清,加入80μL 0.1M CaCl2溶液,輕輕懸浮細胞。
e.吸取80μL制備的感受態細胞于無菌的EP管中,用預冷無菌的槍頭吸取10μl連接產物加入EP管中,輕輕晃動以混勻內含物,于冰上放置30min。
f.將EP管快速放入42℃水浴中2min,切勿搖動EP管。
g.迅速將EP管轉至冰浴中冷卻1~2min,在EP管中加入SOC培養基800μL,放入37℃恒溫搖床中,低速搖動溫育45min。
h.取適量含有感受態細胞的溶液轉移至含有100μg/mL Amp的LB固體培養基平板上,37℃恒溫培養至液體全部被吸收。倒置平板,37℃培養過夜。
從LB固體培養基上隨機挑區單菌落與液體LB培養基中培養過夜,吸取少量菌液進行菌落PCR,經1%瓊脂糖凝膠電泳初步鑒定,再將陽性克隆進行基因測序分析。
5.anti-RegIV scFv的表達、純化、鑒定
將構建好的重組表達菌株接種于LB(100μg/mL Amp)液體培養基,37℃過夜活化。次日一1%接種量接與新鮮的LB(100μg/mLAmp)液體培養基。當OD600達到0.8時加入終濃度0.2mM IPTG,于20℃誘導表達20h。
4℃,8000rpm離心15min收集誘導表達的發酵液菌體,用5%初始發酵液體積的高滲溶液(50mM Tris-HCl,20%sucrose,1mMEDTA,pH8.0)重懸菌體,冰上溫和攪拌10min。12000rpm離心30min,收集上清;再用同體積的低滲溶液(5mM MgSO4)重懸菌體,冰上溫和攪拌10min。12000rpm離心30min,將兩次的離心上清混合,0.22μm濾膜過濾。
過濾后的樣品用鎳親和柱層析純化,隨后用含不同濃度的咪唑(20mM、50mM、100mM、250mM、500mM)進行梯度洗脫,同時收集洗脫液。用12%SDS-PAGE分析收集的樣品,挑選出高純度蛋白進行Western Blot鑒定,如下:
將蛋白轉印到PVDF膜上,200mA恒流轉印60min;而后將膜放入5%脫脂牛奶37℃封閉2h,用5%脫脂牛奶按1∶5000比例稀釋鼠抗His抗體,將膜放入到稀釋好的溶液中,4℃孵育過夜;用TBST洗膜3遍,再用5%脫脂牛奶按1∶10000稀釋HRP標記的羊抗鼠IgG多克隆抗體,將膜放入到稀釋好的溶液中,37℃孵育2h;再用TBST洗5遍,滴加ECL發光顯色液,凝膠成像儀曝光拍照。
將最終純化后的蛋白樣品經透析超濾濃縮后-70℃保存。
實施例4 BLI技術測定抗體親和力
將標記了生物素的RegIV蛋白連接到Streptavidin(SA)傳感器上,分別對不同濃度的抗體進行梯度檢測。設置的濃度為0nM、187nM、375nM、750nM、1500nM。用ForteBio的計算軟件進行計算處理,獲得的解離平衡常數KD分別為8.82×10-9、6.24×10-9。
實施例5 MTT檢測抗體的抗腫瘤活性
用0.25%胰蛋白酶-EDTA溶液消化PANC-1細胞至單細胞懸液。用2%FBS的細胞培養基稀釋PANC-1細胞,鋪96孔板,最終調整細胞濃度為3000個/孔,每孔100μL,培養24h。對96孔板里的每孔細胞進行加藥處理,藥物終濃度分別是500nM、250nM、125nM、75nM、30nM、15nM、0nM。加藥作用72h后,每孔加入11μL的MTT(5mg/mL),繼續培養4h。3000rpm離心5min后,吸出上清,加入DMSO溶解10min,酶標儀檢測570nm和630nm處的吸光值。
- 還沒有人留言評論。精彩留言會獲得點贊!