一種豬圓環病毒亞單位滅活疫苗的制作方法
本發明屬于生物
技術領域:
,具體地說,本發明涉及一種用于免疫的融合蛋白,其由PCV1和PCV2的主要結構蛋白Cap蛋白的亞單位、豬白細胞介素-2及純化標簽序列串聯而成,然后克隆入載體,轉化宿主菌,經過發酵、純化、乳化工藝制備成豬圓環病毒亞單位滅活疫苗,該疫苗能夠誘導機體產生顯著體液免疫和細胞免疫,有效預防豬圓環病毒的感染。
背景技術:
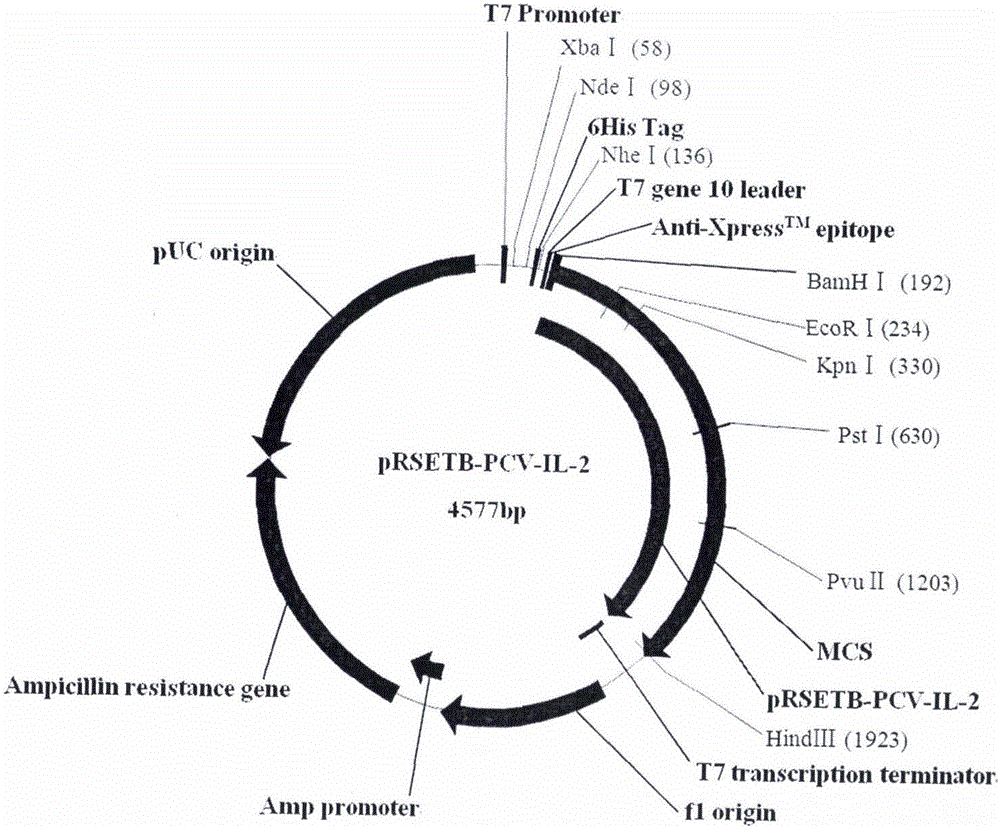
:豬圓環病毒感染是由豬圓環病毒(Porcinecircovirus,PCV)引起的一種傳染病。主要臨床表現為體質下降、消瘦、貧血、黃疸、生長發育不良、腹瀉、呼吸困難、母豬繁殖障礙,內臟器官及皮膚的廣泛病理變化,特別是腎臟、脾臟及全身淋巴結的高度腫大、出血和壞死。豬圓環病毒為圓環病毒科圓環病毒屬,由Tischer于1974年首先在PK-15(ATCC-CCL)細胞中發現。PCV有2種血清型,即PCV1和PCV2。已知PCV1對豬的致病性較低,偶爾可引起懷孕母豬的胎兒感染,造成繁殖障礙,但在正常豬群及豬源細胞中污染率極高。PCV2對豬的危害極大,主要侵害豬體的免疫系統,引起機體免疫抑制及抵抗力下降,從而繼發其它疾病。已證明是仔豬多系統衰竭綜合征發生的必要病原,此外,豬皮炎腎病綜合征、豬呼吸道綜合征、母豬繁殖障礙等疾病的發生也與PCV2的感染有關。PCV基因組分為兩種基因型,即PCV1型基因組和PCV2型基因組。PCV1基因組全長約1.7kb,PCV2約1.768kb。PCV1和PCV2的基因結構極為相似,都含有11個ORFs,其中ORF1和ORF2是最主要的兩個ORF,ORF1編碼Rep和Rep’蛋白,主要參與病毒復制;ORF2編碼Cap蛋白,大小約27.8KD,是PCV2唯一的結構蛋白,也是主要的免疫原性蛋白,能誘導機體產生中和抗體。基因序列分析發現,同一血清型中各毒株之間的核苷酸序列同源性在96%以上,而不同血清型核苷酸序列同源性低于80%。PCV1和PCV2之間與復制有關的DNA復制起始區和Rep蛋白基因序列同源性分別為79.5%和82%;而Cap蛋白基因存在較大差異,同源性只有62%左右。自PCV發現以來,PCV1和PCV2已被證實為世界性流行和存在的病毒,我國由郎洪武等2001年首次從豬群中分離到PCV2,目前各豬場已普遍存在。血清學調查發現,國內豬群陽性率高達52.8%-100%。該病發病率高達50%,死亡率因豬場條件、繼發感染等情況而不同,一般在5%-70%,是目前造成養豬業重大經濟損失的主要傳染病之一。目前,商品化疫苗主要有桿狀病毒表達的亞單位疫苗和PCV2滅活疫苗,抗原純度不高且價格昂貴,加上體外培養PCV比較困難,病毒滴度較低,因而急需研制安全有效的新型疫苗來預防豬圓環病毒的感染。白介素-2(Interleukin-2,IL-2)又稱T細胞生長因子,是由輔助性T細胞(THC)分泌的一種糖蛋白。IL-2在體外能促進T細胞分化成熟和擴增,促進THC的增長,刺激NK細胞生長并增強其溶細胞功能,增強B細胞和巨噬細胞的作用,是一種具有廣泛生物活性的細胞因子。IL-2在特異性免疫應答反應中發揮重要作用,將IL-2與保護性抗原基因連接構成融合蛋白,可以增強亞單位疫苗的抗體產生和細胞免疫水平。本發明提供了一種新的用于免疫的融合蛋白及其疫苗組合物,能有效預防豬圓環病毒的感染。技術實現要素:本發明根據不同結構蛋白在PCV病毒感染中的作用,選擇PCV1和PCV2主要結構蛋白Cap蛋白亞單位作為疫苗框架結構,通過柔性Linker連接后再與豬白介素-2串聯,克隆入pRSETB載體后轉化大腸桿菌,經過發酵、純化、乳化等工藝,獲得具有理想免疫原性的豬圓環病毒亞單位疫苗。利用本發明制備的疫苗可以有效預防豬圓環病毒的感染。在第一個方面,本發明提供了一種用于制備免疫的融合蛋白,其含有PCV1型和PCV2型病毒主要結構蛋白Cap蛋白亞單位以及豬白介素2(IL-2)。所述的“PCV1型和PCV2型病毒主要結構蛋白Cap蛋白亞單位”指的是具有免疫原性的PCV1和PCV2的主要結構蛋白Cap蛋白的一部分多肽或其具有基本相同免疫原性的功能等價物,優選是選自SEQIDNo.4、6的氨基酸序列或其功能等價物。所述的“豬白介素-2”指的是豬白細胞介素-2(IL-2)亞單位或其具有基本相同佐劑功能的功能等價物,優選是如SEQIDNo.8所示的氨基酸序列或其功能等價物。所述的融合蛋白或多肽或藥學上可接受的鹽以及表達抗原表位所需要的載體。載體也可以包括單獨編碼各抗原表位的序列,串聯可以通過遺傳工程方法進行。所述疫苗也包括非免疫活性物質,即為各多肽的連接部分,不具有抗原表位的免疫原性,也不具有任何佐劑活性,主要有純化標簽、接頭肽、化學修飾部分、N端信號肽和C端多聚腺苷酸等。所述藥學上可接受的鹽是指無毒性、刺激和變態反應,適用于人或動物組織的鹽。非活性物質和藥學上可接受的鹽為本領域技術人員所熟知。在第二個方面,本發明提供了一種核苷酸分子,其編碼本發明第一方面所述的豬圓環病毒亞單位疫苗多肽。本發明中核苷酸可以是RNA形式、DNA形式,通過人工合成方式合成抗原表位串聯序列,然后通過基因工程操作連接后克隆入載體,轉化入大腸桿菌,經過篩選、發酵、純化等工藝獲得豬圓環病毒亞單位疫苗多肽。在本發明中可以對該核酸進行常規的分子生物學操作,如:PCR、限制性內切酶酶切、連接等。優選本發明中的核苷酸序列如SEQIDNo.1所示。在第三個方面,本發明提供了一種載體,其含有本發明第二方面所述的核酸分子。本文中的術語“重組表達載體”、“表達載體”,有時僅稱為“載體”,在此可以交互替換使用,是指本領域中常用的細菌質粒、粘粒、噬菌粒、酵母質粒、植物細胞病毒、動物病毒及其他各種病毒載體。本發明中適用的載體包括但不限于:在細菌中表達用的載體(原核表達載體)、在酵母中表達用的載體(如畢赤酵母載體、漢遜酵母載體等)、在昆蟲細胞中表達的桿狀病毒載體、在哺乳動物細胞中表達用的載體(痘苗病毒載體、逆轉錄病毒載體、腺病毒載體等)、在植物中表達用的植物病毒載體以及在哺乳動物乳腺中表達用的各種載體。總之,只要能在宿主細胞中穩定復制,任何質粒和載體都可以使用。優選表達載體包含選擇標記基因,如細菌的氨芐青霉素抗性基因、四環素抗性基因、卡那霉素抗性基因、鏈霉素抗性基因、氯霉素抗性基因;酵母菌的新霉素抗性基因、Zeocin抗性基因,酵母菌的缺陷選擇標志,如His、Leu、Trp等;真核細胞的新霉素抗性基因、Zeocin抗性基因、二氫葉酸還原酶基因及熒光蛋白標記基因等。在一優選實施方式中,所述表達載體為大腸桿菌表達載體,本領域技術人員可利用DNA重組技術等一系列技術,構建含本發明所述編碼融合蛋白的DNA序列、合適的轉錄和翻譯調控序列、啟動子及選擇性標記基因等特定元件的表達載體。上述載體可用來轉化、轉染合適的宿主細胞,以獲得所需要的融合蛋白。在第四個方面,本發明提供了一種宿主細胞,其特征在于,所述的細胞已用本發明第三方面所述的核酸分子轉化或轉染。宿主細胞可以是原核細胞,也可以是真核細胞,如細菌細胞、酵母細胞、植物細胞、昆蟲細胞、哺乳動物細胞等。宿主細胞在轉化或轉染含本發明所述編碼融合蛋白的基因序列后,即構成工程化細胞或細胞株,可用于生產所需融合蛋白。本領域技術人員能夠恰當地選擇適當的載體、宿主細胞,并熟知如何將載體高效地轉化或轉染入宿主細胞中,所用方法包括但不限于:氯化鈣法、電穿孔法用于細菌細胞,電穿孔法和原生質體融合法用于酵母細胞,脂質體包裹、磷酸鈣共沉淀、電融合法以及顯微注射法用于哺乳動物細胞等真核細胞。在第五個方面,本發明提供了制備本發明第一個方面所述融合蛋白的方法,其包括以下步驟:用本發明第四個方面的宿主細胞表達本發明第一個方面的融合蛋白,并分離所述的融合蛋白。獲得的工程細胞可以通過常規方法培養、誘導來表達所需的融合蛋白,包括發酵過程和純化工藝。上述表達的蛋白可在細胞內、細胞膜上或分泌到細胞周質、細胞外。根據需要,可利用融合蛋白的物理的、化學的以及其他生物學特性,進行分離純化。方法包括但不限于:裂菌(超聲波裂菌、滲透壓裂菌),離心,鹽析,分子篩色譜,離子交換色譜,吸附色譜(親和層析、金屬螯合層析),反向色譜,高效液相色譜,毛細管電泳,制備性等點聚焦以及常規的變性、復性處理等,這些方法均是本領域技術人員所熟知的。在第六個方面,本發明提供了一種用于免疫的藥物組合物,其包括本發明第一個方面所述的融合蛋白以及藥學上可接受的載體,能預防豬圓環病毒的感染。對于本領域普通技術人員來說,已經有很多公知的方法能將蛋白質或多肽活性成分與藥學上可接受的載體制備成藥物組合物。本文中使用的藥學上可接受的載體指無毒的填充劑、稀釋劑、佐劑或其他制劑輔料。根據本領域的公知技術,可以根據治療目的、給藥途徑的需要將藥物組合物制成各種劑型,優選該組合物為單位劑量形式,如片劑、膠囊、粉劑、乳液劑、注射劑、噴霧劑型或作為飼料添加劑的劑型。優選該藥物組合物為注射劑型、噴霧劑型或作為飼料添加劑的劑型、這些組合物包括不同緩沖液內容(如磷酸鹽緩沖液、Tris-HCl緩沖液)、相應的離子強度和pH值,以及其他物質(如聚乳酸、甘露醇等)。也優選該藥物組合物為疫苗組合物,優選進一步含有佐劑,如弗氏完全佐劑、弗氏不完全佐劑、CpG序列等。在第七個方面,本發明提供了本發明第一個方面所述的融合蛋白在制備預防豬圓環病毒感染的藥物中的應用。在第八個方面,本發明提供了本發明第五個方面所述的藥物組合物在制備預防豬圓環病毒感染的藥物中的應用。在本發明的一個優選實施方式中,通過對實驗動物以特定劑量肌肉注射給藥,有效地保護了實驗動物。附圖說明下列附圖用于說明本發明的具體實施方案,而不用于限定由權利要求書所界定的本發明范圍。圖1為含有融合蛋白編碼基因的表達載體pRSETB-PCV-IL-2的示意圖。圖2顯示了重組表達載體pRSETB-PCV-IL-2用HamHI+HindIII酶切后的電泳結果,其中M為DNAMarker,泳道1為質粒酶切圖,泳道2為未酶切對照,泳道3為空質粒。圖3為融合蛋白編碼基因表達產物SDS-PAGE鑒定結果,其中M為分子量Marker,從上至下依次為94KD、66KD、45KD、33KD、26KD、20KD、14KD,1泳道為誘導純化樣品。圖4為樣品純化WesternBlot印跡結果,其中M為預染Marker,從上至下依次為94KD、62KD、40KD、30KD、24KD、16KD,泳道1為樣品,泳道2為陰性對照。圖5為免疫小白鼠ELISA檢測血清特異性抗體結果,其中(-◆-)為20150302組;(-■-)為20150304組;(-▲-)為20150306組;(-●-)為商品化滅活苗組;(-+-)為PBS對照組。圖6為PCV刺激鼠脾細胞T淋巴細胞增殖反應檢測結果。具體實施方式實施例中所述的具體試驗方法描述僅是示例性描述,用于詳細闡明本發明,但并不構成對本發明范圍的限制,以下所述實驗方法,沒有具體說明的,均按照《分子克隆實驗指南》(2002年,第三版,科學出版社)所述方法進行。實施例一融合蛋白基因的來源本發明綜合分析國內豬圓環病毒1型和2型主要流行株的基因序列、抗原結構、流行病學研究進展,根據其主要結構蛋白Cap蛋白的氨基酸序列,利用相關生物信息學軟件對其親水性、抗原性、可塑性、表面可及性和二級結構進行分析,預測可能的抗原表位,并綜合相關報道,從而確定PCV1和PCV2Cap蛋白亞單位。通過柔性Linker連接形成疫苗骨架結構后再與豬白介素2串聯,該疫苗總體結構為:PCV1Cap-PCV2Cap-IL-2-Tag實施例二大腸桿菌表達載體與表達菌株的構建將實施例一中設計好的多肽編碼核苷酸送上海英俊生物技術公司合成,核苷酸片段兩端分別設計了BamHI(5’端)和HindIII(3’端)限制性酶切位點,將合成好的片段克隆到pMD18T載體上,序列測定證實插入基因片段與涉及序列一致(見序列表)。將重組質粒命名為pMD18T-PCV-IL-2,用相應的限制性內切酶對質粒進行酶切處理,大腸桿菌表達載體選用Invitrogen公司的pRSETB質粒,也使用相同的限制性內切酶處理,酶切條件:10μL反應體系,體系內加入質粒2μL,限制性內切酶5個活性單位(NewEnglandbiolabs),10×緩沖液1μL,去離子水補齊,37.0℃酶切1.5小時。酶切結束后加入1μL200mMEDTA終止反應。在1%瓊脂糖凝膠電泳中電泳30分鐘。紫外燈下將pRSETB質粒和目的片段切下,按照Qiagen公司凝膠回收試劑盒說明書進行膠回收。按照載體:片段為1∶2-3的比例將多表位核苷酸片段與表達載體混合,反應體系15μL,由T4DNA連接酶進行連接,16℃連接過夜,獲得重組質粒命名為pRSETB-PCV-IL-2(見圖1),轉化感受態大腸桿菌BL21(DE3)pLysS。轉化:將pRSETB-PCV-IL-2置冰上融化,加入1mL連接反應液,再次混勻,冰水浴30分鐘,42℃30秒鐘,然后迅速放回冰水浴90秒鐘,加入1mLLB培養液,37.0℃靜置培養1小時,4000g低溫離心10秒鐘棄上清,用200μLLB培養基重懸菌體,將菌液均勻涂布于含有100μL/mL氨芐青霉素的LB瓊脂培養板上,倒置于37℃恒溫箱中培養12-16小時,直至克隆形成。鑒定:挑取平板上的單克隆至LB培養基中,37℃,200rpm震蕩培養12小時,提取質粒,使用限制性內切酶BamHI和HindIII進行雙酶切,可以切出相應豬圓環病毒亞單位疫苗基因大小片段的克隆為1700bp左右,可初步確定為陽性克隆(見圖2),陽性克隆進行DNA序列測定進一步驗證其正確性(見序列表)。誘導表達:將陽性克隆過夜培養,次日早上按照1∶100轉接,37℃震蕩培養3小時候,加入0.5mMIPTG誘導,繼續培養3小時,制備樣品。常規SDS-PAGE檢測目的蛋白的表達情況,可在66KD分子量處見到特異性條帶為正確克隆(見圖3)。取正確克隆,放大培養,SDS-PAGE證實表達正確后,使用常規Western-blot進一步證實其表達準確性(見圖4)。最后篩選得到的高效分泌表達融合蛋白的工程菌,命名為pRSETB-PCV-IL-2/BL21(DE3,PLys)。實施例三工程菌的發酵、純化與乳化發酵將生產菌種接種到2mL含有100μL/mL氨芐青霉素的LB液體培養基中,37℃,180rpm震蕩培養12小時活化菌種。將活化好的菌種以1∶100的接種量接入搖瓶,37℃震蕩培養至OD600=3,可按10%比例接種入發酵罐。發酵用培養基為半合成培養基,用蒸餾水配制,其中不含有任何抗生素。校正溶氧和pH值電極,開啟罐體攪拌,轉數為300rpm,罐體在線滅菌,待罐內培養液溫度降至37℃時,標定pH及溶氧(OD)零點。發酵溫度為37.0℃±0.1℃,溶氧控制在20%左右,pH控制在7.0,接種后培養菌體OD600=1.0-1.2時流加補料500mL,補料后1小時加入IPTG(終濃度為0.5mM)誘導表達,連續誘導6個小時后發酵結束,取樣做SDS-PAGE檢測表達情況。純化將收集的菌體,用包涵體洗液I(1%TritonX-100,20MmTris-clpH8.0)混懸后進行超聲,2000W超聲裂解1小時。4℃,12000rpm離心收集包涵體,并用包涵體洗液II(1%DOC,4M尿素,20mMTris-clpH8.0)混懸二次超聲洗滌包涵體,二次低溫離心收集包涵體。包涵體沉淀用8M尿素,0.3%β-ME,20mMTris-cl(pH=8.0)混勻,室溫攪拌4小時,8000rpm低溫離心30分鐘,棄去沉淀。變性蛋白1∶100稀釋,復性液用Tris(pH=8.0)緩沖體系,加入0.3M精氨酸,4℃攪拌復性24小時。復性液用pH=8.0的20mM磷酸緩沖液,0.5M氯化鈉,20mM咪唑,平衡上親和層析柱,用pH=8.0的20mM磷酸緩沖液,0.5M氯化鈉,0.5M咪唑洗脫。再用1.5M硫酸銨、100mMEDTA、pH=8.5的10mM磷酸氫二鈉平衡上疏水層析柱,再平衡,用pH=8.5的10mM磷酸氫二鈉洗脫,即得豬圓環病毒亞單位疫苗半成品原液,進行SDS-PAGE以及Western-blot印記檢定純化產物是否為目的蛋白。乳化將純化的半成品原液用滅菌PBS稀釋至200μg/mL。取進口白油礦物油佐劑DUOPRIME(醫藥級)經121℃滅菌15分鐘,備用。按油相∶水相=50∶50的比例配制,先將油相加入乳化缸內,開動攪拌機以80-100r/min的速度緩慢攪拌,緩緩加入水相,加完后再攪拌2分鐘,然后以5500r/min高速循環乳化9分鐘,制成油包水單相疫苗。實施例四豬圓環病毒亞單位滅活疫苗安全性實驗材料疫苗:豬圓環病毒亞單位滅活苗,批號20150302、20150304、20150306,由公司研發中心提供。試驗動物:8周齡BaIb/c小白鼠購自濟南朋悅實驗動物繁育有限公司。28日齡健康三元雜交斷奶仔豬由廣東永順制藥提供。方法疫苗對小白鼠的安全性將40只8周齡BaIb/c小白鼠隨機分為3個批次組和1個對照組,10只/組。批次組分別皮下注射3個不同批次的豬圓環病毒亞單位滅活疫苗,0.5mL/只。對照組皮下注射生理鹽水白油乳劑0.5mL/只。連續觀察14天,觀測小白鼠的健康狀況。疫苗對仔豬的安全性將20頭28日齡健康三元雜交斷奶仔豬隨機分為3個批次組和1個對照組,5頭/組。批次組分別耳后肌肉注射3個不同批次的豬圓環病毒亞單位滅活疫苗,2mL/頭。對照組注射生理鹽水白油乳劑2mL/只。連續觀察14天,觀測仔豬的健康狀況。試驗結果疫苗對小白鼠的安全性試驗結果見表1,免疫后,所有試驗小鼠均未出現任何過敏反應或中毒癥狀,精神狀態良好,體溫、采食、飲水等一切正常,未出現明顯局部炎癥等損傷性臨床副反應,無死亡發生,與對照組一致,表明豬圓環病毒亞單位滅活苗對小白鼠是安全的。表1疫苗對小白鼠的安全性試驗結果組別動物數量體溫食欲精神健康狀況死亡數量2015030210正常正常正常良好02015030410正常正常正常良好02015030610正常正常正常良好0對照組10正常正常正常良好0疫苗對仔豬的安全性試驗結果如表2,整個觀察期內,所有免疫的仔豬體溫和食欲均正常,精神狀態良好,未出現任何臨床異常現象,免疫部位未發現過敏或炎癥,無死亡發生,批次組與對照組一致,表明豬圓環病毒亞單位滅活苗對斷奶仔豬是安全的。表2疫苗對仔豬的安全性試驗結果組別動物數量體溫食欲精神健康狀況死亡數量201503025正常正常正常良好0201503045正常正常正常良好0201503065正常正常正常良好0對照組5正常正常正常良好0實施例五亞單位疫苗與傳統疫苗免疫效力對比試驗疫苗:豬圓環病毒亞單位滅活苗,批號20150302、20150304、20150306,由公司研發中心提供。商品化滅活苗由廣東永順制藥提供。試驗動物:8周齡BaIb/c小白鼠購自濟南朋悅實驗動物繁育有限公司。方法將25只8周齡BaIb/c小白鼠隨機分為5組,3個疫苗免疫組,1個商品化滅活苗對照組和1個空白對照組,5只/組。按照分組情況對試驗小白鼠進行免疫,皮下注射0.2ml/只,首免21天后,同等劑量同樣方法加強免疫一次。分別在免前和首免后7、14、21、28、35、42、49、56天斷尾采血,分離血清用于抗體檢測,并于最后一次采血后,宰殺小鼠,分離鼠脾細胞用于T淋巴細胞增殖試驗。實施例六間接ELISA檢測特異性抗體將純化的PCV重組蛋白抗原用50mmol/L的CBS(pH9.6)稀釋成1μg/mL,加入酶標板中,100μL/孔,4℃靜置包被過夜;去掉液體,用PBST(含0.05%Tween-20,pH7.4)洗板三次,加入封閉液(含5%小馬血清的PBST),100μL/孔,37℃封閉1小時;洗板三次,用血清稀釋液(含5%小馬血清的PBST)將待檢樣品1∶100、1∶200、1∶400、1∶800、1∶1600、1∶3200、1∶6400、1∶12800倍稀釋,加入酶標板,100μL/孔,同時用免疫PBS的血清做陰性對照,37℃孵育1小時;洗板三次,加入1∶5000稀釋的HRP標記羊抗鼠IgG,100μL/孔,37℃孵育1小時;洗板四次,加入TMB底物100μL/孔,避光顯色15分鐘;加入2MH2SO4終止反應,于450nm波長下檢測吸光度值(BIORAD680酶標儀)。試驗結果:如圖5,免后14天,疫苗免疫組和商品化滅活苗對照組的小白鼠血清中開始檢測到特異性抗體,然后抗體水平不斷升高,并在首免后35天達到高峰,隨后穩定下降,一直持續到試驗結束。免疫組與空白對照組呈極顯著差異(P<0.01)。結果表明本發明提供的豬圓環病毒亞單位滅活苗可以刺激小白鼠體內產生較強的體液免疫反應,且抗體水平與現有商品化滅活苗相當,無顯著差異(P>0.05)。實施例七T淋巴細胞增殖檢測首免后56天無菌采集脾臟進行T淋巴細胞增殖試驗,以檢測亞單位疫苗免疫后的細胞免疫反應。將小鼠脾細胞制備成細胞懸液(2×105個/100μL),加入96孔細胞版中,100μL/孔;隨后加入培養基混勻,100μL/孔;以刀豆球蛋白(5μg/mL,sigma)作為陽性對照,每個樣品3個重復;37℃、5%CO2孵育72小時;每孔加入20μLMTS,孵育5小時;酶聯免疫檢測儀(BIORAD680酶標儀)490nm波長下讀數。刺激指數(SI)用抗原刺激細胞孔的平均值比細胞(未刺激)孔的平均值來計算。試驗結果:如圖6,亞單位疫苗免疫組觀察到了較高水平的脾細胞增殖活性,明顯高于商品化滅活苗組和對照組(P<0.05),且三個批次之間無明顯差異(P>0.05)。表明本發明提供的亞單位疫苗能夠在試驗動物體內誘導加強細胞免疫反應。實施例八亞單位疫苗攻毒保護試驗疫苗:豬圓環病毒亞單位滅活苗,批號20150302、20150304、20150306,由公司研發中心提供。商品化滅活苗由廣東永順制藥提供。試驗動物:28日齡健康三元雜交斷奶仔豬山廣東永順制藥提供。方法將25頭28日齡仔豬隨機分為5組,3個疫苗免疫組,1個商品化滅活苗對照組和1個對照組,5頭/組。按照分組情況對試驗仔豬進行免疫,耳后肌肉注射2ml/只,首免21天后,同等劑量同樣方法加強免疫一次,第35天采用PCV2-LG毒株(104.0TCID50/ml)進行攻毒。觀察和記錄試驗仔豬的發病和死亡情況。攻毒后連續14天觀察豬群的精神狀態、會陰部和四肢是否出現癥狀、死亡情況,統計死亡數并計算死亡率。保護率=[(攻毒對照組死亡率-疫苗免疫組死亡率)/攻毒對照組死亡率]×100%。試驗結果:結果如表3,攻毒對照組5頭全部發病,其中4頭死亡;商品化疫苗組2頭發病,其中一頭死亡;亞單位疫苗組中20150302組和20150306組各有一頭發病,其中20150306組一頭死亡,20150304組無發病,無死亡,保護率不低于商品化滅活苗。表3豬圓環亞單位滅活苗對仔豬的保護效應組別發病數死亡數保護率(n=5)2015030210100%2015030400100%201503061175%商品化滅活苗2175%對照組54-當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1