利用天然糖抗體靶向免疫治療腫瘤的脂質體及其制備方法與流程
本發明涉及藥物化學領域,具體涉及一種利用天然糖抗體靶向免疫治療腫瘤的脂質體及其制備方法與應用。
背景技術:
鼠李糖(rhamnose,Rha)是一種單糖,存在于許多細菌中,但人體中卻不能合成。大量研究已經表明鼠李糖具有免疫原性。而最近的研究發現,在人體血清中具有高滴度的鼠李糖抗體,并且其含量比α-Gal豐富,而改造過的α-Gal已被利用多價效應能有效殺傷腫瘤細胞。而且在野生型小鼠中,anti-Rha比anti-α-Gal數量多很多,anti-α-Gal幾乎沒有,說明如果做小鼠實驗的話,利用anti-α-Gal需要將小鼠體內的半乳糖基轉移酶基因進行敲除,而利用anti-Rha則不用;另外,鼠李糖的結構也比α-Gal簡單,更容易通過化學方法進行改造。這提示我們,應用鼠李糖作為免疫抗原進行改造,用作抗腫瘤藥物研究會有更好的效果。
脂質體是一種很好的運送載體,很多研究都利用脂質體包裹藥物。但是脂質體載藥普遍面臨一大問題,即包封率不高且容易泄露,另外許多藥物本身毒副作用大,這些都極大地限制了脂質體包封藥物的應用。而且腫瘤細胞有許多分子特征,特別是一些腫瘤細胞表面會過表達許多受體,如表皮生長因子受體(EGFR)、葉酸受體(FR)等;其中葉酸受體在90%的腫瘤細胞表面過表達,如卵巢癌、乳腺癌、宮頸癌、子宮內膜癌、腎癌、膀胱癌、胰腺癌、黑色素瘤、骨肉瘤等。況且,葉酸分子結構簡單,易于進行化學改造。本發明采用鼠李糖和葉酸修飾的磷脂作為原料制備脂質體,無需包裹、靶向性好,充分利用人體天然免疫高效殺傷腫瘤細胞,毒副作用極小。
技術實現要素:
本發明的一個目的提供一種新型磷脂類衍生物,其可用于制備靶向免疫治療腫瘤的脂質體,利用補體依賴毒性免疫靶向殺傷腫瘤細胞。
本發明提供了一種新型的磷脂類衍生化合物,其具有如式(I)所示的結構:
其中,R1選自如下的基團:
R2選自如下的基團:
其中,式(I)結構中的m為大于零的正整數;優選的,m的范圍為1-500的正整數;更優選的,m的范圍為1-40、40-50或50-500的正整數;更優選的,m的范圍為20-40、40-50或50-150的正整數;最優選的,m為正整數45;
其中,R1基團中的R3選自H,Na,K,更優選為H;
其中,R2基團中的R4為一價陽離子,選自H+,Na+,K+,NH4+,優選為NH4+;
其中,R2基團中的n為10-20的正整數;優選的,n為正整數12,14或16;更優選的,n為正整數16;
其中,R2基團中的p和q各自為5-15的正整數;優選的,p和q各自為5-10的正整數;更優選的,p和q分別為正整數7。
優選的,式(I)選自如下結構的化合物:
(1)
(2)
式(I)的化合物是由PEG修飾的磷脂與葉酸或鼠李糖反應生成。其中,磷脂主體結構的如R2所示,優選的磷脂種類為1,2-二油酰-SN-甘油-3-磷脂酰乙醇胺(DOPE),二-十二酰基磷脂酰乙醇胺(DLPE),二-十四酰基磷脂酰乙醇胺(DMPE),1,2-二硬酯酸-3-磷脂酰乙醇胺(DSPE),棕櫚酰油酰磷脂酰膽堿(POPC)。更優選的磷脂種類為1,2-二油酰-SN-甘油-3-磷脂酰乙醇胺(DOPE)或1,2-二硬酯酸-3-磷脂酰乙醇胺(DSPE)。
修飾磷脂的聚乙二醇分子量優選為1000-200000道爾頓,優選為1000-50000道爾頓,更優選為2000-20000道爾頓。
將聚乙二醇修飾的磷脂與葉酸(Folate)或鼠李糖(Rhamnose)反應生成磷脂-PEG-Folate或磷脂-PEG-Rhamnose,其通式結構如式(I)所示。優選的,當所述的PEG分子量為2000時,通式中的m值為45。更優選的,當所述的磷脂為DSPE時,可以得到兩種類型的具體化合物,1,2二硬酯酸-3磷脂酰乙醇胺-聚乙二醇-葉酸(DSPE-PEG-Folate),1,2二硬酯酸-3磷脂酰乙醇胺-聚乙二醇-鼠李糖(DSPE-PEG-Rhamnose)。其中,優選的分子DSPE-PEG2000-Folate和DSPE-PEG2000-Rhamnose的結構式分別如(1)和(2)所述。
本發明的另一目的是提供一種磷脂-PEG-Folate分子的制備方法,所述方法包括如下的步驟:
(1)將葉酸與聚乙二醇修飾的磷脂在合適的溶劑及催化劑環境下反應;
(2)分離得到磷脂-PEG-Folate分子,該分子結構如式(I)所示:
其中,R1基團的結構如下所示:
R2選自如下的基團:
其中,式(I)結構中的m為大于零的正整數;優選的,m的范圍為1-500的正整數;更優選的,m的范圍為1-40、40-50或50-500的正整數;更優選的,m的范圍為20-40、40-50或50-150的正整數最優選的,m為正整數45;
其中,R1基團中的R3選自H,Na,K,更優選為H;
其中,R2基團中的R4為一價陽離子,選自H+,Na+,K+,NH4+,優選為NH4+;
其中,R2基團中的n為10-20的正整數;優選的,n為正整數12,14或16;更優選的,n為整數16;
其中,R2基團中的p和q各自為5-15的正整數;優選的,p和q各自為5-10的正整數;更優選的,p和q分別為正整數7。
上述反應步驟(1)中,優選的PEG修飾的磷脂種類為DOPE-PEG-NH2,DLPE-PEG-NH2,DMPE-PEG-NH2,DSPE-PEG-NH2,POPC-PEG-NH2。更優選的PEG修飾的磷脂種類DOPE-PEG-NH2或DSPE-PEG-NH2。修飾磷脂的聚乙二醇分子量優選為1000-200000道爾頓,優選為1000-50000道爾頓,更優選為2000-20000道爾頓。一種優選的PEG修飾的磷脂為DSPE-PEG2000-NH2。
上述反應步驟(1)中,所述合適的溶劑選自二甲亞砜(DMSO)、甲醇、乙醇、氯仿、丙酮、乙醚及乙酸乙酯中的一種或其混合物,優選為二甲亞砜(DMSO)。反應條件為將葉酸(Folate)溶解在DMSO中,再加入PEG修飾的磷脂(例如DSPE-PEG-NH2或DOPE-PEG-NH2)和吡啶。其中葉酸和PEG修飾的磷脂的摩爾比為1:1-20:1,優選為1:1-10:1,更優選為1:1-5:1。反應溫度為0℃-45℃,優選為10℃-30℃,優選為室溫環境。
上述反應步驟(1)中,所述合適的催化劑為常用縮合劑,如二環己基二亞胺(DCC)、1-(3-二甲氨基丙基)-3-乙基碳二亞胺(EDC)等,更優選為二環己基碳二亞胺(DCC)。
上述反應步驟(2)中,反應完成后加熱蒸發去除溶劑,加入水溶解,離心收取上清,透析后,凍干得到磷脂-PEG-Folate分子。
本發明的另一目的是提供一種磷脂-PEG-Rhamnose分子的制備方法,所述方法包括如下的步驟:
(1)將鼠李糖衍生物(RhaNBuacid)與聚乙二醇修飾的磷脂在合適的溶劑及催化劑環境下反應;其中,鼠李糖衍生物的結構
如下所示:
(2)分離得到磷脂-PEG-Rhamnose分子,其結構如式(I)所示:
其中,R1基團的結構如下所示:
R2選自如下的基團:
其中,式(I)結構中的m為大于零的正整數;優選的,m的范圍為1-500的正整數;更優選的,m的范圍為1-40、40-50或50-500的正整數;更優選的,m的范圍為20-40、40-50或50-150的正整數;最優選的,m為正整數45;
其中,R1基團中的R3選自H,Na,K,更優選為H;
其中,R2基團中的R4為一價陽離子,選自H+,Na+,K+,NH4+,優選為NH4+;
其中,R2基團中的n為10-20的正整數;優選的,n為正整數12,14或16;更優選的,n為整數16;
其中,R2基團中的p和q各自為5-15的正整數;優選的,p和q各自為5-10的正整數;更優選的,p和q分別為正整數7。
上述反應步驟(1)中,優選的PEG修飾的磷脂種類為DOPE-PEG-NH2,DLPE-PEG-NH2,DMPE-PEG-NH2,DSPE-PEG-NH2,POPC-PEG-NH2。更優選的PEG修飾的磷脂種類DOPE-PEG-NH2或DSPE-PEG-NH2。修飾磷脂的聚乙二醇分子量優選為1000-200000道爾頓,優選為1000-50000道爾頓,更優選為2000-20000道爾頓。一種優選的PEG修飾的磷脂為DSPE-PEG2000-NH2。
上述反應步驟(1)中,所述合適的溶劑選自二甲亞砜(DMSO)、甲醇、乙醇、氯仿、丙酮、乙醚及乙酸乙酯中的一種或其混合物,優選為二甲亞砜(DMSO)。反應條件為將RhaNBuacid溶解在DMSO中,再加入PEG修飾的磷脂(例如DSPE-PEG-NH2或DOPE-PEG-NH2)和吡啶。其中RhaNBuacid和PEG修飾的磷脂的摩爾比為1:1-20:1,優選為5:1-20:1,更優選為10:1-20:1。反應溫度為0℃-45℃,優選為10℃-30℃,優選為室溫環境。
上述反應步驟(1)中,所述合適的催化劑為常用縮合劑,如二環己基二亞胺(DCC)、1-(3-二甲氨基丙基)-3-乙基碳二亞胺(EDC)等,更優選為二環己基碳二亞胺(DCC)。
上述反應步驟(2)中,反應完成后加熱蒸發去除溶劑,加入水溶解,離心收取上清,透析后,凍干得到磷脂-PEG-Rhamnose分子。
上述反應中步驟(1)中,其中鼠李糖衍生物RhaNBuacid的合成過程如圖2-2所示。具體為鼠李糖在酸酐和吡啶環境下使糖分子上的羥基乙酰化,然后在TMSN3和SnCl4環境下反應得到之后該化合物通過兩步反應與琥珀酐生成之后在堿環境下脫去保護基團得到鼠李糖衍生物RhaNBuacid。
本發明的另一目的是提供一種含有式(I)所述磷脂類衍生物的脂質體藥物組合物,其可用于靶向免疫治療腫瘤,利用補體依賴毒性免疫靶向殺傷腫瘤細胞。
本發明所述的脂質體藥物組合物,包含磷脂,磷脂-PEG-Folate和磷脂-PEG-Rhamnose,其中磷脂:磷脂-PEG-Folate:磷脂-PEG-Rhamnose的摩爾比為100~1000:0.1~1:1~5000。優選的摩爾比為500~1000:0.5~1:100~5000,更優選的摩爾比為500~1000:1:100~5000,最優選的摩爾比為1000:1:100~3000。
上述藥物組合物中,磷脂選自為1,2-二油酰-SN-甘油-3-磷脂酰乙醇胺(DOPE),二-十二酰基磷脂酰乙醇胺(DLPE),二-十四酰基磷脂酰乙醇胺(DMPE),1,2-二硬酯酸-3-磷脂酰乙醇胺(DSPE),二油酰磷脂酰膽堿(DOPC)。優選的磷脂為DOPE和DOPC,更優選的磷脂為DOPE。
上述藥物組合物中,磷脂-PEG-Folate分子優選為DOPE-PEG-Folate,DLPE-PEG-Folate,DMPE-PEG-Folate,DSPE-PEG-Folate。其中,PEG分子量優選為1000-200000道爾頓,優選為1000-50000道爾頓,更優選為2000-20000道爾頓。一種優選的磷脂-PEG-Folate分子為DSPE-PEG2000-Folate分子。
上述藥物組合物中,磷脂-PEG-Rhamnose分子優選為DOPE-PEG-Rhamnose,DLPE-PEG-Rhamnose,DMPE-PEG-Rhamnose,DSPE-PEG-Rhamnose。其中,PEG分子量優選為1000-200000道爾頓,優選為1000-50000道爾頓,更優選為2000-20000道爾頓。一種優選的磷脂-PEG-Rhamnose分子為DSPE-PEG2000-Rhamnose分子。
膽固醇可調節磷脂雙分子層膜的流動性,使膜通透性降低,減少藥物滲漏。同時可使脂膜維持一定柔韌性,增強脂質體囊泡抗擊外部條件變化的能力。并對磷脂的氧化有一定保護作用。制備普通載藥脂質體,膽固醇是必須的添加物,用量一般為膽固醇:磷脂=0.3-1(摩爾比)。因磷脂(PC)和藥物的不同,存在膽固醇的最佳用量。在一定范圍內,脂質體的粒徑、氧化穩定性、物理穩定性與膽固醇添加量成正相關,超出范圍時,超過膜負荷,會造成部分脂質體破裂。另外,膽固醇的添加會對膜相變溫度有一定影響,臨界值以內使相變溫度降低,臨界值以上,使相變溫度升高。如果不載藥的話,可以選擇不添加膽固醇。
作為本發明的一個優選的技術方案,本發明公開了一種脂質體藥物組合物,包含磷脂,膽固醇,磷脂-PEG-Folate和磷脂-PEG-Rhamnose,其中磷脂:膽固醇:磷脂-PEG-Folate:磷脂-PEG-Rhamnose的摩爾比為100~1000:100~1000:0.1~1:1~5000。上述藥物組合物中,磷脂:膽固醇:磷脂-PEG-Folate:磷脂-PEG-Rhamnose的摩爾比優選為500~1000:500~1000:0.5~1:100~5000,更優選的摩爾比為500~1000:500~1000:1:100~5000,最優選的摩爾比為1000:1000:1:100~3000。
作為本發明的一個優選的技術方案,本發明公開了一種脂質體藥物組合物,包含磷脂,膽固醇,磷脂-PEG-Folate和磷脂-PEG-Rhamnose,其中磷脂:膽固醇:磷脂-PEG-Folate:磷脂-PEG-Rha的摩爾比為100~1000:100~1000:0.1~1:1~5000;其中所述的磷脂為DOPE,磷脂-PEG-Folate為DSPE-PEG-Folate,磷脂-PEG-Rhamnose為DSPE-PEG-Rhamnose。
作為本發明的另一個優選的技術方案,本發明公開了一種脂質體藥物組合物,包含磷脂,膽固醇,磷脂-PEG-Folate和磷脂-PEG-Rhamnose,其中磷脂:膽固醇:磷脂-PEG-Folate:磷脂-PEG-Rha的摩爾比為500~1000:500~1000:1:100~3000;其中所述的磷脂為DOPE,磷脂-PEG-Folate為DSPE-PEG-Folate,磷脂-PEG-Rhamnose為DSPE-PEG-Rhamnose。
作為本發明的另一個優選的技術方案,本發明公開了一種脂質體藥物組合物,包含磷脂,膽固醇,磷脂-PEG-Folate和磷脂-PEG-Rhamnose,其中磷脂:膽固醇:磷脂-PEG-Folate:磷脂-PEG-Rha的摩爾比為1000:1000:1:100~3000;其中所述的磷脂為DOPE,磷脂-PEG-Folate為DSPE-PEG2000-Folate,磷脂-PEG-Rhamnose為DSPE-PEG2000-Rhamnose。
本發明脂質體組分中,通過優化DSPE-PEG-Rhamnose與DSPE-PEG-Folate的摩爾比,可使補體依賴的毒性達到最佳。例如,當DSPE-PEG2000-Rhamnose與DSPE-PEG2000-Folate的摩爾比為100:1,CDC%為20%;DSPE-PEG2000-Rhamnose與DSPE-PEG2000-Folate的摩爾比為1000:1,CDC%為29%;DSPE-PEG2000-Rhamnose與DSPE-PEG2000-Folate的摩爾比為2500:1,CDC%為58.5%。
優選的,上述的組合物中還可進一步包括附加劑,例如陽離子脂質體DOTMA或DOTAP,優選為DOTAP;其中,磷脂-PEG-Folate相對于陽離子脂質體的摩爾比為1:1-1:10,優選為1:2-1:6,更優選為1:4。
本發明提供的脂質體藥物組合物粒徑范圍在80~200nm之間,Zeta電位值為|zeta電位|>30mV。制備靶向脂質體,作為本發明的重要改進與完善,本發明中所優化的脂質體濃度以葉酸的濃度來計算,并且其最佳工作濃度為10-7M。
本發明的另一目的是提供一種制備上述脂質體藥物組合物方法,其包括如下的步驟:
(1)、取按摩爾比為1~5000的磷脂-PEG-Rhamnose,0.1~1的磷脂-PEG-Folate,100~1000的磷脂,加入適量有機溶劑,減壓旋轉蒸發除去有機溶媒,形成薄的均勻的脂質膜;
(2)加入pH范圍6.0-8.5的緩沖液洗滌脂質膜,超聲;
(3)將溶液通過薄膜擠壓器反復擠壓,得到粒徑大小均勻的脂質體。
上述方法步驟(1)中,磷脂-PEG-Rhamnose,磷脂-PEG-Folate和磷脂的定義如前所述,其優選的摩爾比范圍亦如前所述。
若脂質體組合物含有膽固醇,則步驟(1)為取按摩爾比為1~5000的磷脂-PEG-Rhamnose,0.1~1的磷脂-PEG-Folate,100~1000的磷脂,100~1000的膽固醇,加入適量有機溶劑,減壓旋轉蒸發除去有機溶媒,形成薄的均勻的脂質膜;
所述方法步驟(1)中,有機溶劑為二甲亞砜(DMSO)、甲醇、乙醇、氯仿、丙酮、乙醚及乙酸乙酯中的一種或其混合物,優選為氯仿和甲醇的混合液,其體積比氯仿:甲醇為1:1~10:1(V/V),優選為9:1(V/V)。
所述方法步驟(2)中,緩沖液選自水溶液狀態下pH值為6.0-8.5的緩沖液,例如PBS、HEPES、Hanks或者生理鹽水,優選為PBS。
所述方法步驟(3)中,薄膜選自孔徑大小為80nm~200nm多聚碳酸(PC)膜,優選為Whatman 200nm PC膜。脂質體多次通過擠出膜的過濾使單室脂質體的粒徑呈正態分布,優選經過10-20次的反復擠壓,最后獲得的脂質體粒徑大小為80nm~200nm。
作為一種優選的實施方案,本發明中具體的靶向脂質體制備方法如下:三種組分均溶解在氯仿/甲醇=9:1的混合溶液中。稱量配制母液為10-3M的DSPE-PEG2000-Folate,10-2M的DSPE-PEG2000-Rhamnose和10-1M的DOPE.按上述摩爾比,分別加入一定量體積的三種組分稀釋在氯仿/甲醇=9:1的混合溶液中。然后用旋轉蒸發儀旋干,形成脂質膜后,通往一股氮氣氣流,真空避光旋干過液,第二天加入3g直徑約2mm的干凈玻璃珠和一定量pH 7.4的PBS再次通入一股氮氣氣流后,旋轉洗滌脂質膜30分鐘,接著水浴超聲2分種,最后用200nm的多聚碳酸(PC)膜,擠出理想粒徑大小的脂質體。
本發明的另一目的是提供了式(I)的化合物以及由式(I)的化合物制備得到的脂質體組合物在制備治療腫瘤疾病藥物中的用途。
本發明所制備的脂質體可以利用配體與受體高度特異性的親和力,將帶有葉酸和鼠李糖的脂質體準確地靶向到葉酸受體過表達的腫瘤細胞,相比于葉酸受體低表達的正常細胞,腫瘤細胞會利用高親和力和多價效應使得細胞表面帶上更多數量的鼠李糖抗原,該鼠李糖抗原會招募人體血清里面天然的鼠李糖抗體,從而結合補體系統中的C1q蛋白,進而啟動了蛋白酶活性,形成攻膜復合物,最終導致腫瘤細胞的裂解。本發明獲得的脂質體制劑能發揮高效的補體依賴毒性,可用于治療多種實體瘤,例如卵巢癌、乳腺癌、宮頸癌、子宮內膜癌、腎癌、膀胱癌、胰腺癌、黑色素瘤、骨肉瘤等葉酸受體過表達的腫瘤,在體外實驗中殺傷這些腫瘤細胞明顯,更為重要的是在體內實驗中也能夠發揮顯著作用,說明本發明所采用的策略制備脂質體,療效可靠。本發明制備的脂質體制劑可經注射途徑給藥,如靜脈、肌肉或皮下注射給藥。
本發明技術與現有技術相比,本發明技術所用脂質體的量的數量級為10-7M,而相比現有技術包裹脂質體用藥的數量級10-6M-10-3M,其用藥量更少,生產更為廉價,濃度低、無需包封、穩定性更好;除此之外,本發明技術是利用人體天然糖抗體發揮補體毒性作用,因此,毒副作用更低;而且,本發明技術是針對癌細胞表面過表達的受體,要利用多價效應才能發揮作用,不針對正常細胞,所以靶向性更好;能夠利用免疫小鼠進行活體實驗,更加適用于臨床研究和工業化生產。因此,若采用此技術開發新型腫瘤免疫靶向藥物將會產生巨大的經濟效益。
附圖說明
圖1:免疫靶向脂質體的設計策略圖
圖2-1:DSPE-PEG2000-Folate的合成路線圖
圖2-2:DSPE-PEG2000-Rhamnose的合成路線圖
圖3:實施例3中所獲得的脂質體的粒徑分布和zeta電位值
圖4:實施例3中所獲得的脂質體靶向性測定的激光共聚焦圖
圖5:體外實驗中實施例3所獲得的脂質體的補體依賴毒性
圖6:實施例3所獲得的脂質體在體內小鼠實驗中發揮的CDC效應
具體實施方式
下面通過具體實例來詳細闡述本發明。應當指出的是,以下所描述的實施例中采用的條件都不是孤立的,而是經過反復實驗進行優化組合的。本發明的實施例只是作為一種示范,而不是作為本發明權利要求范圍的限制。對于本領域的技術人員而言,基于本發明進行的適當修改或變通仍然屬于本發明的保護范圍之內。
實施例1:鼠李糖偶聯的聚乙二醇二硬脂酸磷酸酰乙醇胺
精確稱量40mg RhaNBuacid,溶解于0.78ml二甲基亞砜(DMSO),再在此溶液當中加入27mg 1,2二硬酯酸-3磷脂酰乙醇胺-聚乙二醇-氨基(DSPE-PEG2000-NH2)和0.39ml吡啶(pyridine),接下來加入81mg二環已基碳二亞胺,室溫反應4小時。形成霧狀后的混合液通過旋轉蒸發法去除吡啶,并加入10ml單蒸水。再通過離心收取上清,該上清用3000分子量的透析膜,50mM 2L鹽溶液透析兩次,2L去離子水透析三次,最后通過將透析物進行凍干得到白色固體的DSPE-PEG2000-Rhamnose。合成路線如圖2-2所示。
實施例2:葉酸偶聯的聚乙二醇二硬脂酸磷酸酰乙醇胺
精確稱量79mg葉酸,溶解于2ml二甲基亞砜(DMSO),再在此溶液當中加入50mg 1,2二硬酯酸-3磷脂酰乙醇胺-聚乙二醇-氨基(DSPE-PEG2000-NH2)和1ml吡啶(pyridine),接下來加入96mg二環已基碳二亞胺,室溫反應4小時。形成霧狀后的混合液通過旋轉蒸發法去除吡啶,并加入10ml單蒸水。再通過離心收取上清,該上清1000分子量的透析膜,50mM 2L鹽溶液透析兩次,2L去離子水透析三次,最后通過將透析物進行凍干得到黃色固體的DSPE-PEG2000-Folate。合成路線如圖2-1所示。
實施例3:免疫靶向脂質體的制備
配制1,2-二油酰-SN-甘油-3-磷脂酰乙醇胺(DOPE),實施例1所得鼠李糖偶聯的聚乙二醇二硬脂酸磷酸酰乙醇胺(DSPE-PEG2000-Rhamnose),實施例2所得葉酸偶聯的聚乙二醇二硬脂酸磷酸酰乙醇胺(DSPE-PEG2000-Folate)三種成分濃度分別為0.1M,0.01M和0.001M的母液,儲存于-80℃。
取20μl DOPE,200μL DSPE-PEG2000-Rhamnose和2μl DSPE-PEG2000-Folate配成摩爾比為1000:1000:1的混合液(稀釋于10ml氯仿/甲醇(9/1))中,并置于250ml潔凈圓底燒瓶中,在旋轉蒸發儀上以60轉/分鐘的速度進行旋干。旋轉蒸發時,圓底燒瓶要浸于40℃水浴中,并且旋干出現均勻脂質膜以后繼續旋干。15分鐘后,圓底燒瓶離開水面,通入一股氮氣氣流后,將圓底燒瓶用錫箔紙進行避光,高真空下5轉/分鐘低速旋轉過夜(一般14h)。第二天取下圓底燒瓶加入3g直徑為2mm的玻璃珠和2ml PH7.4的PBS,再次通入一股氮氣氣流后,高真空下室溫避光旋轉洗滌脂質膜30分鐘。接著將圓底燒瓶進行水浴超聲2分鐘后,吸出大多室脂質體,用mini-extruder(avanti polar lipid)通過200nm多聚碳酸膜(Whatman PC membrane)來回至少11次,最終得到理想粒徑的單室脂質體。其它比例的脂質體,只需改變DSPE-PEG2000-Rhamnose起始旋干時的母液體積(1000:500:1為100μl,1000:2500:1為500μl)。對照脂質體中不加入DSPE-PEG2000-Folate。
實施例4:脂質體的粒徑和zeta電位的測定
將實施例3中所制備的脂質體取1μl用PBS稀釋1000倍,用馬爾文激光粒度儀進行粒徑的測定;將實施例3中所制備的脂質體取1μl用去離子水稀釋1000倍,用馬爾文激光粒度儀進行zeta電位測定(圖3)。
實施例5:脂質體靶向性的測定
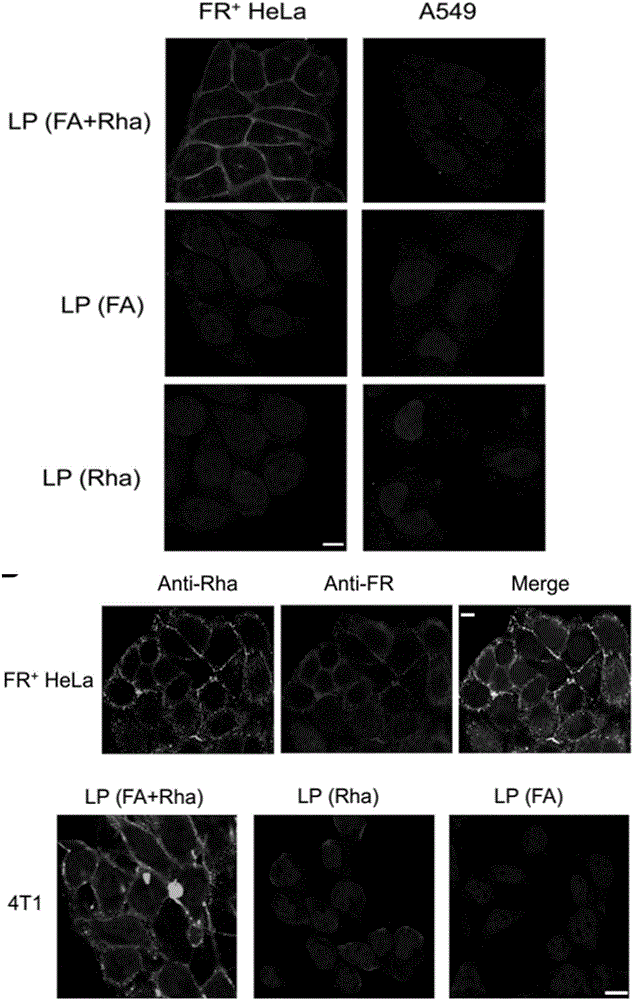
進行細胞實驗,首先將Hela細胞用含10%FBS無Folic acid 1640培養基傳代5次得到FR+Hela細胞(葉酸受體過表達Hela細胞)。FR+Hela以40%的匯合度鋪于24孔板中,貼壁后,用f-rha-lip,f-rha,f-lip,f-lip+rha四組脂質體孵育6h(脂質體的濃度用葉酸的濃度計算并且其孵育最終嘗試為10-7M)。吸出脂質體,PBS洗滌2次,4%多聚甲醛(PFA)室溫固定10分鐘,PBS洗滌兩次,1:200人血清中純化的鼠李糖抗體和1:200兔源葉酸受體抗體室溫孵育1h,再次用PBS洗滌兩次,1:500AF488偶聯的羊抗人抗體和1:500驢抗兔抗體室溫孵育1h,PBS洗滌兩次。最后用Hoechst33342室溫染色10分鐘,PBS洗滌兩次后,在激光共聚焦顯微鏡下觀察熒光(圖4)帶葉酸和鼠李糖的脂質體能夠很好地靶向到葉酸受體過表達的腫瘤細胞(如FR+Hela,4T1)表面。
實施例6:免疫靶向脂質體藥效的體外測定
首先培養FR+Hela細胞,以1×104cells/well的密度接種于96孔板中培養過夜,第二天每孔中加入脂質體孵育6小時,然后用100μl含20%人血清的無葉酸1640培養基替換舊培養基孵育2h,不加人血清的孔作為對照組,另外加入9%H2O2(用含20%人血清的無葉酸1640培養基進行稀釋)的孔作為最大殺傷力(max killing)組,最后在每孔中加入100μl Cell Titer Glo(Promega),每組處理至少進行3次重復.室溫振蕩2分鐘誘導細胞裂解,繼續室溫靜止穩定10分鐘,用Synergy H1(Bio Tek)測發光強度(圖5)鼠李糖靶向脂質體能夠很好地靶向到葉酸受體過表達的腫瘤細胞(如FR+Hela,4T1)并有效殺傷細胞,而且殺傷力會隨著鼠李糖濃度的增加而增加。CDC%=100%-(with human serum-max killing)/(without human serum-max killing)。
實施例7:免疫靶向脂質體藥效的體內測定
進行免疫靶向脂質體藥效的體內測定首先將五到六周大小的BALB/c小鼠,在兩周內每次用30μg Rhamnose-BSA免疫三次。一周后將1×106小鼠乳腺癌4T1細胞接種于裸鼠中成瘤。共養15只小鼠,平均分成三組,分別用實施例3中制備的脂質體f-lip-rha,f-lip和PBS連續處理六周。在第十周對小鼠進行無痛致死處理并取出腫瘤。小鼠腫瘤大小用游標卡尺每兩周測一次(圖6)。用以下公式計算腫瘤體積:腫瘤體積=長度×寬度2/2。
實施例8:含膽固醇的免疫靶向脂質體的制備
具體制備工藝參照實施例3所述的實驗參數。其中,免疫靶向脂質體組合物包含膽固醇,組分中DOPE:膽固醇:DSPE-PEG2000-Rhamnose:DSPE-PEG2000-Folate的摩爾比為1000:1000:1000:1。最后獲得的脂質體粒徑大小為80nm~200nm。
實施例9:含膽固醇和陽離子脂質體DOTAP的免疫靶向脂質體的制備
具體制備工藝參照實施例3所述的實驗參數。其中,免疫靶向脂質體組合物包含膽固醇和陽離子脂質體DOTAP,組分中DOPE:膽固醇:DSPE-PEG2000-Rhamnose:DSPE-PEG2000-Folate:DOTAP的摩爾比為1000:1000:1000:1:4。最后獲得的脂質體粒徑大小為80nm~200nm。
- 還沒有人留言評論。精彩留言會獲得點贊!