一種基于氨基化硅膠濃縮檢測水體中諾如病毒的方法與流程
本發明涉及一種諾如病毒的富集檢測方法,特別涉及一種基于氨基化硅膠濃縮檢測水體中諾如病毒的方法。
(二)
背景技術:
諾如病毒(NoV)屬于杯狀病毒,是無包膜單股正鏈RNA病毒,基因組大小為7624個堿基,包括3個開放閱讀框(ORF1、ORF2和ORF3)。根據NoV的全部衣殼基因序列,病毒可分為5個基因組(GI~GV);目前,已知29種基因型。其中,引起人感染的NoV主要是G I基因組中的8種基因型和G II基因組中的17種基因型。通過突變和重組,諾如病毒的基因組進行著快速的變異,表現出基因的多樣化,從而導致新突變株的產生以及急性胃腸炎疾病的大暴發。NoV的感染性強,甚至少于102拷貝數/mL的NoV顆粒都能導致感染。并且,NoV對環境具有較強的耐受性,在酸性(pH 2.7)條件下、加熱(60℃)條件及自來水中游離氯(3.75~6.25mg/L)濃度條件下,仍具感染性,預防手段十分有限
諾如病毒(Norovirus,NoV)是世界范圍內引起人類急性胃腸炎的最常見病原微生物之一,流行地區極為廣泛,全年均有流行,感染對象主要為成人和學齡兒童,常分布在醫院、餐館、學校、養老院、家庭等。該病毒主要傳播途徑為主要通過糞-口途徑傳播,人感染了諾如病毒通常是由于飲用受污染的水、食品及生活接觸,其中飲用受污染的水是重要途徑之一。對水中NoV的準確檢測能為諾如病毒胃腸炎防控提供科學依據。
水體中諾如病毒檢測的難點在于含量太低、干擾測定的基本成份復雜,給準確測定造成了很大的困難。大部分水體需先通過水樣中病毒的濃縮,才能進行檢測,但水中不必要的污染物也因此被濃縮吸附,從而干擾試驗結果。如通常使用絮凝沉淀法對水樣進行濃縮,但其殘留的有機物質可能會對PCR結果造成影響。另外傳統的病毒濃縮方法,如細胞培養病毒鑒定,在操作上比較耗時,在技術成本的花費上比較昂貴,而且病毒很難在體外環境下進行培養。因此開發病毒的檢測新技術,研究病毒的環境行為和風險評估已引起國際研究界廣泛關注。
由于硅膠具有良好的化學穩定性、熱穩定性以及良好的機械強度,在催化、離子交換、金屬富集和色譜技術中應用很多。利用硅膠表面含有大量的活性硅羥基,用乙醇胺、二乙醇胺、乙二胺、二乙烯三胺和三乙烯四胺等胺類化合物進行表面化學鍵合或改性,可獲得吸附性較好的改性硅膠產品。對合成的氨基化硅膠材料及其吸附性能的研究一直是人們關注的熱點。目前氨基化硅膠已經廣泛應用于生物醫藥、電化學、污水處理及殺菌劑等。本發明主要通過對一類氨基化硅膠病毒吸附特性的研究,開發一種快速、經濟和高效的氨基化硅膠吸附富集諾如病毒的方法。
(三)
技術實現要素:
本發明目的是提供一種操作簡便、省時高效的水體中諾如病毒的富集方法,它以水體中的諾如病毒為對象,采用氨基化硅膠吸附,又在超聲波輔助作用下經特定洗脫液洗脫分離,實現水體中諾如病毒的富集濃縮及檢測。
本發明采用的技術方案是:
本發明提供一種基于氨基化硅膠濃縮檢測水體中諾如病毒的方法,所述方法為:將含有諾如病毒的待測污染水樣與氨基化硅膠混合,在pH值為5~10的條件下,于20-30℃下振蕩孵育2小時,使氨基化硅膠與病毒顆粒充分接觸,孵育結束后,將氨基化硅膠懸濁液(即混合液)離心,取吸附有病毒顆粒的氨基化硅膠沉淀用少量BGT洗脫液浸泡15-30min,浸泡期間每隔30-45s用20-25KHz超聲波處理(即超聲波振蕩輔助洗脫)5min,超聲處理結束后,離心,取上清即為污染水樣中的諾如病毒濃縮液,檢測濃縮液中諾如病毒含量,根據濃縮倍數,獲得待測污染水樣中諾如病毒含量;所述氨基化硅膠是由胺類化合物與硅膠混合,采用物理包裹法制備而成,所述胺類化合物為下列之一:聚乙烯亞胺、3-氨丙基三乙氧基硅烷和N-氨乙基-γ-氨丙基三甲氧基硅烷;所述BGT洗脫液質量組成為:2.5%牛肉浸膏,0.05%吐溫80,溶劑為0.25M甘氨酸水溶液,pH 3.5。
進一步,所述含有諾如病毒的待測污染水樣中病毒含量為4.39×101~4.39×1010拷貝/mL,含有諾如病毒的待測污染水樣體積加入量以氨基化硅膠質量計為10ml/g。
進一步,所述胺類化合物為聚乙烯亞胺,分子量(600、1800、10000),優選分子量為600。
進一步,所述BGT洗脫液體積用量以混合液離心獲得的沉淀質量計為1.5-3ml/g。
進一步,所述硅膠粒徑40-75μm,中性pH,比表面積480m2/g。
進一步,所述氨基化硅膠按如下方法制備:將活化后的硅膠與0.01-2mg/ml胺類化合物的有機溶劑溶液混合,在20-60℃下振蕩培養,離心,取沉淀用溶劑洗滌之后,烘干,獲得氨基化硅膠;所述有機溶劑為甲醇或甲苯,所述溶劑為0.5mol/L H2SO4水溶液、去離子水、1mol/L氨水、甲苯、丙酮或甲醇;所述胺類化合物的有機溶劑溶液體積用量以活化后硅膠質量計為10ml/g。
更進一步,所述氨基化硅膠按如下方法之一制備:(1)將硅膠加入1mol/L硝酸雙蒸水溶液,加熱至微沸狀態,持續攪拌4小時,反應結束后,產物依次用蒸餾水和甲醇洗滌洗至中性,然后在110℃真空干燥,獲得活化后的硅膠;取活化后的硅膠加入到0.5-2mg/mL聚乙烯亞胺的甲醇溶液中混勻后,60℃溫度下,持續震蕩20小時,4000×g離心1min,棄上清,沉淀依次用0.5mol/L H2SO4水溶液、去離子水抽濾和1mol/L氨水浸泡5min后離心去上清,沉淀于80℃30min烘干,獲得聚乙烯亞胺硅膠;所述聚乙烯亞胺的甲醇溶液體積用量以活化后硅膠質量計為10ml/g;(2)將硅膠放入馬弗爐內,150℃干燥過夜,獲得活化后的硅膠;將活化后的硅膠加入到0.02-0.03mg/mL 3-氨丙基三乙氧基硅烷的甲苯混合液中混勻后,56℃溫度下,持續震蕩20小時,4000×g離心1min,棄上清,沉淀依次用甲苯、丙酮和甲醇洗滌,之后于105℃,5h烘干,獲得3-氨丙基三乙氧基硅烷-硅膠;3-氨丙基三乙氧基硅烷的甲苯混合液體積用量以活化后硅膠質量計為10ml/g;(3)將硅膠放入馬弗爐內,150℃干燥過夜,獲得活化后的硅膠;將活化后的硅膠加入到0.01-0.05mg/mL N-氨乙基-γ-氨丙基三甲氧基硅烷的甲苯混合液中混勻后,26℃溫度下,持續震蕩12小時,4000×g離心1min,棄上清,沉淀依次用甲苯、丙酮和甲醇洗滌之后于105℃,5h烘干,獲得N-氨乙基-γ-氨丙基三甲氧基硅烷-硅膠;N-氨乙基-γ-氨丙基三甲氧基硅烷的甲苯混合液體積用量以活化后硅膠質量計為10ml/g。
本發明重點是針對待測水樣中諾如病毒含量低,提供一種濃縮污染水樣中諾如病毒的方法,至于濃縮液中諾如病毒含量的檢測可以采用本領域公知的方法進行,比如熒光定量PCR方法。具體所述濃縮液中諾如病毒含量檢測方法為:采用QIAamp Viral RNA Mini Kit試劑盒(購自德國凱捷公司)提取濃縮液中的諾如病毒RNA,具體步驟按照其說明書進行,提取完畢的病毒RNA于-20℃保存備用。
反轉錄-熒光定量PCR檢測:采用One Step PrimescriptTM RT-PCR Kit進行RT-PCR擴增。擴增體系(25μL):2×buffer 12.5μL,逆轉錄酶和Taq酶各0.5μL,上、下游引物(20μmol/L)各0.6μL,探針(20μmol/L)0.3μL,RNA模板5μL,ddH2O 5μL。擴增條件:42℃逆轉錄反應30min;95℃預變性2min;95℃變性5s,55℃退火、延伸35s,39個循環。
繪制標準曲線:取上述NoV GII特異性PCR產物,純化后與質粒相連,構建含有NoV GII特異性片段的重組質粒。將構建的重組質粒用蒸餾水或TE緩沖液按體積比1:10梯度稀釋后,分別以各個稀釋濃度作為反轉錄-熒光定量PCR檢測模板,通過重組質粒的分子量和待測核酸總量判斷病毒的拷貝數,并根據病毒原液各個稀釋濃度與其對應的拷貝數之間的關系建立標準曲線(圖1)。
計算諾如病毒換算公式及濃縮效率如下
Y=-0.3288X+12.264 (1)
本發明諾如病毒污染水樣中病毒含量的初步計算,推算公式如下:
公式(1)中Y表示病毒的數量(拷貝/μL);X表示熒光定量PCR檢測中的Ct值。公式(2)為濃縮效率計算公式。
所述的氨基化硅膠富集諾如病毒,當1g活化硅膠與10mL、1mg/mL聚乙烯亞胺的甲醇溶液作用,獲得氨基化硅膠后,其中1g氨基化硅膠富集10-40mL濃度4.39×103~4.39×107拷貝/mL諾如病毒水樣時,在pH值為7~9的條件下,其富集效率可達到較為穩定的81.23~87.53%之間。
所述的1g活化硅膠與10mL、0.025mg/mL 3-氨丙基三乙氧基硅烷的甲苯溶液作用獲得氨基化硅膠后,其中1g氨基化硅膠富集10-40mL濃度4.39×103~4.39×107拷貝/mL諾如病毒水樣時,在pH值為7~9的條件下,其富集效率可達到較為穩定的60.65~65.91%之間。
所述的1g活化硅膠與10mL、0.03mg/mL N-氨乙基-γ-氨丙基三甲氧基硅烷的乙醇溶液作用獲得氨基化硅膠后,其中1g氨基化硅膠富集10-40mL濃度4.39×103~4.39×107拷貝/mL諾如病毒水樣時,在pH值為6~9的條件下,其富集效率可達到較為穩定的72.65~85.76%之間。
與現有技術相比,本發明有益效果主要體現在:
1.本發明濃縮病毒操作簡單易行,適用于實驗室和現場作業。
2.采用了氨基化硅膠富集病毒的技術,氨基化硅膠富集病毒可有效減少病毒富集濃縮時的PCR抑制劑,突出操作簡便、分離速度快、可重復性好、成本低和不需要大型昂貴儀器適合現場操作等優點。
3.使用超聲波輔助BGT洗脫液洗脫氨基化硅膠表面的病毒,有助于病毒的洗脫效率的提高。
4.有效的縮短了常規方法中諾如病毒的檢測時間和成本。
5.本發明中聚乙烯亞胺硅膠有較好的富集諾如病毒的能力,表現為1g氨基化硅膠富集10-40mL濃度4.39×103~4.39×107拷貝/mL諾如病毒水樣時,在pH值為7~9的條件下,其濃縮效率可達到較為穩定的81.23~87.53%之間。是未氨基化的原硅膠濃縮效率的7-8倍;同時也顯著高于3-氨丙基三乙氧基硅烷氨基硅膠(60.65~65.91%)和N-氨乙基-γ-氨丙基三甲氧基硅烷氨基硅膠(72.65~85.76%)的濃縮效率。
(四)附圖說明
圖1諾如病毒的熒光定量PCR的Ct值與諾如病毒相應拷貝數的標準曲線。
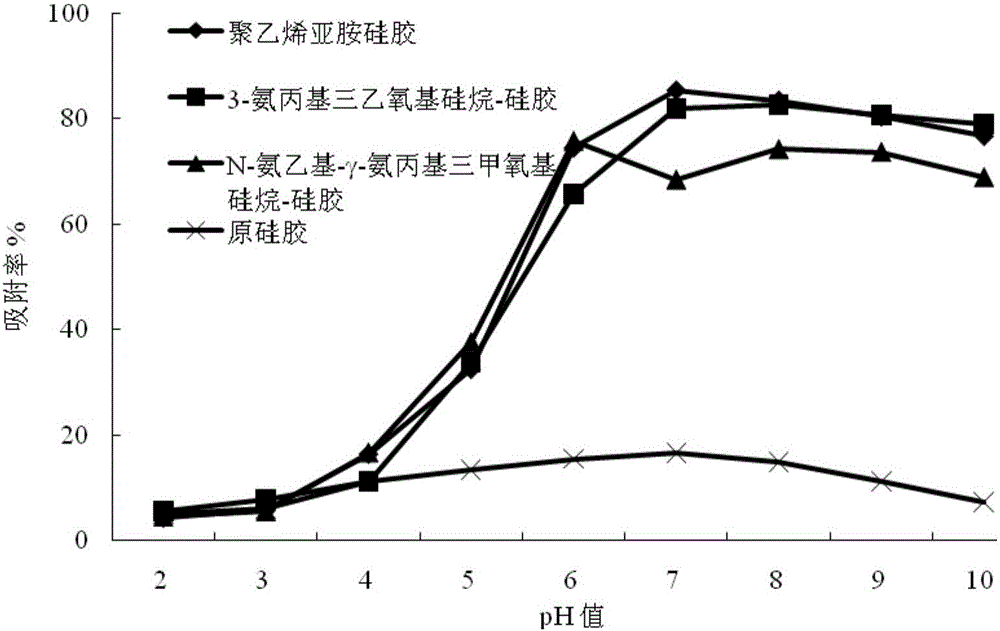
圖2 pH值對氨基化硅膠病毒吸附率的影響。
圖3氨基化硅膠病毒富集能力。
圖4氨基化硅膠病毒濃縮示意圖。
(五)具體實施方式
下面結合具體實施例對本發明進行進一步描述,但本發明的保護范圍并不僅限于此:
本發明采用上海阿拉丁生化科技股份有限公司的硅膠,粒徑40-75μm,中性pH,比表面積480m2/g。氨基材料采用上海阿拉丁生化科技股份有限公司的胺類化合物包括聚乙烯亞胺(分子量600)、3-氨丙基三乙氧基硅烷(分子量221.37)和N-氨乙基-γ-氨丙基三甲氧基硅烷(分子量222.36)。
本發明實施例所述BGT洗脫液質量組成為:2.5%牛肉浸膏、0.05%吐溫80、溶劑為0.25M甘氨酸水溶液,pH 3.5。
實施例1、聚乙烯亞胺硅膠材料富集水體中諾如病毒的效率
(1)聚乙烯亞胺硅膠材料的制備
硅膠活化:將10g硅膠移至三角燒瓶中,加入50ml、1mol/L的硝酸的雙蒸水溶液,加熱至微沸狀態,持續攪拌4小時,反應結束后,產物依次用蒸餾水和甲醇洗滌至中性,然后在110℃真空干燥,即制備出活化硅膠10g。
物理包裹:稱取1g活化后的硅膠加入到10mL聚乙烯亞胺的甲醇溶液(1.0mg/mL)中混勻后,60℃溫度下,持續震蕩20小時,4000×g離心1min,棄上清,沉淀依次用0.5mol/L H2SO4水溶液、去離子水抽濾和1mol/L氨水浸泡5min后離心去上清,之后沉淀于80℃烘干30min,獲得聚乙烯亞胺硅膠1g。
(2)pH值對聚乙烯亞胺硅膠富集諾如病毒影響(圖2)
將1g制備的聚乙烯亞胺硅膠加入到10mL諾如病毒濃度為4.39×107(拷貝/mL)的水樣中,分別在不同pH值(pH 2、3、4、5、6、7、8、9、10)的條件下,于室溫下孵育2小時,4000×g離心1min。使上清與沉淀分離,沉淀轉入新的EP管中,按照步驟(4)和(5)進行分析,以未氨基化的原硅膠為對照,結果見圖2。
(3)病毒濃度對聚乙烯亞胺硅膠富集諾如病毒影響(圖3)
取濃度為4.39×1010拷貝/mL的諾如病毒水樣,按10-1、10-2、10-3、10-4、10-5、10-6、10-7和10-8的方式依次用蒸餾水遞減稀釋。取8份步驟(1)制備的聚乙烯亞氨硅膠,每份1g,分別加入到10mL不同濃度(4.39×1010、4.39×109、4.39×108、4.39×107、4.39×106、4.39×105、4.39×104、4.39×103、4.39×102和4.39×101拷貝/mL)的諾如病毒水樣中,分別在pH值為7的條件下,于室溫下孵育2小時,4000×g離心1min。使上清與沉淀分離,沉淀轉入新的EP管中,按照步驟(4)和(5)進行分析,以未氨基化的原硅膠為對照,結果見圖3。
(4)聚乙烯亞胺硅膠中病毒的洗脫
向步驟(2)、(3)的沉淀1g中分別加入1.5mL BGT洗脫液,浸泡20min,期間每隔30-45s用超聲波(20-25KHz)振蕩5min。超聲結束后,4000×g離心1min,收集上清。
(5)定量測定諾如病毒的富集效率
提取諾如病毒RNA:采用QIAamp Viral RNA Mini Kit試劑盒(購自德國凱捷公司)提取步驟(4)上清中的諾如病毒RNA,具體步驟按照其說明書進行,提取完畢的病毒RNA于-20℃保存備用。
反轉錄-熒光定量PCR檢測:采用One Step PrimescriptTM RT-PCR Kit進行RT-PCR擴增。擴增體系(25μL):2×buffer 12.5μL,逆轉錄酶和Taq酶各0.5μL,上、下游引物(20μmol/L)各0.6μL,探針(20μmol/L)0.3μL,RNA模板5μL,ddH2O 5μL。擴增條件:42℃逆轉錄反應30min;95℃預變性2min;95℃變性5s,55℃退火、延伸35s,39個循環。
繪制標準曲線:取上述NoV GII特異性PCR產物,純化后與質粒相連,構建含有NoV GII特異性片段的重組質粒。將構建的重組質粒用蒸餾水或TE緩沖液按體積比1:10梯度稀釋后,分別以各個稀釋濃度作為反轉錄-熒光定量PCR檢測模板,通過重組質粒的分子量和待測核酸總量判斷病毒的拷貝數,并根據病毒原液各個稀釋濃度與其對應的拷貝數之間的關系建立標準曲線(圖1)。
計算諾如病毒換算公式及濃縮效率如下
Y=-0.3288X+12.264 (1)
公式(1)中Y表示病毒的數量(拷貝/L);X表示熒光定量PCR檢測中的Ct值。公式(2)為濃縮效率計算公式。
本發明諾如病毒污染水樣中病毒含量的初步計算,推算公式如下:
表1 運用聚乙烯亞胺硅膠檢測污染水樣中諾如病毒含量
a檢出值(拷貝/mL)=(濃縮值(拷貝/mL)×濃縮體積)/(原始污染水樣體積(mL))
表2 諾如病毒NoV GII特異性引物和探針
(6)聚乙烯亞胺硅膠吸附病毒能力
結果表明:當1g活化硅膠與10mL、1mg/mL聚乙烯亞胺的甲醇溶液作用,可獲得氨基化硅膠;氨基化硅膠與諾如病毒的吸附效果受到病毒溶液酸堿度的影響,當pH值在2-6時,吸附效果不穩定,且較小。而pH值在7-9時,吸附效果較好(圖2)。同時,氨基化硅膠吸附病毒能力的研究表明,諾如病毒的濃度對氨基化硅膠的富集效果也有影響。圖2的結果表明在pH值為7~9的條件下,1g氨基化硅膠富集10mL濃度4.39×103~4.39×107拷貝/mL諾如病毒水樣時,其富集效率可達到較為穩定的81.23~87.53%之間。
實施例2、3-氨丙基三乙氧基硅烷-硅膠材料富集水體中諾如病毒的效率
(1)3-氨丙基三乙氧基硅烷-硅膠材料的制備
將硅膠放入馬弗爐內,150℃干燥過夜。將1g干燥后的硅膠加入到10mL 3-氨丙基三乙氧基硅烷的甲苯混合液(0.03mg/mL)中混勻后,56℃溫度下,持續震蕩20小時,4000×g離心1min,棄上清,沉淀依次用甲苯、丙酮和甲醇洗滌之后于105℃,5h烘干,獲得3-氨丙基三乙氧基硅烷-硅膠1g。
(2)pH值對3-氨丙基三乙氧基硅烷-硅膠富集諾如病毒影響(圖2)
將1g步驟(1)制備的3-氨丙基三乙氧基硅烷-硅膠加入到10mL諾如病毒濃度為4.39×107(拷貝/mL)的水樣中,分別在不同pH值(pH 2、3、4、5、6、7、8、9、10)的條件下,于室溫下孵育2小時,4000×g離心1min。使上清與沉淀分離,沉淀轉入新的EP管中,按照步驟(4)和(5)進行分析,以未氨基化的原硅膠為對照,結果見圖2。
(3)病毒濃度對3-氨丙基三乙氧基硅烷-硅膠富集諾如病毒影響(圖3)
取濃度為4.39×1010拷貝/mL的諾如病毒水樣,按10-1、10-2、10-3、10-4、10-5、10-6、10-7和10-8的方式依次用蒸餾水遞減稀釋。取8份步驟(1)制備的3-氨丙基三乙氧基硅烷-硅膠,每份1g,分別加入到10mL不同濃度(4.39×1010、4.39×109、4.39×108、4.39×107、4.39×106、4.39×105、4.39×104、4.39×103、4.39×102和4.39×101拷貝/mL)的諾如病毒水樣中,分別在pH值為7的條件下,于室溫下孵育2小時,4000×g離心1min。使上清與沉淀分離,沉淀1g轉入新的EP管中,按照步驟(4)和(5)進行分析,以未氨基化的原硅膠為對照,結果見圖3。
(4)3-氨丙基三乙氧基硅烷-硅膠中病毒的洗脫
分別向步驟(2)和(3)的EP管中加入1.5mL BGT洗脫液,浸泡吸附有病毒的氨基化硅膠沉淀30min,期間每隔30-45s用超聲波(20-25KHz)超聲處理5min。超聲處理結束后,4000×g離心1min,收集上清。
(5)定量測定諾如病毒的富集效率
測定方法同實施例1。
(6)3-氨丙基三乙氧基硅烷-硅膠吸附病毒能力
結果表明:當1g活化硅膠與10mL、0.025mg/mL 3-氨丙基三乙氧基硅烷的甲醇溶液作用,可獲得氨基化硅膠;氨基化硅膠與諾如病毒的吸附效果受到病毒溶液酸堿度的影響,當pH值在2-6時,吸附效果不穩定,且較小。而pH值在7-9時,吸附效果較好(圖2)。同時,氨基化硅膠吸附病毒能力的研究表明,諾如病毒的濃度對氨基化硅膠的富集效果也有影響。圖2的結果表明在pH值為7~9的條件下,1g氨基化硅膠富集10mL濃度4.39×103~4.39×107拷貝/mL諾如病毒水樣時,其富集效率可達到較為穩定的60.65~65.91%之間。
實施例3、N-氨乙基-γ-氨丙基三甲氧基硅烷-硅膠材料富集水體中諾如病毒的效率
(1)N-氨乙基-γ-氨丙基三甲氧基硅烷-硅膠材料的制備
將硅膠放入馬弗爐內,150℃干燥過夜。將1g干燥后的硅膠加入到10mL N-氨乙基-γ-氨丙基三甲氧基硅烷的甲苯混合液(0.04mg/mL)中混勻后,26℃溫度下,持續震蕩12小時,在40℃下4000×g離心1min,棄上清,沉淀依次用甲苯、丙酮和甲醇洗滌之后于105℃,5h烘干,之后在60℃下干燥6小時,獲得N-氨乙基-γ-氨丙基三甲氧基硅烷-硅膠1g。
(2)pH值對N-氨乙基-γ-氨丙基三甲氧基硅烷-硅膠富集諾如病毒影響(圖2)
將1g制備的N-氨乙基-γ-氨丙基三甲氧基硅烷-硅膠加入到10mL諾如病毒濃度為4.39×107(拷貝/mL)的水樣中,分別在不同pH值(pH 2、3、4、5、6、7、8、9、10)的條件下,于室溫下孵育2小時,4000×g離心1min。使上清與沉淀分離,沉淀轉入新的EP管中,按照步驟(4)和(5)進行分析,以未氨基化的原硅膠為對照,結果見圖2。
(3)病毒濃度對N-氨乙基-γ-氨丙基三甲氧基硅烷-硅膠富集諾如病毒影響(圖3)
取濃度為4.39×1010拷貝/mL的諾如病毒水樣,按10-1、10-2、10-3、10-4、10-5、10-6、10-7和10-8的方式依次用蒸餾水遞減稀釋。取8份步驟(1)制備的N-氨乙基-γ-氨丙基三甲氧基硅烷-硅膠,每份1g,分別加入到10mL不同濃度(4.39×1010、4.39×109、4.39×108、4.39×107、4.39×106、4.39×105、4.39×104、4.39×103、4.39×102和4.39×101拷貝/mL)的諾如病毒水樣中,分別在pH值為7的條件下,于室溫下孵育2小時,4000×g離心1min。使上清與沉淀分離,1g沉淀轉入新的EP管中,按照步驟(4)和(5)進行分析,以未氨基化的原硅膠為對照,結果見圖3。
(4)N-氨乙基-γ-氨丙基三甲氧基硅烷-硅膠中病毒的洗脫
分別向步驟(2)和(3)的EP管中加入1.5mL BGT洗脫液浸泡吸附有病毒的氨基化硅膠沉淀30min,期間每隔45s用超聲波(20-25KHz)超聲作處理5min。超聲處理結束后,4000×g離心1min,收集上清。
(5)定量測定諾如病毒的富集效率
測定方法同實施例1。
(6)N-氨乙基-γ-氨丙基三甲氧基硅烷-硅膠吸附病毒能力
結果表明:當1g活化硅膠與10mL、0.03g/mL N-氨乙基-γ-氨丙基三甲氧基硅烷的甲醇溶液作用,可獲得氨基化硅膠;氨基化硅膠與諾如病毒的吸附效果受到病毒溶液酸堿度的影響,當pH值在2-5時,吸附效果不穩定,且較小。而pH值在6-9時,吸附效果較好(圖2)。同時,氨基化硅膠吸附病毒能力的研究表明,諾如病毒的濃度對氨基化硅膠的富集效果也有影響。圖2的結果表明在pH值為6~9的條件下,1g氨基化硅膠富集10mL濃度4.39×103~4.39×107拷貝/mL諾如病毒水樣時,其富集效率可達到較為穩定的72.65~85.76%之間。
以上內容是結合具體的優選實施方式對本發明所做的進一步說明,不能認定本發明的具體實施只局限于這些說明。對于本發明所屬技術領域的普通技術人員來說,在不脫離本發明構思的前提下,其構架形式能夠靈活多變,可以派生系列產品。只是做出簡單的推演活替換,都應當視為屬于本發明由所提交的權利要求書確定的專利保護范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!