通過正義抑制的木質素生物合成的改良的制作方法
技術領域:
本發明涉及植物中木質素生物合成的改良、木質素生物合成途徑包含的酶和編碼這些酶的核酸,以及更具體地,涉及通過正義抑制改良木質素生物合成的方法、相關的核酸和結構。本發明發還涉及調控元件,以及更具體地,涉及在植物細胞中能夠引起外源基因表達的啟動子,如編碼植物中木質素生物合成途徑涉及的酶的基因。本發明還涉及包含本發明的核酸和調控元件的載體,轉化有這些調控元件、核酸和載體的植物細胞、植物、種子和植物其它部分,以及使用這些核酸、調控元件和載體的方法。
背景技術:
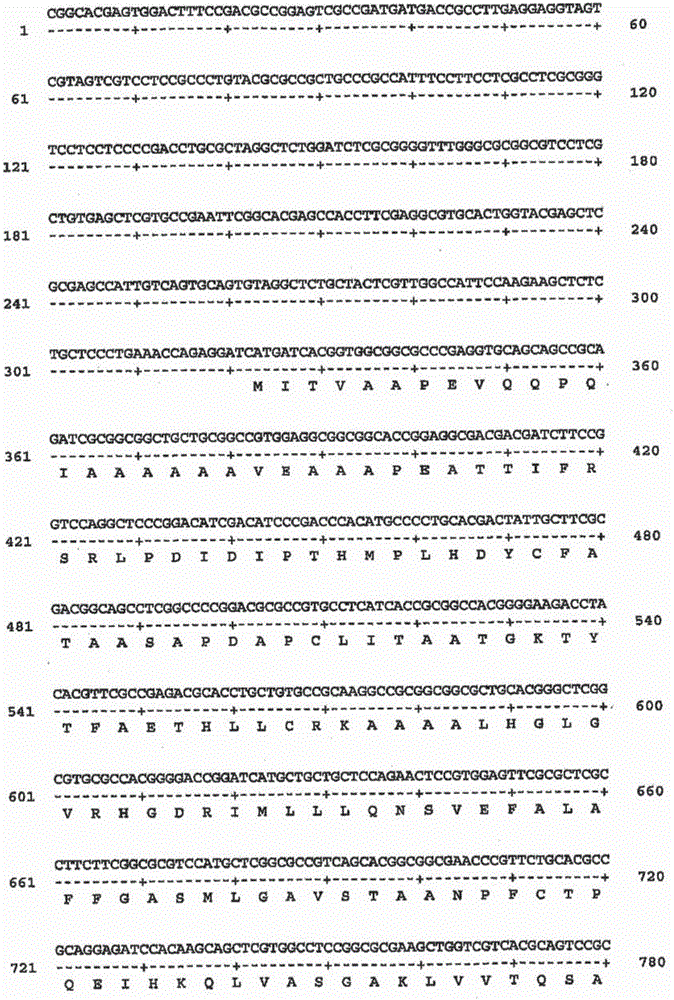
:木質素是復雜的酚聚合體,其增強細胞壁抵抗機械和化學的降解。木質化過程典型地發生在具有結構性的、傳導或防御作用的細胞的壁的次生加厚過程中。通過脫氫聚合將三個單體前體,芥子醇、松柏醇和p-香豆醇化合,分別形成木質素聚合體的丁香基(S)、愈創木基(G)和羥基(H)亞單元,木質素聚合體也能夠通過過氧化物酶和其它氧化性同工酶的作用與細胞壁多糖連接。在禾本科中,單體前體的生物合成是多步過程,由芳香族氨基酸苯丙氨酸和酪氨酸開始。這是該途徑中最后的兩個還原/脫氫步驟,由肉桂酰輔酶A還原酶(CCR)和肉桂醇脫氫酶(CAD)催化,肉桂酰輔酶A還原酶(CCR)和肉桂醇脫氫酶(CAD)被認為是木質素生物合成中特異性酶。根據植物種類、組織、發育階段和亞細胞定位,木質素聚合體中結合的單體的比例有所變化。咖啡酸O-甲基轉移酶(OMT)、4-香豆酸輔酶A連接酶(4CL)、肉桂酰輔酶A還原酶(CCR)和肉桂醇脫氫酶(CAD)是木質素生物合成中的關鍵酶。全世界的永久牧場估計覆蓋了70%的農業耕作面積。黑麥草(Loliumspp.)和其密切相關的羊茅(Festucaspp.)對溫帶草原有重要價值。商業上最有價值的黑麥草是意大利或一年生黑麥草(L.multiflorumLam.)和多年生黑麥草(L.perenneL.)。在牲畜生產是密集型產業的國家,如荷蘭、英國和新西蘭,它們是關鍵的草料種類。商業上最重要的羊茅是高羊茅(F.anundinaceaSchreb.)、牛尾草(F.pratensis)和紫羊茅(F.rubra)。多年生黑麥草(LoliumperenneL.)是播種在澳大利亞溫帶乳牛牧場的主要的草類,和貫穿世界溫帶氣候的關鍵牧草。在澳大利亞溫帶牧場觀察到的草的飼喂價值顯著下降是在晚春和初夏,此時以多年生黑麥草為基礎的牧場的營養價值不能滿足哺乳乳牛的代謝要求。多年生黑麥草也是重要的草皮草。草和豆科植物體外干物質消化率與木質素含量呈負相關。另外,具有較高瘤胃消化率的玉米、高粱和珍珠粟中的木質素生物合成的酶的自然突變體,表現為具有較低的木質素含量和改變的S/G亞單元比例。因此,當它們成熟時,植物細胞壁的木質化是降低草料組織的消化率的主要因素。期望有改變植物中木質素生物合成的方法,包括草類如黑麥草和羊茅,通過降低關鍵生物合成酶的活性,以減少木質素含量和/或改變木質素成分,以增加干物質消化率和改良草本性質。但是,對于一些申請,是期望提高木質素生物合成以增加木質素含量和/或改變木質素成分,例如增加木材的機械強度,增加草皮草的機械強度,降低植物高度和減輕倒伏或改善抗病性。雖然編碼木質素生物合成途徑中的一些酶的核酸序列已經從某些種類植物中分離出,仍然需要用于改良植物中,特別是草種類如黑麥草和羊茅中的木質素生物合成的材料。可能通過轉基因處理改良的植物的其它表型特征包括疾病抗性、礦物質含量、營養品質和抗旱性。但是,植物中,表型特征的轉基因處理需要能夠引起外源基因在植物細胞中表達的調控元件的有效作用。技術實現要素:本發明的一個目的是克服、或至少減輕,現有技術相關的一個或多個難點或不足。在一個方面,本發明提供實質上提純的或分離的編碼黑麥草(Lolium)或羊茅(Festuca)種類的下列酶的核酸或核酸片段:4-香豆酸輔酶A連接酶(4CL)、肉桂酰輔酶A還原酶(CCR)和肉桂醇脫氫酶(CAD)。黑麥草(Lolium)或羊茅(Festuca)種類可以是任何合適類型,包括意大利或一年生黑麥草、多年生黑麥草、高羊茅、牛尾草和紫羊茅。優選地,黑麥草或羊茅的種類是黑麥草屬(Lolium)種,如Loliumperenne或Loliumarundinaceum,也被認為是Festucaarundinacea。“核酸”意思是能夠攜帶遺傳信息的核苷酸鏈。本術語通常指基因或功能性活性片段或它們的變異體以及或能夠影響表型的生物體基因組中其它序列。術語“核酸”包括DNA(如cDNA或基因組DNA)和RNA(如mRNA或microRNA),單鏈或雙鏈,可選擇地包括合成的、非自然的或改變的核苷酸堿基、合成的核酸和它們的組合物。核酸或核酸片段可以是任何合適的類型,包括DNA(如cDNA或基因組DNA)和RNA(如mRNA),單鏈或雙鏈,可選擇地包括合成的、非自然的或改變的核苷酸堿基以及它們的組合物。“實質上提純的”意思是核酸或啟動子從基因中分離出,在生物體自然存在的、本發明的核酸或啟動子源于的基因組中,基因在核酸或啟動子的側部。因此本術語包括,例如,融合至載體、自主復制質粒或病毒、或者原核生物或真核細胞基因組DNA的核酸或啟動子,或者作為不依賴其它序列的單獨的分子(如,cDNA或通過PCR或限制性核酸內切酶消化的基因組的或cDNA片段)存在的核酸或啟動子。還包括是雜交基因一部分的核酸或啟動子。優選地,實質上提純的核酸或啟動子至少是大約90%的純度;更優選地,至少大約95%的純度,甚至更優選地,至少大約98%的純度。術語“分離的”意思是材料從它的初始環境(如,如果是自然存在即自然環境)中移開。例如,存在于活的植物中的自然存在的核酸不是分離的,但是,從自然系統中某些或全部共存材料中分離出來的同樣的核酸,是分離的。這樣的核酸可以是載體的一部分和/或這樣的核酸可以是組合物的一部分,并且在載體或組合物中仍然是分離的,這樣的載體或組合物不是它們自然環境的一部分。在本發明這方面的一個優選實施方式中,實質上提純的或分離的編碼4CL的核酸或核酸片段包括核苷酸序列,該核苷酸序列選自:(a).本發明圖2、3和4中所示的序列(序列號分別為:1、3和5);(b).本發明圖2、3和4中所示的序列(序列號分別為:1、3和5)的互補序列;(c).(a)和(b)中序列的反義序列;和(d).(a)、(b)和(c)中序列的功能活性片段和變異體組成的組。在本發明這方面的進一步優選實施方式中,實質上提純的或分離的編碼CCR的核酸或核酸片段包括核苷酸序列,該核苷酸序列選自:(a).本發明圖10中所示的序列(序列號:7);(b).本發明圖10中顯示的序列(序列號:7)的互補序列;(c).(a)和(b)中序列的反義序列;和(d).(a)、(b)和(c)中序列的功能活性片段和變異體組成的組。在本發明這方面的進一步優選實施方式中,實質上提純的或分離的編碼CAD的核酸或核酸片段包括核苷酸序列,該核苷酸序列選自:(a).本發明圖13、14、26和27中顯示的序列(序列號分別為:9、11、14和16);(c).(a)和(b)中序列的反義序列;和(d).(a)、(b)和(c)中序列的功能活性片段和變異體組成的組。“功能活性”意思是片段或變異體(如相似物、派生物或突變體)能夠參與或改良植物中木質素的生物合成。這樣的變異體包括自然存在的等位基因變異體和非自然存在的變異體。另外,可以考慮一個或多個核苷酸的增加、缺失、取代和衍生化,只要這樣的修改沒有導致片段或變異體的功能性活性的損失。優選地,功能活性片段或變異體與該片段或變異體相應的上面提到的序列的相關部分至少大約80%同源;更優選地,至少大約90%同源;甚至更優選地,至少大約95%同源;最優選地,至少大約98%同源。這樣的功能活性變異體和片段包括,例如,具有保守的核苷酸變化。“保守的核苷酸變化”意思是由于遺傳密碼的兼并,導致在編碼的蛋白中的氨基酸的保守的核苷酸取代。這樣功能活性變異體和片段還包括,例如,那些具有導致在相應的氨基酸序列中一個或多個殘基的保守的氨基酸的取代的核苷酸變化。“保守的氨基酸取代”意思是一個氨基酸由同類中的另一個氨基酸取代,這些類別如下非極性的:Ala、Val、Leu、Ile、Pro、Met、Phe、Trp極性的中性的:Gly、Ser、Thr、Cys、Tyr、Asn、Gln酸性的:Asp、Glu堿性的:Lys、Arg、His還可以按如下形成其它的保守的氨基酸取代:芳香族的:Phe、Tyr、His質子供體:Asn、Gln、Lys、Arg、His、Trp質子受體:Glu、Asp、Thr、Ser、Tyr、Asn、Gln優選地,片段大小至少為20個核苷酸;更優選地,至少50個核苷酸;更優選地,至少100個核苷酸;更優選地,至少200個核苷酸;更優選地,至少500個核苷酸。本發明這方面的進一步優選實施方式中,功能活性片段或變異體能夠通過正義抑制改良植物中木質素生物合成。因此,本發明提供實質上提純的或分離的核酸,該核酸包括編碼木質素生物合成酶的基因的片段或變異體,所述核酸能夠通過正義抑制改良植物中木質素生物合成。“正義抑制”的意思是當功能活性片段或變異體以正義方向(senseorientation)引入植物中時,相對于非轉化的對照植株,能夠引起轉化植株中相應基因的表達的可鑒定地減少。“正義”方向的意思是核酸與編碼成或可編碼成蛋白的信使RNA拷貝具有相同的方向或相同的極性。用于正義抑制的片段和變異體包括在根據本發明的核酸和核酸片段中有一個或多個核苷酸增加、缺失、取代或衍生化的片段和變異體。用于正義抑制的片段和變異體優選地包括具有短的缺失的,例如,1-大約500、1-大約300、或1-大約100個核苷酸,優選地是連續的核苷酸。在一個優選的實施方式中,短的缺失可以位于或接近于片段或變異體所基于的基因的3’或5’末端的例如大約200、100、50或20個堿基內。在本發明這方面的優選實施方式中,能夠通過正義抑制改良木質素生物合成的功能活性片段或變異體可以是編碼4CL、CCR或CAD的核酸或核酸片段的功能活性片段或變異體,例如這里之前描述的,或者如在國際專利申請WO02/26994或WO03/40306中描述的;或者編碼肉桂酸-4-羥基化酶(C4H)、咖啡酰輔酶A3-O-甲基轉移酶(CCoAOMT或CCoAMT)、咖啡酸-O-甲基轉移酶(OMT或COMT)、阿魏酸-5-羥基化酶(F5H)或苯丙氨酸解氨酶(PAL)的核酸或核酸片段的功能活性片段或變異體,例如在國際專利申請WO02/26994或WO03/40306中所描述的;或者肉桂酸-3-羥基化酶(C3H)的功能活性片段或變異體,例如在國際專利申請WO2008/064289中描述的。優選地,功能活性片段或變異體編碼4CL、CCR、CAD、C3H、C4H、CCoAOMT、COMT、F5H或PAL多肽,該多肽沒有酶活性或者具有實質上降低的酶活性。“實質上降低的酶活性”的意思是酶活性明顯降低,例如至少比野生型植株的酶活性低大約25%、50%或75%。優選地,功能活性片段或變異體包括相對于片段或變異體所基于的相關基因的移碼突變。這可能導致編碼的多肽的酶活性實質性降低。“移碼突變”的意思是插入或缺失多個核苷酸的突變,核酸序列不能被3整除。由于基因以三聯密碼子表達,插入或缺失可能破壞讀碼框,或者形成密碼子的核酸組,導致與原本不同的翻譯結果。序列中缺失或插入發生的越早,蛋白被改變的幾率越大。移碼突變可以引起讀碼的差異,所以突變后大多數的密碼子(有一些例外,由于冗余或同時發生的相似性)與野生型序列中相應的密碼子相比,將編碼不同的氨基酸,導致實質上改變的多肽序列。此外,終止密碼子“UAA、UGA或UAG”不能被讀出,或者終止密碼子在早一些的位點產生。產生的蛋白可能異常地短、異常地長、和/或包括錯誤的氨基酸。這不可能有功能。發生在或靠近5’末端的缺失或添加可以優選地在短的距離內,例如大約在ATG起始密碼子的20、50、100或200個堿基之內,優選地在ATC起始密碼子下游的短的距離內,例如大約在ATG起始密碼子下游的20、50、100或200個堿基內。“下游”的意思是沿著核酸的5’-3’方向。優選地,這樣發生在或靠近5’末端的缺失或添加可以導致移碼突變,因此得到的多肽具有很少或沒有酶活性。在具體優選實施方式中,位于或靠近5’末端的缺失或添加可以在ATG起始密碼子下游的短距離內的1、2、4、5、7或8個堿基的缺失或添加,優選地,是連續堿基,因此導致移碼突變,得到的多肽具有很少或沒有酶活性。更優選地,移碼突變是一個堿基缺失。發生在或靠近3’末端的缺失可以優選地起始于3’末端或在3’末端短距離內,例如大約20、50、100或200個堿基開始,并且向5’方向延伸。優選地,這樣的缺失的大小在大約50至500個核苷酸之間,更優選地,大約100至300個核苷酸之間。在本發明這方面具體優選實施方式中,能夠通過正義抑制改良木質素生物合成的功能活性片段或變異體可以是編碼的CCR、4CL或CAD、C3H、C4H、CCoAOMT、COMT、F5H或PAL的核酸或核酸片段的功能活性片段或變異體。因此,在優選實施方式中,本發明提供核酸的片段或變異體,該核酸選自具有本發明圖10中所示的序列(序列號:7),和公布號為WO02/26994的專利申請中的圖38、40、41、43和44中的序列(序列號分別為:102、104-106、107、109-110和111),和公布號為WO03/40306的專利申請中的序列號為147和148中的序列的核酸組成的組;其中所述的片段或變異體能夠通過正義抑制所述植物中編碼CCR的基因,改良植物中木質素生物合成。在進一步優選實施方式中,本發明提供核酸的片段或變異體,該核酸選自具有本發明圖13、14、26和27所示的序列(序列號分別為9、11、14和16),和公布號為WO02/26994的專利申請中的圖9、11、13、15、16、18、19、21和22中的序列(序列號分別為23、25、27、29至33、34、36至40、41、43至44和45),和公布號為WO2008/064289的專利申請中的序列號為7中的序列,和公布號為WO03/40306的專利申請中序列號為35和145中的序列的核酸組成的組;其中所述片段或變異體能夠通過正義抑制所述植物中編碼CAD的基因,改良植物中木質素生物合成。在進一步優選實施方式中,本發明提供核酸的片段或變異體,該核酸選自具有本發明圖2、3和4中所示的序列(序列號分別為1、3和5),和公布號為WO02/26994的專利申請中的圖68、70、71和73中的序列(序列號分別為154、156-161、162和164),和公布號為WO03/40306的專利申請中的序列號為29、31、27、142和143中的序列的核酸組成的組;其中所述片段或變異體能夠通過正義抑制所述植物中編碼4CL的基因,改良植物中木質素生物合成。在進一步優選實施方式中,本發明提供核酸的片段或變異體,該核酸選自具有公布號為WO02/26994的專利申請中的圖32、34、36和76中所示的序列(序列號分別為96、98、100和166),和公布號為WO2008/064289的專利申請中的序列號為6中的序列,和公布號為WO03/40306的專利申請中的序列號為33和144中的序列的核酸組成的組;其中所述片段或變異體能夠通過正義抑制所述植物中編碼C4H的基因,改良植物中木質素生物合成。在進一步優選實施方式中,本發明提供核酸的片段或變異體,該核酸選自具有公布號為WO02/26994的專利申請中的圖1、3、4、6、7、82和87中所示的序列(序列號分別為1、3-11、12、14-20、21、168和170),和公布號為WO2008/064289的專利申請中的序列號為8中的序列,和公布號為WO03/40306的專利申請中的序列號為37和146中的序列的核酸組成的組;其中所述片段或變異體能夠通過正義抑制所述植物中編碼CCoAOMT的基因,改良植物中木質素生物合成。在進一步優選實施方式中,本發明提供核酸的片段或變異體,該核酸選自具有公布號為WO02/26994的專利申請中的圖24、26、27、29、30、93和99中所示的序列(序列號分別為47、49-58、59、61-93、94、172和174),和公布號為WO2008/064289的專利申請中的序列號為2、8和9中的序列,和公布號為WO03/40306的專利申請中的序列號為149、42、150和43中的序列的核酸組成的組;其中所述片段或變異體能夠通過正義抑制所述植物中編碼COMT的基因,改良植物中木質素生物合成。在進一步優選實施方式中,本發明提供核酸的片段或變異體,該核酸選自具有公布號為WO02/26994的專利申請中的圖59和61中所示的序列(序列號分別為135和137-139),和公布號為WO03/40306的專利申請中的序列號為45和151中的序列的核酸組成的組;其中所述片段或變異體能夠通過正義抑制所述植物中編碼F5H的基因,改良植物中木質素生物合成。在進一步優選實施方式中,本發明提供核酸的片段或變異體,該核酸選自具有公布號為WO02/26994的專利申請中的圖62、64、65和67中所示的序列(序列號分別為140、142-148、149和151-153),和公布號為WO03/40306的專利申請中的序列號為152、153、50、54、48、53、156、49、51、154、52和155中的序列的核酸組成的組;其中所述片段或變異體能夠通過正義抑制所述植物中編碼PAL的基因,改良植物中木質素生物合成。在進一步優選實施方式中,本發明提供核酸的片段或變異體,該核酸選自具有公布號為WO2008/064289的專利申請中的序列號為1中所示的序列;其中所述片段或變異體能夠通過正義抑制所述植物中編碼C3H的基因,改良植物中木質素生物合成。優選地,片段或變異體包括位于或靠近如這里之前所述的序列的3’或5’末端的短的缺失。優選地,片段或變異體包括相對于如這里之前所述的序列的移碼突變。在特別優選的實施方式中,片段或變異體包括選自表1和表2所示的移碼DNA序列組的序列,或者編碼包括選自表1和表2所示的移碼蛋白序列組的序列的多肽。在本發明的第二個方面,提供包括根據本發明的核酸或核酸片段的基因構建體或載體。在本發明這方面的優選實施方式中,載體可以包括調控元件如啟動子、根據本發明的核酸或核酸片段和終止子,所述調控元件、核酸或核酸片段和終止子是有效地連接。“基因構建體”的意思是重組核酸分子。“載體”的意思是用于轉移遺傳材料至目標細胞的基因構建體。“有效地連接”的意思是核酸和調控序列,如啟動子,以這樣一種方式連接:能夠使所述核酸在合適的條件下表達,例如當合適的分子如轉錄激活因子蛋白結合至調控序列時。優選地,有效連接的啟動子在相關的核酸的上游。載體可以是任何合適的類型,可以是病毒的或非病毒的。載體可以是表達載體。這樣的載體包括染色體的、非染色體的和合成的核酸序列,如植物病毒衍生物;細菌質粒;來自于根癌農桿菌(Agrobacteriumtumefaciens)的Ti質粒的衍生物;來自于毛根農桿菌(Agrobacteriumrhizogenes)的Ri質粒的衍生物;噬菌體DNA;酵母人工染色體;細菌人工染色體;雙元細菌人工染色體;來自于質粒和噬菌體DNA的聯合體的載體。但是,可以使用任何其它的載體,只要它能夠在植物細胞中復制或者整合或者可生存。調控元件和終止子可以是任何合適的類型,并且可以是目標植物細胞內源的,或者是外源的,只要它們在目標植物細胞中起作用。優選地,調控元件是啟動子。可以用在本發明的載體的多種的啟動子是本領域技術人員所熟知的。影響啟動子選擇的因素包括期望的載體的組織特異性,和期望是組成型表達或誘導型表達和需要轉化的植物細胞的種類(如:單子葉植物或雙子葉植物)。特別合適的啟動子包括花椰菜花葉病毒35S(CaMV)啟動子,玉米泛素啟動子,水稻肌動蛋白啟動子和黑麥草內源的OMT、4CL、CCR或CAD啟動子。可以用在本發明的載體的多種的終止子是本領域技術人員所熟知的。終止子可以來自與啟動子序列同一個基因或不同的基因。特別合適的終止子是多聚腺苷酸化信號,如CaMV35S的多聚A和其它來自胭脂堿合酶(nos)和章魚堿合酶(ocs)基因的終止子。載體,除調控元件、本發明的核酸或核酸片段和終止子之外,可以包括更多的對于核酸或核酸片段的表達必須的元件,以不同的方式組合,例如載體骨架、復制起點(ori)、多克隆位點、間隔序列、增強子、內含子(如玉米泛素Ubi內含子)、抗生素抗性基因和其它選擇性標記基因(如新霉素磷酸轉移酶(npt2)基因、潮霉素磷酸轉移酶(hph)基因、草丁膦乙酰轉移酶(bar或pat)基因)、和報告基因(如β-葡糖苷酸酶(GUS)基因(gusA))。載體還可以包含用于翻譯起始的核糖體結合位點。載體還可以包括用于擴增表達的合適序列。作為可選擇的標記基因使用的選擇,可選擇的標記基因提供用于挑選轉化的宿主細胞的表型,在轉化細胞中載體的存在可以通過本領域熟知的其它技術測定,例如PCR(聚合酶鏈式反應),Southern印跡雜交分析,組織化學GUS試驗,Northern和Western印跡雜交分析。本領域技術人員將意識到載體的多種成分是有效地連接,導致所述的核酸或核酸片段的表達。將本發明中的載體的成分有效地連接的技術是本領域技術人員熟知的。這樣的技術包括連接物的使用,如合成的連接物,例如包括一個或多個限制性內切酶位點。本發明的載體可以融合至多種植物,包括單子葉植物(來自于黑麥草屬、羊茅屬、狗牙根屬、臂形草屬、雀稗屬、黍屬、芒屬、狼尾草屬、虉草屬的草,和其它的草料、草皮和生物能草,玉米,燕麥,甘蔗,小麥和大麥),雙子葉植物(如擬南芥屬、煙草、豆類、苜蓿屬、橡樹、桉屬、楓、楊屬、油菜、大豆和鷹嘴豆)和裸子植物(如松屬)。在優選實施方式中,載體用于轉化單子葉植物,優選地草種類如黑麥草屬、羊茅屬、狗牙根屬、臂形草屬、雀稗屬、黍屬、芒屬、狼尾草屬、虉草屬、和其它的草料、草皮和生物能草,更優選地是黑麥草種如多年生黑麥草(Loliumperenne)或Loliumarundinaceum,包括用于草料和草皮使用的栽培品種。用于將本發明的載體融入至植物細胞的技術(例如通過轉導、轉染或轉化)是本領域技術人員熟知的。這樣的技術包括農桿菌介導的導入,電轉化至組織、細胞和原生質體,原生質體融合,注射至繁殖器官,注射至未成熟的胚和高速彈射介導至細胞、組織、愈傷組織、未成熟的和成熟的胚。技術的選擇很大程度上依賴于要轉化的植物的類型。融合有本發明的載體的細胞可以篩選,如前面所述,然后使用本領域公知的技術,在合適的培養基上培養以產生轉化的植物。培養環境,如溫度、pH值等等,對本領域技術人員是顯而易見的。得到的植物可以繁殖,有性繁殖或無性繁殖,利用本領域公知的方法,以產生轉化植物的連續世代。本發明的進一方面,提供了轉化的植物細胞、植物、植物種子或其它植物部位、或植物生物量,包括可消化的生物量如干草,包括,如轉化有本發明的核酸、基因構建體或載體。優選地,轉基因植物細胞、植物、植物種子或其它植物部位通過根據本發明的方法制造出。本發明還提供轉基因植物、植物種子或其它植物部位,或植物生物量,來自于本發明的植物細胞以及包括本發明的核酸、基因構建體或載體。本發明還提供轉基因植物、植物種子或其它植物部位,或植物生物量,來自于本發明的植物以及包括本發明的核酸、基因構建體或載體。本發明的核酸、基因構建體或載體可以是穩定地融入至植物基因組、植物種子、其它植物部分或植物生物量。植物細胞、植物、植物種子或其它植物部分可以來自于任何合適的種類,包括單子葉植物、雙子葉植物和裸子植物。在優選的實施方式中,植物細胞、植物、植物種子和其它植物部分可以來自于單子葉植物,優選地是草種類,如黑麥草屬、羊茅屬、狗牙根屬、臂形草屬、雀稗屬、黍屬、芒屬、狼尾草屬、虉草屬、和其它的草料、草皮和生物能草,更優選地是黑麥草種如多年生黑麥草(Loliumperenne)或Loliumarundinaceum。本發明的進一方面,提供了一種改良植物中木質素生物合成的方法,所述方法包括向所述植物中導入有效量的根據本發明的核酸或核酸片段、基因構建體和/或載體。“有效量”的意思是在所述植物、或植物、植物種子或其它植物部分、或來自它們的植物生物量中足以引起可識別的表型的量。本領域的技術人員在考慮植物的類型、處理順序和其它相關因素后,可以很容易地測定這樣的量。這樣的技術人員可以很容易地測定合適的量和處理方法。參見,例如,Maniatis等,分子克隆:實驗手冊,冷泉港實驗室,冷泉港,所有公開的內容以參考引用的方式結合至此。使用本發明的方法和材料,植物木質素生物合成相對于非轉化的對照植物可以增加、減少或其它方式地改良。可以是增加或其它方式地改良,例如,通過融合本發明的正義核酸或核酸片段的額外的拷貝。可以是減少,例如,通過融合本發明的反義核酸或核酸片段或通過融合能夠通過正義抑制改良植物中木質素生物合成的功能活性片段或變異體。另外,可以操作編碼木質素生物合成途徑中的不同酶基因拷貝的數量以修改每一個合成的單體的相對量,因此導致具有改變的成分的木質素的形成。因此,本發明這方面的優選實施方式提供了改良植物中木質素生物合成的方法,所述方法包括向所述植物中引入正義方向的有效量的根據本發明的核酸、基因構建體或載體,致使相關基因的表達被抑制。優選的用于正義抑制的功能活性片段和變異體包括這里之前所描述的那些。本發明的進一方面,提供了根據本發明的核酸、基因構建體或載體用于在植物中木質素生物合成的正義抑制的應用。本發明的進一方面,提供了根據本發明的核酸或核酸片段的應用,和/或它們的核苷酸序列信息,和/或它們的單核苷酸多態性,作為分子遺傳標記。更特別地,根據本發明的核酸或核酸片段,和/或它們的核苷酸序列信息,和/或它們的單核苷酸多態性,可以用作分子遺傳標記,用于數量性狀基因座(QTL)標記、定位、DNA印記和標記輔助選擇,以及可以用作候選基因或優選標記,特別是在黑麥草或羊茅中。甚至更特別地,根據本發明的核酸或核酸片段,和/或它們的核苷酸序列信息,可以在草料和草皮草改進中用作分子遺傳標記,如用于干物質消化率、草品質、機械壓力忍受性、疾病抗性、蟲害抗性、植物株高以及葉片和莖顏色的標記QTLs。本發明更進一方面,提供了從黑麥草(黑麥草屬)或羊茅(羊茅屬)種中實質上純化或分離的多肽,該多肽選自酶4CL、CCR和CAD組成的組。黑麥草(黑麥草屬)或羊茅(羊茅屬)種可以是任何合適類型,包括意大利或一年生黑麥草、多年生黑麥草、高羊茅、牛尾草和紫羊茅。優選地種類是黑麥草,更優選地是多年生黑麥草(L.perenne)。在本發明的這方面的優選實施方式中,實質上純化的或分離的酶4CL包括選自本發明的圖2、3和4中所示的序列(序列號分別為:2、4和6)組成的組的氨基酸序列,和它們的功能活性片段和變異體。在本發明的這方面的更進一步優選實施方式中,實質上純化的或分離的酶CCR包括選自本發明的圖10中所示的序列(序列號為:8)組成的組的氨基酸序列,和它的功能活性片段和變異體。在本發明的這方面的進一步優選實施方式中,實質上純化的或分離的酶CAD包括選自本發明圖13、14、26和27中所示的序列(序列號分別為10、12、15和17)組成的組氨基酸序列,和它們的功能活性片段和變異體。本內容中“功能活性”的意思是片段或變異體分別具有酶4CL、CCR和CAD的一種或多種生物學特性。可以考慮一個或多個氨基酸的增加、缺失、取代和衍生化,只要這些修改沒有導致片段或變異體的功能活性的喪失。優選地,片段或變異體與上述提及的序列的相應部分有至少大約60%的同源性;更優選地,有至少大約80%的同源性;最優選地,有至少大約90%的同源性。這樣的功能活性變異體和片段包括,例如,那些在相應氨基酸序列中有一個或多個殘基的保守氨基酸取代。優選地,片段大小至少是10個氨基酸,更優選地是至少15個氨基酸,最優選地至少20個氨基酸。本發明這方面的進一步優選實施方式中,提供了根據本發明的核酸或核酸片段重組產生的多肽。重組產生多肽的技術是本領域技術人員所熟知的。本發明的更進一方面,提供了從本發明的植物、植物種子或其它植物部位中實質上或部分純化的或分離的木質素或改良的木質素。這樣的木質素可以根據其長度、聚合度(單元數)、支化度和/或單元間的連接性質,從自然存在的木質素中改良。在更進一方面,本發明提供了分離的調控元件,該調控元件能夠引起外源基因在植物細胞中的表達。優選地,調控元件從編碼OMT、4CL、CCR或CAD的核酸或核酸片段中分離。調控元件可以是單鏈或雙鏈的核酸分子,包括DNA(如cDNA或基因組DNA)和RNA(如mRNA),任選地包括合成的、非自然的或改變的核苷酸堿基,以及它們的組合。優選地,調控元件包括啟動子;更優選地,O-甲基轉移酶啟動子;更加優選地,來自黑麥草(黑麥草屬)或羊茅(羊茅屬)種的O-甲基轉移酶啟動子;更優選地,是黑麥草的O-甲基轉移酶啟動子;最優選地,是多年生黑麥草(Loliumperenne)的O-甲基轉移酶啟動子。在本發明這方面的特別優選實施方式中,調控元件包括來自于咖啡酸O-甲基轉移酶基因的啟動子,所述咖啡酸O-甲基轉移酶基因與來自于多年生黑麥草的cDNA同源LpOMT1相應。優選地,調控元件包括核苷酸序列,該核苷酸序列包括本發明圖18所示序列(序列號:13)的最初的大約4630個核苷酸;或它的功能活性片段或變異體。本內容中“功能活性”的意思是片段或變異體(如相似物、衍生物或突變體)能夠引起轉基因在植物細胞中的表達。這樣的變異體包括自然存在的等位基因變異體和非自然存在的變異體。可以考慮一個或多個核苷酸的增加、缺失、取代和衍生化,只要該修改沒有導致調控元件功能活性的喪失。優選地,功能活性片段或變異體與上述序列的相關部分有至少大約80%的同源性;更優選地,至少大約90%的同源性;最優選地,至少大約95%的同源性。優選地,片段的大小為至少100個核苷酸,更優選地至少150個核苷酸,最優選地至少200個核苷酸。在本發明的這方面的特別的優選實施方式中,調控元件包括核苷酸序列,該核苷酸序列選自由本發明圖18(序列號13)序列組成的組:核苷酸-4581至-1核苷酸-4285至-1核苷酸-4020至-1核苷酸-2754至-1核苷酸-1810至-1核苷酸-831至-1核苷酸-560至-1核苷酸-525至-1核苷酸-274至-1核苷酸-21至-1;或它們的功能活性片段或變異體。在另一個優選實施方式中,調控元件包括4-香豆酸輔酶A連接酶啟動子;更加優選地,來自黑麥草(黑麥草屬)或羊茅(羊茅屬)種的4-香豆酸輔酶A連接酶啟動子;更優選地是黑麥草的4-香豆酸輔酶A連接酶啟動子,最優選地是多年生黑麥草(Loliumperenne)的4-香豆酸輔酶A連接酶啟動子。在本發明這方面的特別優選實施方式中,調控元件包括來自4-香豆酸輔酶A連接酶基因的啟動子,該4-香豆酸輔酶A連接酶基因與多年生黑麥草cDNA同源Lp4CL2相應。優選地,調控元件包括核苷酸序列,核苷酸序列包括本發明圖38中所示序列(序列號17)的最初的大約2206個核苷酸;或者它們的功能活性片段或變異體。本內容中“功能活性”的意思是片段或變異體(如相似物、衍生物或突變體)能夠引起轉基因在植物細胞中的表達。這樣的變異體包括自然存在的等位基因變異體和非自然存在的變異體。可以考慮一個或多個核苷酸的增加、缺失、取代和衍生化,只要該修改沒有導致調控元件的功能活性的喪失。優選地,功能活性片段或變異體與上述序列的相關部分有至少大約80%的同源性;更優選地,至少大約90%的同源性;最優選地,至少大約95%的同源性。優選地,片段的大小為至少100個核苷酸,更優選地至少150個核苷酸,最優選地至少200個核苷酸。在本發明的這方面的特別優選實施方式中,調控元件包括核酸序列,該核酸序列選自本發明圖38的序列(序列號17)組成的組:核苷酸-2206至-1核苷酸-1546至-1核苷酸-1186至-1核苷酸-406至-1核苷酸-166至-1;或者它們的功能活性片段或變異體。在另一個優選實施方式中,調控元件包括肉桂酰輔酶A還原酶啟動子;更加優選地,來自黑麥草(黑麥草屬)或羊茅(羊茅屬)種的肉桂酰輔酶A還原酶啟動子;更優選地是黑麥草的肉桂酰輔酶A還原酶啟動子,最優選地是多年生黑麥草(Loliumperenne)的肉桂酰輔酶A還原酶啟動子。在本發明這方面的特別優選實施方式中,調控元件包括來自肉桂酰輔酶A還原酶基因的啟動子,該肉桂酰輔酶A還原酶基因與多年生黑麥草的LpCCR1cDNA相應。優選地,調控元件包括核苷酸序列,該核苷酸序列包括本發明圖39所示序列(序列號:18)的最初的6735個核苷酸;或者它們的功能活性片段或變異體。本內容中的“功能活性”的意思是片段或變異體(如相似物、衍生物或突變體)能夠引起轉基因在植物細胞中的表達。這樣的變異體包括自然存在的等位基因變異體和非自然存在的變異體。可以考慮一個或多個核苷酸的增加、缺失、取代和衍生化,只要這種修改沒有導致調控元件的功能活性的喪失。優選地,功能活性片段或變異體與上述序列的相關部分有至少大約80%的同源性,更優選地至少大約90%的同源性,最優選地至少大約95%的同源性。優選地,片段大小為至少100個核苷酸,更優選地至少150個核苷酸,最優選地至少200個核苷酸。在本發明這發明的特別優選的實施方式中,調控元件包括核苷酸序列,該核苷酸序列選自本發明圖39的序列(序列號18)組成的組:核苷酸-6735至-1核苷酸-5955至-1核苷酸-5415至-1核苷酸-4455至-1核苷酸-4035至-1核苷酸-3195至-1核苷酸-2595至-1核苷酸-1755至-1核苷酸-1275至-1核苷酸-495至-1核苷酸-255至-1核苷酸-75至-1;或它們的功能活性片段或變異體。“外源基因”的意思是沒有與所述調控元件自然連接的基因。在本發明的一些實施方式中,外源基因也沒有自然存在于相關的植物或植物細胞中。外源基因可以是任何合適的類型。外源基因可以是核酸如DNA(如cDNA或基因組DNA)或RNA(如mRNA),和它們的組合。外源基因可以與靶基因相一致,例如能夠影響疾病抗性、草料消化率、營養物品質、礦物質含量或干旱忍受力的基因,或能夠改良所述靶基因表達的基因的片段或變異體(如相似物、衍生物或突變體)。這樣的變異體包括反義于所述靶基因的核酸序列或它們的相似物、衍生物、突變體或片段。轉基因可以編碼蛋白或RNA序列,取決于目標的環境以及是否需要上調或下調的基因表達。優選地,靶基因選自編碼編碼蛋白的mRNA的外源編碼序列,該蛋白可以是細菌起源(如細胞壁變異或細胞壁新陳代謝、細胞分裂素生物合成中所涉及的酶),或真核起源(如藥物學活性多肽)或植物起源(如酚化合物合成、細胞壁新陳代謝、糖新陳代謝、木質素生物合成中所涉及的酶)的。優選地,靶基因選自O-甲基轉移酶、4-香豆酸輔酶A連接酶、肉桂酰輔酶A還原酶、肉桂醇脫氫酶、肉桂酸-4-羥基化酶、酚酶、漆酶、過氧化物酶、松柏醇葡糖基轉移酶、松柏苷β-葡糖苷酶、苯丙氨酸氨解酶、阿魏酸-5-羥基化酶、幾丁質酶、葡糖聚酶、異戊烯轉移酶、木聚糖酶組成的組。植物細胞可以是任何合適的類型,本發明的調控元件在所述植物細胞中能夠引起外源基因的表達。植物細胞可以來自單子葉植物(如來自于黑麥草屬、羊茅屬、狗牙根屬、臂形草屬、雀稗屬、黍屬、芒屬、狼尾草屬、虉草屬的草、和其它的草料和草皮草、玉米、谷物、燕麥、甘蔗、小麥和大麥),雙子葉植物(如擬南芥屬、煙草、豆類、苜蓿屬、橡樹、桉屬、楓、楊屬、油菜、大豆和鷹嘴豆)和裸子植物(如松屬)。優選地,植物細胞來自于單子葉植物,更優選地是草的種類如黑麥草屬、羊茅屬、狗牙根屬、臂形草屬、雀稗屬、黍屬、芒屬、狼尾草屬、虉草屬、和其它的草料、草皮和生物能草,更優選地是黑麥草屬種如多年生黑麥草(Loliumperenne)或Loliumarundinaceum。根據本發明的調控元件可以用于表達外源基因,在轉基因植物的產生中,調控元件有效地與外源基因連接。因此,本發明的進一方面,提供了包含根據本發明的調控元件的載體。在本發明這方面的優選實施方式中,載體可以包括根據本發明的調控元件、如這里之前所述的外源基因、和終止子;所述調控元件、外源基因和終止子有效地連接,因此所述調控元件能夠引起所述外源基因在植物細胞中的表達。優選地,所述調控元件在所述外源基因的上游,所述終止子在所述外源基因的下游。載體可以是任何合適的類型,可以是病毒的或非病毒的。載體可以是表達載體。這樣的載體包括染色體、非染色體和合成的核酸序列,例如,植物病毒衍生物;細菌質粒;來自根癌農桿菌(Agrobacteriumtumefaciens)的Ti質粒的衍生物;來自毛根農桿菌(Agrobacteriumrhizogenes)的Ri質粒的衍生物;噬菌體DNA;酵母人工染色體;細菌人工染色體;雙元細菌人工染色體;來自質粒和噬菌體DNA的聯合體的載體。但是,可以使用其它載體,只要能夠在植物細胞中整合的復制或可存活。終止子可以是任何合適的類型,包括例如多聚腺苷化信號,如花椰菜花葉病毒35S多聚A(CaMV35S多聚A)和其它來自胭脂堿合酶(nos)和章魚堿合酶(ocs)基因的終止子。載體,除調控元件、外源核酸和終止子之外,可以包括更多核酸表達所必須的元件,以不同的方式組合,例如載體骨架、復制起點(ori)、多克隆位點、間隔序列、增強子、內含子(例如玉米泛素Ubi內含子)、抗生素抗性基因和其它選擇性標記基因(如新霉素磷酸轉移酶(npt2)基因、潮霉素磷酸轉移酶(hph)基因、草丁膦乙酰轉移酶(bar或pat)基因)、和報告基因(如β-葡糖苷酸酶(GUS)基因(gusA))。載體還可以包含用于翻譯起始的核糖體結合位點。載體還可以包括用于擴增表達的合適序列。本發明的調控元件還可以與其它全長啟動子或部分啟動子元件一起使用。作為提供用于篩選轉化的宿主細胞的表型的選擇性標記基因使用的選擇,在轉化細胞中存在的載體可以通過本領域公知的其它技術測定,例如PCR(聚合酶鏈式反應),Southern印跡雜交分析,組織化學GUS試驗,Northern和Western印跡雜交分析。本領域技術人員將意識到載體的多種成分是有效地連接,從而導致所述轉基因的表達。將本發明中的載體的成分有效地連接的技術是本領域技術人員熟知的。這樣的技術包括連接物如合成的連接物的使用,例如包括一個或多個限制性內切酶位點。本發明的載體可以融合至多種植物中,包括單子葉植物、雙子葉植物和裸子植物。在優選實施方式中,載體用于轉化單子葉植物,優選地草的種類為如黑麥草(黑麥草屬種)和羊茅(羊茅屬種),更優選地為多年生黑麥草(Loliumperenne),包括用于草料和草皮使用的栽培品種。用于將本發明的載體融入至植物細胞的技術(例如通過轉導、轉染或轉化)是本領域技術人員熟知的。這樣的技術包括農桿菌介導的導入,電轉化至組織、細胞和原生質體,原生質體融合,注射至繁殖器官,注射至未成熟的胚和高速彈射介導至細胞、組織、愈傷組織、未成熟的和成熟的胚。技術的選擇很大程度上依賴于要轉化的植物的類型。融合有本發明的載體的細胞可以使用本領域公知的技術如前面所述的篩選,然后在合適的培養基上培養以產生轉化的植物。培養環境,如溫度、pH值等等,對本領域技術人員是顯而易見的。得到的植物可以利用本領域公知的方法繁殖,有性繁殖或無性繁殖,以產生轉化植物的連續世代。本發明的進一方面,提供了包括,例如轉化有本發明的載體的植物細胞、植物、植物種子或其它植物部分。植物細胞、植物、植物種子或其它植物部分可以來自任何合適的種,包括單子葉植物、雙子葉植物和裸子植物。在優選實施方式中,植物細胞、植物、植物種子或其它植物部分來自單子葉植物,優選地來自禾本科的種,更優選地來自黑麥草(黑麥草屬種)或羊茅(羊茅屬種),更加優選地來自多年生黑麥草(Loliumperenne),包括用于草料和草皮使用的栽培品種。本發明還提供源自本發明的植物細胞的植物、植物種子、或其它植物部分。本發明還提供源自本發明的植株的植物、植物種子、或其它植物部分。本發明的更近一方面提供了包括根據本發明的調控元件的重組植物基因組。在本發明這方面的優選實施方式中,重組植物基因組進一步包括有效地連接于所述調控元件的外源基因。本發明的進一方面,提供了用于在植物細胞中表達外源基因的方法,所述方法包括將有效量的根據本發明的調控元件和/或載體導入所述植物細胞中。“有效量”的意思是在所述植物細胞、或植物、植物種子或來自它們的其它植物部分中足夠引起可識別的表型變化的量。本領域的技術人員在考慮植物細胞的類型、處理順序和其它相關因素后,可以很容易地測定這樣的量。這樣的技術人員可以很容易地測定合適的量和處理方法。參見,例如,Maniatis等,分子克隆:實驗手冊,冷泉港實驗室,冷泉港,所有公開的內容以參考引用的方式結合至此。附圖說明參照隨附的實施例和附圖可以更充分地描述本發明。但,應當理解,以下的描述僅是說明性的,不能以任何方式理解為對本發明以上描述的一般性的限制。圖中圖1表示編碼多年生黑麥草4CL同源的三個cDNAs的質粒圖譜。圖2表示Lp4CL1的核苷酸序列(序列號:1)和氨基酸序列(序列號:2)。圖3表示Lp4CL2的核苷酸序列(序列號:3)和氨基酸序列(序列號:4)。圖4表示Lp4CL3的核苷酸序列(序列號:5)和氨基酸序列(序列號:6)。圖5表示由Lp4CL1(序列號:2)、Lp4CL2(序列號:4)和Lp4CL3(序列號:6)編碼的推定的蛋白質的氨基酸序列比對。圖6表示使用Lp4CL1、Lp4CL2和Lp4CL3為雜交探針對發育的多年生黑麥草的northern雜交分析。SR:苗的根(發芽后3-5天);SS:苗的芽(發芽后3-5天);ML:12周植株的葉片;MS:12周植株的莖。斑點在65℃下用0.2×SSPE,0.1%SDS清洗。在這樣的嚴格條件下,Lp4CL1、Lp4CL2和Lp4CL3沒有交互雜交。大小以kb給出。圖7表示說明在創傷的多年生黑麥草葉片中4CLmRNA的表達的時間進程的northern雜交分析。圖8表示使用Lp4CL1、Lp4CL2和Lp4CL3作探針的基因組Southern雜交分析。10μg的消化的多年生黑麥草基因組DNA或20μg消化的高羊茅基因組DNA在1.0%的瓊脂糖凝膠中分開,轉移至HybondN+膜上,然后用32P標記的Lp4CL1、Lp4CL2和Lp4CL3探針雜交。黑麥草Lp4CL1、Lp4CL2和Lp4CL3基因表現出在高羊茅中的同源序列,說明黑麥草4CL基因能夠用于分離和操控高羊茅(Festucaarundinacea)4CL基因的表達。圖9表示LpCCR1的限制性酶切圖譜。在Ubi-ZApTM(Stratagene)中構建的多年生黑麥草(L.perenne)苗的cDNA文庫在42℃下在溶液中篩選,所述溶液包括10×PIPES、50%的去離子甲酰胺和10%的SDS。在室溫下,在0.1%SDS、2×SSPE中三次,然后在0.1%SDS、0.2×SSPE中兩次清洗篩選物。用于northern和Southern雜交分析的探針的定位通過黑線標記的LpCCR531表示。圖10表示LpCCR1的核苷酸序列(序列號:7)和氨基酸序列(序列號:8)。圖11表示以LpCCR1為雜交探針的雙單倍體(DH)多年生黑麥草的DNA的Southern雜交分析。用Dral、BamHI、EcoRI、EcoRV、HindIII或XbaI消化10μg的DH基因組DNA,在1%瓊脂糖凝膠分離,然后用毛細管點在尼龍膜上(AmershamHybond-N)。在雜交液中,用25ng/ml的地高辛標記的LpCCR531片段探測膜。42℃下,在4×SSC、50%甲酰胺、0.1%N-月桂酰-肌氨酸、0.02%SDS、2%封閉液中完成雜交。室溫下在2×SSC、0.1%SDS中清洗膜兩次5分鐘,然后68℃下在0.5×SSC、0.1%SDS中清洗膜兩次15分鐘。通過與地高辛標記的marker對比測量分子量(羅氏分子生物化學)。圖12表示以LpCCR1為探針對來自多年生黑麥草的不同器官和發育期的RNA樣品的northern雜交分析。苗的根(發芽后3-5天)、苗的芽(發芽后3-5天)、苗的根(發芽后7-10天)、苗的葉片(發芽后7-10天)、6和10周植株的根、6和10周植株的葉片、6和10周植株的莖、11天的虉草屬和7天的羊茅屬的全苗。使用Trizol(GibcoBRL)分離總RNA,在含有6%甲酰胺的1.2%瓊脂糖凝膠中分開15μg的總RNA,然后用毛細管點在尼龍膜上(AmershamHybond-N)。使用0.2%亞甲基藍/0.3M醋酸鈉將膜染色,使marker顯色,并確保RNA均勻沉淀。使用32P-dCTP(AmershamMegaprime)隨機標記50ng的LpCCR531;雜交條件是4×SSC、50%甲酰胺、0.5%SDS、5×denhardt溶液、5%硫酸葡聚糖、0.1%鯡魚精DNA,42℃過夜。黑麥草LpCCR1基因顯示了在高羊茅和虉草屬中的同源轉錄本,因此表明黑麥草CCR基因能夠用于操控高羊茅(Festucaarundinacea)和虉草屬CCR同源基因的表達。圖13表示LpCAD1的核苷酸序列(序列號:9)和氨基酸序列(序列號:10)。圖14表示LpCAD2的核苷酸序列(序列號:11)和氨基酸序列(序列號:12)。圖15表示編碼多年生黑麥草CAD的同源LpCAD1的cDNA克隆的質粒圖譜。圖16表示使用A)LpCAD1和B)LpCAD2作為雜交探針的多年生黑麥草的不同器官和發育期的RNA樣品的northern雜交分析。發芽后3-5天的苗的根、發芽后7-10天的苗的根、6周和10周苗的根、發芽后3-5天和7-10天的苗的芽、6周和10周植株的葉片、6周和10周植株的莖組織。從虉草屬和羊茅屬的11天和7天的苗中分離RNA。黑麥草CAD基因顯示了在高羊茅和虉草屬中的同源轉錄本,因此表明黑麥草CAD基因能夠用于操控高羊茅和虉草屬CAD同源基因的表達。圖17表示基因組Southern雜交分析。將10μg用一系列限制性內切酶消化的多年生黑麥草基因組DNA在0.8%瓊脂糖凝膠中分開,轉移至HybondN,然后用地高辛標記的A)LpCAD1和B)LpCAD2雜交探針雜交。圖18表示LpOmt1啟動子的核苷酸序列(序列號:13)。圖19表示攜帶在多年生黑麥草LpOmt1啟動子控制下的報告基因β-葡糖苷酸酶(GUS)基因(gusA)的植物轉化載體的質粒圖譜。圖20(上面的圖)表示包含在多年生黑麥草LpOMT1啟動子控制下的gusA基因的轉基因煙草植株的PCR分析(上圖)。用gusA特異性引物完成PCR反應。圖20(下面的圖)表示組織化學GUS試驗,表明木質部特異性的gusA表達(A和B)和在轉基因煙草植株的葉片腺體毛狀體(C和D)中gusA表達,轉基因煙草植株包含多年生黑麥草LpOMT1啟動子控制的gusA基因。圖21表示LpCCR1基因組克隆1的分離。A)用XbaI、Ncol、SalI、XhoI、XhoI/SalI消化的CCR基因組克隆λLp6.1.1a的Southern雜交分析,DNA在0.8%的瓊脂糖凝膠中分開,轉移至HybondN,用地高辛標記的CCR1探針雜交。B)表示基于序列結果的LpCCR1克隆1的基因組基因結構圖譜。C)在不同植物種(多年生黑麥草(Loliumperenne),Lp.;桉屬加檸桉(Eucalyptusgunni),Eg.;柳桉(Eucalyptussaligna),Es.;大葉鉆天楊(Populusbalsamifera),Pb.)中的植物CCR外顯子的大小和數量的比較。圖22表示LpCCR1基因組克隆2的分離。A)用XbaI、Ncol、SalI、XhoI、XhoI/SalI消化的CCR基因組克隆λLp6.1.1a的Southern雜交分析,DNA在0.8%的瓊脂糖凝膠中分開,轉移至HybondN,用200bp的CCR1啟動子(圖21B)雜交。B)表示基于序列結果的LpCCR1克隆2的啟動子區的圖譜。圖23表示Lp4CL基因組克隆的分離。A)用BamHI、KpnI或SalI消化的4CL基因組克隆λLp4CL2的Southern雜交分析,DNA在0.8%的瓊脂糖凝膠中分開,轉移至HybondN,用地高辛標記的4CL1雜交探針雜交。B)使用C)中標出的指定位置的正向和反向寡聚核苷酸的10μl標準PCR反應。PCR產物在0.8%瓊脂糖凝膠中分開,并用溴化乙錠染色。C)表示基于序列和PCR結果的λLp4CL2的基因組基因結構的圖譜。圖24表示Lp4CL基因組克隆的分離。A)用BamHI、KpnI、SalI消化的4CL基因組克隆λLp4CL2的Southern雜交分析。DNA在0.8%的瓊脂糖凝膠中分開,轉移至HybondN,用地高辛標記的4CL1探針雜交。B)表示Lp4CL2克隆1的基因組基因結構和克隆2的啟動子區的圖譜。圖25表示攜帶有在多年生黑麥草Lp4CL2啟動子控制下的gusA基因的植物轉化載體質粒圖譜(Lp4CL2::gusA)。圖26表示基因組克隆CAD2cvBarlano的核苷酸序列(序列號:14)和氨基酸序列(序列號:15)(內含子1和編碼區最前邊的111bp缺失)。圖27表示從基因組克隆CAD2cvBarlano推測的核苷酸序列(序列號:16)和氨基酸序列(序列號:15)(黑體區域在基因組克隆中缺失)。圖28表示LpCAD2基因組克隆的分離。A)用BamHI、EcoRI、KpnI、SaiI或XbaI消化的CAD基因組克隆λLpCAD2的Southern雜交分析。DNA在0.8%瓊脂糖凝膠中分開,轉移至HybondN,用地高辛標記的CAD2雜交探針雜交。B)表示基于序列結果的λLpCAD2的基因組基因結構的圖譜。圖29表示A)CaMV35S啟動子控制下的正義和反義的Lp4CL1、Lp4CL2和Lp4CL3轉化載體;B)玉米泛素啟動子控制下的正義和反義的Lp4CL1、Lp4CL2和Lp4CL3轉化載體。圖30表示A)CaMV35S啟動子控制下的正義和反義的LpCCR1轉化載體;B)玉米泛素啟動子控制下的正義和反義的LpCCR1轉化載體。圖31表示A)CaMV35S啟動子控制下的正義和反義的LpCAD1轉化載體;B)玉米泛素啟動子控制下的正義和反義的LpCAD1轉化載體。圖32表示Lp4CL1-轉基因煙草的分子分析。A)攜帶融合正向Lp4CL1基因的轉化載體質粒圖譜。B)使用Lp4CL1特異引物的獨立轉基因煙草克隆的PCR分析。C)使用Lp4CL1特異探針的獨立轉基因煙草的Southern雜交分析。D)使用Lp4CL1特異探針的獨立轉基因煙草的Northern雜交分析。圖33表示LpCCR1-轉基因煙草的分子分析。A)攜帶融合正義和反義LpCCR1基因的轉化載體的質粒圖譜。B)使用LpCCR1特異引物的獨立正義轉基因煙草克隆的PCR分析。圖34表示用于轉基因多年生黑麥草植株的不依賴懸浮液培養液的產物的方案。A)分離合子胚,種植在MSM5培養基上,第0天;B)胚性愈傷組織的形成和發芽繁殖,胚分離后的6-8周;C)在基因槍轉化之前將胚性愈傷組織排布在高滲透的MSM3Plus培養基上;D)組織化學GUS試驗表明GUS的表達聚集在轟擊了融合的gusA基因后的3-4天;E)在包含100mg/l巴龍霉素(Pm)的MSM3培養基上篩選胚性愈傷組織,微粒轟擊后2周;F)Pm抗性芽在包含100mg/lPm的MSK培養基上再生,微粒轟擊后4周;G)來自PM抗性胚性愈傷組織的體外植株再生,微粒轟擊后6周;H)胚分離后28周的轉基因多年生黑麥草植株。圖35表示攜帶正義和反義LpOmt1轉基因的轉基因多年生黑麥草植株的分子分析。用于多年生黑麥草胚性愈傷組織共轉化的載體的質粒圖譜;pHP23攜帶融合的新霉素磷酸轉移酶(npt2)選擇性標記基因;pUbiomt1攜帶驅動正義LpOmt1基因的玉米泛素啟動子;pUbitmo1攜帶驅動反義LpOmt1基因的玉米泛素啟動子(上面)。使用npt2特異性引物的來自用正義和反義LpOmt1載體基因槍轉化的5株獨立轉基因多年生黑麥草植株的PCR分析(上面中間)。使用omt1雜交探針的用正義(1-3甬道)和反義(4-7甬道)LpOmt1載體共轉化的7株獨立的多年生黑麥草植株的Southern雜交分析。使用npt2雜交探針的獨立的多年生黑麥草植株的Southern雜交分析(下面中間右邊)。用反義LpOmt1載體共轉化的多年生黑麥草植株的Northern雜交分析(底部)。C=未轉化的多年生黑麥草的陰性對照;P=陽性質粒對照。圖36表示LpOmt1-轉基因多年生黑麥草的生物化學分析。測量來自篩選的獨立LpOmt1-轉基因多年生黑麥草植株(Ell8、Ell11、Ell14和Ell15)的葉片樣品的OMT活性,并且與未轉化的多年生黑麥草陰性對照植株L.perennecv.Ellett(野生型)對比。顯示出重復檢測的平均值和標準偏差。圖37表示轉基因黑麥草植株的PCR篩選。使用npt2特異性引物的來自轉化有反義LpUbi4CL2載體的基因槍轉化的8株獨立的轉基因多年生黑麥草植株的PCR分析。圖38表示多年生黑麥草的基因組克隆4CL2的核苷酸序列(序列號:17)。圖39表示多年生黑麥草的基因組克隆CCR1的核苷酸序列(序列號:18)圖40表示Lp4CL1、Lp4CL3、LpCAD1、LpCAD2、LpCCR1、LpOMT1和LpOMT2(黑體)在多年生黑麥草遺傳連鎖圖中的圖譜定位。圖41.用于形成表達多年生黑麥草木質素生物合成基因的結構的Gateway來源的表達載體的說明。圖42.用于LpC4D3cDNA的GatewayTMEntry克隆的載體詳細說明。圖43.用于啟動子LpCAD2的GatewayTMEntry克隆的載體詳細說明。圖44.用于終止子LpCAD2的GatewayTMEntry克隆的載體詳細說明。圖45.結構1的質粒圖譜,LpCAD2p::LpCAD3::LpCAD2t在載體pAUX3132中。圖46.結構2的質粒圖譜,LpCCR1::LpCCR1::LpCCR1在載體pAUX3169中。圖47.LpCCR1基因的序列(序列號19)和給予LpCCR1基因單一堿基缺失的修飾的正向引物(序列號20)。圖48.結構3的質粒圖譜,LpCCR1::LpCCR1(fs)::LpCCR1在載體pAUX3169中。圖49.對含有表達結構Act1D::hph::35S的用作植物選擇性標記的pAcH1結構的載體詳細說明。圖50.來自未成熟花序的胚性愈傷組織的微粒轟擊的轉基因多年生黑麥草的制備。A)多年生黑麥草的離體未成熟花序,2-3mm;B-E)胚性愈傷組織的誘導和繁殖,花序切除后1-8周;F)在基因槍轉化前,將胚性愈傷組織分布在高滲透性培養基LP3-OS培養基上;G)基因槍轉化裝置,PDS-1000/He;H-I)潮霉素抗性芽的生長和發育,轟擊后30-75天;J)體外潮霉素抗性芽的生長和發育;K)潮霉素抗性植株種植在土壤中并且密封溫室條件下生長。圖51.來自苗分裂組織的胚性愈傷組織的微粒轟擊的轉基因多年生黑麥草的制備。A)用于基部分生組織(basalmeristem)分離的體外芽培養物,再生于苗分生組織來源的愈傷組織;B)將基部分生組織材料分布在愈傷組織誘導培養基(initiationmedium)上;C-E)多年生黑麥草的芽分生組織的胚性愈傷組織的誘導和繁殖;F)在基因槍轉化前將胚性愈傷組織分布在高滲透性培養基上;G)基因槍轉化裝置,PDS-1000/He;H-I)潮霉素抗性芽的生長和發育,轟擊后30-84天;J)體外潮霉素抗性芽的生長和發育;K)潮霉素抗性植株種植在土壤中并且密封溫室條件下生長。圖52.描述用于產生包含關注的表達結構和選擇性標記基因(hph)的轉基因多年生黑麥草的轉化方法的流程圖。圖53.在用質粒pAcH1和pAUX3132-LpCAD2::LpCAD3::LpCAD2共轟擊后再生的假定的轉基因多年生黑麥草中提取的基因組DNA的樣品中通過Q-PCR的潮霉素磷酸轉移酶(hph)基因的擴增。圖54.用EcoR1(R1)消化和用瓊脂糖凝膠電泳分離的基因組DNA的Southern分析,用hph或Ubi啟動子探針檢測轉基因。所有的六株假定的轉基因植株確定包含hph和關注的基因,hpLpCCR1。圖55.來自野生型和轉基因pUbi::hpCCR1::35S黑麥草的R1和R2期的橫截面節間部分的Maule染色說明在轉基因植株中微紅色的強烈減少可能暗示相比與野生型植株的S木質素含量的減少。圖56.R1發育期的多年生黑麥草節間部分的總木質素含量說明從節間部分1(底部)到節間部分5(頂部)的木質素含量的逐漸減少。圖57.從野生型多年生黑麥草種提取的木質素的thioacidlysis衍生化后說明G-木質素和S-木質素單體的分離和確定的氣相色譜(GC-MS)的例子。具體實施方式實施例1多年生黑麥草(Loliumperenne)的3個4-香豆酸輔酶A連接酶(4CL)cDNAs的分離和表征材料和方法植物材料多年生黑麥草(LoliumperenneL.)cvEllet和高羊茅(FestucaarundinaceaSchreb.)cvTriumph的植株和胚細胞懸浮液的建立和保存如之前所述(Heath等,1998)。創傷實驗使用10日齡的多年生黑麥草(cvEllet)如前所述(Heath等,1998)完成。cDNA文庫的篩選從多年生黑麥草苗分離出的RNA制備的cDNA文庫(Heath等,1998)用[32P]dCTP-標記的水稻部分4CL探針篩選。水稻4CL探針和844bp組成的4CL特異性序列插入PUC119中。這個插入序列與水稻4CL的cDNA序列(Genbank,L43362,堿基453-1300)有93%的序列同源性。使用ExAssist輔助性噬菌體在SOLR株系(Stratagene)中,如制造商所述的將cDNA插入序列切除和再環化(recircularized)。DNA測序cDNA克隆用8個限制性內切酶(BamHI、EcoRI、KpnI、NotI、PstI、SalI、XbaI、XhoI)消化,選擇的克隆使用M13正向和反向引物利用雙脫氧鏈終止法對雙鏈均測序。為Lp4CL1、Lp4CL2和Lp4CL3的內部區域的測序,合成的寡聚核苷酸引物從提前測定的DNA序列中設計。測序使用ABI染料終止子試劑盒和自動測序儀完成。核苷酸序列用SeqEd程序(ABI)比對,使用HIBIODNASISvs2程序(日立軟件公司)完成進一步分析。基因組DNA印跡分析根據Lichtenstein和Draper(1985),從多年生黑麥草和高羊茅的單一基因型來源的細胞懸浮液中分離基因組DNA。將10μg的多年生黑麥草DNA和20μg的高羊茅DNA用限制性內切酶HindIII和XbaI分別消化,在1%瓊脂糖凝膠中分開,并根據制造商(Amersham)的說明轉移至HybondN+膜上。由Lp4CL1(1771bp)、Lp4CL2(2034bp)或Lp4CL3(2080bp)的BamHI/KpnI片段組成的探針使用Megaprime標記試劑盒(Amersham)和[32P]dCTP標記。65℃下,在5×SSPE、5×Denhardt’s溶液、0.5%(w/v)SDS和200μg/mL變性鯡魚精DNA中完成雜交。25℃下在2×SSPE、0.1%SDS中將膜清洗10分鐘,三次;然后在65℃下在0.1×SSPE、0.1%SDS中清洗20分鐘,兩次。RNA印跡分析將總RNA(10μg)在1.2%甲醛凝膠中分開,并根據制造商的說明轉移至HybondN(Amersham)膜上。膜用0.2%亞甲基藍染色以確定RNA準確的附著和轉移。42℃下,在5×SSPE、5×Denhardt’s溶液、0.5%SDS、50%去離子甲酰胺、200μg/mL變性鯡魚精DNA中完成雜交。探針的制備和膜的清洗如同DNA印跡分析,除了高羊茅Northern印跡,其最后兩次清洗在42℃下、0.1×SSPE、0.1%SDS中10分鐘完成。結果多年生黑麥草4CL的cDNAs的分離和序列分析從多年生黑麥草苗提取的RNA中制備的cDNA文庫用水稻4CL雜交探針篩選,從2×105pfu中分離出10個cDNAs。cDNAs用8個限制性內切酶的限制性分析表征。所有的克隆都是全長(大約2.0-2.2kb),具有多聚(A)尾,并且能夠被分成3組:Lp4CL1(4個克隆)、Lp4CL2(5個克隆)和Lp4CL3(1個克隆)。(圖1)顯示Lp4CL1、Lp4CL2和Lp4CL3的質粒圖譜。Lp4CL1、Lp4CL2和Lp4CL3全長測序(分別為圖2、3和4)。Lp4CL1有2284bp長,具有1710bp的開放閱讀框(ORF),322bp的5’非編碼區和包含多聚(A)尾的252bp的3’非編碼區。Lp4CL2有1992bp長,具有1668bp的ORF,61bp的5’非編碼區和包含多聚(A)尾的263bp的3’非編碼區。Lp4CL3有2038bp長,具有1671bp的ORF,112bp的5’非編碼區和包含多聚(A)尾的255bp的3’非編碼區。在編碼區中,Lp4CL1與Lp4CL2和Lp4CL3均具有70%的核酸序列同源性,而Lp4CL2與Lp4CL3具有79%的序列同源性。克隆之間,3’非編碼區具有很少的序列同源性(52-55%)。氨基酸序列比較由三個cDNAs編碼的推定的蛋白中,Lp4CL1由570個氨基酸組成(60290u(Da))、Lp4CL2由556個氨基酸組成(59238u)以及Lp4CL3由557個氨基酸組成(59735u)。(圖5)顯示了Lp4CL1、Lp4CL2和Lp4CL3的推斷的氨基酸序列。Lp4CL2和Lp4CL3具有79%氨基酸序列同源性,Lp4CL1和Lp4CL2具有61%氨基酸序列同源性,而Lp4CL1和Lp4CL3僅有58%氨基酸序列同源性。高序列同源性的區域在酶的中間和c-末端區域更普遍。例如Lp4CL2和Lp4CL3的每個酶的氨基酸208-568之間的序列同源性是85%,Lp4CL1和Lp4CL2是72%,Lp4CL1和Lp4CL3是67%。Lp4CL1、Lp4CL2和Lp4CL3與其它植物4CLs共有幾個共同區域。特別地,它們包含假定的AMP-結合域和保守的GEICIRG基序,除了Lp4CL3,其第二個異亮氨酸被纈氨酸取代(圖5)。已經提出區域II與4CL的催化活性相關聯。同樣,在植物4CLs中保守的4個Cys殘基在Lp4CL1、Lp4CL2和Lp4CL3中保守存在(圖5)。三個結果暗示多年生黑麥草(L.perenne)cDNAs編碼很可能起源于三個不同4CL基因的三個不同的4CL酶。多年生黑麥草4CL基因的表達Lp4CL1、Lp4CL2和Lp4CL3在含有兩個發育期的多年生黑麥草的不同器官中制備的RNA的Northern印跡中被用作雜交探針。所有的三個探針與大約2.2-2.3kb的單一的mRNA種類雜交。Lp4CL1、Lp4CL2和Lp4CL3在發育的苗期和成熟期均表達,在所有檢測的器官中都表達。對于Lp4CL2和Lp4CL3,最強的信號出現在苗期的根和成熟期的莖的RNA樣品中(圖6)。Lp4CL1、Lp4CL2和Lp4CL3也在含有從高羊茅中制備的RNA的Northern印跡中被用作雜交探針。所有的三個探針與多年生黑麥草中相似的mRNA種類(2.3kb)雜交(圖6)。最強的信號出現在成熟期的莖的RNA樣品中,在根和苗期的芽的RNA中的信號較弱。在葉片中沒有發現Lp4CL1、Lp4CL2或Lp4CL3的表達。三個探針在高羊茅中與相關同源序列的雜交能力不同,Lp4CL3導致最強的信號,Lp4CL1僅僅很微弱地雜交。為檢測4CL是否能夠在脅迫條件下被誘導,對多年生黑麥草的苗的葉片進行創傷。在創傷中沒有觀察到Lp4CL1、Lp4CL2或Lp4CL3在轉錄水平有增加(圖7)。多年生黑麥草4CL基因的基因組結構多年生黑麥草DNA用兩種限制性內切酶HindIII或XbaI消化。這些酶的酶切位點在Lp4CL1、Lp4CL2或Lp4CL3的cDNA序列中不存在。當Lp4CL1、Lp4CL2或Lp4CL3用作探針,暴露出幾個變化強度的DNA雜交片段(圖8)。每一個探針與獨特組的片段雜交,暗示Lp4CL1、Lp4CL2和Lp4CL3代表三種不同基因。此外,Lp4CL1和Lp4CL2與每次消化的2-3個主要片段雜交,可能表明同樣基因的等位基因,或說明在每一個種類中存在多于一個基因。在高嚴格條件下的高羊茅的基因組Southern印跡中,Lp4CL1、Lp4CL2和Lp4CL3還揭示了幾個不同大小的雜交DNA片段(圖8),暗示在高羊茅(F.arundinacea)中存在三個相似的4CL基因。實施例2多年生黑麥草(Loliumperenne)的肉桂酰輔酶A還原酶(CCR)cDNA的分離和表征使用玉米CCR探針對總計500,000噬菌體進行篩選,噬菌體來自由10日齡的黃化的多年生黑麥草(L.perenne)苗構建的cDNA文庫。在初步篩選中發現93個陽性噬菌斑,5個隨后用限制性酶切消化進行分析。5個中的4個是一樣的。4個一樣的cDNAs中的一個,LpCCR1,被選出用于進一步分析(圖9)。多年生黑麥草CCRcDNA的核酸序列分析獲得了LpCCR1的全長核苷酸序列,并預測了氨基酸序列(圖10)。LpCCR1的cDNA為1395bp,具有149bp的5’非編碼區和160bp的3’非編碼區。1086bp的開放閱讀框編碼具有362個氨基酸的蛋白。發現編碼區的成分是富含68%的G+C。同樣檢測了密碼子的使用,發現偏向于XXC/G密碼子(94%),而XCG和XUA密碼子經計算分別僅為9%和0.55%。G+C的富集及三聯密碼子第三個位置偏向于G和C是之前已經報道過的單子葉植物基因的特征。多年生黑麥草CCR基因的基因組結構在黑麥草基因組中存在的CCR基因的數量通過來自雙單倍體植物的基因組DNA的Southern印跡分析測量,LpCCR1cDNA的片段(LpCCR531,圖9)用作探針。雙單倍體DNA減少了等位基因變異的復雜性。使用不在cDNA內部酶切的酶對基因組DNA進行酶切:DraI、BamHI、EcoRI、EcoRV、HindIII和XbaI,膜在中度嚴格條件下雜交和清洗。每條甬道都顯現單一的強烈雜交帶(圖11)說明在多年生黑麥草基因組中存在單一拷貝的LpCCR1基因。多年生黑麥草CCR基因的表達為研究CCR基因在黑麥草中的表達譜,使用總RNA完成Northern雜交分析,其中總RNA從苗生長期的根和芽(0.5-1cm和4-6cm芽)以及成熟生長期的根、莖和葉片(6和10周)中提取。苗在25℃黑暗中種植在濾紙上,然后轉移至土壤和溫室條件(25℃)直至6-10周時期。來自羊茅屬和虉草屬的全部苗的總RNA包括在northern分析中。使用LpCCR531(圖9)的雜交在中度嚴格條件下完成,然后在高度嚴格條件下對膜進行清洗。在所有的組織中都發現大約1.5kb的轉錄本,表達水平隨成熟度而變化,從一種組織類型到另一種組織類型也不同(圖12)。LpCCR1轉錄本表現出在根和莖中比芽和葉片中更多。在莖中,轉錄本量從6周到10周增加,說明當植株成熟時,莖中的轉錄上調。發現表達在形成次級細胞壁的組織如莖和根中占優勢,說明LpCCR1基本包括在木質化中。實施例3多年生黑麥草(Loliumperenne)的肉桂醇脫氫酶(CAD)cDNAs的分離和表征從cDNA中擴增558bp的肉桂酰脫氫酶(CAD)片段,該cDNA從多年生黑麥草苗中制備的總RNA中合成。輻射松、紫花苜蓿、食用土當歸(Araliacordata)、葡萄桉和擬南芥的CADs間的保守氨基酸區域被用于設計擴增多年生黑麥草CAD的寡聚核苷酸。正向寡聚核苷酸設計在保守氨基酸區域CAGVTVYS,反向寡聚核苷酸設計在保守區域DVRYRFV。克隆出551bp的PCR片段并測序以確定其相應于多年生黑麥草CAD的PCR片段。用特異于多年生黑麥草CAD的551bp的PCR片段篩選從多年生黑麥草苗中提取的RNA制備的eDNA文庫。分離出8個cDNA,并通過限制性酶切分析被分成6組。從兩組中的每一組挑選出一個代表性克隆(LpCAD1、LpCAD2)用于進一步表征。多年生黑麥草CADcDNAs的核酸序列分析測定多年生黑麥草CAD同源基因LpCAD1的全部序列(圖13)。1325bp克隆具有多聚(A)尾、典型的起始和終止密碼子和編碼408個氨基酸的預測蛋白的該克隆的開放閱讀框(ORF)。同樣測定了多年生黑麥草CAD同源基因LpCAD2的全部核苷酸序列(圖14)。多年生黑麥草CAD基因的表達用從不同發育期的多年生黑麥草分離的RNA樣品與全長的LpCAD1的1325bpcDNA(圖15)雜交完成northern雜交分析,以測定器官和發育表達的模式。探針與大約1.6kb的單一mRNA種類雜交。LpCAD1轉錄本在所有檢測組織中表達:根、芽、莖和葉片(圖16A)。LpCAD1轉錄本在根組織和成熟莖中最富集,這個表達模式在包含在植物細胞壁木質化中的基因中很典型。揭示了羊茅屬和虉草屬的屬間同源性。使用LpCAD2完成相似的northern雜交分析(圖16B),但是發現轉錄本在成熟莖組織和芽中最富集。多年生黑麥草CAD基因的基因組結構使用從多年生黑麥草雙單倍體植株中分離的并用DraI、BamHI、EcoRI、EcoRV、HindIII和XbaI消化的DNA樣品與500bpLpCAD1探針雜交完成Southern雜交分析。在高嚴格條件下的雜交模式揭示了對于完全消化物的兩條顯著條帶的存在,說明LpCAD1屬于小基因家族并且在多年生黑麥草中存在多拷貝基因(圖17A)。使用LpCAD2完成相似的Southern雜交分析(圖17B),在高嚴格條件下的雜交模式揭示了對于完全消化物的一條或兩條顯著條帶的存在,說明LpCAD2以單一拷貝基因或小基因家族的成員存在于多年生黑麥草中(圖17B)。實施例4多年生黑麥草(Loliumperenne)的O-甲基轉移酶(OMT)、肉桂酰輔酶A還原酶(CCR)、4-香豆酸輔酶A連接酶(4CL)和肉桂醇脫氫酶(CAD)的基因組克隆和啟動子的分離和表征使用相應的cDNAs作為雜交探針,從多年生黑麥草基因組文庫中分離O-甲基轉移酶(OMT)、肉桂酰輔酶A還原酶(CCR)、4-香豆酸輔酶A連接酶(4CL)和肉桂醇脫氫酶(CAD)的基因組克隆和啟動子。多年生黑麥草O-甲基轉移酶(OMT)的基因組競隆和啟動子的分離和表征用cDNA克隆,LpOmt1(Heath等,1998),編碼O-甲基轉移酶(OMT),篩選多年生黑麥草基因組文庫。發現5’非翻譯區和編碼區序列與以前分離的LpOmt1cDNA一致。全部4.8kb的基因組克隆完全測序(圖18)。為進一步表征啟動子,形成啟動子序列至β-葡糖苷酸酶(GUS)編碼序列(gusA)的轉錄融合(圖19)。向煙草原生質體的直接基因轉移實驗使用相應的融合基因完成以使它們在異源系統中轉基因地表達,以進行通過組織化學GUS試驗的原位表達模式分析。產生一組攜帶在LpOmt1啟動子的5’調控區控制下的融合gusA基因的轉基因煙草植株以評估LpOmt1啟動子的木質部特異性的潛在用途,和定目標于下調編碼關鍵木質素生物合成的酶的基因。使用LpOmt1啟動子驅動融合gusA轉化載體而產生的轉基因煙草植株通過PCR和組織化學GUS試驗篩選。采取使用gusA特異引物的PCR篩選用于轉基因煙草植株的初始鑒定(圖20)。通過組織化學GUS試驗對PCR陽性煙草植株進行篩選以進行原位表達模式分析(圖20)。多年生黑麥草肉桂酰輔酶A還原酶(CCR)的基因組克隆和啟動子的分離和表征從多年生黑麥草中分離出CCR基因組克隆,包括6.5kb啟動子和全部的基因結構(內含子/外顯子分界)。CCR啟動子可用于外源基因在轉基因植株中的靶向表達。用編碼木質素生物合成酶,肉桂酰輔酶A還原酶(CCR)的cDNA克隆LpCCR1對多年生黑麥草基因組文庫進行篩選。根據限制性酶切消化分析,鑒定出4個不同的基因組克隆。克隆6.1.1a被挑選出用于進一步分析。將來自克隆6.1.1a的6.42kb的XhoI片段亞克隆至pBluescriptSK(圖21A),該片段與LpCCR1cDNA探針強烈雜交。序列分析揭示6.42kb的XhoI片段包括整個的LpCCR1基因和200bp啟動子區。內含子/外顯子分界在圖21B中圖解說明,外顯子的定位和大小顯示出在不同種類的其它CCR中的保守性(圖21C)。為分離LpCCR1的啟動子區,包含消化的噬菌體基因組DNA的Southern印跡用200bp啟動子區再探測,其中噬菌體基因組DNA從克隆λLp6.1.1a中分離。探針與6.5kb的SalI片段強烈雜交。這個基因組片段LpCCR1克隆2亞克隆至pBluescriptSK并測序(圖22A)。序列結果揭示6.5kb的SalI片段包含6.5kb的啟動子(圖22B)。獲得了包含啟動子和全部基因序列(外顯子和內含子)的LpCCR1基因組克隆的全長序列并在圖39中示出。多年生黑麥草4-香豆酸輔酶A連接酶(4CL)的基因組競隆和啟動子的分離和表征從多年生黑麥草中分離4CL2基因組克隆,包含2.5kb的啟動子和部分基因結構(內含子/外顯子分界)。4CL2啟動子可用于外源基因在轉基因植株中的靶向表達。將2.5kb啟動子融合至報告基因gusA以進行表達分析。用Lp4CLcDNA探針對多年生黑麥草基因組文庫進行篩選。在第三次篩選后,獲得了陽性4CL基因組克隆,并用限制性酶切消化和Southern雜交分析進行表征(圖23A)。序列分析揭示,從多年生黑麥草中分離的4CL基因組克隆(4CL2)與Lp4CL2cDNA克隆有100%核苷酸同源性。為進一步表征這個5kbλLp4CL2基因組克隆和確定該基因組克隆與Lp4CL2的cDNA相應,使用了多個利用從cDNA中設計的引物的PCR反應。PCR結果確定這個5kb基因組片段是相應于Lp4CL2cDNA的部分基因組克隆(圖23B)。使用引物聯合體F1和R1擴增全部的4.8kb基因組片段。為測定內含子的定位,利用引物組合物F1/R2和F2/R1進行額外的PCR反應,分別擴增出1kb和3.5kb條帶。從這些結果中可以測定內含子的定位和大小,并且通過序列分析進一步確定。這個大的5kb基因組片段包含4個小的外顯子,代表Lp4CL2的編碼序列在508bp和1490bp之間(圖23C)。基因組克隆1,Lp4CL2不包含啟動子區。為分離Lp4CL2的啟動子區,包含從克隆λLp4CL2中分離的消化的噬菌體基因組DNA的Southern印跡用從cDNA克隆Lp4CL2的5’末端分離的300bp的EcoRI/BglI片段再探測。300bp探針與2.5kbBamHI片段強烈雜交。基因組片段Lp4CL2克隆2亞克隆至pBluescriptSK并測序(圖24A)。序列結果揭示2.5kb的BamHI片段包含從基因組克隆1中缺失的、Lp4CL2的5’ORF的508bp和2.0kb的啟動子區(圖24B)。獲得了包含啟動子和部分基因序列(外顯子和內含子)的Lp4CL2基因組克隆的全部序列,并在圖39中示出。因此分離出Lp4CL2啟動子,并用于融合gusA報告基因的制備(圖25)。多年生黑麥草肉桂醇脫氫酶(CAD)的基因組克隆和啟動子的分離和表征從多年生黑麥草中分離CAD基因組克隆,包括基因結構(內含子/外顯子分界)減去包含CAD編碼區的最前邊111bp的內含子1。基因組克隆對于從多年生黑麥草cv.Barlano分離的CAD2基因組克隆的編碼區的851bp位置的存在G、而在多年生黑麥草cv.Ellett分離的CAD2cDNA克隆不存在G視為一致。在2個株系間發現的存在的SNP(單核苷酸多態性)具有作為分子標記的潛在的用途,用于草本品質、干物質消化率、機械壓力忍受、疾病抗性、蟲害抗性、植物株高以及葉片和莖顏色。以下的結果表明基因組克隆的分離,和來自多年生黑麥草cv.Barlano的基因組克隆CAD2推論的編碼序列與來自cvEllett的截短的cDNACAD2的推論的編碼序列的比較序列分析。在多年生黑麥草cv.Ellett中缺失的G已經高亮示出(圖26和27)。用相應于LpCAD2cDNA克隆的5’末端探針對多年生黑麥草基因組文庫進行篩選,該克隆編碼木質素生物合成酶肉桂醇脫氫酶。在初步文庫篩選中,鑒定出10個陽性噬菌斑并分離。在次級和三級篩選后,獲得兩個陽性噬菌斑,其相應的陽性基因組克隆通過限制酶消化和Southern雜交分析被進一步表征。根據限制性酶切消化分析,發現兩個基因組克隆是一樣的。一個克隆,命名為λLpCAD2被選出進行進一步Southern雜交分析。與LpCAD2cDNA探針強烈雜交的4.5kb的BamHI片段亞克隆至pBluescriptSK并測序(圖28A)。序列分析揭示4.5kb的BamHI片段是LpCAD2的部分基因組克隆。這個大的4.5kb基因組片段包括4個小的外顯子,代表LpCAD2的編碼序列在213bp和1213bp的終止密碼子之間,內含子/外顯子分界的定位在圖28B中圖例說明。實施例5包含多年生黑麥草的4CL、CCR和CADcDNA序列的融合基因的轉化載體的制備為改變木質素生物合成涉及的關鍵酶4CL、CCR和CAD的表達,通過反義和/或正義抑制技術及用于在轉基因植物中過表達這些關鍵酶,制造出一組正義和反義轉化載體。產生包含融合基因的轉化載體,融合基因是在CaMV35s或玉米泛素啟動子控制下以正向或反向方向使用多年生黑麥草4CL、CCR和CADcDNAs(圖29、30和31)。實施例6表達多年生黑麥草的融合4CL、CCR和CAD基因的轉基因煙草植株的制備和表征培育出一組攜帶多年生黑麥草4CL、CCR和CAD融合基因的轉基因煙草植株并分析。制備具有在CaMV35S或玉米泛素啟動子控制下的正向或反向方向的Lp4CL1、Lp4CL2和Lp4CL3全長cDNA序列的轉化載體。制備具有在CaMV35S和玉米泛素啟動子之一控制下的正向或反向方向的LpCCR1cDNA的轉化載體。制備具有在CaMV35S和玉米泛素啟動子之一控制下的正向的1325bp全長LpCAD1cDNA和反向的1051bp的部分LpCAD1cDNA的轉化載體。使用這些轉化載體完成向煙草原生質體的直接基因轉移實驗。攜帶在組成型CaMV35S啟動子控制下的多年生黑麥草Lp4CL1和LpCCR1cDNAs的轉基因煙草植株的制備和分子分析在這里詳細說明。一組使用Lp4CL1正義轉化載體產生的轉基因煙草植株通過PCR篩選,并用于Southern和northern雜交分析。對于轉基因煙草植株的初步的鑒定,使用npt2和Lp4CL1特異性引物進行PCR篩選。陽性轉基因煙草植株被鑒別出共轉化有選擇性標記npt2和Lp4CL1融合基因(圖32)。用來自PCR陽性轉基因煙草植株的DNA樣品完成Southern雜交分析以證明融合Lp4CL1轉基因在煙草植株基因組的整合。陽性的轉基因煙草植株攜帶1至5個Lp4CL1轉基因拷貝。沒有觀察到內在的煙草4CL基因和使用的多年生黑麥草雜交探針之間的交互雜交(圖32)。使用從攜帶融合的正義Lp4CL1轉基因的轉基因煙草植株中制備的總RNA樣品和用Lp4CL1特異性雜交探針探測的Northern雜交分析,揭示了在一個分析的Lp4CL1轉基因煙草植株中強烈表達的1.2kb的Lp4CL1轉錄本的存在(圖32)。通過直接基因轉移,在CaMV35S啟動子控制下的LpCCR1正義和反義轉化載體導入煙草原生質體中。制備一組轉基因煙草植株并用特異性引物通過PCR進行篩選,以鑒定攜帶融合LpCCR1轉基因的轉基因煙草植株。示出LpCCR1轉基因煙草植株的分子分析(圖33)。實施例7表達多年生黑麥草的融合OMT、4CL、CCR和CAD基因的轉基因多年生黑麥草植株的制備和表征開發了改進的轉化方法用于轉基因多年生黑麥草植株的制備,通過胚細胞的基因槍轉化。使用多年生黑麥草的融合OMT、4CL、CCR和CAD基因和改進的轉化方法培育轉基因多年生黑麥草植株。用于轉基因多年生黑麥草植株的制備的改進的方法該改進的程序使用產于成熟的種來源的胚的胚性愈傷組織作為基因槍轉化法的直接目標,而不需要構建胚性細胞懸浮液。該方案依賴于持續地提供分離的合子胚用于胚誘導。轉基因黑麥草植株在胚分離后的24-28周再生(圖34)。分離的胚種植在MSM5培養基上,以產生8周內作為用于基因槍轉化的目標的合適的胚性愈傷組織。胚性愈傷組織,在微粒轟擊之前,在高滲透培養基MSM3Plus中處理,在含有100mg/L巴龍霉素(Pm)的MSM3培養基中篩選2周,然后轉移至含有100mg/L的Pm的MSK上4周直至出現Pm抗性芽的分化。再生芽轉移至新鮮的含有100mg/LPm的選擇培養基MSK持續4周(圖34)。表達多年生黑麥草的融合OMT、4CL、CCR和CAD基因的轉基因多年生黑麥草植株的制備通過胚性愈傷組織的基因槍轉化,使用融合黑麥草OMT、4CL、CCR和CAD基因培育轉基因多年生黑麥草(Loliunperenne)植株。將描述這些轉基因黑麥草植株的制備的例子和詳細的分子分析。使用胚性愈傷組織的基因槍轉化和攜帶在組成型玉米泛素啟動子控制下的LpOmt1cDNA正向和反向序列的植物轉化載體pUbiomt1和pUbitmo1制備用于OMT下調的轉基因多年生黑麥草植株。這些用于下調OMT活性的轉基因多年生黑麥草植株從巴龍霉素抗性愈傷組織中再生,巴龍霉素抗性愈傷組織從使用覆蓋有兩種質粒的微粒的基因槍轉化中獲得,兩種質粒是:pHP23(攜帶作為選擇性標記的融合npt2基因)和由玉米泛素啟動子驅動的正義或反義LpOmt1轉化載體之一。轉基因多年生黑麥草植株用于使用npt2特異性引物的多聚酶鏈式反應(PCR)篩選。從胚性愈傷組織的基因槍轉化中獲得的獨立的npt2PCR陽性轉基因多年生黑麥草植株,胚性愈傷組織產生于大約60,000分離的成熟種子來源的胚,使用LpOmt1正義(pUbiomt1)和LpOmt1反義(pUbitmo1)轉化載體被鑒定(16個pUbiomt1轉化植株和27個pUbitmo1轉化植株)(圖35)。用未消化的和HindIII消化的DNA樣品完成Southern雜交分析,DNA樣品從PCR陽性轉基因多年生黑麥草植株中制備,以證明它們轉基因的類型和融合的npt2和LpOmt1轉基因的整合。共轉化有選擇性標記npt2基因和LpOmt1融合基因的陽性轉基因多年生黑麥草植株被鑒定(圖35)。在最多的例子中,含有包括重排轉基因拷貝的多拷貝的選擇性標記基因的轉基因多年生黑麥草植株再生。在未轉化的陰性對照中沒有發現npt2雜交條帶。HindIII消化的基因組DNA的例子包括在使用LpOmt1基因特異性雜交探針(omt1)的分析中。Omt1探針與DNA樣品中多個條帶雜交,DNA樣品與轉基因植株和非轉化的陰性對照均相應。Omt1雜交條帶在所有相應于內在的LpOmt1基因序列的樣品中都存在,內在的LpOmt1基因序列代表多年生黑麥草基因組的小的多基因家族(Heath等,1998)。不同的omt1雜交條帶在來自轉基因植株的樣品中出現,在未轉化的陰性對照樣品中不存在,未轉化的陰性對照樣品相應于反義(tmo1)和正義(omt1)LpOmt1轉基因整合結果(圖35)。使用鏈特異性LpOmt1探針的Northern雜交分析鑒定表達反義LpOmt1轉基因的轉基因多年生黑麥草植株(圖35)。測定選擇的反義和正義LpOmt1轉基因多年生黑麥草植株的OMT活性。用于OMT活性的生物化學分析首先在未轉化的植株(如煙草和多年生黑麥草)中建立。對于OMT催化的咖啡酸轉化成阿魏酸實驗中,利用放射性同位素標記的S-腺苷甲硫氨酸作為甲基供體。測量放射性阿魏酸的產物以及測定提供的OMT活性。測定選擇的LpOmt1轉基因多年生黑麥草植株(L.perennecv.Ellett)的OMT活性。觀察到在個別的轉化結果中明顯改變的OMT活性(圖36)。于是證明了在轉基因多年生黑麥草植株中的OMT活性的操縱取決于融合的黑麥草LpOmt1基因的表達。對于編碼關鍵的木質素生物合成酶4CL的基因的表達的操控,使用胚性愈傷組織的基因槍轉化,轉基因多年生黑麥草植株再生。使用分別攜帶融合的Lp4CL2正向和反向cDNA序列的、由組成型玉米泛素(Ubi)啟動子驅動的植物轉化載體pUbi4CL2和pUbi2LC4。用于4CL操縱的多年生黑麥草植株從Pm抗性愈傷組織中再生,Pm抗性愈傷組織從胚性愈傷組織的基因槍轉化中獲得,基因槍轉化使用覆蓋有攜帶融合的npt2基因作為選擇性標記基因的質粒pHP23和反義pUbi2LC4的微粒。轉基因多年生黑麥草植株用于使用npt2特異性引物的聚合酶鏈式反應(PCR)篩選。獨立的npt2PCR陽性轉基因多年生黑麥草植株從胚性愈傷組織的基因槍轉化中獲得(圖37)。對于編碼關鍵的木質素生物合成酶CCR和CAD的基因的表達的操控,使用胚性愈傷組織的基因槍轉化,轉基因多年生黑麥草植株同樣再生。實施例8多年生黑麥草OMT、4CL、CCR和CAD基因的基因組圖譜Lp4CL1、Lp4CL3、LpCAD1、LpCAD2、LpCCR1、LpOMT1和LpOMT2克隆用PCR擴增,并用放射性同位素標記以用作探測限制性片段長度多態性(RFLPs)的探針。RFLP用使用下面表3所述的酶酶切的p150/112多年生黑麥草參照群體的110子代個體定位。表三:RFLPs的定位Lp4CL1、Lp4CL3、LpCAD1、LpCAD2、LpCCR1、LpOMT1和LpOMT2基因座定位在表3和圖40顯示的連鎖群中。這些基因位置現在可用作數量性狀基因座的候選基因,所述數量性狀基因座用于木質素生物合成相關的形狀,如草本品質、干物質消化率、機械壓力忍受、疾病抗性、蟲害抗性、植株株高以及葉片和莖的顏色。實施例9正義抑制DNA序列元件和結構制備設計三個用于具有改良的木質素生物合成的轉基因多年生黑麥草的開發的結構,使用正義抑制技術。序列元件的單獨的成分在表4中列出。在結構產物中使用的啟動子和終止子來源于多年生黑麥草基因組序列。基因來源于多年生黑麥草cDNA序列。pAUX質粒載體的起點已經在之前描述(Goderis等,2002)。結構號載體骨架啟動子基因終止子1pAUX3132LpCAD2LpCAD3LpCAD22pAUX3169LpCCR1LpCCR1LpCCR13pAUX3169LpCCR1LpCCR1(fs)LpCCR1表4.在制備用于多年生黑麥草轉化的結構中使用的成分。結構使用GatewayTM技術(Invitrogen)制備。GaewayTM克隆系統由一個載體骨架和多個基于pUC18的輔助載體組成(Goderis等,2002)。多位點的重組盒使用多克隆位點在輔助載體中建立,側翼連接歸巢核酸內切酶位點(圖41)。歸巢核酸內切酶是罕見的切除限制性酶,如果需要表達盒的切除,將表達盒中意外的限制性的風險降到最小。各自的啟動子、cDNA和終止子序列使用合并合適的AttB重組序列引物通過PCR擴增,并克隆至單獨的GatewayTMEntry載體。例如,LpCAD表達載體(結構1)的構建需要三個Entry克隆:LpCAD3cDNA(圖42)、LpCAD2啟動子(圖43)和LpCAD2終止子(圖44)。然后這些與pAUX3132聯合,用于多重組反應和表達盒pAUX3132-LpCAD2::LpCAD3::LpCAD2(圖45)的生成。對于結構2,Entry克隆具有獨立的成分:LpCCR1啟動子、LpCCR1cDNA和LpCCR1終止子,用同樣的PCR克隆策略制備。Entry克隆與基礎載體pAUX3169在重組克隆反應中聯合以制備最終的結構pAUX3169-LpCCR1::LpCCR1::LpCCR1(圖46)。對于結構3,使用改變的沉默策略,包括移碼基礎途徑。這個方法包括單堿基對的缺失,就在起始位點下游,使用具有單堿基缺失的正向引物引入(圖47)。這個結構通過正義抑制起作用,因為制備的轉錄本將不能編碼正確的蛋白以及沒有產生功能性蛋白。制備具有獨立的成分LpCCR1啟動子、LpCCR1(fs)cDNA和LpCCR1終止子的Entry克隆,并在重組克隆反應中與基礎載體pAUX3169合并,以制備最終的結構pAUX3169-LpCCR1::LpCCR1(fs)::LpCCR1(圖48)。在單獨的質粒pAcH1中包含在抗生素潮霉素B中促進假定的轉基因黑麥草的選擇的植物選擇性標記。質粒利用水稻Actin1D啟動子驅動潮霉素磷酸轉移酶(hph)基因的原位表達。pAcH1質粒已經之前在飼草轉化中使用。轉化方案方案的開發和建立基于胚性愈傷組織的基因槍轉化,其中胚性愈傷組織從未成熟的花序中誘導,花序從多年生黑麥草的原位培養春化的收集物中分離,或源于體外苗培養物的分生組織。在兩種方案中的不同時期的圖示說明,來自用于胚性愈傷組織的誘導和增殖的移植體的分離,其中胚性愈傷組織用于基因組轉化至轉基因植株的再生,顯示在圖50和51中。兩種基因組轉化方法都考慮足以維持、容易利用的供體植物材料源,供體植物材料能夠高度勝任植物的再生和基因組轉化,以及與基因槍轉化技術相兼容。轉化中包括的過程的基本要點在圖52中描述。假定的轉基因植株的分子分析假定的轉基因多年生黑麥草植株的分子分析已利用用于Q-PCR的引物實施。設計了下面的引物:1、特異于hph基因的引物2、跨越CAD2啟動子-CAD3基因連接點的引物3、特異于pAUX3169載體的引物(因為特異于CCR1連接點的引物也能夠擴增內在基因組序列)。在圖53中示出用于在提取的基因組DNA中探測hph的Q-PCR程序的例子。概述了對于每一個結構的轉基因多年生黑麥草植株的數量的結果在表5中示出。表5.對于含有用于木質素生物合成改良的結構的多年生黑麥草株系轉化過程總結。通過RNA干擾和正義抑制的CAD和CCR表達的下調為了改良LpCCR1在多年生黑麥草中的表達水平,使用RNA介導的轉錄后基因沉默策略(RNA干擾)。玉米泛素(Ubi)啟動子被用于驅動LpCCR1發夾環(hp)結構在轉基因多年生黑麥草中的表達,LpCCR1發夾環結構包括3’UTR的可變區。多年生黑麥草的未成熟的花序來源的愈傷組織被用作基因槍轉化的目標。hpLpCCR1轉基因黑麥草植株通過Southern分析確定(圖54)。在同樣的方式中,使用結構1、2和3改良在多年生黑麥草中CAD和CCR的表達(正義抑制)。轉基因植株中木質素的分析木質素含量和成分通過特定染色方法顯現,包括可以區分G-木質素和S-木質素單體的Maule組織化學染色(Moore等,1991)。來自不同節間的花莖的Maule染色對野生型和Ubi::hpLpCCR1轉基因多年生黑麥草施行。結果證明在早期再生期(R1)和中間再生期(R2)的莖中均明顯減少的木質素積聚(圖55)。此外,在不同節間中,在全部木質素的相對量中有向頂(基底至頂點)的減少。以相同的方式,分析包含結構1、2和3的轉基因多年生黑麥草株系中木質素的含量和成分。額外的木質素分析方法包括通過持續的熱水、醇和氯仿/甲醇提取的細胞壁材料的分離(Fukushima和Hatfield,2001),接著總木質素含量/干重量的測定,使用乙酰溴方法(Liyama和Wallis,1990)(圖56)。為確定G/S比例的進一步的木質素單體分析通過硫代酸解(thioacidoylysis)分裂方法(Rolando等,1992)完成,用氣相色譜分析(GC-MS)量化(圖57)。參考文獻Fukushima,R.S.和R.D.Hatfield(2001)。“木質素的提取和分離用作標準物以利用乙酰溴方法測定木質素濃度(Extractionandisolationofligninforutilizationasastandardtodetermineligninconcentrationusingacetylbromidespectrophotometricmethod)。”農業和食品化學雜志(J.Agri.FoodChem)29:3133-3139。Goderis,I.,M.DeBolle,I.Francois,P.Wouters,W.Broekaert和B.Cammue(2002)。“一組允許高達6個表達單元靈活插入的標準植物轉化載體(Asetofmodularplanttransformationvectorsallowingflexibleinsertionofuptosixexpressionunit)。”植物分子生物學(PlantMolBiol)50:17-27。Heath等(1998)來自多年生黑麥草(Loliumperenne)的三個咖啡酸O-甲基轉移酶同源基因的cDNA克隆和差異表達(cDNAcloninganddifferentialexpressionofthreecaffeicacidO-methytransferasehomologuesfromperennialryegrass(Loliumperenne))。植物生理學雜志(JournalofPlantPhysiology)153:649-657。Lichtenstein,C,和J.Draper(1985)植物的基因工程學(Geneticengineeringofplants)。In:D.M.Glover(ed),DNA克隆,卷2,67-119頁,IRL出版社,華盛頓。Liyamam,K.和A.F.A.Wallis(1990)。“通過改良的乙酰溴方法在草本植物中的木質素的測定(Determinationoflignininherbaceousplantsbyanimprovedacetylbromideprocedure)。”食品科學與農學雜志(J.SciFoodAgric)51:145-161。Moore,K.J.,L.E.Moser,K.P.Vogel,S.S.Waller,JohnsonB.E.和P.J.F.(1991)。“多年生草料草的生長期的描述和量化(Describingandquantifyinggrowthstagesofperennialforagegrasses)。”農學雜志(Agron.J.)83:1073-1077。Rolando,C.,B.Monties和C.Lapierre(1992)。Thioacidolysis.木質素化學中的方法(MethodsinLigninChemistry)S.Y.Lin和C.W.Dence,Springer-Verlag:334-349頁。Spangenberg,G.,Z.Y.Wang,X.L.Wu,J.Nagel,V.A.Iglesias和I.Potrykus(1995)。“來自胚性懸浮液細胞的微粒轟擊的轉基因高羊茅和紫羊茅植株(Transgenictallfescueandredfescueplantsfrommicroprojectilebombardmentofembryogenicsuspensioncells)。”植物生理學雜志(JPlantPhysiol)145:693-701。最后,應當理解,在不背離如這里概述的本發明實質下,可以做出多種改變、修飾和/或添加。還應當理解,在本說明書中使用的術語“包含”(或它的文法上的變化)與術語“包括”等同,并且不能將其它成分或特征排除在外。說明書中引用的文件僅是起參考作用,它們包含的內容不能被確認是形成相關技術的公知的普通知識。當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1