人雌激素受體α亞型單克隆抗體雜交瘤細胞株、單克隆抗體、制備方法、應用與流程
本發明涉及生物技術領域,具體涉及人雌激素受體α亞型單克隆抗體雜交瘤細胞株、人雌激素受體α亞型單克隆抗體、制備方法、應用。
背景技術:
雌激素受體(estrogen receptor,ER)是一類甾類激素超家族的核受體,在人與動物體內通常介導雌激素的分泌作用。1967年,Jensen等在乳腺癌組織中首先發現了ER,1996年,Mosselman等在睪丸組織中發現了一種結構與之相似的核受體,現稱之為ERβ亞型,并將前者稱為ERα亞型,上述雌激素受體的兩個亞型具有共同的結構框架,由三個獨立但又相互影響的功能區構成:氨基末端(A/B區)、DNA結合區(C區)、羥基末端的配體結合區(D/E/F區)。雌激素受體與相應的配體結合,引起雌激素受體構型的改變,與相應的調節因子相互作用,進而雌激素受體與相應的應答基因結合,這一系列的過程都與這三個結構功能區密切相關。雌激素(17β-estradiol,E2)位于腦漿或胞核內,是雌激素受體的主要配體,具有轉綠基子的作用。E2一旦與雌激素結合,就會發生變構形成二聚體,然后與雌激素受體反應元件(estrogen response element,ERE)集合,刺激靶基因轉綠,從而調節雌激素促進細胞增生,分化和維持正常的生理功能。
作為其中的一個亞型,ERα受體主要分布在一些通常認為有雌激素效應的組織,如子宮、乳腺、胎盤、肝臟、中樞神經系統、心血管系統和骨組織、這些組織含有較多的ERα,可以誘導E2反應基因的表達,因此檢測ERα在組織中的表達情況,被作為判斷乳腺癌、肺癌、胃癌、結腸癌、宮頸癌、子宮肌瘤、膀胱癌、卵巢癌等 腫瘤細胞的標志之一。目前臨床上主要通過免疫組織化學(IHC)的方法在實際病理檢測當中針對腫瘤組織中ERα的表達情況進行檢測,進而評價病理組織中雌激素水平的高低,為腫瘤細胞病變情況的診斷提供依據。因此上述方法中使用的ERα單克隆抗體的品質決定了整個檢測結果的準確度,因此研制開發出一種特異性強、靈敏度高的人雌激素受體α亞型單克隆抗體,對于臨床上針對乳腺癌、肺癌、胃癌、結腸癌、宮頸癌、子宮肌瘤、膀胱癌、卵巢癌等疾病的診斷具有重要的意義。
技術實現要素:
本發明的目的之一是提供人雌激素受體α亞型單克隆抗體雜交瘤細胞株,該細胞株能夠穩定分泌特異性強、靈敏度高的人雌激素受體α亞型單克隆抗體。
本發明的目的之二是提供人雌激素受體α亞型單克隆抗體,該抗體與ERα特異性結合,與細胞內ERβ、PR、P53、AFP等蛋白無交叉反應。
本發明的目的之三是提供本發明人雌激素受體α亞型單克隆抗體在制備用于檢測ERα蛋白的免疫檢測工具中的應用,顯著提高了ERα免疫檢測的特異性、準確性和可靠性,真實反應腫瘤細胞內ERα蛋白的表達情況,可應用于對乳腺癌、肺癌、胃癌、結腸癌、宮頸癌、子宮肌瘤、膀胱癌、卵巢癌等相關腫瘤組織中ERα蛋白表達情況的檢測。
本發明的目的之四是提供本發明人雌激素受體α亞型單克隆抗體在制備用于標記組織細胞的試劑或試劑盒中的應用。
本發明的目的之五是提供人雌激素受體α亞型單克隆抗體雜交瘤細胞株的制備方法。
為了實現以上目的,本發明所采用的技術方案是:
人雌激素受體α亞型單克隆抗體雜交瘤細胞株,由以下方法制備獲得:依次包括以下操作步驟:ERα重組蛋白表達質粒的構建、ERα重組蛋白的表達與純化、ER α重組蛋白免疫的小鼠脾臟細胞與骨髓瘤細胞融合、細胞篩選與克隆;其中細胞篩選與克隆的具體方法為:培養融合后的細胞,初步篩選出上清液中與ERα抗原呈現陽性反應的細胞,取初步篩選出的細胞的上清液,利用收集獲得的ERα陽性組織蠟塊,對初步篩選出的細胞的上清液進行免疫組化驗證,篩選獲得與ERα陽性組織蠟塊的實際臨床檢測結果相符的細胞株,然后對該細胞株按照有限稀釋法進行亞克隆,即得所述的人雌激素受體α亞型單克隆抗體雜交瘤細胞株。
上述免疫組化驗證是指以初步篩選出的細胞上清液為一抗,對人乳腺癌組織細胞ERα陽性蠟塊進行免疫檢測。
所述ERα重組蛋白表達質粒的構建的具體方法為:根據人雌激素受體α亞型蛋白序列所對應的核苷酸序列,設計引物,擴增從第901bp至1788bp的基因序列,在基因序列兩端分別引入限制性內切酶位點BamHI和XhoI,將擴增后的基因插入表達載體pET-28a中,即得所述的ERα重組蛋白表達質粒;其中人雌激素受體α亞型的核苷酸序列如SEQ ID NO.1所示,888bp;ERα蛋白序列如SEQ ID NO.2所示;所述引物的
上游引物序列:SEQ ID NO.3:CGCCATATGTCTAAGAAGAACAGC;
下游引物序列:SEQ ID NO.4:CCGGTGCTCTCAGACCGTGGCAGG。其中下劃線表示基因插入位點。
所述ERα重組蛋白的表達與純化的具體方法為:將ERα重組表達質粒轉化E.coli細胞,篩選出陽性菌體,誘導后裂解離心收集上清液,將上清液經0.22μm濾器過濾,利用含2%咪唑的0.01M pH7.2的PBS過His純化鎳柱,清洗平衡,然后用不含咪唑的PBS平衡鎳柱,將過濾后的上清液上樣平衡后的鎳柱,控制流速為0.5~1mL/min,然后經50mM、100mM、200mM、350mM、500mM咪唑進行梯度洗脫,分別收集洗脫餾分,進行凝膠電泳驗證,篩選與ERα原核部分表達蛋白理論分 子量大小相同、條帶單一的一組餾分,4℃條件下利用上述含2%咪唑的0.01M pH7.2的PBS過夜透析,即完成ERα重組蛋白的純化。
所述將ERα重組表達質粒轉染E.coli細胞,篩選出陽性菌體,誘導后裂解離心收集上清液的具體方法為:將重組質粒取10μL加入E.coil菌感受態細胞中,混勻后冰上放置30~50min,然后立即放入42℃水浴中熱激90s,冰上靜止3~5min,再加入0.8~1mL的LB無抗性培養液,37℃搖床搖45~60min,接種在含Kana抗生素的LB半固體培養板中,倒置放入37℃溫箱中過夜培養12~14小時;挑取培養皿上的單克隆菌落與LB培養液中,37℃搖菌至OD值為0.6~0.8,加入IPTG誘導劑至終濃度1~1.5mM,37℃下誘導4h,離心收集菌體,超聲破碎離心收集上清液。
所述ERα重組蛋白免疫的小鼠脾臟細胞由以下方法制備而得:取純化后的ERα重組蛋白免疫小鼠,進行二次免疫,第二次免疫與第一次免疫間隔3周,第二次免疫后2周取尾血進行效價ELISA評價,取抗體效價較高的小鼠的脾臟細胞進行后續的細胞融合。
所述ERα重組蛋白免疫的小鼠脾臟細胞與骨髓瘤細胞融合的具體方法為:將免疫后的小鼠脾臟細胞進行研磨后與骨髓瘤細胞按照5~10:1的比例混勻、離心,37℃下用50%的PEG-4000融合,融合后加入RPMI-1640培養基終止,1200rpm條件下離心10min,利用含HAT的10%FBS培養基重懸后按照10~20萬/孔的總細胞密度進行鋪板,置于二氧化碳培養箱中培養。
初步篩選出上清液中與ERα抗原呈現陽性反應的細胞的具體方法為:待孔板上細胞團生長至可進行檢測的數目時,按照200ng/孔的包被量,4℃條件下過夜包被ERα蛋白,第二日拍干后,每孔加入120~150μL的含5%BSA的PBST封閉液,置于37℃下孵育2h。后拍干,加入待檢測的細胞培養上清,后面實驗按照ELISA間接法檢測上清中有無與ERα抗原反應的抗體,篩選保留與ERα有免疫反應的細胞株。
人雌激素受體α亞型單克隆抗體,由上述人雌激素受體α亞型單克隆抗體雜交瘤細胞株分泌制得。
上述人雌激素受體α亞型單克隆抗體,由以下方法制備而得:將人雌激素受體α亞型單克隆抗體雜交瘤細胞株進行體外細胞培養瓶中擴大培養,后植入小鼠腹腔,收集腹水,分離、純化得人雌激素受體α亞型單克隆抗體;其中純化的具體方法為:將分離后的待純化腹水經過平衡完全的Protein G層析柱中,利用pH3.0的檸檬酸緩沖液進行洗脫,峰值處收集流出相,調整pH值至7.0~7.6之間,經0.01M pH 7.2的PBS透析收集即得到所述抗體。
所述純化過程中腹水流經Protein G層析柱后的流速為0.5~1mL/min。
上述人雌激素受體α亞型單克隆抗體在制備用于檢測人雌激素受體α亞型蛋白的免疫檢測工具中應用。
所述免疫檢測工具為試劑、試劑盒、芯片、試紙或磁微粒。
上述人雌激素受體α亞型單克隆抗體在制備用于標記組織細胞的試劑、試劑盒或芯片中的應用。
所述組織細胞為乳腺癌、肺癌、胃癌、結腸癌、宮頸癌、子宮肌瘤、膀胱癌或卵巢癌的組織細胞。
本發明人雌激素受體α亞型單克隆抗體雜交瘤細胞株,將初步篩選出的與ERα抗原呈現陽性反應的細胞,進一步的利用收集獲得的人乳腺癌ERα陽性組織蠟塊,對其進行免疫組化驗證,篩選獲得與人乳腺癌ERα陽性組織蠟塊的臨床預期符合的細胞株,該雜交瘤細胞株分泌人雌激素受體α亞型單克隆抗體與ERα蛋白特異性結合,而與細胞內其他蛋白無交叉反應,顯著提高了ERα免疫檢測的特異性、準確性和可靠性,真實反映腫瘤細胞內ERα蛋白表達情況,可用于乳腺癌、肺癌、胃癌、結腸癌、宮頸癌、子宮肌瘤、膀胱癌、卵巢癌或相關腫瘤組織中ERα表達情況的檢 測。
進一步的,本發明人雌激素受體α亞型單克隆抗體雜交瘤細胞株的制備方法,在人ERα重組蛋白表達制粒的構建過程中,根據人雌激素受體α亞型蛋白序列所對應的核苷酸序列,設計引物,擴增從第901bp至1788bp的基因序列,提高雜交瘤細胞株制備和篩選過程的目的性,提高制備效率。
附圖說明
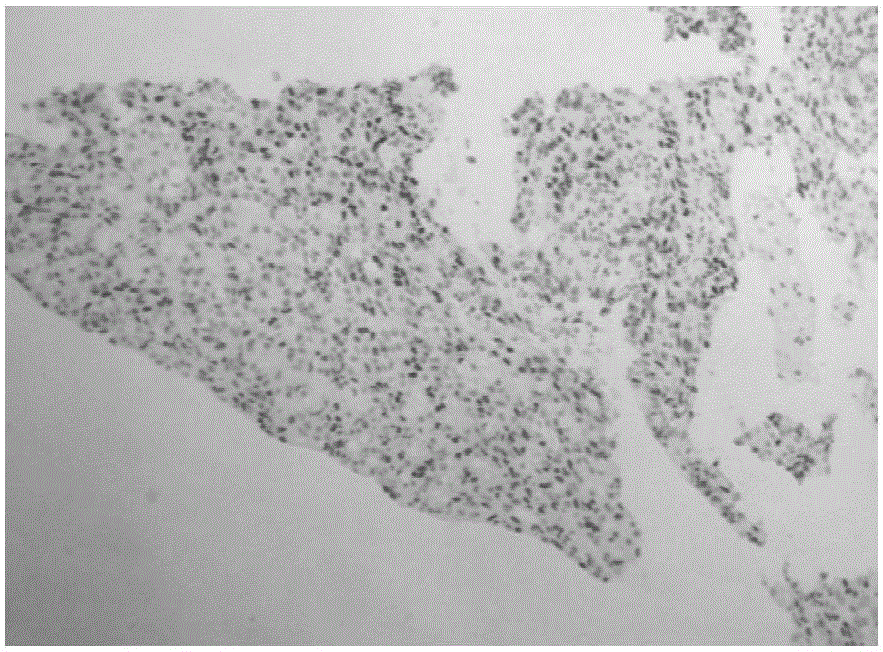
圖1是以實施例2制備的抗體C3A8為一抗的人乳腺癌免疫組化結果圖;
圖2是以實施例2制備的抗體C3A8為一抗的人宮頸癌免疫組化結果圖;
圖3是以實施例2制備的抗體C3A8為一抗的人子宮內膜癌免疫組化結果圖;
圖4是以實施例2制備的抗體C3A8為一抗的人結腸癌免疫組化結果圖;
圖5是以實施例2制備的抗體C3A8為一抗的人扁桃體免疫組化結果圖;
圖6是以對比例制備的抗體C6H7為一抗的人扁桃體免疫組化結果圖;
圖7是以實施例2制備的抗體C3A8為一抗的人睪丸免疫組化結果圖;
圖8是以對比例制備的抗體C6H7為一抗的人睪丸免疫組化結果圖;
圖9是以實施例2制備的抗體C3A8為一抗的人腎上腺免疫組化結果圖;
圖10是以對比例制備的抗體C6H7為一抗的人腎上腺免疫組化結果圖;
圖11是以實施例2制備的抗體C3A8為一抗的人食管免疫組化結果圖;
圖12是以對比例制備的抗體C6H7為一抗的人食管免疫組化結果圖;
圖13是以實施例2制備的抗體C3A8為一抗的人小腦免疫組化結果圖;
圖14是以對比例制備的抗體C6H7為一抗的人小腦免疫組化結果圖;
圖15是以實施例2制備的抗體C3A8為一抗的人子宮平滑肌瘤免疫組化結果圖;
圖16是以對比例制備的抗體C6H7為一抗的人子宮平滑肌瘤免疫組化結果圖。
具體實施方式
本發明公開了一種人雌激素受體α亞型單克隆抗體雜交瘤細胞株、人雌激素受體α亞型單克隆抗體和應用,本領域技術人員可以借鑒本文內容,適當改進工藝參數實現。特別需要指出的是,所有類似的替換和改動對本領域技術人員來說是顯而易見的,它們都被視為包括在本發明。本發明的方法及應用已經通過較佳實施例進行了描述,相關人員明顯在不脫離本發明內容、精神和范圍內對本文所述的方法和應用進行改動或適當變更與組合,來實現和應用本發明技術。
下面通過具體實施例對本發明的技術方案進行詳細說明。
下述實施例中采用的試劑和原料均為市售商品。
實施例1
本實施例人雌激素受體α亞型單克隆抗體雜交瘤細胞株,由以下方法制備而得,具體操作步驟為:
1)構建ERα重組蛋白表達質粒:以從北京傲銳東源生物科技有限公司購得的質粒RC213277為模板,根據人雌激素受體α亞型的核苷酸序列(如SEQ ID NO.1所示),ERα蛋白序列(如SEQ ID NO.2所示),設計兩條引物進行PCR擴增,分別引入酶切位點BamHI和XhoI,克隆ORF第901bp至1788bp到表達載體pET-28a,建立ERα重組蛋白表達質粒;克隆位點設計;所述引物的上游引物序列:SEQ ID NO.3:CGCCATATGTCTAAGAAGAACAGC;下游引物序列:SEQ ID NO.4:CCGGTGCTCTCAGACCGTGGCAGG;
2)ERα重組蛋白的表達與純化:
A:轉化E.coil細胞:將E.coil(BL-21)菌感受態從-80℃環境中取出,冰上拍打解凍,將ERα重組蛋白表達質粒取10μL加入感受態細胞中,混勻后冰上放置30~50min,后立即放入42℃水浴中熱激90s,冰上靜止3~5min,再加入0.8~1mL的LB培養液,37℃搖床搖45~60min,接種在含Kana抗生素的LB半固體培養板中, 倒置放入37℃溫箱中過夜培養12~14小時;
B:裂解細胞:挑取培養皿上的單克隆菌落與LB培養液中,37℃搖菌至OD值為0.6~0.8,加入IPTG誘導劑至終濃度至1~1.5mM,誘導4h,離心收集菌體,超聲破碎離心收集上清;
C:鎳柱純化:將收集的上清離心,將上清經0.22μm濾器過濾,利用含2%咪唑的0.01M pH 7.2的PBS過His純化鎳柱,清洗平衡,然后用不含咪唑的相同PBS平衡His純化鎳柱,將過濾后的上清液上樣平衡后的鎳柱,控制流速為0.5~1mL/min,然后經50mM、100mM、200mM、350mM、500mM咪唑進行梯度洗脫,分別收集洗脫餾分,進行凝膠電泳驗證,篩選與ERα原核部分表達蛋白理論分子量大小相同、條帶單一的一組餾分,4℃條件下利用上述含2%咪唑的0.01M pH7.2的PBS過夜透析,即完成ERα重組蛋白的純化,紫外分光光度計下測量蛋白濃度,調整至1mg/mL;
3)ERα重組蛋白免疫的小鼠脾臟細胞與骨髓瘤細胞融合:
A:蛋白免疫:利用從北京博奧龍免疫技術有限公司購買的Quickantibody快免佐劑(五周)與步驟2)中純化后的ERα重組蛋白按照體積1:1混合進行Balb/c小鼠(河南省動物實驗中心)腿部肌肉免疫,依次進行兩次免疫,第二次免疫與第一次免疫間隔3周,第二次免疫后2周取尾血進行效價ELISA評價,取抗體效價達到要求的小鼠進行細胞融合;
B:細胞融合:
取步驟A中抗體效價達到要求的小鼠的脾臟細胞進行研磨后與SP2/0細胞數目按照5~10:1的比例關系混勻、離心,37℃下用50%的PEG-4000融合,融合后加入RPMI-1640培養基終止,1200rpm條件下離心10min,利用含HAT的10%FBS培養基重懸后按照10~20萬/孔的總細胞密度進行鋪板,置于二氧化碳培養箱中培養;
4)細胞篩選與克隆:
待步驟3)中孔板上融合細胞團生長至可進行檢測的數目時,按照200ng/孔的包被量,4℃條件下過夜包被ERα抗原,利用ELISA間接法進行檢測細胞上清中有無與ERα抗原反應的抗體,初步篩選保留與ERα有免疫反應的細胞;取初步篩選出的細胞的上清液,利用收集獲得的人乳腺癌ERα陽性組織蠟塊,對初步篩選出的細胞的上清液進行免疫組化驗證,篩選獲得與人組織細胞ERα陽性組織蠟塊的實際臨床檢測結果相符細胞株,然后對該細胞株按照有限稀釋法進行亞克隆,即得所述的人雌激素受體α亞型單克隆抗體雜交瘤細胞株,命名為C3A8。
實施例2
本實施例人雌激素受體α亞型單克隆抗體,由以下方法制備而得,具體操作步驟為:
1)腹水制備:取實施例1制備的人雌激素受體α亞型單克隆抗體雜交瘤細胞株進行擴大培養,待收集獲得100~200萬細胞后,植入預先已注入石蠟油的小鼠腹腔,適時收集獲得腹水,然后將腹水經過5000rpm,2min離心分離去除紅細胞和上層石蠟油,并按照1:1體積比計入0.01M pH7.2的PBS稀釋分離純化后的腹水;
2)抗體純化:將Protein G柱利用上述PBS平衡,然后通過上樣環將步驟1)純化后的腹水加入平衡后的Protein G柱上,流速調至0.5~1mL/min,待上樣結束后,利用pH 3.0的檸檬酸緩沖液進行洗脫,峰值處收集流出相,利用pH 8.0Tris緩沖液接收峰值處流出的抗體蛋白,調整pH值至7.0~7.6之間,經0.01M pH 7.2的PBS透析收集即得人雌激素受體α亞型單克隆抗體,命名為C3A8抗體。
對比例
該對比例人雌激素受體α亞型單克隆抗體雜交瘤細胞株為《生物技術通訊》Vol.26 No.2Mar,2015刊登名稱為《雌激素受體α型抗體的制備及臨床應用研究》,作者為劉玲玲、翟晉豫、齊華,的論文中記載的分泌抗體C6H7的雜交瘤細胞株。
試驗例1
取相同數目實施例1制備的人雌激素受體α亞型單克隆抗體雜交瘤細胞株與對比例制備的人雌激素受體α亞型單克隆抗體雜交瘤細胞株在相同條件下培養分泌抗體,通過ELISA間接法檢測對兩者分泌抗體的能力和抗體效價進行檢測,結果如下表1所示:
表1
由上述表1所示的結果可知,本發明實施例1制備的雜交瘤細胞株分泌抗體能力強,分泌的抗體效價明顯高于對比例制備的雜交瘤細胞株。
試驗例2本發明實施例2制備的人雌激素受體α亞型單克隆抗體C3A8抗體的特異性和靈敏性檢測
試驗方法:取人雌激素受體α亞型單克隆抗體與ERβ、PR、P53、AFP、ERα蛋白進行交叉反應驗證,采用間接ELISA檢測(波長450nm,參考波長630nm),試驗組采用實施例2制備的C3A8抗體,對照組采用市售的徠卡6F11抗體,檢測結果如下表2所示:
表2 C3A8抗體與各抗原交叉反應結果
由上述表2所示的結果可知,本發明人雌激素受體α亞型單克隆抗體與ERα蛋白特異性結合,而與細胞內其他蛋白無交叉反應,顯著提高了ERα免疫檢測的特異性、準確性和可靠性。
試驗例2本發明實施例2制備的單克隆抗體C3A8抗體為一抗的免疫組化檢測
1、試驗方法:具體操作步驟如下:
(1)取由河南省人民醫院收集獲得的乳腺癌ERα陽性蠟塊,置于-20℃冰箱中低溫放置30~60min,使用Leica組織切片機進行切片,組織厚度3μm,置于粘附載玻片上;
(2)烤片:將切片獲得的粘附載玻片置于60℃烘片機中烤片20min;
(3)脫蠟:將步驟2處理后的切片置于二甲苯I、二甲苯II中各10min;二甲苯I、II均為分析純二甲苯;
(4)洗二甲苯:將切片分別置于分析純無水乙醇I、II各5min,95%濃度、80%濃度、70%濃度、50%濃度乙醇中各5min;
(5)抗原修復:將抗原修復液預熱,并將洗二甲苯后的切片放入其中,加熱20min。后至室溫約30℃;去離子水洗滌浸泡5min,洗滌一次;
(6)內源性過氧化物酶封閉:用Leica試劑過氧化物酶封閉劑中和切片組織內源性過氧化物酶5min,TBS洗滌(沖洗浸泡)10min;
(7)蛋白封閉劑封閉:利用Leica試劑蛋白封閉劑封閉切片組織孵育5min,TBS洗滌(沖洗浸泡)10min;
(8)一抗:加C3A8抗體(1:500比例稀釋),37℃孵育60min,TBS洗滌(沖洗浸泡)10min;
(9)二抗:加leica的NovoLink聚合物(二抗)孵育30min,TBS洗滌(沖洗浸泡)10min;
(10)DAB顯色:利用leica中DAB(1:20比例配置)顯色5min,利用去離子水沖洗浸泡5min;
(11)蘇木精復染:利用Leica中的蘇木精復染5min,利用去離子水沖洗浸泡5min;
(12)脫水與透明:依次經過50%、70%、80%、95%濃度的乙醇及無水乙醇I、II各2min,二甲苯II、I各2min;
(13)封閉:待切片組織二甲苯揮發完畢后,利用中性樹膠封片,置于鏡下觀察,如圖1所示。
按照上述同樣的方法分別取由河南省人民醫院收集獲得的人宮頸癌ERα陽性蠟塊、子宮內膜癌ERα陽性蠟塊、人結腸癌ERα陽性蠟塊,進行免疫組化檢測,結果如圖2、圖3、圖4所示。
2、實驗結果:
由圖2-5所示,在人乳腺癌、子宮內膜癌、胃癌、宮頸癌組織中可以見到特異性細胞質與核染色,結果與ERα在細胞內的定位及組織表達一致,表明實施例2制備的C3A8抗體可用于免疫組織化學檢測ERα細胞內表達水平。
上述試驗結果也表明本發明制備的上述人雌激素受體α亞型單克隆抗體可用于制備用于檢測人雌激素受體α亞型蛋白的劑、試劑盒、芯片、試紙或磁微粒等免疫檢測工具。同樣的也可用于制備用于標記乳腺癌、肺癌、胃癌、結腸癌、宮頸癌、子宮肌瘤、膀胱癌或卵巢癌等組織細胞的試劑、試劑盒或芯片。
試驗例3免疫組化對比驗證試驗
試驗方法:按照試驗例2所述的免疫組化檢測方法分別以實施例2制備的抗體C3A8和對比例所述的抗體C6H7為一抗,對河南省人民醫院收集獲得的扁桃體ERα陽性蠟塊、睪丸ERα陽性蠟塊、腎上腺ERα陽性蠟塊、食管ERα陽性蠟塊、小 腦ERα陽性蠟塊、子宮平滑肌瘤ERα陽性蠟塊,進行免疫組化對比檢測,結果如圖5~圖16所示,由圖中的同一組織順序切片免疫組化結果可知,C6H7抗體免疫組化結果的一組中均不同程度出現了非特異染色,即在非陽性部位外(細胞膜、細胞質)出現了染色。由此可知,實施例2制備的抗體C3A8在扁桃體、睪丸、腎上腺、食管、小腦、子宮平滑肌瘤組織中與ERα在細胞內的定位及組織表達一致,無非特異性結合,而對比例所述的抗體C6H7出現了非特異性結合,表明本發明制備人雌激素受體α亞型單克隆抗體雜交瘤細胞株分泌抗體的特異性明顯優于對比例所述雜交瘤細胞株分泌抗體的特異性。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 作為AXL抑制劑的雜環化合物的制作方法與工藝
- HPTP?β抑制劑的制作方法與工藝
- 作為LSD1抑制劑的環丙胺的制作方法與工藝
- KRAS G12C的抑制劑的制作方法與工藝
- 調節雌激素受體突變體的方法和組合物與流程
- 作為PI3K抑制劑的吡啶并[1,2?A]嘧啶酮類似物的制作方法與工藝
- 作為PI3K抑制劑的吡啶并[1,2?A]嘧啶酮類似物的制作方法與工藝
- 包含Ⅲ類受體酪氨酸激酶抑制劑和烷基化組蛋白?脫乙酰酶抑制劑融合分子EDO?S101的藥物組合及其在治療癌癥中的用途的制作方法與工藝
- 包含Ⅲ類受體酪氨酸激酶抑制劑和烷基化組蛋白?脫乙酰酶抑制劑融合分子EDO?S101的藥物組合及其在治療癌癥中的用途的制作方法與工藝
- 新型雌激素相關受體α抑制劑及其醫學用途的制作方法與工藝
- Virosaine A的四氫吡咯基和嗎啉基衍生物的組合物在抗骨質疏松藥物中的應用
- 鑒定嗅覺受體調節劑的方法
- 用于治療局部晚期或轉移性雌激素受體陽性乳腺癌的雌激素受體調節劑的制作方法
- 作為mglu5受體的負性別構調節劑的6-氟-2-[4-(吡啶-2-基)丁-3-炔-1-基]咪唑并[1,2a ...的制作方法
- Virosaine A的哌嗪基和咪唑基衍生物的組合物在抗骨質疏松藥物中的應用
- 受體調節劑的環烷基氧基吡啶化合物和雜環烷基氧基吡啶化合物的制作方法
- 作為甲酰肽受體調節劑的苯基氨基甲酸酯衍生物的制作方法
- 雄激素受體調節劑的晶形的制作方法
- 受體調節劑的環烷基氧基吡啶化合物和雜環烷基氧基吡啶化合物的制作方法
- 作為甲酰肽受體調節劑的苯基氨基甲酸酯衍生物的制作方法