一種CD19特異性嵌合抗原受體及其編碼基因、應用的制作方法
本發明涉及細胞免疫技術領域,尤其涉及一種CD19特異性嵌合抗原受體及其編碼基因、應用。
背景技術:
B淋巴細胞腫瘤是起源于B細胞的惡性血液系統疾病,主要包括B細胞源行的急性淋巴系統白血病(ALL)、非霍奇金淋巴瘤(NHL)及大部分的慢性淋巴系統白血病(CLL)。其中ALL的發病率最高,并且有逐年增高的趨勢。目前的治療主要通過全身化療和造血干細胞的移植。大劑量的放化療,毒副作用強,患者耐受性差,免疫力大大降低,雖然可以緩解,但是復發率高。而且造血干細胞的來源稀缺,配型成功率低。
嵌合抗原受體修飾的T細胞(chimeric antigen receptor;CAR-T)治療是利用基因工程技術,借助逆轉錄病毒或者逆轉病毒載體或者mRNA轉導,使得T細胞獲得可以識別腫瘤表面抗原,殺傷腫瘤的嵌合抗原受體。CAR-T治療相比于傳統的治療方法展現出巨大的優勢,具體體現在殺傷腫瘤精準性高,CAR-T細胞治療采用抗原抗體特異性結合的技術,只有腫瘤表面抗原表達的腫瘤細胞被殺傷,對正常細胞的傷害小;殺傷腫瘤范圍廣泛,只要表達腫瘤相關抗原,CAR-T細胞就能清除,對于轉移性腫瘤、復發性腫瘤均有效;對于患者而言避免了放化療的痛苦,恢復健康迅速。
CD19屬于Ig超家族成員,分子量為95kDa,是一種穿膜糖蛋白,分布于B細胞表面。CD19的相應的生理性配體尚不清楚。研究表明,CD19與B細胞活化和信號的轉導有關:(1)CD19單克隆抗體可誘導胞漿內多種底物迅速發生磷酸化;(2)CD19胞漿區可被一種絲氨酸激酶催化而發生磷酸化;(3)CD19胞漿區與src激酶家族Lyn穩定的結合。最近提出一個B細胞最佳信號放大的雙重抗原結合模型,這個模式認為是BCR/IgαIg&beta與抗原結合后,使CD19與CD21相互接近形成復合物,外來抗原及包裹抗原的C3dg分別被BCR和CD21所結合,后者激活CD19/CD21復合物中與CD19緊密結合的src家族Lyn,而使CD19分子胞漿內酪氨酸發生磷酸化。CD19廣泛表達在多種B細胞惡性腫瘤細胞表面,在正常B細胞,濾泡性樹突狀細胞表面也有表達,而在其他組織和血液細胞沒有表達,血液中也未曾檢測到CD19可溶性蛋白的存在。因此它被認為是CAR-T治療B細胞腫瘤的理想靶點。臨床試驗結果顯示,CD19CAR-T對急性B-淋巴細胞白血病(B-ALL)的治愈率已經達到了90%。
技術實現要素:
基于背景技術存在的技術問題,本發明的目的在于提供一種CD19特異性嵌合抗原受體。
本發明的目的還在于提供編碼上述嵌合抗原受體的基因。
本發明的目的還在于提供上述嵌合抗原受體的應用。
為了實現上述目的,本發明提出的一種CD19特異性嵌合抗原受體,包括胞外抗原結合區、鉸鏈區和胞內信號轉導區,所述鉸鏈區為人抗體IgG4的CH2CH3。
優選地,所述人抗體IgG4的CH2CH3的氨基酸序列如SEQ ID NO.1所示。
優選地,所述胞外抗原結合區為人抗CD19的單鏈抗體。
優選地,所述人抗CD19的單鏈抗體的氨基酸序列如SEQ ID NO.2所示;優選地,所述人抗CD19的單鏈抗體的重鏈和輕鏈分子之間有個連接肽,其氨基酸序列如SEQ ID NO.3所示。
優選地,所述嵌合抗原受體由人抗CD19的單鏈抗體、人抗體IgG4的CH2CH3、CD28的跨膜區和胞內信號結構、CD137的胞內信號結構、及CD3ζ的胞內信號結構串聯構成。
優選地,所述嵌合抗原受體的氨基末端含有一個信號肽,其氨基酸序列如SEQ ID NO.4所示。
優選地,所述嵌合抗原受體以CD28的跨膜區和胞內信號結構、CD137胞內信號結構、CD3ζ的胞內信號結構串聯構成的結構域為T細胞共刺激信號傳導結構;優選地,所述T細胞共刺激信號傳導結構的氨基酸序列如序列表中的SEQ ID NO.5所示。
優選地,所述嵌合抗原受體的氨基酸序列如SEQ ID NO.6所示。
本發明提出的編碼上述CD19特異性嵌合抗原受體的基因,其核酸序列如SEQ ID NO.2所示。
本發明提出的上述CD19特異性嵌合抗原受體在制備治療CD19相關腫瘤藥物中的應用。
本發明根據1991年發表的鼠源抗人CD19抗體克隆FMC63的重鏈和輕鏈的可變區序列(Zola,Immunol cell boil.1991,Dec 69),經過密碼子優化,基因合成抗CD19的ScFv序列,并將合成ScFv克隆到pSFG-CH2CH3-CD28-CD137-CD3ζ中,即構建成本發明的CD19-scFv-CH2CH3-CD28-CD137-CD3ζ嵌合抗原受體。
美國賓州大學Carl June在2010年申請了CD19-CAR專利(WO2012079000),同樣利用了抗CD19抗體FMC63的抗體序列,但其CAR結構與本發明中序列不同,WO2012079000中CAR(1)使用了慢病毒系統來組建CAR,本發明中使用了逆轉病毒;(2)WO2012079000包含了CD19scFv序列,CD8a序列作為鏈接序列和跨膜序列,CD137胞內信號序列和CD3ζ胞內序列。本發明中使用了人的IgG4的CH2CH3作為鏈接序列,以及CD28跨膜序列和CD28胞內序列。利用CH2CH3作為鏈接區的優勢在于CH2CH3有利于形成二聚體,可以提高CD19scFv對CD19分子的親和力。
同時其他發表文章中已經構建了利用人IgG1的CH2CH3的CD19-CAR分子,IgG1的CH2CH3可以引起潛在的ADCC作用,會造成細胞因子風暴,產生副作用,而本發明利用了IgG4的CH2CH3,通常不會造成細胞因子風暴。此外,本發明中的CAR包含了CD28的胞內刺激信號,因此本發明中的CAR提供了兩個共刺激信號CD28和CD137,大大提高了CAR的殺腫瘤作用。
本發明利用嵌合抗原受體與逆轉病毒包裝質粒PeqPam3及RD114env在293T細胞包裝成逆轉病毒,利用該病毒感染T淋巴細胞。利用Elisa檢測CAR-T細胞在抗原刺激下IFN-γ的分泌及通過流式檢測對CD19陽性的腫瘤細胞的殺傷作用。
本發明公布CD19特異性的嵌合抗原受體的結構,和體外感染T淋巴細胞的技術。修飾后的T淋巴細胞釋放IFN-γ等殺傷腫瘤細胞。CD19特異性的嵌合抗原受體可以用于CD19相關腫瘤的靶向治療。
附圖說明
圖1為本發明提出的CD19特異性嵌合抗原受體的結構示意圖。
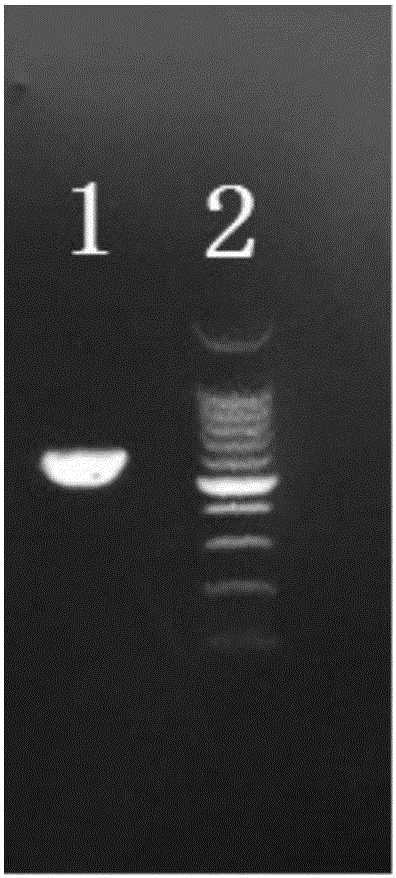
圖2為本發明所得CD19-scFv的PCR產物的電泳圖。
圖3為本發明所得CD19特異性嵌合抗原受體的電泳圖。
圖4為流式檢測CD19特異性CAR-T細胞中CAR分子的表達的結果圖。
圖5為流式細胞分析腫瘤細胞和T細胞的比例結果圖。
圖6為本發明所得嵌合抗原受體CD19特異性CAR-T細胞與淋巴瘤細胞的MTT檢測結果圖。
圖7為ELISA檢測本發明所得CAR-T細胞在受到CD19刺激后IFN-γ和IL2的表達結果圖。
具體實施方式
下面,通過具體實施例對本發明的技術方案進行詳細說明。
實施例1:CD19特異性嵌合抗原受體逆轉病毒載體的構建
本發明提出的一種CD19特異性嵌合抗原受體,由人抗CD19的單鏈抗體、人抗體IgG4的CH2CH3、CD28的跨膜區和胞內信號結構、CD137的胞內信號結構、及CD3ζ的胞內信號結構串聯構成,其氨基酸序列如SEQ ID NO.1所示。
1、利用1991年發表的FMC62鼠源抗人CD19單克隆抗體序列,選出VH和VL的序列,用于設計CAR載體中的scFv序列,采用金斯瑞生物技術公司OptimumGeneTM基因設計軟件對密碼子進行進一步優化,在優化的序列兩端分別加上NcoI,BAMHI酶切位點,優化后的序列由南京金斯瑞生物技術公司完成基因合成,合成后的序列克隆在pCDNA3載體,質粒命名為CD19-scFv-pCDNA3。
其中插入的CD19-scFv序列部分可以經由PCR進行擴增得到,接著進行檢測,如圖2所示,其中條帶1為CD19-scFv的PCR產物,700bp左右;條帶2為100bp的條帶參照。
2、CD19-scFv-pCDNA3質粒用限制性內切酶NcoI和BAMHI酶切,酶切體系如下:2μg CD19-scFv-pCDNA3、1μL NcoI、1μL BamHI、2μL 10×酶切緩沖液,用水補到20μL,37℃水浴中過夜,酶切產物用1%的瓊脂糖凝膠電泳,在紫外下切取目的條帶,采用DNA凝膠回收試劑盒(AXYGEN公司)回收目的片段;用同樣的方法NcoI和BAMHI酶切pSFG-CH2CH3-CD28-CD137-CD3ζ載體,用瓊脂糖凝膠電泳,回收目的片段。將回收后的CD19-ScFv與酶切載體通過T4DNA連接酶連接,反應體系如下:2μL CD19-ScFv、2μL載體酶切產物、1μL 10×連接緩沖液,1μL連接酶,用水補到10μL,16度水浴中過夜。取連接產物加入到DH5α感受態中[參考《分子克隆》第三版中大腸桿菌感受態制備(CaCl2法)],放置37度細菌培養箱中過夜培養。挑取單個菌落,擴大培養,提取陽性克隆的質粒,經酶切和測序,將正確的載體命名為CD19-scFv-CH2CH3-CD28-CD137-CD3ζ,即本發明提出的CD19特異性嵌合抗原受體。
將所得CD19特異性嵌合抗原受體進行檢測,其結果如圖3所示,其中條帶1為100bp的對照條帶,條帶2為所得CD19特異性嵌合抗原受體。
實施例2:CD19特異性嵌合抗原受體修飾的T淋巴細胞的制備
1、含CD19特異性嵌合抗原受體逆轉病毒的包裝
用無內毒素質粒大提試劑盒內(天根生物)的操作說明書提取逆轉錄病毒包裝載體pRD114和CD19-scFv-CH2CH3-CD28-CD137-CD3ζ逆轉錄病毒載體共轉染到293T細胞中,轉染后48h收集細胞上清,4000rpm離心10min,去除上清中的細胞及細胞碎片。用0.45μm的濾膜過濾,分裝凍存,備用。
2、T淋巴細胞的制備
采取20mL健康志愿者的新鮮抗凝血,用淋巴分離液(GE公司)分立外周血單核細胞(PBMC)。分離后的細胞用CD3和CD28平板刺激48h,用T淋巴細胞培養基GT-T551(TAKARA公司)加3%自身血漿進行誘導,得到T淋巴細胞。
3、CAR-T細胞的制備
用50μg/mL的RetroNectin(TAKARA公司)包被非組織培養板24孔板,每孔加入500μL,4℃過夜。每孔再加入500μL病毒上清,37℃孵育30min。去除病毒上清,再加入500μL病毒上清,37℃孵育30min,除病毒上清,每孔加入1.5mL病毒上清,再加入0.5mL稀釋后的T淋巴細胞,從而獲得CD19-scFv-CH2CH3-CD28-CD137-CD3ζ細胞,即CD19特異性CAR-T細胞。
4、流式檢測CD19特異性CAR-T細胞中CAR分子的表達
將CAR-T細胞加入5μL FITC標記的抗Fc抗體(Jackson公司),37℃孵育1h后,進行流式檢測,檢測結果如圖4所示:其中虛線所形成的峰為對照的T淋巴細胞,而實線的峰表示感染嵌合抗原受體的逆轉錄病毒的T淋巴細胞。由圖4可知:本方法所得CAR-T細胞的效率大于90%。
實施例3:嵌合抗原受體CD19特異性CAR-T細胞對CD19相關腫瘤的殺傷作用
1、CAR-T細胞對腫瘤的殺傷力檢測
將淋巴瘤細胞用培養基調整到5×106/mL,每孔50μL,按效應細胞和靶細胞比為1:4,加入CD19陽性的淋巴瘤細胞2.5×105個,待細胞完全貼壁后,收集T細胞和CAR-T細胞,調整細胞濃度為1.25×106/mL,每孔50μL,然后分別進行流式細胞(培養24h)和MTT檢測(培養12h)。
首先,收集細胞進行CD3和CD19的染色,進行流式細胞分析腫瘤細胞(CD19+)和T細胞(CD3+)的比例,其結果如圖5所示。由圖5可知:本發明所得嵌合抗原受體CD19特異性CAR-T細胞能有效殺傷淋巴瘤細胞。
其次,同樣的實驗棄上清加入100μL稀釋的CCK8,孵育4-6小時,酶標儀檢測OD450的吸光值。其檢測結果如圖6所示,CAR-T細胞對CD19表達的腫瘤的殺傷率高于CD19不表達的腫瘤細胞;CAR-T細胞對相關腫瘤殺傷作用高于T細胞,高于單純培養基。
2、ELISA檢測CAR-T細胞在受到CD19刺激后IFN-γ和IL2的表達
將淋巴瘤細胞用培養基調整到5×106/mL,每孔50μL,加入淋巴瘤細胞2.5×105個,待細胞完全貼壁后,收集T和CAR-T細胞,調整細胞濃度為1×106/mL,每孔50μL,培養24h。收集上清液,利用ELISA試劑盒檢測IFN-γ和IL2的表達。
其結果如圖7所示,CD19特異性嵌合抗原受體修飾的T淋巴細胞在收到CD19陽性的淋巴瘤細胞刺激后表達和分泌IFN-γ和IL2。
以上所述,僅為本發明較佳的具體實施方式,但本發明的保護范圍并不局限于此,任何熟悉本技術領域的技術人員在本發明揭露的技術范圍內,根據本發明的技術方案及其發明構思加以等同替換或改變,都應涵蓋在本發明的保護范圍之內。
- 還沒有人留言評論。精彩留言會獲得點贊!