一種基因工程菌及其在生產1,5?戊二胺中的用途的制作方法
本發明涉及生物催化技術領域,特別涉及一種增加大腸桿菌胞內磷酸吡哆醛(PLP)合成的基因工程菌及其在生產1,5-戊二胺中的用途。
背景技術:
1,5-戊二胺(簡稱戊二胺),即尸胺,是生物體內廣泛存在的具有生物活性的含氮堿,為蛋白質腐敗時賴氨酸在脫羧酶作用下發生脫羧反應時生成的產物。在農業上, 1,5-戊二胺可用于調控植物衰老過程、促進雌雄蕊的發育,改善植物果實發育,提高果實產量;醫學上,亦可以作為一種有效治療痢疾的藥物成份;工業上是一種極為重要的化工原料,與己二酸、琥珀酸和癸二酸等二元酸聚合可分別形成新型材料聚酰胺5.6、聚酰胺5.4和聚酰胺5.10。
目前合成戊二胺的方法有化學合成法、酶轉化法、微生物發酵生產法等。化學合成法條件苛刻、污染環境;酶轉化法過程復雜、成本較高;微生物直接發酵生產法雖相對生產原料成本較低,但直接發酵生產的戊二胺含量較低,且發酵液成分復雜,副產物多,產物的分離純化比較困難。
全細胞催化是指利用完整的生物有機體作為催化劑進行化學轉化,其本質是利用細胞內的酶進行催化,是介于發酵法和提取酶催化法之間的一種生物催化技術。相比發酵法,全細胞催化克服了發酵法生產周期長、代謝產物復雜、底物轉化率低、產物分離提取困難及能耗高等缺點。相比純酶催化反應,全細胞中各酶系維持原有狀態和特定位置,酶穩定性更好,半衰期更長,適應性更強,更易實現能量和輔酶的原位再生;細胞內完整的多酶體系可以實現酶的級聯反應,催化效率高。全細胞催化的另一特點是不需考慮催化產物對細胞的毒害作用,非常適合類似1,5-戊二胺等對細胞有毒性的物質的生產。
專利CN 103725724 A中利用固定化的蜂房哈夫尼菌(Hafnia alvei )AS1.1009,通過流加200 g/l的L-賴氨酸母液,轉化生產得到1,5-戊二胺60.54 g/l。專利US 7189543中將E.coli W3110(ATCC 39936)的賴氨酸脫羧酶基因(cadA)克隆到質粒pUC18上,而后轉化到E.coli JM109中構建了一株基因工程菌株,并利用該菌株采用全細胞催化技術生產1,5-戊二胺,其在反應液中濃度達到69 g/l,是目前報道最高產量。
已知兩種存在于大腸桿菌中賴氨酸脫羧酶(CadA和LdcC),都需要磷酸吡哆醛(PLP)作為輔酶。經實驗驗證(詳見實施例2),在全細胞轉化生產戊二胺過程中加入賴氨酸脫羧酶的輔酶磷酸吡哆醛,對維持生產菌株的1,5-戊二胺轉化能力有顯著作用。同時也表明,菌株胞內自身合成的PLP無法滿足賴氨酸脫羧酶高效轉化L-賴氨酸生成1,5-戊二胺的需求。其部分原因是大腸桿菌合成PLP主要依賴1-脫氧-5-磷酸木酮糖途徑,該途徑需7種酶參與,合成效率較低;相比較,生物體中存在另一種依賴核糖-5-磷酸的PLP合成途徑,該途徑只需兩個酶參與即可利用細胞中較充足存在的核糖-5-磷酸、甘油醛-3-磷酸和谷氨酰胺一步合成PLP,且該途徑廣泛分布于包括真菌、植物及部分原核生物細胞中,參與PLP合成的酶為YaaD(又稱PdxS、Pdx1或SnzP)和 YaaE (又稱PdxT、 Pdx2, 或SnoP)。此外,菌體胞內的PLP含量是受嚴格調控的,其含量過高或過低均會對菌體造成傷害。(見Pease A J, Roa B R, Luo W, Winkler M E. Positive Growth Rate-Dependent Regulation of the pdxA, ksgA, and pdxB Genes of Escherichia coli K-12 [J]. Journal of bacteriology, 2002, 184(5): 1359-69.)因此,要增加菌體胞內PLP的含量,不僅要改造菌體胞內PLP的合成途徑,還需要優化菌體培養方法,從而實現在不影響菌體生長的前提下,提高菌體積累PLP的能力,進而構建出高效的1,5-戊二胺生產菌株。
技術實現要素:
本發明所要解決的技術問題是提供一種增加大腸桿菌胞內磷酸吡哆醛(PLP)合成的基因工程菌及該菌在生產1,5-戊二胺中的用途。
為解決的上述技術問題,本發明公開了一種重組表達載體,其含有磷酸吡哆醛(PLP)合成基因。
本發明所述核糖-5-磷酸途徑依賴的磷酸吡哆醛(PLP)合成基因來源沒有特別限制,但是優選使用來源于(例如)芽孢桿菌屬(Bacillus spp.)等原核生物。
進一步的,所述的表達yaaD的氨基酸序列為SEQ ID NO:2所示的氨基酸序列或其突變體。
進一步的,所述的表達yaaE氨基酸序列為SEQ ID NO:3所示的氨基酸序列或其突變體。
另一方面,本發明還公開了一種基因工程菌,其含有上述所述的重組表達載體。
進一步的,所述的基因工程菌,還包括質粒pETDuet-pelB-CadB-CadA。
本發明中所述產戊二胺的基因工程菌所使用的載體系列包括:pETDuet系列質粒、pACYCDuet系列、pRSFDuet系列、pCDFDuet系列、pET系列、pGEX系列、pMAL系列、、pTXB1系列、pTYB系列。
本發明中所述產戊二胺的基因工程菌,其特征在于所述的能高效表達外源基因的宿主菌為下列之一:BL21系列、Rosetta系列、Origami系列、Tuner系列。
另一方面,本申請公開了所述基因工程菌在生產1,5-戊二胺中的用途。
優選的,基因工程菌的培養基以甘油與乳糖作為碳源,二者比例為1:1~7:3,總糖量為2%;以氯化銨或硫酸銨為氮源,培養基C/N比為3:2~3:4。
另外,
本發明中,種子培養基為用于培養大腸桿菌的常規培養基,如LB培養基。
本發明中,發酵培養基,可以使用含有可同化的碳源、氮源及無機鹽類等的營養培養基。作為碳源,可以使用例如葡萄糖、甘油、果糖、蔗糖、麥芽糖、淀粉水解產物等,優選甘油。作為氮源,可以使用氨、氯化銨、硫酸銨、碳酸銨、醋酸銨等各種無機和有機銨鹽類,尿素,其它含氮化合物,以及肉類提取物、酵母提取物、玉米漿、大豆水解產物等含氮有機物,優選氯化銨和硫酸銨。作為無機鹽,可以使用磷酸二氫鉀、磷酸氫二鉀、硫酸鎂、碳酸鈣、氯化鈉、硫酸銨、鉬酸銨等。此外,根據需要,可以添加生物素、硫胺素、維生素B6等微量營養源。
所述的底物L-賴氨酸優選為L-賴氨酸鹽酸鹽,也可以為其他賴氨酸鹽,例如賴氨酸·己二酸鹽、賴氨酸·癸二酸鹽、賴氨酸·琥珀酸酸鹽等。
對于轉化過程pH的調節,優選使用鹽酸或二羧酸。pH調節到5~8,優選控制在pH 5.6。
本發明中,表達yaaD和yaaE的核酸序列來源廣泛,真菌、植物及部分原核生物細胞中的YaaD(又稱PdxS、Pdx1或SnzP)和 YaaE (又稱PdxT、 Pdx2, 或SnoP)核酸序列序列均可。
本發明所述的產戊二胺基因工程菌的構建、表達及應用的效果具體體現在:
提供了一種有效提高胞內PLP含量的基因構建策略,實現胞內PLP的高效合成,并保障菌體的正常生長。
(1)提供了一種利用胞內PLP合成積累的培養策略,并實現與L-賴氨酸脫羧酶及賴氨酸-尸胺反向轉運蛋白協調表達策略,從而實現在不另外添加PLP的情況下,高效轉化生產戊二胺。
(2)所得基因工程菌菌體活性高,實現胞內PLP含量達到1144 nmol/gDCW,單位菌體的1,5-戊二胺生產強度達到25 g/gDCW/h,1,5-戊二胺含量達到210 g/l,遠優于現有技術報道。
附圖說明
圖1為質粒pRSF-yaaDE構建示意圖。
圖2為磷酸吡哆醛(PLP)的添加對基因工程菌轉化生產1,5-戊二胺的影響。
圖3為基因工程菌胞內磷酸吡哆醛(PLP)含量及1,5-戊二胺產率。
圖4為基因工程菌培養條件優化。
圖5、圖6、圖7為補料分批全細胞轉化生產1,5-戊二胺。
圖8為基因工程菌全細胞轉化產物MS分析結果(單丹酰尸胺)。
圖9為基因工程菌全細胞轉化產物MS分析結果(雙丹酰尸胺)。
具體實施方式
以下結合具體實施例,進一步闡述本發明。這些實施例僅用于說明本發明而不用于限制本發明的范圍。下列實施例中未注明具體條件的實驗方法,通常按照常規條件或按照制造廠商所建議的條件。除非另行定義,文中所使用的所有專業與科學用語與本領域熟練人員所熟悉的意義相同。此外,任何與所記載內容相似或均等的方法及材料皆可應用于本發明方法中。文中所述的較佳實施方法與材料僅作示范之用。
實施例1 產1,5-戊二胺菌株的構建
根據枯草芽孢桿菌Bacillus subtilis (GenBank: AL009126.3)
的磷酸吡哆醛合成酶基因序列設計引物:
YaaDE-NcoI-F:CATGccATGGCTCAAACAGGTACTGAACG;
YaaDE-SalI-R:ACGCGTCGACTTATACAAGTGCCTTTTGCTTATATTCCTCAACC。
PCR得到的yaaDE基因克隆至質粒pRSF質粒上,構建得到質粒pRSF-yaaDE (圖1)。yaaDE核苷酸序列如SEQ ID NO:1,將質粒pETDuet-pelB-CadB-CadA(見本發明人的公開專利申請文獻:發明名稱為一種表達重組載體及其應用,申請公布號CN104498519A)和pRSF-yaaDE用常規方法均導入大腸桿菌BL21 (DE3),菌株命名為BL-BADE,并以甘油菌或凍干菌種形式保存。
實施例2 外源添加磷酸吡哆醛(PLP)對1,5-戊二胺合成的影響
挑取BL- DAB(見本發明人的公開專利申請文獻:發明名稱為一種表達重組載體及其應用,申請公布號CN104498519A)單菌落于5ml含100 ug/ml 氨芐青霉素的LB液體培養基中,37℃、200 rpm過夜活化菌種。活化的菌種按1%接種量轉接到50 ml 含相應抗生素(100 ug/ml 氨芐青霉素)的液體發酵培養基中, 37℃、200 rpm 培養至OD600約為0.5。加入IPTG至終濃度0.5 mM,30 ℃,200 rpm誘導培養12h后4000 x g 離心收集菌體細胞,用0.9%的氯化鈉溶液洗滌兩遍后用轉化反應液重懸到細胞濃度為4 g(DCW)/l,轉化反應液含L-賴氨酸鹽酸鹽至終濃度125 g/l (相當于L-賴氨酸濃度為100 g/l)。重懸菌液分為兩組,一組添加終濃度為0.1 mM PLP;另一組為對照組(即不添加PLP組)。37 ℃,250 rpm轉化,每隔三小時取樣檢測上清中L-賴氨酸及1,5-戊二胺含量。
L-賴氨酸含量使用SBA-40E型生物傳感儀進行檢測。1,5-戊二胺含量用丹磺酰氯衍生化后,反相高效液相色譜檢測。衍生步驟如下:移取100 ul離心后的轉化液到5 ml離心管中,依次加入2 M NaOH溶液200 μl, 飽和NaHCO3溶液300 μl ,10 g/1的1,7-二氨基庚烷溶液(內標)100 μl及10 g/l 的丹磺酰氯溶液1 ml。混勻后置于40 ℃水浴中避光反應45 min,而后加入25%的氨水100 μl,混勻后室溫避光靜置30 min。反應結束后,用乙腈定容至5 ml。HPLC分析使用agilent 1290 infinity system,色譜柱為Prevail C18反向柱(250 mm × 4.6 mm × 5 μm)。HPLC條件為:流動相A:100% 乙腈,流動相B:0.1 M 乙酸銨溶液,采用梯度洗脫,條件如下:初始:50% A;19 min:90% A;20-30 min:50% A;流速:1.0 ml/min;柱溫:40±1 °C;進樣量:10 μl。檢測使用熒光檢測器 (FLD G1321B),激發波長:320 nm;發射波長:523 nm。
結果如圖2所示,不添加PLP條件下,單位質量菌體的1,5-戊二胺產率從3 h的3.91 g/gDCW/h下降到9 h的2.30 g/gDCW/h,降低了41%。而當添加0.1 mM PLP時,單位質量菌體的1,5-戊二胺產率僅下降5%。結果表明,外源PLP的添加對維持菌體活力有顯著效果。
實施例3 基因工程菌轉化生產1,5-戊二胺
挑取單菌落BL-BADE于5ml含100 ug/ml 氨芐青霉素的LB液體培養基中,37℃、200 rpm過夜活化菌種。活化的菌種按1%接種量轉接到50 ml 含相應抗生素(100 ug/ml 氨芐青霉素,170 μg/ml氯霉素)的液體發酵培養基中, 37℃、200 rpm 培養至OD600約為0.5。加入IPTG至終濃度0.5 mM,30 ℃,200 rpm誘導培養12h后4000 x g 離心收集菌體細胞,取10 mg(干重)菌體細胞檢測胞內PLP含量。剩余菌體用0.9%的氯化鈉溶液洗滌兩遍后用轉化反應液重懸到細胞濃度為2 g(DCW)/l,轉化反應液含L-賴氨酸鹽酸鹽至終濃度12.5 g/l (相當于L-賴氨酸濃度為10 g/l),37 ℃,250 rpm轉化30分鐘后,6000 x g離心后,檢測上清中L-賴氨酸及1,5-戊二胺含量。
L-賴氨酸和1,5-戊二胺含量檢測方法見實施例2。
胞內PLP含量檢測采用反相高效液相色譜法,條件為:流動相A(pH 3.0):0.1 M 磷酸二氫鉀, 0.1 M 高氯酸鈉和0.5 g/L 亞硫酸鈉;流動相B(pH 3.0):0.1 M 磷酸二氫鉀, 0.1 M 高氯酸鈉,0.5 g/L 亞硫酸鈉和20% 乙腈。 采用梯度洗脫,條件如下:0-4 min :100% A;4.1 to 13 min:27% B;流速:1.0 ml/min;柱溫:25 ± 1°C;進樣量:20 μl。檢測使用熒光檢測器 (FLD G1321B),激發波長:300 nm;發射波長:400 nm。
結果如圖3所示,經30分鐘轉化后,基因工程菌BL-BADE的胞內PLP含量達到533 nmol/gDCW,1,5-戊二胺產率為0.21 g /gDCW /h, 分別是對照菌株BL-DAB的1.5倍和1.6倍;是初始菌株BL21 (DE3)的5.3倍和4.7倍。
實施例4 基因工程菌培養條件優化
挑取BL-BADE單菌落于5ml含100 ug/ml 氨芐青霉素和170 μg/ml氯霉素的LB液體培養基中,37℃、200 rpm過夜活化菌種。活化的菌種按1%接種量轉接到50 ml 含100 ug/ml 氨芐青霉素和170 ug/ml氯霉素的液體發酵培養基中, 37℃、200 rpm 培養12 h后轉接優化培養基中。優化培養基以甘油與乳糖作為碳源,二者比例為1:1~7:3,總糖量為2%;以氯化銨為氮源,培養基C/N比為3:2~3:4;對比試驗以LB培養基使用IPTG誘導作為對照。37 ℃,200 rpm誘導培養6 h后4,000 × g離心10 min收集菌體并進行全細胞轉化試驗及檢測胞內PLP含量。
全細胞轉化條件同實施例3。轉化液中L-賴氨酸、1,5-戊二胺和胞內PLP含量檢測方法見實施例2和實施例3。
結果如圖4所示,利用優化培養基得到的菌株BL-BADE胞內PLP含量達到1051 nmol/gDCW,菌株1,5-戊二胺產率達到0.7 g /gDCW/h,與LB培養基添加IPTG誘導相比,分別提高了1.97倍和3.5倍。且生物量沒有顯著差異。
實施例5 補料分批全細胞轉化生產1,5-戊二胺
挑取單菌落于5ml含100 ug/ml 氨芐青霉素和170 μg/ml氯霉素的LB液體培養基中,37℃、200 rpm過夜活化菌種。活化的菌種按1%接種量轉接到250 ml 含100 ug/ml 氨芐青霉素和170 μg/ml氯霉素的種子培養基中,37℃、200 rpm 培養8h。而后按10 %比例接種到4 L發酵培養基中,37℃,200 rpm, 1 vvm,培養12小時,離心收集菌體。種子培養基為LB培養基;發酵培養基成分為:1.2% (W/V) 蛋白胨、2.4% (W/V) 酵母提取物、0.4% (V/V) 甘油、17 mM KH2PO4、72 mM K2HPO4。
轉化體系包括:菌體8 gDCW/l, L-賴氨酸量150 g/l。轉化條件為37 ℃,200 rpm,轉化4小時,其間補加5 M 鹽酸維持pH穩定。轉化過程中定期檢測轉化液中L-賴氨酸含量,當賴氨酸消耗至2.5 ~ 4 g /g DCW時,補加底物至150 g/l。
轉化液中L-賴氨酸含量使用SBA-40E型生物傳感儀進行檢測。1,5-戊二胺含量用丹磺酰氯衍生化后,HPLC-MS分析。衍生化操作見實施例2。
HPLC-MS分析使用電噴霧離子質譜,色譜柱為Prevail C18反向柱(250 mm × 4.6 mm × 5 μm)。HPLC條件為:流動相A:100% 乙腈,流動相B:0.1 M 乙酸銨溶液,采用梯度洗脫,條件如下:初始:50% A;19 min:90% A;20-30 min:50% A;流速:1.0 ml/min;柱溫:40±1 °C;進樣量:10 μl。檢測使用紫外檢測器,檢測波長254 nm。
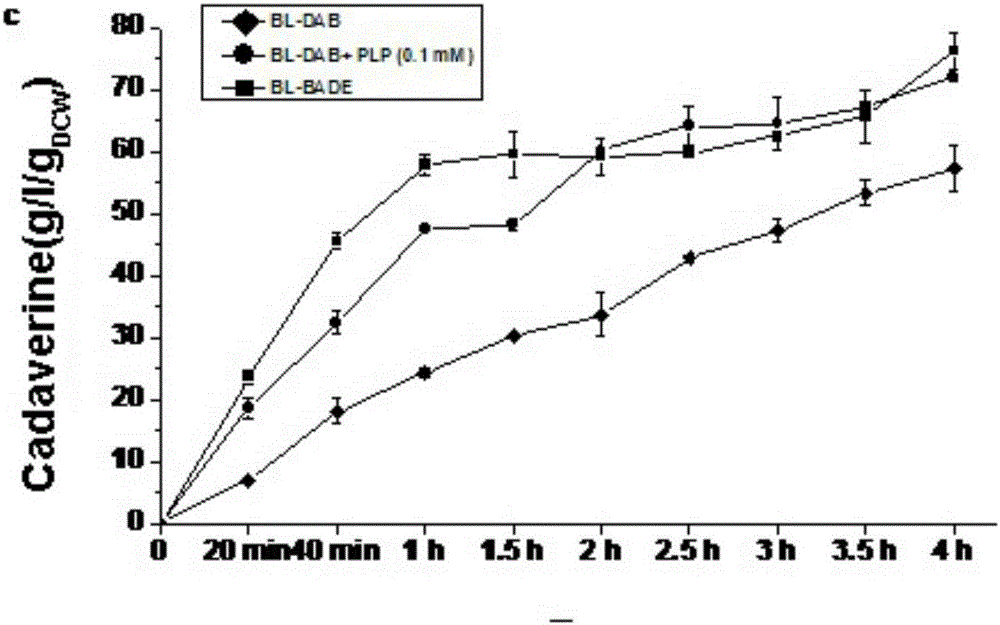
結果如圖5所示,菌株BL-BADE在不添加PLP情況下的產率相當于(p=0.143, α=0.05) 添加0.1 mM PLP的菌株BL-DAB的產量,轉化液中1,5-戊二胺含量達到210 g/l,最大1,5-戊二胺產率可達到 25 g /gDCW/h,是菌株BL-DAB在不添加PLP情況下的2.9倍;且菌株可維持該產率達1小時,第一小時1,5-戊二胺的平均產率為24 ± 1 g /gDCW/h,是菌株BL-DAB在添加0.1 mM PLP條件下的產率(20 ± 1 g /gDCW/h)的1.2倍(如圖6所示)。經過4小時的轉化,單位質量菌株BL-BADE可生產1,5-戊二胺76 g/L,略高于菌株BL-DAB在添加了0.1 mM PLP下的產率(71.9 g/L)(如圖7所示)。
轉化產物經HPLC-MS分析,單丹酰尸胺(圖8)分子量為335(336-1=335),雙丹酰尸胺(圖9)分子量為568(569-1=568),分別于單丹酰尸胺和雙丹酰尸胺的分子量吻合。
本實施例結果說明本發明所公開的1,5-戊二胺生產菌構建策略可有效協調賴氨酸的攝取、賴氨酸脫羧及戊二胺外排等過程,并可高效從頭合成脫羧反應所需的輔酶磷酸吡哆醛(PLP),以滿足菌體高效轉化生產1,5-戊二胺的需求。所構建的菌種生產能力強,配合本發明公開的培養策略,可轉化生產得到高濃度的1,5-戊二胺的溶液,遠優于現有技術報道。
本發明的范圍不受所述具體實施方案的限制,所述實施方案只作為闡明本發明各個方面的單個例子,本發明范圍內還包括功能等同的方法和組分。實際上,除了本文所述的內容外,本領域技術人員參照上文的描述和附圖可以容易地掌握對本發明的多種改進。所述改進也落入所附權利要求書的范圍之內。上文提及的每篇參考文獻皆全文列入本文作為參考。
序列表
<110> 南京工業大學
<120> 一種基因工程菌及其在生產1,5-戊二胺中的用途
<130> xb16052702
<160> 3
<170> PatentIn version 3.3
<210> 1
<211> 1497
<212> DNA
<213> Bacillus subtilis
<400> 1
atggctcaaa caggtactga acgtgtaaaa cgcggaatgg cagaaatgca aaaaggcggc 60
gtcatcatgg acgtcatcaa tgcggaacaa gcgaaaatcg ctgaagaagc tggagctgtc 120
gctgtaatgg cgctagaacg tgtgccagca gatattcgcg cggctggagg agttgcccgt 180
atggctgacc ctacaatcgt ggaagaagta atgaatgcag tatctatccc ggtaatggca 240
aaagcgcgta tcggacatat tgttgaagcg cgtgtgcttg aagctatggg tgttgactat 300
attgatgaaa gtgaagttct gacgccggct gacgaagaat ttcatttaaa taaaaatgaa 360
tacacagttc cttttgtctg tggctgccgt gatcttggtg aagcaacacg ccgtattgcg 420
gaaggtgctt ctatgcttcg cacaaaaggt gagcctggaa caggtaatat tgttgaggct 480
gttcgccata tgcgtaaagt taacgctcaa gtgcgcaaag tagttgcgat gagtgaggat 540
gagctaatga cagaagcgaa aaacctaggt gctccttacg agcttcttct tcaaattaaa 600
aaagacggca agcttcctgt cgttaacttt gccgctggcg gcgtagcaac tccagctgat 660
gctgctctca tgatgcagct tggtgctgac ggagtatttg ttggttctgg tatttttaaa 720
tcagacaacc ctgctaaatt tgcgaaagca attgtggaag caacaactca ctttactgat 780
tacaaattaa tcgctgagtt gtcaaaagag cttggtactg caatgaaagg gattgaaatc 840
tcaaacttac ttccagaaca gcgtatgcaa gaacgcggct ggtaagaaca taggagcgct 900
gctgacatgt taacaatagg tgtactagga cttcaaggag cagttagaga gcacatccat 960
gcgattgaag catgcggcgc ggctggtctt gtcgtaaaac gtccggagca gctgaacgaa 1020
gttgacgggt tgattttgcc gggcggtgag agcacgacga tgcgccgttt gatcgatacg 1080
tatcaattca tggagccgct tcgtgaattc gctgctcagg gcaaaccgat gtttggaaca 1140
tgtgccggat taattatatt agcaaaagaa attgccggtt cagataatcc tcatttaggt 1200
cttctgaatg tggttgtaga acgtaattca tttggccggc aggttgacag ctttgaagct 1260
gatttaacaa ttaaaggctt ggacgagcct tttactgggg tattcatccg tgctccgcat 1320
attttagaag ctggtgaaaa tgttgaagtt ctatcggagc ataatggtcg tattgtagcc 1380
gcgaaacagg ggcaattcct tggctgctca ttccatccgg agctgacaga agatcaccga 1440
gtgacgcagc tgtttgttga aatggttgag gaatataagc aaaaggcact tgtataa 1497
<210> 2
<211> 294
<212> PRT
<213> yaaD of 枯草芽孢桿菌Bacillus subtilis
<400> 2
Met Ala Gln Thr Gly Thr Glu Arg Val Lys Arg Gly Met Ala Glu Met
1 5 10 15
Gln Lys Gly Gly Val Ile Met Asp Val Ile Asn Ala Glu Gln Ala Lys
20 25 30
Ile Ala Glu Glu Ala Gly Ala Val Ala Val Met Ala Leu Glu Arg Val
35 40 45
Pro Ala Asp Ile Arg Ala Ala Gly Gly Val Ala Arg Met Ala Asp Pro
50 55 60
Thr Ile Val Glu Glu Val Met Asn Ala Val Ser Ile Pro Val Met Ala
65 70 75 80
Lys Ala Arg Ile Gly His Ile Val Glu Ala Arg Val Leu Glu Ala Met
85 90 95
Gly Val Asp Tyr Ile Asp Glu Ser Glu Val Leu Thr Pro Ala Asp Glu
100 105 110
Glu Phe His Leu Asn Lys Asn Glu Tyr Thr Val Pro Phe Val Cys Gly
115 120 125
Cys Arg Asp Leu Gly Glu Ala Thr Arg Arg Ile Ala Glu Gly Ala Ser
130 135 140
Met Leu Arg Thr Lys Gly Glu Pro Gly Thr Gly Asn Ile Val Glu Ala
145 150 155 160
Val Arg His Met Arg Lys Val Asn Ala Gln Val Arg Lys Val Val Ala
165 170 175
Met Ser Glu Asp Glu Leu Met Thr Glu Ala Lys Asn Leu Gly Ala Pro
180 185 190
Tyr Glu Leu Leu Leu Gln Ile Lys Lys Asp Gly Lys Leu Pro Val Val
195 200 205
Asn Phe Ala Ala Gly Gly Val Ala Thr Pro Ala Asp Ala Ala Leu Met
210 215 220
Met Gln Leu Gly Ala Asp Gly Val Phe Val Gly Ser Gly Ile Phe Lys
225 230 235 240
Ser Asp Asn Pro Ala Lys Phe Ala Lys Ala Ile Val Glu Ala Thr Thr
245 250 255
His Phe Thr Asp Tyr Lys Leu Ile Ala Glu Leu Ser Lys Glu Leu Gly
260 265 270
Thr Ala Met Lys Gly Ile Glu Ile Ser Asn Leu Leu Pro Glu Gln Arg
275 280 285
Met Gln Glu Arg Gly Trp
290
<210> 3
<211> 196
<212> PRT
<213> yaaE of 枯草芽孢桿菌Bacillus subtilis
<400> 3
Met Leu Thr Ile Gly Val Leu Gly Leu Gln Gly Ala Val Arg Glu His
1 5 10 15
Ile His Ala Ile Glu Ala Cys Gly Ala Ala Gly Leu Val Val Lys Arg
20 25 30
Pro Glu Gln Leu Asn Glu Val Asp Gly Leu Ile Leu Pro Gly Gly Glu
35 40 45
Ser Thr Thr Met Arg Arg Leu Ile Asp Thr Tyr Gln Phe Met Glu Pro
50 55 60
Leu Arg Glu Phe Ala Ala Gln Gly Lys Pro Met Phe Gly Thr Cys Ala
65 70 75 80
Gly Leu Ile Ile Leu Ala Lys Glu Ile Ala Gly Ser Asp Asn Pro His
85 90 95
Leu Gly Leu Leu Asn Val Val Val Glu Arg Asn Ser Phe Gly Arg Gln
100 105 110
Val Asp Ser Phe Glu Ala Asp Leu Thr Ile Lys Gly Leu Asp Glu Pro
115 120 125
Phe Thr Gly Val Phe Ile Arg Ala Pro His Ile Leu Glu Ala Gly Glu
130 135 140
Asn Val Glu Val Leu Ser Glu His Asn Gly Arg Ile Val Ala Ala Lys
145 150 155 160
Gln Gly Gln Phe Leu Gly Cys Ser Phe His Pro Glu Leu Thr Glu Asp
165 170 175
His Arg Val Thr Gln Leu Phe Val Glu Met Val Glu Glu Tyr Lys Gln
180 185 190
Lys Ala Leu Val
195
- 還沒有人留言評論。精彩留言會獲得點贊!