生防菌株HZ-9及其在防治大豆孢囊線蟲中的應用的制作方法
本發明涉及生物防治技術領域,尤其涉及生防菌株HZ-9及其在防治大豆孢囊線蟲中的應用。
背景技術:
大豆孢囊線蟲(Soybean cyst nematode,SCN)主要寄生在大豆(Glycine maxL.)上,Ichinohe于1952年首次將此線蟲與其他孢囊線蟲進行形態學比較,并將其命名為大豆孢囊線蟲(Heterodera glycines Ichinohe)。
至今,大豆孢囊線蟲已蔓延至世界上主要的大豆種植區,也是危害美國經濟最重要的植物病原生物(Wrather J A,Koenning S R.Estimates of disease effects on soybean yields in the United States 2003to 2005[J].Journal of Nematology,2006,38(2):173-180),在日本和中國東北部的大豆產區危害非常嚴重(簡恒.植物線蟲學[J].中國農業大學出版社,2011:89-94)。
在大豆孢囊線蟲的防治措施中,最基礎也是最經濟的防治方法是農業防治。種植抗病品種是國內外控制大豆孢囊線蟲危害,降低大豆產量損失的有效方法(De Bruin J L,Pedersen P.Response of old and new soybean cultivars to Heteroder aglycines Ichinohe[J].Agronomy Journal,2008,100(5):1347-1353),目前我國已獲得一些抗病大豆品種,如抗線1號、抗線2號、齊黃25、嫩豐15等(孔祥超,李紅梅,耿甜,黃文坤,彭德良.大豆種質資源對大豆孢囊線蟲3號和4號生理小種的抗性鑒定[J].植物保護,2012,38(1):146-150;徐文平,申宏波,苗興芬,姚文秋.大豆胞囊線蟲抗病種質鑒定[J].大豆科學,2007,26(3):377-380)。但是,如果在同一地區連續種植同一抗病品種,SCN毒性增強而導致大豆品種喪失抗性,
大豆種衣劑作為一種化肥和農藥復合劑,常被用于防治苗期大豆孢囊線蟲的危害(韓曉增,許艷麗.大豆連作減產主要障礙因素的研究Ⅱ.連作大豆土壤有害生物的障礙效應[J].大豆科學,1999,18(1):48-53;賈玉芹,蔣光勝,王曉彤.幾種種衣劑的應用效果[J].現代化農業,1995,(12):10-11)。由于這些化學藥劑一般毒性較高,在土壤中殘留時間較長,會對環境、人畜安全、糧食安全等一系列的副作用,同時,還會使大豆孢囊線蟲產生抗藥性,現在大都被禁用。。
植物線蟲的生物防治研究起步早,發展慢,目前大豆孢囊線蟲的生物防治的研究主要集中在真菌、細菌和抑制性土壤等幾個領域(尉文彬,武玉環,黃建明,鄭志興.大豆孢囊線蟲生物防治研究進展[J].河北農業科學,2013,17(5):56-58+99)。
目前關于大豆孢囊線蟲研究較多的是生防真菌,由于其種類多、易分離的特點,一些生防真菌成為人們關注的熱點,并被商品化應用于大田。
自1984年最早由Morganjones等人從大豆孢囊線蟲孢囊上分離到生防真菌以來,人們對篩選出的SCN的生防真菌的分類和防效做了大量研究(Morganjones G,Rodriguezkabana R,Tovar J G.Fungi associated with cysts of Heteroder aglycinesin the Cauca Valley,Colombia[J].Nematropica,1984,14(2):173-177)。
Carris等描述了定殖于大豆孢囊線蟲孢囊上的80種真菌,美國也已報道近百種的食線蟲真菌(Carris L M,Glawe D A,Smyth C A,Edwards D I.Fungi associated with populations of Heteroderaglycinesin 2illinois soybean fields[J].Mycologia,1989,81(1):66-75);而Chen等從孢囊上分離到了至少168種真菌(Chen F J,Chen S Y.Mycofloras in cysts,females,and eggs of the soybean cyst nematode in Minnesota[J].Applied Soil Ecology,2002,19(1):35-50)。
我國從不同地區的SCN的孢囊上分離到生防真菌共30個屬51種,其中以厚垣輪枝菌(V.chlamydosporium)、尖孢鐮刀菌(Fusariumoxysporum)、淡紫擬青霉菌(P.lilacinus)等出現頻率最高(李進榮,段玉璽,陳立杰,薛春生.大豆根瘤內生細菌對大豆胞囊線蟲影響研究[J].大豆科學,2005,24(2):154-156;林茂松.真菌寄生大豆孢囊線蟲的初步研究[J].生物防治通報,1990,6(1):38-41;劉杏忠,劉文敏,張東升.定殖于大豆胞囊線蟲的淡紫擬青霉生物學特性研究[J].中國生物防治,1995,11(2):23-27)。隨著近幾年對植物寄生線蟲的生防真菌研究的不斷深入,有研究者將食線蟲真菌分為捕食線蟲真菌、內寄生真菌、機會真菌和產毒真菌等(Barron G L.NematophagousHyphomycetes-new species of Harposporium[J].Antonie Van Leeuwenhoek Journal of Microbiology and Serology,1972,38(2):217-222)。
技術實現要素:
本發明提供了一種生防菌株HZ-9及其在防治大豆孢囊線蟲中的應用,該生防菌株HZ-9能夠有效防治大豆孢囊線蟲病。
所述的生防菌株HZ-9,命名為鉤狀木霉菌(Trichoderma hamatum)HZ-9,保藏編號為CCTCC NO:M 2016207,保藏時間為2016年4月19日,保藏地址為:中國武漢市武漢大學中國典型培養物保藏中心。
該生防菌株HZ-9的生物學特征為:呈絨毛狀菌落,菌絲不發達,分生抱子梗透明,壁光滑,主軸直,頂端逐漸變細,分生孢子綠色,橢圓形,長×寬大小范圍大為3.5-4.9μm×2.6-3.4μm。
生防菌株HZ-9的ITS序列如SEQ ID NO.1所示;生防菌株HZ-9的eEF1a1序列如SEQ ID NO.2所示。
本發明還提供了所述生防菌株HZ-9在防治農作物孢囊線蟲中的應用。
所述的農作物為大豆。
具體地,所述大豆的品種為合豐55。
所述的應用,包括:
(1)制備所述生防菌株HZ-9的生防菌劑;
(2)將所述的生防菌劑施用在所述的農作物上。
所述生防菌劑為生防菌株的孢子懸浮液、孢子懸浮液的稀釋液或生防菌株的發酵液。
作為優選,所述的生防菌劑中,所述生防菌株HZ-9的濃度為106~109CFU/mL。
具體地,以1升計,所述發酵液的液體培養基為玉米粉30g,葡萄糖20g,蒸餾水1000ml。
以1升計,所述孢子懸浮液的固體培養基為去皮馬鈴薯200g,葡萄糖20g,瓊脂20g,蒸餾水1000ml。
所述發酵液制備過程中的發酵條件為:28℃,100rpm振蕩培養10d。
與現有技術相比,本發明具有以下有益效果:
(1)本發明的生防菌株HZ-9為鉤狀木霉菌,其孢子懸浮液對大豆孢囊線蟲病有較好的防治效果,當孢子濃度達109cfu/ml,孢囊抑制率達到87.5%以上。
(2)本發明的生防菌株HZ-9菌落與大豆孢囊線蟲接觸48h后,幼蟲即失去活性;生防菌株HZ-9的發酵液能夠抑制孢囊或雌蟲內卵的孵化。
(3)本發明生防菌株HZ-9的孢子懸浮液和發酵液均能促進大豆的生長。
附圖說明
圖1為菌株培養濾液對卵孵化的影響。
圖2為菌株HZ-9的形態圖;
A.菌落特征;B-D.分生孢子梗和分生孢子。
圖3為菌株HZ-9的ITS區和eEF1a1區PCR擴增產物的電泳圖;
圖4為菌株HZ-9基于木霉屬ITS和eEF1a1合并序列構建的系統發育樹,分支上數字表示大于50%的Bootstrap檢驗值(1000次重復)。
圖5為菌株孢子懸浮液對不同線蟲的校正死亡率(%)。
圖6為不同濃度的孢子懸浮液對大豆孢囊線蟲病的防治效果。
圖7為盆栽試驗50d時,大豆孢囊線蟲在大豆根部的發育;
A,B:處理組;C,D:對照組。
圖8為菌株HZ-9不同濃度孢子懸浮液對大豆根鮮重和株高的影響。
圖9為溫度對菌株HZ-9的菌絲生長和產孢量的影響。
圖10為光照對菌株HZ-9的菌絲生長和產孢量的影響。
圖11為pH值對菌株HZ-9菌絲生長和產孢量的影響。
圖12為碳源對菌株HZ-9的菌絲生長和產孢量的影響。
圖13為氮源對菌株HZ-9的菌絲生長和產孢量的影響。
具體實施方式
下面結合具體實施例對本發明作進一步闡釋。
實施例1 大豆孢囊線蟲生防真菌的分離與篩選
一、大豆孢囊線蟲孢囊、二齡幼蟲和卵懸液的獲得
大豆孢囊線蟲采自浙江省杭州市、山西省太谷縣和安徽省宿州市大豆孢囊線蟲危害嚴重的地塊。
1、獲取大豆孢囊線蟲孢囊
將采集到的大豆根和病土放入淘洗桶中,充分混合后,加入適量的水淘洗均勻,使土樣完全溶解,靜置約10-20秒后,把懸浮液倒入在雙層篩子上(上層為20目,下層為100目),用強水流沖洗篩子。倒去上層20目網篩上的殘余物,用細水流把100目網篩上的沉積物中的泥沙沖去,剩余物用緩慢水流收集在一個干凈的燒杯中。在解剖鏡下用鑷子從中挑取新鮮飽滿的棕色孢囊,放入4℃冰箱備用。
將獲得的孢囊置于孵化池中,放在28℃生化培養箱中進行孵化,5天后將孵化池中的懸浮液通過500目篩,即可獲得較干凈的J2懸浮液。
2、獲取大豆孢囊線蟲二齡幼蟲和卵懸液
將上述收集好的孢囊置于一個直徑約3cm的小容器中,用玻璃棒底部將孢囊輕輕壓碎,然后倒在雙層目篩上(上層為100目,下層為500目)用強水流將卵和二齡幼蟲沖洗到下層篩子,收集下層篩子上的液體至50ml離心管中,并加入適量76%的現配的蔗糖溶液,2000rpm離心2min,然后將上層懸浮液倒在500目篩子上,用水流輕輕沖洗以除掉蔗糖即可獲得大豆孢囊線蟲卵的懸浮液,然后置于4℃冰箱保存備用(Acedo J R,Dropkin V H.Technique for obtaining eggs and juveniles of Heterodera glycines[J].Journal of Nematology,1982,14(3):418-420.)。
二、大豆孢囊線蟲生防真菌的分離
1、根際土壤中大豆孢囊線蟲寄生真菌的分離
每份土壤樣品稱取1g加入盛有99ml無菌水的三角瓶中置于搖床上200rpm,60min后,制備成土壤懸液,然后進行10-2、10-4、10-6和10-8的梯度稀釋,每個稀釋度吸取200μl土壤懸液在無菌條件下采用涂布法接種于含有100mg/L氨芐和硫酸鏈霉素的PDA培養基上,涂布均勻后,將平板倒置于25℃恒溫培養箱中暗培養。每個稀釋度重復3次,待菌落長出后進行分離純化(楊蕾,梁軍,周國英,倪楊,呂全,張星耀.土壤中楊樹潰瘍病生防菌的分離鑒定[J].西南農業學報,2015,51(4):116-124.)。
通過上述方法,得知當土壤混合液稀釋至10-6時,即可在PDA上發現單菌落,挑取新長出的新鮮菌絲轉移到新的PDA培養基上,進行純化培養;共獲得30個菌分離物,經保存后備用。
2、大豆孢囊線蟲孢囊上寄生真菌的分離
將上文收集到的孢囊用0.5%的次氯酸鈉消毒3min后,用無菌水沖洗三遍,在無菌培養皿底部墊上一張滅過菌的圓形定性濾紙,在濾紙上放置孢囊,封好皿蓋,并做好標記,25℃下保濕培養3d。3d后,挑出表面長有菌絲的孢囊,放在含硫酸鏈霉素和氨芐霉素的PDA固體培養基上,25℃培養。待長出菌落后,用挑針切取菌落邊緣的菌絲體轉至新的培養基平板中,25℃純化培養三次。通過上述方法,共篩選出34株真菌,經純化培養后,保存備用。
3、大豆孢囊線蟲二齡幼蟲和卵上寄生真菌的分離
將上文中收集到的二齡幼蟲和卵先用0.5%的次氯酸鈉消毒3min后,用無菌水清洗三 遍,制備二齡幼蟲和卵的懸浮液,然后進行10倍,100倍,1000倍稀釋。分別取原懸浮液、10倍稀釋液、100倍稀釋液、1000倍稀釋液200μl均勻涂布在含硫酸鏈霉素和氨芐霉素的PDA固體平板上,3d后挑取單菌落的菌絲置于新的平板上,25℃純化培養三次。通過上述方法,共分離出81株真菌,經純化培養后,保存備用。
上述三種方法篩選出的真菌,如下表1所示。
表1 大豆孢囊線蟲寄生真菌的分離
4、生防真菌的保存
挑取純化后的菌株,置于含硫酸鏈霉素和氨芐霉素的PDA斜面上培養2周后放于4℃冰箱進行短期保存;同時長期保存使用超低溫保存法,用1.5mL冷凍管滅菌后加入1mL冷凍保存液備用。從生長旺盛的菌落邊緣挑取約為0.5cm2的菌塊若干塊,直接放入冷凍保存管中。
加入菌塊的冷凍管先置于4℃冰箱預冷30min,再放入-20℃冰箱30-40min,再轉入-75℃冰箱保存備用。冷凍保存液的配方如下(1L):15%甘油(v/v),葡萄糖10g,酵母提取物1g,酪蛋白水解物1g,高壓滅菌后備用。
三、生防菌株的篩選(HZ-9來自大豆根際土壤)
1、菌株對大豆孢囊線蟲孢囊的寄生性
對挑取出的菌株,選取菌落形態不同的真菌,進行大豆孢囊線蟲孢囊寄生性的鑒定,按上文的方法獲得孢囊,用0.5%NaClO表面消毒3min,用無菌水清洗三遍。
將純化后的菌株轉至PDA培養基上,待菌落直徑長至培養皿1/2-3/4時,將消毒后的孢囊放入PDA培養基上新鮮菌絲的邊緣,每皿放置10個孢囊,每個菌株設置三個生物學重復。放置在25℃的生化培養箱中培養10d,將孢囊輕輕挑出(注意不要弄破孢囊),用0.5%NaClO表面消毒3min,無菌水清洗三遍,每個孢囊放于一個滅菌的濾紙片上,保濕培養5d。5d后觀察濾紙片上長菌的情況,記錄孢囊被寄生的情況。
從篩選出的145株真菌菌株中,選取菌落形態和孢子形態不一致的33株真菌進行回接孢囊的實驗,測定所篩選的菌株對孢囊的寄生性。
所選取的33株真菌中,大部分真菌菌株都能進行回接孢囊,其中侵染率達到100%的菌株有7株,分別是:HZ-L9,TG-9,HZ-7,HZ-L21,TG-L37,TG-3和AH-8;侵染率大于90%的菌株有10株,分別為:HZ-3,HZ-4,HZ-5,HZ-L23,HZ-L26,TG-13,TG-17,AH-3,TG-1和HZ-9;侵染率大于80%的菌株有11株,分別為:HZ-L25,HZ-L18,HZ-L7,HZ-L5,AH-L16,TG-15,TG-L8,AH-L7,AH-L6,HZ-1和HZ-9;侵染率小于80%的有5株,分別為HZ-L4,AH-1, TG-L5,AH-L15和TG-6。
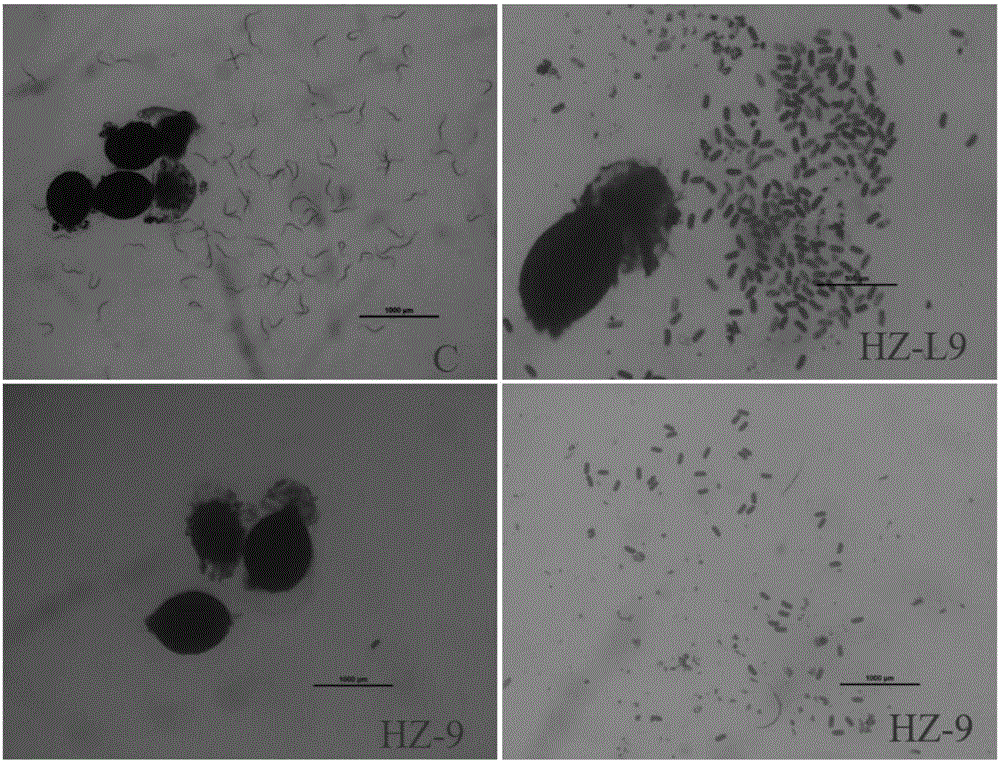
2、菌株對大豆孢囊線蟲二齡幼蟲毒性的初步測定
將純培養的菌株接種在含硫酸鏈霉素和氨芐霉素的PDA固體培養基平板上(90mm無菌培養皿),25℃生化培養箱中培養2-3d后,在菌落邊緣接入20μL二齡幼蟲懸浮液(約200條),分別于24h,48h后顯微鏡下觀察被菌絲粘著和穿透及隨后被消化的情況,同時在不接菌的PDA培養基上也接入同樣多的線蟲作為對照,每個處理設置三個生物學重復。
對上述菌株進行大豆孢囊線蟲二齡幼蟲致病性的初步篩選,結果顯示,進行測定的33株菌株中,其中HZ-4,HZ-9,HZ-L9,TG-1,TG-15,TG-L37及AH-8菌株對大豆孢囊線蟲二齡幼蟲的活動能力有影響,蟲體接觸菌絲后,線蟲行動自由度降低;HZ-L9及HZ-9菌落與幼蟲接觸后,幼蟲在24h后即失去活性,48h以后被菌絲覆蓋;TG-1,TG-15及AH-8在菌絲接觸蟲體48h后線蟲蟲體才開始僵直,而其他菌株菌絲對大豆孢囊線蟲二齡幼蟲沒有毒殺作用,蟲體48h后仍能活動自由。
3、菌株發酵液對孢囊或雌蟲內卵孵化的影響
將菌株接種于盛有150ml玉米粉液體培養基的250ml的三角瓶中,28℃、100rpm振蕩培養10d,培養液經滅菌的雙層擦鏡紙過濾除去菌絲團,然后4℃12000rpm離心20min,上清液通過直徑0.22um的微孔濾膜,即得菌株發酵液,保存在4℃冰箱備用。
在24孔培養基中每孔加入1ml的菌株發酵液,另加入5個雌蟲,無菌水做對照,每個菌株的發酵液及對照均設6個重復,將24孔細胞培養板放置在28℃生化培養箱中,稀釋0x、5x、10x、20x五個濃度梯度,每皿加入500μL,用無菌水做對照,重復三次,并用封口膜封嚴,防止水分蒸發和雜菌污染。置于25℃培養箱中10d。觀察記錄孵化出的線蟲數,計算孵化相對抑制率。
采用上述方法檢測菌株發酵液對大豆孢囊線蟲卵孵化的影響,首先分別用33株菌株的發酵液原液測定其對大豆孢囊線蟲卵孵化的影響,結果可知,菌株HZ-L9,HZ-9,HZ-L26,AH-1,AH-L6,TG-L5,TG-16對大豆孢囊線蟲孢囊或雌蟲內卵的孵化有抑制作用,其中菌株HZ-L9和菌株HZ-9的發酵液原液基本不能使孢囊或雌蟲內的卵孵化(圖1)。
通過對菌株HZ-L9和菌株HZ-9的發酵液原液進行5x,10x,20x稀釋,以無菌水作對照,再次測定其稀釋液對卵孵化的影響,發現所獲取的兩株目的菌株的發酵液對大豆孢囊線蟲卵的孵化有一定的抑制作用(見表2和3),并且各稀釋濃度的發酵液以及無菌水處理之間,對線蟲孵化影響差異顯著,其中發酵液原液處理,幾乎沒有線蟲孵化;20x稀釋時,兩菌株對孢囊或雌蟲內卵的孵化抑制率分別達到47.75%和45.87%,顯示較好的抑制作用。
表2 HZ-L9發酵液不同稀釋倍數對大豆孢囊線蟲卵孵化的影響
注:不同大、小寫英文字母分別表示差異極顯著(P≤0.01)和差異顯著(P≤0.05),字母相同者為差異不顯著。
表3 鉤狀木霉(HZ-9)發酵液不同稀釋倍數對大豆孢囊線蟲卵孵化的影響
注:不同大、小寫英文字母分別表示差異極顯著(P≤0.01)和差異顯著(P≤0.05),字母相同者為差異不顯著。
實施例2 生防菌株的鑒定
一、形態鑒定
將保存于4℃PDA培養斜面中的菌株移入直徑90mm的PDA平板上,28℃生化培養箱中活化3-5d,用直徑14mm的打孔器在菌落邊緣切取菌塊,轉接到新的PDA平板上,28℃生化培養箱中恒溫培養,3次重復。逐日觀察記錄菌落形態、顏色及生長狀況。
待上述菌落培養3d后,用電子顯微鏡(LEICA DMI 3000B,德國徠卡)觀察菌絲、分生孢子梗、分生孢子等的形態特征,統計100個孢子的長、寬,計算其長寬比。根據木霉屬真菌菌落形態、孢子特征,對其進行初步鑒定。
菌株HZ-9在PDA呈絨毛狀菌落,菌絲不發達,分生抱子梗透明,壁光滑,主軸直,頂端逐漸變細,分生孢子綠色,橢圓形,長×寬大小范圍大約3.5-4.9μm×2.6-3.4μm(圖2)。
二、分子生物學鑒定
1、DNA的提取方法
用解剖刀刮取PDA平板上25℃生化培養箱中培養了3d的菌絲,將其放置于含有石英砂的振蕩管中,每管加入800μl CTAB抽提液,用振蕩器震蕩90s,65℃水浴孵育1-2h,加入等體積的氯仿-異戊醇(24:1)混勻,10000rpm離心15min,取上清液(約750μl)轉入2ml離心管中,加入等體積的酚-氯仿-異戊醇(25:24:1)混勻,12000rpm離心20min,取上清液(約450μl)至1.5ml離心管中,加入2/3體積的異丙醇混勻5min,12000rpm離心10min,棄上清,加入200μl 70%的乙醇清洗,12000rpm離心1-2min,倒光液體,晾干沉淀,加入30μl TE水懸浮溶解沉淀,即可獲得DNA。
2、ITS序列和eEF1a1片段的擴增
以基因組DNA為模板,用真菌通用引物ITS1和ITS4擴增ITS區的片段以及引物tef71f和tef997R擴增eEF1a1片段(Shoukoui E,Bissett J.Preferred primers for sequencing 50end of the translation elongation factor 1-alpha gene(EF1-a1)and subnit 2of the RNA ploymerase B gene(RPB2)ISTH available from:http://isth.info/methods,2008.)。
實驗所用PCR擴增試劑盒購自大連寶生物工程有限公司(Takara)。引物均由英濰捷基 (上海)貿易有限公司合成。
PCR擴增采用50μl反應體系,各試劑用量如下:
引物序列:
ITS1 5’-TCCGTAGGTGAACCTGCGG-3’
ITS4 5’-TCCTCCGCTTATTGATATGC-3’
tef71f5’-CAAA ATG GGT AAG GAG GAS AAGAC-3’
tef997R5’-CA GTA CCG GCR GCR ATR ATS AG-3’
擴增ITS區的反應程序:94℃預變性3min;94℃變性30s,56℃退火45s,72℃延伸1min,35個循環;72℃延伸10min,8℃永久保存。
擴增eEF1a1片段采用‘touchdown’擴增程序:首先94℃預變性4min,然后4個循環:94℃變性1min,70℃退火1min30s,72℃延伸1min30s;26個循環:94℃變性1min,68℃(每經過一個循環降低0.5℃)退火1min30s,72℃延伸1min30s;12個循環:94℃變性1min,55℃退火1min30s,72℃延伸1min30s;72℃延伸7min,8℃保存。
PCR程序完成后取2μl PCR產物加入3μl 6×Loding buffer混勻后,用1.0%的瓊脂糖凝膠電泳分離(120V,400mA,25min)。電泳后經EB染色10-15min,在紫外檢測儀上觀察和拍照。
3、PCR產物的純化
選用浙江愛思進生物技術公司(AxyGen)的AxyPrep DNA凝膠回收試劑盒進行PCR產物的回收、純化。
4、純化產物的連接
PCR純化產物可直接與pUCM-T連接,采用10μl反應體系,依次加入:
12000rpm離心10秒,置4℃連接過夜或16℃連接4小時。
5、連接產物的轉化
(1)從-70℃冰箱中取100μl大腸桿菌DH 5α感受態,1min冰上解凍;
(2)向離心管中加入10μl的上述連接溶液,輕輕攪拌均勻,冰上放置20-30min;
(3)42℃水浴中熱擊90s,熱擊后迅速置于冰上冷卻5min;
(4)向管中加入1ml LB液體培養基(不含Amp),混勻后37℃振蕩培養40min;
(5)1500rpm離心2min,去上清800μl,吹打混勻剩余液體,吸取200μl涂布于含Amp,X-gal和IPTG篩選平板上,正面向上放置半小時,待菌液完全被培養基吸收后倒置培養皿,37℃培養16-24h。
6、重組質粒的PCR鑒定
將菌液直接用于PCR鑒定,步驟如下:
(1)100ml LB液體培養基中加入100μl氨芐霉素(100mg/ml)
(2)用0.2μl無菌eppendorf管挑取白色單菌落接種到含有氨芐霉素的2ml LB培養液中,振蕩培養(37℃,180rpm)約12h;
(3)取2μl上清用于PCR鑒定(25μl反應體系)。
7、DNA序列測定與分析
每個平板挑取3個陽性克隆送生工生物(上海)科技有限公司測序。測序結果用DNAstar進行編輯,運用木霉鑒定在線網站(http://www.isth.info)上的7Hc/70KEY和TWcABLAST對序列進行比對分析。
菌株HZ-9的rDNA–ITS(SEQ ID NO.1)和eEF1a1片段(SEQ ID NO.2)經PCR克隆、測序,結果如圖3,菌株HZ-9的rDNA–ITS(SEQ)和eEF1a1片段大小分別為600bp和760bp,運用木霉菌鑒定在線網站(http://www.isth.info)上的7Hc/70KEY和TWcABLAST對序列進行比對分析可知,菌株HZ-9的兩個片段均與Trichoderma hamatum有高度同源性。
三、系統發育分析
將由DNAStar軟件編輯后的序列在GenBank中進行Blast比對,根據序列同源性下載相關序列。下載的序列用Mega 6.0軟件Clustal W程序進行多序列聯配,對聯配結果進行系統發育分析,以鄰接法(N-J)構建系統進化樹,用Bootstrap對系統樹進行檢驗,1000次重復。
選擇GenBank中Trichoderma屬已公布的種的ITS序列和eEF1a1序列(見表4),用Mega 6.0軟件對rDNA–ITS和eEF1a1片段合并后序列進行聚類分析,并分別以鉤狀木霉Trichoderma hamatum、里氏木霉Hypocrea lixii作為外群,經Clustal W匹配排列后,用Mega6.0軟件N–J法分別構建系統發育樹,從圖4可知菌株HZ-9與Trichoderma hamatum在同一分支,親緣關系最近。
表4 用于多基因序列分析的木霉屬菌株
綜上所述,結合形態學和分子生物學鑒定結果,將菌株HZ-9鑒定為鉤狀木霉(T.hamatum)。
將上述菌株HZ-9進行菌種保藏,該生防菌株命名為鉤狀木霉菌(Trichoderma hamatum)HZ-9,保藏編號為CCTCC NO:M 2016207,保藏時間為2016年4月19日,保藏地址為:中國武漢市武漢大學中國典型培養物保藏中心。
實施例3 生防菌株孢子懸浮液對不同線蟲的毒殺作用
南方根結線蟲(Meloidogyne incognita)二齡幼蟲(juvenile 2)為長期在番茄上純培養獲得,挑取番茄根部南方根結線蟲的卵囊置于孵化器中進行孵化,兩天后即可獲得大量干凈的 南方根結線蟲(J2)懸浮液,然后配成每10ul含100條J2的懸浮液4℃冰箱保存備用。
甘薯莖線蟲(Ditylenchus destructor)、松材線蟲(Bursaphelenchus xylophilus)、水稻干尖線蟲(Aphelenchoides bessyi)均為長期培養在灰葡萄菌上的半寄生性線蟲,將線蟲接種在長滿灰葡萄菌的PDA培養基上,一個月后,向皿中加入5ml無菌水即可獲得干凈的線蟲濾液,然后配成每10μl含100條J2的線蟲懸浮液4℃冰箱保存備用。
1、菌株孢子懸浮液的制備及計數
從保存菌株的斜面上用滅菌的挑針挑取菌絲接種到含有硫酸鏈霉素和氨芐霉素的PDA平板中央,置于28℃生化培養箱中培養1周后,加入6ml滅菌水到PDA平板表面,用滅過菌的三角棒刮取菌株的菌絲和孢子,所獲得的懸浮液通過滅過菌的雙層紗布過濾除去菌絲即得干凈的孢子懸浮液。
用型號為XB-K-25的血球計數板對孢子懸浮液進行計數,將孢子懸浮液充分混勻,根據實際情況稀釋10倍到100倍或不稀釋,首先將混勻后的孢子懸浮液用滴管滴在中央平臺上,蓋上蓋玻片,在低倍鏡下找到方格網后,轉換至高倍鏡下進行觀察和計數,通常檢查5個中格內的孢子數,5個中格分別在四個角上和中央,計數的方格多分布在不同的方位上,可以避免孢子在各個方位上分布不均所造成的誤差。計數后,用無菌水調至所需濃度放于4℃冰箱保存備用。
2、生防菌株孢子懸浮液(濃度為108/ml)對線蟲毒殺作用的測定
將大豆孢囊線蟲二齡幼蟲的懸浮液配成每10μl含100條J2的懸浮液,用無菌的24孔細胞培養皿,加入500μl事先準備好的孢子懸浮液,以無菌水做對照,每個處理3個生物學重復,每孔中加入10μl配置好的J2懸浮液或者其他供試線蟲懸浮液,48h后觀察并計算擊倒率。
菌株HZ-9對供試的幾種植物病原線蟲均具有一定的活性,其對大豆孢囊線蟲校正死亡率達到83.3%;對松材線蟲校正死亡率達到85.6%;對甘薯莖線蟲和南方根結線蟲的毒殺作用相對較差,校正死亡率分別為64.0%和58.3%(圖5)。
實施例4 生防菌株的盆栽防效試驗及其生物學特性
一、實驗材料
(1)菌株:HZ-9;
(2)供試大豆品種:大豆孢囊線蟲感病品種合豐55;
(3)供試大豆孢囊線蟲:采自安徽省宿州市大豆孢囊線蟲危害嚴重的地塊,經多年純培養獲得;
(4)半乳糖、可溶性淀粉、蔗糖、甘露糖、果糖、麥芽糖、葡萄糖、山梨醇、蔗糖;氯化銨、谷氨酰胺、胰蛋白胨、牛肉浸膏、硝酸鈉、酵母膏、脯氨酸、甘氨酸、硫酸銨購買于生工生物(上海)科技有限公司。
二、實驗方法
制備生防菌株HZ-9的孢子懸浮液(方法同實施例2),用無菌水分別把菌株的孢子懸浮液稀釋成109cfu/ml、108cfu/ml、106cfu/ml、104cfu/ml、102cfu/ml的不同梯度。
大豆種子放入0.5%次氯酸鈉溶液中,用玻璃棒攪拌4min,然后用無菌水徹底沖洗3次后,將大豆在無菌水中浸泡1h以去除殘留的次氯酸鈉,然后置于放有一層無菌濾紙的大培養皿中(直徑15cm),大豆上再覆蓋一張浸濕無菌濾紙,蓋好培養皿后置于25℃培養箱中黑暗培養。
期間每天用無菌水沖洗大豆并注意保濕培養,培養箱中溫度設置在25℃,16h光照,8h黑暗處理,濕度60%,光照100%。5天后,當根大約4-5cm長時,挑選長勢一致的幼芽移栽到盛有350cm3無菌細沙的塑料杯中(直徑12cm),然后將所有的塑料杯都放入塑料箱中(550×350×90mm)培養。
待幼苗長出3天后,每個杯中接入15ml所設定的不同濃度的孢子懸浮液。接種菌懸液2d后接種線蟲,每株接種1500個卵。用直徑0.5cm的玻璃棒在大豆根部周圍土壤打3-4個3cm深的小洞。將配制好的含1500個卵的線蟲懸浮液4ml注入小洞中,并用沙子封上。每個菌懸液濃度處理重復4次,以無菌水代替菌懸液作對照處理。
接種線蟲后,每隔7天澆一次設定濃度的孢子懸浮液(109cfu/ml、108cfu/ml、106cfu/ml、104cfu/ml、102cfu/ml)或發酵液原液。50天后計數大豆根部和土壤中雌蟲數量以及根上線蟲數,計算孢囊抑制率。
接種線蟲50d后,采用次氯酸鈉-酸性品紅染色方法,對大豆根部線蟲進行染色。將洗凈的病根放入150ml的小燒杯中,在燒杯中加入50ml蒸餾水,并加入適量5.25%的次氯酸鈉(次氯酸鈉的用量取決于根組織的幼嫩程度),用玻璃棒不斷攪拌4min后取出根,用水流沖洗45s,將根組織浸泡在蒸餾水中15min,以徹底去除次氯酸鈉,倒去蒸餾水,將根組織放在盛有30-50ml蒸餾水的燒杯中,并加入1ml的酸性品紅溶液,微波爐中煮沸30s,冷卻后,用蒸餾水漂洗根組織,將根組織放入20-30ml酸性甘油(在純甘油中滴加2-3滴5mol/L的鹽酸)中煮沸使根組織褪色(注意不要煮沸過度,否則根組織易變黃),待冷卻后,取出根組織在體視顯微鏡下觀察。
待大豆苗生長50d后,調查大豆根部的孢囊數量,并計算不同處理對大豆孢囊線蟲的抑制率:孢囊抑制率(%)=(對照組孢囊數量-處理組孢囊數量)/對照組孢囊數量×100%。
大豆根部孢囊數量的調查結束后,測量全部植株的株高和根鮮重。
試驗數據經SAS軟件和Excel 2013軟件統計,并采用單因素方差分析(One Way ANOVA)進行差異顯著性分析。
1、溫度對菌絲生長和產孢量的影響
采用菌碟接種法,即用直徑為14mm的打孔器,從培養了3d的PDA平板上的菌落邊緣打出菌碟,將菌碟接種于新的PDA平板上,分別置于15℃、20℃、25℃、28℃、30℃、35℃生化培養箱內培養,每個溫度為1個處理,每個處理4次重復,培養2d后觀察菌落生長狀況,十字交叉法測量菌落直徑,并于5d后檢查其產孢量。
2、光照對菌絲生長和產孢量的影響
打取菌碟后,接種于PDA平板上,28℃下分別置于24h光、12h光12h暗、24h暗下培養,每種光照條件為1個處理,每個處理4次重復。培養2d后觀察菌落生長狀況,十字交叉法測量菌落直徑,并于5d后檢查其產孢量。
3、pH對菌絲生長和產孢量的影響
將高壓滅菌后的PDA培養基在超凈工作臺中,用l mol·L-1的HCl和lmol·L-1的NaOH配置pH值分別為4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0的PDA培養基,制成90mm的平板,打取菌碟放在平板中央,每個pH值為1個處理,每個處理4次重復。培養2d后觀察菌落生長狀況,十字交叉法測量菌落直徑,5d后檢查其產孢量。
4、不同碳源對菌絲生長和產孢量的影響
以查氏培養基(NaNO3 2.00g,K2HPO4 1.00g,KCl 0.50g,MgSO4·7H2O 0.50g,FeSO40.01g,蔗糖30.00g,加水定容至1000ml)為基礎培養基。以NaNO3為氮源,測定半乳糖、可溶性淀粉、甘露醇、果糖、麥芽糖、葡萄糖、山梨醇、蔗糖對菌株生長的影響,以無碳源查氏培養基為對照,每個處理4次重復。培養2d后觀察菌落生長狀況,十字交叉法測量菌落直徑,5d后檢查其產孢量。
5、不同氮源對菌絲生長和產孢量的影響
以查氏培養基為基礎培養基。以蔗糖為碳源,測定甘氨酸、谷氨酰胺、脯氨酸、酵母膏、硫酸銨、牛肉浸膏、胰蛋白胨、氯化銨、硝酸鉀對菌株生長的影響,以無氮源查氏培養基為對照,每個處理4次重復。培養2d后觀察菌落生長狀況,十字交叉法測量菌落直徑,5d后檢查其產孢量。
二、實驗結果
1、生防菌株孢子懸浮液或發酵液原液對大豆孢囊線蟲病的防治效果
在盆栽大豆苗根部土壤中施用不同濃度的孢子懸浮液50d后,統計大豆根部和土壤中的白雌蟲和孢囊數量,計算目的生防真菌對大豆孢囊線蟲引起的大豆孢囊線蟲病的孢囊抑制率;通過酸性品紅染色法統計大豆根部不同齡期的線蟲數,觀察處理組與對照組根部線蟲減少情況。
圖6為生防真菌鉤狀木霉(HZ-9)對大豆孢囊線蟲病防治效果的評估。
與對照相比,鉤狀木霉(HZ-9)孢子懸浮液濃度在106-109時,防治效果較好,且孢囊抑制率最高達到87.5%。
圖7為盆栽試驗50d后,孢子懸浮液處理與用無菌水處理的大豆孢囊線蟲侵染的大豆根部線蟲侵染狀況,,與對照相比,根上線蟲最高減少96%,說明所篩選出的生防菌株的孢子懸浮液在盆栽試驗中對大豆孢囊線蟲具有抑制作用。
2、生防菌株不同濃度孢子懸浮液對大豆株高和根鮮重的影響
對50d后大豆的根鮮重和大豆株高進行統計分析,來衡量目的生防真菌對大豆長勢的影響。
鉤狀木霉(HZ-9)不同濃度孢子懸浮液對感染了大豆孢囊線蟲病的大豆根鮮重和株高的 影響結果(圖8)。
施用鉤狀木霉孢子懸浮液處理組與對照組相比,大豆植株的根鮮重和植株高度會有不同程度的增加。
總之,生防菌株在盆栽試驗中對大豆孢囊線蟲的孢囊和二齡幼蟲均有抑制作用,且對大豆的生長有一定的促進作用。
3、生防菌株HZ-9發酵液對大豆孢囊線蟲病的防治效果以及對大豆株高和根鮮重的影響如表5所示,菌株HZ-9的發酵液對大豆孢囊線蟲病有較好的防治效果,將發酵液原液施用于大豆盆栽試驗中,孢囊抑制率最高達到88.9%,根上線蟲數量與對照相比最高減少75%,同時,與對照相比,大豆的株高有一定的增加,處理組根鮮重與對照組相當。
表5 生防菌株HZ-9發酵液對大豆孢囊線蟲病的防治效果以及對大豆株高和根鮮重的影響
4、溫度對菌絲生長和產孢量的影響
溫度對鉤狀木霉HZ-9菌絲生長和產孢量的影響,如圖9所示。
溫度對菌株HZ-9的生長影響有一定的差異,其中,菌株HZ-9在溫度為35℃時不生長,在溫度為25-28℃時生長最好,但在溫度為15℃和35℃時均不產孢,溫度為28℃時產孢量最大。
5、光照對菌絲生長和產孢量的影響
圖10為光照條件對鉤狀木霉HZ-9菌絲生長和產孢量的影響。
光照條件對鉤狀木霉菌絲生長的影響不大,但對產孢量有一定影響,24h全光照時,產孢量最大,達到2.4×109個,而光照和黑暗交替培養時,最不利于鉤狀木霉產孢。
6、pH值對菌絲生長和產孢量的影響
圖11為不同pH值對鉤狀木霉HZ-9菌絲生長和產孢量的影響。
鉤狀木霉在pH值為6時,生長和繁殖達到最佳,但鉤狀木霉的產孢對堿性環境較為敏感,在pH值為11.0時基本上不產孢。
7、碳源對菌絲生長和產孢量的影響
圖12為碳源對鉤狀木霉HZ-9的菌絲生長和產孢量的影響。
8種碳源與無碳對照相比菌絲生長和產孢量均有一定的差異,不同碳源對菌絲生長只存在很小的差異,鉤狀木霉在以可溶性淀粉作為碳源的培養基上生長最快,同時在以半乳糖為碳源的培養基上產孢量最大,達到4.8×108個。
8、氮源對菌絲生長和產孢量的影響
圖13為氮源對鉤狀木霉(HZ-9)菌絲生長和產孢量的影響。鉤狀木霉在以酵母膏為氮源的培養基上生長和繁殖最好,5d時其產孢量最高能達到0.4×108個。
- 還沒有人留言評論。精彩留言會獲得點贊!