含有與前列腺抗原特異性結合短肽的噬菌體及其應用的制作方法
本發明涉及生物技術和免疫分析技術領域,具體地說是含有與前列腺抗原特異性結合短肽的噬菌體及其應用。
背景技術:
前列腺疾病是男科最常見的疾病,包括前列腺炎、前列腺增生及前列腺癌等,其中前列腺癌是男性癌癥患者中最常見的惡性腫瘤之一。隨著生活水平的提高以及社會人口老齡化加重,前列腺癌的發病率逐年遞增趨勢更為明顯。因此,前列腺癌早期快速、準確的檢測具有十分重要的意義。
前列腺癌的主要診斷方法有前列腺特異性抗原系列檢測,影像學檢查,直腸指檢,穿刺活體組織檢查等。其中前列腺特異性抗原作為前列腺癌的腫瘤標記物已廣泛應用于前列腺癌的早期診斷、療效評估以及手術治療的跟蹤指標、預后判斷等。前列腺抗原(PSA)具有高度組織來源特異性,正常狀態下,PSA僅存在于前列腺組織、精液、前列腺液中,血液中PSA含量極低。當前列腺發生炎癥或是癌變等病變時,前列腺組織會大量分泌PSA,并使其進入血液中,使血清中PSA含量升高。在血清中,PSA可以與含有絲氨酸蛋白酶抑制基團的的復合物共價結合形成復合物,因此血液中的PSA是以多種分子形態存在的。其中約10%~30%的前列腺特異性抗原以游離態的形式存在,即游離的PSA(free PSA,f-PSA);約70%~90%的前列腺特異性抗原與內源性蛋白酶抑制物α1-抗糜蛋白酶(α1-antichymotrypsin,ACT)結合形成前列腺特異性抗原-α1-抗糜蛋白酶復合物(PSA-ACT)。臨床上通常以f-PSA與PSA-ACT的和作為總PSA(t-PSA),代表血清中的PSA水平。確定fPSA/tPSA比值,對前列腺癌的診斷、鑒別以及確定前列腺疾病性質具有非常重要的意義前列腺特異性抗原的傳統檢測方法主要有放射免疫檢定法、免疫放射測定法、化學發光免疫分析法、金標免疫層析法、時間分辨熒光免疫分析法和酶聯免疫分析法(ELISA)等。這些檢測方法都是基于抗原與單克隆抗體之間的特異性免疫反應,借助于放射標記、化學發光、熒光分析等方法完成檢測的。近些年來,為提高前列腺特異性抗原的檢測靈敏度,加強前列腺癌的早期診斷,一些新型的PSA檢測方法不斷被科學家們研究探索,同樣是基于抗原與單克隆抗體之間的特異性免疫反應,實現PSA的高靈敏檢測。ELISA在免疫分析技術中表現出的高特異性和高靈敏度使其成為腫瘤標記物檢測中非常實用的檢測工具。基于ELISA試劑盒的PSA檢測已經成為一種常規的檢測手段。近二十年來,眾多學者致力于前列腺抗原高特異性、高靈敏度單克隆抗體的篩選,并應用于ELISA試劑盒的研發。
噬菌體展示技術是將外源蛋白或多肽的DNA序列插入到噬菌體外殼結構蛋白基因的特定位置,使外源基因表達產物融合于結構蛋白的N端或C端,隨噬菌體的組裝而將外源蛋白或多肽展示到噬菌體表面的生物技術。噬菌體展示技術已廣泛應用于生物科學技術的各個領域。絲狀噬菌體是一類能夠感染革蘭陰性細菌的細菌病毒,主要包括M13、f1和fd噬菌體。基于噬菌體展示技術構建展示文庫,可為諸多蛋白靶分子提供一個豐富的配體篩選資源,目前噬菌體展示文庫主要有隨機肽庫和抗體文庫。噬菌體展示隨機多肽文庫的構建是將特定長度的編碼多肽的隨機寡核苷酸序列插入到噬菌體基因的特定位點,使特定長度的不同序列的外源多肽展示于噬菌體表面。Petrenko與Smith等人以絲狀噬菌體fd-tet為基礎,構建出f8/8風景噬菌體文庫。將編碼隨機八肽的寡核苷酸序列取代編碼噬菌體pVIII蛋白N端Glu-Gly-Glu(E2-G3-E4)的核酸序列,將隨機八肽展示于噬菌體表面。f8/8風景噬菌體文庫中含有約3.0×109個展示有不同八肽序列的噬菌體克隆,而每種八肽序列在單一噬菌體的表面有近4000份相同的拷貝。f8/8風景噬菌體克隆應用于免疫分析檢測具有很大的優勢。噬菌體有極高的效價可以與靶標多價結合,噬菌體的制備簡單、快速,特異性噬菌體克隆一經淘選獲得后即可無限量培養擴增,成本廉價,噬菌體可經得起嚴酷的生存環境,在很寬的pH范圍內穩定,能經得起核苷酶的處理,具有極好的耐溫性,噬菌體在非水溶劑中穩定。鑒于上述眾多優點,風景噬菌體作為一種新型的特異性探針應用于ELISA免疫分析領域中,必然具有良好的發展前景。
技術實現要素:
本發明的目的是提供含有與前列腺抗原特異性結合短肽的噬菌體及其應用。
為實現上述目的,本發明采用的技術方案為:
一種與前列腺抗原特異性結合的短肽,短肽的氨基酸序列F1為ERNSVSPS或F2為ATRSANGM。
所述短肽F1特異性識別f-PSA;F2同時識別f-PSA和PSA-ACT,即t-PSA。
一種與前列腺抗原特異性結合短肽的篩選方法,以游離態的前列腺抗原作為靶標對噬菌體文庫進行生物淘選獲得的噬菌體單克隆;而后以腫瘤標記物為靶標,通過噬菌體捕獲實驗進行特異性結合評價,確定特異性識別前列腺抗原的噬菌體單克隆,展示于該噬菌體單克隆表面的多肽即為前列腺抗原特異性結合的短肽。
所述前列腺抗原是游離態的前列腺特異性抗原(free PSA,f-PSA)和f-PSA與前列腺特異性抗原-α1-抗糜蛋白酶復合物(PSA-ACT)的和(總PSA,t-PSA)。
一種與前列腺抗原特異性結合短肽的應用,所述短肽作為前列腺抗原特異性配體探針。
所述特異性配體探針用于前列腺抗原的檢測。
所述短肽作為特異性配體探針采用夾心ELISA法對f-PSA和t-PSA進行相應檢測。
一種含有與前列腺抗原特異性結合的短肽的噬菌體,噬菌體為含有所述F1或F2短肽的噬菌體單克隆體。
所述的噬菌體單克隆是通過以游離態的前列腺抗原作為靶標對噬菌體文庫進行生物淘選獲得的噬菌體單克隆,具體方法是將f-PSA(Meridian Life Science)包被于96孔酶標板上,加入噬菌體文庫,孵育;洗去沒有靶標結合特性的噬菌體,保留具有靶標結合特性的噬菌體;再用弱酸洗脫具有靶標結合特性的噬菌體,感染饑餓細胞進行噬菌體滴度測定,結果作為第一輪淘選特異性噬菌體的輸出量。按照上述淘選步驟依次進行第二輪、第三輪生物淘選,測定每一輪淘選的噬菌體文庫的輸入量、輸出量,并計算每一輪淘選的回復率。以f-PSA為靶標進行三輪淘選后,將第三輪洗脫的噬菌體進行梯度稀釋,稀釋梯度為10-1、10-2、10-3、10-4,然后進行平板涂布,37℃過夜培養。選擇合適的噬菌體濃度梯度,使用無菌牙簽從過夜培養的平板上隨機挑選多個噬菌體單克隆,按照PCR條件進行菌落PCR,瓊脂糖凝膠電泳對PCR產物進行鑒定。鑒定后的PCR產物送至北京六合華大基因科技股份有限公司測序。運用BioEdit軟件對測序序列分析,獲取噬菌體表面展示的多肽序列。其中T1展示的八肽序列是ERNSVSPS,T2展示的八肽序列是ATRSANGM。
以腫瘤標記物AFP、hK-2、CA125、CA15-3、CA19-9作為對照靶標,通過噬菌體捕獲實驗進行特異性結合評價,確定特異性識別前列腺抗原的噬菌體單克隆,具體方法是分別以f-PSA、PSA-ACT、AFP、hK-2、CA125、CA15-3、CA19-9包被96孔酶標板(以空白孔作為空白對照);加入噬菌體單克隆106TU,4℃,16h過夜與之孵育;洗去未被包被抗原捕獲的噬菌體,漂洗10次,每次10min,再用弱酸洗去被靶標捕獲的噬菌體,經Tris-HCl中和后,感染饑餓細胞,進行滴度測定,分別測試不同抗原捕獲的噬菌體數量,并計算回復率進行比較。T1僅對f-PSA表現出很高的親和性和特異性,其識別特性為識別f-PSA。T2對f-PSA響應的同時,還可識別PSA-ACT,而且明顯高于其它抗原和空白對照,其識別特性可確定為識別f-PSA和PSA-ACT,即t-PSA。
上述噬菌體文庫的一個優選例是f8/8風景噬菌體文庫。
上述噬菌體單克隆的一個優選例是噬菌體pVIII蛋白N端展示有隨機八肽序列,可以與前列腺特異性抗原發生特異性相互作用。
所述噬菌體單克隆體作為前列腺抗原特異性配體探針。
所述特異性配體探針用于分別以f-PSA及t-PSA前列腺抗原為檢測對象的檢測中;所述檢測方法是“噬菌體探針/前列腺抗原/前列腺抗原單克隆抗體”模式的夾心法ELISA檢測方法。
所述的前列腺抗原特異性配體探針有兩種,其中噬菌體單克隆T1能夠特異性識別f-PSA,噬菌體單克隆T2能夠特異性識別t-PSA。T1展示的八肽序列是ERNSVSPS,T2展示的八肽序列是ATRSANGM,兩條氨基酸序列的同源性只有12.5%。
所述的ELISA檢測方法是分別以f-PSA和t-PSA為靶標,建立的噬菌體探針/前列腺抗原/前列腺抗原單克隆抗體”模式的夾心法ELISA檢測方法,實現f-PSA和t-PSA的分別檢測,進而確定fPSA/tPSA的比值,對前列腺癌的診斷、鑒別以及確定前列腺疾病性質具有非常重要的意義。
本發明所具有的效果:
1.本發明利用噬菌體展示技術從噬菌體文庫中篩選得到能夠與前列腺抗原特異結合的展示有隨機多肽的噬菌體單克隆,以此作為抗體類似物,克服了傳統單克隆抗體制備過程復雜、昂貴、穩定性差和低效價的缺陷。
2.本發明利用含有與前列腺抗原特異結合短肽的噬菌體作為探針,建立了“噬菌體探針/前列腺抗原/前列腺抗原單克隆抗體”模式的夾心法ELISA前列腺抗原檢測方法,此方法靈敏度高、穩定性好、成本低。
3.本發明以前列腺特異性抗原為靶標與噬菌體文庫作用,經生物淘選后得到具備前列腺特異性抗原結合特性的噬菌體單克隆。
4.本發明以腫瘤標記物AFP、CA125、CA15-3、CA19-9作為對照靶標,通過噬菌體捕獲實驗對噬菌體單克隆進行特異性結合評價,其中噬菌體單克隆T1能夠特異性識別f-PSA,噬菌體單克隆T2能夠特異性識別t-PSA。T1展示的八肽序列是ERNSVSPS,T2展示的八肽序列是ATRSANGM。
5.本發明利用篩選獲得的噬菌體單克隆作為探針,建立了噬菌體探針/前列腺抗原/前列腺抗原單克隆抗體”模式的夾心法ELISA檢測方法,實現f-PSA和t-PSA的分別檢測,檢測的線性范圍分別為0.8-165ng/mL和3.3-330ng/mL,檢測限分別為0.33ng/ml和1.6ng/mL。
6.本發明利用篩選獲得的噬菌體單克隆T1和T2分別實現了f-PSA和t-PSA的檢測,進而確定fPSA/tPSA的比值,可更好地鑒別前列腺癌與前列腺疾病,大大提高前列腺癌早期診斷的特異性,對前列腺癌的診斷、鑒別以及確定前列腺疾病性質具有非常重要的意義。
7.本發明提供了含有與前列腺抗原特異性結合短肽的噬菌體的制備方法。所述的噬菌體單克隆可作為新型的生物檢測探針,在分析化學、檢測、免疫反應、生物醫學等領域得到廣泛的應用。
附圖說明
圖1為本發明實施例提供的噬菌體單克隆的特異性結合評價試驗結果圖。
圖2為本發明實施例提供的基于噬菌體單克隆的前列腺特異性抗原ELISA檢測方法的流程圖。
圖3為本發明實施例提供的包被液pH對ELISA的影響效果圖。
圖4為本發明實施例提供的噬菌體探針包被濃度對ELISA的影響效果圖。
圖5為本發明實施例提供的反應條件對噬菌體ELISA的影響效果圖。
圖6為本發明實施例提供的PSA抗體稀釋度對噬菌體ELISA的影響效果圖。
圖7為本發明實施例提供的PSA的檢測工作曲線圖。
具體實施方式
以下結合附圖和實施方式對本發明作進一步的詳細說明。
實施例1
前列腺特異性抗原的生物淘選:以f-PSA為靶標對f8/8風景噬菌體文庫進行生物淘選,獲得與f-PSA高親和力的噬菌體單克隆,具體過程如下:
1.饑餓細胞的制備
(1)將甘油凍存的大腸桿菌K91 Blue Kan(VA Petrenko,GP Smith,X Gong,T Quinn,A library of organic landscapes on filamentous phage,Protein Engineering,1996.9(9):797-801)接種于NZY培養基(10g/L酶水解酪素,5g/L酵母提取物,5g/L NaCl)中,于37℃,200rpm條件下搖床培養過夜;
(2)取過夜培養的大腸桿菌K91 Blue Kan菌株,接種于NZY培養基中,37℃,200rpm條件下搖床培養至OD600約0.45(約2~2.5小時);
(3)OD600達到0.45后,調整搖床轉速至50rpm,37℃搖床培養8min;
(4)菌液4℃、2000g條件下離心10min;
(5)離心后去除上清,加20mL 80mM NaCl溫和地懸浮細胞;
(6)細胞37℃、50rpm條件下搖床培養45min;
(7)菌液4℃、2000g條件下離心10min;
(8)離心后去除上清,取1mL冷的NAP緩沖溶液(12mL 1M NaCl,15mL 0.5M NH4H2PO4,123mL去離子水混合均勻)溫和地懸浮菌體,于冰上存放。
2.噬菌體的擴增及純化
(1)按照饑餓細胞的制備方法制備饑餓細胞;
(2)取適量噬菌體與等體積饑餓細胞溫和混勻,室溫下靜置15min后轉移至含40mL NZY培養基(含四環素,0.2μg/mL)的250mL三角瓶中,37℃,200rpm條件下振蕩培養45min;
(3)培養基中補加四環素至終濃度20μg/mL,37℃,200rpm條件下搖床過夜培養;
(4)過夜培養菌液4℃、3000g條件下離心10min;
(5)上清4℃、6700g條件下離心10min;
(6)上清加入0.15倍體積的PEG-NaCl(100g PEG 4000,116.9g NaCl溶于475mL去離子水),置于4℃過夜沉淀;
(7)沉淀溶于200μL TBS溶液中,4℃儲存。
3.噬菌體滴度的測定
(1)按照饑餓細胞的制備方法制備饑餓細胞;
(2)用TBS-gelatin(TBS緩沖液中加入0.1%的明膠)緩沖液制備噬菌體稀釋液;
(3)分別取10μL噬菌體稀釋液(稀釋梯度可根據實際情況選擇)于無菌的1.5mL離心管,加10μL制備好的饑餓細胞,溫和的混勻,室溫下靜置15min;
(4)每個離心管分別加入980μL NZY培養基(含四環素,0.2μg/mL),37℃條件下靜置培養45min,誘導四環素抗性;
(5)取100μL涂布于含四環素20μg/mL的NZY平板(每個梯度3個平行),37℃過夜培養;
(6)平板計數,計算噬菌體滴度:滴度=菌落數×1000×稀釋梯度。TBS-gelatin是TBS緩沖液中加入0.1%的明膠。
4.前列腺特異性抗原的生物淘選
(1)將f-PSA(10μg/mL)置于96孔板(可拆酶標板Nunc-Immuno LockWell,Maxisorp表面)中,4℃,振蕩孵育16h;
(2)吸出f-PSA溶液,添加100μL 10mg/mL牛血清白蛋白(BSA)溶液,室溫下封閉1h;
(3)吸出BSA溶液,室溫下加100μL TBST(TBS緩沖液中加入0.5%的Tween 20)輕微震蕩漂洗6次,每次10min;
(4)添加f8/8風景噬菌體文庫(VA Petrenko,GP Smith,X Gong,T Quinn,A library of organic landscapes on filamentous phage.Protein Engineering,1996.9(9):797-801):將含~1011個風景景噬菌體克隆的文庫(作為生物淘選的輸入量),加至包被有PSA的96孔板中,4℃,振蕩孵育16h;
(5)按照饑餓細胞的制備方法制備饑餓細胞;
(6)吸出文庫溶液,使用TBST 100μL震蕩漂洗10次,每次10min;
(7)吸出96孔板中的TBST,并甩干殘留,加入100μL洗脫緩沖液(0.1M HCl,1mg/mL BSA,0.1mg/mL酚紅,甘氨酸調節pH至2.2),室溫下振蕩10min,洗脫與f-PSA特異性結合的噬菌體克隆;
(8)將洗脫液完全轉移至離心管中,添加19μL Tris-HCl作為中和液,混勻,并注意觀察液體顏色變化(從黃到紅);
(9)加100μL TBS,室溫下振蕩10min,將TBS吸出加入到噬菌體洗脫液中(重復2~3次);使用30kDa的超濾管,濃縮至50μL(濃縮過程僅用于第一輪淘選),取5μL用于滴度測定;
(10)對上步中噬菌體進行梯度稀釋,按照噬菌體滴度的測定方法,測定洗脫噬菌體的滴度;
(11)將洗脫噬菌體轉移至1.5mL離心管中,與100μL饑餓細胞溫和混勻,室溫下靜置15min,然后轉移至40mL NZY培養基(含四環素0.2μg/mL),37℃、200rpm條件下搖床培養45min;
(12)待培養45min后,培養基中補加四環素至終濃度20μg/mL,37℃、200rpm條件下搖床培養過夜;
(13)平板計數,并計算噬菌體滴度作為生物淘選的輸出量,計算回復率,即生物淘選過程中噬菌體輸出量與輸入量的比值;
(14)過夜培養菌液4℃、3000g條件下離心10min;
(15)上清液4℃、6700g條件離心10min;
(16)上清液加入0.15倍體積的PEG/NaCl,置于4℃過夜沉淀;
(17)噬菌體4℃、6700g條件離心50min,棄上清;
(18)4℃、6700g條件下離心5min,棄殘留上清,沉淀溶于1mL TBS溶液中;
(19)4℃、12000g條件下離心2min,去除不溶物;
(20)加150μL PEG/NaCl,4℃過夜沉淀;
(21)按照饑餓細胞制備方法制備饑餓細胞;
(22)噬菌體4℃、12000g條件下離心50min,去除上清;
(23)4℃、12000g條件下離心5min去除殘留上清,將沉淀溶于200μL TBS溶液中;
(24)4℃、12000g條件下離心2min,去除所有不溶物,上清轉移至一新離心管中,作為新一輪淘選的輸入文庫;
(25)按照噬菌體滴度的測定方法對上步中純化得到的噬菌體進行滴度測定;
(26)平板計數,計算噬菌體滴度。
按照上述淘選步驟依次進行第二輪、第三輪生物淘選,測定每一輪淘選的噬菌體文庫的輸入量、輸出量,并計算每一輪淘選的回復率。經過f-PSA對f8/8風景噬菌體文庫的三輪生物淘選,與靶標特異性結合噬菌體的回復率從(2.76×10-5)%增加到(3.05×10-2)%,目標噬菌體克隆得到有效富集。
6.單克隆噬菌體的挑選及測序
(1)引物的設計與合成
根據噬菌體的核苷酸序列設計寡核苷酸上下游引物,由南京金斯瑞生物科技有限公司合成:
正向引物F:5’-CAAAGCCTCCGTAGCCGTTG-3’
反向引物R:5’-CATTCCACAGACAGCCCTCA-3’
(2)噬菌體單克隆的挑取
待三輪生物淘選過后,將獲得的目的噬菌體進行適當的梯度稀釋,取10μL侵染饑餓細胞,涂布含四環素20μg/mL的NZY培養基平板,37℃過夜培養。
使用無菌牙簽從長滿單菌落的NZY平板上隨機挑取噬菌體克隆,懸浮于100μL無菌水中,作為PCR的模板。取潔凈無菌的0.5mL薄壁PCR管,依次加入模板、上下游引物、TaKaRa Taq、雙蒸水,將各組分混合均勻后,采用PCR技術對單克隆噬菌體的目的基因進行擴增。
(3)單克隆噬菌體目的基因序列分析
將PCR產物送至北京六合華大基因科技股份有限公司測序,運用BioEdit軟件對單克隆噬菌體的序列進行分析比較,獲取噬菌體表面展示的多肽序列。其中T1展示的八肽序列是ERNSVSPS,T2展示的八肽序列是ATRSANGM。
實施例2
噬菌體單克隆的特異性測試:噬菌體與PSA的結合特異性通過噬菌體捕獲實驗測試。
前列腺抗原在血清中主要以游離態(f-PSA)和復合物(主要為PSA-ACT)的形式存在,以f-PSA和PSA-ACT同時分別捕獲特異性噬菌體單克隆,通過回復率測定,確定特異性噬菌體單克隆的識別特性,根據其是否識別PSA-ACT確定特異性噬菌體單克隆識別f-PSA或t-PSA(f-PSA+PSA-ACT)。鑒于前列腺抗原屬于血清中含有的一種腫瘤標記物,以腫瘤標記物AFP、hK-2、CA125、CA15-3、CA19-9以及空白作為參照,對噬菌體單克隆進行特異性測試。
(1)將抗原f-PSA、PSA-ACT、AFP、hK-2、CA125、CA15-3、CA19-9(10μg/mL)分別置于96孔酶標板(Nunc-Immuno LockWell,Maxisorp表面)孔中,4℃振蕩孵育16h;
(2)吸出各靶標溶液,添加100μL 10mg/mL BSA溶液,室溫下孵育1h;
(3)吸出BSA溶液,室溫下加入100μL TBS-Tween漂洗,10次,每次10min;
(4)添加單克隆噬菌體:將~106TU的單克隆噬菌體(作為噬菌體捕獲實驗的輸入量),加至包被有分別包被抗原PSA、PSA-ACT、AFP、hK-2、CA125、CA15-3、CA19-9的96孔酶標板中,4℃振蕩孵育16h;
(5)按照饑餓細胞的制備方法制備饑餓細胞;
(6)吸出噬菌體溶液,使用TBST 100μL震蕩漂洗10次,每次10min,洗去未與各抗原結合的噬菌體;
(7)吸出96孔酶標板中的TBST,并甩干殘留,加入100μL洗脫液,室溫下振蕩10min,洗脫與各抗原結合的噬菌體克隆;
(8)將洗脫液完全轉移至離心管中,分別添加19μL Tris-HCl作為中和液,混勻,并注意觀察液體顏色變化(從黃到紅);
(9)對上步中各噬菌體進行梯度稀釋,按照噬菌體滴度的測定方法,測定各洗脫噬菌體的滴度;
(10)平板計數,并計算各抗原捕獲的單克隆噬菌體的量(作為噬菌體捕獲實驗的輸出量),計算回復率,即噬菌體捕獲實驗中噬菌體輸出量與輸入量的比值,比較各抗原對單克隆噬菌體的捕獲情況。
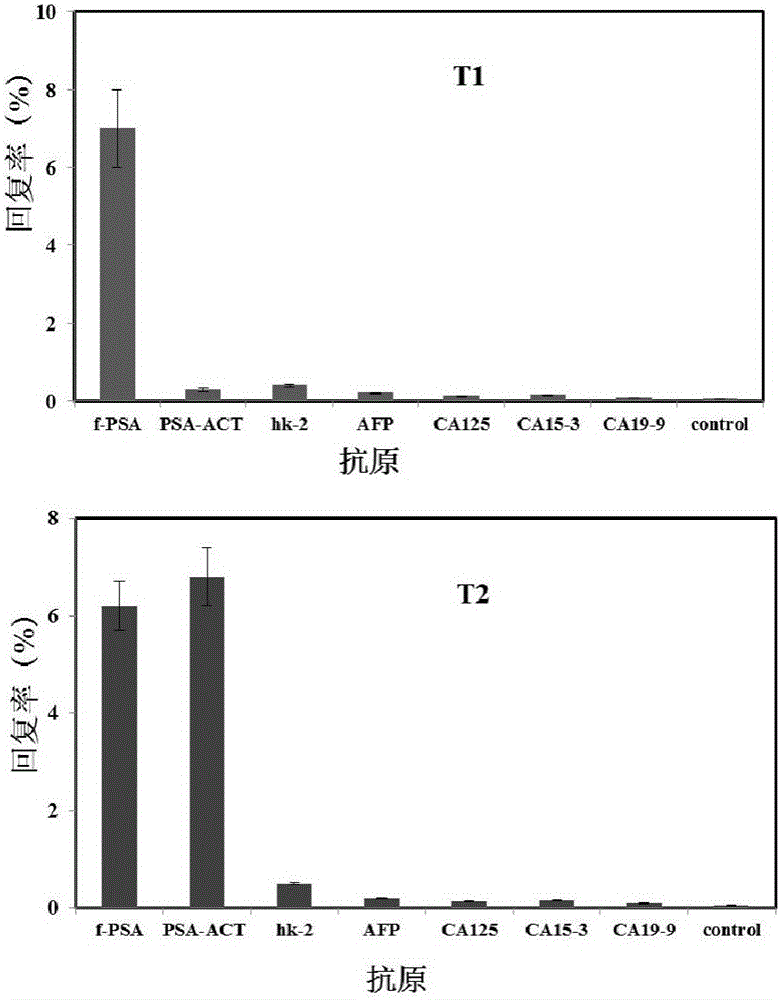
測定不同抗原捕獲的噬菌體的數量,根據輸入噬菌體的數量,計算捕獲回復率進行比較(圖1)。f-PSA對T1噬菌體克隆的捕獲量明顯高于PSA-ACT及其它抗原和空白對照,說明T1僅對f-PSA均表現出很高的親和性和特異性,其識別特性為識別f-PSA。T2對f-PSA響應的同時,還可識別PSA-ACT,而且明顯高于其它抗原和空白對照,其識別特性可確定為識別f-PSA和PSA-ACT,即t-PSA。
實施例3
基于噬菌體的ELISA檢測方法(操作流程如圖2所示):
1.包被液pH噬菌體包被效率的影響
在ELISA實驗中,最佳包被液的選擇主要依賴于蛋白或抗體的表面特性,對于不同的蛋白或抗體,其最佳包被液可能各不相同。對于大多數蛋白或抗體而言,常用的包被液主要為pH 7.5的中性緩沖液或pH 9.6作用的堿性溶液,為檢驗不同pH包被液對噬菌體包被的影響,我們分別選用不同pH的碳酸鹽緩沖液和Tris-HCl緩沖液作為包被試劑,探索不同pH包被液對噬菌體包被效率的影響。
特異性噬菌體T1、T2分別溶于0.1M TBS(pH 7.0)、0.1M TBS(pH 7.5)、0.1M NaHCO3(pH 8.6)、0.1M Na2CO3(pH 9.6)至濃度1.0×1010TU/mL,分別取40μL(作為噬菌體包被平板的輸入量)加入到96孔酶標板孔中(Corning,Costar),置于濕盒內,4℃包被16h;吸出酶標板中的噬菌體溶液,加200μL 0.05%PBST(PBS緩沖液中加入0.05%的Tween 20)漂洗4次,每次3min;然后弱酸洗脫包被于酶標板上的噬菌體,經Tris-HCl中和后,感染饑餓細胞,進行滴度測定,作為噬菌體包被平板的輸出量。計算輸出量與輸入量的比值作為包被效率進行比較。
從圖3中可知,噬菌體克隆T1在pH7.5和pH7.0的TBS包被液中的包被效率相當,但明顯高于其它堿性pH的碳酸鹽包被液,同樣T2在pH7.5和pH7.0的TBS包被液中的包被效率也明顯高于堿性pH的碳酸鹽包被液,說明噬菌體在中性pH包被液中的包被效率高于堿性pH包被液,因此選擇TBS(pH7.5)作為噬菌體T1的包被液,TBS(pH7.0)作為噬菌體T2的包被液,用于ELISA中噬菌體的固定。
2.噬菌體包被濃度對ELISA的影響
制備一系列濃度梯度的特異性噬菌體T1、T2(T1溶于TBS,pH7.5;T2溶于TBS,pH7.0),分別包被96孔酶標板(40μL每孔),經0.5%PBST漂洗4次后,加入10nM PSA 50μL(含0.5%Tween 20),37℃反應2h, 0.5%PBST漂洗6次后先后加入鼠抗人前列腺抗原單克隆抗體、辣根過氧化物酶(HRP)偶聯的羊抗鼠IgG和顯色底物鄰苯二胺(OPD),催化顯色15min后,酶標儀492nm測定OD值(圖4)。
從圖4可以看出,隨著噬菌體濃度的增加,OD492值隨之增大,對于噬菌體克隆T1而言,噬菌體濃度增達到2.5×1010TU/mL時,OD值變化基本達到穩定;噬菌體T2在濃度5.0×1011TU/mL時OD值達到最大。為更有效的利用噬菌體,分別選擇2.5×1010TU/mL和5.0×1011TU/mL作為噬菌體克隆的包被濃度用于f-PSA和t-PSA的檢測。
3.反應條件對噬菌體ELISA的影響
在ELISA試驗中,固定化探針與抗原或抗體之間的反應是檢測過程中最為關鍵的步驟之一,常用的反應條件為37℃孵育一定時間或4℃過夜孵育,為實現噬菌體ELISA中反應條件最優,達到較好的檢測效果,選擇合適的反應條件尤為重要。
分別以噬菌體T1(2.5×1010TU/mL)、噬菌體T2(5.0×1010TU/mL)40μL,4℃孵育16h包被96孔酶標板,0.5%PBST漂洗4次后,加入10nM PSA 50μL(含0.5%Tween 20),分別于以下條件孵育反應:4℃過夜12h,37℃1h,37℃2h,37℃3h,37℃4h,37℃5h,0.5%PBST漂洗6次后先后加入鼠抗人前列腺抗原單克隆抗體、HRP偶聯的羊抗鼠IgG和顯色底物OPD,催化顯色15min后,酶標儀492nm測定OD值(圖5)。
從圖5中可知,37℃孵育3h后,OD值變化不大,噬菌體與PSA的反應基本可達到飽和,因此選擇37℃孵育3h作為噬菌體ELISA檢測的反應條件。
4.前列腺抗原抗體稀釋度對噬菌體ELISA的影響
ELISA試驗中,檢測抗體對抗原的識別反應是ELISA檢測過程中另一關鍵步驟,抗體濃度的選擇往往影響到ELISA信號的測定以及非特異性背景值,因此ELISA實驗中要選擇最為合適的抗體稀釋比,以獲得檢測過程中的最佳檢測效果。
分別以噬菌體T1(2.5×1010TU/mL)、噬菌體T2(5.0×1010TU/mL)40μL,4℃孵育16h包被96孔酶標板,0.5%PBST漂洗4次后,加入10nM PSA 50μL(含0.5%Tween 20),于37℃孵育反應3h,0.5%PBST漂洗6次后加入不同稀釋度的鼠抗人前列腺特異性抗原單克隆抗體(1:500,1:1000,1:2000,1:4000,1:8000),然后分別加入HRP偶聯的羊抗鼠IgG和顯色底物OPD,催化顯色15min后,酶標儀測定OD492,計算不同抗體稀釋度下加PSA板孔與對照板孔OD值的比值(圖6)。
在此實驗中,抗體稀釋度越小產生的陽性信號值越高,但同時產生較大的非特異性背景信號,因此選擇信噪比值最高的作為ELISA檢測參數。抗體稀釋度1:500與1:2000之間時,噬菌體T1、T2的ELISA的信噪比值 均較高,應用效果較好,為更有效的利用試劑,在此選擇1:1000的PSA抗體稀釋度用于噬菌體ELISA檢測。
5.前列腺抗原檢測工作曲線的繪制
將特異性識別f-PSA的噬菌體克隆T1溶于TBS(pH 7.5)至2.5×1010TU/mL,特異性識別t-PSA的噬菌體克隆T2溶于TBS(pH 7.0)至5.0×1010TU/mL,40μL包被96孔酶標板(Corning Corstar),置于濕盒內4℃包被16h,0.5%PBST洗滌6次后后加入一系列濃度的PSA,37℃孵育反應3h,0.5%PBST再次漂洗后先后加入鼠抗人前列腺特異性抗原單克隆抗體(Meridian Life Science)(1:1000稀釋),然后分別加入HRP偶聯的羊抗鼠IgG和顯色底物OPD,催化顯色15min后,酶標儀492nm測定OD值,繪制工作曲線(如圖7所示),f-PSA檢測的線性范圍為0.8-165ng/mL,檢測限度可達到0.33ng/ml,t-PSA檢測的線性范圍為3.3-330ng/mL,檢測限度可達到1.6ng/mL。以上各實驗重復10次的變異系數均小于8%,表明具有良好的重復性。
實施例4
前列腺抗原實際樣品的檢測
利用所建立的“噬菌體探針/前列腺抗原/前列腺抗原單克隆抗體”夾心法對血清樣品進行檢測。分別對血清樣品中的f-PSA和t-PSA平行3份進行檢測,結果如表1所示。表1中也列出了電化學免疫分析法檢測結果。本法和電化學免疫分析法相比較,兩者相關性較好,相對誤差在10%以內,表明本研究建立的ELISA法可用于實際血清樣品的檢測。
表1.血清樣品中PSA的測定
- 還沒有人留言評論。精彩留言會獲得點贊!