高密度脂蛋白模擬肽Reverse-D-4F在治療LPS誘導呼吸窘迫綜合癥藥物中的應用的制作方法
本發明涉及高密度脂蛋白模擬肽Reverse-D-4F的應用領域,具體為治療LPS誘導呼吸窘迫綜合癥的藥物中的應用。
背景技術:
急性呼吸窘迫綜合征(ARDS)是一種常見的臨床綜合征,具有較高的死亡率,臨床表現為呼吸窘迫、困難,通過傳統氧療糾正缺氧。ARDS的發病機制可分為生物和非生物病原菌。生物病原體包括細菌、病毒、真菌、非典型病原體和惡性腫瘤,而非生物病原包括酸性物質、藥物、有毒氣體吸入和機械通氣相關的傷害。最初,在血液循環中的內毒素等有害物質損傷肺毛細血管內皮細胞(PCEC),導致內皮細胞通透性增加,以及收縮和死亡。損傷約2小時后,出現肺間質水腫發生;損傷12至24小時后,出現肺泡水腫。
內皮細胞功能障礙和炎癥在急性呼吸窘迫綜合征的發生和發展中起著重要的作用。伯翰等表明生存率與內皮祖細胞(EPCs)克隆數呈正相關。在LPS誘導的急性肺損傷(ALI)大鼠模型中發現,內皮祖細胞移植可維持肺泡毛細血管屏障的完整性,恢復血管內皮功能,改善炎癥狀態。因此,EPCs對修復ARDS的內皮損傷和抑制ARDS發生發展具有重要作用。但是,ARDS患者體內促炎因子水平提高(如氧化低密度脂蛋白、IL-6、TNF-αα),這些炎癥因子損害內EPCs的功能,包括細胞增殖、遷移和血管形成。這些受損的內皮祖細胞無法恢復ARDS患者受損的血管內皮系統。因此,增加內皮祖細胞的數量,減輕炎性因子引起的內皮祖細胞功能障礙可能在抑制ARDS發展中發揮重要作用。
高密度脂蛋白(HDL)已被證明具有動員骨髓EPCs,抑制EPCs凋亡和促進EPCs分化為內皮細胞的功能。載脂蛋白A-I(apoA-I)是高密度脂蛋白的重要功能性成分,有243種氨基酸,已被證明能提高膿毒癥大鼠的生存率。因為apoA-I脂質結合能力與其兩親性螺旋結構有很大關系,因此最近根據該特性設計了模擬肽,該模擬肽在疏水表面含有四個苯丙氨酸殘基(4F;F代表苯丙氨酸),并模 仿的A類兩親性螺旋,該模擬肽與apoA-I沒有序列同源性。據報道,4F有抗炎、抗氧化作用,改善膿毒癥大鼠的生存率。Reverse-D-4F是按照D-4F(Ac-DWFKAFYDKVAEKFKEAF-NH2)的反向序列合成的模擬肽,該模擬肽對膿毒癥治療并沒有報道。
本發明發現了Reverse-D-4F能修復LPS誘導的EPCs功能損傷,抑制LPS誘導的EPCs凋亡,因而Reverse-D-4F通過動員EPCs并修復其功能來對LPS誘導大鼠肺損傷進行治療,是治療肺損傷的一個有效治療劑,由此完成本發明。
技術實現要素:
本發明涉及一種高密度蛋白模擬肽Reverse-D-4F,其序列為Ac-FAEKFKEAVKDYFAKFWD-NH2。
一種高密度蛋白模擬肽Reverse-D-4F在制備治療LPS誘導呼吸窘迫綜合癥的藥物或試劑盒中的應用,所述高密度蛋白模擬肽的序列為Ac-FAEKFKEAVKDYFAKFWD-NH2。
一種高密度蛋白模擬肽Reverse-D-4F在制備內皮祖細胞修復內皮損傷藥物或試劑盒中的應用,所述高密度蛋白模擬肽的序列為Ac-FAEKFKEAVKDYFAKFWD-NH2。
一種高密度蛋白模擬肽Reverse-D-4F在制備預防或治療肺損傷藥物或試劑盒中的應用,所述高密度蛋白模擬肽的序列為Ac-FAEKFKEAVKDYFAKFWD-NH2。
一種高密度蛋白模擬肽Reverse-D-4F在制備預防或治療膿毒癥藥物或試劑盒中的應用,所述高密度蛋白模擬肽的序列為Ac-FAEKFKEAVKDYFAKFWD-NH2。
其中所述肺損傷為肺水腫,所述試劑盒還進一步包括佐劑,所述佐劑為氫氧化鋁佐劑、短小棒狀桿菌、脂多糖、細胞因子或明礬。
本發明發現提出Reverse-D-4F能抑制LPS誘導大鼠肺損傷模型的肺水腫,抑制體內炎癥因子的產生,抑制肺泡壁增厚,胞間隙紅細胞和白細胞的浸潤,以及肺血管內皮炎癥標志的產生(ICAM-1、VCAM-1和iNOS),增加內皮的標志(eNOS和vWF)。Reverse-D-4F促進LPS誘導大鼠肺損傷模型EPCs動員,無論在體外還是在體內,Reverse-D-4F均能修復LPS誘導大鼠肺損傷模型EPCs損傷的功能。
附圖說明
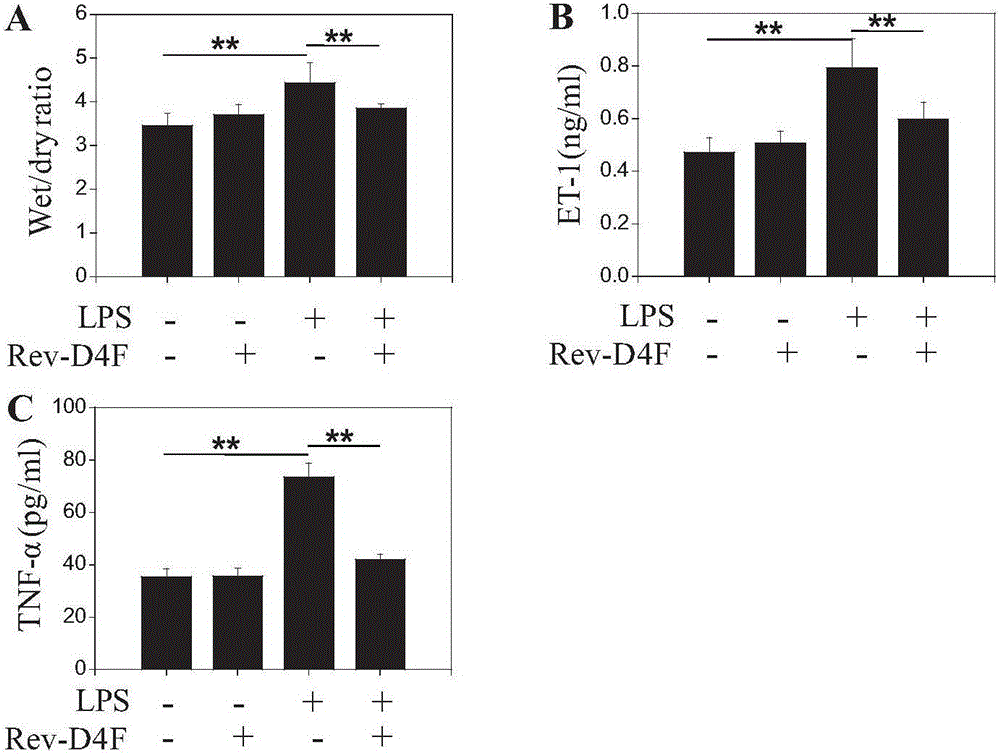
圖1所示是Reverse-D-4F能抑制LPS誘導大鼠肺損傷模型的肺水腫和體內 炎癥因子的產生。
圖2所示是Reverse-D-4F抑制LPS誘導大鼠肺損傷模型肺泡壁增厚,胞間隙紅細胞和白細胞的浸潤
圖3所示是Reverse-D-4F抑制LPS誘導大鼠肺損傷模型肺血管內皮炎癥標志的產生(ICAM-1、VCAM-1和iNOS),并增加內皮的標志(eNOS和vWF)。
圖4所示是Reverse-D-4F動員LPS誘導大鼠肺損傷模型的EPCs。
圖5所示是Reverse-D-4F修復LPS誘導大鼠肺損傷模型EPCs損傷的功能。
圖6所示是Reverse-D-4F體外修復LPS誘導EPCs損傷的功能。
具體實施方式
Reverse-D-4F治療LPS誘導大鼠肺損傷模型。
動物ARDS模型建立,24只雄性C57小鼠分為4組:
(1)對照組(腹腔注射PBS);
(2)Reverse-D-4F組(腹腔注射Reverse-D-4F 10mg/Kg)
(3)模型組(腹腔注射LPS 10mg/Kg);
(4)Reverse-D-4F處理組(腹腔注射Reverse-D-4F 10mg/Kg和LPS10mg/Kg)
模型制作2天后,通過鹽酸氯胺酮靜脈注射全麻后處死,取左肺,肺組織表面液體用吸水紙吸干凈,稱取左肺的重量被認為是濕重;左肺被放置在干燥箱60℃干燥48小時,然后稱取重量為干重。濕干重比值來評價肺水腫程度。
用ELISA試劑盒來檢測小鼠血漿中腫瘤壞死因子-α和ET-1的表達水平。
肺部的右葉均經10%福爾馬林固定,石蠟包埋,切片6μm,然后用蘇木精-伊紅染色。用特異性抗體(VCAM-1、ICAM-1、iNOS、eNOS、vWF和Sca-1)進行免疫組織化學染色和HE染色。
用高倍鏡隨機挑選10個視野觀察HE染色肺切片,并對浸潤的紅細胞和白細胞計數,同時對肺泡壁厚度進行測量。
用紅細胞裂解緩沖液裂解外周血紅細胞。然后用抗體FITC-CD34(BD),PE-Flk-1,和APC-CD133標記細胞。流式分析陽性細胞數。
C57小鼠麻醉后斷頭處死,75%乙醇浸泡15min,剪取股骨和脛骨;冷PBS液反復沖洗骨髓腔直至沖洗液清亮,將沖洗液反復吹打,100μm濾網過濾成單 細胞懸液;沖洗液與Ficoll分離液的體積比為1∶1,20℃下2 000r/min離心20min。輕輕吸取離心管中間乳白色云霧狀單個核細胞層到新的離心管中,磷酸鹽緩沖液PBS洗細胞沉淀2次;完全培養液重懸細胞,反復輕柔吹打制成單細胞懸液后進行細胞計數。按106/cm2的密度接種在預先用Fibronectin包被的六孔板或培養瓶上;培養3d后,用PBS液洗掉非貼壁細胞,每3d更換培養液一次。
EPCs與2.5mg/L的DiI-acLDL在37℃孵育2h;然后用1-2%多聚甲醛固定細胞5min;PBS浸洗后,加入10mg/L的FITC-UEA,37℃孵育1h后,洗去多余染料后,中性甘油封片,用熒光顯微鏡或激光共聚焦觀察;顯示紅色熒光的為DiI-acLDL陽性,顯示綠色熒光的為FITC-UEA-1陽性,顯示黃色的為免疫雙熒光陽性,被確認為DiI-acLDL和FITC-UEA雙染色陽性細胞被認為是正在分化的EPCs。
將EPCs胰酶消化后接種于預先鋪好纖維連接蛋白的培養板中,同培養液孵育30min,隨即取5個高倍鏡(×10)視野計數貼壁細胞。細胞接種于鋪有纖維連接蛋白的96孔板中,每孔接種3000個細胞,24h后,每孔加入MTT(5g/L)20μL后37℃繼續孵育4h,棄上清,各孔加入150μL二甲基亞砜(DMSO),室溫震蕩10min,酶標儀492nm讀取吸光度值。
將消化好的EPC接種于預先鋪有matrigel膠的培養板上,37℃、5%CO2培養24小時后,顯微鏡觀察成血管情況。
用8μm 24孔板檢測EPCs的遷移。不同處理后的細胞,用0.25%胰蛋白酶消化,1.2×104細胞液分別置于上腔。EGM-2MV培養基置于下室。37℃培養24h,上部細胞用棉簽去除,下室用DAPI染色。隨機選五個視野觀察(×10)遷移的細胞計數。
培養7天的小鼠骨髓來源的單個核細胞用0.25%胰蛋白酶消化,103細胞置于96孔板中。每隔一天用0.25%胰蛋白酶消化并進行細胞計數。
附圖1表征了Reverse-D-4F能抑制LPS誘導大鼠肺損傷模型的肺水腫和體內炎癥因子的產生情況,小鼠經LPS或Rev-D4F處理48小時后處死,取肺左葉檢測濕干比(A);取小鼠血漿檢測ET-1(B)和TNF-α(C)水平。據圖1所示,LPS誘導的小鼠急性肺損傷模型中肺水腫明顯增加,模型血液中炎癥因子TNF- α和ET-1明顯增加;給予高密度脂蛋白模擬肽Reverse-D-4F治療后,小鼠肺水腫明顯降低,并且血液中炎癥因子TNF-α和ET-1的增加水平明顯得到抑制。
附圖2是Reverse-D-4F抑制LPS誘導大鼠肺損傷模型肺泡壁增厚,胞間隙紅細胞和白細胞的浸潤,Rev-D4F對LPS誘導的小鼠肺損傷的修復作用。A,肺右葉進行HE染色;B,量取肺泡壁厚度,以對照組為100%,分別計算各組肺泡壁厚度的百分比;C,各組選取十個視野數紅細胞數,最后取其均值;D,各組選取十個視野數白細胞數,最后取其均值。據圖2所示,LPS誘導的小鼠急性肺損傷模型中肺泡壁厚度明顯增加,且肺胞間隙明顯出現紅細胞和白細胞浸潤;給予Reverse-D-4F治療后,明顯改善小鼠肺損傷模型的上述表現。LPS誘導的小鼠急性肺損傷模型中
附圖3是Reverse-D-4F抑制LPS誘導大鼠肺損傷模型肺血管內皮炎癥標志的產生(ICAM-1、VCAM-1和iNOS),并增加內皮的標志(eNOS和vWF)。免疫組化對肺組織各指標檢測:ICAM-1、VCAM-1和iNOS是肺內皮炎癥標志物,eNOS和vWF是肺內皮細胞標志。據圖3所示,LPS誘導的小鼠急性肺損傷模型肺組織中內皮損傷的炎癥標志因子VCAM-1、ICAM-1和iNOS表達水平明顯增加,而正常內皮細胞標志因子eNOS和vWF明顯降低;給予Reverse-D-4F治療后,明顯降低內皮損傷的炎癥標志因子VCAM-1、ICAM-1和iNOS的表達水平,同時提高正常內皮細胞標志因子eNOS和vWF的表達水平。
附圖4是Reverse-D-4F動員LPS誘導大鼠肺損傷模型的EPCs,其中,A,小鼠外周血中CD34+、FLK-1+、CD133+、CD34+/FLK-1+、FLK-1+/CD133+和CD34+/CD133+各亞群百分比(NS為100%);B,免疫組化染祖細胞標志Sca-1,檢測肺組織祖細胞歸巢情況。據圖4所示,LPS能動員干細胞至外周血,如CD34+、FLK-1+、CD133+、CD34/FLK-1+、FLK-1/CD133+和CD34/CD133+細胞明顯增加,在肺組織中帶有干細胞標志因子Sca-1+的細胞也明顯增加;給予Reverse-D-4F治療后,外周血CD34+、CD34/FLK-1+和CD34/CD133+細胞的增加明顯得到抑制,而FLK-1+、CD133+和FLK-1/CD133+帶有內皮祖細胞標志的細胞進一步增加,在肺組織中Sca-1+細胞數量進一步增加來修復LPS誘導的肺損傷。
附圖5表征了Reverse-D-4F修復LPS誘導大鼠肺損傷模型EPCs損傷的功能。 取各組小鼠骨髓誘導分化為EPCs并檢測其功能:A,各組小鼠骨髓單個核細胞以106/cm2接種于六孔培養板,3天后去除非貼壁細胞,貼壁細胞選取五個視野進行細胞計數,然后各組取均值;B,各組小鼠骨髓細胞誘導分化EPCs胰酶消化后,取12000個細胞接種于遷移小室上室,下室加入EGM-2MV誘導24小時后,DAPI染色,選取五個視野熒光顯微鏡下計數;C,各組小鼠骨髓細胞誘導分化EPCs進行吸附低密度脂蛋白(紅色)和結合凝集素(綠色)實驗,選取五個視野熒光顯微鏡下觀察,雙陽性細胞占所有細胞的百分比;D,各組小鼠骨髓單個核細胞培養7天,胰酶消化,以每孔1000個細胞接種于96孔板,細胞每隔1天計數一次。據圖5所示,不同組小鼠骨髓取出并誘導分化為EPCs,并檢測其功能,結果發現模型組小鼠EPCs分化的細胞數減少,盡管模型組EPCs能迅速增殖,但其粘附能力和遷移能力較對照組有所下降;給予Reverse-D-4F治療后,小鼠骨髓單個核細胞分化為EPCs的數量有所增加,其粘附和遷移功能的損傷也得到了修復。
附圖6表征了Reverse-D-4F體外修復LPS誘導EPCs損傷的功能,其中,A,MTT檢測各組EPCs活力,以對照組的OD值為100%;B,遷移小室方法檢測各組EPCs的遷移能力;C,Matrigel凝膠方法檢測EPCs的體外成血管能力。據圖6體外研究所示,LPS(30μg/ml)明顯損傷EPCs的增殖、遷移和體外血管生成的功能,而Reverse-D-4F能明顯修復LPS誘導上述功能的損傷,用LY294002(PI3K抑制劑)明顯抑制Reverse-D-4F對EPCs功能損傷的修復作用。
- 還沒有人留言評論。精彩留言會獲得點贊!