LG-362B在治療急性早幼粒細胞白血病中的應用的制作方法
本發明涉及醫藥技術領域,具體涉及小分子化合物lg-362b在制備治療急性早幼粒細胞白血病藥物中的應用。
背景技術:
白血病是一種常見的惡性血液疾病。研究表明,白血病是因為骨髓造血干細胞出現不正常的分化和過度增殖而引發的。因為其治愈率低,致死率高,發病群體廣泛,最終嚴重威脅人類的生命,所以又被稱為血癌。根據美國2015年《臨床腫瘤雜志》最新報導,在美國白血病在各類癌癥發病率中排名第九,約54,270名患者患有白血病;致死率排名第六,約24,450名患者死于白血病。根據中國2015年《臨床腫瘤雜志》最新報導,在中國白血病在各類癌癥發病率中排名第十四,致死率排名第十。急性早幼粒細胞白血病(acutepromyeloctyicleukemia,apl)作為m3型急性髓性白血病(acutemyeloidleukemia,aml),在所有成年aml患者中占大約10%。apl最早于1957年被發現,并被描述為“一周內即可死亡的疾病”,其高度致死性在當時引起了人們的極度恐慌。此外,已有相關報道表明,曾接受過化療或放療的患者尤其是乳腺癌患者患上apl的可能性也會增加,這種繼發性的apl由于其病因復雜,治療難度大,目前也越來越引起人們的重視。
15號染色體與17號染色體發生易位產生pml-rarα蛋白。它是導致急性早幼粒細胞白血病的直接原因。pml-rarα融合蛋白的主要功能是促進rarα蛋白與轉錄共抑制復合物相結合。這種結合進一步抑制rarα蛋白靶基因的表達,早幼粒細胞的正常分化也隨之抑制。最后發生大量未成熟的早幼粒細胞導致apl的發生。與此同時,pml-rarα蛋白具有破壞核體nbs(nuclearbody)或pod(pml致癌結構域)結構的能力,使得pml無法正常定位,因此失去了誘導細胞凋亡和抑制細胞增殖的功能,引發細胞的惡性增殖,進一步加速了apl的發展。
apl的治療目前分為兩個階段:(1)誘導緩解階段;早在1967年,人們開始采用化學療法治療apl,1973年蒽環霉素被引入用于apl的臨床治療。直到1985年人們試圖用全反式維甲酸(atra)治療apl,并于1988年取得了較高的cr。因此,atra的出現是apl治療發展史上的革命性事件,直到現在,臨床上治療apl仍然以atra為主,尤其在初期誘導緩解階段。然而,臨床上單獨使用atra常常引發副作用。即維甲酸綜合征(retinoicacidsymptom,ras)和atra耐藥性復發。在治療耐藥復發型apl的藥物中,臨床上常用的是砷類藥物。最具代表性的是三氧化二砷(arsenictrioxide,ato),又名砒霜。ato作為除了atra以外另一種靶向治療apl的小分子藥物,從2000年起,其與atra的聯合使用開始引起人們的關注。研究表明,這兩種藥物的聯用使apl患者獲得了更高的cr,復發率更低,副作用也明顯減輕,從一 定程度上提高了藥物誘導早幼粒細胞成熟分化的能力,從而增強了藥物的效果。除了上面提到的atra和ato兩種小分子靶向藥物以外,單克隆抗體和組蛋白去乙酰化酶抑制劑也是臨床上常用的靶向治療apl的常用藥物。(2)緩解后鞏固階段。緩解后鞏固階段對于臨床治療apl是不可或缺的。臨床數據表明,即使apl初期誘導緩解后的cr指數達到90%以上。如果患者沒有進一步接受鞏固治療,80%以上的患者都會復發,其生存率不足36%,而經過鞏固治療可達61%以上。此外,復發會引發atra的耐藥性,為apl的治療增加了難度,也為患者帶來了更多的痛苦。因此,為了避免此類事情發生,臨床上通常對經過成功誘導緩解后的病人進行鞏固治療。常用的鞏固治療策略是多種化療藥物的聯用。如atra與甲氨蝶呤(mtx)、巰蝶呤(6-mp)聯合使用,用于鞏固治療,可使病人平均5年無病生存率達到70%以上,ato與ha、da或依托泊苷聯合使用在apl患者鞏固治療階段也常用的方案,大大提高了病人的生存率。
雖然atra、ato等靶向治療apl的小分子藥物在臨床上取得了不錯的成績,在一定程度上緩解了apl病情的發展,然而這類藥物所產生的副作用和耐藥性復發也越來越引起人們的關注。因此,我們試圖尋找其他更加高效安全的靶向治療apl的新型小分子化合物,并期望能夠解決臨床上atra耐藥性難題。
技術實現要素:
本發明第一目的是提供7-氨乙酰基氨基-n-苯乙酰基-1,3,4,9-四氫-beta-咔啉(lg-362b)化合物或其衍生物或其藥學上可接受的鹽化合物,在制備治療急性早幼粒細胞白血病(acutepromyeloctyicleukemia,apl)藥物或藥物組合物中的用途。
其中,所述lg-362b化合物如式(i)所示,
式(i)所示lg-362b化合物是一種小分子化合物,分子量:362.42。
本發明提出了式(i)所示lg-362b化合物在制備體內和/或體外抑制apl細胞的生長、增殖、遷移、浸潤、分化、或誘導apl細胞凋亡的藥物中的應用。
在一實施方案中,所述藥物或藥物組合物能夠在體內抑制apl細胞的浸潤、或體內抑制apl細胞增殖或體內誘導apl細胞凋亡。在一個具體實施方案中,所述apl細胞包括pml-rara陽性細胞、pml-rara陰性細胞及atra耐藥性細胞。
在另一實施方案中,所述藥物或藥物組合物能夠在體內通過caspases依賴性途徑,誘導pml-rarα融合蛋白及rarα蛋白的降解,清除apl細胞,從而達到治療apl疾病的目的。
在一個實施方案中,所述lg-362b化合物還可與藥學上可接受的固體或液體載體結合,以及任意地與藥學上可接受的輔助劑和/或賦形劑結合。
本發明第二目的是提供上述一種式(i)所示lg-362b化合物或其衍生物或其藥學上可接受的鹽化合物,在體外研究其抑制apl細胞增殖、生長、遷移、浸潤、或誘導apl細胞凋亡的用途。
在一個實施方案中,一種lg-362b化合物或其衍生物或其藥學上可接受的鹽化合物,可在體外抑制pml-rara陽性細胞、pml-rara陰性細胞及atra耐藥性細胞的增殖。在一個具體實施方案中,其中所述apl包括apl細胞株nb4、hl60細胞、atra耐藥性apl細胞株nb4-r1細胞。
在另一實施方案中,一種lg-362b化合物或其衍生物或其藥學上可接受的鹽化合物,可以抑制atra治療無效的apl細胞株nb4-r1細胞增殖。
本發明第三目的是提供上述一種lg-362b化合物或其衍生物或其藥學上可接受的鹽化合物,在體外誘導atra耐藥性apl細胞分化、抑制或篩選atra耐藥性apl細胞株的用途。
在一個實施方案中,所述lg-362b化合物或其衍生物或其藥學上可接受的鹽化合物,可體外抑制atra耐藥性apl細胞株nb4-r1細胞的增殖。
在另一實施方案中,所述一種lg-362b化合物或其衍生物或其藥學上可接受的鹽化合物,可體外誘導atra耐藥性nb4-r1細胞的分化。
在上述任一所述的實施方案中,所述體外或體內包括人類或哺乳動物。在一個具體實施方案中,所述哺乳動物包括臨床用實驗動物。在更具體的實施方案中,所述實驗動物包括實驗用的小鼠、大鼠、兔、猴等。
本發明的有益效果在于,
本發明提出式(i)所示的lg-362b化合物在體外誘導apl細胞分化的應用及方法。瑞氏吉姆薩染色法可以檢測由式(i)lg-362b體外所誘導的apl細胞株nb4、hl60及atra耐藥細胞nb4-r1的分化;式(i)lg-362b可以體外誘導apl細胞株nb4、hl60及atra耐藥細胞nb4-r1發生nbt還原反應;式(i)lg-362b可以在體外促進apl細胞株nb4、hl60及atra耐藥細胞nb4-r1集落刺激因子受體(csfr)的表達;式(i)lg-362b可以在體外促進apl細胞株nb4、hl60及atra耐藥細胞nb4-r1細胞表面抗原cd11b的表達。
本發明的atra敏感(as)及atra耐藥(ar)移植性小鼠模型參照上海交通大學醫學院陳國強教授實驗室所建立的動物模型。本發明建立了atra敏感(as)及atra耐藥(ar) 移植性小鼠模型。
本發明提出了式(i)所示的lg-362b化合物在體內和/或體外抑制apl細胞增殖的應用及方法。式(i)lg-362b可以抑制異體移植小鼠模型腫瘤的生長。
本發明提出了式(i)所示的lg-362b化合物在體內和/或體外強烈抑制apl細胞生長的應用及方法。式(i)lg-362b可以抑制異體移植小鼠模型腫瘤的生長。
本發明提出式(i)lg-362b化合物在體內和/或體外強烈抑制apl細胞的浸潤的應用及方法。肝臟、脾臟的重量及大小是反應腫瘤是否浸潤的一個直觀指標。肝臟和脾臟的h&e染色從組織化學上進一步反映apl細胞是否浸潤。
本發明提出式(i)lg-362b化合物在體內和/或體外強烈誘導apl細胞的分化。瑞氏吉姆薩染色法可以檢測由式(i)lg-362b在體內誘導的apl細胞的分化。
本發明提出了式(i)所示的lg-362b化合物在體內和/或體外誘導apl細胞凋亡的應用及方法。式(i)lg-362b可以抑制異體移植小鼠模型腫瘤的生長。
本發明提出了式(i)所示的lg-362b化合物在體內和/或體外強烈抑制apl細胞的凋亡的應用及方法。
在一個實施方案中,所述lg-362b化合物還可與藥學上可接受的固體或液體載體結合,以及任意地與藥學上可接受的輔助劑和/或賦形劑結合。
我們采用mts試劑盒檢測了由本實驗室化學組合成的一系列小分子化合物篩選得到式(i)lg-362b,該化合物能夠在體外和體內強烈抑制apl細胞的增殖以及誘導白apl細胞的分化和凋亡。
附圖說明
圖1所示為lg-362b在體內和外特異性抑制apl細胞增殖的效果。
圖1(a)表示式(i)lg-362b的制備流程圖及其化學結構式。
圖1(b)表示式(i)lg-362b對nb4、hl6o兩株apl細胞以及三株其它類型白血病細胞的增殖的抑制效果。
圖1(c)表示式(i)lg-362b促進nb4和hl6o細胞凋亡呈劑量依賴性效果的直觀統計圖。
圖1(d)表示通過測量腫瘤體積反應式(i)lg-362b在體內對apl細胞皮下生長的抑制效果。
圖1(e)表示通過測量腫瘤重量反應式(i)lg-362b在體內對apl細胞皮下生長的抑制效果。
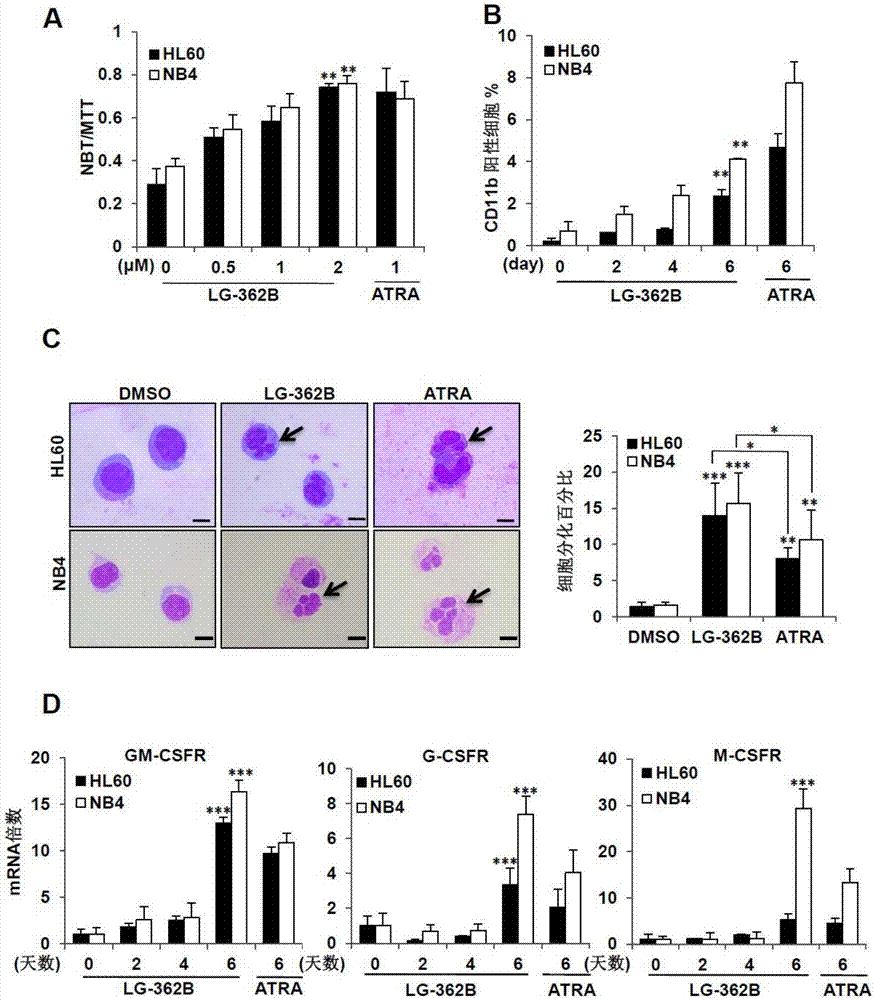
圖2所示為式(i)lg-362b在體外誘導apl細胞分化的效果。
圖2(a)表示式(i)lg-362b體外誘導apl細胞株nb4、hl60發生nbt還原反應。
圖2(b)表示式(i)lg-362b體外促進apl細胞株nb4、hl60細胞表面抗原cd11b的表達。
圖2(c)左圖表示式(i)lg-362b體外誘導apl細胞株nb4、hl60細胞分化的瑞氏吉姆薩染色鏡檢圖。
圖2(c)右圖表示式(i)lg-362b體外誘導apl細胞株nb4、hl60細胞分化的瑞氏吉姆薩染色鏡檢結果統計圖。
圖2(d)表示式(i)lg-362b體外促進apl細胞株nb4、hl60三種csfr表達水平統計圖。
圖3所示為式(i)lg-362b在體內誘導apl細胞分化的效果。
圖3(a)表示式(i)lg-362b延長apl小鼠生存周期效果統計圖。
圖3(b)表示通過測量肝臟重量反應式(i)lg-362b抑制apl細胞肝臟浸潤效果統計圖。
圖3(c)表示式(i)lg-362b體內抑制apl細胞脾臟浸潤效果圖。
圖3(d)表示通過測量脾臟重量反應式(i)lg-362b抑制抑制apl細胞脾臟浸潤效果統計圖。
圖3(e)表示式(i)lg-362b體內誘導apl細胞分化的瑞氏吉姆薩染色鏡檢圖。
圖3(f)表示式(i)lg-362b對apl小鼠肝臟、脾臟浸潤效果的h&e染色鏡檢圖。
圖4所示為式(i)lg-362b體外抑制atra耐藥apl細胞增殖及誘導atra耐藥apl細胞分化效果圖。圖4(a)表示式(i)lg-362b抑制atra耐藥apl細胞增殖效果圖。
圖4(b)表示式(i)lg-362b促進atra耐藥apl細胞呈劑量依賴性凋亡的直觀統計圖。
圖4(c)左圖表示式(i)lg-362b體外誘導atra耐藥apl細胞分化的瑞氏吉姆薩染色鏡檢圖。
圖4(c)右圖表示式(i)lg-362b體外誘導atra耐藥apl細胞分化的瑞氏吉姆薩染色鏡檢結果統計圖。
圖4(d)表示式(i)lg-362b體外誘導atra耐藥apl細胞發生nbt還原反應。
圖4(e)表示式(i)lg-362b體外促進atra耐藥apl細胞表面抗原cd11b的表達。
圖4(f)表示式(i)lg-362b體外促進atra耐藥apl細胞三種csfr表達水平統計圖。
圖5所示為式(i)lg-362b在atra耐藥小鼠模型體內誘導apl細胞分化的效果。
圖5(a)表示式(i)lg-362b延長atra耐藥小鼠模型生存周期效果統計圖。
圖5(b)表示通過測量肝臟重量反應式(i)lg-362b抑制atra耐藥小鼠模型apl細胞肝臟浸潤效果統計圖。
圖5(c)表示式(i)lg-362b體內抑制atra耐藥小鼠模型apl細胞脾臟浸潤效果直觀圖。
圖5(d)表示通過測量脾臟重量反應式(i)lg-362b抑制atra耐藥小鼠模型apl細胞脾臟浸潤效果統計圖
圖5(e)表示式(i)lg-362b體內誘導atra耐藥小鼠模型apl細胞分化的瑞氏吉姆薩染色鏡檢圖。
圖5(f)表示式(i)lg-362b對atra耐藥小鼠模型體內肝臟、脾臟浸潤效果的h&e染色鏡檢圖。圖6所示為式(i)lg-362b通過caspases依賴性途徑誘導pml-rarα融合蛋白及rarα蛋白蛋白降解。
圖6(a)表示式(i)lg-362b下調apl細胞及atra耐藥apl細胞pml-rarα融合蛋白及rarα蛋白的表達效果。
圖6(b)表示式(i)lg-362b降解hl60細胞皮下荷瘤小鼠模型體內實體腫瘤rarα蛋白效果。
圖6(c)表示式(i)lg-362b對pml-rarα融合蛋白及rarα蛋白mrna表達水平的影響。
圖6(d)表示確定式(i)lg-362b降解pml-rarα融合蛋白及rarα蛋白的途徑。
圖6(e)表示式(i)lg-362b誘導apl細胞及atra耐藥apl細胞凋亡相關蛋白的表達。
具體實施方式
結合以下具體實施例和附圖,對本發明作進一步的詳細說明,本發明的保護內容不局限于以下實施例。在不背離發明構思的精神和范圍下,本領域技術人員能夠想到的變化和優點都被包括在本發明中,并且以所附的權利要求書為保護范圍。實施本發明的過程、條件、試劑、實驗方法等,除以下專門提及的內容之外,均為本領域的普遍知識和公知常識,本發明沒有特別限制內容。
實施例1:式(i)lg-362b在體內體外對多種apl細胞增殖的抑制效果。
技術方法:
1.細胞的培養本實驗中所用的jurkat細胞、thp-1細胞購買于atcc細胞庫;hl60細 胞、nb4細胞、nb4-r1細胞、kg1-α細胞來自于上海交通大學醫學院陳國強教授實驗室。細胞培養于37℃恒溫培養箱(濕度95%,co2濃度5%)中,培養基為含10%胎牛血清(front)的rpmi-1640(gibco)。待細胞長滿后,用800rpm離心5min收集離心后的細胞,按一定的比例傳代到裝有新培養基的新的培養瓶。一般2天傳代一次。
2.mts法測定細胞活力
離心重懸細胞后,不同的細胞株以1×104-2×104個/孔密度接種至96孔板(corning)中,96孔板四周用pbs封閉。每孔加入50μl含不同濃度藥物的培養基,對照組加入等量的dmso,使得每孔最終為100μl體系。細胞培養48小時后,避光,每孔加入20μlmts溶液于37℃、5%co2培養箱中孵育1-2h。孵育完成后用酶標儀(spectramax190)于490nm波長下讀取od值。細胞存活率(%)=加藥物od值/對照組od值×100%。獨立重復三次后,計算方差并制作統計圖,以此分析藥物對細胞活力的影響。
3.細胞凋亡(apoptosis)實驗
將懸浮細胞接種于6孔板中,每孔大約50×104個細胞,加入藥物使其最終濃度分別為0μm、0.5μm、1μm、5μm和10μm,不染組和單染組(pi組和annexinv組)的最終藥物濃度均為10μm。于37℃、5%co2培養箱中培養48小時后利用凋亡檢測試劑盒進行凋亡檢測。流式細胞凋亡檢測時,細胞分為不染組、單染pi組、單染annexinv組以及pi、annexinv雙染組。離心收集細胞,計數保證每組不少于100×104/ml個細胞。pbs重懸細胞洗兩次,離心收集細胞。每管加入100μl用milli-q水稀釋成的1×bindingbuffer溶液,用移液槍輕輕吹打,使細胞重懸,不染組不加pi以及annexinv,單染pi組加入pi5μl,單染annexinv組加入annexinv5μl,annexin-v-pi雙染組均加入pi和annexinv各5μl,混勻。室溫避光孵育15分鐘,加入400μl結合緩沖液混勻并轉移到5ml流式管中,進行流式細胞儀檢測分析。
4.小鼠皮下荷瘤模型
皮下荷瘤實驗是檢測體內腫瘤生長的常見模型。將500×104個hl60細胞皮下注射到32只4-5周齡的雄性免疫缺陷小鼠(blab/c-nude,裸鼠)背部皮下,兩周后,有20只小鼠皮下腫瘤長到250mm3左右,然后根據腫瘤體積將小鼠分為四組,每組5只小鼠,并保證每組小鼠腫瘤的平均大小基本一致。四組小鼠分別為:對照組、10mg/kglg-362b處理組、30mg/kglg-362b處理組和30mg/kgatra處理組。分組后即可打藥。10mg/kglg-362b處理組和30mg/kglg-362b處理組小鼠腹腔注射dmso溶解的濃度分別為10mg/kg、30mg/kg的小分子化合物lg-362b,每天注射,連續注射20天。對照組小鼠則每天腹腔注射同等劑量的dmso溶劑。對于atra處理組小鼠,隔天腹腔注射dmso溶解的30mg/kgatra,注射時間與lg-362b處理組小鼠相同。實驗過程中,隔天記錄小鼠體重并測量小鼠背部腫瘤大小,20天 后處死小鼠并剝下腫瘤,拍照并稱重,用4﹪多聚甲醛固定腫瘤組織用于后續免疫組化分析。
實驗結果如圖1(b),(c)(d和e)所示,其中,
如圖1(b)所示式(i)lg-362b對nb4、hl6o兩株apl細胞以及三株其它類型白血病細胞的增殖效果,其中該化合物在較低劑量下就可以有效抑制nb4、hl60兩株apl細胞的增殖,而對于其他三株非apl白血病細胞而言即使在較高劑量藥物作用下抑制效果幾乎不明顯。
如圖1(c)所示,式(i)lg-362b能夠劑量依賴性地促進apl細胞nb4、hl6o的凋亡。
如圖1(d和e)所示,lg-362b在體內能夠有效抑制腫瘤的生長。高劑量給藥組的抑制效果與陽性對照組(atra)的抑制效果基本相同。
以上實驗表明式(i)lg-362b能顯著抑制乳apl細胞株的體外細胞增殖,并能顯著抑制體內apl腫瘤細胞的生長,預示其以作為制備治療apl的潛在藥物。
實施例2:式(i)lg-362b在體外誘導多種apl細胞及atra耐藥細胞分化。
技術方法:
1.瑞氏吉姆薩(wright-giemsa)染色法檢測apl細胞及atra耐藥細胞的分化
首先,用低濃度藥物長時間處理apl細胞及其atra耐藥細胞,通過mts技術檢測細胞的活性,探索在保證細胞活性的實驗條件下研究化合物lg-362b誘導細胞分化的能力。與此同時,考慮到atra作為誘導早幼粒細胞正常分化的經典藥物,我們將atra作為陽性對照以此判斷lg-362b對細胞分化的誘導。接著,在相同實驗條件下我們對nb4、hl60及nb4-r1進行加藥處理,處理相應時間后進行細胞涂片及瑞氏吉姆薩染色。具體制作過程分為以下4個步驟:(1)制作細胞涂片,自然晾干(2)在涂片上滴加a液(約0.5ml-0.8ml)覆蓋整個涂片,室溫染色1min(3)在涂片上滴加a液2-3倍的b液,用吸耳球輕輕吹打混勻,室溫染色3-5min(4)自來水或蒸餾水輕輕沖洗以洗去多余染料,自然晾干后封片,鏡檢。通過顯微鏡觀察染色后細胞的細胞核的形態變化,就可以判定apl細胞是否發生分化。
2.硝基藍四氮唑(nitrobluetetrazolium,nbt)還原實驗
離心收集細胞制備濃度為1×104個/ml的細胞懸液,96孔板每孔接種100μl,加等量含藥物的培養基使其最終濃度分別為0μm、0.5μm、1μm和2μm,于37℃、5%co2的增濕培養箱中培養,每兩天換液一次,培養6天后于高速離心機離心96孔板,分別加入100μl由pbs配制的2mg/ml的mtt和1mg/mlnbt、0.24ug/mltpa溶液重懸細胞,并于37℃培養箱中各孵育1h 和4h,然后離心用pbs洗兩次,每孔加入200μldmso于搖床上搖20min,注意不要過于劇烈以免dmso濺出影響實驗結果。最后用酶標儀于570nm波長下檢測其od值,并通過計算nbt與mtt的od值之比求得還原比。
3.細胞表面抗原檢測技術
300g5min離心收集細胞。隨后用4℃預冷的含2%胎牛血清的pbs反復洗兩次。然后用200μlpbs重懸細胞并分為相同的兩份,一份加1μlcd11b抗體于4℃冰箱中孵育,另一份細胞懸液不加抗體。30min-1h后,再次離心并用4℃預冷的含2%胎牛血清的pbs洗兩次,以洗去多余的抗體,最后用200μlpbs重懸,保證懸液中至少1×104個細胞,避光進行流式細胞儀檢測。
4.聚合酶鏈式反應(polymerasechainreaction,pcr)實驗
4.1rna提取
提取rna的具體操作過程:(1)800rpm離心5min收集懸浮細胞,加1mltrizol,上下輕輕顛倒后室溫裂解5min,放-80℃冰箱可保存一周(2)加200ml氯仿(三氯甲烷)顛倒震蕩混勻,室溫放置5min(3)12000rpm于4℃高速離心機離心20min(4)吸取上層水相至另外一個ep管,注意千萬不要吸到中間界面(5)每毫升trizol加500μl異丙醇,混勻室溫靜置5min。(6)12000rpm4℃離心10min,棄上清,rna沉于管底(7)加1ml由depc水配制的75﹪乙醇,懸浮沉淀(8)800rpm4℃離心5min,盡量棄上清(9)自然晾干(10)加20-30μldepc水溶解rna(11)測rna濃度。
4.2反轉錄
反轉錄具體操作過程:(1)反應體系(10μl體系):5×primescriptrtmstermix2μl;totalrna最多500ng;rnasefreedh20upto10μl。(2)反應條件:37℃30min;85℃5s;4℃∞。
4.3實時定量pcr分析(real-timequantitativepcr)
(1)反應體系(total25μl):sybrpremixextaq12.5μl;pcrforwardprimer(10μm)0.5μl;pcrreverseprimer(10μm)0.5μl;cdna1μl;rnasefreedh2010μl。(2)反應條件:a.預變性:95℃5min1cycle。b.pcr反應:95℃30s變性;55℃30s延伸;72℃30s退火;進行40個cycle。c.溶解曲線:95℃30s;55℃30s;95℃30s;進行1個cycle。(3)realtimepcr引物:gm-csfr、g-csfr、m-csfr和人源β-actin引物序列如下:
gm-csfr
5"-aaacagcccaggacctatc-3"
5"-gacaagggttcccacgatta-3"
g-csfr
5"-agactgggagcagagcttc-3"
5"-cagcgtatctgcagggtgta-3"
m-csfr
5"-caatggcagcgtggaatgg-3"
5"-gcagtagtgcgtcctggtcct-3"
β-actin
5"-tgaagtgtgacgtggacatc-3"
5"-catactcctgcttgctgatc-3"
實驗結果如圖2(a),(b),(c),(d)及圖4(c),(d),(e),(f)所示。
如圖2(a)如圖4(d)所示,式(i)lg-362b誘導apl細胞及其atra耐藥細胞發生nbt反應.如圖2(b)如圖4(e)所示,式(i)lg-362b促進apl細胞及其atra耐藥細胞表面抗原cd11b的表達.如圖2(c)如圖4(c)所示,式(i)lg-362b誘導apl細胞及其atra耐藥細胞的細胞形態發生變化。如圖2(d)如圖4(f)所示,式(i)lg-362b促進apl細胞及atra耐藥細胞三種csfrmrna的表達。
以上實驗表明式(i)lg-362b能夠體外誘導apl細胞及atra耐藥細胞分化。可以作為制備治療apl的潛在藥物。
實施例3:式(i)lg-362b在體內誘導atra敏感及atra耐藥患病小鼠體內apl細胞正常分化
1.小鼠的飼養
4-5周齡的雄性裸鼠和6-8周齡的雄性fvb/n小鼠均在華東師范大學動物中心清潔級屏障動物房飼養。每天飼喂水和鼠糧,定期更換墊料與鼠籠,每籠5只小鼠。從公司購買的小鼠不可直接進入華東師范大學動物中心清潔級屏障,必須在動物中心監察1周以確定其無傳染病,方可進入屏障進行常規飼養。待動物基本適應飼養環境后,即可進行實驗。實驗全過程符合《華東師范大學動物實驗倫理委員會實驗操作規范流程》的相關規定,并受到華東師范大學動物實驗倫理委員會的嚴格監督。
2.atra敏感(as)及atra耐藥(ar)移植性小鼠模型建立
該模型的建立參照上海交通大學醫學院陳國強教授實驗室的atra敏感(as)及atra耐藥(ar)移植性小鼠模型的建立方法,將6-8周fvb/n小鼠首先經過4.5gy劑量x射線 照射,一天后尾靜脈注射2×105個hmrp8-pml-rarα蛋白或其突變體的轉基因小鼠來源的脾臟細胞,移植后第二天即可進行給藥。無論是atra敏感還是耐藥的移植性小鼠,與正常小鼠相比,大概20天后均會出現毛發無光澤、活動能力差、脾臟腫大的患病癥狀,且生存期將明顯降低。
3.骨髓細胞、外周血細胞采集及分析
3.1骨髓細胞采集
頸椎脫臼法處死小鼠后,用75﹪酒精浸泡小鼠5min。然后在超凈臺中用眼科剪小心剪開小鼠腹部皮膚,剪斷小鼠腳踝及髖關節,分離出小鼠下肢。小心剝離下肢的皮膚及肌肉組織后,在脛骨與股骨的連接處剪斷,分離脛骨與股骨。取脛骨或股骨,剪去骨兩端的軟骨,露出骨髓腔,用1ml無菌注射器吸取適量rpmi-1640培養基后輕輕插入骨髓腔,沖洗骨髓腔直至脛骨或股骨呈白色即可采集到骨髓細胞,制作細胞涂片并進行瑞氏吉姆薩染色。
3.2外周血細胞采集
小鼠外周血細胞采集采用眼球取血方法。固定小鼠,將中指輕按在小鼠心臟部位,無名指輕按在小鼠腹部。同時我們用拇指輕壓取血側眼部皮膚。然后用彎頭鑷摘除小鼠眼球,收集流出的血液制作血涂片并進行瑞氏吉姆薩染色。
4.h&e染色
(1)組織固定:將剝離的組織如腫瘤塊、脾臟、心臟、肺、肝臟、腎臟等切成小塊,放入4﹪的多聚甲醛溶液中于搖床中常溫固定過夜。固定時間不宜超過24小時。將固定好的組織塊修剪平整,放入包埋盒中流水沖洗過夜以洗去殘余的多聚甲醛溶液。(2)組織脫水:將組織依次浸入50﹪乙醇、70﹪乙醇、90﹪乙醇i、90﹪乙醇ii、100﹪乙醇i、100﹪乙醇ii中各1h,使組織脫水。(3)組織透明:將組織依次浸入乙醇:二甲苯=1:1溶液30-45min,100﹪二甲苯i、100﹪二甲苯ii溶液各1h,使組織透明。(4)組織包埋:將組織浸入i號蠟30min,ii號蠟中可過夜,iii號蠟處理2h,三種蠟中二甲苯含量依次減少。用包埋機加蠟包埋,待其冷卻凝固形成蠟塊后放-20℃可長期保存。(5)組織切片、展片、烤片:修整蠟塊以突出組織部分,并將其固定在leica切片機上,調節厚度為4μm進行切片,然后放入水溫為42℃展片機中展片,待組織展平后,用硅化防脫載玻片撈出組織片,放在60℃烤片機上烤片2h使組織片固定在載玻片上。常溫或37℃烘箱中保存。(5)將組織切片依次浸入二甲苯i、二甲苯ii、乙醇:二甲苯=1:1、100﹪乙醇i、100﹪乙醇ii、90﹪乙醇i、90﹪乙醇ii、70﹪乙醇i、70﹪乙醇ii、50﹪乙醇溶液中各5min。(6)將組織切片浸于蘇木精中復染10min,在水里漂洗后鹽酸酒精分色30s。自來水中返藍30min。伊紅染料染色5s。(7)將組織切片浸于85﹪乙醇、伊紅、90﹪乙醇i、90﹪乙醇ii、100﹪乙醇i、100﹪乙醇ii、乙醇:二甲苯=1:1、 100﹪二甲苯i、100﹪二甲苯ii中浸泡各5min。(8)封片:中性樹脂封片,晾干、鏡檢。
實驗結果如圖3(a),(b),(c),(d),(e),(f)及圖5(a),(b),(c),(d),(e)所示。如圖3(a)所示,不管是高劑量還是低劑量的lg-362b化合物均能延長atra敏感小鼠的生存期,但是相對而言,高劑量的lg-362b更為明顯地延長了atra敏感小鼠的生存期,并且效果比atra的還要具有優勢。如圖5(a)所示,對于atra耐藥(ar)移植性小鼠而言,atra已經已經無法起到治療作用,而不管是高劑量還是低劑量的lg-362b化合物還是能夠起到延長atra敏感小鼠的生存期的作用。如圖3(b),(c),(d)以及圖5(b),(c),(d)所示,lg-362b能夠顯著抑制atra敏感(as)及atra耐藥(ar)移植性小鼠肝臟及脾臟apl細胞的浸潤。然而,atra對于atra耐藥(ar)移植性小鼠起的抑制作用遠不及lg-362b化合物。如圖3(e)及5(e)所示,lg-362b化合物能夠體內誘導atra敏感(as)及atra耐藥(ar)移植性小鼠外周血(pb)和骨髓細胞(bm)發生分化。如圖3(f)及5(f)所示,h&e染色結果進一步從組織化學水平上驗證了lg-362b能夠顯著抑制atra敏感(as)及atra耐藥(ar)移植性小鼠肝臟及脾臟apl細胞的浸潤。
以上實驗表明式(i)lg-362b能夠誘導atra敏感(as)及atra耐藥(ar)移植性小鼠體內apl細胞及atra耐藥細胞分化。可以作為制備治療apl的潛在藥物。
實施例4:式(i)lg-362b在體外體內降解apl細胞pml-rarα融合蛋白及rarα蛋白蛋白。
技術方法:
1.蛋白樣品的制備
2000rpm離心5min收集藥物處理后的細胞。用預冷的pbs洗兩次。冰上用適量ripa裂解液裂解30min,每隔10min渦旋震蕩以充分裂解細胞。12000rpm4℃離心20min,取上清,去沉淀。即可得到細胞裂解液。在蛋白印跡檢測之前我們使用bca試劑盒(thermoscientific公司提供)來對蛋白進行定量,使得每組蛋白樣品的蛋白總量一致。定量后,加5×sdsloading,于100℃水浴鍋中煮10min,-20℃或-80℃儲存。
2.westernblot(蛋白印跡)實驗
蛋白經煮沸變性后用聚丙烯酰胺凝膠page電泳分離蛋白質樣品,然后轉移到硝酸纖維素薄膜上,首先用特異性抗體(一抗)孵育過夜,再用帶有熒光標記的二抗體孵育一小時,最后用掃膜儀odyssey檢測目的蛋白的表達水平。
實驗結果如圖6(a),(b),(c),(d),(e)所示。如圖6(a)所示,lg-362b下調apl細胞及atra耐藥apl細胞pml-rarα融合蛋白及rarα蛋白的表達。如圖6(b)所 示lg-362b降解了皮下荷瘤小鼠體內實體腫瘤rarα蛋白。如圖6(c)所示lg-362b不影響apl細胞內pml-rarα融合蛋白及rarα蛋白mrna的表達水平。如圖6(d)所示lg-362b通過caspases依賴性途徑誘導pml-rarα融合蛋白及rarα蛋白的降解。
以上實驗表明式(i)lg-362b能夠通過caspases依賴性途徑誘導pml-rarα融合蛋白及rarα蛋白降解,從分子水平上揭示了lg-362的作用機理。可以作為制備治療apl的潛在藥物。
上述實施例僅為了說明本發明的技術構思及特點,其目的在于讓本領域技術人員能夠了解本發明的內容并據以實施,并不能以此限制本發明的保護范圍。凡是根據本發明內容的實質所作出的等效變化或修飾,都應涵蓋在本發明保護范圍內。
- 還沒有人留言評論。精彩留言會獲得點贊!