一種TLR7激動劑的晶型A、其制備方法和醫藥用途與流程
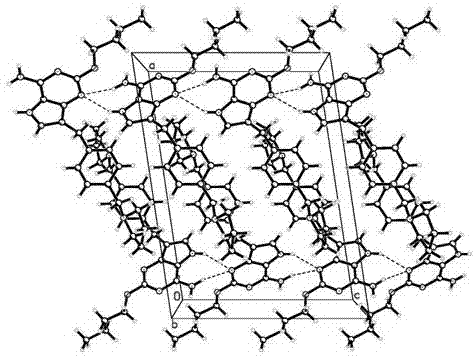
本發明屬于藥物化學領域,具體而言,本發明涉及一種tlr7激動劑(2-丁氧基-7-(4-(吡咯烷-1-基甲基)芐基)-5h-吡咯并[3,2-d]嘧啶-4-胺)的晶型a,以及該晶型a的制備方法、包含該晶型a的結晶組合物、包含該晶型a或其結晶組合物的藥物組合物、以及它們的醫藥用途。
背景技術:
:toll樣受體表達于多種免疫細胞。toll樣受體識別高度保守結構基序:由微生物病原體表達的病原體相關的微生物模式(pamp)或由壞死細胞釋放的損傷相關分子模式(damp)。通過相應的病原體相關的微生物模式(pamp)或損傷相關分子模式(damp)刺激toll樣受體引發信號級聯導致轉錄因子如ap-1、nf-κb和干擾素調節因子(脈沖響應函數)的激活。這導致多種細胞反應,包括生產干擾素,促炎性細胞因子和效應細胞因子,從而產生免疫應答。迄今為止哺乳動物中有13種toll樣受體已被發現。toll樣受體1、2、4、5和6主要表達在細胞表面上,toll樣受體3、7、8和9表達在內體中。不同的toll樣受體識別不同病原體衍生的配體。對于toll樣受體7(tlr7),它主要是由漿細胞樣樹突細胞(pdc)表達和配體識別而誘導干擾素α(ifn-α)的分泌。toll樣受體7(tlr7)和toll樣受體8(tlr8)高度同源。因此tlr7配體,在大多數情況下也是tlr8配體。tlr8刺激主要誘導產生細胞因子如腫瘤壞死因子α(tnf-α)和趨化因子。干擾素α是治療慢性乙型肝炎或丙型肝炎的主要藥物之一,而tnf-α是一種促炎細胞因子,過多分泌可能導致嚴重的副作用。所以對tlr7和tlr8的選擇性對于開發tlr7激動劑用于治療病毒感染性疾病至關重要。tlr7激動劑已有報道,如咪喹莫特,瑞喹莫德,gs-9620。但具備更好的選擇性、活性和安全性的新的tlr7激動劑仍然有很大需求。一種這樣的小分子為2-丁氧基-7-(4-(吡咯烷-1-基甲基)芐基)-5h-吡咯并[3,2-d]嘧啶-4-胺,它具有以下結構:中國專利申請201410405136.0公開了式i化合物及其合成方法等,在此全文引入作為參考。除了治療效力外,藥物研發者試圖提供具有作為藥物的性質(所述性質涉及加工、制造、儲存穩定性等)的活性分子的適合形式。因此,發現具有所需性質的形式對藥物研發至關重要。技術實現要素:本發明一方面提供了式i所示化合物的晶型a,在其x-射線粉末衍射(xrd)圖譜中,具有2θ=5.5°±0.2°、10.1°±0.2°、13.8°±0.2°、19.7°±0.2°、23.7°±0.2°、24.1°±0.2°的衍射峰。本發明另一方面提供了式i所示化合物的晶型a的制備方法,所述方法包括以下步驟:1)使式i所示化合物溶于結晶溶劑中,加熱溶解;2)冷卻析晶、過濾、洗滌、干燥。本發明提供的式i所示化合物的晶型a具有純度高、結晶度高、穩定性好等優點;同時,本發明提供的式i所示化合物晶型a的制備方法簡單,溶劑價廉易得,結晶條件溫和,適合工業化生產。此外,本發明還提供了包含式i所示化合物的晶型a的結晶組合物,其中,式i所示化合物的晶型a占所述結晶組合物重量的50%以上。本發明進一步提供了一種藥物組合物,該藥物組合物中包含有效量的式i所示化合物的晶型a或其結晶組合物,此外,該藥物組合物還可以含有或不含有藥學上可接受的載體、賦形劑和/或介質。本發明的另一方面提供了式i所示化合物的晶型a、其結晶組合物、或其藥物組合物在制備治療toll樣受體7(tlr7)相關疾病的藥物中的用途。可通過如下段落[1]至段落[20]中所述的內容對本發明的技術方案加以說明:[1]一種式i所示化合物的晶型a,其特征在于,在x-射線粉末衍射圖譜中,具有2θ=5.5°±0.2°、10.1°±0.2°、13.8°±0.2°、19.7°±0.2°、23.7°±0.2°、24.1°±0.2°的衍射峰。[2]如段落[1]所述的式i所示化合物的晶型a,其特征在于,在x-射線粉末衍射圖譜中,具有2θ=5.5°±0.2°、10.1°±0.2°、13.8°±0.2°、16.4°±0.2°、19.7°±0.2°、23.7°±0.2°、24.1°±0.2°、27.9°±0.2°的衍射峰。[3]如段落[2]所述的式i所示化合物的晶型a,其特征在于,在x-射線粉末衍射圖譜中,具有2θ=5.5°±0.2°、10.1°±0.2°、13.8°±0.2°、16.4°±0.2°、17.9°±0.2°、19.0°±0.2°、19.7°±0.2°、20.3°±0.2°、21.8°±0.2°、22.1°±0.2°、23.7°±0.2°、24.1°±0.2°、25.5°±0.2°、27.9°±0.2°、32.9°±0.2°、34.0°±0.2°的衍射峰。[4]如段落[1]-[3]中任一項所述的式i所示化合物的晶型a,其特征在于,所述晶型a具有基本上如圖1所示的x-射線粉末衍射圖。[5]如段落[1]-[4]中任一項所述的式i所示化合物的晶型a,其特征在于,所述晶型a具有如下晶胞參數:α=90°β=98.54(3)°γ=90°空間群:p21/cz=4。[6]如段落[1]-[5]中任一項所述的式i所示化合物的晶型a,其特征在于,用dsc進行表征時,所述晶型a的起始溫度為199.0℃±5℃,峰 值溫度為200.4℃±5℃。[7]一種如段落[1]-[7]中任一段所述的式i所示化合物的晶型a的制備方法,該方法包括以下步驟:1)使式i所示化合物溶于結晶溶劑中,加熱溶解;2)冷卻析晶、過濾、洗滌、干燥。[8]如段落[7]所述的制備方法,其特征在于,步驟1)中,所述結晶溶劑選自甲醇、乙醇、丙醇、異丙醇、正丁醇、異丁醇、叔丁醇、丙酮、乙酸乙酯、水或它們的混合溶劑。[9]如段落[8]所述的制備方法,其特征在于,所述結晶溶劑為乙醇。[10]如段落[7]-[9]中任一項所述的制備方法,其特征在于,步驟1)中,每1g式i所示化合物對應加入的結晶溶劑量為2~10ml。[11]如段落[10]所述的制備方法,其特征在于,每1g式i所示化合物對應加入的結晶溶劑量為4~8ml。[12]如段落[11]所述的制備方法,其特征在于,每1g式i所示化合物對應加入的結晶溶劑量為5~7ml。[13]如段落[7]-[12]中任一項所述的制備方法,其特征在于,步驟1)中,所述加熱溶解是使式i所示化合物與結晶溶劑形成均相體系。[14]如段落[7]-[13]中任一項所述的制備方法,其特征在于,步驟1)中,加熱溫度可為40℃~90℃。[15]如段落[14]所述的制備方法,其特征在于,步驟1)中,加熱溫度可為50℃~80℃。[16]如段落[15]所述的制備方法,其特征在于,步驟1)中,加熱溫度可為70℃~80℃。[17]一種結晶組合物,其特征在于,段落[1]-[6]中任一段所述的式i所示化合物的晶型a占結晶組合物重量50%以上,優選80%以上,更優選90%以上,最優選95%以上。[18]一種藥物組合物,包含有效量的如段落[1]-[6]中任一段中所述的式i所示化合物的晶型a或者如段落[17]所述的結晶組合物。[19]如段落[1]-[6]中任一段所述的式i所示化合物的晶型a、或者如段落[17]所述的結晶組合物、或者如段落[18]所述的藥物組合物在制備治療toll樣受體7相關疾病的藥物中的用途。[20]如段落[19]所述的用途,其特征在于,所述疾病為病毒感染。附圖說明圖1式i所示化合物的晶型a的xrpd譜圖。圖2式i所示化合物的晶型a的晶胞圖。圖3式i所示化合物的晶型a的dsc譜圖。具體實施方式本發明采用下述縮略詞:sem-cl代表2-(三甲硅烷基)乙氧甲基氯;dipea代表二異丙基乙基胺;tfa代表三氟乙酸;dmf代表n,n-二甲基甲酰胺;n-buoh代表正丁醇;nh3·h2o代表氨水;na代表金屬鈉;xrpd代表x-射線粉末衍射;dsc代表差熱分析。本發明一方面提供了式i所示化合物的晶型a,在其x-射線粉末衍射(xrpd)圖譜中,具有2θ=5.5°、10.1°、13.8°、19.7°、23.7°、24.1°±0.2°的衍射峰,典型地具有2θ=5.5°、10.1°、13.8°、16.4°、19.7°、23.7°、24.1°、27.9°±0.2°的衍射峰,更典型地具有2θ=5.5°、10.1°、13.8°、16.4°、17.9°、19.0°、19.7°、20.3°、21.8°、22.1°、23.7°、24.1°、25.5°、27.9°、32.9°、34.0°±0.2°的衍射峰。本發明中,x-射線衍射光譜采用下述方法測定:儀器:brukerd8advancex-射線衍射儀;方法:靶:cu:k-alpha;波長管壓voltage:40kv;管流current:40ma;掃描范圍:4~40°;樣品旋轉速度:15rpm;掃描速度:10°/分鐘。在本發明的部分實施方式中,本發明的式i所示化合物的晶型a的衍射峰具有如下特征:在本發明的部分實施方式中,所述式i所示化合物的晶型a的x-射線粉末衍射譜圖如圖1所示。需要說明的是,在x-射線衍射光譜中,由結晶化合物得到的衍射譜圖對于特定的晶型往往是特征性的,其中譜帶(尤其是在低角度)的相對強度可能會因為結晶條件、粒徑和其它測定條件的差異而產生的優勢取向效果而變化。因此,衍射峰的相對強度對所針對的晶型并非是特征性的,判斷是否與已知的晶型相同時,更應該注意的是峰的相對位置而不是它們的相對強度。此外,對任何給定的晶型而言,峰的位置可能存在輕微誤差,這在晶體學領域中也是公知的。例如,由于分析樣品時溫度的變化、樣品移動、或儀器的標定等,峰的位置可以移動,2θ值的測定誤差有時約為±0.2°,典型地約為±0.1°。因此,在確定每種晶型結構時,應該將此誤差考慮在內。在xrd圖譜中通常用2θ角或晶面距d表示峰位置,兩者之間具有簡單的換算關系:d=λ/2sinθ,其中d代表晶面距,λ表入射x射線的波長,θ為衍射角。對于同種化合物的同種晶型,其xrd譜的峰位置在整體上具有相似性,相對強度誤差可能較大。還應指出的是,在混合物的鑒定中,由于含量下降等因素會造成部分衍射線的缺失,此時,無需依賴高純試樣中觀察到的全部譜帶,甚至一條譜帶也可能對給定的晶體是特征性的。在本發明的部分實施方式中,本發明的式i所示化合物的晶型a具有如下晶胞參數(如圖2所示):α=90°β=98.54(3)°γ=90°空間群:p21/cz=4。本發明的式i所示化合物的晶型a也可以用dsc進行表征,起始溫度為199.0℃,峰值溫度為200.4℃。在本發明的部分實施方式中,所述式i所示化合物的晶型a的dsc譜圖如圖3所示。本發明中,差示掃描量熱分析(dsc)采用下述方法測定:儀器:taq2000差示掃描量熱儀;方法:取樣品(~1mg)置于dsc鋁鍋內進行測試,方法為:25℃~300℃,升溫速率10℃/min。dsc測定當晶體由于其晶體結構發生變化或晶體熔融而吸收或釋放熱時的轉變溫度。對于同種化合物的同種晶型,在連續的分析中,熱轉變溫度和熔點誤差典型的在約5℃之內,通常在約3℃之內,當我們說一個化合物具有某一給定的dsc峰或熔點時,這是指該dsc峰或熔點±5℃。dsc提供了一種辨別不同晶型的輔助方法。不同的晶體形態可根據其不同的轉變溫度特征而加以識別。需要指出的是對于混合物而言,其dsc峰或熔點可能會在更大的范圍內變動。此外,由于在物質熔化的過程中伴有分解,因此熔化溫度與升溫速率相關。本發明另一方面提供了式i所示化合物的晶型a的制備方法,包括使式i所示化合物的晶型a從溶劑中析出。在本發明的部分實施方式中,該方法包括以下步驟:1)使式i所示化合物溶于結晶溶劑中,加熱溶解;2)冷卻析晶、過濾、洗滌、干燥。上述步驟1)中,所述結晶溶劑選自甲醇、乙醇、丙醇、異丙醇、正丁醇、異丁醇、叔丁醇、丙酮、乙酸乙酯、水或它們的混合溶劑;優選乙醇。上述步驟1)中,每1g式i所示化合物對應加入的結晶溶劑量為2~10ml,優選4~8ml,更優選5~7ml。上述步驟1)中,所述加熱溶解的目的是將式i所示化合物與結晶溶劑形成均相體系,加熱溫度可為40℃~90℃,優選50℃~80℃,更優選70℃~80℃。本發明另一方面提供了包含式i所示化合物的晶型a的結晶組合物。在本發明的部分實施方式中,式i所示化合物的晶型a占結晶組合物重量50%以上,優選80%以上,更優選90%以上,最優選95%以上。此外,所述“結晶組合物”中除了晶型a外還可以含有其它晶型、或無定形、或式i化合物以外的雜質。本發明的另一方面提供了包含式i所示化合物的晶型a的藥物組合物,該藥物組合物中包含有效量式i所示化合物的晶型a、或其結晶組合物,此外,該藥物組合物還可以含有或不含有藥學上可接受的載體、賦形劑和/或介質。本發明中,術語“藥物組合物”是指本發明的晶型a或其結晶組合物與在本領域中通常接受的用于將生物活性化合物輸送至有機體,例如人,的載體、賦形劑和/或介質的制劑。藥物組合物的目的是有利于對有機體給予本發明的晶型a或其結晶組合物。本發明中,術語“藥學上可接受的載體”是指對有機體無明顯刺激作用,而且不會損害該活性化合物的生物活性及性能的載體和稀釋劑。“藥學上可接受的賦形劑和/或介質”是指與活性成分一同給藥的、有利于活性成分的給藥的惰性物質。“藥學上可接受的載體、賦形劑和/或介質”包括但不限于可用于人或家畜動物的任何載體、賦形劑、介質、助流劑、增甜劑、稀釋劑、防腐劑、染料/著色劑、矯味增強劑、表面活性劑、潤濕劑、分散劑、崩解劑、助懸劑、穩定劑、等滲劑、溶劑或乳化劑。所述賦形劑的非限制性實例包括碳酸鈣、磷酸鈣、各種糖和各類淀粉、纖維素衍生物、明膠、植物油和聚乙二醇等等。以純的形式或以適宜的藥物組合物形式的本發明化合物的給藥可通過提供類似用途的藥劑的任何可接受給藥模式來進行。本發明的藥物組合物可通過將本發明的化合物與適宜的藥學上可接受的載劑、稀釋劑或賦形劑組合而制備,且可配制成固態、半固態、液態或氣態制劑,如片劑、丸劑、膠囊劑、粉劑、顆粒劑、膏劑、乳劑、懸浮劑、溶液劑、栓劑、注射劑、吸入劑、凝膠劑、微球及氣溶膠等等。給予本發明化合物或其藥物組合物的典型途徑包括但不限于口服、 直腸、透黏膜、經腸給藥,或者局部、經皮、吸入、腸胃外、舌下、陰道內、鼻內、眼內、腹膜內、肌內、皮下、靜脈內給藥。本發明的藥物組合物可以采用本領域眾所周知的方法制造,如常規的混合法、溶解法、制粒法、制糖衣藥丸法、磨細法、乳化法、冷凍干燥法等等。在優選的實施方式中,藥物組合物是口服形式。對于口服給藥,可以通過將活性化合物與本領域熟知的藥物可接受的載體、賦形劑和/或介質混合,來配制該藥物組合物。這些載體、賦形劑和介質能使本發明的化合物被配制成片劑、丸劑、錠劑、糖衣劑、膠囊劑、液體、凝膠劑、漿劑、懸浮劑等,用于對患者的口服給藥。可以通過常規的混合、填充或壓片方法來制備固體口服組合物。例如,可通過下述方法獲得:將所述的活性化合物與固體賦形劑混合,任選地碾磨所得的混合物,如果需要則加入其它合適的輔劑,然后將該混合物加工成顆粒,得到了片劑或糖衣劑的核心。適合的賦形劑包括但不限于:填充劑,如糖,包括乳糖、蔗糖、甘露醇或山梨糖醇;纖維素制劑例如微晶纖維素、玉米淀粉、小麥淀粉、大米淀粉和馬鈴薯淀粉;以及其它物質,如硅膠、明膠、黃芪膠、甲基纖維素、羥丙基甲基纖維素、羥甲基纖維素鈉和/或聚乙烯吡咯烷酮;崩解劑,如羧甲淀粉鈉、交聯羧甲基纖維素鈉、交聯聚乙烯吡咯烷酮、瓊脂或藻酸,也可以使用鹽,如藻酸鈉。可以根據通常藥物實踐中公知的方法任選地對糖衣劑的核心進行包衣,尤其使用腸溶包衣。本發明的另一方面提供了式i所示化合物的晶型a、或其結晶組合物或藥物組合物在制備治療toll樣受體7(tlr7)相關疾病的藥物中的用途,優選地,所述疾病選自病毒感染。本發明提供的式i所示化合物的晶型a具有純度高、結晶度高、穩定性好等優點;同時,本發明提供的式i所示化合物晶型a的制備方法簡單,溶劑價廉易得,晶型條件溫和,適合工業化生產。實施例本發明所使用的所有溶劑是市售的,無需進一步純化即可使用。反 應一般是在惰性氮氣下、無水溶劑中進行的。質子核磁共振數據記錄在brukeravanceiii400(400mhz)分光儀上,化學位移以四甲基硅烷低場處的(ppm)表示。質譜在安捷倫1200系列加6110(&1956a)上進行測定。lc/ms或shimadzums包含一個dad:spd-m20a(lc)和shimadzumicromass2020檢測器。質譜儀配備有一個正或負模式下操作的電噴霧離子源(esi)。制備例1:2-丁氧基-7-(4-(吡咯烷-1-基甲基)芐基)-5h-吡咯并[3,2-d]嘧啶-4-胺的制備式iii:2,4-二氯-5-((2-(三甲基硅基)乙氧基)甲基)-5h-吡咯并[3,2-d]嘧啶式ii化合物(2,4-二氯-5h-吡咯并[3,2-d]嘧啶)(4.00kg,21.28mol)溶解于dmf(20.00l)中;室溫(25℃)下分批加入dipea(2.58kg,20.00mol),隨后攪拌30min,反應液用冰浴降溫至0℃,然后在5小時內,以1~2滴/秒的滴速,緩慢滴加sem-cl(4.00kg,24.00mol),滴完后,反應液在0℃下攪拌反應4小時,hplc監測反應完全,反應液用70l水淬滅稀釋后,用乙酸乙酯(15l×3)萃取,合并的有機相依次用1m的鹽酸水溶液(5l×2)和飽和食鹽水(7l×2)洗滌,減壓蒸餾除去溶劑后得式iii化合物(6.40kg,20.11mol,產率94.50%)。1hnmr(400mhz,dmso-d6)δ8.24-8.35(m,1h),6.70-6.85(m,1h),5.77(s,2h),3.45-3.57(m,2h),0.74-0.86(m,2h),0.00(s,9h)。式iv:2-氯-5-((2-(三甲基硅基)乙氧基)甲基)-5h-吡咯并[3,2-d]嘧啶-4-胺10l高壓釜中,式iii化合物(1.60kg,5.03mol)溶于異丙醇(1.60l),室溫(25℃)下一次性加入氨水(4l),反應混合物在95℃下攪拌7小時,hplc監測反應完畢,反應液自然冷卻到室溫,經布氏漏斗過濾后得到黑褐色固體,該固體依次用乙酸乙酯/正庚烷(1/1,5l×2)中打漿,乙酸乙酯(4l)打漿,得到式iv化合物棕色固體(1.25kg,4.18mol,產率83.1%)。1hnmr(400mhz,dmso-d6)δ7.61-7.77(m,1h),6.97-7.19(m,2h),6.28-6.38(m,1h),5.54-5.67(m,2h),3.43-3.53(m,2h),0.76-0.91(m,2h),0.07(s,9h)。式v:2-丁氧基-5-((2-(三甲基硅)基乙氧基)甲基)-5h-吡咯并[3,2-d]嘧啶-4-胺氮氣保護下,金屬鈉(525.05g,22.84mol)緩慢分批加入到n-buoh(17.0l)中;加入完畢后,體系升溫至60℃,并在該溫度下持續攪拌,直至金屬鈉全部溶解,隨后,體系冷卻至25℃,將式iv化合物(1.95kg,6.53mol)分批加入,攪拌混合均勻后,反應物在90℃下持續攪拌8小時,hplc監測反應完全,反應混合物自然降溫至25℃后,緩慢倒入30l飽和氯化銨水溶液中,隨后用乙酸乙酯(15l×3)萃取,合并的有機相用飽和食鹽水(20l×2)洗滌,經無水na2so4干燥、過濾后,減壓蒸餾除去溶劑后,殘余物在正庚烷(4l)中打漿,過濾分離得到固體,再在乙酸乙酯(5l)中打漿,得到式v化合物黃白色固體(1.53kg,4.55mol,69.7%)。1hnmr(400mhz,dmso-d6)δ7.49-7.54(m,1h),6.54-6.62(m,2h),6.15-6.20(m,1h),5.54(s,2h),4.10-4.22(m,2h),3.42-3.55(m,2h),1.58-1.73(m,2h),1.35-1.47(m,2h),0.90-0.96(m,3h),0.83-0.89(m,2h),0.05(s,9h)。式vi:2-丁氧基-5h-吡咯并[3,2-d]嘧啶-4-胺式v化合物(1.10kg,3.27mol)溶于tfa(5.50l),反應液在25℃下持續攪拌16小時,hplc監測反應完全,減壓蒸餾除去tfa,剩余物溶解在甲醇(1.2l)和冰水(1.2l)中,均勻攪拌下,用濃氨水調節體系ph至12,然后攪拌2小時,溶液中不斷有沉淀析出,過濾后,濾餅為白色固體,依次用15%的氨水(1.2l×3)和乙酸乙酯(4l)打漿,得到式vi化合物白色固體(550.00g,2.67mol,81.7%)。1hnmr(400mhz,甲醇-d4)δ7.37(d,j=2.89hz,1h),6.29(d,j=3.01hz,1h),4.27(t,j=6.53hz,2h),1.75(d,j=7.91hz,2h),1.44-1.61(m,2h),1.00(t,j=7.40hz,3h)。式vii:4-((4-氨基-2-丁氧基-5h-吡咯并[3,2-d]嘧啶-7-基)-羥基甲基)苯甲醛將對苯二甲醛(790.64mg,5.82mmol)和異丙醇(10ml)投入至三口瓶中,攪拌下加入2-丁氧基-5h-吡咯并[3,2-d]嘧啶-4-胺(1.00g,4.85mmol),降溫至0℃,之后繼續攪拌10min,加入純化水(10ml)和碳酸鉀(804.17mg,5.82mmol),25℃反應16hr,lcms監控至原料反應完全,反應完全后,有固體析出。過濾,所得固體用20ml純化水打漿,30ml(乙酸乙酯/正庚烷=1/20)打漿,過濾,干燥,得到式vii化合物黃色固體(1.50g,4.41mmol,收率:90.9%)。1hnmr(400mhz,甲醇-d4)δ9.94(s,1h),7.86(d,j=8.16hz,2h),7.72(d,j=8.16hz,2h),7.12-7.17(m,1h),6.19(s,1h),4.28(t,j=6.53hz,2h),1.68-1.77(m,2h),1.44-1.54(m,2h),0.97(t,j=7.34hz,3h)。式viii:(4-氨基-2-丁氧基-5h–吡咯并[3,2-d]嘧啶-7-基)(4-(吡咯烷-1- 基甲基)苯基)甲醇將式vii化合物(450.0g,1.32mol)和異丙醇(4.5l)投入至30l反應釜中,攪拌5min,之后加入冰醋酸(119.0g,1.98mol),攪拌降溫至0-10℃,滴加吡咯烷(112.4g,1.58mol),在滴加中保持溫度低于10℃,滴畢,分批次加入三乙酰氧基硼氫化鈉(420.0g,1.98mol),10-20℃反應3hr,液相監控至原料完全消失,反應完全后,加入純化水5l,將溶液溫度降至-10℃左右,加入15%氨水12l,加入過程中溶液溫度低于0℃,攪拌有固體析出,過濾,所得濾餅2l水打漿,2l×2乙酸乙酯打漿,過濾,40℃減壓烘干12hr,得到式viii化合物,黃色固體465.0g,1.18mol,收率89.4%,水分0.9%。1hnmr(400mhz,甲醇-d4)δ7.46(d,j=7.91hz,1h),7.29(d,j=8.03hz,1h),7.09(s,1h),6.12(s,1h),4.29(t,j=6.53hz,2h),3.60(s,2h),2.52(br.s.,4h),1.66-1.83(m,6h),1.49(d,j=7.53hz,2h),0.98(t,j=7.40hz,3h)。式i:2-丁氧基-7-(4-(吡咯烷-1-基甲基)芐基)-5h-吡咯并[3,2-d]嘧啶-4-胺將式viii化合物(440.0g,1.11mol)和二氯甲烷(7.0l)投入20l反應釜中,攪拌降溫至-15℃以下,滴加三乙基硅烷(880ml,5.55mol)后,繼續滴加三氟乙酸(880ml),在滴加中保持溫度低于-10℃,滴加完畢后,0℃反應2hr,液相監控至原料點消失,反應完全后,將反應液濃縮至干,加入乙酸乙酯2.2l,攪拌降溫至0℃以下,之后加入飽和碳 酸鈉溶液調節溶液ph=9-10,此過程中溫度小于10℃,過濾,所得濾餅用2.2l水打漿后過濾,減壓烘干,得到式i的三氟乙酸鹽白色固體550g。將525g的式i的三氟乙酸鹽白色固體加入1.6l乙醇,攪拌降溫至0℃左右,之后加入1mol/l的氫氧化鈉溶液2.2l,過濾,濾餅用2.5l純化水打漿,過濾,濾餅減壓烘干得到式i化合物,固體380.0g。1hnmr(400mhz,甲醇-d4)δ7.46(d,j=7.91hz,1h),7.29(d,j=8.03hz,1h),7.09(s,1h),6.12(s,1h),4.29(t,j=6.53hz,2h),3.60(s,2h),2.52(br.s.,4h),1.66-1.83(m,6h),1.49(d,j=7.53hz,2h),0.98(t,j=7.40hz,3h)。實施例1:2-丁氧基-7-(4-(吡咯烷-1-基甲基)芐基)-5h-吡咯并[3,2-d]嘧啶-4-胺晶型a的制備取由制備例1獲得的式i的化合物380g溶于乙醇(2.3l)中,加熱回流,攪拌至全部溶解,過濾,濾液降至室溫,靜置析晶,過濾,所得濾餅減壓干燥,得到固體310.0g,即為式i化合物的晶型a。采用下述方法對xrpd進行測定:儀器:brukerd8advancex-射線衍射儀;方法:靶:cu:k-alpha;波長管壓voltage:40kv;管流current:40ma;掃描范圍:4~40°;樣品旋轉速度:15rpm;掃描速度:10°/分鐘。結果顯示,所獲得的化合物晶體具有基本上如圖1所示的衍射峰。實施例2:高溫穩定性試驗依據《原料藥與藥物制劑穩定性試驗指導原則》(中國藥典2010版附錄xixc),考察式i化合物的晶型a在加速試驗高溫條件下的穩定性。將實施例1得到的晶型a置于開口潔凈容器中,60℃下放置,分別于第10、20和30天取樣檢測,檢測結果與第0天的初始檢測結果進行比較,試驗結果見下表1所示:表1取樣時間(天)外觀含量(%)總雜質(%)0白色粉末99.80.9210淡黃色粉末98.51.1020淡黃色粉末98.11.1830淡黃色粉末98.81.29高溫穩定性試驗顯示,式i所示化合物的晶型a在高溫條件下有著良好的穩定性。實施例3:高濕穩定性試驗依據《原料藥與藥物制劑穩定性試驗指導原則》(中國藥典2010版附錄xixc),考察式i化合物的晶型a在加速試驗高濕條件下的穩定性。將實施例1得到的晶型a開口置于恒溫恒濕容器中進行加速試驗,條件為40℃/75%濕度(敞口),于第30、60和90天取樣檢測,檢測結果與第0天的初始檢測結果進行比較,試驗結果見下表2所示:表2高濕穩定性試驗顯示,式i所示化合物的晶型a在高濕條件下有著良好的穩定性。藥物活性效果實施例效果實施例1:toll樣受體7和toll樣受體8體外受體結合活性篩選方案試劑:hek-bluehtlr7細胞和hek-bluehtlr8細胞(來源于invivogen公司)dmem培養基熱滅活胎牛血清抗支原體試劑normocintm博來霉素殺稻瘟菌素方案:(1)96孔化合物板的準備:利用液體工作站pod將化合物從10mmol/l濃度起始,用dmso做3倍梯度稀釋,共稀釋10個點(從第2列到第11列,每個點2個重復)。在第12列加入1μl5mg/ml的陽性化合物r848作為陽性對照,在第1列加入1μldmso作為陰性對照。每孔中含有的dmso 體積均為1μl。(2)收集細胞培養瓶中的細胞,將細胞密度稀釋成250,000個細胞/ml。(3)加入200μl(50,000個細胞/孔)細胞懸液至準備好的化合物板中。每孔中dmso終濃度為0.5%。(4)將含有細胞和化合物的培養板放入co2培養箱中培養24小時,培養條件為37℃,5%co2濃度。(5)培養24小時后,從細胞培養板中每孔取出20μl上清液轉移到一塊96孔透明檢測板中。然后往檢測板中每孔加入180μlquanti-blue試劑,并置于37℃,5%co2培養箱孵育1小時。(6)1小時后,用酶標儀od650讀板檢測20μl上清液中堿性磷酸酶的含量。(7)利用prism軟件分析數據,得出各化合物的ec50。實驗結果如表3所示:表3化合物名稱tlr7ec50(nm)tlr8ec50(nm)gs-96205177867式i化合物16011632結論:本發明的式i所示化合物展現出比對照品(toll樣受體7激動劑gs-9620)更高的與toll樣受體7體外受體結合活性,以及比對照品(toll樣受體7激動劑gs-9620)更低的與toll樣受體8體外受體結合活性。效果實施例2外周血單個核細胞試驗方案本實驗目的在于檢測利用式i所示化合物刺激人外周血單核細胞(pbmc)24h后細胞因子的表達水平。檢測時細胞上清液不稀釋,直接檢測ifn-α的水平。實驗過程中首先將式i的化合物配制成20mmol濃度的dmso儲存液,用細胞培養基做10倍梯度稀釋,總共稀釋11個點。取其中9個稀釋點的化合物(化合物的最高濃度為200μmol/l)加入96孔板中,每孔50μl,然后接種新鮮的人外周血單核細胞,每孔接種150μl體系,其中含有450,000個細胞。將細胞培養板置于37℃和5%co2培養箱中培養24小時,培養結束后將培養板以1200rpm的速度離心5分鐘,隨后收集上清并將其儲存于 -20℃以待檢測。細胞因子的檢測利用bd公司的流式液相多重蛋白定量技術(cba),在流式細胞儀上完成檢測。利用上述檢測方法,我們將刺激產生30pg/ml的ifn-α的最低藥物濃度,定義為該化合物在該細胞因子刺激實驗上的mec值。實驗結果如下表4所示:表4化合物名稱inf-αmec(nm)tnf-αmec(nm)gs-962050500式i的化合物5500結論:本發明的式i化合物展示出比對照品(gs-9620)更好的體外pbmc的ifn-α誘導活性、以及與對照品(gs-9620)相當的tnf-α的誘導活性。當前第1頁12
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1