環境響應型多價態異喹啉-3-羧酸偶聯物及其制備方法和應用與流程
本發明涉及異喹啉-3-羧酸偶聯物,尤其涉及環境響應型多價態異喹啉-3-羧酸偶聯物及其制備方法,本發明還涉及該環境響應型多價態異喹啉-3-羧酸偶聯物在抗腫瘤中的應用,屬于異喹啉-3-羧酸偶聯物領域。
背景技術:
惡性腫瘤是多發性疾病,對人類健康造成了嚴重危害。發展惡性腫瘤的臨床化療藥物一直是腫瘤研究的熱點之一。異喹啉類生物堿廣泛存在于自然界并具廣譜的生物活性。自從1974年,kluepfel等從streptomyceslusitanus中分離到第一個具有抗腫瘤活性的四氫異喹啉天然產物naphthriydinomycin以來,異喹啉生物堿作為抗腫瘤劑的應用得到廣泛關注(scott,j.d.;williams.r.m.chem.rev.2002,102,1669.)。其中ecteinascidin743于2007年被批準在歐洲上市用于治療晚期軟組織肉瘤(molinski,t.f.;dalisay,d.s.;lievens,s.l.;saludes,j.p.natrevdrugdiscov.2009,8,69.)。因此異喹啉類生物堿的研究成為抗腫瘤藥物研發的熱點之一,特別是在新藥及其新藥先導化合物發現中起著不可替代的作用。盡管異喹啉-3-羧酸表現出一定的抗腫瘤活性,但由于存在溶解度差、生物利用度低等缺陷,使得其無法很好地發揮抗腫瘤功能。現有的技術,如公布號為cn104211767a的中國發明專利申請公開了用寡肽agdv修飾異喹啉-3-羧酸,但是這樣制得的異喹啉-3-羧酸衍生物在相對高的劑量下(1μm/kg)體內抗腫瘤的抑制率并不高。因此,有必要用新的技術進一步改善異喹啉-3-羧酸的抗腫瘤活性。
生物體內糖配體與蛋白之間可以通過多價效應的協同作用增強它們之間的親和性、特異性,產生所謂的“多價效應”(multivalenteffect)或“簇 集效應”(clustereffect)。研究發現在細胞與細胞之間、細胞與毒素之間、細胞與病毒之間、細胞與細胞間質之間的吸附等生物過程中普遍存在這種多價態結合。生物系統中多價作用的強度可能比一個低分子量的配體與一個蛋白的單一作用或是他們幾個單一作用的加和都高得多。公布號為cn101876658a(申請號:200910310366.8)的中國發明專利公開了多價性質使得細胞表面受體介導納米載體內吞的效率顯著提高。多價效應這一概念為設計新型藥物分子提出了新方案。
腫瘤臨床的化學治療通常不容易獲得滿意療效。在眾多影響因素中,抗腫瘤藥物的毒副作用至關重要。抗腫瘤藥物在體內運輸過程中會受到氧化還原物質等內源性刺激。氧化還原響應型藥物就是人體內氧化還原反應作為刺激,來達到藥物的智能釋放。谷胱甘肽(gsh)是一種還原劑,能特異性地還原二硫鍵。其中最具有代表性的二硫鍵和巰基體系,二硫鍵在人體內廣泛存在,對人體沒有生理毒性,可以穩定存在于人體的血液環境中,但是在外界環境中含有一定量的具有還原性的巰基時,二硫鍵就會發生斷裂。腫瘤組織細胞由于生長代謝比正常組織細胞快,消耗氧的量就高于正常細胞,因而腫瘤組織細胞含有的還原型谷胱甘肽的濃度就遠高于正常組織細胞,當以二硫鍵鍵合在載體上的藥物被運送腫瘤細胞時,就很容易被腫瘤細胞內大量的還原型谷胱甘肽還原,二硫鍵發生斷裂而生成巰基,從而達到藥物的靶向智能釋放。
申請號為201410255238.9的中國專利公開了以β-環糊精為藥物載體與七個有抗腫瘤活性的異喹啉-3-羧酸偶聯得到優秀的抗腫瘤劑。但目前尚未見多個異喹啉這類具有抗腫瘤活性的生物堿通過二硫鍵偶聯得到氧化還原響應的多價態化合物的合成及作為抗腫瘤劑的應用。
技術實現要素:
本發明的目的之一是提供一種具有抗腫瘤活性的氧化還原響應的多 價態異喹啉-3-羧酸偶聯物;
本發明的目的之二是提供一種制備所述氧化還原響應的多價態異喹啉-3-羧酸偶聯物的方法;
本發明的目的之三是提將所述的氧化還原響應的多價態異喹啉-3-羧酸偶聯物應用于制備抗腫瘤藥物。
為實現上述目的,本發明所采取的技術方案是:
一種具有良好抗腫瘤活性的氧化還原響應的多價態異喹啉-3-羧酸偶聯物,其為式ⅰ所示的結構:
本發明進一步提供了一種制備所述式ⅰ所示結構的多價態異喹啉-3-羧酸偶聯物的方法,包括:
(1)將異喹啉-3-羧酸與n-叔丁氧羰基三氨乙基胺進行縮合反應,得到下述式ⅱ所示的化合物:
(2)將式ⅱ所示的化合物脫去保護基得到式ⅲ所示的化合物:
(3)將式ⅲ所示的化合物與3,3’-二硫代丙二酸通過接肽的方式進行偶聯,得到式ⅰ所示結構的多價態異喹啉-3-羧酸偶聯物。
優選的,步驟(1)中在n,n-二甲基甲酰胺(dmf)溶液中,采用1-羥基苯并三唑(hobt),n,n'-二環己基碳二亞胺(dcc)將異喹啉-3-羧酸與n-叔丁氧羰基三氨乙基胺(tren)脫水縮合。
通過體外細胞毒實驗,本發明分別評價了異喹啉-3-羧酸(4)、化合物(8)以及陽性藥阿霉素三個化合物對于a2780、hela、hepg2、kb、mcf-7五株腫瘤細胞的細胞活性。實驗結果顯示,本發明的化合物8較母核異喹啉-3-羧酸(4)對腫瘤細胞的細胞毒作用有明顯提高。
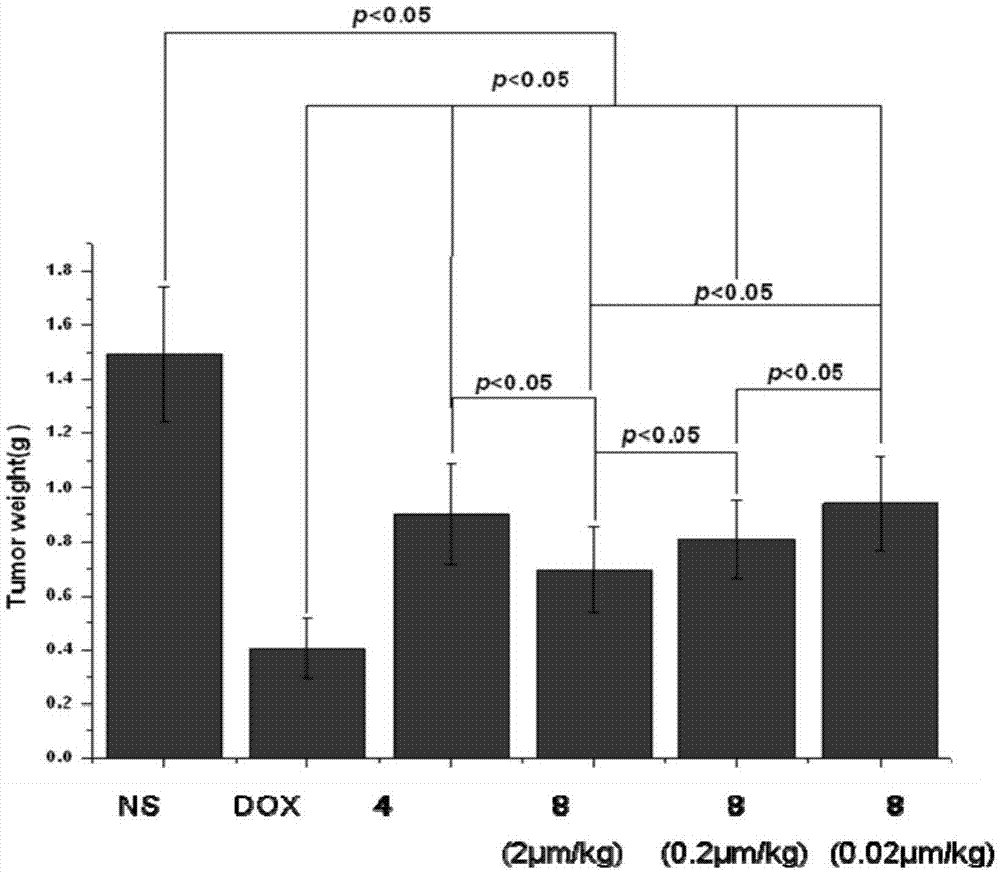
在體內小鼠移植性腫瘤模型中,本發明分別對母核異喹啉-3-羧酸(4)、本發明化合物(8)、阿霉素(dox)進行抗腫瘤評價。根據實驗結果可見,本發明化合物(8)在2μmol/kg給藥劑量下,抑瘤率為53.40%;與生理鹽水組瘤重相比p<0.05,具有顯著性差異;與母核異喹啉-3-羧酸(4)相比p<0.05,說明本發明化合物(8)在與母核(4)相同劑量下表現出優于母核的抗腫瘤活性。化合物(8)的劑量依賴性研究表明,在不同劑量下,各組瘤重之間相比,p值均小于0.05,并且化合物(8)在0.02μmol/kg給藥劑量下的抗腫瘤活性與母核異喹啉-3-羧酸(4)在8μmol/kg的劑量下相當,p>0.05。這一結果表明,本發明的化合物(8)在低于母核異喹啉-3-羧酸400倍的劑量下達到與母核相當的抗腫瘤能力,表明化合物(8)是個優秀的抗腫瘤化合物。
本發明化合物(8)的化學結構中含有二硫鍵(s-s),其在還原環境中則會被還原劑(如還原型谷胱甘肽gsh)斷裂,生成含有巰基(-sh)的還原產物,分子量為化合物(8)的一半,且極性發生改變。因此利用lc-ms 可以檢測到當化合物(8)處于還原環境中化合物(8)的峰消失,在另一處則出現還原產物的新峰,并檢測出相應的分子量。本發明化合物的體外還原響應釋放實驗結果說明本發明化合物(8)對gsh有良好的還原敏感響應性,藥物對腫瘤環境具有刺激響應釋放的能力。
本發明選用3,3’-二硫代丙二酸為連接臂,將四個異喹啉3-羧酸與通過三(2-氨基乙基)胺之偶聯,形成異喹啉衍生物,不僅可以通過藥物載體上多個藥效團對病變位點的多價協同作用顯著提高了抗腫瘤活性,而且可以通過二硫鍵對腫瘤環境氧化還原的響應,對藥物進行智能靶向釋放降低對正常組織的毒性。
附圖說明
圖1為本發明化合物(8)的合成路線。
圖2為本發明化合物(8)的體內腫瘤量效關系。
圖3為本發明化合物(8)在體外還原響應的lc-ms圖。
具體實施方式
下面結合具體實施例來進一步描述本發明,本發明的優點和特點將會隨著描述而更為清楚。但是應理解所述實施例僅是范例性的,不對本發明的范圍構成任何限制。本領域技術人員應該理解的是,在不偏離本發明的精神和范圍下可以對本發明技術方案的細節和形式進行修改或替換,但這些修改或替換均落入本發明的保護范圍。
實施例1制備(3s)-1,2,3,4-四氫異喹啉-3-羧酸(化合物1)
將hcl(320ml)和hcho(160ml)置于500ml茄瓶中,混合后加入l-phe(30.10g,182.45mmol),于油浴95℃反應24h后終止反應,冷卻至室溫。冰浴下用飽和naoh調節ph至6~7,有大量白色固體析出。過濾得白色固體(21.80g,67.54%)。esi-ms(m/z):178.1[m+h]+。
實施例2制備(3s)-1,2,3,4-四氫異喹啉-3-羧酸甲酯(化合物2)
在250ml茄瓶中加入甲醇(100ml),冰鹽浴下逐滴滴加二氯亞砜(15ml),攪拌30min后,緩慢加入(3s)-1,2,3,4-四氫異喹啉-3-羧酸(1)(10.00g,56.50mmol),反應9-10h,將反應液抽干,得到白色固體(8.46g,78.40%)。esi-ms(m/z):192.0[m+h]+。
實施例3制備異喹啉-3-羧酸甲酯(化合物3)
在250ml茄瓶中加入(3s)-1,2,3,4-四氫異喹啉-3-羧酸甲酯(2)(4.23g,22.15mmol),冰鹽浴下加入n,n-二甲基甲酰胺(50ml)將其溶解,加入高錳酸鉀2.97g(18.79mmol),反應6h后加入乙醇(50ml)攪拌30min,移除溶劑,加入甲醇(30ml)復溶。柱層析分離純化得到無色固體(858mg,24.56%)。esi-ms(m/z):188.0[m+h]+。
實施例4制備異喹啉-3-羧酸(化合物4)
在100ml茄瓶中加入異喹啉-3-羧酸甲酯(3)(858mg,4.59mmol),用少量甲醇溶解,冰鹽浴下用2nnaoh調節ph=12,出現白色沉淀;待反應結束后,冰鹽浴下用飽和khso4調節ph=7,旋除所有溶劑。用二氯甲烷和甲醇的混合溶液溶解,過濾,收集濾液。將濾液旋除后,得白色固體(481.7mg,60.69%)。esi-ms(m/z):171.9[m-h]-。
實施例5制備n-叔丁氧羰基三氨乙基胺(化合物5)
在100ml的雙頸瓶中,滴加三氨乙基胺(5.1ml,34.23mmol)溶于30ml的二氧六環中,稱取二碳酸二叔丁酯(1.2g,5.5mmol)溶于30ml的二氧六環中,然后緩慢滴加于反應液中,在n2保護下,反應17h。反應結束后,旋干反應液,旋干后得到的粗產物用柱層析分離純化,得到透明油狀物(940mg,69%)。esi-ms(m/z):246.2[m+h]+。
實施例6制備化合物(6)
在250ml茄瓶中加入異喹啉-3-羧酸(4)(415.2mg,2.4mmol),用dmf30ml溶解,n-叔丁氧羰基三氨乙基胺(5)(246.2mg,1mmol)溶于5mldmf后逐滴滴入茄瓶中,然后在油浴恒溫50℃下加入dmtmm(664.1mg,2.4mmol),反應12h后,移除溶劑,然后柱層析分離純化得到白色固體(353.6mg,63.6%)。esi-ms(m/z):557.2[m+h]+。1h-nmr(300mhz,dmso-d6):δ=9.097(s,2h),8.813(t,2h),8.448(s,2h),8.039(dd,j1=12.8hz,j2=4.5hz,4h),7.804(t,j=7.1hz,2h),7.710(t,j=7.2hz,2h),3.457(q,6h),2.752(t,j=6.2hz,6h),1.303(s,9h).13cnmr(75mhz,dmso-d6)δ/ppm=164.39,156.03,151.69,144.21,135.71,131.64,129.42,129.34,128.27,128.04,119.82,77.95,53.39,38.78,37.55,28.60。
實施例7制備化合物(7)
在100ml的茄瓶中加入化合物(6)(353.6mg,0.64mmol),滴加約2mltfa溶解,攪拌反應8h,待反應結束后,旋干溶劑,旋干后得到的粗產物用柱層析分離純化得到白色固體(196.1mg,67.2%)。esi-ms(m/z):457.5[m+h]+。1h-nmr(300mhz,dmso-d6):δ=9.19(s,2h),8.92(t,2h),8.38(s,2h),8.06(dd,j1=18.0hz,j2=9.0hz,4h),7.77(t,j=7.5hz,2h),7.71(t,j=7.5hz,2h),3.45(q,4h),2.90(t,j=6.0hz,2h),2.75(t,j=6.0hz,6h).13cnmr(75mhz,dmso-d6)δ/ppm=164.71,151.76,144.07,135.63,131.60,129.45,129.36,128.22,128.08,119.89,54.08,40.82,40.55。
實施例8制備化合物(8)
在50ml的茄瓶中加入3,3’-二硫丙二酸(46.2mg,0.22mmol),hobt(58.1mg,0.43mmol),dcc(106.6mg,0.52mmol),用3mldmf溶解,置于冰浴下攪拌1h,撤去冰浴室溫下攪拌1h,用2mldmf溶解化合物(7)(196.1mg,0.43mmol),然后逐滴滴入茄瓶中,反應12h。待反應結束后,過濾除去固體,旋干液體,旋干后得到的粗產物用柱層析分離純化,得到白色固體(65.3mg,27.3%)。esi-ms(m/z):1086.4[m+h]+。1h-nmr(300mhz,dmso-d6):δ/ppm:=9.013(s,4h),8.777(t,j=5.4hz,4h),8.376(s,4h),7.983(d,j=8.4hz,4h), 7.953(d,j=9hz,4h),7.876(t,j=4.5,2h),7.728(td,j1=7.5hz,j2=1.2hz,4h),7.643(td,j1=8.1hz,j2=0.9hz,4h),3.500(q,j=5.4hz,8h),3.200(q,j=5.4hz,4h),2.876(t,j=7.2hz,4h),2.708(t,j=6hz,8h),2.649(t,j=6.6hz,4h),2.565(t,j=7.2hz,4h).13cnmr(75mhz,dmso-d6):δ/ppm:=170.50,164.53,151.57,144.00,135.54,131.52,129.31,129.26,128.17,127.96,119.83,53.44,53.33,37.48,37.42,35.47,34.28。
實驗例1本發明化合物的體外細胞毒實驗
本發明的化合物均用含0.5%dmso的培養基配制。共使用了a2780(人卵巢癌細胞)、hela(人宮頸癌細胞)、hepg2(人肝癌細胞)、mcf-7(人乳腺癌細胞)、kb(人口腔表皮癌細胞),五株腫瘤細胞。分別將生長狀態良好、處于對數生長期的hela、a2780、hepg2、mcf-7、kb細胞按照4×105個/ml的密度接種于96孔板,每孔100μl。在37℃、5%co2條件下繼續培養48小時,然后加入mtt溶液(5mg/ml)進行染色,每孔25μl。然后繼續培養4小時,小心移除上清液,并加入100μl的dmso溶液。在搖床上震搖15分鐘,使沉淀完全溶解。然后用酶聯免疫檢測儀檢測各孔吸光度值,檢測波長為490nm。計算抑瘤率及ic50。結果列入表1。
表1體外細胞毒活性(ic50±sdμm)a
a阿霉素用dox表示,n=6
在體外細胞毒實驗中,分別評價了異喹啉-3-羧酸(化合物(4))、化合物(8)以及陽性藥阿霉素三個化合物對于a2780、hela、hepg2、kb、mcf-7五株腫瘤細胞的細胞活性。實驗結果顯示,化合物(8)對a2780、hela、hepg2、kb、mcf-7五株腫瘤細胞的ic50值分別為17.17±1.19 μmol/l、22.30±3.33μmol/l、14.62±2.13μmol/l、11.54±0.92μmol/l、5.27±1.21μmol/l,母核異喹啉-3-羧酸(4)對a2780、hela、hepg2、kb、mcf-7五株腫瘤細胞的ic50值均大于100μmol/l。結果表明,本發明的化合物8較母核異喹啉-3-羧酸(4)對腫瘤細胞的細胞毒作用有明顯提高。
實驗例2荷s180小鼠移植性腫瘤模型評價化合物(8)體內抗腫瘤活性實驗
無菌條件下取接種于icr小鼠7-10天的s180肉瘤細胞,加入適量生理鹽水配制成瘤細胞懸液,細胞數為1.2×107個/ml,接種于健康雄性icr小鼠前肢腋皮下,每只小鼠注射0.2ml瘤液。健康icr雄性小鼠靜息一天后,第二天在每只小鼠腋下接種s180細胞液0.2ml,并在接種后隨機分為5組。腫瘤接種24h后,即第三天起,每組分別連續9天給藥,實驗組小鼠每日灌胃給藥0.2ml本發明化合物的水溶液(2μmol/kg)。空白組小鼠每日灌胃給藥0.2ml生理鹽水。對照組小鼠每日腹腔注射0.2ml阿霉素水溶液(2μmol/kg)。第12天對各組小鼠脫椎處死,分別取出每只小鼠的腫瘤、心、肝、脾、腎、腦,并稱重,最后統計化合物的抑瘤率。化合物的療效以瘤重抑制百分率表示,計算如下:瘤重抑制率%=(1-給藥組瘤重/空白組瘤重)×100%。實驗結果見表2。
表2不同劑量化合物(8)對icr雄性小鼠腫瘤形成的影響的抗腫瘤活性
瘤重用mean±sdg表示,n=12;阿霉素用dox表示;a)與ns組相比,p<0.05;b)與dox組相比,p<0.05;c)與異喹啉-3-羧酸(4)相比,p<0.05;d)與化合物8(2μmol/kg)劑量相比,p<0.05;e)與化合物8(0.2μmol/kg)劑量相比,p<0.05;f)與異喹啉-3-羧酸(4)相比,p>0.05。
抑瘤率按公式計算:抑瘤率=(生理鹽水組平均瘤重-實驗組平均瘤重) /生理鹽水組平均瘤重;統計方法采用獨立樣本t檢驗。
在體內小鼠移植性腫瘤模型中,分別對母核異喹啉-3-羧酸(4)、本發明化合物(8)、阿霉素(dox)進行抗腫瘤評價。得出以下結果:(1)阿霉素(dox)在2μmol/kg給藥劑量下,抑瘤率為72.81%,與生理鹽水組瘤重相比p<0.01,具有極顯著性差異,說明小鼠s180移植性腫瘤模型建立成功。(2)異喹啉-3-羧酸(4)在8μmol/kg給藥劑量下,抑瘤率為39.61%,與生理鹽水組瘤重p<0.05,說明化合物異喹啉-3-羧酸(4)母核抗腫瘤活性。(3)本發明化合物(8)在2μmol/kg給藥劑量下,抑瘤率為53.40%;與生理鹽水組瘤重相比p<0.05,具有顯著性差異;與母核異喹啉-3-羧酸(4)相比p<0.05,說明本發明化合物(8)在與母核(4)相同劑量下表現出優于母核的抗腫瘤活性。化合物(8)的劑量依賴性研究表明,在不同劑量下,各組瘤重之間相比,p值均小于0.05,并且化合物(8)在0.02μmol/kg給藥劑量下的抗腫瘤活性與母核異喹啉-3-羧酸(4)在8μmol/kg的劑量下相當,p>0.05。這一結果表明,本發明的化合物(8)在低于母核異喹啉-3-羧酸400倍的劑量下達到與母核相當的抗腫瘤能力,表明化合物(8)是個優秀的抗腫瘤化合物。
實驗例3本發明化合物的體外還原響應釋放實驗
化合物(8)的化學結構中含有二硫鍵(s-s),其在還原環境中則會被還原劑(如還原型谷胱甘肽gsh)斷裂,生成含有巰基(-sh)的還原產物,分子量為化合物(8)的一半,且極性發生改變。因此利用lc-ms可以檢測到當化合物(8)處于還原環境中化合物(8)的峰消失,在另一處則出現還原產物的新峰,并檢測出相應的分子量。實驗結果如圖3所示,化合物(8)(m+na=1109.4173)在加入gsh后,二硫鍵斷裂,化合物(8)的峰消失,生成還原產物(m+na=567.2136),說明化合物(8)對gsh有良好的還原敏感響應性,藥物對腫瘤環境具有刺激響應釋放的能力。
- 還沒有人留言評論。精彩留言會獲得點贊!