使用基因組特異性探針的循環腫瘤和腫瘤干細胞檢測的制作方法
本申請要求于2014年12月10日提交的美國臨時申請序列號62/090,167的優先權權益,其全部內容在此通過引用并入。
背景技術:
:1.
技術領域:
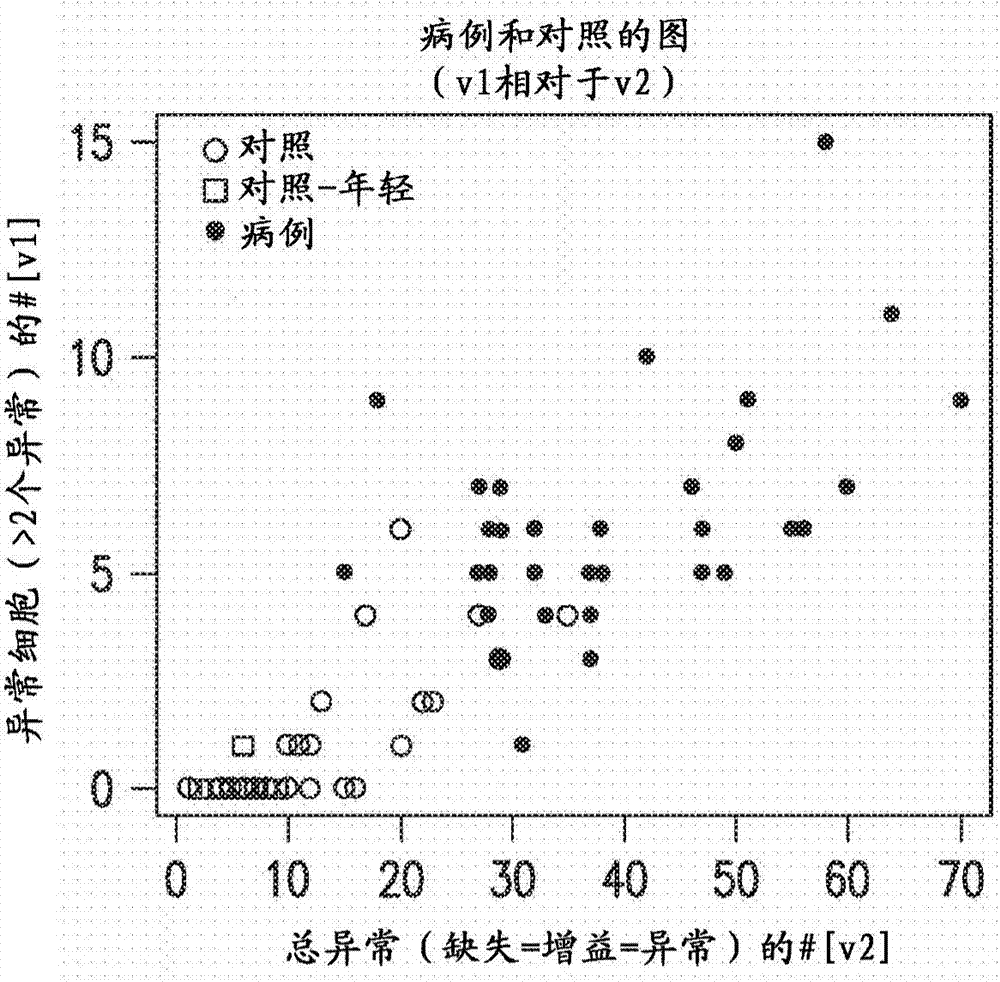
本公開內容涉及腫瘤學、遺傳學和分子生物學領域。更特別地,本公開內容涉及使用針對高度預測贅生物形成(neoplasia)的發生和贅生性事件的進展的區域的探針。利用本公開內容,可以使用極少量的血液(例如,手指針刺物)來篩選對象的例如肺癌。2.相關技術說明據估計2005年在美國肺癌占新癌癥病例的13%,并且是癌癥死亡的主要原因。不幸的是,盡管在治療上取得了進展,但是總體5年存活率仍保持低于15%。明顯地,需要開發用于治療肺癌的新策略,并且同時開發可以用于監測對新治療的早期應答的靈敏性替代生物標志物。構成腫瘤亞群的一小部分但確是關鍵部分的循環癌細胞(circulatingcancercell,ctc)或腫瘤干細胞的存在現在被認為是用于檢測和根除患者應答和存活的“圣杯”。cristofanilli等(2004)在患有轉移性乳腺癌的患者的前瞻研究中表明,在基線處ctc高于5個/7.5ml血液的患者與顯著更短的無進展存活和更短的總體存活二者均相關。pierga等類似地報道了患有乳腺癌的患者的外周血中細胞角蛋白陽性ctc的存在與階段和預后相對應(pierga等,2004)。一些研究者已著眼于與原發性腫瘤相比轉移細胞中的基因組標簽,并且已經發現原發性腫瘤中預測轉移和不良臨床結果的基因表達標簽(gangnus等,2004;ramaswamy等,2003;muller和pantel,2004)。另一些研究者使用pcr在非小細胞肺癌(non-smallcelllungcancer,nsclc)病例中的外周血中鑒定與ctc有關的基因,并且已經表明不良的治療應答與治療后的ctc檢測有關(sher等,2005)。一種共識正在形成:癌發生(carcinogenesis)的關鍵早期事件是基因組不穩定性表型的誘導,這使得初始細胞能夠通過得到更大的增殖能力而演變成癌細胞(fenech等,2002)。眾所周知,癌癥由可通過染色體改變介導的多個遺傳變化的累積引起,并且由此具有在細胞遺傳學上可檢測的潛力(solomon等,1991)。已經假定,外周血淋巴細胞中遺傳損傷的水平反映了導致靶組織中癌發生過程的前體細胞損傷的量(hagmar等,1998)。最近來自組群和巢式病例-對照研究的結果已經有力地證實了細胞遺傳生物標志物與癌癥風險呈正相關的證據,其顯示染色體畸變是作為癌癥風險的標志物(liou等,1999;bonassi等,2000;bonassi等,2004;smerhovsky等,2001;tucker和preston,1996),這反映致癌原的遺傳毒性效應和個體癌癥易感性是用于測量dna損傷的常用方法,因為評價微核(mn)比染色體畸變相對地更容易(fenech等,2002)。mn起源于未能接合有絲分裂紡錘體并且因此在細胞分裂時滯后的染色體片段或整個染色體。相比于其他細胞遺傳測定,量化mn提供了數個優點,包括分析的速度和方便、無需中期細胞以及可靠地鑒定已經完成僅一次核分裂的細胞,這防止了由細胞分裂動力學的差異所引起的混淆影響,因為mn、npb或nbud的表達依賴于核分裂的完成(fenech,2000)。由于細胞阻滯于雙核階段,故還可以測量起源于不對稱的染色體重排和/或端粒末端融合的核質橋(nucleoplasmicbridge,npb)(umegaki等,2000;stewenius等,2005)。當在后期雙著絲粒染色體或染色單體的著絲粒被拉至細胞的相對極時,npb出現。在cbmn測定中,容易觀察到具有npb的雙核細胞,因為胞質分裂被抑制,從而阻止npb所來源的后期橋斷裂并且由此在npb周圍形成核膜。在暴露于dna斷裂劑的細胞中mn和npb均出現(stewenius等,2005;fenech和crott,2002)。除mn和npb之外,cbmn測定還允許檢測核芽(nuclearbud,nbud),其代表細胞移除擴增的dna的機制,并且因此被認為是可能的基因擴增的標志物(fenech(2002)綜述)。cbmn測試正在緩慢地替代在淋巴細胞中的染色體畸變分析,因為mn、npb和nbud易于識別和評分,并且可以在較短時間內獲得結果(fenech,2002)。在肺癌患者中預測臨床結果的因素包括疾病或腫瘤負荷的程度。循環腫瘤細胞(ctc)可以作為腫瘤負荷的量度,并且還可以是更準確地分期患者的方法。先前基于以下測定來從全血中分離ctc,所述測定采用包被有抗細胞角蛋白抗體的磁珠(陽性選擇),或用針對上皮細胞的角蛋白的抗體(epicam)消耗cd45淋巴樣細胞或消耗cd45細胞。oncoquick系統涉及梯度分離的細胞和免疫組織化學以及隨后的圖像分析。用于獲得ctc的其他方法包括介電電泳(dielectrophoresis,dep)陣列法,其中通過電極陣列將包含經熒光標記的ctc的經富集細胞樣品注射到盒中,這產生介電場。這將每個細胞誘捕到dep虛擬籠中,在此之后,可基于熒光模式來選擇目的細胞并將其分派用于進一步研究。然而,為了發現哪些目的細胞可能是ctc,操作者必需預先知曉ctc的免疫表型。先前檢測ctc的方法還包括pcr測定。然而,這些方法不能量化腫瘤細胞的數目或觀察形態。基于先前為抗原依賴性并且需要ctc表達血流中僅少數ctc表達的上皮抗原epcam的方法,發現循環癌細胞的產率低到不存在,尤其是在肺癌和三陰性乳腺癌中。因此,需要開發用于檢測樣品中ctc并確定其中ctc水平的更靈敏且與抗原無關的方法。實現這一點的最有前途方式之一依賴于考慮在正常外周血單個核細胞(peripheralbloodmononuclearcell,pbmnc)中從未發現的染色體異常的測試,所述染色體異常限定非整倍體細胞并且可以通過間期熒光原位雜交(inter-phasefluorescence-in-situhybridization)或fish量化。發明概述提供了在含血細胞樣品中檢測循環腫瘤細胞(ctc)的方法,其包括:(a)通過評估核面積和/或圓度來從含血細胞樣品中選擇ctc;(b)使選擇的細胞與針對3p22.1、10q22.3、10號染色體著絲粒(chromosome10centromeric,cep10)和3號染色體著絲粒(chromosome3centromeric,cep3)的經標記核酸探針雜交;(c)通過檢測來自細胞的熒光原位雜交來評價選擇的細胞的信號模式;以及(d、)基于所有4種經標記核酸探針與所選擇的細胞雜交的模式來檢測ctc。所述方法還可以包括獲得所述樣品。步驟(d)可以包括評估所有異常或僅增益。所述方法可以包括四個探針組中兩個或更多個的異常。所述方法還可以采用通過例如使用免疫組織化學檢測表面活性蛋白(例如sp-a、sp-b和/或sp-c)來進行ctc檢測。通常來說,例如使用dapi(4’,6-二脒基-2-苯基吲哚)來對核染色以允許評估/分選。在某些實施方案中,從細胞中獲得核并使其自行分選。可以使用標準的細胞裂解方案來裂解細胞。通常以彩色或單色ccd相機對細胞制備物上存在的全部有核細胞成像并分類。分類的細胞的數目由操作者預先設定,但是通常針對以下掃描數千個細胞:1)基于dapi染色的以像素計的核面積,其表示為任意單位,因此,如果為5000,則意指細胞面積為5000像素;2)核直徑;以及3)圓度因子(circularityfactor,cf),其通過改變伸長率(細胞的高度和寬度之間的比例)來計算,其中完美圓的值為1(淋巴細胞的cf接近1,異常細胞由于其核周長的不規則性而有很多cf>>1)。如在dapi染色(核染色)上測量的,異常細胞(惡性ctc)的核面積以核所占據的像素的數目(如通過fish多體性(polysomy)>2所限定的)為基礎,并且以任意單位表示。在其中ctc的絕對數目具有診斷性的一些實施方案中,4個或更多個ctc的發現將指示患者具有癌癥。所述方法還可以包括在步驟(b)之前過濾所述血液樣品,例如通過使用真空裝置和穿孔有7.5μm孔的膜來過濾所述血液樣品;并且進一步地,所述血液樣品是外周血單個核細胞的梯度分離樣品。血液樣品可以是通過ficoll-hypaque梯度從血液中分離的血沉棕黃層(buffycoatlayer),例如通過基于cd3和/或cd45珠的純化進一步純化以除去白細胞的血沉棕黃層。ctc的選擇可以通過評估核面積來實現,評估核面積包括通過確定核直徑或通過dapi濃度及其標準差來確定每個ctc的像素尺寸并施加預定閾值進行排除。患者可以是已知或懷疑患有癌癥的,所述癌癥例如引起血源性轉移的癌癥形式,包括但不限于肺、頭和頸、乳腺、結腸、前列腺、胰腺、食管、腎、胃腸腫瘤、泌尿生殖腫瘤、腎、黑素瘤、內分泌腫瘤(甲狀腺,包括乳頭狀甲狀腺癌;腎上腺皮質或髓質)或肉瘤的癌癥。染色還可以包括使樣品與經標記的cd45抗體、經標記的snail1抗體和/或經標記的抗glut1抗體接觸,例如其中標記為熒光標記或生色原(chromagen)標記。檢測信號可以包括使用自動化熒光掃描儀。所述方法還可以包括在步驟(b)至(d)中使用并檢測一種或更多種另外的探針,例如urovysiondna探針組;lavysiondna探針組;著絲粒7/7p12表皮生長因子(egfr)探針;cep7/7p22.1、cep17和9p21.3探針;egfr/cep和10/cep10q探針;pten、cep10和cep10q探針;和/或eml4-alk探針組。在另一個實施方案中,提供了如下確定來自患者的含血細胞樣品中循環腫瘤細胞(ctc)的水平的方法:(a)通過評估核尺寸和/或圓度來從血液樣品中選擇ctc;(b)使選擇的細胞與針對3p22.1、10q22.3、10號染色體著絲粒(cep10)和3號染色體著絲粒(cep3)的經標記核酸探針接觸;(c)檢測來自細胞的熒光原位雜交;以及(d)基于與所有4種經標記核酸探針的雜交來量化ctc。步驟(d)可以包括評估所有異常或僅增益。所述方法可以包括四個探針組中的兩個或更多個的異常。所述方法還可以采用通過例如使用免疫組織化學檢測表面活性蛋白(例如sp-a、sp-b和/或sp-c)來進行ctc檢測。在又一個實施方案中,提供了在患者中檢測癌癥的方法,其包括通過上述任一種方法來確定來自患者的含血細胞樣品中循環腫瘤細胞(ctc)的水平,其中樣品中存在等于4個或更多個ctc指示癌癥,例如其中樣品為分離的血沉棕黃層的5ml樣品。在又一個實施方案中,提供了在患者中檢測癌癥的方法,其包括通過上述任一種方法來確定來自患者的含血細胞生物樣品中ctc的水平,其中在肺中存在大于3mm的不確定結節的情況下,血液樣品中存在ctc指示癌癥。在又一個實施方案中,提供了在處于高肺癌風險的患者中篩選肺癌的方法,其包括通過上述任一種方法來確定來自患者的含血細胞樣品中循環腫瘤細胞(ctc)的水平,其中血液樣品中ctc的存在指示肺癌。高風險可以基于年齡>55歲、當前或曾經為吸煙者的歷史、暴露于二手香煙煙霧或者具有癌癥家族史。所述方法還可以包括當觀察到ctc存在時進行螺旋ct掃描。所述方法還可以包括在第二時間點重復所述方法以確定ctc水平的增加。在又一個實施方案中,提供了在患者中評價癌癥的方法,其包括通過上述任一種方法來確定來自患者的含血細胞樣品中循環腫瘤細胞(ctc)的水平,其中與對照或來自非侵襲性癌癥形式的預定ctc數目相比,樣品中ctc的水平較高指示侵襲性癌癥形式和/或癌癥預后差。對照可以是非癌性樣品。所述方法還可以包括獲得患者樣品,報告ctc水平,和/或基于ctc水平是否高來治療癌癥,例如用化學治療、放射治療、外科手術、基因治療、免疫治療、靶向治療或激素治療來治療癌癥。在另一個實施方案中,提供了在患者中監測癌癥的治療的方法,其包括:(a)通過上述任一種方法來確定來自患者的第一樣品中ctc的水平;(b)通過上述任一種方法來確定來自實施治療后的患者的第二樣品中ctc的水平;以及(c)將第一樣品中ctc的水平與第二樣品中ctc的水平進行比較以評估變化,從而監測治療。所述方法還可以包括如果與步驟(a)相比步驟(b)中ctc水平降低,則繼續治療。所述治療可以是化學治療、放射治療、外科手術、基因治療、免疫治療、靶向治療或激素治療。所述方法還可以包括如果與步驟(a)相比步驟(b)中ctc水平未降低,則停止治療。所述方法還可以包括獲得所述第一和/或第二患者樣品。另一個實施方案包括在患者中分期癌癥的方法,其包括通過上述任一種方法來確定來自患者的含血細胞樣品中的循環腫瘤細胞(ctc),其中與給定期的預定對照相比,樣品中ctc的水平較高指示較晚期的癌癥,以及與給定期的對照相比,樣品中ctc的水平較低指示較不晚期的癌癥。對照可以是肺癌0期樣品、肺癌i期樣品、肺癌1a期樣品、肺癌1b期樣品、肺癌ii期樣品、肺癌iii期樣品、肺癌iv期樣品、和/或肺非癌性樣品。所述方法還可以包括獲得患者樣品,報告ctc水平,和/或如果ctc水平指示較晚期的癌癥,則治療癌癥。所述治療可以是化學治療、放射治療、外科手術、基因治療、免疫治療、靶向治療或激素治療。所述方法可用于在治療開始之后細化癌癥分期。在一些具體實施方案中,與對照樣品中的水平相比,ctc水平高至少50%。在另一些實施方案中,ctc水平是對照樣品的水平的至少約或至多約2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25倍大,或可從中推出的任何范圍。在一些具體實施方案中,ctc水平是對照樣品的水平的至少2倍大。對于前述任一種方法,還可以檢測一種或更多種癌癥基因標記的表達水平從常規的變化。這些可以促進所述方法的診斷、分期或預后。可以考慮,本說明書中討論的任何實施方案可以根據本公開內容的任何方法或組合物來實施,反之亦然。此外,本公開內容的組合物可以用于實現本公開內容的方法。權利要求書和/或說明書中沒有數量詞修飾的名詞的使用可以意指“一個/種”,但是其還與“一個/種或更多個/種”、“至少一個/種”和“一個/種或多于一個/種”的含義一致。如見于權利要求書和/或說明書中的短語“一個/種或更多個/種”被限定為1、2、3、4、5、6、7、8、9、10個/種或更多個/種。在本申請通篇,術語“約/大約”和“近似”表示值包括裝置、用于確定值的方法的固有誤差變化,或研究對象間存在的變化。在一個非限制性實施方案中,該術語被限定為在10%內,優選在5%內,更優選在1%內,并且最優選在0.5%內。除非明確地指出僅指替代方案或者替代方案相互排斥,否則權利要求書中術語“或/或者”的使用用于意指“和/或”,但是本公開內容支持指僅替代方案和“和/或”的定義。如本說明書和權利要求書中使用的,詞語“包含”(及其任何變化形式)、“具有”(及其任何變化形式)、“包括”(及其任何變化形式)或“含有”(及其任何變化形式)是包括式或開放式的,并且不排除另外的未記載要素或方法步驟。通過以下詳細描述,本公開內容的其他目的、特征和優點將變得顯而易見。然而,應理解,詳細描述和具體實例盡管說明本公開內容的一些具體實施方案但是僅以示例的方式給出,因為通過該詳細描述,在本公開內容的精神和范圍內的多種變化方案和修改方案將對本領域技術人員變得顯而易見。附圖簡述通過參照這些附圖中的一幅或更多幅并結合本文中所示具體實施方案的詳細描述,本公開內容可以更好地被理解。圖1:數據流。圖2a至2d:74個樣品的3d散點圖。圖2a(左上)、圖2b(右上)、圖2c(左下)和圖2d(右下)-74個樣品的3d散點圖。圖3:數據中檢測到的聚簇(cluster)的估計數目。圖4:使用平均連接之簇聚方法的聚簇樣品。圖5:euclideand(y-軸)相對于聚簇(x-軸)。2個紅色菱形(病例)在對照組中,并且聚簇2中的3個空心圓為對照樣品。紅色箭頭指向具有相同euclideand=859的兩個不明確樣品(參見表13)。圖6:外周血單個核細胞中的遺傳異常,其評價所有細胞中染色體的增加和丟失。500個外周血細胞中病例和對照之間所有遺傳異常、缺失和增加之間的比較指出,在25的閾值下,我們有2個假陽性但100%靈敏,如果與另一種增益測試組合,則獲得幾乎完全完美的靈敏性和特異性。y軸=異常數,x軸=對象數。圖7:循環腫瘤細胞的非整倍性,其限定為在4-基因fish探針分析中任何基因增加2個或更多個的細胞。使用>4個異常細胞的閾值,本發明人可以預測患有癌癥的21/23病例的癌癥狀況;注意到使用該閾值,本發明人觀察到100%的特異性。x軸=患者數,y軸=異常細胞的#。示例性實施方案的詳細描述患有肺癌的患者中的循環腫瘤細胞(ctc)會顯示出與原發性肺癌中可見的類似的遺傳異常。其他研究者已經使用免疫磁性捕獲或密度梯度離心與免疫組織化學和fish來檢測ctc的非整倍性。然而,所有的研究盡管證明了與原發性腫瘤的那些類似的遺傳異常但是仍受到低細胞回收率和不能夠在ctc<10/7.5ml血液的患者中檢測染色體異常的限制。與原發性腫瘤包含相同遺傳異常的遺傳異常單個核細胞(或循環腫瘤細胞)存在于肺癌患者的外周血中,與腫瘤階段和腫瘤負荷有關,并且相對于高階段疾病在患有低階段疾病的患者中以較低水平出現。在基線時和治療后隨訪時通過組合的免疫組織化學和熒光原位雜交(fish)監測外周血中的這些細胞提供了針對治療的應答的靈敏分子標志,即使攜帶這些染色體或遺傳異常疾病的細胞的數目降低。在一些情況下,本發明人已經表明ctc水平可以在肺癌的外科手術切除后3至6周達到峰值,并且遠遠高于在外科手術之前在基線時采集的初始血液樣品。本發明人將該第二峰歸因于ctc從隔離位點(例如骨髓)移動到外周血中,并且在12周后采集的第三隨訪血液可以落回到低于基線水平。該發現與更長的存活有關。類似地,具有這些缺失的細胞的數目的持續或增加會指示穩定或進行性疾病。例如,在早期肺贅生物形成的發病機制中同時并且非常早地出現染色體3p21.3和3p22.1的缺失。與肺癌贅生物形成高度相關的大量腫瘤抑制基因位于基因組的這一部分中(barkan等,2004;goeze等,2002)。類似地,染色體10q22-23的缺失已經被頻繁地報道存在于原發性肺癌以及轉移性肺癌(二者均用于小細胞和非小細胞肺癌(nscl))中。此外,10q22-23的缺失與侵襲性臨床過程有關,其中高水平的缺失與預后不良緊密相關jiang等,2005;goeze等,2002;gough等,2002)。因此,本公開內容提供了這樣的方法,其使用核尺寸排阻方法、使用已驗證的核酸探針組的fish分析從外周血中分離腫瘤細胞用于檢測癌癥、治療后隨訪以及用于縱向監測疾病狀態和對不同治療的應答。已經表明,與先前的方法相比,通過本公開內容的方法可以以遠遠更高的水平在外周血中發現具有克隆遺傳異常的細胞。該方法具有以下益處:(1)與其他方法先前所描述的相比,能夠分離數目遠遠更高的異常細胞,從而允許使用較小的樣品體積;(2)能夠使用與免疫熒光染色組合在單個樣品上的多種分子dna探針來進行多色fish以獲得ctc的表型并證明克隆形成能力;以及(3)能夠通過檢測具有合適核尺寸的細胞來富集異常表型。與其他方法相比,靈敏性和準確性方面得到顯著提高。應注意,本申請中所述的方法可以適用于從引起血源性轉移的任何其他類型癌癥中分離循環腫瘤細胞。這包括肺、乳腺、結腸、前列腺、胰腺、食管、全部胃腸腫瘤、泌尿生殖腫瘤、腎癌、黑素瘤、內分泌腫瘤、肉瘤等的癌癥。特別地,基于已公開的基因組數據或基于如下產生的基因組數據每組腫瘤可推導出在特定癌癥亞型中異常的一組基因組標記:用比較基因組雜交(comparativegenomichybridizatiom,cgh)或單核苷酸多態性(singlenucleotidepolymorphism,snps)測試不同的腫瘤并進行生物信息學以確定不同基因的過表達或表達不足。在待測試異常分子區域的最優選擇之后,可以合成最佳的熒光標記探針。i.癌癥本公開內容設想了使用測定來檢測癌癥并結合癌癥治療來預測癌癥進展。在其中患者懷疑處于癌癥風險之中的一些情況下,可以采用預防性治療。在另一些癌癥對象中,診斷可以允許早期的治療干預。在又一些情況下,本文中所述的測定的結果可以提供關于重復治療需要的有用信息,例如,當存在轉移性疾病、復發性疾病或殘余疾病的可能性時。最后,本公開內容證明可以用于表明哪些治療向和不向特定患者提供益處。此外,本申請中所述的方法能夠被轉化成用于從引起血源性轉移的任何其他類型癌癥中分離循環腫瘤細胞的方法。這包括肺、乳腺、結腸、前列腺、胰腺、食管、全部胃腸腫瘤、泌尿生殖腫瘤、腎癌、黑素瘤、內分泌腫瘤、肉瘤等的癌癥。a.腫瘤發生本領域中已經充分研究了腫瘤組織中不同基因的缺失。然而,仍然需要顯著用于檢測癌癥發生中的早期分子事件以及使患者易發生癌癥的分子事件的探針。用于癌癥分期的探針也是感興趣的。所提出的導致腫瘤發生的順序包括如通過染色體丟失或增加所表明的在細胞或亞微觀水平的遺傳不穩定性,其由于賦予選擇性增殖優勢的因子的理論獲得而導致過度增殖狀態。此外,在遺傳水平上,涉及細胞周期抑制劑和腫瘤抑制基因(tsg)的功能喪失或者驅動細胞增殖的癌基因擴增。在增生之后,基于組織學識別發育不良、原位癌和最終腫瘤侵入的進行性程度順序。在這些組織學變化之前以及同時發生遺傳損傷的進行性累積。在染色體水平上,遺傳不穩定性通過伴隨標記染色體演變的染色體丟失或增加以及結構染色體改變(例如染色體的易位和倒位)來顯現。另外,細胞可以經歷多倍體化。贅生性細胞的單個或多個克隆可以演變成在許多情況下以非整倍體細胞群為特征。這些可以通過例如流式細胞術或圖像分析的技術相對于患者的正常細胞測量dna含量或倍性來量化。b.預后因素和分期診斷時癌癥的階段是癌癥擴散程度的指示,并且可以是關于患者存活的最重要預后因素之一。對于每種類型的癌癥,分期系統是特定的。例如,現在關于患有非小細胞型肺癌之患者的存活的最重要預后因素是診斷時疾病的階段。例如,關于患有非小細胞型肺癌之患者的存活的最重要預后因素是診斷時疾病的階段。反之,小細胞癌癥的存在通常伴隨著廣泛擴散傳播,因此分期系統不太適用。分期系統是基于癌癥的解剖程度而設計的,并且現在已知的為基于解剖尺寸以及在肺和鄰近結構、區域淋巴結內的擴散以及遠端轉移的tnm(腫瘤、結節、轉移)系統。目前當疾病處于限制于起始器官的低階段時,治愈方法的唯一希望是腫瘤的可手術性,其只能被切除。c.腫瘤分級肺癌的組織學類型和級別在疾病的階段內具有一定的預后影響,其中i期腺癌被報道具有最佳預后,其中對于支氣管-肺泡和乳頭狀亞型,5年存活率為50%,1年存活率為65%和59%(naruke等,1988;travis等,1995;carriaga等,1995)。對于鱗狀細胞癌和大細胞癌,5年存活率為大約35%。小細胞癌癥具有最差的預后,其中對于患有局部疾病的患者,5年存活率為僅12%(carcy等,1980;hirsh,1983;vallmer等,1985)。對于具有遠端轉移的患者,無論組織學亞型,5年存活率均為僅1%至2%(naruke等,1988)。除組織學亞型之外,已經表明在亞型內癌的組織學分級具有預后價值,其中分化良好的腫瘤比分化差的贅生物具有更長的總體存活。與患有差分化腺癌的患者的僅34%存活率相比,分化良好的局部腺癌的總體存活率為69%(hirsh,1983)。患有局部鱗狀癌的患者的5年存活率從37%(對于分化良好的贅生物)至25%(對于分化差的鱗狀癌)而不同(ihde,1991)。用于確定肺腫瘤亞型的組織學標準如下:鱗狀細胞癌由具有角蛋白形成、角化珠形成和/或細胞間橋的腫瘤組成。腺癌由實體瘤中具有明確腺形成或黏蛋白產生的腫瘤組成。小細胞癌由由具有卵形或梭形核、點狀染色質和不明顯核的小細胞構成的腫瘤組成。大細胞未分化癌由由具有泡狀核和明顯核仁而沒有鱗狀或腺分化跡象的大細胞構成的腫瘤組成。分化差的癌包括含有鱗狀和腺分化二者的區域的腫瘤。d.癌的發生肺的癌的演變最有可能代表由整個呼吸消化系統(aero-digestivesystem)遭受長期致癌損害引起的區域性癌變效應(fieldcancerizationeffect),所述致癌損害例如芐基芘、石棉沉著病、空氣污染、以及化學品、其他香煙煙霧中的致癌物質、或者其他環境致癌原。該概念首先由slaughter等(1953)提出。區域性效應的存在的證據是多種同時或異時第二原發性腫瘤(spt)的共同發生,這可發生在口咽、上食管、或者同側或對側肺中的整個呼吸消化道。伴隨這些分子缺陷的是組織學異常上皮變化的頻繁顯現,所述變化包括增生、化生、發育異常和原位癌。在吸煙者中已經證明,鄰近的正常支氣管上皮以及贅生物形成前組織學病變二者都可能包含遺傳改變細胞的克隆(wistuba等,2000)licciardello等(1989)發現大部分在患有最早期原發性腫瘤spt的患者中,上和下呼吸消化道中異時腫瘤的10%至40%發生率和同時spt的9%至14%發生率可比來自原始原發性腫瘤的復發承受更高的風險并且可以證明是在成功治療早期原發性頭、頸或肺腫瘤之后長期存活的最主要威脅。因此,仔細追蹤這些患者在新惡性腫瘤高風險部位(特別在呼吸消化系統中)的新spt的跡象至關重要。除微觀水平上的染色體改變之外,多次盲法支氣管活組織檢查可以證明在鄰近肺癌區域的部位存在不同程度的上皮內贅生物形成。另一些研究者已經表明,在大部分輕型和重型吸煙者以及已經手術切除癌癥的全部肺中存在從纖毛損失和基底細胞增生到cis的上皮變化(auerbach等,1961)。voravud等(1993)通過使用針對7號和17號染色體的染色體特異性探針的原位雜交(ish)研究證明了,30%至40%鄰近腫瘤的組織學正常上皮顯示出這些染色體的多體性。此外,與來自沒有癌跡象的患者的正常對照口腔上皮相比,在離癌最近的組織中多體性的頻率進行性增加。離腫瘤區域較近增加的基因型異常的發現支持區域性癌變的概念。有趣的是,在鄰近染色體測量處的feulgen染色切片中dna含量沒有增加,如在正常出現的黏膜中測量的,這可能反映為了改變dna指數而已經獲得了不足的dna。有趣的是,在靠近癌癥的發育異常區域中和在癌性區域中都觀察到dna含量非常類似的增加,這表明在鄰近肺癌的發育異常上皮中已經建立克隆的復雜核型異常。另一些研究者也表明在離癌癥區域最近的發育異常病變中顯示p53突變的細胞的數目增加,所述癌癥區域也不變地是p53突變的。最近已經在吸煙者的腫瘤和發育異常上皮中證明的其他染色體異常包括3p、17p、9p和5q的缺失(feder等,1998;yanagisawa等,1996;thiberville等,1995)。e.肺癌中的染色體缺失小細胞肺癌(sclc)和非小細胞肺癌通常顯示在3號染色體的短臂上具有細胞遺傳學上可見的缺失(hirano等,1994;valdivieso等,1994;cheon等,1993;pence等,1993)。與這種3p缺失出現在那些非吸煙患者中相比,其更經常出現在吸煙患者的肺腫瘤組織中(rice等,1993)。由于大約85%的肺癌患者為重型吸煙者(mrkve等,1993),故3p可能包含與暴露于煙草致癌原相關的特定dna基因座。還已經報道了,3p缺失發生在肺癌發生的早期階段,例如支氣管發育異常(pantel等,1993)。除細胞遺傳學可見缺失之外,雜合性丟失(lossofheterozygosity,loh)研究也將3-21.3限定為單獨或組合地經歷丟失的獨特區域之一(fontanini等,1992;liewald等,1992)。數個其他組已經在肺癌中發現3p21.3處的大純合性缺失(macchiarini等,1992;miyamoto等,1991;ichinose等,1991;yamaoka等,1990)。將來自3-21.3-3p21.2的dna片段轉移到肺腫瘤細胞系中可以抑制腫瘤發生(sahin等,1990;volm等,1989)。這些發現有力地表明在該特定染色體區域中存在至少一種其丟失將引發肺癌發生的腫瘤抑制基因。肺癌的細胞遺傳學觀察已經表明染色體3p的缺失率異常地一致。事實上,小細胞肺癌(sclc)在染色體3p的某些區域內顯示100%的缺失率。非小細胞肺癌(nsclc)顯示70%的缺失率(mitsudomi等,1996;shiseki等,1996)。雜合性丟失和比較基因組雜交分析已經表明在3p14.2和3p21.3之間的缺失是在肺癌中最常見的發現,并且被假定為肺腫瘤發生的最關鍵變化(wu等,1998)。已經假定,帶3p21.3是肺癌腫瘤抑制基因的位置。該假定得到3號染色體轉移研究的支持,所述研究降低肺腺癌的致瘤性。關于非小細胞肺癌的等位基因型研究表明在27%的病例中染色體10q上的遺傳物質丟失。10號染色體等位基因丟失的研究已經表明在小細胞肺癌中存在非常高的loh發生率,高達91%(alberola等,1995;ayabe等,1994)。與在僅14%病例中觀察到loh的非轉移性scc相比,在轉移性鱗狀細胞癌(scc)中在56%病例中注觀察到10q上等位基因的統計學顯著性loh(ayabe等,1994)。在nsclc的其他亞型中沒有觀察到loh。另外,使用微衛星多態性分析,表明在d10s677和d10s1223之間存在高發生率的丟失。該區域跨越在帶q21至q24處的10號染色體的長臂,并且與晚期高級膀胱癌研究中缺失的區域重疊,所述研究證明在10q22.3至10q23.1處的2.5cm區域內等位基因丟失的頻率較高(kim等,1996)。ii.通過核尺寸的分選和選擇在一個方面中,本公開內容提供了根據核尺寸或核質比來分離和/或分類ctc。這些方法可以涉及物理分選,例如通過facs或其他核分選手段,使用計算機驅動的尺寸分析的光學數據分析,或通過細胞核的人工詢問,例如通過使用標準光學顯微術。通常,例如用dapi(4’,6-二脒基-2-苯基吲哚)將核染色以允許評估/分選。在某些實施方案中,從細胞中獲得核并使其自行分選。可以使用標準的細胞裂解方案來裂解細胞。a.bioview系統和軟件bioviewduettm(rehovot,israel)系統使用彩色或單色ccd相機,其通常對細胞制備物上存在的所有有核細胞成像并分類。分類的細胞的數目由操作者預先設定,但是通常掃描幾千個細胞。存在“研究”模式或開放的軟件系統,其然后對每個細胞記錄以下:1)基于dapi染色的以像素計的核面積,其表示為任意單位,因此,如果為5000,則意指細胞面積為5000像素;2)核直徑;以及3)圓度因子(cf),通過改變伸長率(細胞的高度和寬度之間的比例)來計算,其中完美圓的值為1(淋巴細胞的cf接近1,異常細胞由于其核周長的不規則性而具有很多cf>>1)。為了提高ctc的產率,本發明人進行以下測量,并隨后調節軟件以提高異常細胞的產率并減少正常淋巴細胞的數目。如在dapi染色(核染色)上測量的,異常細胞(惡性ctc)的核面積是基于核所占像素的數目(如通過fish多體性>2所限定的)并且表示為任意單位。淋巴細胞的核面積為由血液中淋巴細胞(其通過fish為二倍體)所占像素的數目,其中圓度因子接近1。推導出測量結果的方式是通過觀察來自大量惡性樣品的淋巴細胞(“內部”對照淋巴細胞)的平均核像素面積以及記錄對照樣品中的淋巴細胞或“外部”對照淋巴細胞的平均核像素面積,所述對照樣品或“外部”對照淋巴細胞來自已知是健康的并且沒有前惡性腫瘤史或者在其血流中沒有惡性細胞的患者。類似地,記錄了來自患有已知肺癌之患者的大量“異常”細胞(循環腫瘤細胞)的核面積的觀察結果,所述“異常細胞”限定為具有2個或更多個多體性(額外染色體)的細胞。本發明人表明ctc的核面積遠遠超過任意閾值,如下文討論的。在其中ctc的絕對數目具有診斷性的一些實施方案中,4個或更多個ctc的發現將指示患者患有癌癥。本發明人注意到緩解數年的患者可以顯示很少的ctc(最低殘余疾病;如本文中限定的少于4個ctc),這可能代表休眠的ctc。ctc的半衰期被認為為約4至8小時,因此存在不間斷補充源。現在這是一個具有重大生物相關性的現象,因為在數年的明顯“緩解”之后,患者可復發并死亡,很可能涉及這些休眠的ctc。b.閾值在來自患有肺癌的患者的血液中,基于cf接近1的淋巴細胞的平均像素面積,選擇閾值為78。該閾值顯著低于對異常細胞(通過fish多體性>2所限定的)觀察到的平均像素。c.分類創建了帶有排除的重復任務,使得系統僅開始對ficoll純化樣本中大于78的細胞分類。因此,排除了小于78(包括淋巴細胞的平均核面積)的所有細胞,僅將滿足推導標準(閾值>78)的細胞分類,并呈給操作者進行交互式評價。此外,bioview系統創建了顯示二倍體細胞、非整倍體細胞(單增益或丟失)和異常細胞(如通過fish探針限定的至少2個或更多個基因(3cen、3p、10cen和10q)的多體性)的餅形圖。儀器任務被設置為掃描幾千個細胞,使得可以從幾千個圖像中選擇至少500個具有推導標準(閾值>78)的完整且不重疊的細胞,將其呈給操作者進行額外信號(增益)或信號丟失(缺失)的交互式評價。當評價掃描的細胞時,操作者首先根據餅形圖檢查不同類別的細胞,從限定為至少2個具有額外拷貝的染色體的“異常”細胞開始,然后是單增益和丟失類別,并且最后是對剩余的細胞進行交互式分析,直到500個細胞被評分。iii.基因探針本公開內容包括使選擇的細胞與經標記的核酸探針接觸,并通過熒光原位雜交檢測雜交的細胞。這些探針可以對ctc中最頻繁擴增或缺失的任何遺傳標記具有特異性。特別地,探針可以是3p22.1探針,其是與著絲粒3組合的靶向rpl14、cd39l3、pmgm或gc20的核酸探針;與著絲粒10組合的10q22-23探針(包括表面活性蛋白a1和a2);或pi3激酶探針。其他遺傳標記可以包括但不限于:著絲粒3、7、17;9p21;5p15.2;egfr;c-myc8q22;和6p22-22。關于基因探針的進一步討論,參見美國公開號2007/0218480,其通過引用整體并入本文。a.3p22.1探針3p22.1探針是與著絲粒3組合的靶向rpl14、cd39l3、pmgm或gc20的核酸探針。人核糖體l14(rpl14)基因(genbank登錄號nm_003973)和基因cd39l3(genbank登錄號aac39884和af039917)、pmgm(genbank登錄號p15259和j05073)和gc20(genbank登錄號nm_005875)分離自bac(genbank登錄號ac104186,其通過引用并入本文)并且位于不同肺腫瘤的最小缺失重疊區域中的3p22.1帶中。rpl14基因序列包含具有高多態性的三核苷酸(ctg)重復陣列,其編碼可變長度的多聚丙氨酸束。多聚丙氨酸束見于發育顯著性的基因產物中,其與dna結合或調節轉錄。例如,果蠅(drosophila)蛋白engraled、kruppel和even-skipped全部都包含用作轉錄阻遏物的多聚丙氨酸束。應理解,多聚丙氨酸束在無義介導的mrna衰減途徑中起關鍵作用,其使細胞擺脫畸變蛋白質和轉錄物。rpl14的基因型分析顯示與nsclc細胞系中的25%相比,在正常群體中該基因座是68%雜合的。由正常支氣管上皮獲得的細胞培養物顯示65%的雜合性水平,反映正常群體的雜合性水平。另參見rp11-391m1/ac104186。具有調節功能的基因例如rpl14基因以及基因cd39l3、pmgm和gc20及其類似物是用于診斷腫瘤發生事件的良好候選物。已經假設rpl14蛋白的功能變化可以通過編碼該蛋白質的三核苷酸重復的dna缺失機制而發生。這種缺失機制使rpl14基因成為可以用作肺癌風險研究的標志物的有吸引力序列(shriver等,1998)。此外,rpl14基因顯示在種族特定群體中等位基因頻率分布具有顯著差異,使該序列成為用于研究種族調整性肺癌的有用標志物(shriver等,1998)。因此,該基因可用于肺癌的早期檢測,并且可在化學預防研究中用作中間生物標志物。b.10q22探針在另一些實施方案中,探針可以是與著絲粒10組合的10q22-23探針,其包括表面活性蛋白a1和a2。10q22bac(46b12)為200kb,鄰近pten/mmac1(genbank登錄號af067844)并且是到pten/mmac1的著絲粒,其在10q22-23處并且可以通過researchgenetics(huntsville,al)購買(圖3)。10q22-25的改變已經與多種腫瘤(包括肺、前列腺、腎、和子宮內膜癌、黑素瘤以及腦膜瘤)關聯,表明在該區域中存在影響數種癌癥的可能抑制基因座。編碼雙特異性磷酸酶的pten/mmac1基因位于該區域中,并且已被分離為腫瘤抑制基因,其在數種類型的人腫瘤(包括腦、膀胱、乳腺和前列腺的癌癥)中被改變。pten/mmac1突變已經在一些癌細胞系、異種移植物和激素頑固性癌癥組織樣品中被發現。由于本發明人的10q22bacdna序列與該區域鄰近,故bac10q22中的dna序列可能涉及人肺癌的發生和/或進展。另參見rp11-506m13/ac068139.6。肺相關的表面活性蛋白a1(sp-a)位于10q22.3處。表面活性蛋白a-磷脂-蛋白質復合物降低肺的肺泡中的表面張力,并且在肺中的宿主防御中起主要作用。表面活性蛋白a1還存在于被認為是肺的推定干細胞的肺泡2型細胞中。已知2型細胞參與肺泡受損后的修復和再生。因此,2型細胞可能表達端粒酶和c-myc,其導致表面活性蛋白的損失和非小細胞肺癌的發生(圖4)。10q22探針可用于進一步開發用于早期檢測贅生物形成事件、用于風險評估和監測化學預防治療的效力的臨床生物標志物。c.商業探針組任何商業探針或探針組也可用于本公開內容。例如,可以使用urovysiondna探針組(vysis/abbottmolecular,desplaines,il),其包括針對著絲粒3、著絲粒7、著絲粒17、9p21.3的探針。已經確定urovysion探針檢測肺癌的早期變化。在另一些實施方案中,可以使用lavysiondna探針組(vysis/abbottmolecular,desplaines,il),其包括針對以下的探針:7p12(表皮生長因子受體)、8q24.12-q24.13(myc)、6p11.1-q11(染色體計數(探針cep6))和5p15.2(包括sema5a基因)。已經注意到lavysion探針組檢測較高期或較晚期的肺癌。此外,本公開內容還可以使用針對著絲粒7/7p12(表皮生長因子受體)的單探針組。iv.用于評估基因結構的方法根據本公開內容,將利用多種探針來檢查來自患者樣品的基因組dna的結構。廣泛多種方法可以用于檢測不同染色體區域的結構的變化。以下是這樣的方法的非限制性討論。a.熒光原位雜交和顯色原位雜交熒光原位雜交(fish)可以用于分子研究。fish用于使用熒光顯微術來檢測已經與染色體雜交的高度特異性dna探針。dna探針是經熒光或非熒光分子標記的,然后其通過熒光抗體被檢測。探針與靶染色體上的一個或更多個特異性區域結合。然后,使用對比色將染色體染色,并使用熒光顯微鏡來觀察細胞。每種fish探針對染色體的一個區域是特異性的,并且在其整個長度上經熒光分子標記。每個顯微鏡載玻片包含許多中期物。每個中期物由完整的染色體組組成,每個探針尋找染色體的一小片段并自身與其結合。中期擴散(metaphasespread)可用于可視化特異性染色體和與探針結合的確切區域。第一步驟是分開(變性)探針dna和染色體dna二者中的dna雙鏈,這樣其可以彼此結合。這通過將dna在高溫(70℃至75℃)下在甲酰胺溶液中加熱來完成。接下來,將探針置于載玻片上,并將載玻片置于37℃培養箱中過夜,以使探針與靶染色體雜交。過夜,探針dna尋找其在特異性染色體上的靶序列并與其結合。然后,使鏈緩慢地再退火。在鹽/洗滌劑溶液中洗滌載玻片以除去未與染色體結合的任何探針,并向載玻片中添加不同著色的熒光染料以將全部染色體染色,使得其隨后可以使用熒光顯微鏡觀察到。可以同時混合并使用經不同熒光標簽標記的兩種或更多種不同的探針。然后,用第三色將染色體染色以進行對比。這提供具有三種或更多種顏色的中期或間期細胞,這可以用于同時檢測不同染色體,或者用于在其他靶序列之一缺失并且探針不能與染色體結合的情況下提供對照探針。該技術允許例如基因的定位以及遺傳缺陷的直接形態學檢測。相比于微衛星不穩定性,使用fish探針來測試等位基因雜合性丟失的優點是:(a)fish容易且迅速地在目的細胞上進行,并且可以用于石蠟包埋的或新鮮的或冷凍的組織上,從而允許使用顯微解剖;(b)可以聯系著絲粒探針以細胞為基礎在細胞上分析特定基因變化,使得可以評價dna序列的真純合性相對于雜合性(針對微衛星不穩定性使用pcrtm可能由于純合性缺失的區域中被正常細胞污染而允許擴增周圍的正常dna序列,從而提供目的等位基因沒有缺失的假陽性印象);(c)pcr不能鑒定基因的擴增;以及(d)使用細菌人工染色體(bac)的fish允許使用特異性引物對來容易地在特定染色體上檢測和定位已經分離的目的基因。顯色原位雜交(cish)能夠使用組織學實驗室中已存在的方法來在組織形態學背景下獲得遺傳信息。cish允許在明視場顯微鏡下在福爾馬林固定的石蠟包埋(ffpe)組織上使用常規酶促反應來檢測基因擴增、染色體易位和染色體數目。美國公開號2009/0137412,其通過引用并入本文。可以例如在具有熒光能力的自動掃描儀(bioviewsystem,rehovot,israel)上進行掃描。b.模板依賴性擴增方法許多模板依賴性方法可用于擴增存在于給定模板樣品中的標志物序列。最眾所周知的擴增方法之一是聚合酶鏈反應(被稱為pcrtm),其在美國專利4,683,195、4,683,202和4,800,159中以及在innis等,1990中詳細地被描述,其各自通過引用整體并入本文。簡言之,在pcrtm中,制備與標志物序列的相對互補鏈上的區域互補的兩種引物序列。將過量的脫氧核苷三磷酸與dna聚合酶(例如taq聚合酶)一起添加到反應混合物中。如果樣品中存在標志物序列,則引物將與標志物結合并且聚合酶將通過添加核苷酸來促使引物沿著標志物序列延伸。通過升高和降低反應混合物的溫度,延伸的引物將從標志物解離形成反應產物,過量的引物將與標志物和反應產物結合,并且重復該過程。可以進行逆轉錄酶pcrtm擴增程序以量化擴增的mrna的量。將rna逆轉錄成cdna的方法是眾所周知的并且在sambrook等(1989)中已描述。用于逆轉錄的替代方法利用熱穩定的rna依賴性dna聚合酶。在于1990年12月21日提交的wo90/07641中描述了這些方法。聚合酶鏈反應方法是本領域眾所周知的。另一種用于擴增的方法是連接酶鏈反應(ligasechainreaction,“lcr”),其在通過引用整體并入本文的epo號320308中公開。在lcr中,制備兩個互補探針對,并且在靶序列存在下,每對將與靶標的相對互補鏈結合,使得其鄰接。在連接酶存在下,兩個探針對將連接形成單個單元。通過如在pcrtm中的溫度循環,結合的連接單元從靶標上解離,并隨后用作用于連接過量探針對的“靶序列”。美國專利4,883,750描述了與用于使探針對與靶序列結合的與lcr類似的方法。pct申請號pct/us87/00880中描述的qβ復制酶也可以用作本公開內容中的另一種擴增方法。在該方法中,在rna聚合酶存在下,向樣品中添加具有與靶標互補的區域的rna的復制序列。聚合酶將拷貝復制序列,其然后可以被檢測。等溫擴增法也可以用于本公開內容中的核酸擴增,其中使用限制性內切核酸酶和連接酶來實現靶分子的擴增,所述靶分子在限制性位點的一條鏈中包含核苷酸5′-[α-硫代]三磷酸(walker等,1992)。鏈置換擴增(stranddisplacementamplification,sda)是進行核酸等溫擴增的另一種方法,其涉及多輪的鏈置換和合成,即切口平移。稱為修復鏈反應(repiarchainreaction,rcr)的類似方法涉及在整個靶向擴增的區域中使數種探針退火,然后進行其中僅存在四種堿基中的兩種堿基的修復反應。另外兩種堿基可以作為生物素化衍生物添加,以便于檢測。類似的方法用于sda。還可以使用循環探針反應(cyclicprobereaction,cpr)來檢測靶標特異性序列。在cpr中,將具有非特異性dna的3′和5′序列以及特異性rna的中間序列的探針與存在于樣品中的dna雜交。在雜交之后,使用rna酶h處理反應,探針的產物被鑒定為消化后釋放的獨特產物。使初始模板與另一循環探針退火,并重復反應。根據本公開內容,可以使用在gb申請號2202328和pct申請號pct/us89/01025中描述的又一種擴增方法,所述申請各自通過引用整體并入本文。在前一申請中,“經修飾的”引物用于類似于pcr的模板和酶依賴性合成。引物可以通過用捕獲部分(例如,生物素)和/或檢測部分(例如,酶)標記而被修飾。在后一申請中,向樣品中添加過量的經標記探針。在靶序列存在下,探針結合并被催化切割。在切割之后,靶序列被完整地釋放并被過量探針結合。經標記探針的切割預示靶序列的存在。其他核酸擴增方法包括基于轉錄的擴增系統(transcription-basedamplificationsystem,tas),其包括基于核酸序列的擴增(nucleicacidsequencebasedamplification,nasba)和3sr(kwoh等,1989;gingeras等,pct申請wo88/10315,其通過引用整體并入本文)。在nasba中,可以通過標準苯酚/氯仿提取、臨床樣品的熱變性、用裂解緩沖液處理以及用于分離dna和rna的微型旋轉柱(minispincolumn)或者rna的氯化胍提取來制備核酸以進行擴增。這些擴增技術涉及使具有靶標特異性序列的引物退火。在聚合之后,用rna酶h消化dna/rna雜交體,同時再次將雙鏈dna分子熱變性。在任一種情況下,單鏈dna通過添加第二靶標特異性引物,然后聚合來完全雙鏈化。然后,雙鏈dna分子通過rna聚合酶(例如t7或sp6)多重轉錄。在等溫循環反應中,將rna逆轉錄成單鏈dna,然后將其轉化為雙鏈dna,然后再次用rna聚合酶(例如t7或sp6)轉錄。所得產物無論是截短還是完整的都指示靶標特異性序列。davey等,epo號329822(其通過引用整體并入本文)公開了一種涉及循環合成單鏈rna(“ssrna”)、ssdna和雙鏈dna(dsdna)的核酸擴增方法,其可以根據本公開內容使用。ssrna為第一引物寡核苷酸的模板,其通過逆轉錄酶(rna依賴性dna聚合酶)延伸。然后,通過核糖核酸酶h(rna酶h,一種對與dna或rna的雙鏈體中的rna具有特異性的rna酶)的作用從所得dna:rna雙鏈體中除去rna。所得ssdna是第二引物的模板,所述第二引物還包括在其與模板的同源區5’的rna聚合酶啟動子(以t7rna聚合酶為例)的序列。該引物然后通過dna聚合酶(以大腸桿菌(e.coli)dna聚合酶i的大“klenow”片斷為例)延伸,產生雙鏈dna(“dsdna”)分子,所述分子具有與在引物之間的原始rna的序列相同的序列,并且另外地在一端具有啟動子序列。該啟動子序列通過合適的rna聚合酶可以用于制備dna的許多rna拷貝。這些拷貝隨后再進入循環導致非常迅速的擴增。在酶的適當選擇下,該擴增可以等溫完成而無需在每個循環中添加酶。由于該方法的循環性能,起始序列可以選擇是dna或rna的形式。miller等,pct申請wo89/06700(其通過引用整體并入本文)公開了一種核酸序列擴增方案,其基于使啟動子/引物序列與靶單鏈dna(“ssdna”)雜交,隨后轉錄該序列的許多rna拷貝。該方案不是循環性的,即新的模板不是由所得rna轉錄物產生。其他擴增方法包括“race”和“單側pcr”(frohman,1990;ohara等,1989;其各自通過引用整體并入本文)。以下方法也可以用于本公開內容的擴增步驟中,所述方法基于在具有所得“二寡核苷酸”序列的核酸存在下連接兩個(或更多個)寡核苷酸,從而擴增二寡核苷酸(wu等,1989,其通過引用整體并入本文)。c.southern/northern印跡印跡技術是本領域技術人員眾所周知的。southern印跡涉及使用dna作為靶標,然而northern印跡涉及使用rna作為靶標。各自提供不同類型的信息,但是cdna印跡在許多方面類似于rna物質的印跡。簡言之,使用探針來靶向已固定在合適基質(通常為硝化纖維素的濾紙)上的dna或rna物質。不同物質應當在空間上分離開以便于分析。這通常通過核酸物質的凝膠電泳并隨后在濾紙上“印跡”來完成。隨后,將印跡的靶標與探針(通常是經標記的)在促進變性和再雜交的條件下孵育。由于探針被設計成與靶標堿基配對,因此在復性條件下探針將與靶序列的一部分結合。然后,除去未結合的探針,并如上所述完成檢測。d.分離方法通常希望在一個或另一個階段使擴增產物與模板和過量引物分離以確定是否已經發生特異性擴增。在一個實施方案中,可以采用標準的方法通過瓊脂糖、瓊脂糖-丙烯酰胺或聚丙烯酰胺凝膠電泳來分離擴增產物。參見sambrook等,1989。或者,可以采用色譜技術進行分離。在本公開內容中可以使用許多類型的色譜:吸附、分配、離子交換和分子篩,以及用于其使用的許多專門技術,包括柱、紙、薄層和氣相色譜(freifelder,1982)。e.檢測方法可以使產物可視化以便確定標志物序列的擴增。一種典型的可視化方法涉及用溴化乙錠染色凝膠并在uv光下可視化。或者,如果用經放射性或熒光劑量術標記的核苷酸整合標志物擴增產物,則然后在分離之后可以使擴增產物暴露于x-射線膠片或在合適的刺激光譜下可視化。在一個實施方案中,間接實現可視化。在擴增產物分離之后,使經標記的核酸探針與擴增的標志物序列接觸。該探針優選地與一種生色團綴合,但是可以被放射性標記。在另一個實施方案中,使探針與結合配偶體例如抗體或生物素綴合,并且結合對的另一成員攜帶可檢測的部分。在一個實施方案中,通過經標記的探針進行檢測。涉及的技術是本領域技術人員眾所周知的,并且可以在許多關于分子方案的標準書中找到。參見sambrook等(1989)。例如,生色團或者放射標記的探針或引物在擴增期間或之后鑒定靶標。上述方案的一個實例在通過引用并入本文的美國專利5,279,721中已描述,其公開了用于核酸的自動化電泳和轉移的裝置和方法。該裝置允許無需凝膠的外部操作即可進行電泳和印跡,并且理想地適于進行根據本公開內容的方法。此外,可以使用標準序列分析技術來對上述擴增產物進行序列分析以鑒定特定種類的變化。在某些方法中,使用設計用于最佳測序的引物組通過序列分析進行詳盡的基因分析(pignon等,1994)。本公開內容提供了通過其可以使用任何或所有這些類型分析的方法。f.試劑盒組分上述用于檢測染色體區域的變化所需的所有必需材料和試劑都可以一起組裝在試劑盒中。這通常包括預先選擇的引物和探針。還可以包括適用于擴增核酸的酶,包括各種聚合酶(rt、taq、sequenasetm等);提供擴增所必需的反應混合物的脫氧核苷酸和緩沖液;以及任選地標記劑,例如fish中使用的那些。這樣的試劑盒通常以適當的方式包括用于每種單獨試劑和酶以及用于每種引物或探針的不同容器。g.芯片技術本發明人特別考慮的是基于芯片的dna技術,例如hacia等(1996)和shoemaker等(1996)描述的那些。這些技術涉及用于快速且精確地分析大量基因的定量方法。通過用寡核苷酸標記基因或使用固定的探針陣列,可以采用例如高密度陣列的芯片技術分離靶分子并使用例如熒光、電導、質譜、放射性標記、光學掃描或電泳的方法篩選這些分子。另參見pease等(1994);fodor等(1991)。可以將生物活性dna探針直接或間接地固定在表面上,以確保最佳接觸和最大檢測。當固定在基底上時,使基因探針穩定并由此可以重復使用。一般來說,在固定的核酸靶標上進行雜交,或者將探針分子連接到固體表面(例如硝化纖維素、尼龍膜或玻璃)。可以使用許多其他的基質材料,包括增強硝酸纖維素膜、活化石英、活化玻璃、聚偏二氟乙烯(pvdf)膜、聚苯乙烯基底、基于聚丙烯酰胺的基底、其他聚合物(例如聚(氯乙烯)、聚(甲基丙烯酸甲酯)、聚(二甲基硅氧烷))、光聚合物(其包含光反應性物質,例如能夠與靶分子形成共價連接的氮賓、卡賓和羰游基基團)(saiki等,1994)。基因探針的固定可以通過多種方法來實現,所述方法涉及在包含可錨定部分的固定的dna和錨定物之間的非共價或共價相互作用。dna通常通過首先使玻璃表面硅烷化,然后用碳二亞胺或戊二醛活化來與玻璃結合。替代方法可以使用試劑(例如3-環氧丙氧基丙基三甲氧基硅烷(gop)或氨基丙基三甲氧基硅烷(apts)),其中dna通過在dna合成期間在分子的3′或5′端并入的氨基接頭而連接。可以使用紫外輻射使基因探針直接與膜結合。對于硝化纖維素膜,將探針點到膜上。使用uv光源來照射斑點并誘導交聯。用于交聯的替代方法包括將有斑點的膜在真空中在80℃下烘烤2小時。固定可以由用鏈霉抗生物素蛋白或抗生物素蛋白非共價涂覆固相和隨后固定生物素化的多核苷酸組成(holmstrom,1993)。還可以使用以下來將探針固定到表面上:用聚-l-lys或聚l-lys、phe預先涂覆聚苯乙烯或玻璃固相,然后使用雙功能交聯試劑共價連接氨基或巰基修飾的多核苷酸(running,1990;newton,1993)。固定也可以通過將短的5′-磷酸化引物直接共價連接到化學修飾的聚苯乙烯板(“covalink”板,nunc)上來發生rasmussen(1991)。經修飾的寡核苷酸與固相表面之間的共價鍵通過與水溶性碳二亞胺縮合來引入。該方法有利于主要地寡核苷酸通過其5′-磷酸的5′-連接。nikiforov等(美國專利5,610,287)描述了一種將核酸分子在鹽或陽離子洗滌劑存在下非共價固定在包含--oh、--c=o或--cooh親水性基團的親水性聚苯乙烯固體支持物上或在玻璃固體支持物上。使支持物與包含合成核酸和陽離子洗滌劑或鹽的ph為約6至約8的溶液接觸。可以使用包含非離子洗滌劑的水溶液洗滌包含固定的核酸的支持物而不去除連接的分子。基于芯片的dna技術存在兩種常見的變型,其涉及具有已知序列同一性的dna微陣列。對于一種變型,使用機器人點樣將探針cdna(500至5000個堿基長)固定在例如玻璃的固體表面上,并暴露于單獨地或在混合物中的一組靶標。該方法(“傳統上”被稱為dna微陣列)廣泛地被認為是在斯坦福大學開發的。ekins和chu(1999)的最近一篇文章提供了一些相關細節。另一種變型包括:原位(在芯片上)合成寡核苷酸(20至25聚體寡聚物)或肽核酸(pna)探針的陣列,或者通過常規合成來合成,然后固定在芯片上。使陣列暴露于經標記的樣品dna,雜交并確定互補序列的同一性/豐度。該方法(“歷史上”被稱為dna芯片)是affymetrix,inc.開發的,該公司以商標銷售其產品。v.核酸本發明人提供了一種方法,其包括使選擇的細胞與經標記的核酸探針接觸形成雜交細胞的步驟,其中經標記的核酸的雜交指示ctc。然而,本公開內容不限于本文中公開的特定核酸片段的使用。而是,可以采用靶向相同區域/多態性的多種替代探針。a.探針和引物自然地,本公開內容包括與靶序列互補或基本上互補的dna片段。“互補”的核酸序列是能夠根據標準watson-crick互補規則進行堿基配對的那些。如本文中使用的,術語“互補序列”意指基本上互補的核酸序列,如可以通過以上所述的相同核苷酸比較來評估,或如限定為能夠在相對嚴格的條件下(例如本文中所述的那些)與靶核酸片段雜交。這些探針可以橫跨幾百或幾千個堿基對。或者,雜交片段可以是較短的寡核苷酸。17個堿基長的序列應該在人基因組中僅出現一次,并且由此足以指定獨特的靶序列。雖然較短的寡聚物更易于制備并且增加體內可及性,但是在確定雜交的特異性中涉及許多其他因素。寡核苷酸對其互補靶標的結合親和力和序列特異性二者隨著長度的增加而增加。可以考慮,使用約8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、250、500、700、722、900、992、1000、1500、2000、2500、2800、3000、3500、3800、4000、5000或更多個堿基對的示例性寡核苷酸,但是其他寡核苷酸也在考慮之內。如上文提到的,考慮編碼10,000、50,000、100,000、150,000、200,000、250,000、300,000和500,000個堿基的更長多核苷酸。這樣的寡核苷酸和多核苷酸可用作例如fish、southern和northern印跡中的探針,以及在擴增反應中用作引物。應理解,本公開內容不限于本文中公開的特定探針,并且特別地旨在至少包括可與所公開序列雜交的核酸序列或為這些序列的功能性序列類似物的核酸序列。例如,可以使用部分序列來鑒定結構相關基因或者其來源于的全長基因組或cdna克隆。本領域技術人員清楚地知曉用于產生可以用作上述探針的靶標的cdna和基因組文庫的方法(sambrook等,1989)。對于其中將本公開內容的核酸片段并入載體(例如質粒、黏粒或病毒)中的應用,這些片段可以與其他dna序列組合使得其總長度可以顯著變化,所述其他dna序列例如啟動子、多聚腺苷酸化信號、限制性酶位點、多克隆位點、其他編碼片段等。可以考慮,可以使用幾乎任意長度的核酸片段,其中總長度優選地受制備的難易度和在期望重組dna方案中使用的限制。可以將編碼特定基因的dna片段引入到重組宿主細胞中,并用于表達特定的結構或調節蛋白。或者,通過應用遺傳工程技術,可以采用所選擇基因的子部分或衍生物。可以分離包含調控區域(例如啟動子區域)的上游區域,并隨后用于表達所選擇的基因。b.探針的標記在某些實施方案中,有利地采用與用于確定雜交的合適工具(例如標志物)組合的本公開內容的核酸序列。廣泛的多種合適的指示工具是本領域中已知的,包括能夠被檢測的熒光標簽、放射性標簽、化學發光標簽、電致發光標簽、酶標簽或其他配體,例如抗生物素蛋白/生物素、抗體、親和標記等。在一些優選實施方案中,可以期望使用熒光標記,例如地高辛配基、光譜橙、熒光素(fluorosein)、曙紅、吖啶染料、羅丹明、alexa350、alexa430、amca、bodipy630/650、bodipy650/665、bodipy-fl、bodipy-r6g、bodipy-tmr、bodipy-trx、瀑布藍(cascadeblue)、cy2、cy3、cy5、6-fam、hex、6-joe、oregon綠488、oregon綠500、oregon綠514、太平洋藍(pacificblue)、reg、rox、tamra、tet、或德克薩斯紅。在酶標簽(例如脲酶堿性磷酸酶或過氧化物酶)的情況下,可以用于提供人眼或通過分光光度法可見以鑒定與包含互補核酸的樣品的特異性雜交的檢測方式的比色指示物質是已知的。親和標記的實例包括但不限于以下:抗體、抗體片段、受體蛋白、激素、生物素、dnp或與親和標記結合并且可以用于分離擴增的基因的任何多肽/蛋白質分子。指示工具可以直接連接至探針,或者其可以通過抗原結合來連接。在一些優選實施方案中,在變性之前將地高辛配基連接至探針,并在雜交之后添加熒光團標記的抗地高辛配基fab片段。c.雜交條件合適的雜交條件是本領域技術人員眾所周知的。條件可以通過增加鹽濃度和降低溫度變得較不嚴格。例如,中等嚴格條件可以通過在約37℃至約55℃的溫度下約0.1至0.25mnacl提供,而低嚴格條件可以通過在約20℃至約55℃的溫度下約0.15m至約0.9m的鹽提供。因此,雜交條件可以容易地操縱,并且因此一般是基于期望結果選擇的方法。在另一些實施方案中,雜交可以在例如以下條件下實現:在約20℃至約37℃的溫度下50mmtris-hcl(ph8.3)、75mmkcl、3mmmgcl2、10mm二硫蘇糖醇。使用的其他雜交條件可以包括在約40℃至約72℃的溫度下約10mmtris-hcl(ph8.3)、50mmkcl、1.5μmmgcl2。還可以使用甲酰胺和sds來改變雜交條件。vi.生物標志物及其他風險因子多種具有預后顯著性的生物標志物可以與以上討論的特異性核酸探針聯合使用。這些生物標志物可以幫助預測低期癌癥的存活和從贅生物形成前病變到侵入性肺癌的進展。這些標志可以包括如通過ki-67(mib1)所測量的增殖活性、如使用cd34通過vegf和微血管表達量化的血管生成、如通過erbb2所測量的癌基因表達、和如通過p53表達所測量的腫瘤抑制基因丟失。多種生物標志物候選物已經參與贅生性肺病變的演變。已經研究的生物標志物包括一般性基因組標志,包括染色體改變;特異性基因組標志,例如原癌基因(例如k-ras、erbβ1/egfr、細胞周期調節蛋白d)的改變;增殖標志物,例如ki67或pcna;鱗狀分化標志;以及核類視黃醇受體(papadimitrakopoulou等,1996)。后者特別感興趣,因為其可以通過特定化學預防藥物(例如13-順式-視黃酸或4hpr)調節,并且在正常分化黏膜的恢復下以缺陷型細胞的凋亡而告終(zou等,1998)。a.通過微血管計數的腫瘤血管生成腫瘤血管生成可以通過微血管密度來量化,并且是1期nsclc的可行預后因子。腫瘤微血管密度顯示是1期nsclc的存活的良好預測因子。b.血管內皮生長因子(vegf)vegf(3,6-8ch4),一種內皮細胞特異性促分裂原,是腫瘤血管生成的重要調節因子,其表達與淋巴結轉移很好地相關,并且是腫瘤血管生成的良好間接指示。在nsclc中,vegf進而通過p53蛋白積累而上調。c.p53p53突變在預測患有nsclc的患者的進展和存活中的作用受到廣泛爭議。盡管很少研究暗示微不足道的作用,但是大多數研究提供了關于p53作為nsclc中預后因子之一的作用的強有力證據。p53在nsclc生物學中的重要作用已經成為晚期nsclc患者中腺病毒介導的p53基因轉移的基礎(carcy等,1980)。此外,還已經表明p53是nsclc的化學治療應答的獨立預測因子。在最近的研究(vallmer等,1985)中,研究了p53積累在肺癌患者和未發展成癌癥的那些的侵入前支氣管病變中的重要性。證明了與p53陰性病變相比,贅生物形成前病變中的p53積累發展成侵入的速率更高。d.c-erb-b2與p53類似,還已經表明c-erg-b2(her2/neu)表達是轉移傾向的良好標志并且是這些腫瘤的存活的指示。e.ki-67增殖標志物除了上述標志之外,如通過標記腫瘤細胞的ki-67的程度所測量的腫瘤增殖指數與1期nsclc的臨床結果顯著相關,ki-67是一種在整個細胞周期中表達的核抗原(feinstein等,1970)。腫瘤增殖指數越高,無疾病存活越差。標記指數提供了顯著互補性,即使不是1期nsclc的獨立預后信息,并且有助于鑒定可能需要更積極治療的1期nsclc患者的子群。已知3p21.3和10q22基因座的改變與許多癌癥有關。更具體地,與3p21.3和10q22基因座相關的點突變、缺失、插入或調節擾動可能引發癌癥或促進癌癥發生、引起或促進在原發部位處的腫瘤發展、和/或引起或促進轉移。在3p21.3和10q22基因座處的其他現象包括血管生成和組織侵入。因此,本發明人已經證明,在3p21.3和10q22處的缺失不僅可以用作癌癥的診斷或預后指示,而且還用于預測癌癥發生、發展和治療中的特定事件。在此方面考慮多種不同的測定,包括但不限于熒光原位雜交(fish)、直接dna測序、pfge分析、southern或northern印跡、單鏈構象分析(ssca)、rna酶保護測定、等位基因特異性寡核苷酸(aso)、斑點印跡分析、變性梯度凝膠電泳、rflp和pcr-sscp。多種類型的缺陷是待鑒定的。因此,“改變”應被理解為包括缺失、插入、點突變和重復。點突變導致終止密碼子、移碼突變或氨基酸替換。體細胞突變是發生于非胚系組織中的那些。胚系組織可以存在于任何組織中并遺傳獲得。f.表面活性蛋白a和b存在四種主要的表面活性蛋白:sp-a、b、c和d。sp-a和d是親水性的,而sp-b和c是疏水性的。蛋白質對實驗條件(溫度、ph、濃度、例如鈣的物質,等等)非常敏感。此外,其作用傾向于重疊,并且因此難以指出各蛋白質的特異性作用。1.sp-asp-a是待鑒定的第一表面活性蛋白,并且也是最豐富的(ingenito等,1999)。其分子量為從26至38kda而不等(pérez-gil等,1998)。該蛋白具有六個三聚體的“花束”結構(haagsman和diemel,2001),并且根據存在于系統中的其他物質可以被發現呈開放或閉合的形式。鈣離子導致閉合的花束形式(palaniyar等,1998)。sp-a在免疫防御中起作用。其還參與表面活性劑轉運/吸附(與其他蛋白質一起)。sp-a是產生管狀髓磷脂所必需的,管狀髓磷脂是肺特有的一種脂質轉運結構。管狀髓磷脂由內襯有蛋白質的脂質的方形管狀物組成(palaniyar等,2001)。遺傳工程化成缺乏sp-a的小鼠具有正常的肺結構和表面活性劑功能,并且sp-a的有益表面活性劑特性可能僅僅在應激情況下是明顯(korfhagen等,1996)。2.sp-b乳頭狀甲狀腺癌(ptc)在臨床上是異質性的。除與電離輻射相關之外,ptc的病因學和分子生物學知之甚少。使用基于寡聚物的dna陣列來研究8個匹配對的正常甲狀腺和ptc組織的表達譜,免疫組織化學分析在39/52ptc中檢測到sftpb,但是在濾泡性甲狀腺癌和正常甲狀腺組織中未檢測到huang等,2001)。g.患者面談及其他風險因子除分析多態性的存在或不存在之外,如以上討論的,還可以期望評價患者的另外因子。例如,患者面談與診斷/預后高度相關,患者面談可包括吸煙史(吸煙年數、包/天等)。此外,可以使用痰細胞中形態變化的存在或不存在(鱗狀化生、發育異常等),以及遺傳不穩定性評分(遺傳不穩定性=由來自痰中的上皮細胞和嗜中性粒細胞和/或外周血細胞或者從血液或骨髓分離的骨髓細胞或干細胞的多種組合的異常之和構成)。vii.獲得和純化樣品根據本公開內容,將獲得包含血細胞的生物樣品。在一些實施方案中,評價樣品的ctc水平的實體不直接從患者獲得樣品。因此,本公開內容的方法包括間接或直接從患者獲得樣品。為了達到這些方法,醫生、醫療人員或其工作人員可以獲得用于評價的生物樣品。樣品可以由醫療人員或其工作人員分析,或者可以將其送到外面或獨立實驗室。醫療人員可以認識到測試是否提供了關于ctc的定量水平的信息。在任何這些情況下,醫療人員可以了解相關信息,這些相關信息將使其基于ctc水平來確定患者是否可以診斷為患有侵襲性形式的癌癥和/或癌癥預后差。例如,可以考慮,實驗室進行測試以確定ctc的水平。實驗室人員可以向醫療人員報告進行的測試的具體結果。通常,樣品是使用標準技術(例如jones(1963)公開的,其通過引用并入本文)從取自個體的生物樣品(血液樣品或組織樣品)中分離的。樣品的收集可以通過任何合適的方法進行,但是在某些方面中,通過針、導管、注射器、刮削等來收集。樣品可以用本領域技術人員已知的任何方式來制備。例如,可以在進行ficoll-hypaque梯度分離從而允許富集單個核細胞(淋巴細胞和上皮細胞)之后,從血沉棕黃層中分離來自外周血的循環上皮細胞。還可以使用本領域技術人員已知的其他方法來制備樣品。可以根據標準方法從生物樣品中包含的細胞中分離核酸(sambrook等,1989)。核酸可以是基因組dna或者經分級的rna或全細胞rna。在使用rna的情況下,可以期望將rna轉化成互補dna。根據形式,直接使用擴增或用第二已知核酸然后擴增來在樣品中鑒定特定的目的核酸。在檢測之后,可以將在給定樣品中觀察到的結果與具有統計學顯著性的參考組樣品進行比較,所述參考組樣品來自正常患者和具有或缺乏不同染色體基因座和對照區域的改變的患者。通過這種方式,然后使檢測到的改變的量或種類與多種臨床狀態和治療選擇相關聯。viii.癌癥治療在一些實施方案中,本公開內容提供了用于診斷和治療乳腺癌的組合物和方法。在一個實施方案中,本公開內容提供了一種基于與對照相比ctc水平是否高來確定癌癥的治療的方法。治療可以是常規的癌癥治療。本領域技術人員知曉可以與本公開內容的方法組合的許多治療,其中一些而不是全部在下文進行描述。a.用于向患者施用的制劑和途徑在考慮臨床應用的情況下,有必要制備適合于期望應用的形式的藥物組合物。通常,這將必需制備基本上不含熱原以及可能對人或動物有害的其他雜質的組合物。一般期望使用合適的鹽和緩沖劑來使遞送載體穩定并允許被靶細胞攝取。當向患者中引入重組細胞時也會使用緩沖劑。本公開內容的水性組合物包含有效量的細胞載體與細胞,其溶解或分散在可藥用載體或水性介質中。這樣的組合物也稱為接種劑(inocula)。短語“可藥用的或藥理學上可接受的”是指當施用于動物或人時不產生不利反應、變應性反應或其他不良反應的分子實體和組合物。如本文中使用的,“可藥用載體”包括任何和所有的溶劑、分散介質、包衣、抗細菌劑和抗真菌劑、等張劑和吸收延遲劑,等等。這樣的介質和試劑用于藥物活性物質的用途是本領域眾所周知的。除非任何常規介質或試劑與本公開內容的載體或細胞不相容,否則其在治療組合物中的使用均在考慮之中。補充活性成分也可以并入到組合物中。本公開內容的活性組合物可以包括典型的藥物制劑。根據本公開內容的這些組合物的施用可通過任何常用途徑,只要靶組織通過該途徑是可獲得的即可。這包括經口、經鼻、經頰、經直腸、經陰道或局部。或者,施用可以通過皮內、皮下、肌內、腹膜內或靜脈內注射來進行。這樣的組合物通常會作為可藥用組合物施用。特別感興趣的是直接腫瘤內施用、腫瘤灌注、或者向腫瘤局部或區域性施用,例如在局部或區域脈管系統或淋巴系統中、或者在切除的腫瘤床中施用(例如術后導管)。對于幾乎任何腫瘤,也考慮全身遞送。這證明對攻擊微觀或轉移性癌癥尤其重要。活性化合物也可以作為游離堿或藥理學上可接受的鹽施用,其可以在與表面活性劑(例如羥丙基纖維素)適當混合的水中制備。還可以在甘油、液體聚乙二醇、及其混合物中或者在油中制備分散體。在普通儲存和使用條件下,這些制劑包含防腐劑以防止微生物生長。適用于可注射使用的藥物形式包括無菌水溶液或分散體和用于臨時制備無菌可注射溶液或分散體的無菌粉末。在所有情況下,形式必須是無菌的并且必須是達到存在易注射性的程度的流體。其在制備和儲存條件下必須是穩定的,并且必須被保護以免于微生物(例如細菌和真菌)的污染行為。載體可以為包含以下的溶劑或分散介質:例如水、乙醇、多元醇(例如,甘油、丙二醇和液體聚乙二醇,等等)、其合適混合物、以及植物油。可以維持適當的流動性,例如通過使用包衣(例如卵磷脂)、在分散體的情況下通過維持所需的顆粒尺寸和通過使用表面活性劑來維持。微生物作用的防止可以通過多種抗細菌劑和抗真菌劑(例如對羥基苯甲酸酯、氯丁醇、苯酚、山梨酸、硫柳汞等)來產生。在許多情況下,可優選地,包括等張劑,例如糖或氯化鈉。可注射組合物的延長吸收可以通過在組合物中使用延遲吸收劑(例如單硬脂酸鋁和明膠)來產生。無菌可注射溶液通過根據需要將所需量的活性化合物與以上列舉的多種其他成分一起并入到合適的溶劑中,然后過濾滅菌來制備。通常,分散體通過將多種經滅菌的活性成分并入無菌載劑中來制備,所述無菌載劑包含基本分散介質和來自上述列舉的那些的所需其他成分。在用于制備無菌可注射溶液的無菌粉末的情況下,優選的制備方法為真空干燥和冷凍干燥技術,其由經預先無菌過濾的溶液產生活性成分以及任何另外期望成分的粉末。如本文中使用的,“可藥用載體”包括任何和所有的溶劑、分散介質、包衣、抗細菌劑和抗真菌劑、等張劑和吸收延遲劑,等等。這樣的介質和試劑用于藥物活性物質的用途是本領域眾所周知的。除非任何常規介質或試劑與活性成分不相容,否則其在治療組合物中的使用均在考慮之中。補充活性成分也可以并入到組合物中。本公開內容的組合物可以以中性或鹽形式配制。可藥用鹽包括酸加成鹽(與蛋白質的游離氨基形成的)以及與例如如鹽酸或磷酸的無機酸或者例如乙酸、草酸、酒石酸、扁桃酸等的有機酸形成的。與游離羧基形成的鹽也可以衍生自例如如鈉、鉀、銨、鈣或鐵的氫氧化物的無機堿,以及例如異丙胺、三甲胺、組氨酸、普魯卡因等的有機堿。在配制之后,將溶液以與劑量制劑相容的方式并以例如治療有效的量施用。向患者或對象施用的本公開內容組合物的實際劑量可以由物理和生理因素來確定,所述因素例如體重、病癥的嚴重程度、所治療疾病的類型、先前或同時治療干預、患者的特發病和施用途徑。在任何事件下,負責施用的醫療人員將確定組合物中活性成分的濃度和個體對象的合適劑量。“治療”是指為了獲得疾病或健康相關病癥的治療益處而向對象施用或施加治療劑或者對對象施行某種操作或方式。在本申請通篇使用的術語“治療益處”或“治療有效的”是指關于該病癥的藥物治療促進或增強對象的健康的任何情況。這包括但不限于疾病的體征或癥狀的頻率或嚴重程度的降低。“疾病”可以是由任何原因(例如感染、遺傳缺陷和/或環境應激)引起的身體部分(器官)或系統的任何病理性病癥。“預防”根據其普通和平常的含義使用,意指“在...之前行動”或這樣的行為。在特定疾病的情況下,這些術語是指為了阻斷疾病或健康相關病癥發生而向對象施用或施加藥劑、藥物或治療,或者對對象施行某種操作或方式。對象可以是在相關預防劑被施用時已知或懷疑未患特定疾病或健康相關病癥的對象。例如,對象可以是未患已知疾病或健康相關病癥的對象(即健康對象)。在本公開內容的另一些實施方案中,方法包括鑒定需要治療的患者。例如,可以基于獲得患者歷史或基于臨床檢查的發現來鑒定患者。b.治療在一些實施方案中,所述方法還包括用常規癌癥治療來治療患有乳腺癌的患者。目前癌癥研究的一個目標是找到提高化學治療和放射治療的效力的方式,例如通過將傳統治療與其他抗癌治療組合。在本公開內容的情況下,考慮該治療可以是但不限于化學治療、放射、細胞凋亡的多肽誘導劑、新的靶向治療(例如酪氨酸激酶抑制劑或抗vegf抗體)、或其他治療干預。還可以想到,期望多于一次地施用治療。1.化學治療根據本公開內容可以使用廣泛多種化學治療劑。術語“化學治療”是指使用藥物來治療癌癥。“化學治療劑”用于意指在癌癥治療中施用的化合物或組合物。這些藥劑或藥物通過其在細胞內的活性模式,例如,其是否影響細胞周期或在什么階段影響細胞周期進行分類。或者,可以基于藥劑直接交聯dna、插入dna或通過影響核酸合成來誘導染色體和有絲分裂畸變的能力來對其進行表征。大多數化學治療劑落入以下類別:烷化劑、抗代謝物、抗腫瘤抗生素、有絲分裂抑制劑和亞硝基脲。化學治療劑的實例包括烷化劑,例如噻替派和環磷酰胺;烷基磺酸酯,例如白消安、英丙舒凡和哌泊舒凡;氮丙啶類,例如苯并多巴(benzodopa)、卡波醌、麥曲多巴(meturedopa)和尤利多巴(uredopa);亞乙基亞胺和甲基蜜胺(methylamelamine),包括六甲蜜胺、三亞乙基蜜胺、三亞乙基磷酰胺、三亞乙基硫代磷酰胺和三羥甲基蜜胺;己酸配質(acetogenin)(尤其是布拉它辛(bullatacin)和布拉它辛酮(bullatacinone));喜樹堿(包括合成類似物拓撲替康);苔蘚抑素;callystatin;cc-1065(包括其阿多來新、卡折來新和比折來新合成類似物);隱藻素(cryptophycin)(特別是隱藻素1和隱藻素8);多拉司它汀;倍癌霉素(duocarmycin)(包括合成類似物kw-2189和cb1-tm1);艾榴塞洛素(eleutherobin);水鬼蕉堿(pancratistatin);沙考地汀(sarcodictyin);海綿抑素(spongistatin);氮芥,例如苯丁酸氮芥、萘氮芥、氯膦酰胺、雌莫司汀、異環磷酰胺、雙氯乙基甲胺(mechlorethamine)、鹽酸氧氮芥、美法侖、新恩比興、苯芥膽甾醇、潑尼莫司汀、曲磷胺、尿嘧啶氮芥;亞硝基脲(nitrosurea),例如卡莫司汀、氯脲菌素、福莫司汀、洛莫司汀、尼莫司汀和雷莫司汀(ranimnustine);抗生素,例如烯二炔類抗生素(enediyneantibiotic)(例如,加利車霉素(calicheamicin),尤其是加利車霉素γ1i和加利車霉素ωi1;達內霉素(dynemicin),包括達內霉素a;二膦酸鹽,例如氯屈膦酸鹽(clodronate);埃斯波霉素(esperamicin);以及新制癌菌素生色團及相關的色蛋白烯二炔類抗生素生色團、阿克拉霉素(aclacinomysin)、放線菌素、氨茴霉素(authrarnycin)、重氮絲氨酸、博來霉素、放線菌素c、卡柔比星(carabicin)、洋紅霉素、嗜癌素、色霉素(chromomycinis)、放線菌素d、柔紅霉素、地托比星、6-重氮-5-氧代-l-正亮氨酸、多柔比星(包括嗎啉代-多柔比星、氰基嗎啉代-多柔比星、2-吡咯啉基-多柔比星和脫氧多柔比星)、表柔比星、伊索比星、伊達比星、麻西羅霉素(marcellomycin)、絲裂霉素(例如絲裂霉素c)、霉酚酸、諾加霉素(nogalarnycin)、橄欖霉素、培洛霉素、泊非霉素(potfimromycin)、嘌呤霉素、三鐵阿霉素、羅多比星、鏈黑菌素、鏈佐星、殺結核菌素、烏苯美司、凈司他丁、佐柔比星;抗代謝物,例如甲氨蝶呤和5-氟尿嘧啶(5-fu);葉酸類似物,例如二甲葉酸、甲氨蝶呤、蝶羅呤、三甲曲沙(trimetrexate);嘌呤類似物,例如氟達拉濱、6-巰基嘌呤、硫咪嘌呤(thiamiprine)、硫鳥嘌呤;嘧啶類似物,例如安西他濱、阿扎胞苷、6-氮尿苷、卡莫氟、阿糖胞苷、二脫氧尿苷、脫氧氟尿苷、依諾他濱、氟尿苷;雄激素,例如卡魯睪酮、丙酸屈他雄酮、環硫雄醇、美雄烷、睪內酯;抗腎上腺,例如氨魯米特、米托坦、曲洛司坦;葉酸補充劑,例如亞葉酸(frolinicacid);醋葡醛內酯;醛磷酰胺糖苷;氨基乙酰丙酸;恩尿嘧啶;安吖啶;bestrabucil;比生群(bisantrene);依達曲沙(edatraxate);地磷酰胺(defofamine);地美可辛;地吖醌(diaziquone);依氟鳥氨酸(elformithine);醋酸羥吡咔唑(elliptiniumacetate);埃博霉素(epothilone);依托格魯(etoglucid);硝酸鎵;羥基脲;香菇多糖(lentinan);氯尼達明(lonidainine);美登素類(maytansinoid),例如美登素和安絲菌素;米托胍腙;米托蒽醌;莫哌達醇(mopidanmol);尼曲吖啶(nitraerine);噴司他丁;蛋氨氮芥(phenamet);吡柔比星;洛索蒽醌;鬼臼酸(podophyllinicacid);2-乙基酰肼;丙卡巴肼;psk多糖復合物);雷佐生(razoxane);根毒素;西索菲蘭(sizofiran);螺旋鍺;細交鏈孢菌酮酸;三亞胺醌(triaziquone);2,2′,2″-三氯三乙胺;單端孢霉烯類(尤其是t-2毒素、疣孢菌素a(verracurina)、桿孢菌素a和蛇形菌素(anguidine));烏拉坦(urethan);長春地辛;達卡巴嗪;甘露氮芥;二溴甘露醇;二溴衛矛醇;哌泊溴烷(pipobroman);甲托辛(gacytosine);阿糖胞苷(“ara-c”);環磷酰胺;噻替派;紫杉烷類,例如紫杉醇和多西他賽(doxetaxel);苯丁酸氮芥;吉西他濱;6-硫鳥嘌呤;巰基嘌呤;甲氨蝶呤;鉑配位絡合物,例如順鉑、奧沙利鉑和卡鉑;長春堿;鉑劑;依托泊苷(vp-16);異環磷酰胺;米托蒽醌;長春新堿;長春瑞濱;諾肖靈(novantrone);替尼泊苷;依達曲沙(edatrexate);柔紅霉素;氨基蝶呤;希羅達(xeloda);伊班膦酸鹽(ibandronate);伊立替康(例如,cpt-11);拓撲異構酶抑制劑rfs2000;二氟甲基鳥氨酸(dmfo);類視黃醇a,例如視黃酸;卡培他濱;順鉑(cddp)、卡鉑、丙卡巴肼、雙氯乙基甲胺、環磷酰胺、喜樹堿、異環磷酰胺、美法侖、苯丁酸氮芥、白消安、亞硝基脲、放線霉素d、柔紅霉素、多柔比星、博來霉素、普卡霉素(plicomycin)、絲裂霉素、依托泊苷(vp16)、他莫昔芬、雷洛昔芬、雌激素受體結合劑、紫杉酚、紫杉醇、多西他賽、吉西他濱、諾維本(navelbine)、法呢基蛋白轉移酶抑制劑、反式鉑劑(transplatinum)、5-氟尿嘧啶、長春新堿、長春堿和氨甲蝶呤;以及上述任一種的可藥用鹽、酸或衍生物。該定義中還包括用于調節或抑制對腫瘤的激素作用的抗激素劑,例如抗雌激素和選擇性雌激素受體調節劑(serm),包括例如他莫昔芬、雷洛昔芬、屈洛昔芬、4-羥基他莫昔芬、曲沃昔芬、鹽酸雷洛昔芬(keoxifene)、ly117018、奧那司酮(onapristone)和托瑞米芬;抑制調節腎上腺中雌激素產生的酶芳香酶的芳香酶抑制劑,例如如4(5)-咪唑、氨魯米特、乙酸甲地孕酮、依西美坦、福美坦(formestanie)、法倔唑、伏氯唑、來曲唑和阿那曲唑;以及抗雄激素,例如氟他胺、尼魯米特、比卡魯胺、亮脯利特和戈舍瑞林;以及曲沙他濱(troxacitabine)(1,3-二氧戊環核苷胞嘧啶類似物);反義寡核苷酸,特別是抑制信號傳導途徑中參與異常細胞增殖的基因表達的那些,所述基因例如如pkc-α、ralf和h-ras;核酶,例如vegf表達抑制劑和her2表達抑制劑;疫苗,例如基因治療疫苗;以及上述任一種的可藥用鹽、酸或衍生物。2.放射治療放射治療(也稱為放射性治療)是使用電離輻射來治療癌癥和其他疾病。電離輻射沉積能量,其通過損害遺傳物質來損傷或破壞所治療區域中的細胞,使這些細胞不能夠繼續生長。盡管輻射同時損害癌癥細胞和正常細胞,但是后者能夠自身修復并適當地作用。根據本公開內容使用的放射治療可以包括但不限于使用γ射線、x射線和/或向腫瘤細胞定向遞送放射性同位素。其他形式的dna損傷因素也在考慮之中,例如微波和uv照射。所有這些因素最有可能對dna、dna前體、dna的復制和修復、以及染色體的組裝和維持產生大范圍的損害。x射線的劑量范圍為長時間(3至4周)50至200倫琴的每日劑量至2000至6000倫琴的單劑量。放射性同位素的劑量范圍廣泛變化,并且取決于同位素的半衰期、發出的輻射的強度和類型、以及被贅生性細胞的攝取。放射治療可以包括使用經放射性標記的抗體來向癌癥部位直接遞送輻射劑量(放射免疫治療)。抗體是由機體響應于抗原(被免疫系統識別為外源的物質)的存在而產生的高度特異性蛋白質。一些腫瘤細胞包含觸發產生腫瘤特異性抗體的特異性抗原。大量的這些抗體可以在實驗室中制成并連接到放射性物質(稱為放射性標記的方法)。一旦注射到體內,抗體主動地尋找癌細胞,癌細胞通過輻射的細胞殺傷(細胞毒性)作用而被破壞。該方法可以使對健康細胞的輻射損害的風險最小化。適形放射治療使用相同的放射治療機(線性加速器)作為正常的放射治療性治療,但是將金屬塊放置在x射線束的路徑中改變其形狀以匹配癌癥的形狀。這確保給予腫瘤較高的輻射劑量。健康的周圍細胞和附近結構接受較低劑量的輻射,因此副作用的可能性降低。已經開發了一種被稱為多葉準直器的裝置,并且其可以用作金屬塊的替代物。多葉準直器由固定在線性加速器上的多個金屬片組成。可以調整各層,使得放射治療束無需金屬塊即可根據治療區域成形。放射治療機的精確定位對于適形放射治療性治療是非常重要的,并且可以在每次治療開始時使用專用掃描機來檢查內部器官的位置。高分辨率強度調制放射治療也使用多葉準直器。在這種治療期間,在正給予治療的同時移動多葉準直器的層。該方法可能實現治療束的甚至更精確成形,并允許放射治療劑量在整個治療區域恒定。盡管研究已經表明適形放射治療和強度調制放射治療可以降低放射治療性治療的副作用,但是如此精確地根據治療區域成形可能會停止恰好在所破壞治療區域之外的微觀癌細胞。這意味著,使用這些特化的放射治療技術,將來癌癥復發的風險可能會更高。科學家們也在尋找提高放射治療的有效性的方式。正在研究兩種類型的研究藥物對正進行輻射的細胞的作用。放射增敏劑使腫瘤細胞更可能被損害,放射防護劑保護正常組織免受輻射的影響。還正在研究使用熱的熱療(hyperthermia)在使組織對輻射致敏方面的有效性。3.免疫治療在癌癥治療的背景下,免疫治療通常依賴于使用免疫效應細胞和分子來靶向和破壞癌細胞。曲妥珠單抗(herceptintm)是這樣的一個實例。免疫效應物可以是例如對腫瘤細胞表面上的一些標志物具有特異性的抗體。抗體單獨可以用作治療的效應物,或者其可以募集其他細胞來實際影響細胞殺傷。抗體還可以與藥物或毒素(化學治療劑、放射性核素、蓖麻毒素a鏈、霍亂毒素、百日咳毒素等)綴合,并且僅用作靶向劑。或者,效應物可以是攜帶與腫瘤細胞靶標直接或間接相互作用的表面分子的淋巴細胞。多種效應細胞包括細胞毒性t細胞和nk細胞。治療方式的組合,即直接細胞毒活性和erbb2的抑制或減少,可在治療erbb2過表達癌癥中提供治療益處。還可以使用另一種免疫治療作為與上述基因沉默治療的組合治療的一部分。在免疫治療的一個方面中,腫瘤細胞必須攜帶適合靶向,即不存在于大多數其他細胞上的一些標志物。在本公開內容的背景下,存在許多腫瘤標志物,并且任何這些都可以適合于靶向。常見的腫瘤標志物包括癌胚抗原、前列腺特異性抗原、泌尿腫瘤相關抗原、胎兒抗原、酪氨酸酶(p97)、gp68、tag-72、hmfg、sialyllewis抗原、muca、mucb、plap、雌激素受體、層粘連蛋白受體、erbb和p155。免疫治療的一個替代方面是將抗癌作用與免疫刺激作用組合。還存在免疫刺激分子,其包括:細胞因子,例如il-2、il-4、il-12、gm-csf、γ-ifn;趨化因子,例如mip-1、mcp-1、il-8;以及生長因子,例如flt3配體。已經表明,將免疫刺激分子作為蛋白質或使用基因遞送與腫瘤抑制劑組合增強抗腫瘤作用(ju等,2000)。此外,可以使用針對任何這些化合物的抗體來靶向本文中討論的抗癌劑。目前正在研究或正在使用的免疫治療的實例是免疫佐劑,例如牛型分枝桿菌(mycobacteriumbovis)、惡性瘧原蟲(plasmodiumfalciparum)、二硝基氯苯和芳族化合物(美國專利5,801,005和5,739,169;hui和hashimoto,1998;christodoulides等,1998);細胞因子治療,例如干擾素α、β和γ,il-1,gm-csf,和tnf(bukowski等,1998;davidson等,1998;hellstrand等,1998);基因治療,例如tnf、il-1、il-2、p53(qin等,1998;austin-ward和villaseca,1998;美國專利5,830,880和5,846,945);以及單克隆抗體,例如抗神經節苷脂gm2、抗her-2、抗p185(pietras等,1998;hanibuchi等,1998;美國專利5,824,311)。可以考慮,可以將一種或更多種抗癌治療與本文中所述的基因沉默治療一起使用。在主動免疫治療中,施用抗原性肽、多肽或蛋白質,或者自體或同種異體腫瘤細胞組合物或“疫苗”,通常與不同的細菌佐劑一起(ravindranath和morton,1991;morton等,1992;mitchell等,1990;mitchell等,1993)。在過繼性免疫治療中,體外分離患者的循環淋巴細胞或腫瘤浸潤的淋巴細胞,通過淋巴因子(例如il-2)激活或用腫瘤壞死基因轉導,并重新施用(rosenberg等,1988;1989)。4.外科手術大約60%患有癌癥的人將經歷某種類型的外科手術,其包括預防性、診斷性或分期性、治療性和姑息性外科手術。治療性外科手術是可以與其他治療聯合使用的癌癥治療,所述其他治療例如本公開內容的治療、化學治療、放射治療、激素治療、基因治療、免疫治療和/或替代治療。治療性外科手術包括在其中全部或部分癌性組織被物理去除、切除和/或破壞的切除術。腫瘤切除術是指至少部分腫瘤的物理去除。除腫瘤切除術外,通過外科手術的治療還包括激光外科手術、冷凍外科手術、電外科手術和通過顯微鏡控制的外科手術(mohs外科手術)。還可以考慮,本公開內容可以與除去淺表性癌癥、前期癌或附帶量的正常組織聯合使用。在切除部分或全部癌性細胞、組織或腫瘤之后,可以在體內形成腔。治療可以通過用另外的抗癌治療灌注、直接注射或局部施加部位來實現。這樣的治療可以重復,例如每1、2、3、4、5、6或7天,或者每1、2、3、4和5周,或者每1、2、3、4、5、6、7、8、9、10、11或12個月。這些治療也可以具有不同的劑量。5.基因治療在又一個實施方案中,二次治療為基因治療,其中在施用h2a.z靶向劑之前、之后或同時施用治療性多核苷酸。h2a.z靶向劑與編碼以下基因產物之一的載體聯合遞送可以對靶組織具有組合的抗過度增殖作用。多種蛋白質包括在本公開內容中,其中一些蛋白質在下文中描述。a.細胞增殖的誘導因子根據功能,誘導細胞增殖的蛋白質進一步落入多個類別。所有這些蛋白質的共同性是其調節細胞增殖的能力。例如,pdgf的一種形式sis癌基因是分泌的生長因子。癌基因很少由編碼生長因子的基因產生,而目前,sis是唯一已知的天然存在癌基因生長因子。在本公開內容的一個實施方案中,可以考慮,使用針對特定細胞增殖誘導因子的反義mrna或sirna來阻止細胞增殖誘導因子的表達。fms和erba蛋白為生長因子受體。這些受體的突變導致可調節功能的喪失。例如,影響neu受體蛋白的跨膜結構域的點突變導致neu癌基因。erba癌基因來源于甲狀腺激素的細胞內受體。經修飾的癌基因erba受體被認為與內源性甲狀腺激素受體競爭,導致不受控制的生長。癌基因的最大類別包括信號轉導蛋白(例如src、abl和ras)。src蛋白是細胞質蛋白酪氨酸激酶,并且在某些情況下通過在酪氨酸殘基527處的突變導致其從原癌基因轉變成癌基因。相比之下,在一個實例中,通過序列中氨基酸12從纈氨酸到甘氨酸的突變導致gtp酶蛋白ras從原癌基因轉變成癌基因,降低了rasgtp酶活性。jun、fos和myc蛋白是作為轉錄因子直接發揮其對核功能的作用的蛋白質。b.細胞增殖的抑制因子腫瘤抑制癌基因的作用是抑制過度的細胞增殖。這些基因的失活破壞其抑制活性,導致不受調節的增殖。可以使用腫瘤抑制因子p53、mda-7、fhit、p16和c-cam。除p53外,另一種細胞增殖抑制因子是p16。真核細胞周期的主要過渡是由細胞周期蛋白依賴性激酶或cdk引發的。一種cdk細胞周期蛋白依賴性激酶4(cdk4)通過g1調節進展。該酶的活性可能是在晚期g1磷酸化rb。cdk4的活性受活化亞基(d型細胞周期蛋白)以及抑制亞基的控制,p16ink4已被生物化學表征為特異性結合并抑制cdk4的蛋白質,并且因此可調節rb磷酸化(serrano等,1993;serrano等,1995)。由于p16ink4蛋白是一種cdk4抑制因子(serrano,1993),故該基因的缺失可增加cdk4的活性,導致rb蛋白的過度磷酸化。還已知p16調節cdk6的功能。p16ink4屬于cdk抑制蛋白的一類,其還包括p16b、p19、p21waf1和p27kip1。p16ink4基因圖譜繪制于9p21,其是在許多腫瘤類型中經常缺失的染色體區域。p16ink4基因的純合性缺失和突變在人腫瘤細胞系中較為頻繁。該證據表明p16ink4基因是腫瘤抑制基因。然而,這一解釋由于以下觀察結果而已經受到挑戰:p16ink4基因改變的頻率在原代未培養的腫瘤中比在培養的細胞系中低得多(caldas等,1994;cheng等,1994;hussussian等,1994;kamb等,1994;kamb等,1994;mori等,1994;okamoto等,1994;nobori等,1995;orlow等,1994;arap等,1995)。通過用質粒表達載體轉染來恢復野生型p16ink4功能降低某些人癌細胞系的集落形成(okamoto,1994;arap,1995)。根據本公開內容可以使用的其他基因包括rb、apc、dcc、nf-1、nf-2、wt-1、men-i、men-ii、zac1、p73、vhl、mmac1/h2a.z、dbccr-1、fcc、rsk-3、p27、p27/p16融合體、p21/p27融合體、抗血栓形成基因(例如cox-1、tfpi)、pgs、dp、e2f、ras、myc、neu、raf、erb、fms、trk、ret、gsp、hst、abl、e1a、p300、參與血管生成的基因(例如vegf、fgf、血小板反應蛋白(thrombospondin)、bai-1、gdaif、或其受體)和mcc。c.程序性細胞死亡的調節因子細胞凋亡或程序性細胞死亡是正常胚胎發育、維持成體組織內的穩態和抑制癌發生的必需過程(kerr等,1972)。已經證明了bcl-2蛋白家族和ice樣蛋白酶二者都是其他系統中細胞凋亡的重要調節因子和效應因子。發現與濾泡性淋巴瘤有關的bcl-2蛋白在響應于各種細胞凋亡刺激來控制細胞凋亡和增強細胞存活中發揮突出作用(bakhshi等,1985;cleary和sklar,1985;cleary等,1986;tsujimoto等,1985;tsujimoto和croce,1986)。現在認識到演變上保守的bcl-2蛋白是可歸類為死亡激動劑或死亡拮抗劑的相關蛋白的家族的成員。在bcl-2的發現之后,已經表明bcl-2起抑制由多種刺激觸發的細胞死亡的作用。此外,現在顯而易見的是,存在共有共同結構和序列同源性的bcl-2細胞死亡調節蛋白的家族。已經表明這些不同的家族成員具有與bcl-2類似的功能(例如bclxl、bclw、bcls、mcl-1、a1、bfl-1)或者抵消bcl-2功能并促進細胞死亡(例如bax、bak、bik、bim、bid、bad、harakiri)。d.rna干擾(rnai)在某些實施方案中,h2a.z抑制劑是針對h2a.z.的mrna的雙鏈rna(dsrna)。rna干擾(也稱為“rna介導的干擾”或rnai)是通過其可以降低或消除基因表達的機制。已經觀察到雙鏈rna(dsrna)介導降低,這是一個多步驟過程。dsrna激活轉錄后基因表達監督機制,其顯示起防御細胞免受病毒感染和轉座子活性的作用(fire等,1998;grishok等,2000;ketting等,1999;lin和avery等,1999;montgomery等,1998;sharp和zamore,2000;tabara等,1999)。這些機制的激活靶向成熟的dsrna互補mrna進行破壞。rnai為基因功能的研究提供了重要的實驗優點。這些優點包括非常高的特異性、易于移動穿過細胞膜和所靶向基因長時間下調(fire等,1998;grishok等,2000;ketting等,1999;lin和avery等,1999;montgomery等,1998;sharp等,1999;sharp和zamore,2000;tabara等,1999)。普遍接受的是rnai轉錄后起作用,靶向rna轉錄物進行降解。顯示可以靶向細胞核和細胞質rna二者(bosher和labouesse,2000)。e.sirnasirna必須被設計成使得其在抑制目的基因的表達方面具有特異性和有效性。選擇靶序列,即一個或更多個目的基因中存在的針對其sirna指導降解機制的那些序列的方法,涉及避免可干擾sirna指導功能的序列,同時包括對該一個或更多個基因特異性的序列。通常,長度為約21至23個核苷酸的sirna靶序列是最有效的。該長度反映了如上所述由加工遠遠更長rna產生的消化產物的長度(montgomery等,1998)。sirna是本領域眾所周知的。例如,美國專利6,506,559和6,573,099中以及美國專利申請2003/0051263、2003/0055020、2004/0265839、2002/0168707、2003/0159161和2004/0064842中已經描述了sirna和雙鏈rna,所述專利全部通過引用整體并入本文。已經提出了數種對sirna序列的進一步修飾以改變其穩定性或提高其有效性。已提出,具有二核苷酸突出端的合成互補21聚體rna(即,19個互補核苷酸+3’非互補二聚體)可以提供最大水平的抑制。這些方案主要使用兩個(2’-脫氧)胸苷核苷酸的序列作為二核苷酸突出端。這些二核苷酸突出端通常被寫為dtdt以將其與并入rna的普通核苷酸區分。文獻已經表明,dt突出端的使用主要是以降低化學合成rna的成本的需要為動機。還提出,dtdt突出端可能比uu突出端更穩定,但是可用數據表明與具有uu突出端的sirna相比,dtdt突出端僅略微(<20%)提高。f.抑制性核酸的產生dsrna可以使用充分描述的方法來合成(fire等,1998)。簡言之,使用t7聚合酶(megascript,ambion)由dna模板合成有義和反義rna。在合成完成之后,用dna酶i消化dna模板,并通過苯酚/氯仿提取和異丙醇沉淀來純化rna。在變性瓊脂糖凝膠上測定rna的尺寸、純度和完整性。在檸檬酸鉀緩沖液中稀釋有義和反義rna并將其在80℃下退火3分鐘以形成dsrna。與構建dna模板文庫一樣,可以使用一些操作來幫助該時間密集性操作。個體dsrna種類的總和被稱為“dsrna文庫”。sirna的制備主要通過直接化學合成、通過經由暴露于果蠅胚胎裂解物來加工較長的雙鏈rna、或者通過從s2細胞獲得的體外系統。細胞裂解物或體外處理的使用還可以涉及隨后從裂解物分離短的21至23個核苷酸的sirna,等等,導致該過程有些麻煩且昂貴。化學合成通過制備兩種單鏈rna寡聚物,然后使兩種單鏈寡聚物退火成雙鏈rna來進行。化學合成方法多種多樣。美國專利5,889,136、4,415,723和4,458,066(其明確通過引用并入本文)中以及wincott等(1995)中提供了一些非限制性實例。wo99/32619和wo01/68836提出,用于sirna的rna可以化學合成或酶促合成。這兩篇文本都通過引用整體并入本文。這些參考文獻中考慮的酶促合成是通過細胞rna聚合酶或噬菌體rna聚合酶(例如,t3、t7、sp6)經由使用和產生表達構建體來進行,如本領域中已知的。例如,參見美國專利5,795,715。所考慮的構建體提供產生rna的包含與靶基因之一部分相同的核苷酸序列的模板。由這些參考文獻提供的相同序列的長度為至少25個堿基,并且長度可以多至400個或更多個堿基。該參考文獻的一個重要方面是作者考慮使用在體內將長dsrna轉化成sirna的內源性核酸酶復合物來將較長的dsrna消化到21至25聚體的長度。他們沒有描述或提供用于合成和使用體外轉錄的21至25聚體dsrna的數據。化學或酶促合成dsrna在其用于rna干擾的預期特性之間沒有區別。類似地,wo00/44914(通過引用并入本文)提出可以酶促或通過部分/全有機合成來產生rna單鏈。優選地,由dna模板,優選克隆的cdna模板的pcr產物酶促合成單鏈rna,并且rna產物是cdna的完整轉錄物,其可以包含數百個核苷酸。wo01/36646(通過引用并入本文)在合成sirna的方式上沒有設置限制,只要可以使用人工和/或自動化操作在體外或體內合成rna即可。該參考文獻還提供了體外合成可以是化學的或酶促的,例如使用克隆的rna聚合酶(例如,t3、t7、sp6)來轉錄內源性dna(或edna)模板或二者的混合物。再次,化學或酶促合成的sirna之間在用于rna干擾的期望特性上沒有區別。美國專利5,795,715報道了在單反應混合物中同時轉錄兩種互補dna序列鏈,其中使兩種轉錄物立即雜交。使用的模板優選地具有40至100個堿基對,并且其在每個末端配置有啟動子序列。模板優選地連接到固體表面。在用rna聚合酶轉錄之后,所得dsrna片段可以用于檢測和/或測定核酸靶序列。數個團隊已經開發了在穩定轉染的哺乳動物細胞中持續表達sirna的表達載體(brummelkamp等,2002;lee等,2002;paul等,2002;sui等,2002;yu等,2002)。這些質粒中的一些被工程化成表達缺乏聚(a)尾的shrna(brummelkamp等,2002;paul等,2002;yu等,2002)。shrna的轉錄起始于聚合酶iii(poliii)啟動子,并且被認為終止于4至5個胸腺嘧啶的轉錄終止位點的第2位。shrna被認為折疊成具有3’uu-突出端的莖環結構。隨后,加工這些shrna的末端,將shrna轉化為約21nt的sirna樣分子(brummelkamp等,2002)。sirna樣分子進而可以在轉染的哺乳動物細胞中產生基因特異性沉默。g.其他藥劑可以考慮,可以將其他藥劑與本公開內容一起使用。這些另外的藥劑包括免疫調節劑、影響細胞表面受體和間隙連接上調的藥劑、細胞抑制劑和分化劑、細胞黏附抑制劑、增加過度增殖細胞對凋亡誘導劑的敏感性的藥劑、或其他生物劑。免疫調節劑包括腫瘤壞死因子;干擾素α、β和γ;il-2及其他細胞因子;f42k及其他細胞因子類似物;或者mip-1、mip-1β、mcp-1、rantes,以及其他趨化因子。還可以考慮,細胞表面受體或其配體(例如fas/fas配體、dr4或dr5/trail(apo-2配體))的上調可通過建立對過度增殖細胞的自分泌或旁分泌作用來增強本公開內容的細胞凋亡誘導能力。通過升高間隙連接數來增加細胞間信號可增加對鄰近過度增殖細胞群的抗過度增殖作用。在另一些實施方案中,可以將細胞抑制劑或分化劑與本公開內容組合使用以提高治療的抗過度增殖效力。可以考慮細胞黏附抑制劑以提高本公開內容的效力。細胞黏附抑制劑的實例是黏著斑激酶(fak)抑制劑和洛伐他汀。還考慮,可以將其他增加過度增殖細胞對細胞凋亡的敏感性的藥劑(例如抗體c225)與本公開內容組合使用以提高治療效力。在引入細胞毒性化學治療藥物之后,在癌癥的治療上已經取得許多進展。然而,化學治療的結果之一是出現/獲得抗藥性表型并且發生多重抗藥性。抗藥性的出現仍然是治療這樣的腫瘤的主要障礙,并且因此,顯然需要替代方法,例如基因治療。與化學治療、放射治療或生物治療聯合使用的另一種治療形式包括熱療,其是其中使患者的組織暴露于高溫(高達106°f)的方法。局部、區域性或全身熱療的施加可以涉及外部或內部加熱裝置。局部熱療包括向小區域(例如腫瘤)施加熱。熱在外部可以從體外裝置用靶向腫瘤的高頻波來產生。內部熱可以涉及無菌探針,包括薄的經加熱導線或用溫水填充的中空管、植入的微波天線或射頻電極。加熱患者的器官或肢體進行區域性治療,這使用產生高能量的裝置(例如磁體)來實現。或者,可以移出患者的一些血液并在灌注到將內部加熱的區域之前進行加熱。在癌癥已遍及全身的情況下,還可以實施全身加熱。為了此目的,可以使用溫水毯、熱蠟、感應線圈和熱室。激素治療也可以與本公開內容聯合使用或者與先前描述的任何其他癌癥治療組合使用。激素的使用可以用于治療某些癌癥(例如乳腺癌、前列腺癌、卵巢癌或宮頸癌)以降低某些激素(例如睪酮或雌激素)的水平或阻斷其作用。這種治療通常作為一個治療選擇或為降低轉移風險而與至少一種其他癌癥治療組合使用。5.劑量本文所述組合物中包括的或所述方法中施加的治療劑的量將是在藥學上有效的任何量,并且將取決于許多因素,包括所選治療劑的身份和效力。本領域普通技術人員熟悉涉及確定特定藥劑的治療有效劑量的因素。因此,在該方面中,本文所述組合物中治療劑的濃度可以為任意濃度。在一些具體實施方案中,藥物的總濃度小于10%。在一些更具體的實施方案中,藥物的濃度小于5%。治療劑可以施加一次或多于一次。在一些非限制性實例中,治療劑每天一次、每天兩次、每天三次、每天四次、每天六次、在清醒時每兩小時、每四小時、每隔一天、每周一次地施加,等等。治療可以持續任何持續時間,如本領域普通技術人員所確定的。ix.實施例包括以下實施例來說明本公開內容的某些非限制性方面。本領域技術人員應理解,在以下實施例中公開的技術代表本發明人發現在本公開內容的實施中發揮良好作用的技術。然而,根據本公開內容,本領域技術人員應理解,在不脫離本公開內容的精神和范圍下,可以在所公開的特定實施方案中進行許多變化并且仍然獲得相似或類似的結果。實施例1-材料和方法數據.總共有74個樣品:35個病例(27個獨特的個體病例)和39個對照(31個獨特的個體對照)。在39個對照中,11個為新增的年輕對照。年輕對照與randa對照不同,因此,這些對照從分析中排除。在剩余的63個樣品(35個病例和28個對照)中,有15對,“c”與“f”(8對為病例和7對為對照)。根據“c”和“f”標記,將病例和對照的數據分成兩個集合。每個集合包含27個病例和21個對照。在8對病例中,7對屬于“早期”并且1對屬于“晚期”。該“晚期”樣品根據組織學屬于“肉瘤樣”,并且因此不包括在“鱗狀病例相對于對照”分析中。在7對“早期”樣品中,6對具有“腺”并且1對為“鱗狀”。表1.包含“c”或“f”標記的15對樣品數據分為兩個集合,每個集合包含19個常見病例和14個常見對照加具有“c”標記的8個病例和7個對照(對于集合1),或者具有“f”標記的8個病例和7個對照(對于集合2)。參見圖1。變量.檢測三個獨立變量,變量“異常細胞(>2個異常)的#”被編碼為v1,變量“總異常(缺失+增益+異常)的#”被編碼為v2,變量“僅具有增益的異常細胞的#”被編碼為v3。統計學分析.對病例和對照(全部、早期與對照、晚期與對照、腺與對照和鱗狀與對照)進行t-檢驗(包括使用wilcoxon和kruskal-wallis檢驗的非參數方法)、單變量精確邏輯回歸和多變量精確邏輯回歸(所有三個變量)。表2.不同組中病例和對照的描述統計學注意:在“期”中,0=對照,1=早期,2=晚期。在組織學中,0=對照,1=腺,2=鱗狀,其他為遺漏。實施例2-結果在三個變量(v1、v2和v3)方面,病例與對照顯著不同。無論使用等方差(當f檢驗不顯著時)或不等方差方法,還是使用非參數方法(例如wilcoxon檢驗和kruskal-wallis檢驗),t檢驗的結果全部均顯示在病例和對照之間具有顯著性差異。這在具有“c”標記的樣品的集合中與在具有“f”標記的樣品的集合中是相同的。然而,在具有“f”標記的集合(下表3的底部)中在病例和對照之間在方差檢驗(即f檢驗)中觀察到主要差異。這可以表明在包含“f”樣品的病例和對照之間具有較大的異質性。表3.f檢驗和t檢驗的結果f檢驗中的顯著性結果表明在病例和對照之間檢測到的方差的不等。因此,應當考慮不等方差的t檢驗。包含“f”標記的樣品的集合(8個病例和7個對照)顯示在病例和對照之間的方差差異的強烈趨勢。參照上表1,這樣的差異效應似乎主要來自屬于“早期”和“腺”組的樣品。由于極小的樣品尺寸,即僅3個病例,“晚期”組中的結果可能不可靠,參見上表2。精確邏輯回歸。使用五組病例相對于對照進行單變量精確邏輯回歸。結果顯示在包含“c”標記或“f”標記的兩個集合中在所有組之間具有統計學顯著性。優勢比(oddsratio,or)全部均大于1,意味著所有三個變量的風險因子。比較兩個集合(即“c”和“f”集合)之間的or標度,其在各組中是相似的,例如,在“全部病例相對于對照”組中,or=2.8(包含“c”的v1)相對于or=2.7(包含“f”的v1),1.4(包含“c”的v2)相對于1.26(包含“f”的v2),和5.78(包含“c”的v3)相對于4.7(包含“f”的v3)。在包含“c”標記或“f”標記的兩個集合中“晚期病例相對于對照”和“腺病例相對于對照”的組在變量v3的精確邏輯回歸期間未能獲得最大似然估計導致沒有獲得可靠的結果(同樣v2,在“c”標記中)。表4.精確邏輯回歸(單變量)的結果使用以下模型嘗試多變量精確邏輯回歸:logit(狀態病例/對照)=β0+β1v1+β2v2+β3v3。然而,該將三個變量組合在一起的多變量模型是有問題的,因為甚至當v1至v3值中的一個遺漏時,程序丟棄一個個體。對于小樣品,其導致不穩定的評估。重要的是,在單變量分析中,在所有不同的子集(例如早期、晚期、腺和鱗狀)中v1至v3都是顯著性的。實施例2-結果數據.使用所有74個樣品,包括標記為“c”和“f”的15對和11個年輕對照。對三個變量v1、v2和v3進行簇聚。探究.從散點圖(圖2a至圖2d),11個年輕對照(□)與所有病例(●)區分分開,狹窄地散布在角落處。但是,三個變量各自中均存在少數年長對照(o)與病例交結。這會對簇聚分析構成挑戰。簇聚分析.使用sasproccluster,將11種簇聚方法中的8種用于數據。并且以下結果使用平均連接方法由最佳方法獲取,所述最佳方法由來自其他centroid方法和gower中值方法的結果支持。檢測三個主要統計量以估計聚簇的數目,但是數據集本身被限定在病例(使用值3)和對照(年輕組使用值2和年長組使用值1)的組中。三個統計量為立方簇聚準則(ccc)、偽f(psf)和t2(pst2)。●ccc值大于2或3的峰意指有效聚簇。大的負ccc值指向異常值。●psf的數大意指良好的聚簇數目。●pst2在此可以作為支持結果整合以上兩者來判斷聚簇的數目。在pstsq圖表(對該pst2值繪制圖表)中,pump(向右)后的數目可以指示良好聚簇的數目。表6.根據aff(病例/對照的疾病狀態)的聚簇聚簇數目的峰估計為3,并且在數據中表明總共11個聚簇。基于3聚簇的結果的檢測顯示:aff=1(年輕對照)、2(年長對照)和3(病例)。三個對照被分類到大多數為病例(20個aff=3)的聚簇2,并且2個病例被分組大部分對照所在的聚簇1。這些是在簇聚中的不明確樣品。表7.聚簇中的不明確樣品在三個主要聚簇中,大多數病例被分組到聚簇1中并且大部分病例被分組到聚簇2和3中。表8和表9分別列出了對照和病例的成功分類。成功鑒定出v2不大于23且v3不大于2的對照。對于病例,v2不低于27。表8.成功分類的對照注意:“aff”代表病例和對照的疾病狀態。值2代表年輕對照。左側的表通過id分類,并且右側的表通過v2、v1和v3分類。表9.成功分類的病例左側的表通過id分類,并且右側的表通過v2、v1和v3分類。表10.由于遺漏值的丟棄樣品obsno2v1v2v3簇affid1807..1vs13-127f23503..2vs14-h-7距原點的歐幾里得距離.嘗試另一種簡單測量使用以下公式來計算每個樣品到原點的平方歐幾里得距離,“euclideand”:euclideand=(v1)2+(v2)2+(v3)2,例如,如在具有v1=6、v2=20和v3=2的樣品id=vs13-105的情況下,其euclideand=62+202+22=36+400+4=440。euclideand列出在表11(成功分類的對照)、表12(成功分類的病例)和表13(錯誤分類的病例/對照)中。對于euclideand<=537的對照或euclideand>=779的病例,分類顯示是成功的。在表13中,有一個對照樣品id=vs13-101被分組到聚簇2中。該樣品具有euclideand=859,與病例樣品id=vs13-137(同樣在聚簇2中)完全相同的值。兩個樣品享有完全相同的值v1(=3)、v2(=29)和v3(=3)。平均連接簇聚法將其二者都分組到聚簇2中,但是一個被鑒定為對照,并且由此被認為是錯誤分類。表11.成功分類的對照的euclideand表12.成功分類的病例的euclideand表13錯誤分類的病例和對照使用該系統,本發明人能夠將異常細胞的數目富集在患者(9)和對照(5)的亞組中,使用該新的閾值在bioview系統上再分析其血液樣品以富集惡性細胞群)。在如此測量的9個癌癥病例(大部分患有早期肺癌)中,5/9顯示出異常細胞的增加(被限定為在同一細胞內2個染色體基因座的多體性或增益)。在初始被評分為惡性腫瘤陰性(基于4或>異常細胞的陽性閾值)的早期腺癌的一個病例中,使用新軟件重新分類將異常細胞數目從3升高到5(病例v13-109;參見以下),因此使我們能夠將該病例分類為陽性,并且提高測試的靈敏性和特異性。拍攝全屏幕快照,其顯示在軟件優化之前和之后的循環腫瘤細胞(ctc)富集。腫瘤細胞或循環腫瘤細胞(ctc)被限定為2或>染色體增益或多體性/細胞的任何細胞。該方法產生10fish信號/細胞的最小值,陽性病例被限定為具有4或>ctc的血液樣品。以下討論了三個代表性病例。vs13-109.45歲的女性,曾經的吸煙者,患有ib期鱗狀細胞肺癌,在軟件優化之前使用四色fish面板在duet(bioviewltd.)上顯示3個異常細胞。在優化之后,使用四色fish面板從相同病例中觀察到異常細胞(異常細胞檢測提高66%)。vs13-121.82歲的男性,當前的吸煙者,被診斷患有肺的iib期腺癌,在軟件優化之前,使用四色fish面板在duet(bioviewltd.)上顯示6個fish-異常細胞。在優化之后,使用四色fish面板觀察到10個fish-異常細胞(異常細胞檢測提高66%)。vs13-124.40歲男性,曾經的吸煙者,被診斷患有iia期鱗狀細胞肺癌,在軟件優化之前,使用四色fish面板在duet(bioviewltd.)上顯示6個異常細胞。在軟件優化之后,使用四色fish面板異常細胞產率增加到8個異常細胞(提高33%)。表14總結了這5個患有肺癌的患者的數據,隨著新軟件改進,所述患者的異常(惡性)循環腫瘤細胞數目增加(舊的數目在括號中)。表14在對照病例中,異常細胞的數目增加多于1個細胞,然而仍遠遠低于閾值4,其為惡性腫瘤的閾值。甲狀腺癌.當基于無法捕獲正經歷上皮間充質轉化的ctc的epcam測定時,乳頭狀甲狀腺癌(ptc)患者中循環腫瘤細胞(ctc)的計數一直沒有成功。為了克服這一點,本發明人設計了使用dna探針的基于抗原依賴性fish的測定,所述dna探針先前已經用于檢測肺癌ctc。本發明人假定以上討論的這些相同探針可以檢測ptc中的ctc,因為肺和甲狀腺均源自前腸內胚層,并且與nkx2-1/ttf1(一種譜系存活癌基因)有關,nkx2-1/ttf1控制與肺和甲狀腺祖細胞分化有關的基因(例如表面活性蛋白(sfpt))的表達。此外,通過rnaseq已經證明大多數ptc過表達表面活性蛋白a、b和crna。為了評價患有轉移性ptc(ptcm)的患者的外周血中ctc的存在,本發明人測試了患有ptcm的患者和對照,試圖建立疾病進展和對治療的應答的新預后/替代標志。還試圖了解肺癌探針組是否可以準確地檢測ptc的ctc。招募了12位ptcm患者(年齡62±15.7歲)以及8位具有ptc歷史、成功甲狀腺切除術和超過5年無疾病跡象(ned)的對照患者(年齡46.9±12.1歲)。30位健康對象(年齡62.7±7.8歲)作為第二對照組包括在內。分離外周血單個核細胞(pbmc),并使其與4種dna探針(2種基因座特異性探針(在10q22(sftpa1、2)和3p22處)和2種內部著絲粒探針(cep10和cep3))的多色混合物雜交。掃描系統對500細胞/樣品以每個細胞為基礎評分熒光信號。信號模式通過2個讀出器分析為以下類別:異常細胞(ac)或ctc(2或>探針的增益);缺失或增益(單探針的丟失或增益),和正常細胞。與具有ned的患者(0.18±0.18)或健康對照(0.18±0.23)相比,患有ptcm的患者具有較高的%ac(0.9±0.3,p<0.001和99.9%功率)。0.6%ac(3/500細胞)的截斷值在ptcm和來自兩組的對照之間區分。與健康對照相比,患有ptcm的患者具有較高的cep3缺失百分比(0.80±0.85相對于0.19±0.53,p=0.006)、cep10缺失百分比(1.43±1.37相對于0.45±0.67,p=0.002)、cep10增益百分比(0.45±0.34相對于0.23±0.28,p=0.03)、以及10q22.3增益百分比(0.77±0.60相對于0.13±0.17,p<0.001)、總缺失和增益百分比(5.68±1.91相對于2.47±1.27,p<0.001)以及降低的正常細胞%(94.33±1.88相對于97.52±1.24)(p<0.00001)。ptcm證明了以非整倍性為特征的ctc,其中與對照相比ctc的水平較高。設計用于肺癌的探針成功地檢測ptc患者的ctc的遺傳畸變,可能是由于肺和甲狀腺惡性祖細胞中控制基因表達的共同譜系特異性轉錄因子。需要更大組群的研究來證明ctc在ptcm的預后中的顯著性。*************根據本公開內容,本文中公開和要求保護的所有組合物和方法可以在沒有過度實驗的情況下進行和執行。盡管根據優選實施方案已經對本公開內容的組合物和方法進行描述,但是對本領域技術人員顯而易見的是,在不脫離本公開內容的概念、精神和范圍的情況下可以改變本文中所述的組合物和方法以及方法的步驟或步驟順序。更具體地,顯而易見的是,化學和生理相關的某些試劑可以代替本文中所述的試劑,同時獲得相同或類似的結果。對于本領域技術人員顯而易見的所有這樣的類似替代和修改被認為在由所附權利要求書限定的本公開內容的精神、范圍和概念內。參考文獻以下參考文獻在其提供補充本文中所述的那些的示例性操作細節或其他細節的程度上特別地通過引用并入本文。美國專利4,415,723美國專利4,458,066美國專利4,683,195美國專利4,683,202美國專利4,800,159美國專利4,883,750美國專利5,279,721美國專利5,610,287美國專利5,739,169美國專利5,795,715美國專利5,801,005美國專利5,824,311美國專利5,830,880美國專利5,846,945美國專利5,889,136美國專利6,506,559美國專利6,573,099美國專利6,797,471美國專利公開2002/0168707美國專利公開2003/0051263美國專利公開2003/0055020美國專利公開2003/0159161美國專利公開2004/0064842美國專利公開2004/0265839美國專利公開2007/0218480美國專利公開2009/0137412alberolaetal.,proc.ann.mt.am.soc.clin.oncol.,14:a1094,1995.allardetal.,clin.cancerres.,10:6897-6904,2004.arapetal.,cancerres.,55(6):1351-1354,1995.auerbachetal.,n.englj.med.,265:253-267,1961.austin-wardandvillaseca,revistamedicadechile,126(7):838-845,1998.ayabeetal.,lungcancer,11(3-4):201-208,1994.bakhshietal.,cell,41(3):899-906,1985.barkanetal.,cancer,105:35-43,2004.barkanetal.,cancer,105:35-43,2005.bonassietal.,cancerres.,60:1619-1625,2000.bonassietal.,genomeres.,104(1-4):376-382,2004.bosherandlabouesse,nat.cell.biol.,2(2):e31-e36,2000.brummelkampetal.,cancercell,2:243-247,2002.bubendorfetal.,am.j.clin.pathol.,123516-123523,2005.bukowskietal.,clinicalcancerres.,4(10):2337-2347,1998.caldasetal.,cancerres.,54:3568-3573,1994.carcyetal.,jnci,65:1225-1230,1980.carriagaetal.,cancer,75:406-421,1995.chengetal.,cancerres.,54(21):5547-5551,1994.cheonetal.,yonseimed.j.,34(4):365-370,1993.christodoulidesetal.,microbiology,144(pt11):3027-3037,1998.clearyandsklar,proc.natl.acad.sci.usa,82(21):7439-7443,1985.clearyetal.,j.exp.med.,164(1):315-320,1986.cristofanillietal.,n.engl.j.med.,351:781-791,2004.danielyetal.,urology,66:1354-1359,2005.davidsonetal.,j.immunother.,21(5):389-398,1998.ekinsandchu,trendsinbiotechnology,17:217-218,1999.epoappln.320308epoappln.329822federetal.,cancergenet.cytogenet.,102:25-31,1998.feinsteinetal.,am.rev.repir.dis.,101:671-684,1970.fenechandcrott,mutat.res.,504:131-136,2002.fenech,drugdiscov.today,7:1128-1137,2002.fenech,mutat.res.,455:81-95,2000.fenech,toxicology,181-182:411-416,2002.fireetal.,nature,391(6669):806-811,1998.fodoretal.,biochemistry,30(33):8102-8108,1991.fontaninietal.,cancer,70(6):1520-7,1992.freifelder,in:physicalbiochemistryapplicationstobiochemistryandmolecularbiology,2nded.wm.freemanandco.,ny,1982.frohman,in:pcrprotocols:aguidetomethodsandapplications,academicpress,n.y.,1990.gangnusetal.,clin.cancerres.,10:3457-3464,2004.gbappln.2202328goezeetal.,j.pathol.,196:8-16,2002.goughetal.,biomed.central,4:9:1471-2164,2003.grishoketal.,science,287:2494-2497,2000.haagsmananddiemel,comp.biochem.physiol.mol.integr.physiol.,129(1):91-108,2001.haciaetal.,naturegenet.,14:441-449,1996.hagmaretal.,cancerres.,58:4117-4121,1998.hanibuchietal.,int.j.cancer,78(4):480-485,1998.hellstrandetal.,actaoncologica,37(4):347-353,1998.hiranoetal.,americanj.path.,144(2):296-302,1994.hirsh,manksgaard,1-78,1983.holmstrometal.,anal.biochem.209:278-283,1993.huangetal.,proc.nat′lacad.sci.usa98:15044-15049,2001.huiandhashimoto,infectionimmunt.,66(11):5329-5336,1998.hussussianetal.,nat.genet.,8(1):15-21,1994.ichinoseetal.,cancerres.,51(19):5392-5397,1991.ihde,curr.prob.cancer,15:65,1991.ingenitoetal.,j.appl.physiol.,86(5):1702-1714,1999.innis,etal.,in:pcrprotocols.aguidetomethodsandapplication,academicpress,inc.sandiego,1990.jiangandkatz,diagn.mol.pathol.,11:47-57,2002.jiangetal.,clin.cancerres.,115417-115424,2005.jiangetal.,neoplasia,6:623-635,2004.jones,nature,199:280-282,1963.juetal.,genether.,7(19):1672-1679,2000.kambetal.,nat.genet.,8(1):23-26,1994.kambetal.,science,2674:436-440,1994.katzetal.,mod.pathol.,21:950-960,2008.kerretal.,br.j.cancer,26(4):239-257,1972.kettingetal.,cell,99(2):133-141,1999.kimetal.,cell,87:343-355,1996.korfhagenetal.,proc.natl.acad.sci.usa,93(18):95949599,1996.kwohetal.,proc.natl.acad.sci.usa,86:1173,1989.leeetal.,biochim.biophys.acta,1582:175-177,2002.levershaetal.,clin.cancerres.,15(6):2091-7,2009.lietal.,lab.invest.,86(6):619-627,2006.licciardelloetal.,int.j.radiat.oncol.biol.phys.,17(3):467-476,1989.liewaldetal.,chirurg.,63(3):20510,1992.linandavery,nature,402:128-129,1999.liouetal.,cancerres.,59:1481-1484,1999.macchiarinietal.,procannumt.am.soc.clin.oncol.,11:a995,1992.mitchelletal.,ann.nyacad.sci.,690:153-166,1993.mitchelletal.,j.clin.oncol.,8(5):856-869,1990.mitsudomietal.,clin.cancerres.,2(7):1185-9,1996.miyamotoetal.,cancerres.,51(23pt1)6346-50,1991.montgomeryetal.,proc.natl.acad.sci.usa,95:15502-15507,1998.morietal.,cancerres.,54(13):3396-3397,1994.mortonetal.,arch.surg.,127:392-399,1992.mrkveetal.,anticancerresearch,13(3):571-8,1993.mullerandpantel,breastcancerres.,6:258-261,2004.narukeetal.,j.thorac.cardiovassurg.,96:400,1988.newtonetal.,nucl.acidsres.21:1155-1162,1993.noborietal.,nature(london),368:753-756,1995.oharaetal.,proc.natl.acad.sci.usa,86:5673-5677,1989.okamotoetal.,proc.nail.acad.sci.usa,91(23):11045-11049,1994.orlowetal,cancerres,54(11):2848-2851,1994.orlowetal.,int.j.oncol.,15(1):17-24,1994.palaniyaretal.,biochem.biophys,res.commun.,250(1):131-136,1998.palaniyaretal.,comp.biochem.physiol.amol.integr.physiol.,129(1):109-127,2001.panteletal.,proc.annumt.am.soc.clin.oncol.,12:a941,1993.papadimitrakopoulouetal.,cancerandmetastasisreviews,15:53-76,1996.pauletal.,naturebiotechnol.,20:505-508,2002.pctappln.wo00/44914pctappln.wo01/36646pctappln.wo01/68836pctappln.wo88/10315pctappln.wo89/06700pctappln.wo90/07641pctappln.wo99/32619pctpubln.pct/us87/00880pctpubln.pct/us89/01025peaseetal.,proc.natl.acad.sci.usa,91:5022-5026,1994.penceetal.,archivesofsurgery,128(12):1382-1390,1993.pérez-giletal.,biochim.biophys.acta.,1408(2-3):203-217,1998.piergaetal.,clin.cancerres.,10:1392-1400,2004.pietrasetal.,oncogene,17(17):2235-2249,1998.pignonetal.,hum.mutat.,3:126-132,1994.qinetal.,proc.natl.acad.sci.usa,95(24):14411-14416,1998.ramaswamyetal.,nat.genet,33:49-54,2003.rasmussenetal.,anal,biochem,198:138-142,1991.ravindranathandmorton,intern.rev.immunol.,7:303-329,1991.riceetal.,j.thoraciccardio.surgery,106(2):201-217,1993.rosenbergetal.,ann.surg.210(4):474-548,1989.rosenbergetal.,n.engl.j.med.,319:1676,1988.runningetal.,biotechniques8:276-277,1990.sahinetal.,cancer,65(3):530-7,1990.saikietal.,j.biochem.,116(6):1208-1211,1994.sambrooketal.,in:molecularcloning:alaboratorymanual,2nded.,coldspringharborlaboratorypress,coldspringharbor,ny,1989.serranoetal.,nature,366:704-707,1993.serranoetal.,science,267(5195):249252,1995.sharpandzamore,science,287:2431-2433,2000.sharp,genesdev.,13:139-141,1999.sheretal.,clin.cancerres.,11:173-179,2005.shissekietal.,geneschromosomescancer,17(2):71-7,1996.shoemakeretal.,naturegenetics,14:450-456,1996.shriveretal.,mutat.res.406(1):9-23,1998.sieuwertsetal.,j.natl.cancerinst.,101:61-66,2009.slaughteretal.,cancer,6:963-968,1953.smerhovskyetal.,environ.healthperspect.,109:41-45,2001.solomonetal.,science,254:1153-1160,1991.steweniusetal.,proc.natl.acad.sci.usa,102(15):5541-5546,2005.suietal.,proc.natl.acad.sci.usa,99(8):5515-5520,2002.swennenhuisetal.,cytometrya,75(6):520-7,2009.tabaraetal.,cell,99(2):123-132,1999.thibervilleetal.,cancerresearch,55:5133-5139,1995a.thibervilleetal.,int,j.cancer,64:371,1995b.travisetal.,cancer,75:191-202,1995.tsujimotoandcroce,proc.natl.acad.sci.usa,83(14):5214-5218,1986.tsujimotoetal.,nature,315:340-343,1985.tsujimotoetal.,science,228(4706):1440-1443,1985.tuckerandpreston,mutat.res.,365:147-159,1996.umegakietal.,mutagenesis,15:261-269,2000.valdiviesoetal.,proc.annu.mt.am.soc.clin.oncol.,13:a1121,1994.vallmeretal.,hum.pathol.,16:247-252,1985.volmetal.,versicherungsmedizin,41(1):2-5,1989.voravud,etal.,cancerresearch,53:2874-2883,1993.walkeretal.,nucleicacidsres.,20(7):1691-1696,1992.wincottetal.,nucleicacidsres.,23(14):2677-2684,1995.wistubaetal.,cancerres.,60(7):1949-60,2000.wuetal.,anal.chem.,70:456a,1998.wuetal.,cancerres.,58(8):1605-8,1998.wuetal.,j,thoraconcol.,4:30-36,2009.yamaokaetal.,j.japansurgicaksoc.,91(10):1608-1616,1990.yanagisawaetal.,cancerresearch,56:5579-5582,1996.yendamurietal.,j.thoraconcol.,3:979-984,2008.yuetal.,j.am.chem.soc.,124(23):6576-6583,2002.zouetal.,clinicalcancerresearch4:1345-1355,1998.當前第1頁12
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1