發芽處理植物種子的制造方法、發芽誘導用原料種子的制造方法、發芽處理植物種子的萃取組合物以及篩選方法與流程
本發明涉及發芽處理植物種子的制造方法、發芽誘導用原料種子的制造方法、發芽處理植物種子的萃取組合物以及篩選方法。
背景技術:
已知植物在代謝時,會生成能夠用于醫藥品或健康食品的植物化學成分等有用的化合物。此外,因為植物的代謝依賴于植物的生長環境,所以能夠想到通過改變與植物的生長有關的環境因素,由植物代謝產生的化合物的種類或量會變化。于是,從以往就進行如下的研究:改變與植物的生長有關的環境因素,使植物產生植物化學成分等有用的化合物。
作為植物化學成分,已知有例如多酚,在專利文獻1中,公開有如下的發芽處理植物種子的制造方法:通過將植物種子保持在2000ppm以上的二氧化碳濃度以及/或者18體積%以下的氧濃度的氣氛條件下,并且保持在發芽溫度內的條件下,水溶性多酚的量會增加。
現有技術文獻
專利文獻
專利文獻1:日本國特開2008-125515號公報
技術實現要素:
發明要解決的技術問題
然而,雖然已知植物抗毒素是通常的植物不會產生的二次代謝產物,對于生物功能具有有效性,但是根據專利文獻1的發芽處理植物種子的制造方法,僅能增加水溶性的多酚,難以制造足量的植物抗毒素。
本發明鑒于以上的實際情況而提出,目的在于提供適于產生大量的植物抗毒素的新的發芽處理植物種子的制造方法、用于制造這樣的發芽處理植物種子的發芽誘導用原料種子的制造方法、發芽處理植物種子的萃取組合物以及用于產生目標物質的候補植物種子的篩選方法。
用于解決上述技術問題的手段
本發明人發現對植物種子進行控制發芽環境的前處理,并且之后通過將微生物即病原體接種在植物種子上,發芽處理植物種子能夠大量地產生植物抗毒素,從而完成了本發明。更具體而言,本發明提供以下內容。
(1)一種發芽誘導用原料種子的制造方法,具有前處理工序,所述前處理工序在400ppm以上的二氧化碳濃度以及/或者19體積%以下的氧濃度的氣氛條件下,將植物種子連續地保持5小時以上。
(2)如(1)所述的發芽誘導用原料種子的制造方法,所述保持5小時以上并非是通過對所述植物種子進行浸泡來保持。
(3)如(1)或(2)所述的發芽誘導用原料種子的制造方法,所述前處理工序進行2次以上的所述保持5小時以上以及結束該保持的組合。
(4)一種發芽誘導用原料種子的制造方法,具有前處理工序,前處理工序對植物種子進行處理,使前處理工序后的植物種子中的植物化學成分的質量變為前處理工序前的植物種子的植物化學成分的質量的2倍以上100倍以下。
(5)如(4)所述的發芽誘導用原料種子的制造方法,所述前處理工序對植物種子進行處理,使前處理工序后的植物種子中的植物化學成分整體的質量變為前處理工序前的植物種子的植物化學成分整體的質量的2倍以上100倍以下。
(6)如(1)~(5)中的任一項所述的發芽誘導用原料種子的制造方法,進行所述前處理工序,使所述前處理工序后的所述植物種子中的谷氨酸的質量變為所述前處理工序前的所述植物種子的谷氨酸的質量的2.5倍以上。
(7)一種發芽誘導用原料種子的制造方法,具有前處理工序,前處理工序對植物種子進行處理,使前處理工序后的植物種子中的植物化學成分的質量變為前處理工序前的植物種子的植物化學成分的質量的2倍以上,
進行所述前處理工序,使所述前處理工序后的所述植物種子中的谷氨酸的質量變為所述前處理工序前的所述植物種子的谷氨酸的質量的2.5倍以上。
(8)如(1)~(7)中的任一項所述的發芽誘導用原料種子的制造方法,前處理工序前的所述植物種子的植物化學成分的含量為0.1mg/g以上。
(9)如(8)所述的發芽誘導用原料種子的制造方法,所述植物種子為葡萄科、豆科、茄科、唇形科或者十字花科的植物種子。
(10)一種發芽處理植物種子的制造方法,具有發芽誘導工序,將微生物即病原體接種在如(1)~(9)中的任一項所述的發芽誘導用原料種子上,將所述發芽誘導用原料種子放置在能夠誘導發芽且所述病原體能夠生長的環境下。
(11)如(10)所述的發芽處理植物種子的制造方法,所述病原體為食用微生物。
(12)一種發芽處理植物種子的萃取組合物,由(10)或(11)所述的方法制造。
(13)一種篩選方法,篩選用于產生目標物質的候補植物種子,具有:
前處理工序,在400ppm以上的二氧化碳濃度以及/或者19體積%以下的氧濃度的氣氛條件下,將被試驗植物種子連續地保持5小時以上;
發芽誘導工序,在所述前處理工序后,將微生物即病原體接種在所述被試驗植物種子上,將所述被試驗植物種子放置在能夠誘導發芽且所述病原體能夠生長的環境下;
檢測工序,對所述發芽誘導工序后的所述被試驗植物種子中的目標物質進行檢測;
選擇工序,基于所述檢測結果,選擇用于產生目標物質的候補植物種子。
(14)如(13)所述的篩選方法,所述保持5小時以上并非是通過對所述被試驗植物種子進行浸泡來保持。
(15)如(13)或(14)所述的篩選方法,所述前處理工序進行2次以上的所述保持5小時以上以及結束該保持的組合。
(16)一種篩選方法,篩選用于產生目標物質的候補植物種子,具有:
前處理工序,前處理工序對被試驗植物種子進行處理,使前處理工序后的被試驗植物種子中的植物化學成分的質量變為前處理工序前的被試驗植物種子的植物化學成分的質量的2倍以上100倍以下;
發芽誘導工序,在所述前處理工序后,將微生物即病原體接種在所述被試驗植物種子上,將所述被試驗植物種子放置在能夠誘導發芽且所述病原體能夠生長的環境下;
檢測工序,對所述發芽誘導工序后的所述被試驗植物種子中的目標物質進行檢測;
選擇工序,基于所述檢測結果,選擇用于產生目標物質的候補植物種子。
(17)如(16)所述的篩選方法,所述前處理工序對被試驗植物種子進行處理,使前處理工序后的被試驗植物種子中的植物化學成分整體的質量變為前處理工序前的被試驗植物種子的植物化學成分整體的質量的2倍以上100倍以下。
(18)如(13)~(17)中的任一項所述的篩選方法,進行所述前處理工序,使所述前處理工序后的所述被試驗植物種子中的谷氨酸的質量變為所述前處理工序前的所述被試驗植物種子的谷氨酸的質量的2.5倍以上。
(19)一種篩選方法,篩選用于產生目標物質的候補植物種子,具有:
前處理工序,前處理工序對被試驗植物種子進行處理,使前處理工序后的被試驗植物種子中的植物化學成分的質量變為前處理工序前的被試驗植物種子的植物化學成分的質量的2倍以上;
發芽誘導工序,在所述前處理工序后,將微生物即病原體接種在所述被試驗植物種子上,將所述被試驗植物種子放置在能夠誘導發芽且所述病原體能夠生長的環境下;
檢測工序,對所述發芽誘導工序后的所述被試驗植物種子中的目標物質進行檢測;
選擇工序,基于所述檢測結果,選擇用于產生目標物質的候補植物種子,
進行所述前處理工序,使所述前處理工序后的所述被試驗植物種子中的谷氨酸的質量變為所述前處理工序前的所述被試驗植物種子的谷氨酸的質量的2.5倍以上。
發明效果
根據本發明,能夠提供適于產生大量的植物抗毒素的新的發芽處理植物種子的制造方法、用于制造這樣的發芽處理植物種子的發芽誘導用原料種子的制造方法、發芽處理植物種子的萃取組合物以及用于產生目標物質的候補植物種子的篩選方法。
附圖說明
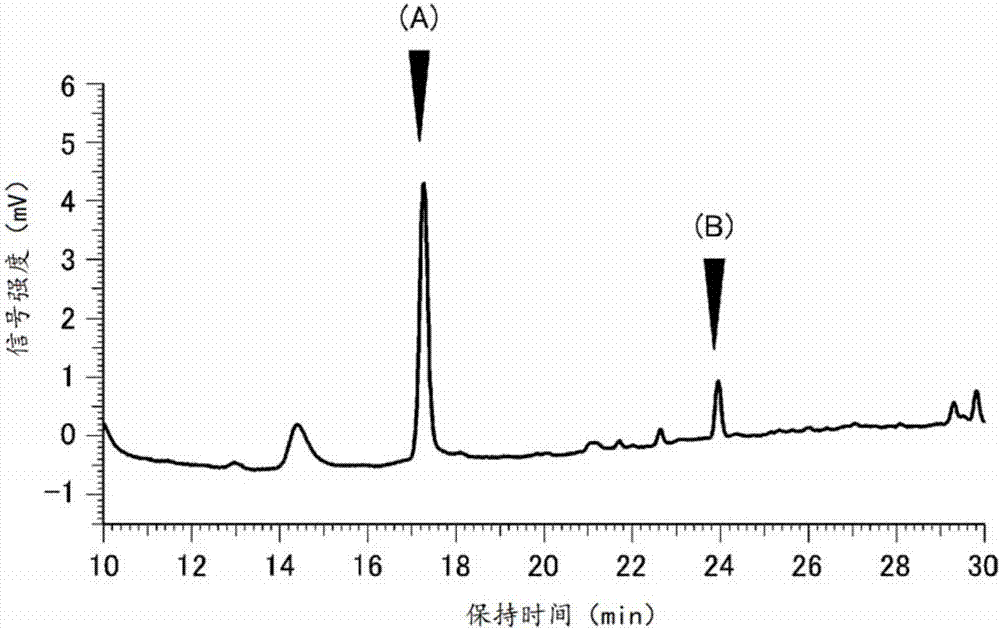
圖1a是示出根據高效液相色譜法對比較例1的葡萄種子的萃取組合物的分析結果的圖,圖1b是示出根據高效液相色譜法對實施例1的發芽處理植物種子的萃取組合物的分析結果的圖。
圖2a是示出根據高效液相色譜法對比較例2的紅車軸草種子的萃取組合物的分析結果的圖,圖2b是示出根據高效液相色譜法對實施例2的發芽處理植物種子的萃取組合物的分析結果的圖,圖2c是示出根據高效液相色譜法對實施例3的發芽處理植物種子的萃取組合物的分析結果的圖。
圖3a是示出根據高效液相色譜法對比較例3的番茄種子的萃取組合物的分析結果的圖,圖3b是示出根據高效液相色譜法對實施例4的發芽誘導用原料種子的萃取組合物的分析結果的圖。
圖4是示出實施例5~7的發芽誘導用原料種子、比較例4~9的大豆萃取組合物中的植物化學成分即異黃酮的量的圖表的圖。
圖5a是示出比較例4~6的大豆萃取組合物中的植物化學成分即各種異黃酮的量的圖表的圖。圖5b是示出比較例7~9的大豆萃取組合物中的植物化學成分即各種異黃酮的量的圖表的圖。圖5c是示出實施例5~7的發芽誘導用原料種子的萃取組合物中的植物化學成分即各種異黃酮的量的圖表的圖。
圖6是示出實施例8~10的發芽處理植物種子、比較例10的種子的萃取組合物中的植物抗毒素即大豆抗毒素的量的圖表的圖。
圖7是示出實施例9的發芽處理植物種子,從接種曲霉菌后時間經過(0~4天)與大豆抗毒素i~v的增加比例之間的關系的圖表的圖。
圖8是示出實施例11的發芽誘導用原料種子、比較例11、12的種子的萃取組合物中的氨基酸的量的圖表的圖。
具體實施方式
以下,雖然對本發明的具體實施方式進行詳細地說明,但是本發明并不受以下任何實施方式的限定,在本發明目的的范圍內,能夠增加適當變更實施。
<發芽誘導用原料種子的制造方法>
本發明的發芽誘導用原料種子的制造方法,具有將植物種子在400ppm以上的二氧化碳濃度以及/或者19體積%以下的氧濃度的氣氛條件下,連續地保持5小時以上的前處理工序,或者具有使前處理工序后的植物種子中的植物化學成分的質量,變為前處理工序前的植物種子的植物化學成分的質量的2倍以上的、對植物種子進行處理的前處理工序。
(前處理工序)
本發明的發芽誘導用原料種子的制造方法中的前處理工序是:將植物種子在400ppm以上的二氧化碳濃度以及/或者19體積%以下的氧濃度的氣氛條件下,連續地保持5小時以上;或者,對植物種子進行處理,使前處理工序后的植物種子中的植物化學成分的質量,變為前處理工序前的植物種子的植物化學成分的質量的2倍以上。在本發明中,“發芽誘導用原料種子”是指主要作為后述的發芽處理植物種子的制造原料而使用的種子,植物化學成分的量通過前處理工序而增加了的種子。
在本發明中,“前處理”是指,在后述的發芽處理植物種子的制造方法中的發芽誘導工序的前階段進行的處理,是進行使種子中的植物化學成分的量增加的處理的工序。像這樣地,通過植物化學成分的量增加,制造的發芽誘導用原料種子,通過后述的發芽誘導用原料種子的制造方法中的發芽誘導工序,能夠大量地產生植物抗毒素。另外,雖然是在后述的發芽處理植物種子的制造方法中進行發芽誘導,但是也可以在本發明的“前處理”中進行發芽誘導。
此外,通過本發明中的前處理工序,也能夠增加植物種子的氨基酸或糖等的產生量。推測其理由是,植物種子在發芽不久后異養,需要用于成長為能夠進行光合作用的自養體的營養素,植物種子將為了成長為自養體而儲藏在種子內的蛋白質分解為氨基酸作為氮源,將儲藏的淀粉分解為糖作為碳源。由此,通過在植物種子內較多地產生氨基酸或糖,在后述的發芽處理植物種子的制造方法中,植物抗毒素的產生量會變多。
前處理能夠通過以下方法來進行,在400ppm以上的二氧化碳濃度以及/或者19體積%以下的氧濃度的氣氛條件下,將植物種子連續地保持5小時以上。雖然在上述的專利文獻1的方法中,也對二氧化碳濃度以及/或者氧濃度進行控制,但是保持是間歇性的,連續的保持時間較短,因此僅水溶性多酚的量會增加。而在本發明中,通過使植物種子在上述環境下的保持時間長達5小時以上,能夠顯著地增加種子中的植物化學成分的量。
二氧化碳濃度以及/或者氧濃度的連續保持時間,只要是5小時以上就沒有特別地限定,但是從種子中的植物化學成分的產生量容易增加的方面考慮,優選是6小時以上,更優選是6.5小時以上,進一步優選是7小時以上,進而優選是8小時以上,更為優選的是10小時以上,最優選是12小時以上。另一方面,若保持時間過長,則植物化學成分的量變得過多,在后述的發芽處理植物種子的制造方法中,微生物即病原體變得難以對抗植物化學成分,結果是植物抗毒素的產生量變少。因此,保持時間優選是72小時以下,更優選是48小時以下,進一步優選是36小時以下。
雖然沒有特別地限定二氧化碳濃度,但是從種子中的植物化學成分的產生量容易增加的方面考慮,優選是2000ppm以上,更優選是5000ppm以上,進一步優選是10000ppm以上,最優選是20000ppm以上。此外,雖然沒有特別地限定二氧化碳濃度的上限,但是若二氧化碳濃度變得過高,結果是氧濃度變少,植物種子會厭氧呼吸,種子的植物化學成分的產生量會變少,因此優選是100000ppm以下,更優選是75000ppm以下,進一步優選是50000ppm以下,最優選35000ppm以下。
雖然沒有特別地限定氧濃度,但是從種子中的植物化學成分的產生量容易增加的方面考慮,優選是18體積%以下,更優選是15%以下,進一步優選是12體積%以下,最優選是9體積%以下。此外,雖然沒有特別地限定氧的下限,但是若氧濃度過低,植物種子會厭氧呼吸,種子的植物化學成分的產生量會變少,因此優選是3體積%以上,更優選是4體積%以上,進一步優選是6體積%以上,最優選7體積%以上。
雖然沒有特別地限定二氧化碳濃度、氧濃度的保持,但是例如通過將植物種子堆積在密閉或者一部分密閉的容器內,能夠使種子周圍的氧濃度減少,二氧化碳濃度上升。因此,通過保持這樣的狀態,能夠將二氧化碳濃度、氧濃度保持在期望的氣氛條件下。為了結束該保持,例如可以通過打開密閉狀態進行,或者也能夠通過噴水進行。此外,能夠通過容器的密閉程度或種子的堆積程度,調整保持的二氧化碳濃度、氧濃度。
在本發明中,暫時結束上述保持之后,也可以再次將植物種子在400ppm以上的二氧化碳濃度以及/或者19體積%以下的氧濃度的氣氛條件下,連續地保持5小時以上。在本發明中,雖然沒有特別地限定進行保持與結束保持的次數,例如可以是1次以上(2次以上、3次以上、4次以上、5次以上、6次以上、8次以上、9次以上等),也可以是10次以下(9次以下、8次以下、7次以下、6次以下、5次以下、4次以下、3次以下、2次以下等),但優選是進行1~10次,更優選是進行2~8次,進一步優選是進行4~6次。
在本發明中,二氧化碳濃度、氧濃度是在gastec檢測管/指示精度:cv=5%(cv:變動系數=σ:標準偏差÷平均值×100)的條件下測量的。
本發明中的植物種子,優選是使用能夠發芽的種子。能夠發芽的種子是指非休眠狀態的種子。但是,在使用休眠狀態的種子的情況下,在前處理工序之前,使休眠狀態的種子經加熱、水等解除休眠狀態之后變為能夠發芽的狀態,從而能夠在前處理工序中使用該種子。
在本發明中,使種子中的植物化學成分量增加的前處理工序,雖然能夠通過將植物種子在400ppm以上的二氧化碳濃度以及/或者19體積%以下的氧濃度的氣氛條件下,連續地保持5小時以上來進行,但是前處理并不限定于此,只要是對植物種子進行處理,使前處理工序后的植物種子中的植物化學成分的質量變為前處理工序前的植物種子的植物化學成分的質量的例如2倍以上的方法,就可以是任何方法。另外,可以進行至少使1種以上的植物化學成分的質量變為2倍以上的處理,也可以進行植物化學成分整體的質量變為2倍以上的處理。
對使植物化學成分的質量變為2倍以上的植物處理,雖然沒有特別地限定,但是除了調整并保持上述的二氧化碳濃度以及/或者氧濃度的氣氛條件的方法之外,也能夠通過單獨地或者組合地控制種子周圍的溫度、水、光、植物激素、種子中的ph、離子濃度、微生物、微生物信號等的、與種子發芽有關的環境因素來進行植物處理。此外,也能夠通過組合對這些環境因素的控制與對二氧化碳濃度以及/或者氧濃度的控制來進行。
溫度雖然沒有特別地限定,但是例如能夠在10~45℃下進行。但是從種子中的植物化學成分的量容易增加的方面考慮,優選是15~40℃,更優選是20~35℃,進一步優選是25~35℃。此外,雖然能夠通過以往已知的任何方法來進行溫度的調整,但是也能夠通過例如能夠調節溫度的恒溫箱、能夠調整室溫的栽培室、加熱器、冷卻裝置、空氣控制裝置、噴水等進行溫度的調整。雖然沒有特別地限定在期望的條件下保持溫度的時間,但是能夠根據例如二氧化碳濃度等的其他環境因素適當地設定該時間。
對水的控制例如能夠通過噴水進行。雖然在本發明中沒有特別地限定,但是能夠通過例如將水吹出至種子上,或在種子上加水這樣的不對植物種子進行浸泡來進行噴水的操作,此外也能夠通過將種子浸泡在水中來進行。此外,在本發明中,通過對水的控制,能夠調整種子周圍的濕度、溫度、二氧化碳濃度、氧等,由此能夠使種子中的植物化學成分量增加。對水的控制能夠根據濕度、溫度、二氧化碳濃度、氧等,適當地設定其保持時間或噴水等的次數。
雖然水中可以含有例如10ppm以上的殺菌劑,但是在前處理中使用微生物的情況下,因在后述的發芽處理植物種子的制造方法中,可能會妨礙菌的生長,所以優選是不過多地使用殺菌劑。在該情況下,殺菌劑的濃度優選是9ppm以下,更優選是小于8ppm,進一步優選是小于5ppm。能夠使用以往的公知的殺菌劑,例如能夠列舉次氯酸鈉等。
雖然沒有特別地限定,但是能夠通過例如照射光強度為5~1000μmol/m2/天的光進行光的控制。此外,光的照射時間雖然沒有特別地限定,但是優選是0.5~24小時/天,更優選是6~12小時/天。光的照射能夠使用熒光燈等的以往的公知手段。
雖然沒有特別地限定,但是能夠通過例如乙烯氣體(c2h4)、赤霉素等進行對植物激素的控制。控制的植物激素能夠列舉例如生長素、赤霉素、細胞分裂素、脫落酸、乙烯、油菜素甾醇、茉莉酸類、促花素、獨腳金內酯等。
雖然沒有特別地限定,但是能夠通過例如將ph控制為2.3~9.0進行ph的控制。控制ph的方法,能夠使用以往的公知手段。
雖然沒有特別地限定,但是能夠通過例如將噴在種子上的水中的離子(例如k+、mg2+、ca2+、na+等)調整為0.001ppm~100ppm進行對離子濃度的控制。
雖然沒有特別地限定,但是能夠通過控制例如曲霉菌等的微生物,或者β葡聚糖等的微生物信號,來進行對微生物或者微生物信號的控制。
通過前處理而增加的植物化學成分的量,大多是在后述的發芽處理植物種子的制造方法中,通過與病原體的相互作用,容易產生大量的植物抗毒素。因此,優選是對植物種子進行處理以使前處理工序后的植物種子中的植物化學成分的質量變為前處理工序前的植物種子的植物化學成分的質量的5倍以上;更優選變為10倍以上;進一步優選變為20倍以上。另一方面,若植物化學成分過多,則在后述的發芽處理植物種子的制造方法中,病原體容易死亡,難以大量地產生植物化學成分。因此,優選是對植物種子進行處理以使前處理工序后的植物種子中的植物化學成分的質量變為前處理工序前的植物種子的植物化學成分的質量的100倍以下;更優選變為80倍以下;進一步優選變為60倍以下。
在本發明中,使用的植物種子的種類沒有特別地限定,例如能夠列舉葡萄科(赤霞珠、黑皮諾等)、豆科(大豆、紅車軸草等)、茄科(番茄(紅洋梨等)等)、菊科、十字花科、唇形科、枳科、薔薇科、銀杏科、禾木科、桑科、蓼科、山茶科、木犀科、冬青科、葫蘆科、石榴科的種子等,更具體地能夠列舉葡萄、向日葵、赤霞珠、車軸草、蕓苔、芝麻、白蘇、胡麻、紫蘇、花生、米、蕎麥、玉米、小麥、野生稻、大麥、粟、稗草、葫蘆巴、迷迭香、百里香、鼠尾草、薄荷、美國紅櫻桃、杏、杏仁、葡萄柚、柑橘、李子、金絲桃、番茄、草莓、胡蘿卜、青椒、山竹、芒果、枇杷、牛蒡、可可等。植物種子的植物化學成分含量較多,在后述的發芽處理植物種子的制造方法中,植物抗毒素的產生量會變多,所以優選是使用植物化學成分含量較多的植物種子。按照該觀點,作為前處理前的植物種子優選是使用植物化學成分含量為1mg/g以上的植物種子,更優選是使用植物化學成分含量為2mg/g以上的植物種子,進一步優選是使用植物化學成分含量為4mg/g以上的植物種子,最優選是使用植物化學成分含量為8mg/g以上的植物種子。更具體地,作為植物種子,因為其中的葡萄科、豆科、茄科、唇形科、十字花科的種子,種子粒較大,植物化學成分的含量較高,所以優選,此外,從能夠比較便宜地獲得的觀點來看,也優選。特別是因為能夠使用葡萄、番茄的種子在制造葡萄酒或番茄汁等時產生的殘渣,所以從有效利用未利用資源的觀點來看,也優選。
本發明中的“植物化學成分”是指,至少1種以上的植物化學成分。作為植物化學成分,只要是以往公知的植物化學成分即可,沒有特別地限定,例如能夠列舉異黃酮等的多酚、番茄紅素等的萜類、辣椒素等的長鏈烷基苯酚衍生物、皂苷等的與糖相關的化合物、蘿卜硫素等的有機硫化合物。因為在發芽處理植物種子的制造方法中,植物抗毒素的產生量變多,所以優選是在這些植物化學成分之中,通過本發明的前處理,增加異黃酮的量。另外,本發明中的“異黃酮”是指,以異黃酮為基本骨架的黃酮類化合物中的異黃酮類。此外,在本發明中,植物化學成分也能夠是植物抗毒素。
在本發明中,種子中的植物化學成分的質量通過高效液相色譜法來測量。
通過本發明中的前處理工序,種子能夠產生氨基酸或糖等的后述的微生物即病原體的營養素。通過較多地生成該氨基酸或糖,能夠在后述的發芽處理植物種子的制造方法中,大量地產生營養素。氨基酸沒有特別地限定,只要是植物的營養素就沒有特別地限定。特別是在氨基酸之中,谷氨酸的量通過前處理工序,優選是在前處理后質量比增加2.5倍以上(3倍以上、3.5倍以上等)。此外,糖的量優選是相對于前處理前增加2.5倍以上。由此,通過使氨基酸或糖的含量增加,在后述的發芽處理植物種子的制造方法中,微生物即病原體難以死亡,因此通過前處理能夠更大量地增加植物化學成分。例如,在氨基酸即谷氨酸的量相對于前處理前變為2.5倍以上的含量的情況下,能夠使植物化學成分的含量相對于前處理前增加到30倍以下(25倍以下、20倍以下等)。
在本發明中,通過uhplc測量氨基酸。此外,通過hplc測量糖。
<發芽處理植物種子的制造方法>
本發明的發芽處理植物種子的制造方法,具有發芽誘導工序,將微生物即病原體接種在上述發芽誘導用原料種子上,將發芽誘導用原料種子放置在能夠誘導發芽且病原體能夠生長的環境下。
(發芽誘導工序)
本發明的發芽處理植物種子的制造方法中的發芽誘導工序是將發芽誘導用原料種子放置在能夠誘導發芽且病原體能夠生長的環境下的工序。本發明通過該工序,能夠制造發芽處理植物種子,所述發芽處理植物種子能夠產生大量的植物抗毒素。
雖然以往已知有通過使用病原體制作發芽處理植物種子,產生異黃酮類等的植物抗毒素的方法(參考simonsr,vinckenjp,roidosn,boveetf,vanierselm,verbruggenma,gruppenh.通過真菌同時發芽和刺激來增加大豆異黃酮的含量與多樣性以調節雌激素.j.agric.foodchem.,2011,59(12)第6748-6758頁),但是根據以往的方法,因為與病原體接種之后的期間長達9天,所以存在費用或細菌管理等的問題,并不實用。但是根據本發明,接種微生物后,經較短期間(例如,1~5天)而無需9天的時間,就能夠產生大量的植物抗毒素。
實施了本發明中的前處理的上述發芽誘導用原料種子,植物化學成分的量較多,該植物化學成分變為植物抗毒素的原料。因為該植物化學成分較多,所以即便接種微生物即病原體,也難以腐爛,結果是能夠長時間地產生植物抗毒素,因此能夠產生大量的植物抗毒素。
如上所述,通過本發明中的前處理能夠在種子中大量地產生營養素即氨基酸或糖。病原體通過該營養素,能夠對抗植物化學成分,因此在接種病原體后,病原體在植物化學成分的量較多的狀態下,能夠較長地生長。而且,推測在那時將前處理后的發芽誘導用原料種子放置在能夠發芽的條件下,由此在病原體與前處理后的發芽誘導用原料種子間產生相互刺激,結果是能夠有效地在種子中產生植物抗毒素。
接種病原體后,放置在上述環境下的時間,沒有特別地限定,雖然例如也可以是6小時~7天等,但是放置時間過長,則植物可能會容易腐爛,因此放置時間優選是5天以下,更優選是4天以下。但是,如上所述,因為在種子中的氨基酸或糖的量變多的情況下,病原體能夠更久地生長,所以接種病原體后,能夠將發芽誘導用原料種子更長時間地放置在上述環境下。接種病原體后,也可以根據接種前的種子中的植物抗毒素的量增加多少程度為基準決定放置在上述環境下的時間,例如也可以放置在上述環境下,直至接種前的種子中的植物抗毒素的質量變為1mg/g以上(5mg/g以上、10mg/g以上、15mg/g以上、20mg/g以上、25mg/g以上、30mg/g以上等)。另外,在該情況下,也可以放置在上述環境下,以使至少1種以上的植物抗毒素的質量變為1mg/g以上等,也可以放置在上述環境下,以使植物抗毒素整體的質量變為1mg/g以上等。
在本發明中,通過四級桿質量分析器lc/ms/ms測量種子中的植物抗毒素的質量。
lc的條件如下。
色譜柱:aqcuityuplcbehshieldrp18柱(1.7μm,2.1mm.×150mm),aqcuityuplcbehshieldrp18vanguard保護柱(1.7μm,2.1mm.×5mm)。
本發明中的植物抗毒素是指,至少1種以上的植物抗毒素。能夠產生的植物抗毒素因種子的種類而不同,例如在使用葡萄種子的情況下,能夠產生白藜蘆醇苷或白藜蘆醇等的二苯乙烯,在使用大豆的情況下,能夠產生各種的大豆抗毒素(大豆抗毒素i、大豆抗毒素ii、大豆抗毒素iii、大豆抗毒素iv等)。
在本發明中,“病原體”是指一般被稱為植物的病原體,在本發明中,為了用于在種子中產生植物抗毒素。本發明中的病原體,只要是微生物就沒有特別地限定,本領域的技術人員能夠根據植物種子的種類選擇適當的病原體。其中,病原體優選是食用微生物。食用微生物沒有特別地限定,能夠列舉例如坦培桿菌(根霉屬菌、tempebacillus)、曲霉菌、納豆菌、酵母菌、乳酸菌、蕈菌等。其中優選是坦培桿菌、曲霉菌、納豆菌、酵母菌、乳酸菌,更優選是坦培桿菌、曲霉菌、酵母菌、乳酸菌。
在本發明中,能夠通過以往公知的方法進行病原體的接種。
在本發明中,使發芽誘導用原料種子能夠誘導發芽且能夠使病原體生長的環境下,沒有特別地限定,能夠根據種子或病原體適當設定。
例如,雖然也可以是在與上述的前處理工序中相同的條件下,但是需要在這樣的條件之中,選擇能夠誘導發芽且病原體能夠生長的條件。能夠誘導發芽的環境是指,雖然能夠列舉例如二氧化碳濃度300~120000ppm,氧濃度為5~20體積%,溫度為10~45℃等的環境,但是在這樣的環境之中,考慮病原體所需二氧化碳濃度、氧濃度、溫度而設定環境。例如,在病原體為厭氧性微生物的情況下,優選氧濃度較低,在病原體為需氧性微生物的情況下,優選氧濃度較高。
<萃取組合物>
本發明的萃取組合物是上述發芽誘導用原料種子的萃取組合物。
本發明中的萃取組合物的調配沒有特別地限定,能夠使用以往公知的方法,例如在將發芽誘導用原料放入容器的狀態下,通過加入水或有機溶劑(乙醇等)并粉碎來進行。此外,也可以具有進一步提純、分離植物抗毒素那樣的有用物質的工序。
本發明中的萃取組合物的用途沒有特別地限定,因為在本發明的萃取組合物中含有植物抗毒素等的有用的化合物,所以在這樣的情況下,優選是將萃取組合物制劑化,用于健康食品、醫藥品等。
<篩選方法>
本發明的篩選方法是用于產生目標物質的候補植物種子的篩選方法,具有:前處理工序,將被試驗植物種子在400ppm以上的二氧化碳濃度以及/或者19體積%以下的氧濃度的氣氛條件下,連續地保持5小時以上,或者對被試驗植物種子進行處理,使前處理工序后的被試驗植物種子中的植物化學成分的質量,變為前處理工序前的被試驗植物種子的植物化學成分的質量的2倍以上;發芽誘導工序,在前處理工序后,將微生物即病原體接種在被試驗植物種子上,將發芽誘導用原料種子放置在能夠誘導發芽且能夠使病原體生長的環境下;檢測工序,對發芽誘導工序后的被試驗植物種子中的目標物質進行檢測;選擇工序,在能夠檢測的情況下,基于該檢測結果,選擇用于產生目標物質的候補植物種子。
雖然根據上述的發芽誘導用原料種子的制造方法以及發芽處理植物種子的制造方法,能夠獲得大量的植物抗毒素,但是得到的植物抗毒素因植物的種類而各式各樣。因此,在希望獲得特定種類的植物抗毒素等的有用的化合物的情況下,某植物種子能否生成期望的化合物,能夠通過利用上述的發芽誘導用原料種子的制造方法以及發芽處理植物種子的制造方法來確定。即,通過利用上述的發芽誘導用原料種子的制造方法以及發芽處理植物種子的制造方法,能夠篩選出能夠用于產生目標物質的候補植物種子。
在本發明中,沒有特別地限定目標物質,例如在本發明的篩選方法中,適于將植物抗毒素等的二次代謝產物作為目標物質。植物抗毒素的種類也沒有特別地限定,也可以是以往已知的任何種類的植物抗毒素。
(前處理工序)
本發明的篩選方法中的前處理工序,是將被試驗植物種子在400ppm以上的二氧化碳濃度以及/或者19體積%以下的氧濃度的氣氛條件下,連續地保持5小時以上的前處理工序,或者對被試驗植物種子進行處理,使前處理工序后的被試驗植物種子中的植物化學成分的質量變為前處理工序前的被試驗植物種子的植物化學成分的質量的2倍以上的前處理工序。所述前處理工序,能夠使用與上述的發芽誘導用原料種子的制造方法中的前處理工序相同的工序。
被試驗植物種子沒有特別地限定,能夠根據目的適當選擇,能夠使用以往公知的植物種子,特別地優選能夠發芽的種子等。
如上所述,種子通過本發明中的前處理工序,能夠生產氨基酸或糖等的微生物即病原體的營養素。因此,在前處理工序后,能夠大量地生成氨基酸或糖等的被試驗植物種子,適于在之后的發芽誘導工序中,產生植物抗毒素等的有用的化合物。因此,也可以在本發明的篩選方法中,具有在前處理工序后對被試驗植物種子中的氨基酸或糖的量進行測量、確認的工序。特別是優選在氨基酸之中,谷氨酸的量,通過前處理工序,在前處理后質量比增加為2.5倍以上(3倍以上、3.5倍以上等)。
(發芽誘導工序)
本發明的篩選方法中的發芽誘導工序,能夠使用與上述的發芽處理植物種子的制造方法中的發芽誘導工序相同的工序。
(檢測工序)
本發明的篩選方法中的檢測工序,是對發芽誘導工序后的被試驗植物種子中的目標物質進行檢測的工序。
檢測能夠使用以往公知的手段。例如,也可以壓碎被試驗植物種子而調配萃取組合物,通過高效液相色譜法進行檢測。
(選擇工序)
選擇工序是在上述的檢測工序后,在能夠檢測的情況下,基于該檢測結果,選擇用于產生目標物質的候補植物種子。
選擇方法沒有特別地限定,只要是通過以往公知的選擇方法對候補物質進行選擇即可。例如,也可以根據上述的檢測結果,確認產生了作為目標的目標物質,由此將被試驗植物種子選為候補植物種子。或者,也可以通過與其他的植物種子中的目標物質的量比較,來進行選擇。作為比較對象的具體例,可以是例如進行前處理工序以及發芽誘導工序前的同種的植物種子,也可以是實施了前處理工序、未實施發芽誘導工序的同種的植物種子,或者可以是已知產生目標物質的其他種類的植物種子,也可以是不產生目標物質的陰性對照的植物種子。
實施例
<使用葡萄種子的試驗>
(實施例1)
使用葡萄種子(品種:赤霞珠)制造發芽處理植物種子。首先,作為前處理,將葡萄種子(300g)容納在大致密閉的容器中,每8小時進行噴水(1分鐘注水后/1分鐘排水),持續6小時地保持平均氧濃度為12體積%、二氧化碳濃度為20000ppm的氣氛。合計進行21次噴水,合計進行7天的前處理工序。另外,水溫以及室溫的條件為28℃,噴水后的氣氛化是氧濃度為20體積%,二氧化碳濃度為300~390ppm。通過該前處理,制造實施例1的發芽誘導用原料種子。
將酵母菌(種名:saccharomycescerevisiae)接種在實施例1的前處理后的發芽誘導用原料種子上,之后進行發芽誘導。接種由加州葡萄酒酵母菌rp15啟動接種。接種后,一邊在氧濃度8體積%、二氧化碳濃度20000ppm、24℃的環境下進行發芽誘導,一邊使酵母菌生長6天。由此,進行實施例1的發芽處理植物種子的制造。
進行實施例1的發芽處理植物種子中的植物抗毒素即白藜蘆醇以及白藜蘆醇苷(piceid)的定量。首先,相對于實施例1的發芽處理植物種子的質量加入乙醇以及水,進行10倍稀釋,粉碎1秒鐘,并粉碎為0.5mm以下。量取15ml含有粉碎后的葡萄種子的溶液于離心管中,進行20分鐘的超音波處理,制作萃取組合物。之后,使用該萃取組合物,進行組合物中的化合物的分析。分析在以下的條件下進行。
色譜柱:aqcuityuplcbehshieldrp18柱(1.7μm,2.1mm.×150mm),aqcuityuplcbehshieldrp18vanguard保護柱(1.7μm,2.1mm.×5mm)/色譜柱溫度:35℃/水(0.1%醋酸)、acn(0.1%醋酸):0-10min15%,10-55min100%,55-60min100%,60-70min15%。
(比較例1)
準備與進行實施例1中的前處理以及發芽處理前的葡萄種子相同的種子,使用該種子,與實施例1同樣地制作萃取組合物,對組合物中的化合物進行分析。
(分析結果1)
圖1示出實施例1、比較例1各自的分析結果。圖1的(a)箭頭所示的峰示出白藜蘆醇苷,圖1的(b)箭頭所示的峰示出白藜蘆醇。如圖1所示,與比較例1的葡萄種子相比,能夠確認實施例1的發芽處理植物種子的白藜蘆醇苷、白藜蘆醇明顯較多。此外,比較例1的葡萄種子(前處理前的葡萄種子)中的植物化學成分量為10mg/g,而實施例1的發芽誘導用原料種子(前處理后的發芽誘導用原料種子)中的植物化學成分量為25mg/g。此外,實施例1的發芽處理植物種子中產生的植物抗毒素的量為10mg/g。
<使用紅車軸草種子的試驗>
(實施例2)
除了使用紅車軸草種子作為植物種子、進行2天的前處理以外,在與實施例1相同的條件下,制造發芽誘導用原料種子。
將曲霉菌(種名:aspergillusoryzae)接種在實施例2的前處理后的發芽誘導用原料種子上后,進行發芽誘導。通過種曲(秋田今野社)進行接種。接種后,一邊在氧濃度8體積%、二氧化碳濃度20000ppm、24℃的環境下進行誘導發芽,一邊使曲霉菌生長5天。由此,進行實施例2的發芽處理植物種子的制造。
對實施例2的發芽處理植物種子中的植物抗毒素即各種異黃酮進行分析。以與實施例1相同的順序進行萃取組合物的制備。分析在以下的條件下進行。
色譜柱:aqcuityuplcbehshieldrp18柱(1.7μm,2.1mm.×150mm),aqcuityuplcbehshieldrp18vanguard保護柱(1.7μm,2.1mm.×5mm)/色譜柱溫度:35℃/水(0.1%醋酸)、acn(0.1%醋酸):0-2min15-20%,2-5min25%,5-6min30%,6-8min40%,8-9min45%,9-10min45%,10-12min50%,12-22min100%,22-24min100%,24-25min15%,25-27min15%。
(實施例3)
除了進行4天的前處理以外,在與實施例2完全相同的條件下進行發芽誘導用原料種子的制造、發芽處理植物種子的制造以及異黃酮的定量。另外,前處理前的紅車軸草種子中的植物化學成分量為5mg/g,而前處理后的發芽誘導用原料種子中的植物化學成分的量為40mg/g。
(比較例2)
準備與進行實施例2中的前處理以及發芽處理前的紅車軸草種子相同的種子(比較例2的種子),使用該種子,與實施例2同樣地制備萃取組合物,對組合物中的化合物進行分析。
(分析結果2)
圖2示出實施例2、3、比較例3各自的分析結果。圖2中的(a)箭頭所示的峰示出三葉豆紫檀苷(trifolirhizin),圖2中的(b)箭頭所示的峰示出芒柄花黃素(formononetinglucosidemalonate),圖2中的(c)箭頭所示的峰示出鷹嘴豆芽素a(biochaninaglucosidemalonate)。此外,在下述表1中示出圖2中的三葉豆紫檀苷、芒柄花黃素以及鷹嘴豆芽素a各峰區域的面積比。
[表1]
如圖2、表1所示,能夠確認相對于未進行任何處理的比較例2的種子,在實施例2以及實施例3的發芽處理植物種子中,三葉豆紫檀苷、芒柄花黃素的量增加了。特別是能夠確認,在進行了4天的前處理的實施例3的發芽處理植物種子中,相對于比較例2的種子,三葉豆紫檀苷增加了11.80倍,芒柄花黃素增加了15.46倍,鷹嘴豆芽素a增加了35.90倍。另外,比較例2的紅車軸草種子(前處理前的紅車軸草種子)中的植物化學成分量為5mg/g,而實施例2的發芽誘導用原料種子(前處理后的發芽誘導用原料種子)中的植物化學成分量為20mg/g。此外,實施例3的發芽誘導用原料種子(前處理后的發芽誘導用原料種子)中的植物化學成分量為如上所述的40mg/g,實施例3的發芽處理植物種子中產生的植物抗毒素的量為30mg/g。
<使用番茄種子的試驗>
(實施例4)
除了使用番茄(品種:紅洋梨)種子作為植物種子以外,在與實施例1相同的條件下,制造發芽誘導用原料種子。
調配實施例4的發芽處理植物種子的萃取組合物,對植物化學成分進行分析。分析在以下的條件下進行。
分析儀器:日立高效液相色譜儀(hplc)/檢測器:uv檢測器/色譜柱:glsciencesods(6.0mml.d.×150mm)/色譜柱溫度:35℃/水(0.1%醋酸)、acn(0.1%醋酸):0-10min15%,10-55min100%,55-60min100%,60-7min15%。
(比較例3)
準備與進行實施例4中的前處理前的番茄種子相同的種子,使用該種子,與實施例4同樣地制備萃取組合物,在與實施例4相同的條件下進行組合物中的植物化學成分的分析。
(分析結果3)
圖3示出實施例4、比較例3各自的分析結果。如圖3所示,能夠確認植物化學成分發生了變化。具體而言,能夠確認在植物化學成分之中,特別是柚皮苷查爾酮增加了。在圖3中,(a)箭頭的峰示出柚皮苷查爾酮。此外,比較例3的番茄種子(前處理前的番茄種子)中的植物化學成分量為4mg/g,而實施例4的發芽誘導用原料種子中的植物化學成分量為16mg/g。
<使用大豆的試驗>
(實施例5)
除了使用大豆(品種:白大豆)種子作為植物種子,此外,營造保持時的氧濃度為10體積%,二氧化碳濃度為40000pm的氣氛,進行1天的前處理以外,在與實施例1相同的條件下進行前處理工序,制造發芽誘導用原料種子。
壓碎實施例5的發芽誘導用原料種子,調配萃取組合物,對植物化學成分異黃酮進行分析。分析在以下的條件下進行。
分析儀器:島津高效液相色譜儀(uhplc)/檢測器:光電二極管陣列檢測器/色譜柱:shim-packxr-odsiii(2.0mml.d.×150mm)/色譜柱溫度:35℃/水(0.1%醋酸)、acn(0.1%醋酸):0-2min15-20%,2-5min25%,5-6min30%,6-8min40%,8-9min45%,9-10min45%,10-12min50%,12-22min100%,22-24min100%,24-25min15%,25-27min15%。
(實施例6)
除了使用秋田綠大豆作為大豆的品種以外,在與實施例5相同的條件下,制造發芽誘導用原料種子。
壓碎實施例6的發芽誘導用原料種子,調配萃取組合物,在與實施例5相同的條件下進行植物化學成分異黃酮的分析。
(實施例7)
除了使用黑千石大豆作為大豆的品種以外,在與實施例5相同的條件下,制造發芽誘導用原料種子。
壓碎實施例7的發芽誘導用原料種子,調配萃取組合物,在與實施例5相同的條件下進行植物化學成分異黃酮的分析。
(比較例4)
準備與進行實施例5中的前處理前的大豆(品種:白大豆)相同的種子,使用該種子,與實施例5同樣地制備萃取組合物,在與實施例5相同的條件下進行組合物中的植物化學成分異黃酮的分析。
(比較例5)
準備與進行實施例6的前處理前的大豆(品種:秋田綠大豆)相同的種子,使用該種子,與實施例6同樣地制備萃取組合物,在與實施例5相同的條件下進行組合物中的植物化學成分異黃酮的分析。
(比較例6)
準備與進行實施例7中的前處理前的大豆(品種:黑千石大豆)相同的種子,使用該種子,與實施例7同樣地制備萃取組合物,在與實施例5相同的條件下進行組合物中的植物化學成分異黃酮的分析。
(比較例7)
除了將實施例5中保持時的氧濃度設為20體積%,二氧化碳濃度設為390ppm以外,通過與實施例5相同的條件,制備萃取組合物,在與實施例5相同的條件下進行組合物中的植物化學成分異黃酮的分析。
(比較例8)
除了將實施例6中保持時的氧濃度設為20體積%,二氧化碳濃度設為390ppm以外,通過與實施例6相同的條件,制備萃取組合物,在與實施例5相同的條件下進行組合物中的植物化學成分異黃酮的分析。
(比較例9)
除了將實施例7中保持時的氧濃度設為20體積%,二氧化碳濃度設為390ppm以外,通過與實施例7相同的條件,制備萃取組合物,在與實施例5相同的條件下進行組合物中的植物化學成分異黃酮的分析。
(分析結果4)
圖4示出實施例5~7、比較例4~9的植物化學成分異黃酮的量。圖4中“發芽前”示出未進行任何的誘導發芽處理的種子(比較例4~6的大豆),“發芽/有氧條件”示出在有氧條件下進行了誘導發芽處理的種子(比較例7~9的大豆),“發芽/微缺氧條件”示出在厭氧條件下進行了誘導發芽的前處理的種子(實施例5~7的發芽誘導用原料種子)。如圖4所示,能夠確認相對于未進行任何處理的比較例4~6的大豆或在氧容量為20%的有氧氣氛條件下處理的比較例7~9的大豆,實施例5~7的發芽誘導用原料種子中的植物化學成分異黃酮高出了2.8~3.0倍。從該結果也能夠確認,通過本發明中的前處理,植物種子中的植物化學成分量上升。
此外,在圖5中示出實施例5~7的發芽誘導用原料種子、比較例4~9的大豆中所含的植物化學成分各種異黃酮的量。圖5a示出比較例4~6的大豆的萃取組合物中的植物化學成分各種異黃酮的量,圖5b示出比較例7~9的大豆的萃取組合物中的植物化學成分各種異黃酮的量,圖5c示出實施例5~7的發芽誘導用原料種子的萃取組合物中的植物化學成分各種異黃酮的量。如圖5所示,與比較例4~9的大豆相比,實施例5~7的發芽誘導用原料種子,特別是丙二酰染料木苷(malonyl-genistin),丙二酰大豆苷(malonyl-daidzin)的量顯著變多。
(實施例8)
除了通過與實施例5相同的條件,使用大豆(品種:白大豆)作為植物種子,此外,營造保持時的氧濃度為10體積%,二氧化碳平均濃度為40000ppm的氣氛以外,在與實施例1相同的條件下進行前處理工序,制造發芽誘導用原料種子。
使用實施例8的發芽誘導用原料種子,使用坦培桿菌(根霉屬菌)(菌種:rhizopussp.)作為病原體以外,通過與實施例1相同的順序進行實施例8的發芽處理植物種子的制造。
對實施例8的發芽處理植物種子中的大豆抗毒素進行分析。以與實施例1相同的順序進行萃取組合物的制備。分析條件如下所述。
分析儀器:島津高效液相色譜儀(uhplc)/檢測器:光電二極管陣列檢測器/色譜柱:aqcuityuplcbehshieldrp18柱(1.7μm,2.1mm.×150mm),aqcuityuplcbehshieldrp18vanguard保護柱(1.7μm,2.1mm.×5mm)/色譜柱溫度:35℃/水(0.1%醋酸)、acn(0.1%醋酸):0-2min15-20%,2-5min25%,5-6min30%,6-8min40%,8-9min45%,9-10min45%,10-12min50%,12-22min100%,22-24min100%,24-25min15%,25-27min15%。
(實施例9)
除了使用曲霉菌(菌種:aspergillussp.)作為病原體以外,在與實施例8相同的條件下,進行發芽誘導用原料種子的制造、發芽處理植物種子的制造、萃取組合物的調配以及大豆抗毒素的分析。
(實施例10)
除了使用乳酸菌(lactobacillussp.)作為病原體以外,在與實施例8相同的條件下,進行發芽誘導用原料種子的制造、發芽處理植物種子的制造、萃取組合物的調配以及大豆抗毒素的分析。
(比較例10)
除了不使用病原體以外,在與實施例8~10完全相同的條件下,進行發芽誘導用原料種子的制造、發芽處理植物種子的制造、萃取組合物的調配以及大豆抗毒素的分析。
(分析結果5)
圖6示出實施例8~10、比較例10的大豆抗毒素的量。如圖6所示,能夠確認相對于不接種病原體的比較例10,在實施例8~10的發芽處理用原料種子中,大豆抗毒素的量顯著地變多。另外,實施例8的發芽處理植物種子中產生的植物抗毒素的量為25mg/g。實施例9的發芽處理植物種子中產生的植物抗毒素的量為25mg/g。實施例10的發芽處理植物種子中產生的植物抗毒素的量為25mg/g。
此外,調查實施例9的發芽處理植物種子在接種曲霉菌后隨著時間的推移(0~4天),大豆抗毒素i~v有多少程度的增加。在圖7中示出其結果。圖7中“i”~“v”分別示出“大豆抗毒素i~v”。另外圖7中將質量最多的示為100%。如圖7所示,能夠確認大豆抗毒素之中,大豆抗毒素iii與大豆抗毒素iv顯著地增加。特別是已知大豆抗毒素iii對乳腺癌的抑制、美肌效果的有效性。因此示出,通過使用大豆作為植物種子,利用本發明的方法制造發芽處理植物種子,不僅大豆抗毒素的量增加,有用的大豆抗毒素iii的比例也增加。
(實施例11)
除了使用大豆(品種:白大豆)作為植物種子以外,在與實施例1相同的條件下,制造發芽誘導用原料種子。
壓碎實施例11的發芽誘導用原料種子,調配萃取組合物,對氨基酸進行分析。分析條件如下所述。
島津高效液相色譜儀(uhplc)/檢測器:熒光檢測器/色譜柱:ymctriartc181.9mm(50mml.d.×3.0mm)/色譜柱溫度:35℃/水(0.1%醋酸)、acn(0.1%醋酸):0-1.5min9.5%,1.5-4.5min18.5%,4.5-6.5min25%,6.5-8.5min45%,8.5-12min85%。
(比較例11)
準備與進行實施例11中的前處理前的大豆相同的種子,使用該種子,與實施例11同樣地制作萃取組合物,在與實施例11相同的條件下進行組合物中的氨基酸的分析。
(比較例12)
除了不進行實施例11中的前處理,代替地進行通常的發芽處理(條件:氧濃度20體積%、二氧化碳濃度300ppm的氣氛、溫度26℃的條件下)以外,與實施例11同樣地制作萃取組合物,在與實施例11相同的條件下進行組合物中的氨基酸的分析。
(分析結果6)
圖8示出實施例11、比較例11、比較例12各自的分析結果。根據圖8能夠確認,實施例11的發芽誘導用原料種子,與未進行任何處理的比較例11的大豆、進行了通常的發芽處理的比較例12的大豆相比較,氨基酸的量增加了。特別是能夠確認谷氨酸的量顯著地增加。
因為通過本發明中的前處理,植物化學成分增加,所以即便接種了病原體也難以生長。但是,像這樣地通過前處理使在種子中病原體的營養素即氨基酸大量地增加,所以病原體能夠對抗植物化學成分。因此,推測在接種微生物即病原體的實施例中,在植物化學成分的量較多的狀態下病原體能夠生長,此時因為病原體與前處理后的發芽誘導用原料種子之間產生相互地刺激,所以結果是能夠在種子中生成大量的植物抗毒素。
- 還沒有人留言評論。精彩留言會獲得點贊!