制備具有較少丙烯酸的酰胺化合物的手段和方法與流程
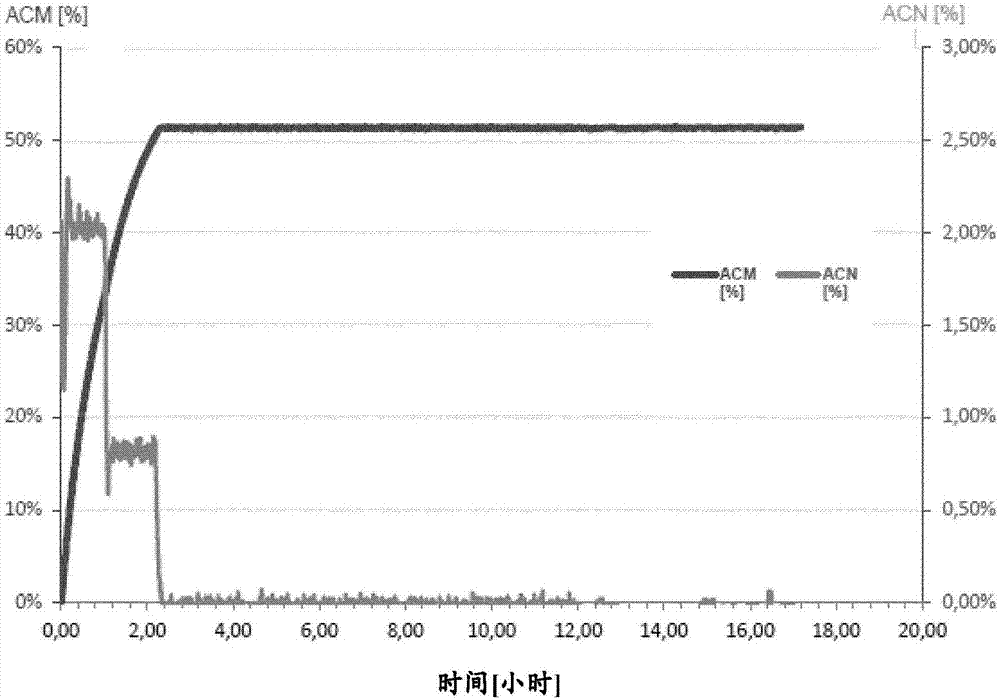
本發明涉及使用產生腈水合酶(nhase)和酰胺酶的微生物作為生物催化劑從腈化合物制備酰胺化合物的方法,所述微生物在與所述腈化合物接觸之前通過干燥步驟預處理,并涉及所述微生物用于從腈化合物制備酰胺化合物的用途。此外,本發明涉及當利用產生腈水合酶和酰胺酶的微生物從腈化合物制備酰胺化合物時減少丙烯酸副產物形成的方法,以及干燥方法用于增加所述微生物的腈水合酶/酰胺酶或降低酰胺酶活性的用途。還提供了通過本發明的方法獲得的酰胺化合物水溶液,以及包含丙烯酰胺或聚丙烯酰胺和干燥微生物的組合物,所述干燥微生物與腈化合物接觸以便將腈化合物轉化為酰胺化合物時表現出至少400的腈水合酶/酰胺酶活性比。丙烯酰胺用作單體以形成丙烯酰胺的聚合物和共聚物。對于這些聚合和共聚反應,可以使用通過生物轉化制備的丙烯酰胺水溶液。然而,已經發現,丙烯酰胺溶液中的高丙烯酸含量導致所得丙烯酰胺聚合物和共聚物的性能降低。更具體地,丙烯酸的存在可以顯著損害丙烯酰胺聚合物和共聚物材料的物理性能,這導致在各種應用如水處理、造紙、油回收或采礦中降低的溶解性和性能。由于發現腈水合酶(nhase),一種將腈水解為酰胺的微生物酶,具有腈水合酶活性的微生物已廣泛用于酰胺化合物的工業生產。由于與酰胺的化學合成相比更溫和的反應條件,產生腈水合酶的微生物作為生物催化劑的用途越來越多地增加。事實上,通過產生腈水合酶的微生物的腈生物轉化的最知名的商業實例之一是從丙烯腈制造丙烯酰胺。然而,在使用產生腈水合酶的微生物作為生物催化劑時,一個具有挑戰性的問題是由酰胺酶介導的副反應的發生。當腈水合酶將腈化合物水解成相應的酰胺化合物時,酰胺酶進一步將酰胺化合物轉化為相應的羧酸,具體地講是轉化為丙烯酸。本發明的技術問題是解決由于在使用產生腈水合酶和酰胺酶的微生物作為生物催化劑從腈化合物制備酰胺化合物中丙烯酸作為副產物形成所產生的問題。通過提供在權利要求中反映的、在說明書中描述的并且在下面的實施例和附圖中闡明的實施方案來解決該技術問題。令人驚訝的是,發明人發現,當產生腈水合酶(nhase)和酰胺酶并且在生物轉化中用作生物催化劑的微生物在與腈化合物接觸之前通過干燥步驟預處理,則在腈化合物至酰胺化合物的生物轉化中,作為副產物的羧酸的產生,具體地講是丙烯酸的產生大大減少。不受理論的束縛,看起來由于這種微生物所經歷的干燥步驟可以降低酰胺酶活性,從而減少由酰胺(該酰胺通過腈水合酶的活性產生)產生的丙烯酸。換句話講,這種干燥的微生物似乎具有的腈水合酶活性和酰胺酶活性之間的比率更有利于腈水合酶活性,即,腈水合酶活性與酰胺酶活性的比率>1.0,例如至少>10、>50、>100、>200、>300或>400。事實上,如在所附實施例中所證實的,顯然在與腈化合物接觸之前,通過干燥步驟預處理的微生物具有腈水合酶/酰胺酶活性的最高值,腈化合物隨后通過所述微生物進行生物轉化。考慮到設置包含幾乎相等量的生物催化劑(由“設置中的腈水合酶活性”反映,參見表1和2)的事實,顯然干燥步驟,即在生物催化劑與腈化合物接觸之前進行干燥步驟,能顯著影響副產物丙烯酸的量。這意味著由于干燥步驟,酰胺酶活性降低到這樣的程度,即這種干燥的微生物產生具有較少丙烯酸副產物的酰胺化合物,這從最右邊的欄中可見。總之,由于在不同設置之間的反應參數保持相同,顯然減少丙烯酸的量的改進可以歸因于干燥步驟。因此,本發明涉及一種由腈化合物制備酰胺化合物的方法,包括使腈化合物與產生腈水合酶(nhase)和酰胺酶的微生物接觸,其中所述微生物在與所述腈化合物接觸之前通過干燥步驟預處理。本發明還提供了一種由腈化合物制備酰胺化合物的方法,包含以下步驟:(a)干燥產生腈水合酶和酰胺酶的微生物;和(b)使腈化合物與所述微生物接觸。此外,根據本發明的令人驚訝的發現,本文提供了一種當由腈化合物制備酰胺化合物時減少丙烯酸形成的方法,其包含使丙烯腈與產生腈水合酶和酰胺酶的微生物接觸,其中所述微生物是如本文所定義的那些。還提供了一種用于產生具有增加的腈水合酶/酰胺酶活性比的微生物的方法,其包含干燥產生腈水合酶和酰胺酶的微生物。同樣,本文提供了一種用于產生具有降低的酰胺酶活性的微生物的方法,其包含干燥產生腈水合酶和酰胺酶的微生物。此外,本發明提供了本文所定義的產生腈水合酶和酰胺酶的微生物用于從腈化合物產生酰胺化合物的用途。類似地,本發明提供了干燥方法用于提高產生腈水合酶和酰胺酶的微生物的腈水合酶/酰胺酶活性比的用途,或者替代地或另外地,提供了干燥方法用于降低產生腈水合酶和酰胺酶的微生物的酰胺酶活性的用途。根據發明人的發現,由于該酰胺溶液包含較少的作為腈化合物轉化為酰胺化合物的副產物的丙烯酸,本發明提供了通過本發明的方法獲得的酰胺化合物水溶液。還根據發明人的發現,本文提供了包含丙烯酰胺或聚丙烯酰胺和產生腈水合酶和酰胺酶的微生物的組合物,所述微生物優選表現出至少400的腈水合酶/酰胺酶活性比。下面將參照幾個示例性實施方案詳細描述本發明。將闡述許多具體細節以便提供對本發明實施方案的透徹理解。當進一步限定和說明本發明的方法、組合物或用途的單一特征時,這些定義和說明適用于本文所描述和提供的所有的本發明的方法、本發明的組合物和本發明的用途。此外,對于本領域技術人員顯而易見的是,可以在沒有下面闡述的一些或全部具體細節的情況下實行實施方案。在其他情況下,沒有詳細描述眾所周知的方法步驟,以免不必要地使本發明難以理解。如根據本發明的發現所證實的,產生腈水合酶和酰胺酶的微生物能夠將腈化合物轉化成酰胺化合物,但是當所述微生物與將要進行生物轉化為酰胺化合物的腈化合物接觸之前通過干燥步驟預處理時,與其它這類產生腈水合酶和酰胺酶的微生物相比,產生較少的羧酸,具體地講是丙烯酸。干燥微生物的這種性質是有利的,因為特別是丙烯酸在隨后從酰胺到聚丙烯酰胺的聚合反應中引起問題。因此,發明人提供了一種具有低酰胺酶活性的微生物形式的生物催化劑,同時其腈水合酶活性基本上不改變,使得微生物產生具有低的羧酸、特別是丙烯酸的量/濃度的酰胺化合物,這是一項杰出的成就。值得注意的是,發明人在沒有用基因工程改造產生腈水合酶和酰胺酶的微生物或使所述微生物經受誘變劑等、或者沒有過多篩選這類(偶然的)天然存在的微生物,而是通過深思的觀察的情況下達到這一成就,所述的觀察是在使所述微生物與腈化合物在其生物轉化成酰胺化合物的過程中接觸之前,對產生腈水合酶和酰胺酶的微生物進行干燥步驟。因此,本發明提供了一種由腈化合物制備酰胺化合物的方法,其包含使腈化合物與產生腈水合酶(nhase)和酰胺酶的微生物接觸,其中所述微生物在與所述腈化合物接觸之前通過干燥步驟預處理。另外,本發明提供一種由腈化合物制備酰胺化合物的方法,其包括以下步驟:(a)干燥產生腈水合酶和酰胺酶的微生物;和(b)使腈化合物與所述微生物接觸。此外,本發明提供了能夠產生腈水合酶和酰胺酶的干燥的微生物,其中腈水合酶和酰胺酶活性之間的比例>1.0,例如至少>10、>50、>100、>200、>300或>400,當與在與應該(生物)轉化為酰胺化合物的腈化合物接觸之前未被干燥的相同微生物相比時,所述干燥的微生物能夠產生具有少得多的丙烯酸副產物的酰胺化合物。術語“在接觸之前通過干燥步驟預處理”是指在將微生物用于本發明的任何方法和用途之前,通過用于干燥所述微生物的手段和/或方法處理微生物。具體地講,微生物在與應該通過所述微生物(生物)轉化的腈化合物接觸之前被干燥。因此,在本發明的優選微生物與腈化合物接觸(或使其接觸)之前將其干燥(進行干燥步驟),所述腈化合物應該被所述干燥的微生物(生物)轉化成酰胺化合物。優選地,所述干燥步驟導致具有殘余水含量的微生物,其殘余水含量至多為微生物總質量的30、25、15、14、13、12、11、10、9、8、7、6或5重量百分比(%w/w)。因此,“微生物的總質量”不必限于微生物本身的質量(盡管這當然是可能的,例如當微生物在干燥步驟之前已經用水洗滌時),而是可以進一步包括那些其存在可以歸因于微生物的培養和/或洗滌步驟等的成分。所述“微生物的總質量”可以進一步包括(除了微生物以外的)儲存緩沖液的組分/鹽、例如基于tris的緩沖液、鹽水緩沖液等的殘余量和/或培養基、生長培養基、營養液、發酵液、例如用于培養微生物等的發酵液、穩定劑、添加劑(例如干燥添加劑)等的殘余量。當在本文中使用時,術語“微生物”涵蓋“產生腈水合酶和酰胺酶的微生物”或者“產生nhase和酰胺酶的微生物”。在本發明的上下文中的微生物優選是細菌、真菌或酵母。本發明的微生物優選在與腈化合物接觸之前通過干燥步驟進行預處理,所述腈化合物通過所述微生物進行生物轉化為酰胺化合物。本發明的微生物優選在干燥前不固定化。如本文所用的“固定”是指本領域技術人員已知的任何固定技術,包括但不限于將微生物結合或吸附到支持基質上、將微生物包埋或包封在支持基質中。在本發明中,“產生腈水合酶和酰胺酶的微生物”用作將腈化合物轉化成相應的酰胺化合物的生物催化劑。如上所述,這樣的微生物優選在與腈化合物接觸之前通過干燥步驟預處理,所述腈化合物進行生物轉化為酰胺化合物。因此,與在接觸將要轉化為酰胺化合物的腈化合物之前不被干燥的相同微生物相比,這樣的微生物能夠產生具有少得多的丙烯酸副產物的酰胺化合物。“腈化合物”由本發明的微生物通過腈水合酶的作用轉化為酰胺化合物。腈化合物是任何具有-c≡n官能團的有機化合物。優選的腈化合物是丙烯腈。還包括在本文公開的方法中使用甲基丙烯腈、乙腈或3-氰基吡啶。“酰胺化合物”通過酰胺酶轉化為酰胺化合物。酰胺化合物具有官能團rnc(o)xnr'2,,其中r和r'指h或有機基團。對于有機酰胺n=1,x=1。酰胺化合物的實例是丙烯酰胺。本發明的方法包括的酰胺化合物的其它實例是甲基丙烯酰胺、乙酰胺或煙酰胺。在本發明中,“產生腈水合酶和酰胺酶的微生物”可以是能夠產生腈水合酶和酰胺酶的任何微生物。在這方面,本發明不關心微生物是否天然編碼腈水合酶和酰胺酶或其是否已經被基因修飾以編碼所述酶。此外,生物催化劑可以是天然編碼腈水合酶和酰胺酶的微生物,并且其進一步被基因工程改造,例如,以增加腈水合酶的產生,或增加腈水合酶的穩定性和/或輸出,或降低酰胺酶的產生,或增加酰胺酶的穩定性和/或輸出。在本發明的上下文中,非天然編碼腈水合酶的“產生腈水合酶和酰胺酶的微生物”可以是基因工程改造的微生物,其天然不含編碼腈水合酶的基因,但是已被操作以含有例如編碼腈水合酶的多核苷酸(例如,通過轉化、轉導、轉染、接合或本領域已知的適合于將多核苷酸轉移或插入細胞中的其它方法;參見sambrook和russell2001,分子克隆:實驗室手冊(molecularcloning:alaboratorymanual),cshpress,coldspringharbor,ny,usa),從而使得微生物能夠產生并穩定保持腈水合酶。為此目的,可能進一步需要插入額外的多核苷酸,其可能是分別允許腈水合酶基因或mrna的轉錄和翻譯所必需的。此類額外的多核苷酸可以尤其包含啟動子序列、或復制起點或其他質粒控制序列。在本文中,這種經過基因工程改造的微生物,其天然不含有編碼腈水合酶的基因、但已被操作以含有編碼腈水合酶的多核苷酸,可以是原核或真核微生物。此類原核微生物的實例包括,例如大腸桿菌(escherichiacoli)物種的代表。此類真核微生物的實例包括,例如酵母(例如,釀酒酵母(saccharomycescerevisiae))。同樣,非天然編碼酰胺酶的“產生腈水合酶和酰胺酶的微生物”可以是基因工程改造的微生物,其天然不含有編碼酰胺酶的基因,但是已被操作以含有編碼酰胺酶的多核苷酸(例如,通過轉化、轉導、轉染、接合或適合于將多核苷酸轉移或插入細胞中的其它方法;參見sambrook和russell2001,分子克隆:實驗室手冊(molecularcloning:alaboratorymanual),cshpress,coldspringharbor,ny,usa),從而使微生物能夠產生并穩定保持酰胺酶。為此目的,可能進一步需要插入額外的多核苷酸,其可能是分別允許酰胺酶基因或mrna的轉錄和翻譯所必需的。此類額外的多核苷酸可以尤其包含啟動子序列、或復制起點或其他質粒控制序列。在本文中,這樣的基因工程改造的微生物天然不含有編碼酰胺酶的基因,但已被操作以包含編碼酰胺酶的多核苷酸,可以是原核或真核微生物。此類原核微生物的實例包括,例如大腸桿菌物種的代表。此類真核微生物的實例包括,例如酵母(例如,釀酒酵母)。(天然或非天然地)編碼腈水合酶的“產生腈水合酶和酰胺酶的微生物”通常還能夠產生并穩定地保持腈水合酶。然而,根據本發明,這樣的微生物也可能僅在微生物的培養(或發酵)期間產生腈水合酶,因此在干燥和/或與腈化合物接觸時含有腈水合酶。在這種情況下,微生物可能在本文所描述和提供的方法期間不再產生腈水合酶,但它們僅通過在它們干燥之前產生的并且在它們干燥后仍含有的腈水合酶單元起作用。如本領域技術人員容易理解的,也可能一些腈水合酶分子可以離開微生物(例如,由于微生物的裂解)并且作為生物催化劑在溶液中自由地起作用。同樣,(天然或非天然地)編碼酰胺酶的“產生腈水合酶和酰胺酶微生物”通常也能夠產生并穩定保持酰胺酶。然而,根據本發明,這樣的微生物也可能僅在微生物的培養(或發酵)期間產生酰胺酶,因此在干燥和/或與腈化合物接觸時含有酰胺酶。在這種情況下,微生物可能在本文所述和提供的方法期間不再產生酰胺酶,但它們僅通過在它們干燥之前產生的并且在它們干燥后仍然含有的酰胺酶單元起作用。在本發明的上下文中,天然編碼腈水合酶和酰胺酶的“產生腈水合酶和酰胺酶的微生物”尤其包括以下屬的細菌:紅球菌屬(rhodococcus)、曲霉屬(aspergillus)、食酸菌屬(acidovorax)、土壤桿菌屬(agrobacterium)、芽孢桿菌屬(bacillus)、短根瘤菌屬(bradyrhizobium)、短桿菌屬(brevibacterium)、伯克霍爾德菌屬(burkholderia)、埃希氏菌屬(escherichia)、土芽孢桿菌屬(geobacillus)、克雷伯菌屬(klebsiella)、中慢生根瘤菌屬(mesorhizobium)、莫拉菌屬(moraxella)、泛菌屬(pantoea)、假單胞菌屬(pseudomonas)、根瘤菌屬(rhizobium)、紅假單胞菌屬(rhodopseudomonas)、沙雷氏菌屬(serratia)、擬無枝酸菌屬(amycolatopsis)、節桿菌屬(arthrobacter)、短桿菌屬(brevibacterium)、棒狀桿菌屬(corynebacterium)、微桿菌屬(microbacterium)、微球菌屬(micrococcus)、諾卡菌屬(nocardia)、假諾卡菌屬(pseudonocardia)、木霉屬(trichoderma)、漆斑菌屬(myrothecium)、短梗霉菌屬(aureobasidium)、假絲酵母屬(candida)、隱球菌屬(cryptococcus)、德巴利酵母屬(debaryomyces)、地霉屬(geotrichum)、有孢漢遜酵母屬(hanseniaspora)、克魯維酵母屬(kluyveromyces)、畢赤酵母屬(pichia)、紅酵母屬(rhodotorula)、叢毛單胞菌屬(comomonas)和火球菌屬(pyrococcus)。在本發明的優選實施方案中,微生物選自紅球菌屬、假單胞菌屬、埃希氏菌屬和土芽孢桿菌屬的細菌。具體地講,“產生腈水合酶和酰胺酶的微生物”尤其包括以下物種:玫瑰色紅球菌(rhodococcusrhodochrous)、嗜吡啶紅球菌(rhodococcuspyridinovorans)、紅串紅球菌(rhodococcuserythropolis)、馬紅球菌(rhodococcusequi)、赤紅球菌(rhodococcusruber)、不透明紅球菌(rhodococcusopacus)、黑曲霉(aspergillusniger)、燕麥食酸菌(acidovoraxavenae)、敏捷食酸菌(acidovoraxfacilis)、根癌土壤桿菌(agrobacteriumtumefaciens)、放射形土壤桿菌(agrobacteriumradiobacter)、枯草芽孢桿菌(bacillussubtilis)、蒼白芽孢桿菌(bacilluspallidus)、史氏芽孢桿菌(bacillussmithii)、芽孢桿菌屬物種br449(bacillusspbr449)、bradyrhizobiumoligotrophicum、高效固氮慢生根瘤菌(bradyrhizobiumdiazoefficiens)、大豆慢生根瘤菌(bradyrhizobiumjaponicum)、burkholderiacenocepacia、唐菖蒲伯克霍爾德菌(burkholderiagladioli)、大腸桿菌、土芽孢桿菌屬物種rapc8(geobacillussp.rapc8)、產酸克雷伯菌(klebsiellaoxytoca)、肺炎克雷伯菌(klebsiellapneumonia)、變棲克雷伯菌(klebsiellavariicola)、鷹嘴豆中慢生根瘤菌(mesorhizobiumciceri)、mesorhizobiumopportunistum、中慢生根瘤菌屬物種f28、莫拉菌屬(moraxella)、pantoeaendophytica、凝聚成團泛菌(pantoeaagglomerans)、綠針假單胞菌(pseudomonaschlororaphis)、惡臭假單孢菌(pseudomonasputida)、根瘤菌屬(rhizobium)、沼澤紅假單孢菌(rhodopseudomonaspalustris)、液化沙雷氏菌(serratialiquefaciens)、粘質沙雷氏菌(serratiamarcescens)、擬無枝酸菌屬(amycolatopsis)、節桿菌屬(arthrobacter)、短桿菌屬物種ch1(brevibacteriumspch1)、短桿菌屬物種ch2(brevibacteriumspch2)、短桿菌屬物種r312(brevibacteriumspr312)、brevibacteriumimperiale、corynebacteriumnitrilophilu、假白喉棒狀桿菌(corynebacteriumpseudodiphteriticum)、谷氨酸棒狀桿菌(corynebacteriumglutamicum)、霍夫曼棒狀桿菌(corynebacteriumhoffmanii)、蛾微桿菌(microbacteriumimperial)、microbacteriumsmegmatis、藤黃微球菌(micrococcusluteus)、球形諾卡菌(nocardiagloberula)、玫瑰色諾卡菌(nocardiarhodochrous)、嗜熱假諾卡菌(pseudonocardiathermophile)、木霉屬(trichoderma)、疣孢漆斑菌(myrotheciumverrucaria)、出芽短梗霉菌(aureobasidiumpullulans)、無名假絲酵母(candidafamata)、吉利蒙假絲酵母(candidaguilliermondii)、熱帶假絲酵母(candidatropicalis)、黃隱球菌(cryptococcusflavus)、隱球菌屬物種ufmg-y28(cryptococcusspufmg-y28)、漢遜德巴利酵母(debaryomyceshanseii)、白地霉(geotrichumcandidum)、地霉屬物種jr1(geotrichumspjr1)、有孢漢遜酵母屬(hanseniaspora)、耐熱克魯維酵母(kluyveromycesthermotolerans)、克魯維畢赤酵母(pichiakluyveri)、膠紅類酵母菌(rhodotorulaglutinis)、睪丸酮叢毛單胞菌(comomonastestosteroni)、pyrococcusabyssi、激烈火球菌(pyrococcusfuriosus)和堀越氏火球菌(pyrococcushorikoshii)、乳酪短桿菌(brevibacteriumcasei)或諾卡菌屬物種163(nocardiasp163)。在本發明的優選實施方案中,“產生腈水合酶和酰胺酶的微生物”是玫瑰色紅球菌、嗜吡啶紅球菌物種的細菌。這些物種的優選代表是玫瑰色紅球菌(ncimb41164)、玫瑰色紅球菌(fermbp-1478)、玫瑰色紅球菌m8和玫瑰色紅球菌m33。在本發明的上下文中,“腈水合酶”(“nhase”)是指催化腈水合成其相應酰胺的微生物酶(iubmb酶命名法(iubmbenzymenomenclature)ec4.2.1.84)。然而,如本文所用的術語“腈水合酶”和“nhase”還包含修飾的或增強的酶,其例如能夠更快地將腈化合物(例如丙烯腈)轉化為酰胺化合物(例如丙烯酰胺),或者其可以以更高的產量/時間比產生,或者它們更穩定,只要它們能夠催化腈化合物(例如丙烯腈)轉化(即水合)成酰胺化合物(例如丙烯酰胺)。測定給定的生物催化劑(例如“產生腈水合酶和酰胺酶的微生物”)將丙烯腈轉化為丙烯酰胺的能力的方法是本領域熟知的。例如,在本發明的上下文中,在本發明意義上,能夠將丙烯腈轉化為丙烯酰胺的給定生物催化劑的活性可以如下測定:首先將100μl細胞懸浮液、細胞裂解物、溶解的酶粉末或含有假定的腈水合酶的任何其它制劑與875μl50mm磷酸鉀緩沖液和25μl丙烯腈在25℃下在eppendorf管振蕩器上以1,000rpm反應10分鐘。在10分鐘的反應時間后,可以抽取樣品,并通過加入相同體積的1.4%鹽酸立即淬滅。混合樣品后,可以通過在10,000rpm離心1分鐘除去細胞,并通過hplc分析澄清上清液來測定形成的丙烯酰胺的量。為了在本發明背景下確認酶是腈水合酶,丙烯酰胺濃度應當在0.25和1.25mmol/l之間,在必要時,樣品必須相應地稀釋,并且必須重復轉化。然后可以通過將來自hplc分析的丙烯酰胺濃度除以反應時間(其為10分鐘),并通過將該值與hplc樣品和原始樣品之間的稀釋因子相乘,從丙烯酰胺的濃度推導出酶活性。活性>5u/mg干細胞重量,優選>25u/mg干細胞重量,更優選>50u/mg干細胞重量,最優選>100u/mg干細胞重量,表明存在功能性表達的腈水合酶,并且在本發明的背景下被認為是腈水合酶。在本發明的上下文中,腈水合酶可以是由多核苷酸編碼的多肽,所述多核苷酸包含或由一段核苷酸序列組成,其與以下的核苷酸序列具有至少70%,優選至少75%,更優選至少80%,更優選至少85%,更優選至少90%,更優選至少95%,更優選至少96%,更優選至少97%,更優選至少98%,更優選至少99%,更優選至少99.5%,并且最優選100%的同一性:seqidno:1的核苷酸序列(玫瑰色紅球菌的腈水合酶的α-亞基:gtgagcgagcacgtcaataagtacacggagtacgaggcacgtaccaaggcgatcgaaaccttgctgtacgagcgagggctcatcacgcccgccgcggtcgaccgagtcgtttcgtactacgagaacgagatcggcccgatgggcggtgccaaggtcgtggccaagtcctgggtggaccctgagtaccgcaagtggctcgaagaggacgcgacggccgcgatggcgtcattgggctatgccggtgagcaggcacaccaaatttcggcggtcttcaacgactcccaaacgcatcacgtggtggtgtgcactctgtgttcgtgctatccgtggccggtgcttggtctcccgcccgcctggtacaagagcatggagtaccggtcccgagtggtagcggaccctcgtggagtgctcaagcgcgatttcggtttcgacatccccgatgaggtggaggtcagggtttgggacagcagctccgaaatccgctacatcgtcatcccggaacggccggccggcaccgacggttggtccgaggaggagctgacgaagctggtgagccgggactcgatgatcggtgtcagtaatgcgctcacaccgcaggaagtgatcgtatga)和/或seqidno:3的核苷酸序列(玫瑰色紅球菌的腈水合酶的β-亞基:atggatggtatccacgacacaggcggcatgaccggatacggaccggtcccctatcagaaggacgagcccttcttccactacgagtgggagggtcggaccctgtcaattctgacttggatgcatctcaagggcatatcgtggtgggacaagtcgcggttcttccgggagtcgatggggaacgaaaactacgtcaacgagattcgcaactcgtactacacccactggctgagtgcggcagaacgtatcctcgtcgccgacaagatcatcaccgaagaagagcgaaagcaccgtgtgcaagagatccttgagggtcggtacacggacaggaagccgtcgcggaagttcgatccggcccagatcgagaaggcgatcgaacggcttcacgagccccactccctagcgcttccaggagcggagccgagtttctctctcggtgacaagatcaaagtgaagagtatgaacccgctgggacacacacggtgcccgaaatatgtgcggaacaagatcggggaaatcgtcgcctaccacggctgccagatctatcccgagagcagctccgccggcctcggcgacgatcctcgcccgctctacacggtcgcgttttccgcccaggaactgtggggcgacgacggaaacgggaaagacgtagtgtgcgtcgatctctgggaaccgtacctgatctctgcgtga),條件是所述多核苷酸編碼的多肽能夠如本文所述和例舉的催化丙烯腈水合成丙烯酰胺(即具有腈水合酶活性)。同樣在本發明的背景下,腈水合酶可以是多肽,所述多肽包含或由一段氨基酸序列組成,其與以下的氨基酸序列具有至少70%,優選至少75%,更優選至少80%,更優選至少85%,更優選至少90%,更優選至少95%,更優選至少96%,更優選至少97%,更優選至少98%,更優選至少99%,更優選至少99.5%,并且最優選100%的同一性:seqidno:2的氨基酸序列(玫瑰色紅球菌的腈水合酶的α-亞基:和/或seqidno:4的氨基酸序列(玫瑰色紅球菌的腈水合酶的β-亞基:條件是所述多肽能夠如本文所述和例舉的催化丙烯腈水合成丙烯酰胺。兩個或更多個序列(例如,核酸序列或氨基酸序列)之間的同一性水平可以通過本領域已知的方法容易地確定,例如通過blast分析。通常,在本發明的上下文中,如果通過例如序列比對來進行比較的兩個序列(例如,多核苷酸序列或氨基酸序列)的同一性不同,則術語“同一性”可以指較短的序列以及與所述較短序列匹配的較長序列的那部分。因此,當比較的序列不具有相同的長度時,同一性程度優選地可以指較短序列中與較長序列中的核苷酸殘基相同的核苷酸殘基的百分比,或者指較長序列中與較短序列中的核苷酸序列相同的核苷酸的百分比。在本文中,技術人員容易確定與較短序列匹配的較長序列的那部分。此外,如本文所使用的,核酸序列或氨基酸序列的同一性水平可以基于相應序列的整個長度,并且優選成對評估,其中每個空位計為一個錯配。序列比對的這些定義(例如,“同一性”值的建立)適用于本文所描述和公開的所有序列。此外,如本文所使用的術語“同一性”是指在相應序列之間存在功能和/或結構等同物。與本文所述的特定核酸/氨基酸序列具有給定同一性水平的核酸/氨基酸序列可以表示這些序列的衍生物/變體,其優選具有相同的生物學功能。它們可以是天然存在的變異,例如來自其他變種、物種等的序列,或突變,并且所述突變可以是天然形成的或可以通過有意誘變產生。此外,變異可以是合成產生的序列。變體可以是天然存在的變體或合成產生的變體或通過重組dna技術產生的變體。與上述核酸序列的偏差可以通過例如缺失、替代、添加、插入和/或重組產生。術語“添加”是指在給定序列的末端添加至少一個核酸殘基/氨基酸,而“插入”是指在給定序列中插入至少一個核酸殘基/氨基酸。術語“缺失”是指刪除或去除給定序列中的至少一個核酸殘基或氨基酸殘基。術語“替代”是指替換給定序列中的至少一個核酸殘基/氨基酸殘基。同樣,這里使用的這些定義經必要修改后適用于本文所提供和描述的所有序列。通常,如本文所用,術語“多核苷酸”和“核酸”或“核酸分子”應當同義地解釋。通常,核酸分子尤其可以包含dna分子、rna分子、寡核苷酸硫代磷酸酯、取代的核糖寡核苷酸或pna分子。此外,術語“核酸分子”可以指本領域已知的dna或rna或其雜交物或其任何修飾(參見例如us5525711、us4711955、us5792608或ep302175中的修飾的實例)。多核苷酸序列可以是單鏈或雙鏈、線性或環狀、天然或合成的,并且沒有任何大小限制。例如,多核苷酸序列可以是基因組dna、cdna、線粒體dna、mrna、反義rna、核酶rna或編碼此類rna或嵌合體的dna(gamper,核酸研究(nucleicacidsresearch),2000,28,4332-4339)。所述多核苷酸序列可以是載體、質粒或病毒dna或rna的形式。本文還描述了與上述核酸分子互補的核酸分子和能夠與本文所述的核酸分子雜交的核酸分子。本文所述的核酸分子還可以是本發明上下文中的核酸分子的片段。具體地講,這樣的片段是功能片段。這種功能片段的實例是可以用作引物的核酸分子。“酰胺酶”是指催化酰胺水解成其相應羧酸的微生物酶(iubmb酶命名法ec3.5.1.4,“酰胺酶”)。在本文中酰胺酶優選是指與腈水合酶共表達的酰胺酶,并且其將由腈水合酶產生的酰胺進一步轉化為相應的羧酸。本文所用的術語“酰胺酶”還包含修飾或受損的酶,只要這些酶仍具有酰胺酶活性。不受理論的束縛,據信生物催化劑(即微生物)的干燥降低了酰胺酶的活性,由此認為腈水合酶活性降低到較低程度或保持不變。事實上,發明人觀察到,當產生腈水合酶和酰胺酶的微生物與腈化合物(該腈化合物應該通過所述的微生物進行生物轉化(腈化合物轉化成酰胺化合物))接觸之前通過干燥步驟預處理時,腈水合酶的活性高于酰胺酶的活性。如上所述,發明人觀察到,在與將要被所述微生物轉化為酰胺化合物的腈化合物接觸之前通過干燥步驟預處理的微生物,當與在與所述腈化合物接觸之前不通過干燥步驟預處理的相同微生物相比時,所述微生物能夠產生具有更少丙烯酸的酰胺化合物。因此,本發明的微生物優選具有至少400單位的腈水合酶/酰胺酶活性比。優選如上文所述測定腈水合酶活性。還根據本發明的發現,本發明方法中涉及的接觸步驟是用干燥的微生物進行的。根據一個實施方案,在本發明的方法中提及的接觸步驟用重配的微生物進行。重配的微生物是懸浮的干燥微生物,即以漿體存在或溶解在水溶液如水或具有生理ph的緩沖溶液或水性組合物中。后者可以含有一種或多種其它成分,例如葡萄糖。在本文中重配是指在微生物與腈化合物接觸之前將水性組合物加入到干燥的微生物中。因此,在本文所述的任何一種方法中,接觸步驟可以用懸浮在水性組合物中的干燥微生物進行。這樣的水性組合物包括但不限于,水(例如去離子水)和緩沖液(例如磷酸鹽緩沖液)。考慮到上述情況,優選本發明方法中涉及的接觸步驟用粉末、顆粒和/或懸浮液形式的微生物進行。也可以使用基質結合的微生物進行接觸步驟。如上所述,當與參照微生物相比時,也用于本文所述的方法和用途中的本發明微生物的腈水合酶活性與酰胺酶活性的比率增加。事實上,如所附實施例所示,顯然,與未通過干燥步驟預處理的微生物相比,在與腈化合物接觸之前通過干燥步驟預處理的微生物(所述腈化合物然后經所述微生物生物轉化)具有最低的丙烯酸值。該發現意味著干燥的微生物的酰胺酶活性似乎降低或受損,因為未干燥的微生物產生更多的丙烯酸作為副產物,所述丙烯酸來自于酰胺化合物向丙烯酸的轉化。結果,相對于(降低的)酰胺酶活性,腈水合酶活性增加。實際上,由于干燥步驟,酰胺酶活性降低到這樣的程度,使這種干燥的微生物產生具有較少丙烯酸副產物的酰胺化合物,這從表1和2的最右邊的欄中可見。總之,由于在實施例1和2中應用的反應參數在不同設置之間保持相同,顯然減少丙烯酸量的改進可歸因于干燥步驟。作為“參照微生物”,當在本文中提及時,可以使用非干燥的生物催化劑(即微生物)。因此,參考微生物是在與腈化合物接觸之前未通過干燥步驟預處理的微生物,所述腈化合物應該通過本發明微生物轉化為酰胺化合物,所述本發明微生物在與所述腈化合物接觸之前通過干燥步驟預處理。合適的“參照微生物”是例如與本發明方法中用作生物催化劑的微生物相同菌株的非干燥的微生物。此外,“參考微生物”可以對應于在干燥之前用于本發明方法的生物催化劑(即微生物)。在這種情況下,可以在該方法的干燥步驟a)之前和之后確定用作生物催化劑的微生物的腈水合酶/酰胺酶活性,并比較腈水合酶/酰胺酶活性以確定干燥是否增加微生物的腈水合酶/酰胺酶活性。此外,玫瑰色紅球菌(ncimb41164)可以用作“參照微生物”。為了確定步驟a)中進行的干燥過程是否提高了所用微生物的腈水合酶/酰胺酶活性比,可另外或可選地使用玫瑰色紅球菌(ncimb41164)進行步驟a)中的干燥過程。在通過步驟a)中進行的干燥來增加玫瑰色紅球菌(ncimb41164)的腈水合酶/酰胺酶活性比的情況下,必須假定通過步驟a)中進行的干燥,在本發明方法中用作生物催化劑的微生物的腈水合酶/酰胺酶活性比同樣地減少。在本發明中,微生物優選不在微生物干燥和干燥的微生物與腈化合物接觸之間進行培養。如本文所用,“培養”是指將微生物懸浮在培養基中并保持在允許微生物生長的條件下。在微生物干燥和干燥的微生物與腈化合物接觸之間,優選將微生物保持在抑制微生物在干燥前恢復其腈水合酶/酰胺酶活性比率的條件下。腈水合酶活性與酰胺酶活性的比率的增加優選至少1.4倍或更多倍,例如1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4或2.5或甚至更高的因子。類似地,酰胺酶活性與腈水合酶活性比率的降低優選至少0.7倍或更低倍,例如0.6、0.5、0.4、0.3、0.2或0.1或甚至更低的因子。本發明發現一種由腈化合物制備酰胺化合物的方法,其包含以下步驟:(a)干燥產腈水合酶和酰胺酶的微生物;和(b)使腈化合物與所述微生物接觸。不受理論限制,假定步驟(a)增加腈水合酶活性與酰胺酶活性的比率根據本領域技術人員的普通知識測量和測定腈水合酶活性,例如上文所述。類似地,根據本領域技術人員的普通知識測量和測定酰胺酶活性。例如酰胺酶活性可以在室溫下通過測量630nm處丙烯酰胺降解釋放的氨來測定。因此,如本文所述,用作生物催化劑的微生物的干燥提高了所述微生物的腈水合酶/酰胺酶活性比。優選地,干燥通過噴霧干燥、冷凍干燥、加熱干燥、空氣干燥、真空干燥、流化床干燥和/或噴霧造粒來介導。在這方面,優選噴霧干燥和冷凍干燥,因為通常通過使用已經進行噴霧或冷凍干燥的生物催化劑,與使用其它方法已經干燥的微生物相比,實現了在由腈化合物制備酰胺化合物期間丙烯酸形成的更多降低。在本文所述的任何一種方法中,微生物的干燥可以在干燥的微生物與腈化合物接觸之前立即進行。或者,微生物可以在干燥和干燥的微生物與腈化合物接觸之間儲存。為了在干燥和接觸步驟之間儲存微生物,干燥的微生物可以保持在干燥狀態(即,微生物不重配),可以冷凍、可以防止受熱、可以防止受潮和/或可以不培養。對干燥的微生物與腈化合物接觸時的干燥微生物的形式沒有特別限制。干燥的微生物可以是干燥的和/或以通過本文所述的任何干燥方法例如噴霧干燥或冷凍干燥可實現的干燥產物的形式。因此,在本文所述的任何一種方法和進一步的實施方案中,接觸步驟可以用具有殘余水含量的微生物進行,其殘余水含量至多為微生物總質量的30、25、15、14、13、12、11、10、9、8、7、6或5重量百分比(%w/w)。確定殘余水含量的方法是本領域技術人員熟悉的。例如,在本發明的上下文中,干燥微生物的樣品的殘余水含量可以通過熱重分析來確定。在熱重分析開始時,確定樣品的初始重量。然后加熱樣品,水分蒸發。繼續加熱直到樣品重量保持恒定。分析結束時的恒定重量和初始重量之間的差表示在分析期間蒸發的水量,其能夠計算樣品的殘余水含量。為了通過熱重分析測定殘余水含量,可以例如在“mettlertoledohb43-s鹵素水分分析儀”上在130℃操作分析微生物樣品,直到樣品重量保持恒定至少30秒。因此,“微生物的總質量”不必限于微生物本身的質量(盡管這當然是可能的,例如當微生物在干燥步驟之前已經用水洗滌時),而是可以進一步包括其存在可以歸因于微生物的培養和/或洗滌步驟等的成分。所述“微生物的總質量”可以進一步包括(除了微生物以外的)儲存緩沖液的組分/鹽、例如基于tris的緩沖液、鹽水緩沖液等的殘余量和/或培養基、生長培養基、營養液、發酵液、例如用于培養微生物等的發酵液、穩定劑、添加劑(例如干燥添加劑)等的殘余量。本發明進一步根據發明人的發現提供了制備具有增加的腈水合酶/酰胺酶活性比的微生物的方法,其包括干燥產生腈水合酶和酰胺酶的微生物,以及制備具有降低的酰胺酶活性的微生物的方法,其包括干燥產生腈水合酶和酰胺酶的微生物。如上所述,通過本發明實現的主要目標是生物轉化的酰胺化合物(由腈化合物生物轉化),具有較少或減少的作為副產物的丙烯酸,因為已知丙烯酸引起隨后酰胺化合物的聚合困難。因此,通過提供一種用于在由腈化合物制備酰胺化合物時減少丙烯酸形成的方法,這種成就得到了體現,所述方法包含使丙烯腈與產生腈水合酶和酰胺酶的微生物接觸,其中所述微生物在與所述腈化合物接觸之前通過干燥步驟預處理。具體地講,發明人已經發現,通過使用在與如本文所述的腈化合物接觸之前已經通過干燥步驟預處理的微生物,與參考方法相比,丙烯酸的形成可以降低至少15%,優選至少20%,更優選至少25%,甚至更優選至少30%,還更優選至少40%,并且最優選至少50%。發明人進一步認為,生物轉化反應,特別是工業規模的反應,應優選以相對簡單的方式進行。具體地講,關于使用本發明的包含腈水合酶的生物催化劑進行的腈化合物向酰胺化合物的生物轉化,發明人已經考慮將反應混合物中的緩沖液的摩爾濃度保持相當低,優選盡可能低,其對于生物轉化過程具有幾個優點。例如,如果在反應混合物中存在相當大量的緩沖液,則其將以相當大的量存在于廢水中。這意味著緩沖液必須再次從廢水中除去,將導致額外的技術努力和成本。此外,在產物(即酰胺溶液)中存在相當大量的緩沖液可能不利地影響隨后的反應步驟,例如聚合或共聚反應。因此,如果將相當大量的緩沖液加入到生物轉化的反應混合物中,則在進一步的反應步驟之前必須將其與酰胺溶液分離,這將伴隨額外的技術努力和成本,或者緩沖液可能導致產品質量的降低。因此,腈化合物向酰胺化合物的生物轉化優選在相對低量的緩沖液存在下在水溶液中進行。為了制備用于將腈化合物生物轉化為酰胺化合物的反應混合物,通過本發明的方法(例如,通過噴霧干燥或冷凍干燥)獲得的干燥的生物催化劑通常可以懸浮在水中,然后可以將含有生物催化劑的所述含水混合物轉移到進行生物轉化的反應器中,其中生物催化劑與含水混合物和要轉化為相應酰胺的腈化合物接觸。然而,發明人驚奇地發現,如果本發明的干燥生物催化劑與非緩沖的水溶液混合,含有生物催化劑的水性混合物的ph將處于弱酸性范圍內(例如ph5至6.5)。這是令人驚訝的,因為在干燥例如噴霧干燥或冷凍干燥之前,在介質中潮濕的生物催化劑通常具有中性ph(例如ph6.7至7.5)。此外,在生物轉化期間的反應混合物是相當弱的堿性。不希望受理論束縛,據信在干燥步驟期間,氨(nh3)從介質中剝離,這在生物轉化前與水溶液混合時導致干燥的生物催化劑的弱酸性ph。在這方面,發明人驚奇地發現,干燥的生物催化劑的含水混合物的酸性ph導致腈水合酶的活性降低,并且這種降低可能是不可逆的,這意味著即使生物轉化在具有中性或微堿性ph的反應混合物中進行,腈水合酶的活性將保持降低。發明人進行了各種實驗,并且發現如果干燥的生物催化劑在生物轉化之前通過懸浮在緩沖的水溶液中而被活化,其中該溶液具有中性或微堿性ph(例如ph6.6至9),則生物催化劑將具有顯著增加的腈水合酶活性。即使將活化混合物(即包含生物催化劑的緩沖的水性混合物)轉移到非緩沖的水溶液中以得到反應混合物,這種高的腈水合酶活性得以保持。通過這種增加的腈水合酶活性,當與在噴霧干燥后相同量的生物催化劑懸浮在沒有緩沖液的水中的生物轉化的反應時間相比,生物轉化的總反應時間顯著降低。此外,簡單地向反應混合物中加入緩沖液,不會產生與在加入反應混合物之前干燥的生物催化劑已經重新懸浮在緩沖液中作為活化物時相同的效果。根據發明人進行的進一步實驗,當在發酵后將緩沖液加入到細胞懸浮液中并且生物催化劑用緩沖液干燥、然后再懸浮于水或緩沖液中時,生物催化劑也具有顯著增加的腈水合酶活性。如上所述,生物催化劑的活化可以通過將干燥的生物催化劑懸浮在含有緩沖液的水溶液中進行。這種活化可以小規模進行,即活化所需的反應體積相當小。另一方面,進行腈化合物至酰胺化合物的生物轉化的反應混合物通常具有相當大的體積。由于與反應混合物的體積相比,活化混合物的體積較小,當活化混合物轉移到反應器中用于腈化合物至酰胺化合物的生物轉化時,在反應混合物中的緩沖液組分被稀釋。盡管如此,在生物轉化中保留了活化期間緩沖液的有益效果。如前所述,作為增強的腈水合酶活性的結果,如果使用相同量的生物催化劑,則使用該生物催化劑的將腈化合物生物轉化為酰胺化合物顯示更高的反應速率。此外,可以降低生物催化劑的量,同時實現了與使用未經歷活化步驟(即在干燥后僅在水中重新懸浮的生物催化劑)的未減少量的生物催化劑的反應速率相比,甚至更高的反應速率。因此,本發明還涉及一種在含水混合物中由腈化合物制備酰胺化合物的方法,所述方法包含:(a)通過干燥步驟對生物催化劑進行預處理;(b)活化步驟,其包括將本發明的干燥的生物催化劑與水溶液混合以產生活化混合物,其中所述活化混合物包含緩沖液;和(c)使用本發明的生物催化劑在反應混合物中將腈化合物轉化為酰胺化合物,其中所述反應混合物包含步驟(b)的所述緩沖液,并且其中活化混合物中的緩沖液摩爾濃度與反應混合物中所述緩沖液的摩爾濃度的比率約為2:1或更高。具體地講,在轉化結束之前,活化混合物中緩沖液的摩爾濃度與反應混合物中所述緩沖液的摩爾濃度的比率約為2:1或更高。在本文公開的任何一種方法中不需要在轉化期間保持該比率恒定。相反,該比率可以在轉化期間變化,只要該比率約為2:1或更高。例如,該比率可以在轉化期間增加。可能是這種情況,如果在轉化期間將反應物加入到反應混合物中,其稀釋反應混合物,從而降低反應混合物中的緩沖液濃度。例如,腈化合物和/或水可以在轉化期間作為反應物進料到反應混合物中。這增加了反應混合物的體積,并且因此降低了反應混合物中緩沖液的摩爾濃度。由于反應混合物中緩沖液的摩爾濃度降低,活化混合物中緩沖液的摩爾濃度與反應混合物中緩沖液的摩爾濃度的比例增加。因此,從該實例可以看出,所述摩爾比可以在轉化反應過程中變化。進一步考慮,活化混合物中緩沖液的摩爾濃度與反應混合物中所述緩沖液的摩爾濃度的比率可以約為3:1或更高,優選約4:1或更高,更優選約5:1或更高,甚至更優選約7:1或更高,還更優選約10:1或更高,還更優選約20:1或更高,還更優選約50:1或更高,最優選約100:1或更高。具體地講,這些比率存在于轉化結束之前。關于活化混合物中緩沖液的摩爾濃度和反應混合物中緩沖液的摩爾濃度,這些濃度均以mol/l(摩爾每升)表示。當計算活化混合物中緩沖液的摩爾濃度與反應混合物中緩沖液的摩爾濃度的比率時,活化混合物中緩沖液的摩爾濃度和反應混合物中緩沖液的摩爾濃度均以mol/l計。本發明還包括,在活化步驟后和在生物催化劑與腈化合物接觸之前,活化混合物的緩沖液可以至少部分除去。作為說明性實例,這可以通過離心活化混合物,然后丟棄上清液,任選地隨后使生物催化劑與另一種水溶液接觸,或者作為另一個說明性實例,通過過濾來完成。在這種情況下,當生物催化劑與腈化合物接觸時,生物催化劑(懸浮液)通常仍然含有殘余的緩沖液。本領域技術人員應當理解,生物催化劑中存在的殘余緩沖液越少,活化混合物中緩沖液的摩爾濃度與反應混合物中所述緩沖液的摩爾濃度的比率越高。本文在干燥的生物催化劑的上下文中使用的術語“活化”,通常是指將干燥的生物催化劑與水溶液混合,以得到包含生物催化劑和緩沖液的水性混合物。所述混合物在本文中也稱為“活化混合物”。根據本文所述的任何一種方法,活化混合物可以通過將緩沖液與水溶液混合以得到緩沖的水溶液,然后將干燥的生物催化劑溶解或懸浮在緩沖的水溶液中來制備。活化混合物也可以通過將干燥的生物催化劑與緩沖液組分、特別是干燥的緩沖液組分混合,然后向混合物中加入水或將混合物加入水中,以及溶解緩沖液組分并且溶解或再懸浮干燥的生物催化劑來制備。本文所用的術語“反應混合物”是指包含生物催化劑和腈化合物和/或酰胺化合物的含水混合物。在一些實施方案中,根據本文公開的任何一種方法的反應混合物,可以通過合并已經經歷活化步驟的生物催化劑、水溶液和腈化合物來產生。通常,生物催化劑催化反應混合物中腈化合物向酰胺化合物的轉化。因此,術語“反應混合物”通常是指在轉化過程的任何時間的包括水、生物催化劑和腈和/或酰胺化合物的混合物,包括在反應開始時、在水溶液中首先使生物催化劑與腈化合物接觸時、以及在轉化停止或結束后但是水溶液、生物催化劑和酰胺或腈化合物仍然存在于混合物中時。本文所用的術語“在轉化結束之前”是指反應混合物中腈向酰胺的轉化仍在進行的任何時間。通常其是指存在反應混合物并且其中轉化還沒有結束或停止的任何時間。在本文公開的方法中還預期,在將生物催化劑進行本發明的干燥步驟以得到干燥的生物催化劑之前,可以將緩沖液加入到生物催化劑懸浮液或溶液中。也可以在加入緩沖液之前洗滌生物催化劑。通過在干燥步驟之前添加緩沖液,干燥后的生物催化劑包含在干燥步驟之前已經加入的干燥的緩沖液組分。因此,當使包含緩沖液的干燥的生物催化劑與水溶液接觸時,緩沖液組分溶解,其與生物催化劑一起產生活化混合物。此外,在本文公開的方法中還包括,用緩沖液處理生物催化劑,隨后將生物催化劑進行干燥步驟以產生干燥的生物催化劑,其隨后可以溶解或重懸浮在緩沖溶液中以得到活化混合物。當根據本文公開的方法用緩沖液活化生物催化劑時,所述活化不需要長的時間段。優選地,所述生物催化劑的活化進行約1分鐘或更長,更優選約5分鐘或更長,甚至更優選約10分鐘至約10小時,還更優選約20分鐘至約5小時,最優選約30分鐘至約2小時。當干燥的生物催化劑用緩沖的水溶液處理以得到活化混合物時,所述活化混合物通常直接用于生物轉化,即直接與水溶液和腈化合物混合以得到反應混合物。另一方面,如果在干燥步驟之前用緩沖溶液或緩沖鹽活化生物催化劑,則干燥的生物催化劑可以隨后儲存幾個月,然后將所述活化的生物催化劑與水溶液混合以得到活化混合物,并且進一步將所述活化混合物與水溶液和腈化合物混合以得到反應混合物。如發明人所發現的,所述生物催化劑在儲存期間沒有顯著丟失活性。這可以被看作所述活化變體的另一優點。本文所公開的方法還包括,包含在活化混合物中的緩沖液具有在約6至約9,優選約6.5至約8范圍內的pka。在這里,緩沖液可包含單一組分,或可以是多于一種緩沖液組分的混合物。還應當理解,一種單一組分可以具有多于一種pka值。如果緩沖液包含pka在約6至約9范圍內的緩沖液組分,則緩沖液通常具有在約6至約9范圍內的pka。例如,磷酸鹽具有三個pka值,2.1、7.2和12.7。由于磷酸鹽的pka值之一在約6至約9的范圍內,所以包含磷酸鹽的緩沖液可以理解為具有pka在約6至約9范圍內的緩沖液。還包括活化混合物具有的ph值約6.6至約9,優選約6.6至約8.8,更優選約6.7至約8.6,甚至更優選約6.8至約8.4,還更優選約6.9至約8.2,最優選約7至約8。本發明還預期了不同的緩沖液非常適合用于本文所公開的方法中,即增加生物催化劑的腈水合酶活性。所述緩沖液包含無機緩沖液或有機緩沖液。進一步考慮,緩沖液可以包含非磺酸緩沖液或羧酸緩沖液。可用于本發明的合適的緩沖液可以包含選自下述的化合物:磷酸鹽、檸檬酸鹽、碳酸鹽、2-[(2-羥基-1,1-雙(羥甲基)乙基)氨基]乙磺酸(tes)、1,4-哌嗪二乙磺酸(pipes)、n-(2-乙酰氨基)-2-氨基乙磺酸(aces)和三(羥甲基)氨基甲烷(tris)及其任何組合。具體地講,緩沖液包含磷酸鹽緩沖液或檸檬酸鹽緩沖液或其組合。優選地,緩沖液是磷酸鹽緩沖液。進一步涉及在活化混合物中緩沖液的濃度為約10mm至約1m,優選約20mm至約500mm,更優選約50mm至約200mm,甚至更優選約70mm至約130mm,最優選約80mm至約120mm。進一步涉及反應混合物中的緩沖液濃度為約100mm或更低,優選約50mm或更低,更優選約20mm或更低,甚至更優選約10mm或更低,還更優選約5mm約1pm,還更優選約4mm至約1pm,還更優選約3mm至約1pm,還更優選約2mm至約1pm,還更優選約1mm至約1pm,還更優選約0.8mm至約1pm,還更優選約0.5mm至約1pm,還更優選約0.4mm至約1pm,還更優選約0.3mm至約1pm,還更優選約0.2mm至約1pm,最優選約0.1mm至約1pm。還包括活化的溫度在約0℃至約50℃,優選約10℃至約40℃,更優選約20℃至約37℃的范圍內。然而,本發明不僅包括方法,還包括以下用途。如本文所述的產生腈水合酶和酰胺酶的微生物用于從腈化合物生產酰胺化合物的用途。干燥方法用于提高產生腈水合酶和酰胺酶的微生物的腈水合酶/酰胺酶活性比的用途。干燥方法用于降低產生腈水合酶和酰胺酶的微生物的酰胺酶活性的用途。本文在本發明方法的上下文中描述的實施方案和定義在適當的變更下同樣適用于本發明的用途。在另一方面,本發明提供通過本發明的方法獲得的酰胺化合物水溶液。這種酰胺化合物水溶液優選特征在于,與從相同生物體(在與腈化合物接觸之前,所述相同生物體不通過干燥步驟預處理)獲得的酰胺化合物水溶液相比,具有降低的丙烯酸含量。具體地講,這種酰胺化合物水溶液的丙烯酸濃度為1500ppm或更低,優選為1200ppm或更低,更優選為1000ppm或更低,進一步優選為750ppm或更低,甚至更優選為500ppm或更低,還更優選為300ppm或更低,還更優選為200ppm或更低,并且最優選為100ppm或更低,其中ppm的指示各自涉及重量份數,并且各自基于酰胺化合物水溶液的總重量。此外,本發明提供了包含丙烯酰胺或聚丙烯酰胺和產生腈水合酶和酰胺酶的微生物的組合物,所述微生物當與參照微生物相比時,表現出至少400單位的腈水合酶/酰胺酶活性比率,和/或腈水合酶活性與酰胺酶活性的比率增加至少1.7倍。除非上下文另有要求,單數術語應包括復數并且復數術語應包括單數。如本文和所附權利要求中所使用的,單數形式“一種”、“一個”和“該”包括復數指示物,除非上下文另有明確指示。因此,例如提及“一種試劑”包括一種或多種這樣的不同試劑,并且提及“該方法”包括提及本領域普通技術人員已知的等價步驟和方法,其可以被本文所述的方法修飾或代替。如本文所使用的,多個所述要素之間的連接詞“和/或”被理解為包含單獨和組合的選項。例如,當兩個要素通過“和/或”連接時,第一個選項指的是采用沒有第二個要素的第一個要素。第二個選項指的是采用沒有第一個要素的第二個要素。第三種選項是指采用第一和第二要素一起。這些選項中的任一個被理解為落入該含義內,并且因此滿足本文所使用的術語“和/或”的要求。多于一個選項的同時采用也被理解為落入該含義內,并且因此滿足本文所使用的術語“和/或”的要求。除非另有說明,在一系列要素之前的術語“至少”應理解為是指該系列中的每個要素。本領域技術人員僅使用不超出常規的實驗就可確定或能夠確定本文所述的本發明的具體實施方案的許多等同物。本發明旨在包含這樣的等同物。在本說明書和隨后的權利要求書中,除非上下文另有要求,否則詞語“包含”及其變體如“包括”將被理解為暗示包括所述整體或步驟或整體或步驟的組,但不排除任何其它整體或步驟或整體或步驟的組。在本文中使用時,術語“包含”可以用術語“含有”替代或有時在本文中用術語“具有”替代。如本文所述,“優選實施方案”或“優選方面”是指“本發明的優選實施方案”或“本發明的優選方面”。同樣,如本文所述,“實施方案”、“另一個實施方案”、“一個方面”、“另一方面”分別是指“本發明的實施方案”、“本發明的另一個實施方案”、“本發明的一方面”和“本發明的另一方面”。除非本文另有定義,本發明使用的科學和技術術語具有本領域普通技術人員通常理解的含義。本發明的方法和技術通常根據本領域熟知的常規方法進行。本領域技術人員使用不超出常規的實驗就可確認或能夠確定本文所述的本發明的具體實施方案的許多等同物。本發明旨在包含這樣的等同物。在本說明書的整個文本中引用了幾個文獻。無論是上文還是下文,本文引用的每篇文獻(包括所有專利、專利申請、科學出版物、制造商的說明書、說明書等)都以引用整體的方式并入本文。本文中的任何內容不應被解釋為承認本發明由于引用以前的發明而沒有資格早于此類公開物。附圖說明圖1:在使用噴霧干燥的玫瑰色紅球菌ncimb41164作為生物催化劑將丙烯腈生物轉化為丙烯酰胺的生物轉化中,以w/w%計的丙烯酰胺(acm,以深灰色描繪)[%]和丙烯腈(acn,以淺灰色描繪)[%]濃度的時間過程。在噴霧干燥后,干燥的生物催化劑已經重新懸浮在水中。使用總量為3.36g的干燥生物催化劑(批次ch10),其在生物轉化開始之前具有測量為116ku/g的腈水合酶活性。反應在26℃下以4l規模(l=升)進行。在反應開始時,將對應于2.4g干燥生物催化劑的重懸生物催化劑加入到反應器中。通過向反應器中加入acn,在生物轉化開始0h至1h后,將acn濃度保持在2w/w%。在生物轉化開始1h后,將對應于0.96g干燥生物催化劑的重懸生物催化劑加入到反應器中。在生物轉化開始1h后,將acn濃度保持在0.8w/w%,直到將總量為1553g的丙烯腈加入到反應器中。直到完全轉化(殘余acn<100ppm)的總反應時間為13.78h。圖2:在使用噴霧干燥的玫瑰色紅球菌ncimb41164作為生物催化劑將丙烯腈轉化為丙烯酰胺的生物轉化中,以w/w%計的丙烯酰胺(acm,以深灰色描繪)[%]和丙烯腈(acn,以淺灰色描繪)[%]濃度的時間過程。在噴霧干燥后,干燥的生物催化劑已經重新懸浮在33ml的100mm磷酸鹽緩沖液(ph7.0)中,其對應于本文公開的活化步驟。活化步驟進行1.0h。使用總量為3.36g的干燥生物催化劑(批次ch10),其在生物轉化開始之前具有測量為116ku/g的腈水合酶活性。反應在26℃下以4l規模(l=升)進行。在反應開始時,將對應于2.4g干燥生物催化劑的重懸生物催化劑加入到反應器中。通過向反應器中加入acn,在生物轉化開始0h至1h后,將acn濃度保持在2w/w%。在生物轉化開始1h后,將對應于0.96g干燥生物催化劑的重懸生物催化劑加入到反應器中。在生物轉化開始1h后,將acn濃度保持在0.8w/w%,直到將總量為1553g的丙烯腈加入到反應器中。直到完全轉化(殘余acn<100ppm)的總反應時間為2.31h。圖3:在使用噴霧干燥的玫瑰色紅球菌ncimb41164作為生物催化劑將丙烯腈轉化為丙烯酰胺的生物轉化中,以w/w%計的丙烯酰胺(acm,以深灰色描繪)[%]和丙烯腈(acn,以淺灰色描繪)[%]濃度的時間過程。在噴霧干燥后,干燥的生物催化劑已經重新懸浮在水中。使用總量為3.36g的干燥生物催化劑(批次ch10),其在生物轉化開始之前具有測量為116ku/g的腈水合酶活性。反應在26℃下以4l規模(l=升)進行。在生物催化劑直接添加之前,將33ml的100mm磷酸鹽緩沖液(ph7.0)加入到反應器中,其對應于在圖2所示實驗的活化步驟中使用的緩沖液的量。在反應開始時,將對應于2.4g干燥生物催化劑的重懸生物催化劑加入到反應器中。通過向反應器中加入acn,在生物轉化開始0h至1h后,將acn濃度保持在2w/w%。在生物轉化開始1h后,將對應于0.96g干燥生物催化劑的重懸生物催化劑加入到反應器中。在生物轉化開始1h后,將acn濃度保持在0.8w/w%,直到將總量為1553g的丙烯腈加入到反應器中。直到完全轉化(殘余acn<100ppm)的總反應時間為11.98h。圖4:在使用噴霧干燥的玫瑰色紅球菌ncimb41164作為生物催化劑將丙烯腈轉化為丙烯酰胺的生物轉化中,以w/w%計的丙烯酰胺(acm,以深灰色描繪)[%]和丙烯腈(acn,以淺灰色描繪)[%]濃度的時間過程。干燥的生物催化劑已經重新懸浮在30ml的100mm磷酸鹽緩沖液(ph7.0)中,其對應于本文公開的活化步驟。活化步驟進行0.5h。使用總量為1.8g的干燥生物催化劑(批次ch10),其在生物轉化開始之前具有測量為116ku/g的腈水合酶活性。反應在23℃下以4l規模(l=升)進行。在反應開始時,將對應于1.8g干燥生物催化劑的重懸生物催化劑加入到反應器中。通過向反應器中加入acn,在生物轉化開始后,將acn濃度保持在1w/w%,直到將總量為1553g的丙烯腈加入到反應器中。直到完全轉化(殘余acn<100ppm)的總反應時間為7.13h。圖5:在使用噴霧干燥的玫瑰色紅球菌ncimb41164作為生物催化劑將丙烯腈轉化為丙烯酰胺的生物轉化中,以w/w%計的丙烯酰胺(acm,以深灰色描繪)[%]和丙烯腈(acn,以淺灰色描繪)[%]濃度的時間過程。干燥的生物催化劑已經重新懸浮在水中。使用總量為1.29g的干燥生物催化劑(批次v3),其在生物轉化開始之前具有測量為172ku/g的腈水合酶活性。反應在26℃下以4l規模(l=升)進行。在反應開始時,將對應于0.92g干燥生物催化劑的重懸生物催化劑加入到反應器中。通過向反應器中加入acn,在生物轉化開始0h至1h后,將acn濃度保持在2w/w%。在生物轉化開始1h后,將對應于0.37g干燥生物催化劑的重懸生物催化劑加入到反應器中。在生物轉化開始1h后,將acn濃度保持在0.8w/w%,直到將總量為1553g的丙烯腈加入到反應器中。20h后沒有達到完全轉化(殘余acn<100ppm)。圖6:在使用噴霧干燥的玫瑰色紅球菌ncimb41164作為生物催化劑將丙烯腈轉化為丙烯酰胺的生物轉化中,以w/w%計的丙烯酰胺(acm,以深灰色描繪)[%]和丙烯腈(acn,以淺灰色描繪)[%]濃度的時間過程。干燥的生物催化劑已經重新懸浮在30ml的100mm磷酸鹽緩沖液(ph8.0)中,其對應于本文公開的活化步驟。活化步驟進行0.5h。使用總量為1.29g的干燥生物催化劑(批次v3),其在生物轉化開始之前具有測量為172ku/g的腈水合酶活性。反應在26℃下以4l規模(l=升)進行。在反應開始時,將對應于0.92g干燥生物催化劑的重懸生物催化劑加入到反應器中。通過向反應器中加入acn,在生物轉化開始0h至1h后,將acn濃度保持在2w/w%。在生物轉化開始1h后,將對應于0.37g干燥生物催化劑的重懸生物催化劑加入到反應器中。在生物轉化開始1h后,將acn濃度保持在0.8w/w%,直到將總量為1553g的丙烯腈加入到反應器中。直到完全轉化(殘余acn<100ppm)的總反應時間為4.4h。圖7:在使用噴霧干燥的玫瑰色紅球菌ncimb41164作為生物催化劑將丙烯腈轉化為丙烯酰胺的生物轉化中,以w/w%計的丙烯酰胺(acm,以深灰色描繪)[%]和丙烯腈(acn,以淺灰色描繪)[%]濃度的時間過程。干燥的生物催化劑已經重新懸浮在30ml的100mm磷酸鹽緩沖液(ph7.0)中,其對應于本文公開的活化步驟。活化步驟進行0.5h。使用總量為1.29g的干燥生物催化劑(批次v3),其在生物轉化開始之前具有測量為172ku/g的腈水合酶活性。反應在26℃下以4l規模(l=升)進行。在反應開始時,將對應于0.92g干燥生物催化劑的重懸生物催化劑加入到反應器中。通過向反應器中加入acn,在生物轉化開始0h至1h后,將acn濃度保持在2w/w%。在生物轉化開始1h后,將對應于0.37g干燥生物催化劑的重懸生物催化劑加入到反應器中。在生物轉化開始1h后,將acn濃度保持在0.8w/w%,直到將總量為1553g的丙烯腈加入到反應器中。直到完全轉化(殘余acn<100ppm)的總反應時間為7.25h。實施例以下實施例進一步描述和舉例說明了本文提供的本發明,但不將本發明限制于其中限定的任何說明或實施方案。進行了由腈化合物制備酰胺化合物的三個實驗。用于生產的培養液是含有生物催化劑的發酵液、所述生物催化劑的濃縮物、噴霧干燥的生物催化劑或冷凍干燥的生物催化劑。濃縮物是在與將要轉化為酰胺化合物的所述腈化合物接觸之前通過干燥步驟進行預處理前的生物催化劑形式。濃縮物是指通過減少液體發酵液進行濃縮的發酵液,例如通過離心。因此,實施例中使用的發酵液、濃縮物和干粉含有相同的生物催化劑。根據通常已知的方法測定腈水合酶和酰胺酶之間的活性比率以及腈水合酶活性。在設置中的腈水合酶活性意味著所有設置包含相同量的生物催化劑,這是由幾乎相同的腈水合酶活性反映的。因此,發酵液、濃縮物和干粉的條件相同。此外,測定丙烯酸的濃度。這些數據總結在下表1中,以及生物轉化反應的結束。實施例1:將水和20gacn置于反應器中。調節水的量,使水+生物催化劑的總量為2447g。在獨立運行中使用三種不同形式的生物催化劑:(i)含有玫瑰色紅球菌ncimb41164的發酵液。水含量:88.2%(w/w)。(ii)濃縮物,其來自(i)已通過離心濃縮的發酵液。水含量:83.5%(w/w)。(iii)通過噴霧干燥來自(ii)的濃縮物獲得的干粉。干粉的殘余水含量:8.05%(w/w)。噴霧干燥在115℃氣體入口溫度和65℃氣體出口溫度下操作。將生物催化劑加入到反應器中,由此開始反應。在反應期間,加入1533g額外的丙烯腈,使得最終的總反應批料大小為4000g。在反應期間溫度保持恒定在26℃。通過在線ftir測量acn濃度,并調節acn的添加速率,使得反應混合物中的acn濃度保持恒定在0.8±0.1%(w/w),直到全部acn已經加入到反應中。由于轉化,當acn濃度已降至<100ppm后停止反應。在反應結束時,每次運行中的丙烯酰胺(acm)濃度為≥51%(w/w)。實施例2:將水和60gacn置于反應器中。調節水的量,使水+生物催化劑的總量為2447g。在獨立運行中使用三種不同形式的生物催化劑:(i)含有玫瑰色紅球菌ncimb41164的發酵液。水含量:91.8%(w/w)。(ii)濃縮物,其來自(i)已通過離心濃縮的發酵液。水含量:85.3%(w/w)。(iii)通過噴霧干燥來自(ii)的濃縮物獲得的干粉。干粉的殘余水含量:6.8%(w/w)。噴霧干燥在115℃氣體入口溫度和60℃氣體出口溫度下操作。將生物催化劑加入到反應器中,由此開始反應。在反應期間,加入1493g額外的丙烯腈,使得最終的總反應批料大小為4000g。在反應期間溫度保持恒定在26℃。通過在線ftir測量acn濃度,并調節acn的加入速率以控制反應混合物中的acn濃度。在反應的第一個小時期間,acn濃度保持恒定在2.0%±0.15%(w/w),此后,保持恒定在0.8%±0.15%(w/w)直到全部acn已經加入到反應中。由于轉化,當acn濃度已降至<100ppm后停止反應。在反應結束時,每次運行中的acm濃度為≥50%(w/w)。實施例3:將水和60gacn置于反應器中。調節水的量,使水+生物催化劑的總量為2447g。在獨立運行中使用兩種不同形式的生物催化劑:(i)濃縮物,其含有已通過離心濃縮的玫瑰色紅球菌ncimb41164的發酵液。水含量:81%(w/w)。(ii)通過冷凍干燥來自(i)的濃縮物獲得的干粉。干粉的殘余水含量:6.8%(w/w)。將生物催化劑加入到反應器中,由此開始反應。在反應期間,加入1493g額外的丙烯腈,使得最終的總反應批料大小為4000g。在反應期間溫度保持恒定在26℃。通過在線ftir測量acn濃度,并調節acn的加入速率以控制反應混合物中的acn濃度。在反應的第一個小時期間,acn濃度保持恒定在2.0%±0.15%(w/w),此后,保持恒定在0.8%±0.15%(w/w)直到全部acn已經加入到反應中。由于轉化,當acn濃度已降至<100ppm后停止反應。在反應結束時,每次運行中的acm濃度為≥50%(w/w)。表1顯然,在與腈化合物接觸之前通過干燥步驟預處理的微生物具有腈水合酶/酰胺酶活性的最高值,所述腈化合物隨后由所述微生物進行生物轉化。考慮到在每個反應(設置)中使用幾乎相同量的生物催化劑(通過使用的每種生物催化劑形式、即發酵液/濃縮物/噴霧干燥/冷凍干燥的腈水合酶活性而測定)的事實,顯然干燥步驟,即在將生物催化劑與腈化合物接觸之前使生物催化劑進行干燥步驟,可顯著影響副產物丙烯酸的量。這意味著由于干燥步驟,酰胺酶活性降低到這種干燥的微生物產生具有較少丙烯酸副產物的酰胺化合物的程度,這從最右側欄中可見。總之,由于在不同設置之間的反應參數保持相同,顯然減少丙烯酸量的改進可歸因于干燥步驟。實施例4:通過在christalpha2-4lscplus實驗室冷凍干燥器中冷凍干燥濃縮的發酵液得到凍干粉末。濃縮物首先在-20℃下冷凍過夜,隨后干燥。在干燥過程中,擱板溫度為-25℃,冷凝器溫度為-82℃,并且腔壓力為0.25mbar。將水和18gacn置于反應器中。調節水的量使得水+生物催化劑的總量為1835g。在獨立運行中使用兩種不同形式的生物催化劑:(i)含有玫瑰色紅球菌j1的發酵液。水含量:96.1%(w/w)。(ii)將(i)通過離心濃縮至含水量為83.6%(w/w)并冷凍干燥濃縮物而獲得的干粉。將生物催化劑加入到反應器中,由此開始反應。在反應期間,加入1147g額外的丙烯腈,使得最終的總反應批量大小為3000g。在反應期間溫度保持恒定在23℃。通過在線ftir測量acn濃度,并且調節acn的添加速率,使得反應混合物中的acn濃度保持恒定在1.0±0.1%(w/w),直到將全部acn加入到反應中。由于轉化,當acn濃度已降至<100ppm后停止反應。在反應結束時,每次運行中的acm濃度為≥51%(w/w)。實施例5:按照上述實施例4進行實驗,除了在反應期間反應混合物中的acn濃度控制在0.3±0.1%(w/w)。實施例4-5的結果如下表2中所示。表2實施例6:噴霧干燥的生物催化劑的活化在離心管中稱出噴霧干燥的生物催化劑并懸浮在30ml緩沖液中用于本文公開的活化步驟。除非另有說明,所述緩沖液是100mm磷酸鹽緩沖液,ph7.0。生物催化劑在室溫下緩沖處理0.5h。然后將生物質(生物催化劑)懸浮液轉移到反應器中并進一步溫育1h。在將該生物質懸浮液加入到反應器中后,用水沖洗離心管,并將溶劑也轉移到反應器中。該水的量被認為是稱重到反應器中的水。實施例7:生物轉化的一般方案丙烯腈的水合通常在攪拌釜反應器(rpm=250,體積v=4l)中進行,其具有用于冷卻的外部循環回路。為此目的,將2.4l水填充在反應器以及生物催化劑中。將生物質作為噴霧干燥的玫瑰色紅球菌細胞加入,其已經預先懸浮在水中。如本文所述,根據本文公開的活化步驟,噴霧干燥的細胞也可以直接懸浮在緩沖液中。為了開始反應,使用過程控制系統將丙烯腈加入攪拌釜反應器中。通過使用在線傅里葉變換紅外(ftir)分析來調節丙烯腈濃度恒定在0.5至5w/w%,所述ftir直接與過程控制單元(labview)相通。反應溫度恒定保持在20~29℃。在加入1553g丙烯腈之后停止丙烯腈的用量。在殘余丙烯腈完全轉化之后,即當達到<100ppm的殘余acn濃度并獲得52w/w%丙烯酰胺時,反應完成。實施例8:通過hplc測定所得丙烯酰胺水溶液中的丙烯酸、丙烯酰胺、丙烯酸和丙烯腈的濃度應用以下條件以測定丙烯酰胺、丙烯酸和丙烯腈的含量:梯度:時間[min]a[%]b[%]流速[ml/min]0.090.010.01.008.090.010.01.00基質:發酵液,生物轉化混合物樣品通過0.22μm過濾分析:保留時間[min]丙烯酰胺3.29丙烯酸3.91丙烯腈4.35實施例9噴霧干燥的批次ch10的玫瑰色紅球菌(ncimb41164)用于丙烯腈到丙烯酰胺的生物轉化反應。生物轉化反應根據實施例7的方法進行。在運行1(圖1所示)中,使用3.36g重懸于水中的生物催化劑(在生物轉化開始時加入2.4g生物催化劑,1h后加入0.96g生物催化劑)。在運行2(圖2所示)中,使用3.36g根據本發明的用100mm磷酸鹽緩沖液(ph7.0)活化的生物催化劑(在生物轉化開始時加入2.4g生物催化劑,在1h后加入0.96g生物催化劑)。根據實施例6進行活化。在運行3(圖3所示)中,使用3.36g重懸于水中的生物催化劑(在生物轉化開始時加入2.4g生物催化劑,在1h后加入0.96g生物催化劑),但是在加入生物催化劑之前,將在運行2的活化步驟中使用的相同量的磷酸鹽緩沖液直接加入到反應器中。在運行4(圖4所示)中,使用1.8g生物催化劑(在生物轉化開始時加入1.8g生物催化劑),其已經根據實施例6用100mm磷酸鹽緩沖液(ph7.0)緩沖處理。結果概述于下表中。從運行2(圖2)可以看出,使用磷酸鹽緩沖液的干燥生物催化劑的活化將總反應時間從13.78h(運行1,圖1)降低至2.31h。運行3(圖3)顯示,與運行1相比,向反應混合物中加入磷酸鹽緩沖液而不活化干燥的生物催化劑,對反應時間幾乎沒有影響。運行4(圖4)表明,如果干燥的生物催化劑使用磷酸鹽緩沖液活化,生物催化劑的量可以從3.36g降低至1.8g,而總反應時間仍小于在運行1中使用3.36g非緩沖液處理的生物催化劑。實施例10:噴霧干燥的批次v3的玫瑰色紅球菌(ncimb41164)用于丙烯腈到丙烯酰胺的生物轉化反應。生物轉化反應根據實施例7的方法進行。在運行5(如圖5所示)中,使用1.29g重懸于水中的生物催化劑(在生物轉化開始時加入0.92g生物催化劑,1h后加入0.37g生物催化劑)。在運行6(圖6所示)中,使用1.29g生物催化劑(在生物轉化開始時加入0.92g生物催化劑,在1h后加入0.37g生物催化劑),其如本文公開的用100mm磷酸鹽緩沖液(ph8.0)活化。在運行7(圖7所示)中,使用1.29g生物催化劑(在生物轉化開始時加入0.92g生物催化劑,在1h后加入0.37g生物催化劑),其用100mm檸檬酸鹽緩沖液(ph7.0)活化。結果概述于下表中。從運行6和7(圖6和7)可以看出,分別用磷酸鹽緩沖液(100mm,ph8.0)和檸檬酸鹽緩沖液(100mm,ph7.0)對批次v3的玫瑰色紅球菌(ncimb41164)進行活化步驟,導致總反應時間從20h后仍未完全轉化顯著減少到4.39h和7.25h后完全轉化。當前第1頁12
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1
- 噻唑橙苯乙烯類化合物作為G-四鏈體核酸熒光探針的制作方法與工藝
- 一種氟原子取代的氰基異佛爾酮苯乙烯化合物、晶體化合物及制備方法與流程
- 一種制備反式二苯基乙烯類化合物的方法與流程
- 一種二苯乙烯和二苯乙烷類化合物的磷酰氨基酸及其衍生物的制備與用途的制造方法與工藝
- 制備具有較少丙烯酸的酰胺化合物的手段和方法與流程
- 酸存在下丙烯酸系化合物的SET?LRP聚合的制造方法與工藝
- 一種二官能烯基苯氧基化合物及其制備方法和利用其改性的可溶性雙馬來酰亞胺樹脂與流程
- 二苯乙烯型化合物、其中間體、制備方法和應用與流程
- 一種基于四苯乙烯的熒光化合物及其制備方法和應用與制造工藝
- 基于二苯乙烯單元的樹枝狀化合物及有機電致發光器件的制造方法與工藝