糖液的制造方法與流程
本發明涉及由生物質制造可在發酵原料等中使用的糖液的方法。
背景技術:
以糖為原料的化學品的發酵生產工藝用于各種工業原料生產。作為成為該發酵原料的糖,現在工業上使用源自甘蔗、淀粉、甜菜等食用原料的糖。但是,從今后世界人口的增加帶來的食用原料價格高漲、或者與食用競爭的倫理的方面考慮,構建由可再生的非食用資源、即含纖維素生物質有效地制造糖液的工藝、或者以得到的糖液為發酵原料、有效地轉換成工業原料的工藝成為今后的課題。
作為由含纖維素生物質制造糖液的方法,除通過使用濃硫酸經酸將纖維素及半纖維素水解來制造糖液的方法以外,還已知通過用稀硫酸將含纖維素生物質水解后,進一步用纖維素酶等酶進行糖化處理來制造糖液的方法(非專利文獻1)。另外,公開了通過將含纖維素生物質用240~280℃的加壓熱水水解后,進一步用糖化酶進行糖化處理來制造糖液的方法(專利文獻1)。這些之中,近年來尤其廣泛研究能量使用量及環境負荷少、且糖產量多的使用糖化酶的生物質的水解方法。然而,由于使用糖化酶制造糖液的方法酶費用高,因而用于制造糖液的費用增高。
作為使用糖化酶制造糖液的方法中的前述技術課題的解決方法,提出了將水解中使用的糖化酶回收再利用的方法。例如公開了用旋轉過濾器連續進行固液分離,使得到的糖液通過超濾膜進行過濾而回收酶的方法(專利文獻2),通過在酶糖化的階段投入表面活性劑來抑制酶吸附,使酶的回收效率提高的方法(專利文獻3)等。另外,公開了通過在下次以后的糖化反應前使用回收的酶水解生物質,從而糖化反應時的酶回收率提高,能夠降低酶使用量的方法(專利文獻4)等。專利文獻4中,在實施例中回收酶與糖化反應中使用的酶是源自相同絲狀菌的酶,實施例中使用木霉。
現有技術文獻
專利文獻
專利文獻1:日本特許3041380號公報
專利文獻2:日本特開2006-87319號公報
專利文獻3:日本特開昭63-87994號公報
專利文獻4:國際公開第2011/115040號
非專利文獻
非專利文獻1:A.Aden等,“Lignocellulosic Biomass to Ethanol Process Design and Economics Utilizing Co-Current Dilute Acid Prehydrolysis and Enzymatic Hydrolysis for Corn Stover”NREL Technical Report(2002)
技術實現要素:
如上所述,開發了回收在含纖維素生物質的水解中使用的酶的方法,但在削減糖化酶的使用量的觀點上考慮,其效果依然不充分,尋求在由含纖維素生物質制造糖液時,在更有效地利用糖化酶的同時制造糖液的方法。
于是,本發明的課題在于,提供能夠使糖化酶的使用量的削減效果進一步提高的糖液的制造方法。
本發明包含以下[1]~[8]構成。
[1]糖液的制造方法,是來自含纖維素生物質的糖液的制造方法,包括以下工序:
工序(1):將含纖維素生物質用源自枝頂孢屬或曲霉屬微生物的木聚糖內切酶水解,獲得木聚糖內切酶水解物,
工序(2):將所述木聚糖內切酶水解物固液分離成木聚糖內切酶水解固體物和木聚糖內切酶水解液體,
工序(3):將所述木聚糖內切酶水解固體物用源自絲狀菌的纖維素酶水解,獲得纖維素酶水解物,及
工序(4):使所述纖維素酶水解物通過超濾膜而進行過濾,從透過液側回收糖液,從非透過液側回收酶成分。
[2]根據(1)所述的糖液的制造方法,所述含纖維素生物質是經選自堿處理、水熱處理及稀硫酸處理中的一種以上方法進行前處理而得的。
[3]根據(1)或(2)所述的糖液的制造方法,所述木聚糖內切酶的酶活性是80U/mg-蛋白以上。
[4]根據(1)~(3)中任一項所述的糖液的制造方法,所述木聚糖內切酶水解物的固液分離滿足以下關系式:
木聚糖內切酶水解固體物的重量<木聚糖內切酶水解液體的重量。
[5]根據(1)~(4)中任一項所述的糖液的制造方法,進一步包括使所述木聚糖內切酶水解液體通過超濾膜而進行過濾,從透過液側回收低聚木糖液,從非透過液側回收木聚糖內切酶的工序。
[6]根據(1)~(5)中任一項所述的糖液的制造方法,所述源自絲狀菌的纖維素酶源自木霉屬微生物。
[7]根據權利要求1~6中任一項所述的糖液的制造方法,工序(4)是使所述纖維素酶水解物固液分離而得的纖維素酶水解液體通過超濾膜而進行過濾,從透過液側回收糖液,從非透過液側回收酶成分的工序。
[8]根據(1)~(7)中任一項所述的糖液的制造方法,將所述酶成分作為工序(3)的源自絲狀菌的纖維素酶使用。
本發明中,在使含纖維素生物質進行糖化反應前,預先將含纖維素生物質用木聚糖內切酶水解,將所得的木聚糖內切酶水解物進行固液分離,從而獲得木聚糖內切酶水解固體物。通過將該木聚糖內切酶水解固體物用源自絲狀菌的纖維素酶水解而得的非透過液進行回收再利用,由此能夠在糖液的制造過程中使糖化酶的使用量的削減效果進一步提高。由此能夠將糖液的制造成本抑制得較低。
附圖說明
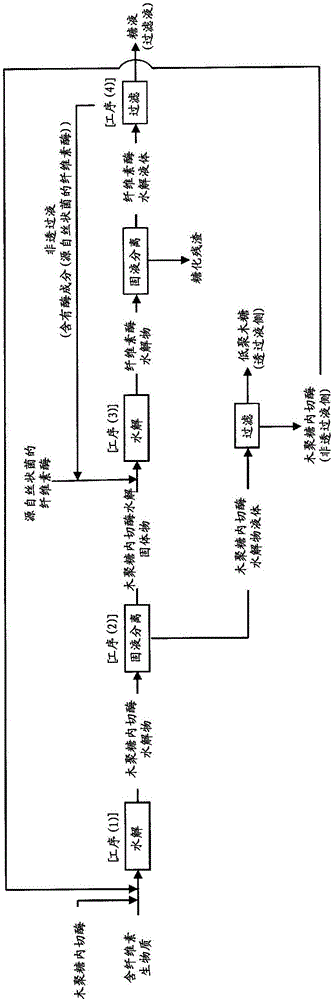
圖1是顯示本發明的糖液制造方法的圖。
圖2是顯示本發明的糖液的制造方法的另一例的圖。
具體實施方式
將本發明的糖液的制造方法示于圖1。對于本發明按各工序逐個地進行詳細說明。此外,本發明不限定于以下說明。
[工序(1)]
工序(1)是將含纖維素生物質用源自枝頂孢屬或曲霉屬微生物的木聚糖內切酶水解,獲得木聚糖內切酶水解物的工序。
工序(1)中使用的含纖維素生物質,是指至少包含纖維素的生物資源。作為含纖維素生物質的具體例,可以舉出甘蔗渣、玉米芯、柳枝稷、象草、蔗茅、玉米秸稈、稻秸、麥秸等草本系生物質、或樹木、廢建材等木質系生物質、由木質系生物質獲得的紙漿、以及藻類、海草等源自水生環境的生物質、玉米外皮、小麥外皮、大豆外皮、稻殼等谷物外皮生物質等,谷物皮類生物質、稻秸最有效,因而優選利用。
含纖維素生物質的水解是指以使纖維素或半纖維素低分子量化而生成單糖或寡糖為目的的水解。在本工序的利用木聚糖內切酶的含纖維素生物質的水解中,作為半纖維素成分的木聚糖被水解。在本發明中,所謂“木聚糖內切酶”,是通過與β-1,4鍵合的木糖主鏈作用而將半纖維素水解的酶,是分類成EC號3.3.1.8的酶。
在將含纖維素生物質通過木聚糖內切酶水解前,為了使水解效率提高,優選對含纖維素生物質進行前處理。由此,能夠使利用源自絲狀菌的纖維素酶的含纖維素生物質的水解效率提高。另外,當準備工序(1)時,可以購買預先進行了前處理的生物質前處理物使用,本發明中也包含這種方式。
作為含纖維素生物質的前處理方法,沒有特別限制,具體而言可以舉出酸處理、硫酸處理、稀硫酸處理、堿處理、苛性鈉處理、氨處理、水熱處理、亞臨界水處理、微粉碎處理、蒸煮處理等,但在本發明中,從后述工序(4)中高效地回收各種酶的觀點考慮,優選水熱處理、稀硫酸處理、堿處理。此外,所謂水熱處理,添加水使得生物質的固體物濃度為0.1~50重量%,然后在100~400℃的溫度下處理1秒~60分鐘。通過在這樣的溫度條件下進行處理,纖維素或半纖維素發生水解。特別是溫度優選為100℃~250℃的范圍,處理時間優選為5~30分鐘。對處理次數沒有特別限定,進行1次以上該處理即可。特別是進行2次以上該處理的情況下,可以在不同的條件下實施第1次和第2次以后的處理。所謂稀硫酸處理,是在水熱處理中添加硫酸的處理。硫酸的添加量優選每1g重量的含纖維素生物質添加0.1~150mg硫酸。所謂堿處理,是在常溫或水熱處理中每1g重量的含纖維素生物質添加0.1~150mg堿的處理。作為使用的堿,可以使用氫氧化鈉、氫氧化鈣、氨等。另外,可以在前處理后通過固液分離除去酸及堿。
本工序中,將源自枝頂孢屬(Aremonium)或曲霉屬(Aspergillus)微生物的木聚糖內切酶用于水解。作為木聚糖內切酶,可以是由為了生產木聚糖內切酶而培養了一定時間的培養液通過柱等純化而得的酶,也可以通過制備編碼木聚糖內切酶的氨基酸序列的DNA,將其與表達載體連接,在宿主中導入表達載體,作為異種或同種蛋白質生產,進行分離及純化,由此獲得。編碼氨基酸序列的密碼子使用頻率可以與枝頂孢屬或曲霉屬相同,也可以根據宿主的密碼子使用頻率變更。
作為枝頂孢屬,沒有特別限定,有互生枝頂孢(Acremonium alternatum)、彎曲枝頂孢(Acremonium curvulum)、桃色枝頂孢(Acremonium persicinum)、瑞塞菲枝頂孢(Acremonium recifei)、直立枝頂孢(Acremonium strictum)、解纖維素枝頂孢(Acremonium cellulolyticus)等。
作為曲霉屬,沒有特別限定,可以舉出棘孢曲霉(Aspergillus aculeatus)、棒曲霉(Aspergillus clavatus)、黑曲霉(Aspergillus niger)、米曲霉(Aspergillus oryzae)。
作為枝頂孢屬的木聚糖內切酶,只要含有木聚糖內切酶,就沒有特別限制,可以舉出從Meiji Seikaファルマ株式會社銷售的“アクレモニウムセルラーゼ”純化木聚糖內切酶而得的純化酶。另外,作為曲霉屬的木聚糖內切酶,只要含有木聚糖內切酶,就沒有特別限制,可以舉出エイチビィアイ株式會社銷售的“セルロシンHC100”等。
作為木聚糖內切酶的活性,以樺木木聚糖(Birch wood xylan)為底物,在1分鐘生成1μmol的木糖生成的酶量為1U。在活性測定中,可以使用二硝基水楊酸法(DNS法),測定540nm的吸光度,由此測定反應后的反應液所含的還原糖量,通過預先使用已知的木糖測定的標準曲線求得還原糖量。活性測定的條件由樺木木聚糖1%、50℃、pH5、10分鐘的反應求得。
作為利用木聚糖內切酶的水解的反應條件,只要依據木聚糖內切酶的優選反應條件進行,就沒有限定,作為木聚糖內切酶的活性,如果活性低,則木聚糖內切酶添加量增多,經濟性變差,因而優選使用木聚糖酶活性高的酶。具體而言,優選每1mg重量酶80U以上的木聚糖內切酶,進一步優選為每1mg重量酶80~10,0000U的木聚糖內切酶。
作為木聚糖內切酶的添加量,沒有特別限制,優選每1g重量生物質添加木聚糖內切酶0.05mg以上,進一步優選添加0.1mg以上。作為添加木聚糖內切酶進行水解的反應時間,沒有特別限制,優選為1~48小時,進一步優選為4~24小時。使用源自枝頂孢屬或曲霉屬微生物的木聚糖內切酶時,通常的反應溫度優選15~100℃的范圍,更優選40~60℃,進一步優選50℃。水解的pH優選pH3~9的范圍,更優選pH4~5.5,進一步優選pH5。此外,pH調節可以添加酸或堿至所希望的pH來調節,另外,可以適當使用緩沖液。此外,為了促進含纖維素生物質與糖化酶的接觸,還為了使水解物的糖濃度均勻,水解物優選進行攪拌混合,加水使得纖維素的固體成分濃度優選為1~25重量%、更優選為5~20重量%的范圍。
[工序(2)]
工序(2)是將所述木聚糖內切酶水解物固液分離成木聚糖內切酶水解固體物和木聚糖內切酶水解液體的工序。
對固液分離的方法沒有特別限定,可以通過螺旋沉降機等的離心分離、壓濾等的膜分離、利用壓帶、帶式過濾、自然沉降的分離、或網篩、無紡布及濾紙等過濾法等進行固液分離。
對通過固液分離而分離的液體、固體的量沒有特別限制,在獲得提高后述的工序(4)中來自非透過液側的酶成分的回收量的效果、而且進行木聚糖內切酶的回收及后述的低聚木糖回收上考慮,木聚糖內切酶水解物的固液分離的操作條件優選以滿足以下關系式的方式設定條件。
木聚糖內切酶水解固體物的重量<木聚糖內切酶水解液體的重量
在木聚糖內切酶水解液體中,通過木聚糖內切酶的作用而含纖維素生物質中的木聚糖水解,結果生成低聚木糖。另一方面,由于纖維素不受木聚糖酶水解,因此大部分以未分解的狀態在木聚糖內切酶水解固體物中存在。
木聚糖內切酶水解液體可以通過超濾膜進行過濾。可以使木聚糖內切酶水解液體通過超濾膜,在超濾膜的非透過液側回收木聚糖內切酶,在超濾膜的透過液側回收低聚木糖。此時,可以通過用水、鹽水洗滌木聚糖內切酶水解固體物而獲得回收了酶的洗滌液,將該洗滌液與木聚糖內切酶水解液體混合。另外,在超濾膜的非透過側回收的木聚糖內切酶能夠在工序(1)的含纖維素生物質的水解中再利用。由于低聚木糖具有調整腸道作用,因此作為特定保健用食品被認可,是價值高的寡糖。
本工序中使用的超濾膜及其過濾方法與后述的工序(4)的過濾工序的超濾膜及其過濾方法是同樣的。
[工序(3)]
工序(3)是將所述木聚糖內切酶水解固體物用源自絲狀菌的纖維素酶水解,獲得纖維素酶水解物的工序。
所謂利用源自絲狀菌的纖維素酶的木聚糖內切酶水解固體物的水解,是以使木聚糖內切酶水解固體物中的纖維素低分子量化,生成單糖或寡糖為目的的水解。木聚糖內切酶水解固體物的水解中,甘露聚糖、阿拉伯聚糖、及不能被木聚糖內切酶水解完全分解的木聚糖等半纖維素成分也同時被水解。本工序中,為了將木聚糖內切酶水解固體物水解,使用源自絲狀菌的纖維素酶作為糖化酶。
源自絲狀菌的纖維素酶是包含纖維二糖水解酶、內切葡聚糖酶、外切葡聚糖酶、β葡萄糖苷酶、木聚糖內切酶、木糖苷酶等多種酶成分,具有將纖維素水解糖化的活性的酶組合物。源自絲狀菌的纖維素酶包含這樣多種酶成分,因此在纖維素分解中可以通過多種酶成分的協同效果或補充效果而有效地進行纖維素的水解。
作為源自絲狀菌的纖維素酶,可以例示源自木霉屬(Trichoderma)、曲霉屬(Aspergillus)、纖維單胞菌屬(Cellulomonas)、梭菌屬(Clostridium)、鏈霉菌屬(Streptomyces)、腐質霉屬(Humicola)、枝頂孢屬(Acremonium)、耙齒菌屬(Irpex)、毛霉屬(Mucor)、籃狀菌屬(Talaromyces)、平革菌(Phanerochaete)屬、白腐菌、褐腐菌等微生物的纖維素酶。另外,可以為源自通過對這些微生物用誘變劑或紫外線照射等實施突變處理而纖維素酶生產性提高了的突變株的纖維素酶。這些源自絲狀菌的纖維素酶中,優選在纖維素水解中使用在培養液中大量生產比活性高的酶成分的源自木霉屬的纖維素酶。
所謂源自木霉屬的纖維素酶,是以源自木霉屬微生物的纖維素酶為主成分的酶組合物。對木霉屬微生物沒有特別限定,優選里氏木霉(Trichoderma reesei),具體而言,可以例示里氏木霉QM9414(Trichoderma reesei QM9414)、里氏木霉QM9123(Trichoderma reesei QM9123)、里氏木霉RutC-30(Trichoderma reesei Rut C-30)、里氏木霉PC3-7(Trichoderma reesei PC3-7)、里氏木霉CL-847(Trichoderma reeseiCL-847)、里氏木霉MCG77(Trichoderma reesei MCG77)、里氏木霉MCG80(Trichoderma reesei MCG80)、綠色木霉QM9123(Trichoderma viride9123)。
纖維二糖水解酶是以從纖維素的末端部分開始水解、釋放纖維二糖為特征的纖維素酶的總稱,作為EC號:EC3.2.1.91記載了歸屬于纖維二糖水解酶的酶群。
內切葡聚糖酶是以從纖維素分子鏈的中央部分開始水解為特征的纖維素酶的總稱,作為EC號:EC3.2.1.4、EC3.2.1.6、EC3.2.1.39、EC3.2.1.73記載了歸屬于內切葡聚糖酶的酶群。
外切葡聚糖酶是以從纖維素分子鏈的末端開始水解為特征的纖維素酶的總稱,作為EC號:EC3.2.1.74、EC3.2.1.58記載了歸屬于外切葡聚糖酶的酶群。
β葡萄糖苷酶是以水解纖維寡糖或纖維二糖為特征的纖維素酶的總稱,作為EC號:EC3.2.1.21記載了歸屬于β葡萄糖苷酶的酶群。
木糖苷酶是以與低聚木糖作用為特征的纖維素酶的總稱,作為EC號:EC3.2.1.37記載了歸屬于木糖苷酶的酶群。
這樣源自絲狀菌的纖維素酶所含的酶,可以通過凝膠過濾、離子交換、二維電泳等公知方法進行分離,對分離而得的成分的氨基酸序列進行分析(N末端分析、C末端分析、質量分析),通過與數據庫的比較而鑒定。
另外,源自絲狀菌的纖維素酶的酶活性可以通過Avicel(微晶纖維素)分解活性、木聚糖分解活性、羧甲基纖維素(CMC)分解活性、纖維二糖分解活性、甘露聚糖分解活性等多糖的水解活性進行評價。顯示Avicel(微晶纖維素)分解活性的主要的酶是具有從纖維素末端部分開始水解的特征的纖維二糖水解酶或外切葡聚糖酶。顯示木聚糖分解活性的主要的酶是木聚糖酶、β-木糖苷酶。參與CMC分解活性的主要的酶是纖維二糖水解酶、外切葡聚糖酶、內切葡聚糖酶。顯示纖維二糖分解活性的主要的酶是β-葡萄糖苷酶。在此,所謂“主要”的含義是來自已知最參與分解的表達,意味著除此以外的酶成分也參與其分解。
由于絲狀菌在培養液中產生纖維素酶,因此可以將其培養液直接作為粗酶劑使用,也可以通過公知的方法純化酶群,將制劑化而得的物質作為源自絲狀菌的纖維素酶混合物使用。以純化源自絲狀菌的纖維素酶、制劑化而得的物質的形式使用的情況下,可以將添加了蛋白酶抑制劑、分散劑、溶解促進劑、穩定劑等除酶以外的物質的制劑作為纖維素酶制劑使用。
在本發明中,作為源自絲狀菌的纖維素酶,優選使用粗酶物。粗酶物源自在為了使絲狀菌產生纖維素酶而調制的培養基中將該微生物培養任意時間而得的培養上清。對使用的培養基成分不特別限定,但是為了促進纖維素酶的產生,一般可以使用添加了纖維素的培養基。而且,作為粗酶物,優選直接使用培養液、或使用僅除去了菌體的培養上清。
對粗酶物中的各酶成分的重量比沒有特別限定,例如,源自里氏木霉的培養液中含有50~95重量%的纖維二糖水解酶,其余成分包含內切葡聚糖酶、β葡糖苷酶等。此外,木霉屬的微生物在培養液中產生強的纖維素酶成分,另一方面由于β葡糖苷酶保持在細胞內或細胞表層,因而培養液中的β葡糖苷酶活性低,因此可以在粗酶物中進一步添加異種或同種的β葡糖苷酶。作為異種的β葡糖苷酶,可以優選使用源自曲霉屬的β葡糖苷酶。作為源自曲霉屬的β葡糖苷酶,可以例示出由ノボザイム社市售的“Novozyme188”等。作為向粗酶物中添加異種或同種的β葡糖苷酶的方法,可以是培養以向木霉屬的微生物導入基因使其在其培養液中產生β葡糖苷酶的方式進行基因重組而得的木霉屬的微生物,分離其培養液的方法。
作為利用源自絲狀菌的纖維素酶的水解的反應條件,只要依據源自絲狀菌的纖維素酶的優選反應條件進行,就沒有限定,但在本發明中,使用源自絲狀菌的纖維素酶時,通常反應溫度優選15~100℃的范圍,更優選40~60℃,進一步優選50℃左右。
對于水解反應時木聚糖內切酶水解固體物的pH,由于在源自絲狀菌的纖維素酶的最適pH下利用源自絲狀菌的纖維素酶的水解的效果最高,因此,在本發明中,纖維素酶處理時的pH優選3~9的范圍,更優選4~5.5,進一步優選5左右。
此外,由于在水解的過程中pH發生變化,因此,pH調節優選使用酸或堿調節到所希望的pH。另外,pH調節可以適當在水解物中使用緩沖液。作為酸,例如可以舉出鹽酸、硫酸、硝酸、磷酸等,從不易引起本發明所得的糖液在發酵時的抑制的觀點考慮,優選使用硫酸、硝酸、磷酸,從經濟性的觀點考慮,更優選使用硫酸。作為堿,從經濟性的觀點考慮,優選使用氨、氫氧化鈉、氫氧化鈣和包含它們的水溶液,從抑制在后述的行程(4)中進行膜分離時發生膜污垢的觀點考慮,更優選使用作為1價離子的氨、氫氧化鈉,從不易引起發酵時的抑制的觀點考慮,進一步優選使用氨。
此外,為了促進木聚糖內切酶水解固體物與糖化酶的接觸,并且使水解物的糖濃度均勻,優選將木聚糖內切酶水解固體物和糖化酶一邊攪拌一邊混合。
加水使得纖維素的固體成分濃度優選為1~25重量%、更優選為5~20重量%的范圍。
[工序(4)]
工序(4)是使所述纖維素酶水解物通過超濾膜而進行過濾,從透過液側回收糖液,從非透過液側回收酶成分的工序。作為非透過液回收的酶成分也可以在工序(3)中再利用,從而可降低工序(3)中的酶成分的使用量。
本發明中使用的超濾膜可以使用具有能夠透過作為單糖的葡萄糖(分子量180)、木糖(分子量150)、能夠阻擋源自絲狀菌的纖維素酶的截留分子量的超濾膜。在本發明中,超濾膜的截留分子量只要為500~50,000的范圍即可,從將酶反應中顯示抑制作用的夾雜物質與酶分離的觀點考慮,更優選為5,000~50,000的范圍,進一步優選為10,000~30,000的范圍。
其中,超濾膜的孔徑過小而難以通過電子顯微鏡等測量膜表面的細孔徑,因而以截留分子量的值代替平均細孔徑作為孔徑大小的指標。此外,截留分子量是指以溶質的分子量為橫軸、以阻擋率為縱軸將數據進行作圖時,阻擋率為90%的分子量。
作為超濾膜的材料,可以使用聚醚砜(PES)、聚砜(PS)、聚丙烯腈(PAN)、聚1,1-二氟乙烯(PVDF)、再生纖維素、纖維素、纖維素酯、磺化聚砜、磺化聚醚砜、聚烯烴、聚乙烯醇、聚甲基丙烯酸甲酯、聚四氟乙烯等。在本發明中,作為使用的超濾膜的材質,再生纖維素、纖維素、纖維素酯受纖維素酶分解,因而優選使用以PES、PVDF等合成高分子為材料的超濾膜。
作為超濾膜的過濾方式,有死端過濾、錯流過濾等,但從抑制膜污垢、流量的觀點出發,優選錯流過濾。
作為超濾膜的膜形態,可以使用平膜型、螺旋型、管狀型、中空絲型等適宜的形態。具體而言,可舉出DESAL社的G-5型、G-10型、G-20型、G-50型、PW型、HWSUF型,KOCH社的HFM-180、HFM-183、HFM-251、HFM-300、HFK-131、HFK-328、MPT-U20、MPS-U20P、MPS-U20S,Synder社的SPE1、SPE3、SPE5、SPE10、SPE30、SPV5、SPV50、SOW30,旭化成株式會社制的マイクローザ(注冊商標)UF系列的相當于截留分子量3,000~10,000的膜,日東電工株式會社制的NTR7410、NTR7450等。
作為過濾方法,可以優選使用壓濾、真空過濾、離心過濾等。另外,作為過濾操作,可以舉出定壓過濾、定流量過濾、非定壓非定流量過濾等。過濾操作可以是將上述超濾膜使用兩次以上的多段過濾。
工序(4)中回收的非透過液作為酶成分包含源自絲狀菌的纖維素酶,因此,通過將回收的包含源自絲狀菌的纖維素酶的非透過液與工序(3)中使用的源自絲狀菌的纖維素酶混合,能夠作為工序(3)的源自絲狀菌的纖維素酶使用。由此能夠降低工序(3)中新使用的源自絲狀菌的纖維素酶的量,因此,能夠實現降低源自絲狀菌的纖維素酶的費用。
這樣,根據本發明的糖液的制造方法,在使含纖維素生物質進行糖化反應之前,預先用木聚糖內切酶水解含纖維素生物質,將得到的木聚糖內切酶水解物固液分離,生成木聚糖內切酶水解固體物。通過將該木聚糖內切酶水解固體物用源自絲狀菌的纖維素酶水解而得的非透過液進行回收再利用,能夠在糖液的制造過程中使作為糖化酶的源自絲狀菌的纖維素酶的使用量的削減效果進一步提高。另外,通過將木聚糖內切酶水解物固液分離而得的木聚糖內切酶水解液體進行過濾,能夠回收低聚木糖,并且能夠回收木聚糖內切酶。得到的木聚糖內切酶能夠在含纖維素生物質的水解中再利用,因此,能夠在削減含纖維素生物質、特別是半纖維素成分的水解中使用的木聚糖內切酶的使用量的同時制造糖液。所以,本發明的糖液的制造方法能夠在將糖化酶回收再利用的同時制造糖液,因此能夠將糖液的制造成本抑制的較低。
(其它方式)
在本發明中,對于將在工序(4)中過濾纖維素酶水解物而得的非透過液、與工序(3)的源自絲狀菌的纖維素酶混合的情況進行了說明,但不限定于此。將本發明的糖液的制造方法的另一例示于圖2。如圖2所示,例如將工序(3)中得到的纖維素酶水解物固液分離,分離成含有糖的溶液(纖維素酶水解液體)、和作為固體成分的糖化殘渣。在工序(4)中,將得到的纖維素酶水解液體用超濾膜進行過濾,分離成包含源自絲狀菌的纖維素酶的非透過液、和作為透過液的糖液。由此,在回收包含源自絲狀菌的纖維素酶的非透過液的同時,作為透過液回收糖液。回收的非透過液可以與工序(3)中使用的源自絲狀菌的纖維素酶混合而再利用。所以,預先將纖維素酶水解物固液分離,除去纖維素酶水解物中的固體成分,由此能夠在工序(4)中高效地進行纖維素酶水解物所含的源自絲狀菌的纖維素酶的回收。由此,可在進一步使源自絲狀菌的纖維素酶的回收率提高的同時制造糖液。
固液分離的方法與工序(2)同樣,可以通過螺旋沉降機等的離心分離、壓濾等的膜分離、利用壓帶、帶式過濾、自然沉降的分離、或網篩、無紡布及濾紙等過濾法進行固液分離。其中,優選使用螺旋沉降機、壓濾、壓帶等過濾法。根據這些過濾方法,獲得不溶性的固體少、混濁少的溶液成分。如果混濁少,則在工序(4)中抑制超濾膜的污垢,因而優選。
另外,優選將固液分離而得的纖維素酶水解液體進一步通過精密過濾膜進行過濾。由于通過將纖維素酶水解液體用精密過濾膜進行過濾,能夠除去在固液分離中沒有完全分離的固體成分,因此,能夠在工序(4)中更加高效地進行纖維素酶水解物所含的源自絲狀菌的纖維素酶的回收。
精密過濾膜是平均細孔徑為0.01μm~5mm的膜。作為材質,只要是除去上述固液分離中沒有完全分離的固體成分的材質,就沒有特別限定,可以舉出纖維素、纖維素酯、聚砜、聚醚砜、聚氯乙烯、聚丙烯、聚烯烴、聚乙烯醇、聚甲基丙烯酸甲酯、聚1,1-二氟乙烯、聚四氟乙烯等有機材料、或不銹鋼等金屬、或陶瓷等無機材料。
如上,本發明中得到的糖液能夠用于食品原料、藥品原料、化學品等的發酵原料等各種各樣的用途。通過本發明而得的糖液作為發酵原料使用,使具有生產化學品的能力的微生物生長,由此能夠制造各種化學品。此外,所謂使微生物生長,是指將糖液所含的糖成分或氨基源作為微生物的營養素利用,進行微生物的增殖、生長維持。作為化學品的具體例,可以舉出醇、有機酸、氨基酸、核酸等在發酵工業中大量生產的物質。這樣的化學品以糖液中的糖成分為碳源,在其代謝過程中在生物體內外以化學品形式蓄積生產。作為可通過微生物生產的化學品,例如可以舉出乙醇、丙醇、丁醇、1,3-丙二醇、1,4-丁二醇、甘油等醇、乙酸、乳酸、丙酮酸、琥珀酸、蘋果酸、衣康酸、檸檬酸等有機酸、肌苷、鳥苷等核苷、肌苷酸、鳥苷酸等核苷酸、尸胺等胺化合物。并且,通過本發明的糖液的制造方法而得的糖液也可應用于酶、抗生素、重組蛋白質等的生產。作為用于這樣的化學品的制造的微生物,只要是能有效地生產目標化學品的微生物即可,可以使用大腸桿菌、酵母、絲狀菌、擔子菌等微生物。
實施例
以下舉出實施例來具體地說明本發明。但是,本發明不受這些實施例限定。
(參考例1)源自絲狀菌的纖維素酶(培養液)的制備
源自絲狀菌的纖維素酶(培養液)按下面的方法制備。
[預培養]
以玉米浸漬液25%(w/vol)、葡萄糖2%(w/vol)、酒石酸銨0.37%(w/vol)、硫酸銨0.14(w/vol)、磷酸二氫鈣0.2%(w/vol)、氯化鈣二水合物0.03%(w/vol)、硫酸鎂七水合物0.03%(w/vol)、氯化鋅0.02%(w/vol)、氯化鐵(Ⅲ)六水合物0.01%(w/vol)、硫酸銅(Ⅱ)五水合物0.004%(w/vol)、氯化錳四水合物0.0008%(w/vol)、硼酸0.0006%(w/vol)、及七鉬酸六銨四水合物0.0026%(w/vol)的方式添加到蒸餾水中,將含有上述各成分的蒸餾水100mL倒入500mL帶擋板的三角燒瓶中,在121℃的溫度下高壓釜滅菌15分鐘。放冷后,將與其分開地分別在121℃的溫度下高壓釜滅菌了15分鐘的PE-M和Tween80分別以0.01%(w/vol)添加到上述500mL帶擋板的三角燒瓶中。在該預培養培養基中以1×105個/mL的方式接種里氏木霉ATCC66589,用振蕩裝置(TAITEC社制BIO-SHAKER BR-40LF)在28℃的溫度下以180rpm振蕩培養72小時,作為預培養。
[主培養]
以玉米浸漬液5%(w/vol)、葡萄糖2%(w/vol)、纖維素(Avicel)10%(w/vol)、酒石酸銨0.37%(w/vol)、硫酸銨0.14%(w/vol)、磷酸二氫鈣0.2%(w/vol)、氯化鈣二水合物0.03%(w/vol)、硫酸鎂七水合物0.03%(w/vol)、氯化鋅0.02%(w/vol)、氯化鐵(Ⅲ)六水合物0.01%(w/vol)、硫酸銅(Ⅱ)五水合物0.004%(w/vol)、氯化錳四水合物0.0008%(w/vol)、硼酸0.0006%(w/vol)、及七鉬酸六銨四水合物0.0026%(w/vol)的方式添加到蒸餾水中,將包含上述各成分的蒸餾水2.5L倒入5L容量的攪拌罐(ABLE社制,DPC-2A)容器中,在121℃的溫度下高壓釜滅菌15分鐘。放冷后,將與其分開地分別在121℃的溫度下高壓釜滅菌了15分鐘的PE-M和Tween80分別以0.01%添加。接種預先用前述方法在液體培養基中進行了預培養的里氏木霉ATCC66589 250mL。其后,在28℃的溫度下以87小時、300rpm、通氣量1vvm的條件進行振蕩培養,離心分離。其后,將上清進行膜過濾(ミリポア社制的Stericup-GV,材質:PVDF)。將在該前述條件下調整的培養液作為源自絲狀菌的纖維素酶在以下的實施例中使用。
(參考例2)源自絲狀菌的纖維素酶的活性的測定方法
對于源自絲狀菌的纖維素酶的酶活性,作為參與纖維素分解的酶群的活性,作為纖維二糖、內切葡聚糖酶的活性通過以下所示的方法測定評價(1)4-硝基苯基-β-D-吡喃乳糖苷(pNP-Lac)的分解活性,作為β葡萄糖苷酶的活性通過以下所示的方法測定評價(2)4-硝基苯基-β-D-吡喃葡萄糖苷(pNP-Glc)的分解活性,作為參與半纖維素的主成分木聚糖的分解的木聚糖內切酶、木糖苷酶的活性通過以下所示的方法測定評價(3)4-硝基苯基-β-D-吡喃木糖苷(pNP-Xyl)的分解活性。此外,將上述(1)~(3)的底物總稱為pNP-糖。
在分別以1mM的濃度包含各底物的100mM乙酸緩沖液(pH5.0)0.9mL中加入0.1mL酶液,在30℃下使其進行反應。對于反應時間,底物是pNP-Lac的情況下為60分鐘,pNP-Glc的情況下為10分鐘,pNP-Xyl的情況下為30分鐘,反應后添加0.1mL的2M碳酸鈉水溶液使反應停止,測定405nm下的吸光度(ODtest)。對于在底物溶液中依次添加2M碳酸鈉水溶液、酶液而得的樣品也同樣測定405nm下的吸光度(ODblank)作為空白。將在上述反應體系中1分鐘生成1μmol的4-硝基苯酚的酶量定義為1U,按照下述式計算出活性值(U/mL)。此外,上述反應體系中的4-硝基苯酚的毫摩爾分子吸光系數為17.2L/mmol/cm。
pNP-Lac分解活性(U/mL)={(ODtest-ODblank)×1.1(mL)×酶稀釋倍率}/{17.2×60(分鐘)×0.1(mL)}
pNP-Glc分解活性(U/mL)={(ODtest-ODblank)×1.1(mL)×酶稀釋倍率}/{17.2×10(分鐘)×0.1(mL)}
pNP-Xyl分解活性(U/mL)={(ODtest-ODblank)×1.1(mL)×酶稀釋倍率}/{17.2×60(分鐘)×0.1(mL)}。
(參考例3)含纖維素生物質的制備
在甘蔗渣干燥重量100g混合9.3g的苛性鈉,121℃使其反應30分鐘,制備堿處理甘蔗渣。
(參考例4)源自枝頂孢的純化木聚糖內切酶的制備
將Meiji Seikaファルマ株式會社銷售的“アクレモニウムセルラーゼ”用以下方法純化而得的酶作為源自枝頂孢屬的純化木聚糖內切酶。
[餾分1、2的制備]
1)使粗酶吸附于強堿性陰離子交換色譜:QAE-TOYOPEARL 550C(東曹(株)),分餾用乙酸緩沖液(0.02M,pH5.5)溶出的木聚糖酶活性餾分。
2)用0.02M乙酸緩沖液(pH6.0)使上述1)的分餾餾分吸附于弱堿性離子交換色譜:DEAE-TOYOPEARL 650S(東曹(株)),分餾用乙酸緩沖液(0.02M,pH5.5)溶出的木聚糖酶活性餾分。
3)用乙酸緩沖液(0.1M,pH3.5)使上述2)的分餾餾分吸附于強酸性離子交換色譜:Mono S(ファルマシア社),進行在乙酸緩沖液(0.1M,pH3.5)中含有0~0.05M的NaCl的線性梯度溶出,分餾顯示木聚糖酶活性的餾分。回收僅顯示木聚糖酶活性的兩種餾分(餾分1,餾分2)。
[餾分3、4、5的制備]
4)用含有0.1M的NaCl的乙酸緩沖液(0.05M,pH3.5)使上述3)的餾分1通過凝膠過濾色譜:Superdex 75(ファルマシア社),分餾木聚糖酶活性餾分(餾分3)。
5)用含有0.1M的NaCl的乙酸緩沖液(0.05M、pH3.5)使上述3)的分餾餾分2通過凝膠過濾色譜:Superdex 75(ファルマシア社),分餾兩種木聚糖酶活性餾分(餾分4、餾分5)。
通過以上的方法,用SDS-聚丙烯酰胺凝膠電泳高度純化餾分3、餾分4、及餾分5直到顯示單一的蛋白質染色帶。將餾分3、餾分4、及餾分5混合作為純化木聚糖內切酶。以樺木木聚糖(Birchwood xylan)為底物,在50℃、pH5、10分鐘的反應后,使用二硝基水楊酸法(DNS法),測定540nm的吸光度,由此測定反應后反應液所含的還原糖量,結果木聚糖內切酶的活性為100U/mg。
(參考例5)糖濃度的測定
對于糖液所含的葡萄糖及木糖的各濃度,用下述所示的高效液相色譜(High performance liquid chromatography:HPLC條件)通過與標準品的比較進行定量。
(HPLC條件)
柱:Shodex SH1011(昭和電工株式會社制)
流動相:硫酸5mM(流速0.6mL/分鐘)
反應液:無
檢測方法:RI(差示折射率)
溫度:65℃。
(實施例1)源自枝頂孢屬微生物的木聚糖內切酶的使用
[工序(1)]
在參考例3中制備的堿處理甘蔗渣1g中添加19g水,調整到固體成分濃度5%。在制備的含纖維素生物質中添加參考例4中制備的源自枝頂孢屬微生物的木聚糖內切酶進行水解。對于源自枝頂孢屬微生物的木聚糖內切酶的添加量,添加0.1mg/g的前處理物,用鹽酸調整到pH為5,進行木聚糖內切酶水解。木聚糖內切酶水解在50℃下進行24小時反應。
[工序(2)]
木聚糖內切酶反應后,用12目的不銹鋼制濾網進行固液分離,回收木聚糖內切酶水解液體10g、木聚糖內切酶水解固體10g。
[工序(3)]
在固液分離固體側10g(固體成分濃度10%)中添加參考例1中制備的源自絲狀菌的纖維素酶進行水解。對于源自絲狀菌的纖維素酶的添加量,添加8mg/g的前處理物,用鹽酸調整到pH為5,開始水解。水解在50℃下進行24小時反應。
[工序(4)]
纖維素酶糖化后,通過離心分離(4500G,10分鐘)進行固液分離,分離成纖維素酶水解固體和纖維素酶水解液體。進一步對纖維素酶水解液體進行膜過濾(ミリポア社制Stericup-GP,材質:PES),得到的上清用截留分子量10,000的超濾膜(Sartorius stedim biotech社制VIVASPIN 20,材質:PES)以4500G離心直到超濾膜的非透過液側為1mL。將10mL蒸餾水添加到膜餾分中,再次以4500G離心直到非透過側餾分為1mL,將所得物質作為回收酶,用參考例2的方法測定酶活性,求得設添加酶的活性為100時的相對值。
[實施例2]源自曲霉屬微生物的木聚糖內切酶的使用
[工序(1)]
在參考例3中制備的堿處理甘蔗渣1g中添加水19g,調整到固體成分濃度5%。在制備的含纖維素生物質中添加源自曲霉屬微生物的木聚糖內切酶(Megazyme社制,活性80U/mg)進行水解。對于源自曲霉屬微生物的木聚糖內切酶的添加量,添加0.13mg/g的前處理物,用鹽酸調整到pH為5,進行木聚糖內切酶水解。木聚糖內切酶水解在50℃下進行24小時反應。
[工序(2)]
木聚糖內切酶反應后,用12目的不銹鋼制濾網進行固液分離,回收木聚糖內切酶水解液體10g、木聚糖內切酶水解固體10g。
[工序(3)]
在固液分離固體10g中添加參考例1中制備的源自絲狀菌的纖維素酶進行水解。利用纖維素酶的水解與比較例1同樣地進行。
[工序(4)]
與實施例1同樣地進行。
(實施例3)實施例1中的工序(2)的木聚糖內切酶的回收、低聚木糖的回收
與實施例1同樣地實施工序(1)、工序(2)、工序(3)、及工序(4)。此時,將工序(2)中得到的木聚糖內切酶水解液體進行膜過濾(ミリポア社制Stericup-GP、材質:PES),得到的上清用截留分子量10,000的超濾膜(Sartorius stedim biotech社制VIVASPIN 20、材質:PES)以4500G離心直到超濾膜的非透過液側為1mL。將蒸餾水10mL添加到膜餾分中,再次以4500G離心直到非透過側餾分為1mL,將所得物質作為木聚糖內切酶回收酶,以樺木木聚糖(Birchwood xylan)為底物,在50℃、pH5、10分鐘反應后,使用二硝基水楊酸法(DNS法),測定540nm的吸光度,由此以設添加的木聚糖內切酶的活性為100時的回收木聚糖內切酶的相對值作為木聚糖內切酶回收率。木聚糖內切酶回收率是73%。另外,根據參考例5測定木聚糖內切酶水解液體的透過液中的低聚木糖濃度,結果每g重量的堿處理甘蔗渣回收了80mg的低聚木糖。
(比較例1)省略實施例1中的工序(1)、工序(2)
在參考例3中制備的含纖維素生物質1g中添加9g水,調整到固體成分濃度為10%。在制備的含纖維素生物質中添加參考例1中制備的源自絲狀菌的纖維素酶進行水解。水解的條件與實施例1同樣地進行。依據實施例1的工序(4)從得到的水解物中回收酶,用參考例2的方法測定酶活性。
(比較例2)省略實施例1中的工序(1)
在參考例3中制備的含纖維素生物質1g中添加水19g,調整到固體成分濃度為5%。將其用12目的不銹鋼制濾網進行固液分離,回收液體側10g、固體側10g。在固液分離固體10g中添加參考例1中制備的源自絲狀菌的纖維素酶,依據實施例1的工序(3)進行水解。依據實施例1的工序(4),從得到的水解物回收酶,用參考例2的方法測定酶活性。
(比較例3)省略實施例1中的工序(2)
在參考例3中制備的含纖維素生物質1g中添加水9g,調整到固體成分濃度為10%。在制備的含纖維素生物質中添加參考例4中制備的源自枝頂孢屬微生物的木聚糖內切酶進行水解。對于源自枝頂孢屬微生物的木聚糖內切酶的添加量,以0.1mg/g前處理物添加,用鹽酸調整到pH為5,進行木聚糖內切酶水解。木聚糖內切酶水解在50℃下進行24小時反應。木聚糖內切酶反應后,不實施固液分離,添加參考例1中制備的源自絲狀菌的纖維素酶,依據實施例1的工序(3)進行水解。依據實施例1的工序(4)從得到的水解物中回收酶,用參考例2的方法測定酶活性。
(比較例4)源自木霉屬微生物的木聚糖內切酶的使用
在參考例3中制備的含纖維素生物質1g中添加水19g,調整到固體成分濃度為5%。在制備的含纖維素生物質中以0.04mg/g前處理物添加源自綠色木霉的木聚糖內切酶(Megazyme社制,活性250U/mg),用鹽酸調整到pH為5,進行木聚糖內切酶水解。木聚糖內切酶水解在50℃下進行24小時反應。木聚糖內切酶反應后,用12目的不銹鋼制濾網進行固液分離,回收木聚糖內切酶水解液體10g、木聚糖內切酶水解固體10g。在固液分離固體10g中添加參考例1中制備的源自絲狀菌的纖維素酶,依據實施例1的工序(3)進行水解。依據實施例1的工序(4)從得到的水解物中回收酶,用參考例2的方法測定酶活性。
將比較例1~4、實施例1及2中酶回收率的結果總結于表1。由表1可知,與比較例1~4相比,實施例1及2中,回收酶的pNP-Lac、pNP-Glc、pNP-Xyl分解活性高,酶回收率提高。
另外,比較例3中,在工序(1)中使用源自枝頂孢屬微生物的木聚糖酶,但沒有實施工序(2),結果回收纖維素酶的活性沒有提高,可知在獲得本發明的效果方面工序(2)的固液分離是必要的。
另外,比較例4是在工序(1)中使用源自木霉屬微生物的木聚糖酶的例。專利文獻4中,在源自絲狀菌的纖維素酶水解前僅進行利用回收酶的水解,回收纖維素酶中蓄積木聚糖內切酶及將木二糖轉換成木糖的木糖苷酶,顯示回收酶的纖維素酶活性及纖維素酶水解中的糖化率提高。可期待與專利文獻4同等的效果,但與實施例1及2相比,纖維素酶回收率差,與比較例1相比纖維素酶回收率的提高也是輕微的。
表1
使用超濾膜從纖維素酶水解物中回收的回收酶成分的酶活性
- 還沒有人留言評論。精彩留言會獲得點贊!