用于疼痛治療的寡核苷酸誘餌的制作方法
本申請根據35U.S.C.§119(e)要求2014年8月15日提交的美國申請第62/037,996號的優先權,其通過引用整體并入本文。
關于序列表的聲明
與本申請相關的序列表以文本格式代替紙質拷貝提供,并且通過引用據此并入本說明書中。包含序列表的文本文件的名稱為ADDY_003_01WO_SeqList_ST25.txt。文本文件約13KB,于2015年8月14日創建,并通過EFS-Web以電子方式提交。
背景
發明領域
本發明涉及治療劑,諸如稱為寡核苷酸誘餌的雙鏈核酸,包含其的藥物組合物,以及調節感受傷害信號傳導以例如預防和/或治療疼痛的相關方法。
相關領域的描述
疼痛可被定義為與真實或潛在組織損傷相關聯,或者以這樣損傷的措辭描述的令人不悅的感覺和情感體驗。慢性疼痛折磨至少40%的美國人口并且與許多有害的醫學病況有關。持續性和高度衰弱的慢性疼痛通常伴有虛弱、失眠、缺乏食欲、易怒和抑郁。隨著時間的推移,生活質量受到深刻影響,患者常常無法完成日常生活的簡單任務。
目前使用的疼痛治療應用三步止痛法(three-step pain ladder),其推薦如下施用藥物:非阿片樣物質(例如,阿司匹林、對乙酰氨基酚等),然后,必要時,溫和阿片樣物質(例如,可待因)和最后強阿片樣物質(例如,嗎啡)。盡管有這種藥物庫,但超過50%的慢性疼痛患者沒有得到有效治療。
目前的疼痛治療的無效性尤其歸因于現有藥物療法的顯著毒性問題。所有種類的疼痛藥物引起輕度至嚴重的毒性:非甾體抗炎藥物引起胃腸損傷,昔布類(coxibs)與心力衰竭相關,且阿片樣物質引起許多副作用,包括呼吸抑制、鎮靜、消化功能障礙和成癮。
轉錄因子是多種信號傳導通路中的重要因子,并且經常控制許多基因的同時表達。許多轉錄因子參與牽涉疼痛的基因的表達調控,所述基因包括但不限于BDNF、轉化生長因子(TGFB1)、CDKN1A、GFAP、POU因子、上游刺激因子(USF1、USF2)、EGR1、cAMP應答元件結合蛋白/活化轉錄因子(CREB/ATF)、活化蛋白1(AP1)、血清應答因子(SRF)、啟動子選擇性轉錄因子(SP1)和runt相關轉錄因子1(CBFA2)。
因此,為了監測牽涉疼痛的基因的表達,在抑制轉錄因子中可能具有顯著的治療潛力。因此,需要的是選擇性的,易于獲得的非毒性轉錄因子抑制劑。
概述
本發明的實施方案總地來說涉及抑制至少一種Krüppel樣家族(KLF)轉錄因子與其內源性轉錄因子結合位點結合的治療劑(諸如寡核苷酸)、包含此類藥劑的藥物組合物,以及調節感受傷害的信號傳導,例如,以預防和/或治療有此需要的受試者的疼痛的相關方法。在一些實施方案中,治療劑是雙鏈寡核苷酸(例如,寡核苷酸誘餌),其包含結合至少一種KLF轉錄因子的一個或多個轉錄因子結合位點。
因此,本發明的實施方案包括包含一個或多個轉錄因子結合位點的寡核苷酸誘餌,其中所述一個或多個轉錄因子結合位點結合選自由KLF1、KLF2、KLF3、KLF4、KLF5、KLF6、KLF7、KLF8、KLF9、KLF10、KLF11、KLF12、KLF13、KLF14、KLF15、KLF16和KLF17組成的組的轉錄因子。在一些實施方案中,所述一個或多個轉錄因子結合位點結合選自由KLF1、KLF2、KLF3、KLF4、KLF5、KLF6、KLF7、KLF8、KLF9、KLF10、KLF11、KLF12、KLF13、KLF14、KLF15、KLF16和KLF17中的一個或多個的一種或多種轉錄因子(1、2、3、4、5種等)。
在具體實施方案中,所述寡核苷酸誘餌包含至少兩個轉錄因子結合位點的組合,其中每個轉錄因子結合位點結合選自由KLF1、KLF2、KLF3、KLF4、KLF5、KLF6、KLF7、KLF8、KLF9、KLF10、KLF11、KLF12、KLF13、KLF14、KLF15、KLF16和KLF17組成的組的轉錄因子。在具體實施方案中,每個轉錄因子結合位點結合不同的KLF轉錄因子。
在一些實施方案中,所述寡核苷酸誘餌在長度上為約15至約35個堿基對。
在具體實施方案中,所述寡核苷酸誘餌包含第一轉錄因子結合位點和第二轉錄因子結合位點,其中所述第一和第二轉錄結合位點重疊。在某些實施方案中,所述第一轉錄因子結合位點結合KLF9,且所述第二轉錄因子結合位點結合KLF15。在某些實施方案中,所述第一轉錄因子結合位點結合KLF9,且所述第二轉錄因子結合位點結合KLF6。
在某些實施方案中,所述寡核苷酸誘餌具有第一轉錄因子結合位點、第二轉錄因子結合位點和第三轉錄因子結合位點,其中所述第一、第二和第三轉錄因子結合位點重疊。在具體實施方案中,所述第一轉錄因子結合位點結合KLF6,所述第二轉錄因子結合位點結合KLF9,且所述第三轉錄因子結合位點結合KLF15。
某些實施方案涉及本文所述的寡核苷酸誘餌的一個或多個群體,其中寡核苷酸誘餌的群體在標準ELISA測定中提供等于或小于約0.8或等于或高于約1.0的KLF15/KLF9的轉錄因子結合比。
一些實施方案涉及寡核苷酸誘餌的群體,其中寡核苷酸誘餌的群體在標準ELISA測定中提供等于或高于預定值例如約0.2OD450的光密度值的對KLF6和KLF9的總轉錄因子結合能力。
在一些實施方案中,所述寡核苷酸誘餌(例如,在群體中)包含由式1或式2表示的序列:
a1t2c3c4T5T6Y7G8M9M10T11Y12Y13K14Y15C16N17H18h19n20n21v22n23n24y25m26h27w28b29v30a31w32(式1;SEQ ID NO:1)
t1g2t3k4b5K6K7D8D9V10D11N12S13D14N15B16N17N18d19v20m21b22v23m24h25r26m27a28(式2;SEQ ID NO:2)
其中S為G或C;W為A或T;Y為T或C;D為A、G或T;B為C、G或T;K為T或G;M為C或A;H為C、T或A;V為C、G或A;R為A或G;并且N為任意核苷酸,其中小寫字母可以存在或不存在,并且其中下標中的數字表示核苷酸在所述序列中的位置。
在一些實施方案中,所述寡核苷酸誘餌包含選自由SEQ ID NO:3-35組成的組的序列或其變體。在具體實施方案中,所述誘餌包含與SEQ ID NO:28(16.6.5)、SEQ ID NO:25(16.6.2)、SEQ ID NO:19(17.5)、SEQ ID NO:34(T16.6-T17.5Fu1)或SEQ ID NO:35(T16.6-T17.5Fu2)的序列具有至少70%同一性的序列。
某些實施方案包括包含由式1或式2表示的序列的寡核苷酸誘餌:
a1t2c3c4T5T6Y7G8M9M10T11Y12Y13K14Y15C16N17H18h19n20n21v22n23n24y25m26h27w28b29v30a31w32(式1;SEQ ID NO:1)
t1g2t3k4b5K6K7D8D9V10D11N12S13D14N15B16N17N18d19v20m21b22v23m24h25r26m27a28(式2;SEQ ID NO:2)
其中S是G或C;W是A或T;Y是T或C;D是A、G或T;B是C、G或T;K是T或G;M是C或A;H是C、T或A;V是C、G或A;R是A或G;并且N是任意核苷酸,其中小寫字母可以存在或不存在,并且其中下標中的數字表示核苷酸在序列中的位置。
在一些實施方案中,所述誘餌包含選自由SEQ ID NO:3-35組成的組的序列或其變體,或由所述序列或其變體組成,或基本上由所述序列或其變體組成。在具體實施方案中,所述誘餌包含與SEQ ID NO:28(16.6.5)、SEQ ID NO:25(16.6.2)、SEQ ID NO:19(17.5)、SEQ ID NO:34(T16.6-T17.5Fu1)或SEQ ID NO:35(T16.6-T17.5Fu2)的序列具有至少70%同一性的序列。
還包括藥物組合物,其包含本文所述的寡核苷酸誘餌或誘餌群體和藥學上可接受的載體。在某些實施方案中,所述寡核苷酸誘餌作為鹽、水合物、溶劑合物或N-氧化物衍生物提供。
一些實施方案包括一個或多個試劑盒,其包含本文所述的寡核苷酸誘餌或誘餌群體,任選地使用寡核苷酸誘餌的說明書。
還包括用于調節存在于細胞中的參與感受傷害的信號傳導的基因的轉錄的方法,其包括向所述細胞施用有效量的本文所述的寡核苷酸誘餌或藥物組合物。
還包括用于調節細胞中感受傷害的信號傳導的方法,其包括向細胞施用有效量的本文所述的寡核苷酸誘餌或藥物組合物。
某些實施方案包括用于預防和/或治療受試者的疼痛的方法,其包括向受試者施用治療有效量的本文所述的寡核苷酸誘餌或藥物組合物。在一些實施方案中,疼痛是慢性疼痛。在具體實施方案中,疼痛是神經性疼痛。在一些實施方案中,疼痛與炎癥相關。在某些的實施方案中,疼痛與中樞神經系統或內臟病癥相關。在具體實施方案中,疼痛是與炎癥相關的神經性疼痛。
還包括用于調節細胞中感受傷害的信號傳導的方法,其包括向所述細胞施用治療有效量的治療劑,其中所述治療劑抑制轉錄因子與其轉錄因子結合位點的結合,其中所述轉錄因子選自由KLF1、KLF2、KLF3、KLF4、KLF5、KLF6、KLF8、KLF9、KLF10、KLF11、KLF12、KLF13、KLF14、KLF15、KLF16和KLF17組成的組。
在一些實施方案中,治療劑在標準ELISA測定中提供等于或小于約0.8或等于或高于約1.0(例如,基于OD450值或等效的標準ELISA測量單位)的KLF15/KLF9的結合比。在具體實施方案中,治療劑在標準ELISA測定中提供等于或高于約0.2OD450的光密度值或使用等同的標準ELISA測量單位的相當的結合水平的對KLF6和KLF9的總轉錄因子結合能力。
還包括用于治療受試者的疼痛的方法,其包括向受試者施用治療有效量的治療劑,其中所述治療劑抑制轉錄因子與其轉錄結合位點的結合,其中所述轉錄因子選自由KLF1、KLF2、KLF3、KLF4、KLF5、KLF6、KLF8、KLF9、KLF10、KLF11、KLF12、KLF13、KLF14、KLF15、KLF16和KLF17組成的組。在一些實施方案中,治療劑在標準ELISA測定中提供等于或小于約0.8或等于或高于約1.0的KLF15/KLF9的結合比。在某些實施方案中,治療劑在標準ELISA測定中提供等于或高于約0.2OD450的光密度值的對KLF6和KLF9的總轉錄因子結合能力。在具體實施方案中,疼痛是神經性疼痛、與炎癥相關的疼痛和/或與炎癥相關的神經性疼痛。
附圖簡述
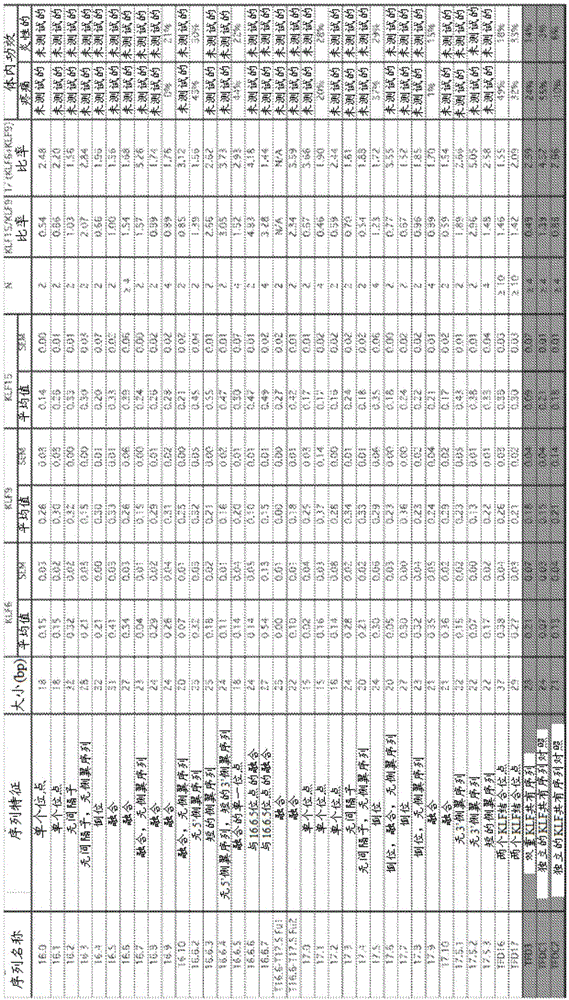
圖1顯示了某些寡核苷酸誘餌相對于對照KLF誘餌(以灰色突出顯示的)的的KLF結合特征。與KLF6、KLF9和KLF15的結合值表示為來自實施例1中描述的體外ELISA結合測定的平均值和SEM OD450值。還列出了相應的N。治療神經性疼痛和/或神經炎性疼痛的功效表示為在相應的動物研究的測試期期間(取決于研究,總共~4-8周,治療后~2-4周)相對于對照的疼痛減輕的百分比(%)。N/A=不適用。
圖2A-B顯示某些寡核苷酸誘餌在慢性神經性疼痛的保留性神經損傷(SNI)模型中的功效。使用重復的von Frey細絲將疼痛測量為機械超敏性(mechanical hypersensitivity)。在術后第14天(POD14),鞘內注射寡核苷酸誘餌(200納摩爾)或媒介物一次。將對von Frey刺激的總反應的平均值+SEM值針對在注射媒介物或誘餌之前于POD14測量的基線疼痛值進行標準化;跨組組合POD14之前的注射前數據,給定的時間點上的對比媒介物的T檢驗:*p≤0.05,誘餌對比媒介物的治療后數據分布(POD 17-POD31):對于TFD16、16.6.2、16.6.5、TFD17、17.5,p≤0.001,對于17.1,p=0.005,對于16.9,p=0.39,以及對于17.9,p=0.46;每個測試組n=4只大鼠。X軸顯示術后天數(POD)。
圖3A-B顯示某些寡核苷酸誘餌在慢性神經炎性疼痛的慢性壓迫性損傷(CCI)模型中的功效。使用重復的von Frey細絲將疼痛測量為機械超敏性。在術后第14天(POD14),鞘內注射寡核苷酸誘餌(200納摩爾)或媒介物一次。將對von Frey刺激的總反應的平均值+SEM值針對在注射媒介物或誘餌之前于POD14測量的基線疼痛值進行標準化;跨組組合POD14之前的注射前數據,給定的時間點上的對比媒介物的T檢驗:*p≤0.1,**p≤0.05,誘餌對比媒介物的治療后數據分布(POD 17-POD31):對于TFD16,p=0.23,對于16.6.2,p=0.01,對于16.6.5,p=0.03,對于16.9為0.02,對于TFD17,p=0.0004,對于17.1,p=0.005,對于17.5,p=0.004以及對于17.9,p=0.12;每個測試組n=4只大鼠(除17.9外:n=3,因為1只大鼠由于在POD14處的基線疼痛值不足而被排除)。X軸顯示術后天數(POD)。
圖4A-C顯示與它們的KLF15/KLF9結合比率相關的某些寡核苷酸誘餌的功效水平(4A),治療慢性神經性疼痛的功效與對KLF6、KLF9和KLF15的結合參數之間的線性相關系數(4B),以及與它們的KLF15/KLF9結合比率(不包括~0.9的比率)相關的所測試的誘餌群體的功效水平的線性回歸(4C)。將每種誘餌的功效水平在慢性疼痛的SNI模型中測量為測試期間(總共~4-8周,治療后~2-4周,取決于研究)對比對照的疼痛緩解的百分比。
圖5A-C顯示與它們的對KLF6、KLF9和KLF15的組合結合相關的某些寡核苷酸誘餌的功效水平(5A),治療慢性神經炎性疼痛的功效與對KLF6、KLF9和KLF15的結合參數之間的線性相關系數(5B),以及與它們對KLF6和KLF9的總結合能力相關的所測試的誘餌群體的功效水平(如通過它們的1/(KLF6+KLF9)結合比率所指示的)的線性回歸(5C)。在慢性疼痛的CCI模型中將每一種誘餌的功效水平測量為測試期間(總共~4-8周,治療后~2-4周,取決于研究)對比對照的疼痛減輕的百分比。
圖6顯示某些寡核苷酸誘餌(白色菱形)跨疼痛的補充性病因(從神經病變(Y-軸)至包括炎癥組分的疼痛(X-軸))的相對于來自文獻的對照KLF誘餌(TFDC1、TFDC2和TFD3,其含有兩個KLF-共有CACCC-盒結合位點,黑色菱形)的功效的差異模式。
圖7顯示表2中的本發明的寡核苷酸誘餌的1/(KLF6+KLF9)結合比率(菱形)(其指示治療神經炎性疼痛的功效(越低,功效越強))和KLF15/KLF9結合比率(方塊)(其指示治療神經性疼痛的功效(越高,功效越強)的曲線圖(X軸,KLF誘餌:1=16.5,2=16.6.7,3=17.7,4=17.1,5=16.2,6=16.6.2,7=17.3,8=16.6,9=17.9,10=17.5,11=16.8,12=16.9,13=17.8,14=17.4,15=17.1,16=16.4,17=16.1,18=17.2,19=16.0,20=17.5.3,21=16.6.3,22=17.5.1,23=16.3,24=16.6.5,25=16.10,26=17.6,27=T16.6-T17.5Fu2,28=17.0,29=16.6.4,30=16.6.6,31=17.5.2,32=16.7,T16.6-T17.5Fu1由于不適用的值而未列出)。
圖8A-B顯示遞升劑量水平的16.6.5寡核苷酸誘餌在慢性神經性疼痛(A)的SNI模型和慢性神經炎性疼痛(B)的CCI模型中的作用。使用重復的von Frey細絲將疼痛測量為機械超敏性。在術后第14天(POD14)鞘內注射16.6.5或媒介物一次。將對von Frey刺激的總反應的平均值+SEM值針對在注射媒介物或誘餌前于POD14測量的基線疼痛值進行標準化;跨組組合POD14之前的注射前數據,給定時間點上的對比媒介物的T檢驗:*p≤0.05,16.6.5對比媒介物的治療后數據分布(POD 17-POD31):在SNI模型中,對于100、200和300納摩爾劑量水平,p≤0.001,對于200摩爾,p=0.02,以及在CCI模型中,對于300納摩爾劑量水平,p≤0.001;每個測試組n=4只大鼠。X軸顯示術后天數(POD)。
詳述
除非另有定義,否則本文使用的所有技術和科學術語具有與本發明所屬領域的普通技術人員通常理解的相同的含義。盡管與本文所述的那些方法和材料相似或等同的任何方法和材料可用于本發明的實踐或測試,但描述了優選方法和材料。為了本發明的目的,在下文中定義以下術語。
定義
冠詞“一個/一種(a/an)”在本文中用于指一個或多于一個(即,指至少一個)該冠詞的語法對象。作為示例,“一個元件”是指一個元件或多于一個元件。
“約”是指相對于參照數量、水平、值、數目、頻率、百分比、尺寸、大小、量、重量或長度變化多達30%、25%、20%、15%、10%、9%、8%、7%、6%、5%、4%、3%、2%或1%的數量、水平、值、數目、頻率、百分比、尺寸、大小、量、重量或長度。
如在結合治療劑諸如寡核苷酸誘餌的轉錄因子的上下文中所使用的,“結合”是指轉錄因子與寡核苷酸誘餌之間的直接相互作用(例如,轉錄因子與寡核苷酸誘餌之間的非共價鍵合,包括氫鍵合、范德華鍵合等)。因此,不結合轉錄因子的治療劑諸如寡核苷酸不與所述轉錄因子直接相互作用,反之亦然。
在整個本說明書中,除非上下文另有要求,否則詞語“包含(comprise/comprises/comprising)”將被理解為暗示包含所述步驟或元素或步驟或元件的組,但不排除任何其它步驟或元素或步驟或元素的組。
“由...組成”意指包括并且不限于短語“由...組成”之后的任何內容。因此,短語“由...組成”表示所列元素是必需的或強制性的,并且可以不存在其它元素。“基本上由......組成”意指包括在短語之后列出的任何元素,并且限于不干擾或促成本公開中針對所列元素指定的活性或作用的其它元素。因此,短語“基本上由......組成”表示所列元素是所需的或強制性的,但其它元素是任選的,并且可以存在或不存在,這取決于它們是否實質影響所列元素的活性或作用。
“慢性”是指包括數月(例如,至少兩個月)或數年的時段。
“同源性”是指相同或構成保守取代的核苷酸的百分數。同源性可使用序列比較程序諸如EMBOSS逐對比對算法(可從歐洲生物信息學研究所(EBI)獲得)、ClustalW程序(可從歐洲生物信息學研究所(EBI)獲得)或BLAST程序(((BLAST Manual,Altschul等,Natl Cent.Biotechnol.Inf.,Natl Lib.Med.(NCIB NLM NIH),Bethesda,Md.和Altschul等,(1997)NAR 25:3389 3402)或GAP(Deveraux等,1984,Nucleic Acids Research 12,387-395)來確定。這樣,可通過將缺口插入比對中來比較長度與本文引用的那些序列相似或大體上不同的序列,此類缺口例如通過由GAP所使用的比較算法來確定。
“分離的”意指大體上或基本上不含通常以其天然狀態伴隨其的組分的材料。例如,如本文中所用,“分離的多核苷酸”或“分離的寡核苷酸”可以指已被從以天然存在的狀態側翼連接其的序列純化或去除的多核苷酸,例如被從在基因組中與DNA片段相鄰的序列去除的所述DNA片段。術語“分離”,當其涉及細胞時,是指從來源受試者(例如,具有多核苷酸重復疾病的受試者)純化細胞(例如,成纖維細胞、淋巴母細胞)。在mRNA或蛋白質的上下文中,“分離”是指從來源(例如,細胞)中回收mRNA或蛋白質。
術語“調節”包括使一個或多個可量化參數“增加”或“減少”任選地確定的和/或統計學顯著的量。“增加(increase/increasing)”、“促進(enhance/enhancing)”或“刺激(stimulate/stimulating)”通常是指一種或多種試劑諸如寡核苷酸誘餌在細胞或受試者中產生或引起相對于由無試劑或對照化合物引起的反應更大的生理或細胞反應(諸如轉錄因子的活性(例如,基因表達))的能力。相關的生理或細胞反應(體內或體外)對本領域技術人員而言將是顯而易見的。相對于由無試劑或對照組合物產生的量或反應,“增加”或“增強”的量或反應可以是“統計學顯著的”,并且可包括為由無試劑或對照化合物產生的量或反應的1.1倍、1.2倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50或更多倍(例如,500倍、1000倍)(包括其間并且高于1(例如1.5、1.6、1.7、1.8)的所有整數和范圍)的增加。術語“減少”或“抑制”通常可涉及一種或多種試劑諸如寡核苷酸誘餌在細胞或受試者中“減少”相關生理或細胞反應的能力,諸如轉錄因子的活性(例如,基因表達)、生理過程(例如,感受傷害的信號傳導)或本文所述的疾病或病況的癥狀(例如,疼痛)。相關的生理或細胞反應(體內或體外)對于本領域技術人員而言將是顯而易見的,并且可以按照常規技術測量。相較于無藥劑或對照組合物產生的反應,反應的“減少”可以是“統計學顯著的”,并且可包括1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%的減少,包括其間的所有整數和范圍。
“基因表達水平的調節”包括基因表達水平的任何變化,包括誘導或活化(例如,基因表達的增加)、抑制或阻遏(例如,基因表達的減少)或穩定化(例如,阻止通常響應于刺激諸如疼痛誘導刺激而發生的基因的上調或下調)。
“感受傷害的信號傳導”是指牽涉有害刺激或潛在有害刺激的檢測的分子和細胞機制,其導致疼痛的感知。具體實例包括神經遞質合成和釋放、神經遞質誘導的信號傳導、膜去極化,以及相關的細胞內和細胞間信號傳導事件。
“疼痛”是指與實際或潛在組織損傷相關或以此類術語描述的不愉快的感覺和情感體驗。疼痛的所有不同表現和性質,包括機械性疼痛(例如,由機械刺激或身體運動引起的)、溫度引起的疼痛(例如,由熱、溫和/或冷的溫度引起的疼痛)以及化學誘導的疼痛(例如,由化學物質誘導的疼痛)。在某些實施方案中,疼痛是慢性、亞慢性、急性或亞急性的。在某些實施方案中,疼痛特征是痛覺過敏(例如,對疼痛刺激的敏感性增加)和/或異常性疼痛(例如,對通常非疼痛刺激的疼痛反應)。在某些實施方案中,疼痛預先存在于患者體內。在其它實施方案中,疼痛是醫源性的,在患者中誘導的(例如,手術后疼痛)。
“預防/防止(preventing/pervention)”包括(1)獲得疾病或病癥(例如,導致疾病的至少一個臨床癥狀在患者中不發展,所述患者可能暴露于疾病或對疾病易感,但尚未經歷或顯示疾病的癥狀)的風險的降低,和/或(2)與疾病或病癥相關的癥狀的可能嚴重性的降低(例如,降低患者的疾病的至少一種臨床癥狀,所述患者可能暴露于或傾向于疾病但尚未經歷或表現出疾病癥狀)。
如本文中所用,術語“序列同一性”或例如包含“與……具有50%同一性的序列”,是指序列在比較窗口中在逐個核苷酸的基礎上相同的程度。因此,可通過在比較窗口上比較兩個最佳比對的序列,確定在兩個序列中存在相同核酸堿基(例如,A、T、C或G)的位置的數目以產生匹配位置的數目,將匹配位置的數目除以比較窗口中的位置總數(即,窗口大小),并將結果乘以100以產生序列同一性的百分數來計算“序列同一性百分比”。在一些實施方案中,用于比對比較窗口的序列的最佳比對可以通過使用EMBOSS逐對比對算法(可從歐洲生物信息學研究所(EBI)獲得)、ClustalW程序(也可從歐洲生物信息學研究所(EBI)獲得)或BLAST程序(BLAST Manual,Altschul等,Natl Cent.Biotechnol.Inf.,Natl Lib.Med.(NCIB NLM NIH),Bethesda,Md.和Altschul等,(1997)NAR 25:3389 3402)來進行。在某些實施方案中,針對參照序列(例如,來自序列表)的整個長度進行用于比對比較窗的序列比對。在一些實施方案中,針對參照序列的一部分進行用于比對比較窗口的序列比對,所述參照序列的一部分是例如參照序列的約、至少約或不超過約10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、21個、22個、23個、24個、25個、26個、27個、28個、29個、30個、31個、32個、33個、34個、35個、36個、37個、38個、39個、40個、41個、42個、43個、44個、45個、46個、47個、48個、49個、50個、60個、70個、80個、90個或100個連續核苷酸。
“受試者”或“有此需要的受試者”或“患者”包括哺乳動物受試者諸如靈長類動物或人受試者。
“亞急性”是指包括數小時(例如,1-24小時,包括其間的所有整數和范圍)的時段。
“亞慢性”是指包數括天或數月(例如,少于2或3個月)的時段。
在一些實施方案中,任何疾病或病癥的“治療(treating/treatment)”是指改善疾病或病癥(例如,阻止或減少疾病或其至少一種臨床癥狀的發展)。在一些實施方案中,“治療”是指改善患者不能辨別的至少一個物理和/或生物學參數。在某些實施方案中,“治療”是指物理地(例如,可辨別的癥狀的穩定化)、生理地(例如,物理參數的穩定化)或在這兩個方面抑制疾病或病癥。在一些實施方案中,“治療”是指延遲疾病或病癥的發作。“治療”或“預防”不一定表示完全根除、治愈或預防疾病或病況或其相關癥狀。
“治療有效量”是指當向患者施時足以實現特定疾病或病癥的此類治療的化合物的量。“治療有效量”將根據化合物、疾病、疾病的嚴重性以及待治療的患者的年齡、體重等而變化。
寡核苷酸誘餌和其它治療劑
本發明的實施方案總地來說涉及抑制至少一種轉錄因子與其(內源)轉錄結合位點中的至少一個的結合的治療劑。具體實例包括包含一個或多個轉錄結合位點的寡核苷酸誘餌,其結合至少一種轉錄因子,從而改變轉錄因子調節基因表達的能力。在某些實施方案中,轉錄因子是轉錄因子的Krüppel樣家族(KLF)的一個或多個成員,其實例包括KLF1、KLF2、KLF3、KLF4、KLF5、KLF6、KLF7、KLF8、KLF9、KLF10、KLF11、KLF12、KLF13、KLF14、KLF15、KLF16和KLF17。
因此,某些實施方案包括包含一個或多個(例如,1個、2個、3個、4個、5個等)轉錄因子結合位點的寡核苷酸誘餌,其中所述一個或多個轉錄因子結合位點結合選自由KLF1、KLF2、KLF3、KLF4、KLF5、KLF6、KLF7、KLF8、KLF9、KLF10、KLF11、KLF12、KLF13、KLF14、KLF15、KLF16和KLF17組成的組的轉錄因子。
還包括寡核苷酸誘餌,其包含至少兩個(例如例如,2個、3個、4個、5個等)轉錄因子結合位點的組合,其中每個轉錄因子結合位點結合選自由KLF1、KLF2、KLF3、KLF4、KLF5、KLF6、KLF7、KLF8、KLF9、KLF10、KLF11、KLF12、KLF13、KLF14、KLF15、KLF16和KLF17組成的組的轉錄因子。轉錄因子結合位點的組合的具體實例包括結合KLF6/KLF9、KLF9/KLF15或KLF6/KLF9/KLF15的那些組合。
術語“寡核苷酸”包括通常小于約200個核苷酸(或100個堿基對)并且包括但不限于DNA、RNA和RNA-DNA雜交體的任何雙鏈或基本上雙鏈的含核酸的聚合物。
在一些實施方案中,寡核苷酸的長度為約、至少約或不超過約10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、21個、22個、23個、24個、25個、26個、27個、28個、29個、30個、31個、32個、33個、34個、35個、36個、37個、38個、39個、40個、41個、42個、43個、44個、45個、46個、47個、48個、49個、50個、60個、70個、80個、90個、100個、110個、120個、130個、140個、150個、160個、170個、180個、190個或200個核苷酸(包括其間的所有整數和范圍),并且任選地包含約、至少約或不超過約10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、21個、22個、23個、24個、25個、26個、27個、28個、29個、30個、31個、32個、33個、34個、35個、36個、37個、38個、39個、40個、41個、42個、43個、44個、45個、46個、47個、48個、49個、50個、60個、70個、80個、90個、100個、110個、120個、130個、140個、150個、160個、170個、180個、190個或200個堿基配對的核苷酸(包括其間的所有整數和范圍)。在具體實施方案中,所述寡核苷酸誘餌的長度為約15至約35個堿基對。
在一些實施方案中,寡核苷酸誘餌包含第一轉錄因子結合位點和第二轉錄結合位點,任選地其中所述第一轉錄結合位點和第二轉錄結合位點重疊。在具體實施方案中,第一轉錄因子結合位點結合KLF9,且第二轉錄因子結合位點結合KLF15。在具體實施方案中,第一轉錄因子結合位點結合KLF9,且第二轉錄因子結合位點結合KLF6。
還包括具有第一轉錄因子結合位點、第二轉錄因子結合位點和第三轉錄因子結合位點的寡核苷酸誘餌,任選地其中第一、第二和第三轉錄結合位點重疊。在具體實施方案中,第一轉錄因子結合位點結合KLF6,第二轉錄因子結合位點結合KLF9,且第三轉錄因子結合位點結合KLF15。
在某些實施方案中,寡核苷酸誘餌(例如,誘餌的有義鏈)包含由下表1所示的式1或式2所示的序列(例如,雙鏈序列)或其變體或其互補序列(例如,反義序列),由所述序列或其變體或其互補序列組成或基本上由所述序列或其變體或其互補序列組成。
在具體實施方案中,寡核苷酸誘餌(例如,誘餌的有義鏈)包含下表2中的序列或其變體或其互補序列(例如,反義序列),由所述序列或其變體或其互補序列組成或基本上由所述序列或其變體或其互補序列組成。
在本文所述的式和序列中,“A”是腺嘌呤核苷酸,“C”是胞嘧啶核苷酸,“G”是鳥嘌呤核苷酸,“T”是胸腺嘧啶核苷酸,“N”可以是任意核苷酸,優選A、C、G或T。盡管所述式和序列顯示單鏈,但應理解,互補反義鏈被包括作為寡核苷酸誘餌的結構的部分。在某些實施方案中,任何一個或多個“T”可以是“U”或尿嘧啶核苷酸。
因此,某些寡核苷酸誘餌包含表1或表2(例如,SEQ ID NO:1-35)中的序列或其變體或連續或非連續部分,由所述序列或其變體或連續或非連續部分組成或基本上由所述序列或其變體或連續或非連續部分組成。例如,某些寡核苷酸誘餌包含表1或表2中的靶向序列(例如,SEQ ID NO:1-35)中的任何靶向序列的約或至少約10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34個或35個連續或非連續核苷酸,并且其結合一種或多種的本文所述的KLF轉錄因子(例如,KLF1、KLF2、KLF3、KLF4、KLF5、KLF6、KLF7、KLF8、KLF9、KLF10、KLF11、KLF12、KLF13、KLF14、KLF15、KLF16、KLF17)。對于非連續部分,可刪除間插核苷酸,或用不同的核苷酸取代間插核苷酸,或可添加間插核苷酸。變體的另外的實例包括與表1或表2中的序列(例如,SEQ ID NOS:1-35)的整個長度或連續部分具有至少或至少約70%序列同一性或同源性(例如,70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性或同源性)的寡核苷酸誘餌,并且所述寡核苷酸誘餌結合一種或多種本文所述的KLF轉錄因子(例如,KLF1、KLF2、KLF3、KLF4、KLF5、KLF6、KLF7、KLF8、KLF9、KLF10、KLF11、KLF12、KLF13、KLF14、KLF15、KLF16、KLF17)。在一些實施方案中,連續部分為表1或表2中的序列(例如,SEQ ID NO:1-35)的約、至少約或不超過約10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、21個、22個、23個、24個、25個、26個、27個、28個、29個、30個、31個、32個、33個、34個、35個、36個、37個、38個、39個、40個、41個、42個、43個、44個、45個、46個、47個、48個、49個、50個、60個、70個、80個、90個或100個連續核苷酸。
與另一序列具有一定百分比(例如,65%、70%、75%、80%、85%、90%、95%或99%)序列同一性的寡核苷酸誘餌意指,當比對時,該百分比在比較兩個序列中確定堿基排列的對應性水平。該比對和百分比同源性或同一性可以使用本領域已知的允許局部比對的任何合適的軟件程序來測定。在一些實施方案中,此類程序包括但不限于EMBOSS逐對比對算法(可從歐洲生物信息學研究所(EBI)獲得)、ClustalW程序(也可從歐洲生物信息學研究所(EBI)獲得)或BLAST程序(BLAST Manual,Altschul等,Natl Cent.Biotechnol.Inf.,Natl Lib.Med.(NCIB NLM NIH),Bethesda,Md.和Altschul等,(1997)NAR25:3389 3402)。
如上所述,本領域技術人員將認識到本發明包括的序列包括與本文所述的序列完全或部分互補的那些序列,包括在嚴格雜交條件下與示例序列(例如,表1和2;SEQ ID NO:1-35)雜交的那些序列。當核酸的單鏈形式可在適當的溫度和溶液離子強度條件下與另一單鏈核酸退火時,核酸可與另一核酸雜交。雜交條件是本領域熟知的。在一些實施方案中,退火可在含鹽溶劑(例如Tris-EDTA緩沖液)中,在從變性溫度(例如,100℃)至室溫的溫度緩慢降低期間發生。
還包括寡核苷酸誘餌的群體,包括提供與KLF轉錄因子的組合(例如,KLF15/KLF9)的轉錄因子結合比率,和/或與一種或多種個(例如,1種、2種、3種、4種、5種等)KLF轉錄因子(例如,KLF6+KLF9)的總轉錄結合能力的那些寡核苷酸誘餌的群體,所述轉錄因子結合比率和/或總轉錄結合能力是相對于預定量定義的。在一些實施方案中,轉錄因子結合比率或總轉錄結合能力約等于、小于或高于預定水平或量。可以使用多種技術(諸如標準ELISA測定法(參見實施例))建立用于定義相對結合比率或總結合能力的“預定水平”。
例如,在具體實施方案中,寡核苷酸誘餌的群體提供等于或小于約0.8或等于或高于約1.0(基于來自標準ELISA測定(參見實施例)的OD450值(或等效的標準ELISA測量單位,例如,熒光))的KLF15/KLF9的轉錄因子結合比率。在具體實施方案中,KLF15/KLF9的轉錄因子結合比率等于或小于約0.8、0.7、0.6、0.5、0.4、0.3、0.2、0.1、0.05、0.01或更小(包括其間的所有范圍和整數)(基于來自標準ELISA測定的OD450值)。在一些實施方案中,KLF15/KLF9的轉錄因子結合比率等于或高于約1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.5、3.0、3.5、4.0、4.5、5.0、6.0、7.0、8.0、9.0或10.0或更高(包括其間的所有范圍和整數)(基于來自標準ELISA測定法的OD450值(或等效的標準ELISA測量單位))。
在一些實施方案中,寡核苷酸誘餌的群體提供等于或高于預定量的對KLF6和KLF9的總轉錄因子結合能力。在一些情況下,預定量是如在標準ELISA測定(參見實施例)中測量的約0.2OD450或更高的光密度值(或等效的標準ELISA測量單位,例如熒光)。在一些實施方案中,對KLF6和KLF9的預定量或總轉錄因子結合能力等于或高于約0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0或更高(包括其間的所有范圍和整數)(基于來自標準ELISA測定法的OD450值(或等效的標準ELISA測量單位))。
在一些實施方案中,寡核苷酸誘餌的群體提供等于或小于預定量的對KLF6和KLF9的總轉錄因子結合能力。在一些實施方案中,對KLF6和KLF9的預定量或總轉錄因子結合能力表示為1/(KLF6+KLF9)(基于來自標準ELISA測定(參見實施例)的光密度值(或等效的標準ELISA測量單位,例如熒光))。例如,在具體實施方案中,對KLF6和KLF9的總轉錄因子結合能力(如由1/(KLF6+KLF9)表示的)為約5或更小(基于來自標準ELISA測定的OD450值(或等效的標準ELISA測量單位)。在一些實施方案中,對KLF6和KLF9的總轉錄因子結合能力(如由1/(KLF6+KLF9)表示的)等于或小于約5、4、3、2、1、0.5、0.1或更小(包括其間的所有范圍和整數)(基于來自標準ELISA測定的OD450值(或等效的標準ELISA測量單位))。
寡核苷酸誘餌的群體可由一種寡核苷酸誘餌,或兩種或更多種(例如2種、3種、4種、5種等)寡核苷酸誘餌的組合組成。在某些實施方案中,寡核苷酸誘餌的群體由具有單個KLF轉錄因子結合位點的一種寡核苷酸誘餌組成。在一些實施方案中,寡核苷酸誘餌的群體由具有至少兩個(例如2個、3個、4個、5個等)轉錄因子結合位點的組合的一種寡核苷酸誘餌組成,其結合相同或不同(例如,兩種或至少兩種不同的)KLF轉錄因子。在一些實施方案中,寡核苷酸誘餌的群體包含具有至少3個(例如,3個、4個、5個等)轉錄因子結合位點的組合的一種寡核苷酸誘餌,其結合相同或不同(例如,3種或至少3種不同的)KLF轉錄因子。其它組合對于本領域技術人員是顯而易見的。
通常,本文公開的寡核苷酸誘餌可用于結合調節牽涉感受傷害的信號傳導和/或受試者(例如,患者)的疼痛感覺的基因表達的轉錄因子,例如,從而抑制所述轉錄因子。被設計來結合特定轉錄因子的寡核苷酸誘餌具有模擬通常被轉錄因子結合的內源基因組DNA序列的核酸序列。因此,在一些方面,本文公開的寡核苷酸誘餌抑制基因表達和調節的必要步驟。此外,本文公開的寡核苷酸誘餌可以結合一種或多種不同的轉錄因子。
術語寡核苷酸涵蓋包括任何已知的DNA和RNA的堿基類似物的序列,所述堿基類似物包括但不限于2,6-二氨基嘌呤、5-羧甲基氨甲基-2-硫尿嘧啶、5-羧甲基氨甲基尿嘧啶、二氫尿嘧啶、肌苷、尿嘧啶-5-氧基乙酸、N6-異戊烯基腺嘌呤、1-甲基腺嘌呤、N-尿嘧啶-5-氧基乙酸甲酯、辮苷(queosine)、2-硫代胞嘧啶、5-溴尿嘧啶、甲基膦酸酯、二硫代磷酸酯、甲縮醛(ormacetal)、3'-硫代甲縮醛、硝基氧主鏈、砜、氨基磺酸酯、嗎啉代衍生物、鎖核酸(LNA)衍生物和/或肽核酸(PNA)衍生物。在一些實施方案中,寡核苷酸由退火在一起的兩個互補單鏈寡核苷酸組成。在一些實施方案中,寡核苷酸由形成分子內堿基對以產生基本上雙鏈結構的一個單鏈寡核苷酸組成。
在一些實施方案中,本文公開的寡核苷酸誘餌通過本領域技術人員熟知的方法(例如,在核苷酸之間摻入硫代磷酸酯、甲基膦酸酯、二硫代磷酸酯、氨基磷酸酯、碳酸酯、硫醚、硅氧烷、乙酰胺酯或羧甲基酯鍵聯)來修飾,以防止被細胞內和/或細胞外流體(例如血清、腦脊液)中的核酸酶降解。在一些實施方案中,寡核苷酸誘餌被設計來形成發夾結構和啞鈴結構,其還可防止或阻礙核酸酶降解。在具體實施方案中,將寡核苷酸誘餌作為能夠在靶細胞中附加型維持或組成型復制的較大質粒的一部分插入,以提供對誘餌序列的更長期的增強的細胞內暴露和/或減少其降解。因此,本領域已知的增強寡核苷酸穩定性的任何化學修飾或結構改變在本公開的范圍內。在一些實施方案中,可將本文公開的寡核苷酸誘餌例如連接于改善寡核苷酸誘餌的治療效果的聚乙二醇聚合物、肽(例如,蛋白質易位結構域)或蛋白質。此類修飾的寡核苷酸誘餌可優先穿過細胞膜。
本文所述的寡核苷酸誘餌通常可以用作游離酸或游離堿。或者,寡核苷酸誘餌可以以酸或堿加成鹽的形式使用。本發明的游離氨基化合物的酸加成鹽可以通過本領域熟知的方法制備,并且可以由有機和無機酸形成。合適的有機酸包括馬來酸、富馬酸、苯甲酸、抗壞血酸、琥珀酸、甲磺酸、乙酸、三氟乙酸、草酸、丙酸、酒石酸、水楊酸、檸檬酸、葡糖酸、乳酸、扁桃酸、肉桂酸、天冬氨酸、硬脂酸、棕櫚酸、乙醇酸、谷氨酸和苯磺酸。
合適的無機酸包括鹽酸、氫溴酸、硫酸、磷酸和硝酸。堿加成鹽包括與羧酸鹽陰離子形成的那些鹽,包括與有機和無機陽離子,諸如選自堿金屬和堿土金屬(例如,鋰、鈉、鈣、鉀、鎂、鋇和鈣),以及銨離子及其取代的衍生物(例如,二芐基銨、芐基銨、2-羥基乙基銨等)形成的鹽。因此,術語“藥學上可接受的鹽”旨在包括任何和所有可接受的鹽形式。
還包括前藥。前藥是當將向患者施用此類前藥時在體內釋放化合物的任何共價鍵合的載體。前藥通常通過以使得修飾通過常規操作或在體內裂解而產生母體化合物的方式修飾官能團來制備。前藥包括例如本發明的化合物,其中羥基、胺或巰基被鍵合于任何基團,當向患者施用時,其裂解以形成羥基、胺或巰基。因此,前藥的代表性實例包括(但不限于)本文所述的寡核苷酸誘餌的醇和胺官能團的乙酸酯、甲酸酯和苯甲酸酯衍生物。此外,在羧酸(-COOH)的情況下,可以使用酯,諸如甲酯、乙酯等。
在某些實施方案中,將寡核苷酸誘餌作為鹽、水合物、溶劑合物或N-氧化物衍生物提供。在某些實施方案中,在溶液(例如,具有生理pH的鹽溶液)中或以凍干形式中提供寡核苷酸誘餌。在一些實施方案中,在脂質體中提供寡核苷酸誘餌。
本文所述的寡核苷酸誘餌可通過本領域已知的常規方法制備,因此完全在本領域技術人員的知識范圍內。寡核苷酸誘餌及其變體的活性可按照本領域的常規技術(參見實施例)來測定。在具體實施方案中,寡核苷酸誘餌是合成寡核苷酸(即,化學合成的、非天然存在的寡核苷酸)。
還包括非基于寡核苷酸的治療劑,包括例如通過特異性結合KLF轉錄因子,或通過特異性結合其內源性轉錄因子結合位點(例如,通過模擬KLF轉錄因子結合位點)來抑制轉錄因子與其內源轉錄結合位點結合的那些治療劑。治療劑的實例包括結合劑諸如抗體、例如抗體、小分子、肽、adnectin、anticalin、錨蛋白重復蛋白(Darpin)、anaphone和適體,所述結合劑表現出對KLF轉錄因子例如KLF因子轉錄因子結合位點結構域的結合特異性,或表現出對內源KLF轉錄因子結合位點的結合特異性。
如果結合劑以可檢測的水平(在例如ELISA測定中)與多肽或核酸反應,并且在相似條件下不以顯著(例如,統計學顯著的)方式與無關結構可檢測地反應,則結合劑被認為對KLF多肽(例如,其轉錄因子結合結構域)或內源性KLF轉錄因子結合位點(例如,雙鏈DNA序列)表現出“結合特異性”、“特異性結合”。
術語“抗體”涉及免疫球蛋白(無論是天然的還是部分或全部合成產生的)。該術語還涵蓋具有為抗原結合結構域或與抗原結合結構域同源的結合結構域的任何多肽或蛋白質。該術語也涵蓋CDR移植抗體。術語“抗體的抗原結合部分”、“抗原結合片段”、“抗原結合結構域”、“抗體片段”或“抗體的功能片段”在本發明中可互換使用,以包括一個或多個保留特異性結合抗原的能力的抗體的片段(參見例如Holliger等,Nature Biotech.23(9):1126-1129(2005))。
抗體可通過本領域普通技術人員已知的多種技術中的任一種制備。參見,例如Harlow和Lane,Antibodies:A Laboratory Manual,Cold Spring Harbor Laboratory,1988。可使用Kohler和Milstein,Eur.J.Immunol.6:511-519,1976中的技術及其改進來制備對于目標多肽是特異的單克隆抗體。還包括利用轉基因動物諸如小鼠來表達人抗體的方法。參見,例如,Neuberger等,Nature Biotechnology 14:826,1996;Lonberg等,Handbook of Experimental Pharmacology 113:49-101,1994;和Lonberg等,Internal Review of Immunology 13:65-93,1995。具體實例包括由產生的平臺(參見,例如,美國專利第6,596,541號)。還可通過使用噬菌體展示或酵母展示文庫產生或鑒定抗體(參見,例如,美國專利第7,244,592號;Chao等,Nature Protocols.1:755-768,2006)。
如上所述,抑制KLF轉錄因子與其轉錄因子結合位點結合的“肽”被包括作為結合劑。術語肽通常是指氨基酸殘基的聚合物及其變體和合成類似物。在某些實施方案中,術語“肽”是指相對短的多肽,包括由約3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、25個、30個、31個、32個、33個、34個、35個、36個、37個、38個、39個、40個、41個、42個、43個、44個、45個、46個、47個、48個、49個、50個或更多個(包括其間的所有整數和范圍(例如,5-10個、8-12個、10-15個、15-20個、20-25個、25-30個、30-40個、40-50個))氨基酸組成,以及例如結合KLF轉錄因子的一個或多個區域,例如轉錄因子結合結構域,或通過結合其內源性轉錄因子結合位點的至少一個來模擬KLF轉錄因子的肽。肽可以由天然存在的氨基酸和/或非天然存在的氨基酸組成。
如上所述,本發明包括抑制KLF轉錄因子與其轉錄因子結合位點結合的小分子。“小分子”是指合成或生物來源,但通常不是聚合物的有機或無機化合物。有機化合物包括其分子含有碳的一大類化合物,通常不包括僅包含碳酸鹽、簡單的碳氧化物或氰化物的那些化合物。“聚合物”通常是指由重復結構單元組成的大分子或高分子,其通常通過共價化學鍵連接。在某些實施方案中,小分子具有小于1000-2000道爾頓,通常在約300與700道爾頓之間,并且包括約50、100、150、200、250、300、350、400、450、500、550、500、650、600、750、700、850、800、950、1000或2000道爾頓的分子量。
還包括抑制KLF轉錄因子與其轉錄因子結合位點結合的適體作為結合劑(參見,例如,Ellington等,Nature.346,818-22,1990;和Tuerk等,Science.249,505-10,1990)。適體的實例包括核酸適體(例如,DNA適體、RNA適體)和肽適體。核酸適體通常是指具有二級和三級結構以結合各種分子靶諸如小分子、蛋白質、核酸和甚至細胞、組織和生物體的核酸種類,其已通過重復輪的體外選擇或等效方法諸如SELEX(通過指數富集的配體的系統演化)進行了工程化。參見例如美國專利第6,376,190號和第6,387,620號。因此,包括結合KLF轉錄因子的一個或多個區域(例如,轉錄因子結合結構域)或結合其內源性轉錄因子結合位點的至少一個的核酸適體。
肽適體通常包括在兩個末端端附接于蛋白質支架的可變肽環、雙重結構約束(其通常將肽適體的結合親和力提高至與抗體的結合親和力相當的水平(例如,在納摩爾范圍內))。在某些實施方案中,可變環長度可由約10-20個氨基酸(包括其間的所有整數)組成,并且支架可包括具有良好的溶解度和致密度性質的任何蛋白質。某些示例性實施方案可利用細菌蛋白硫氧還蛋白-A作為支架蛋白,可變環被插入在還原活性位點(野生蛋白中的-Cys-Gly-Pro-Cys-環)內,其中兩個半胱氨酸側鏈為能夠形成二硫鍵。用于鑒定肽適體的方法描述于例如美國申請第2003/0108532號中。因此,包括結合KLF轉錄因子的一個或多個區域(例如,轉錄因子結合結構域)或結合其內源性轉錄因子結合位點的至少一個的肽適體。肽適體選擇可使用本領域已知的不同系統(包括酵母雙雜交系統)來進行。
還包括特異性結合KLF轉錄因子的ADNECTINSTM、AVIMERSTM和ANTICALINS。ADNECTINSTM是指一類源自人纖連蛋白的靶向生物制劑,所述纖連蛋白是與其它蛋白質天然結合的豐富的細胞外蛋白質。參見,例如美國申請第2007/0082365號;第2008/0139791號和第2008/0220049號。ADNECTINSTM通常由天然纖連蛋白主鏈,以及人纖連蛋白的特定部分的多個靶向結構域組成。可以工程化靶向結構域以使得AdnectinTM能夠特異性識別目標治療靶標,諸如KLF轉錄因子多肽或其片段,例如轉錄因子結合結構域,或其內源性轉錄因子結合位點的至少一個。
AVIMERSTM是指使用體外外顯子改組和噬菌體展示工程化的多聚體結合蛋白或肽。連接多個結合結構域,從而導致與單表位免疫球蛋白結構域相比更大的親和力和特異性。參見,例如,Silverman等,Nature Biotechnology.23:1556-1561,2005;美國專利第7,166,697號;和美國申請第2004/0175756號、第2005/0048512號、第2005/0053973號、第2005/0089932號和第2005/0221384號。
還包括設計的錨蛋白重復蛋白(DARPin),其包括一類非免疫球蛋白蛋白,所述非免疫球蛋白蛋白可在藥物發現和藥物開發中提供優于抗體的靶結合的優點。在其它用途中,DARPin由于其有利的分子性質,包括小尺寸和高穩定性,理想地適合于體內成像或毒素或其它治療有效載荷的遞送。在細菌中的低成本生產和許多靶特異性DARPin的快速產生使得DARPin法可用于藥物發現。另外,DARPin可以容易地以多特異性形式產生,提供將效應子DARPin靶向特定器官或用一個由幾個DARPin組成的分子靶向多個多肽/核酸的潛力。參見,例如,Stumpp等,Curr Opin Drug Discov Devel.10:153-159,2007;美國申請第2009/0082274號;和PCT/EP2001/10454。
某些實施方案包括“單體”,其通常利用人纖連蛋白(FNfn10)的第10纖連蛋白III型結構域作為支架來展示用于靶結合的多個表面環。FNfn10是具有類似于免疫球蛋白折疊的β-夾心結構的小(94個殘基)蛋白質。其是高度穩定的,無二硫鍵或金屬離子,其可在細菌中以正確折疊形式高水平表達。FNfn10支架與實際上任何展示技術兼容。參見,例如,Batori等,Protein Eng.15:1015-20,2002;和Wojcik等,Nat Struct Mol Biol.,2010和美國專利第6,673,901號。
Anticalin是指一類抗體模擬物,其通常由人脂質運載蛋白(具有由結構上剛性的框架支持的高變環區域的結合蛋白的家族)合成。參見,例如,美國申請第2006/0058510號。Anticalin通常具有約20kDa的大小。Anticalin可通過由八個反向平行的β-鏈(穩定的β-桶支架)形成的桶結構來表征,所述反向平行的β-鏈由四個肽環和附接的α-螺旋成對連接。在某些方面,在高變環區域中產生實現特異性結合的構象偏差。參見,例如,Skerra,FEBS J.275:2677-83,2008,通過引用并入本文。
治療劑,例如本文所述的抑制KLF轉錄因子與其內源性轉錄因子結合位點結合的結合劑可用于本文所述的任何方法和組合物。
使用方法
本發明的實施方案包括使用本文所述的治療劑(例如寡核苷酸誘餌、結合劑)和相關組合物調節一種或多種KLF轉錄因子的活性的方法,所述治療劑抑制或以其它方式減少一種或多種KLF轉錄因子與其內源性轉錄結合位點的結合。在具體實施方案中,所述一種或多種轉錄因子選自由KLF1、KLF2、KLF3、KLF4、KLF5、KLF6、KLF8、KLF9、KLF10、KLF11、KLF12、KLF13、KLF14、KLF15、KLF16和KLF17組成的組。
所述方法可用于例如治療受試者的疼痛,以調節存在于細胞中的參與感受傷害的信號傳導的基因的轉錄,調節存在于細胞中的參與受試者疼痛的感知的基因的轉錄,和/或調節例如受試者的細胞中的感受傷害的信號傳導。此類方法可以在體外實施,例如通過將細胞與治療劑(例如,寡核苷酸誘餌)或相關組合物接觸,或在體內實施,例如通過向有此需要的受試者施用治療劑(例如,寡核苷酸誘餌)或相關組合物。在具體實施方案中,治療劑是如本文所述的寡核苷酸誘餌或寡核苷酸誘餌的群體。
因此,某些實施方案包括用于治療受試者的疼痛的方法,包括向受試者施用治療有效量的治療劑,其中所述治療劑抑制轉錄因子與其轉錄結合位點的結合,并且其中所述轉錄因子來自由KLF1,KLF2,KLF3,KLF4,KLF5,KLF6,KLF8,KLF9,KLF10,KLF11,KLF12,KLF13,KLF14,KLF15,KLF16和KLF17組成的組。還包括治療有此需要的受試者的疼痛的方法,其包括向受試者施用治療有效量的本文所述的一種或多種寡核苷酸誘餌。在一些實施方案中,提供了預防受試者的疼痛的方法,例如治療或控制疼痛的預防性方法。此類方法包括向有此需要的受試者(例如,可能發展疼痛,例如手術后疼痛的患者)施用治療有效量的本文所述的寡核苷酸誘餌。
因此,在某些實施方案中,向遭受疼痛或預期遭受疼痛的有此需要的受試者(例如,諸如動物(例如,鳥、哺乳動物、靈長類動物、人患者)施用寡核苷酸誘餌和/或包含其的藥物組合物。疼痛的具體實例包括但不限于機械性疼痛(例如,機械痛覺過敏和/或異常性疼痛)、化學疼痛、溫度疼痛、慢性疼痛、亞慢性疼痛、急性疼痛、亞急性疼痛、炎性疼痛、神經性疼痛、肌肉疼痛、骨骼疼痛、手術后疼痛、神經根疼痛、背痛、關節炎疼痛和/或糖尿病疼痛。在某些實施方案中,向患者諸如動物施用寡核苷酸誘餌和/或其藥物組合物,作為針對疼痛的預防措施,所述疼痛包括但不限于前述疼痛實例中的任何一種或多種。在一些實施方案中,疼痛是手術后疼痛、慢性疼痛、炎性疼痛、神經性疼痛、肌肉疼痛和/或骨骼痛。在某些實施方案中,寡核苷酸誘餌和/或其藥物組合物可用于預防疼痛的一個方面,同時治療另一種疼痛癥狀。
在具體實施方案中,疼痛是慢性疼痛。在一些實施方案中,疼痛是神經性疼痛,例如慢性神經性疼痛和/或與炎癥(例如,神經炎癥)相關的(慢性)神經性疼痛。在某些實施方案中,疼痛與炎癥相關,例如與炎癥相關的慢性疼痛、與炎癥相關的慢性神經性疼痛。在一些實施方案中,疼痛與中樞神經系統和/或內臟病癥相關。在一些實施方案中,疼痛是手術后疼痛。
在一些實施方案中,被施用來治療、控制和/或預防疼痛的治療劑(例如,寡核苷酸誘餌、寡核苷酸誘餌的群體、結合劑)或組合物提供等于或小于約0.8或等于或高于約1.0(基于標準ELISA測定(參見上文)中的OD450值(或等效的標準ELISA測量單位))的KLF15/KLF9的結合比率。在具體實施方案中,前述治療劑用于治療神經性疼痛。
在具體實施方案中,被施用來治療、控制和/或預防疼痛的治療劑(例如,寡核苷酸誘餌、寡核苷酸誘餌的群體、結合劑)或組合物在標準ELISA測定(參見上文)中提供與預定量,例如約0.2OD450(或使用等效的標準ELISA測量單位的相當結合水平)的光密度值相等或高于其的對KLF6和KLF9的總轉錄因子結合能力。在一些實施方案中,KLF6和KLF9的總轉錄因子結合能力(如由1/(KLF6+KLF9)所指示的)等于或小于約5、4、3、2、1、0.5、0.1或更小(包括其間的所有范圍和整數)(基于來自標準ELISA測定的OD450值(或等效的標準ELISA測量單位,例如,熒光))。在具體實施方案中,前述治療劑用于治療與炎癥相關的疼痛或神經性疼痛。
還包括用于調節存在于細胞中的參與受試者的感受傷害的信號傳導和/或疼痛感知的基因的轉錄的方法,所述方法包括向所述細胞施用治療有效量的治療劑,其中所述治療劑抑制轉錄因子與其轉錄因子結合位點的結合,其中所述轉錄因子選自由KLF1、KLF2、KLF3、KLF4、KLF5、KLF6、KLF8、KLF9、KLF10、KLF11、KLF12、KLF13、KLF14、KLF15、KLF16和KLF17組成的組。在一些實施方案中,所述治療劑包括本文所述的一種或多種寡核苷酸誘餌。在某些實施方案中,轉錄的調節包括抑制或阻遏基因表達。在一些實施方案中,轉錄的調節包括穩定基因表達。在具體實施方案中,轉錄的調節包括活化或誘導基因表達。在某些實施方案中,所述基因參與感受傷害的信號傳導。涉及感受傷害的信號傳導的基因包括但不限于編碼膜蛋白(例如,離子通道、膜受體等)、可溶性信號傳導分子(例如,細胞內信號傳導分子或神經遞質)、合成酶(例如,神經遞質合成酶)和轉錄因子的基因。此類蛋白質的具體實例包括但不限于BDNF(由KLF9調節)、TGFB1(由KLF6調節)、CDKN1A、JUN、GFAP(由KLF15調節);和其它蛋白質諸如BDKRB2、HTR3A、SCN9A、GRM5、NOS1、GCH1、CDK5R1、CACNA1B、P2XR3和PNMT。
一些實施方案包括用于調節細胞中感受傷害的信號傳導的方法,其包括向所述細胞施用治療有效量的治療劑,其中治療劑抑制轉錄因子與其轉錄因子結合位點的結合,其中轉錄因子選自由KLF1、KLF2、KLF3、KLF4、KLF5、KLF6、KLF8、KLF9、KLF10、KLF11、KLF12、KLF13、KLF14、KLF15、KLF16和KLF17組成的組。在一些實施方案中,治療劑包括本文所述的一種或多種寡核苷酸誘餌。在某些實施方案中,感受傷害的信號傳導的調節包括抑制或阻遏感受傷害的信號傳導。在一些實施方案中,感受傷害的信號傳導的調節包括活化感受傷害的信號傳導的抑制劑。在具體實施方案中,感受傷害的信號傳導的調節包括增加參與細胞中感受傷害的信號傳導的蛋白質的蛋白水解降解。在某些實施方案中,蛋白質降解的調節包括刺激蛋白酶體功能。在某些實施方案中,蛋白質參與感受傷害的信號傳導。參與感受傷害的信號傳導的蛋白質包括但不限于膜蛋白(例如,離子通道、膜受體等)、可溶性信號傳導分子(例如,細胞內信號傳導分子或神經遞質)、合成酶(例如,神經遞質合成酶)和轉錄因子。此類蛋白質的具體實例包括但不限于BDNF(由KLF9調節)、TGFB1(由KLF6調節)、CDKN1A、JUN、GFAP(由KLF15調節);和其它蛋白質諸如BDKRB2、HTR3A、SCN9A、GRM5、NOS1、GCH1、CDK5R1、CACNA1B、P2XR3和PNMT。
在某些實施方案中,在體內(例如,在遭受疼痛或可能遭受疼痛的受試者中)提供各種方法的細胞。體內提供的細胞可位于不同位置,包括但不限于背根神經節和/或脊髓。在其它實施方案中,在體外(例如,在陪替氏培養皿中)提供各種方法的細胞。細胞可以是參與感受傷害的信號傳導的任何細胞,包括但不限于神經元(例如,來自背根神經節和/或脊髓或來自交感神經系統的疼痛神經元)、神經膠質細胞、組織支持性細胞(例如,成纖維細胞)、免疫細胞或來自細胞系的細胞(例如,PC12細胞)。
在一些實施方案中,寡核苷酸誘餌和/或其藥物組合物用于與至少一種其它治療劑的組合治療。其它治療劑的實例包括但不限于一種或多種另外的寡核苷酸誘餌。寡核苷酸誘餌和/或其藥物組合物和治療劑可累加地或更優選協同地起作用。在一些實施方案中,將寡核苷酸誘餌和/或其藥物組合物與另一治療劑(包括另一寡核苷酸誘餌)的施用同時施用。在其它實施方案中,在施用另一治療劑(包括另一寡核苷酸誘餌)之前或之后施用寡核苷酸誘餌或其藥物組合物。
對于向有此需要的受試者施用,可通過任何方便的途徑施用本文所述的寡核苷酸誘餌和/或藥物組合物。具體實例包括通過輸注或推注注射,通過經上皮或粘膜皮膚襯里(例如,口腔粘膜、直腸和腸粘膜等)的吸收以及通過口服施用的施用。施用可以是全身性的或局部的。各種遞送系統是本領域已知的,包括例如包封在脂質體、微粒、微膠囊、膠囊等中,其可用于施用化合物和/或其藥物組合物。施用方法包括但不限于真皮內、肌內、腹膜內、靜脈內、皮下、鼻內、硬膜外(epidural)/硬膜外(peridural)、口服、舌下、鼻內、腦內、陰道內、經皮、經直腸、通過吸入或局部(特別地至耳、鼻、眼或皮膚)施用。在某些實施方案中,神經周、硬膜外/硬膜外、鞘內或皮內施用寡核苷酸誘餌。在某些實施方案中,向患者施用多于一種寡核苷酸誘餌。優選的施用模式由醫生決定,并且將部分地取決于醫學病況的部位。
在具體實施方案中,可能需要向需要治療的區域局部施用一種或多種寡核苷酸誘餌。這可以例如但不限于通過在手術期間局部輸注、局部敷貼(例如,與手術后的傷口敷料結合)、通過注射、通過導管、通過栓劑,或通過植入物(所述植入物是多孔、非多孔或凝膠狀材料,包括膜,諸如硅橡膠膜或纖維)來實現。在一些實施方案中,施用可以是通過在疼痛部位(例如,先前、現在或預期的部位)直接注射。
在某些實施方案中,可能需要通過任何合適的途徑(包括但不限于腦室內、鞘內、神經周和/或硬膜外/硬膜外注射)將一種或多種寡核苷酸誘餌導入神經系統。腦室內注射可以通過腦室內導管(例如,附接于儲器諸如Ommaya儲器的)來促進。
也可以使用肺施用,例如通過使用吸入器或霧化器,以及具有霧化劑的制劑,或通過在碳氟化合物或合成肺表面活性劑中的灌注。
在治療或預防患者疼痛中將是有效的寡核苷酸誘餌的量將取決于病況的具體性質,并且可通過本領域已知的標準臨床技術來確定。另外,可任選地使用體外或體內測定來幫助鑒定最佳劑量范圍。所施用的寡核苷酸誘餌的量當然將取決于受治療的受試者、受試者的體重、痛苦的嚴重程度、施用方式和處方醫師的判斷等因素。在某些實施方案中,單劑量的寡核苷酸誘餌包含約5μg至約15mg、約50μg至約7.5mg、約100μg至約1mg、約250μg至約750μg,或約500μg的寡核苷酸誘餌/千克(kg)體重。
在一些實施方案中,劑型適于不超過每日兩次,更優選每日僅一次向患者施用。給藥可以單獨提供或與其它藥物組合提供,并且可持續長至有效治療或預防疼痛所需的時間。
組合物和試劑盒
某些實施方案包括組合物,例如藥物或治療組合物,其包含任選與一種或多種藥學上可接受的載體(例如,藥物級載體)組合的本文所述的一種或多種治療劑(例如,寡核苷酸誘餌、結合劑)。
本文公開的藥物組合物包含治療有效量的一種或多種治療劑(例如,寡核苷酸誘餌),優選以純化形式與合適量的藥學上可接受的載體一起,以提供用于向患者的適當施用的形式。當向患者施用時,治療劑諸如寡核苷酸誘餌和藥學上可接受的載體優選是無菌的。藥學上可接受的載體的實例包括但不限于鹽水、磷酸鹽緩沖鹽水(PBS)、tris緩沖液、水、含水乙醇、乳液諸如油/水乳液或甘油三酯乳液、片劑和膠囊。當靜脈內施用寡核苷酸誘餌時,水是優選的媒介物。鹽水溶液和葡萄糖水溶液以及甘油溶液也可用作液體媒介物,特別是用于可注射溶液。合適的藥學上可接受的載體還包括賦形劑諸如淀粉、葡萄糖、乳糖、蔗糖、明膠、麥芽、大米、面粉、白堊、硅膠、硬脂酸鈉、單硬脂酸甘油酯、滑石、氯化鈉、干脫脂乳、甘油、丙烯、乙醇、水、乙醇等。如果需要,藥物組合物還可含有少量的潤濕劑或乳化劑或pH緩沖劑。另外,可使用助劑、穩定劑、增稠劑、潤滑劑和著色劑。
藥物組合物可通過常規混合、溶解、制粒、糖衣丸制造、研磨、乳化、包封、包埋或凍干方法制備。可以以常規方式使用一種或多種生理學上可接受的載體、稀釋劑、賦形劑或助劑配制藥物組合物,其有利于將本文公開的化合物加工成可在藥學上使用的制劑。適當的制劑取決于所選擇的施用途徑。
藥物組合物可采取溶液、混懸劑、乳液、片劑、丸劑、丹劑、膠囊、含有液體的膠囊、粉劑、持續釋放制劑、栓劑、氣霧劑、噴霧劑、混懸劑或適合使用的任何其它形式的形式。合適的藥物媒介物的其它實例已經在本領域中進行了描述(參見Remington’s Pharmaceutical Sciences,Philadelphia College of Pharmacy and Science,第19版,1995)。
用于口服遞送的藥物組合物可呈片劑、錠劑、水性或油性混懸劑、顆粒劑、粉劑、乳劑、膠囊劑、糖漿劑或酏劑形式。口服施用的組合物可含有一種或多種任選的試劑,例如甜味劑諸如果糖、阿斯帕坦或糖精、調味劑諸如薄荷、冬青油或櫻桃著色劑和防腐劑,以提供藥學上可口的制劑。此外,當呈片劑或丸劑形式時,可包被組合物以延遲在胃腸道中的崩解和吸收,從而在延長的時段內提供持續的作用。口服組合物可包括標準媒介物諸如甘露醇、乳糖、淀粉、硬脂酸鎂、糖精鈉、纖維素、碳酸鎂等。此類媒介物優選是藥物級的。
對于口服液體制劑諸如例如混懸劑、酏劑和溶液劑,合適的載體、賦形劑或稀釋劑包括水、鹽水、亞烷基二醇(例如,丙二醇)、聚亞烷基二醇(例如,聚乙二醇)、油、醇、pH 4與pH 6之間的微酸性緩沖液(例如,在約5mM至約50mM之間的乙酸鹽、檸檬酸鹽或抗壞血酸鹽)等。另外,可以加入調味劑、防腐劑、著色劑、膽汁鹽、酰基肉堿等。
對于頰部施用,組合物可采取以常規方式配制的片劑、錠劑等形式。適合與噴霧器和液體噴霧裝置和EHD氣溶膠裝置一起使用的液體藥物制劑通常包括化合物與藥學上可接受的媒介物。在一些方面,藥學上可接受的媒介物是液體,諸如醇、水、聚乙二醇或全氟化碳。任選地,可添加另一種材料以改變化合物的溶液或混懸劑的氣溶膠性質。在一些方面,所述材料是液體諸如醇、二醇、聚乙二醇或脂肪酸。配制適用于氣溶膠裝置的液體藥物溶液或混懸劑的其它方法是本領域技術人員已知的(參見,例如Biesalski,美國專利第5,112,598號;Biesalski,美國專利第5,556,611號)。還可將化合物配制成直腸或陰道組合物,諸如例如含常規栓劑基質諸如可可脂或其它甘油酯的栓劑或保留灌腸劑。除了先前描述的制劑以外,還可將化合物配制為貯庫型制劑(depot preparation)。此類長效制劑可以通過植入(例如,皮下或肌內)或通過肌內注射進行施用。因此,例如,化合物可用合適的聚合物或疏水材料(例如,作為在可接受的油中的乳液)或離子交換樹脂配制,或配制為微溶衍生物,例如配制為微溶鹽。
可將寡核苷酸誘餌作為藥學上可接受的鹽、溶劑化物或水合物包含在任何本文所述的制劑中,或者任何其它合適的制劑中。藥學上可接受的鹽大體上保留母體化合物的活性,并且可通過與適當的堿或酸反應來制備,并且傾向于比相應的母體形式更易溶于水性和其它質子溶劑中。
在一些情況下,可將脂質體用于促進寡核苷酸誘餌至細胞中的攝取,例如在體外或在受試者中(參見,例如,Williams,S.A.,Leukemia10(12):1980-1989,1996;Lappalainen等,Antiviral Res.23:119,1994;Uhlmann等,Chemical Reviews,第90卷,No.4,25,第544-584頁,1990;Gregoriadis,G.,第14章,Liposomes,Drug Carriers in Biology and Medicine,第287-341頁,Academic Press,1979)。水凝膠也可以用作用于寡核苷酸誘餌施用的媒介物,例如,如WO 93/01286中所述的。或者,可將寡核苷酸誘餌在微球或微粒中施用。(參見,例如Wu,G.Y.和Wu,C.H.,J.Biol.Chem.262:4429-4432,30 1987)。或者,使用與寡核苷酸誘餌復合的充氣微泡可增強向靶組織的遞送,如美國專利第6,245,747號中所述的。也可使用持續釋放組合物。這些可包括以成型制品形式存在的半透性聚合物基質,諸如膜或微膠囊。
可使用本領域公認的技術(例如,轉染、電穿孔、融合、脂質體、膠體聚合物顆粒和病毒及非病毒載體以及本領域已知的其它方法)將寡核苷酸誘餌引入細胞。所選擇的遞送方法將至少取決于寡核苷酸化學、待處理的細胞和細胞的位置,并且對于本領域技術人員將是顯而易見的。例如,可以通過在表面上具有導向脂質體的特異性標志物的脂質體、直接注射至含有靶細胞的組織中、特異性受體介導的攝取等來實現定位。
如本領域中已知的,寡核苷酸誘餌可使用例如牽涉脂質體介導的攝取、脂質綴合物、聚賴氨酸介導的攝取、納米顆粒介導的攝取和受體介導的內吞作用的方法,以及另外的非內吞遞送模式諸如顯微注射、透化(例如,鏈球菌溶血素-O透化作用、陰離子肽透化作用)、電穿孔和本領域已知的各種非侵入性非內吞遞送方法(參見,例如,Dokka和Rojanasakul,Advanced Drug Delivery Reviews 44:35-49,通過引用整體并入)來進行遞送。
在某些實施方案中,在試劑盒中提供一種或多種寡核苷酸誘餌。在某些實施方案中,試劑盒包括例如用于使用所述一種或多種寡核苷酸誘餌的說明書。在某些實施方案中,所述說明書描述了本發明的一種或多種方法,例如用于預防或治療疼痛的方法,調節細胞中基因表達的方法,調節細胞中感受傷害的信號傳導的方法,調節細胞中的蛋白質降解等的方法。在某些實施方案中,試劑盒中提供的寡核苷酸誘餌以凍干形式提供。在某些相關實施方案中,包含一種或多種凍干的寡核苷酸誘餌的試劑盒還包含可用于重懸浮一種或多種寡核苷酸誘餌的溶液(例如,藥學上可接受的鹽水溶液)。
以下實施例旨在說明而非限制本發明。本文提及的每個專利和非專利參考文獻通過引用整體并入。
實施例
實施例1
靶向KLF家族用于治療疼痛
設計針對轉錄因子(KLF)的Krüppel樣家族成員的寡核苷酸誘餌,其特征在于KLF結合,并在神經性疼痛和神經炎性疼痛的動物模型中對其測試。
跨兩個單獨的神經性和神經炎性疼痛模型(如下所述的)的KLF結合模式、功效幅度和持續時間的交叉分析顯示,寡核苷酸誘餌TF D16(GATCCTTTGCCTCCTTCGATCCTTTGCCTCCTTCAAG;SEQ ID NO:37)和TFD17(GGTGTTTGGGAGAGCTTTGGGAGGATACG;SEQ ID NO:38)在兩種模型中均有效,并通過抑制KLF6,9和/或15起作用(數據未顯示)。這些數據表明,通過KLF9和KLF15的組合抑制,減輕慢性神經性疼痛的功效是有效的,通過KLF6和KLF9的組合抑制,減輕慢性神經炎性疼痛的功效是有效的。
因此,選擇TFD16和TFD17作為序列矩陣來產生具有互補KLF6、9和15結合模式的另外的寡核苷酸誘餌序列。基于該分析,制備表2(上文)中的寡核苷酸誘餌,測試其的KLF結合,并且如下所述,在疼痛的動物模型中進一步測試表E1(下文)中的那些寡核苷酸誘餌。
ELISA測定。使用定制版本的SP1商業ELISA試劑盒(SP1ELISA試劑盒,目錄號EK-1090,Affymetrix)測量寡核苷酸誘餌的KLF結合。簡言之,將生物素-誘餌探針(12.8皮摩爾/孔)與15μg的含有KLF轉錄因子的核蛋白提取物一起孵育,所述提取物來自(a)HELA細胞:用于KLF1-6、8-14和16-17檢測(目錄#36010,活性基序,CA),或(b)HEK290:用于KLF15檢測(目錄#36033,活性基序,CA)。對于KLF 7檢測,使用0.5和1μg重組人KLF7蛋白(Novus,CA,目錄號NBP2-23176)。
根據ELISA試劑盒供應商進行誘餌探針-蛋白質混合物的加工:將混合物加載在鏈霉抗生物素蛋白包被的96孔板上,并在微量板讀數器(OD450nm)中用基于抗體的比色檢測(綴合于HRP的抗-兔第二抗體)測量捕獲的KLF的量。當將遞增濃度的競爭性非生物素化誘餌添加至結合混合反應時,結合至生物素化探針的轉錄因子的減少是結合特異性的證明。針對內部測量的每一個ELISA運行的本底信號對所有數據進行標準化,并根據試劑盒供應商的推薦標準化所有測試步驟和測試條件,包括利用檢測緩沖液的檢測時間(即,對于該測定,5.2分鐘被測定為最佳的),以確保ELISA運行之間的強力(brute)OD450結合值的適當比較。
對于ELISA測定,每種誘餌的單鏈由Invitrogen(CA)制造,將其重懸于100μM的TE pH 8,NaCl 50μM中的原液中,并如下在4μM工作溶液中退火:(a)誘餌混合物(100μL):4μL反義鏈(100μM)+4μl反義鏈(100μM)+89.5μl TE pH 8+2.5μl NaCl(1.94M);(b)退火:在95°下7分鐘,隨后在使用或于-20℃下貯存之前在室溫下緩慢冷卻1小時。
通過測量結合信號線性、與游離競爭劑KLF誘餌的結合的減少,以及通過缺乏與突變型誘餌結合的KLF來評估結合特異性(參見下表E2)。
兔第一KLF抗體從商購可得來源獲得,并且用于KLF測定的綴合于HRP的第二抗兔抗體是ELISA試劑盒中提供的抗體(稀釋度1:200)。
體內功效研究。下面提供了用于疼痛動物模型的材料和方法。
動物。Sprague-Dawley大鼠,250-300g,雄性,Harlan Industries(Livermore,CA)。
測試和對照用品。對于動物測試,寡核苷酸誘餌由Trilink Biotechnologies(CA)制造并被配制為10mM或15mM原液(Tris-pH 7.5,CaCl2)。對于選定的劑量遞送,以適當濃度制備用于20μL注射的每種誘餌。以盲法方式和在即用型小瓶中將供寡核苷酸誘餌和媒介物對照(Tris-10mM,140mM NaCl,pH 7.5)提供至測試部位。
保留性神經損傷(SNI)模型。以2L/分鐘用2%的O2中的異氟烷誘導麻醉,并用0.5%的O2中的異氟烷來維持麻醉。然后剃刮大鼠并且將其無菌地準備用于手術。基于由Decosterd等描述的方法(Decosterd和Woolf,2000)進行保留性神經損傷。簡言之,切開左大腿的皮膚和筋膜,股二肌(m.biceps femoris)的兩頭擴展,暴露坐骨神經的3個末端分支。緊密結扎脛骨和腓總神經,遠端解剖以結扎,去除2-3mm的神經干。腓腸分支完好無損。以分層方式封閉傷口。
慢性壓迫性損傷(CCI)模型。根據慢性壓迫性損傷模型(Bennett和Xie,1988),通過經過股二頭肌的鈍性解剖在大腿中部的水平暴露右側共同坐骨神經。在坐骨三叉分枝附近,約12mm的神經沒有粘附組織,并且四個結扎線以約1mm的間距松弛地圍繞所述神經。所受影響的神經的長度為約6-8mm長。注意綁扎結扎線,以使得當用40倍放大倍數觀察時,看到神經的直徑恰好幾乎不縊縮。期望的縊縮程度延遲但不阻止通過表面神經脈管系統的循環,并且有時在暴露的周圍的肌肉中產生小的短暫的顫搐。在層中封閉切口。
機械超敏性。使用重復von Frey細絲測試將疼痛測量為機械超敏性。簡言之,使用von Frey細絲(1-4-6-8-10-10-26g)測試對后爪機械刺激的反應性。在測試前1小時,使動物習慣在網孔地板上,并且每個細絲應用五次。對于每個應用,用足以引起輕微彎曲的垂直于爪壓靠毛發,并保持約1-2秒。如果爪急劇撤回,則注意到陽性反應。在除去毛發后立即退縮也被認為是陽性反應。按照上述模式連續提供刺激。在手術前和注射前后的確定的時間點在基線測試動物。
盲法和隨機化。所有實驗都是盲法進行的。測試地點接受盲法小瓶,并且盲測代碼在測試完成后破裂。
在基線疼痛測試后和給藥前在POD14進行隨機化。對于每個測試的組群,將動物分布在2至3只大鼠的組中,以使得平均POD14von Frey值盡可能接近測試組,如果值允許,靶向彼此的15%內。一旦動物被分成組,針對組的溶液處理的性質是由實驗者自行決定的。
預定義的納入與排除標準。從結果分析排除在第一次注射當天(即,POD14)具有≤5的von Frey值的動物。為5的von Frey值基于跨多個測試部位的內部歷史數據,其中大鼠可在基礎條件下,手術前達到該值,因此是模型誘導的超敏反應的不存在/存在的閾值。如果在注射后的第一周期間,媒介物處理的機超敏性值的平均值減小50%或更多,則基于疼痛模型沒有適當地執行的理由排除該組群。
鞘內遞送。鞘內遞送寡核苷酸誘餌。將Sprague-Dawley大鼠用2%異氟烷麻醉,將其背部剃毛并用聚維酮碘(Betadine)來制備。然后將大鼠放在瓶上以保持背部拱起。將17G 1/2針沿著L6椎骨水平橫突的左側向嘴側滑動,直至其達到L5椎骨水平。然后將針插入L5與L6之間,直至達到鞘內空間,如通過尾部顫搐所指示的。然后鞘內(IT)注射20μL的誘餌或媒介物。取決于研究,大鼠在手術后于POD14,或在POD14和在POD17接受單次IT注射一次。
統計分析。使用非參數學生T檢驗,隨后通過不均勻方差校正的T-Welsh分析來分析個體時間點和實驗條件之間的數據分布比較。
來自KLF結合ELISA分析以及利用單一劑量水平的誘餌的疼痛的CCI和SNI動物模型的結果示于圖1-3B中。圖1顯示來自表2和E1的寡核苷酸誘餌相對于獨立對照KLF誘餌(以灰色突出顯示;參見,例如Shields和Yang,1998;Matsumuto等,1998)的KLF結合特征。針對KLF6、KLF9和KLF15的結合值表示為來自實施例1中描述的體外ELISA結合測定的平均值和SEM OD450值。還列出了相應的N。治療神經性疼痛和/或神經炎性疼痛的功效表示為在相應動物研究的測試期間相對于對照的疼痛減輕的百分比(%)。
圖2A-B顯示了測試的寡核苷酸誘餌在慢性神經性疼痛的SNI模型中的功效,圖3A-B顯示了測試的寡核苷酸誘餌在慢性神經炎性疼痛的CCI模型中的功效。
進行體內測試的所有寡核苷酸誘餌的組合體內功效和體外結合結果的詳細薈萃分析,以表征KLF結合模式與寡核苷酸誘餌的功效之間的關系。圖4A-C顯示與它們的KLF15/KLF9結合比率相關的用于治療慢性神經性疼痛的寡核苷酸誘餌的功效水平(4A),用于治療慢性神經性疼痛的功效與對KLF6、KLF9和KLF15的結合參數之間的線性相關系數(4B),以及與KLF15/KLF9結合比率相關的功效水平的線性回歸(4C)。
類似地,圖5A-C顯示與它們的對KLF6、KLF9和KLF15的組合結合相關的用于治療慢性神經炎性疼痛的寡核苷酸誘餌的功效水平(5A),治療慢性神經炎性疼痛的功效與對KLF6、KLF9和KLF15的結合參數之間的線性相關系數(5B),和與對KLF6和KLF9的總轉錄因子結合能力相關的功效水平(如通過1/(KLF6+KLF9)結合比率指示的)的線性回歸(5C)。
圖6顯示跨補充性病原性疼痛(從神經性疼痛(Y-軸)至包括炎性組分的疼痛(X-軸))的來自本發明的誘餌相對于來自文獻的對照KLF共有誘餌(TFDC1、TFDC2和TFD3)的功效的差異和優異模式。
圖7顯示表2中的寡核苷酸誘餌的1/(KLF6+KLF9)結合比率(其表示治療神經炎性疼痛的功效)(越低,則功效越強)和KLF15/KLF9結合比率(其指示治療神經性疼痛的功效)(越高,則功效越強))的曲線圖。X軸中的每個數字對應于個體誘餌。
為了進一步表征16.6.5寡核苷酸誘餌的治療特征,在SNI和CCI動物模型中進行劑量反應研究。圖8A-B顯示了在這兩種疼痛動物模型中從50至300納摩爾的遞增劑量水平的穩固和持久的功效。
總之,這些研究不僅鑒定將KLF轉錄因子的家族鑒定為用于治療疼痛的治療相關性靶標,而且還相對于先前描述的KLF序列鑒定了一組寡核苷酸序列,所述寡核苷酸序列對KLF轉錄因子具有獨特的結合特征,所述結合特征與用于治療跨多個病因的體內疼痛的獨特和強勁的潛力相關。
序列表
<110> Adynxx, Inc.
Mamet, Julien
Orr, Rick
Manning, Don
Harris, Scott
Martin, William
<120> 用于疼痛治療的寡核苷酸誘餌
<130> ADDY-003/01WO
<150> US 62/037,996
<151> 2014-08-15
<160> 42
<170> PatentIn 3.5版
<210> 1
<211> 32
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<220>
<221> misc_feature
<222> (1)..(4)
<223> 核苷酸1-4可以存在或可以不存在
<220>
<221> misc_feature
<222> (17)..(17)
<223> n為a, c, g或t
<220>
<221> misc_feature
<222> (20)..(21)
<223> n為a, c, g或t
<220>
<221> misc_feature
<222> (23)..(24)
<223> n為a, c, g或t
<220>
<221> misc_feature
<222> (19)..(32)
<223> 核苷酸19-32可以存在或可以不存在
<400> 1
atccttygmm tyykycnhhn nvnnymhwbv aw 32
<210> 2
<211> 28
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<220>
<221> misc_feature
<222> (1)..(5)
<223> 核苷酸1-5可以存在或可以不存在
<220>
<221> misc_feature
<222> (12)..(12)
<223> n為a, c, g或t
<220>
<221> misc_feature
<222> (15)..(15)
<223> n為a, c, g或t
<220>
<221> misc_feature
<222> (17)..(18)
<223> n為a, c, g或t
<220>
<221> misc_feature
<222> (19)..(28)
<223> 核苷酸19-28可以存在或可以不存在
<400> 2
tgtkbkkddv dnsdnbnndv mbvmhrma 28
<210> 3
<211> 18
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<400> 3
tttgcctcct tcgatccc 18
<210> 4
<211> 18
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<400> 4
atcctttgcc tccttcga 18
<210> 5
<211> 32
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<400> 5
atcctttgcc tccttccctt tgcctccttc aa 32
<210> 6
<211> 28
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<400> 6
cctttgcctc cttccctttg cctccttc 28
<210> 7
<211> 32
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<400> 7
atcctttgcc tccttcgaag gaggcaaagg at 32
<210> 8
<211> 31
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<400> 8
atcctttgcc tccttccttt gcctccttca a 31
<210> 9
<211> 27
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<400> 9
atcctttgcc tccttcgcct ccttcaa 27
<210> 10
<211> 23
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<400> 10
cctttgcctc cttcgcctcc ttc 23
<210> 11
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<400> 11
atcctttgcc tccttctcct tcaa 24
<210> 12
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<400> 12
atcctttgcc tttgcctcct tcaa 24
<210> 13
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<400> 13
cctttgcctt tgcctccttc 20
<210> 14
<211> 15
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<400> 14
tgtttgggag agctt 15
<210> 15
<211> 15
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<400> 15
gctttgggag gatac 15
<210> 16
<211> 16
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<400> 16
tgggagagct ttggga 16
<210> 17
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<400> 17
tgtttgggag atttgggagg atac 24
<210> 18
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<400> 18
tttgggagat ttgggaggat 20
<210> 19
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<400> 19
tgtttgggag aatcctccca aagc 24
<210> 20
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<400> 20
tttgggagaa tcctcccaaa 20
<210> 21
<211> 27
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<400> 21
tgtttgggag agctatcctc ccaaagc 27
<210> 22
<211> 23
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<400> 22
tttgggagag ctatcctccc aaa 23
<210> 23
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<400> 23
tgtttgggag agggaggata c 21
<210> 24
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<400> 24
tgtttgggtt tgggaggata c 21
<210> 25
<211> 25
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<400> 25
cctttgcctc cttcgcctcc ttcaa 25
<210> 26
<211> 25
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<400> 26
tcctttgcct ccttcgcctc cttca 25
<210> 27
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<400> 27
cctttgcctc cttcgcctcc ttca 24
<210> 28
<211> 18
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<400> 28
atccttcgcc tccttcaa 18
<210> 29
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<400> 29
atccttcgcc ttcgcctcct tcaa 24
<210> 30
<211> 27
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<400> 30
atccttcgcc tccttcgcct ccttcaa 27
<210> 31
<211> 22
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<400> 31
tgtttgggag aatcctccca aa 22
<210> 32
<211> 22
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<400> 32
tttgggagaa tcctcccaaa gc 22
<210> 33
<211> 22
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<400> 33
gtttgggaga atcctcccaa ag 22
<210> 34
<211> 25
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<400> 34
atccttcgcc tccttctccc aaagc 25
<210> 35
<211> 22
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<400> 35
atccttcgaa tccttccaaa gc 22
<210> 36
<211> 28
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<400> 36
gcgcacccca gcctggctca cccacgcg 28
<210> 37
<211> 37
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<400> 37
gatcctttgc ctccttcgat cctttgcctc cttcaag 37
<210> 38
<211> 29
<212> DNA
<213> 人工序列
<220>
<223> KLF誘餌寡核苷酸
<400> 38
ggtgtttggg agagctttgg gaggatacg 29
<210> 39
<211> 33
<212> DNA
<213> 人工序列
<220>
<223> 游離競爭劑KLF誘餌寡核苷酸
<400> 39
atgcaggaga aagattggcg tagtatctac tag 33
<210> 40
<211> 33
<212> DNA
<213> 人工序列
<220>
<223> 游離競爭劑KLF誘餌寡核苷酸
<400> 40
cttcatgatt ttattgcttt caaaatccaa aat 33
<210> 41
<211> 30
<212> DNA
<213> 人工序列
<220>
<223> 游離競爭劑 KLF誘餌寡核苷酸
<400> 41
gttatgcgtt tgtagatgct ttcgttatag 30
<210> 42
<211> 30
<212> DNA
<213> 人工序列
<220>
<223> 游離競爭劑KLF誘餌寡核苷酸
<400> 42
ctatttcgaa acgatctaca ttggcataac 30
- 還沒有人留言評論。精彩留言會獲得點贊!