心臟細胞培養材料的制作方法
本發明涉及心臟細胞培養材料,以及在具有壁面和/或底面的培養基材的壁面和/或底面上使用該心臟細胞培養材料進行涂覆的細胞培養基材。另外,本發明涉及通過使用該心臟細胞培養材料來培養心臟細胞而得到的人工器官材料及其制造方法。
背景技術:
成纖維細胞幾乎存在于所有脊椎動物中,并且當組織被創傷和缺血造成傷害的時候,受傷害的區域通過成纖維細胞增殖和豐富的細胞外基質沉積而被纖維組織置換。同樣,在諸如心肌梗塞和心肌疾病的各種心臟疾病中,很多心肌細胞喪失,纖維組織也置換該區域,引起心臟重塑以及伴隨過剩的血液動力學壓力和神經體液性刺激的心力衰竭。盡管公知的是諸如血管緊張素II和內皮素-1的神經體液因子有助于通過升高血壓、心肌細胞凋亡和局部炎癥促進心臟重塑,已報道心臟成纖維細胞分泌這些因子。眾所周知,心臟成纖維細胞在心臟發育中擔負重要作用。在心臟成纖維細胞中相互連接的細胞過程形成膠原、成纖維細胞和肌細胞的網絡。雖然心肌細胞增殖是厚的心室壁的形成的必不可少的過程,但是也已報道胚性心臟成纖維細胞通過β1整聯蛋白信號轉導促進心肌的有絲分裂活性。產生心臟成纖維細胞占優勢的效果的物質迄今無人知曉。在此,由于心臟成纖維細胞通過各種各樣的方法作用于心臟發育和發病中,理解心肌細胞和心臟成纖維細胞之間的相互作用和潛在機制的重要性被廣泛認可。但是,心臟成纖維細胞的尚不明確的特性成為其瓶頸,需要明確心臟成纖維細胞的功能和分子生物學性質。
心臟組織工程不僅對于再生醫療,而且對于組織模型也是有前景的方法。在心臟組織工程方法中,開發了使用溫度應答性培養皿的基于細胞片層的心臟組織。此前,據報道在各種類型的血管床上,包含新生大鼠來源的心肌細胞、成纖維細胞和內皮細胞的心臟細胞片層的分層,使得可以對血管化的能存活的心臟組織進行三維構建(非專利文獻1~3)。因為基于細胞片層的組織工程不需要任何支架,所以需要一些量的細胞外基質以構建細胞片層。與左心室主要由成纖維細胞和心肌細胞構成的證據相一致,在使用來自于純化的胚胎干細胞的心肌細胞時,一定量的成纖維細胞對于構建心臟細胞片層來說是必不可少的(非專利文獻4)。由于最近的報告表明心肌細胞和非肌細胞之間的細胞-細胞相互作用對于心臟的生理學和病理而言是重要的(非專利文獻5),心臟成纖維細胞功能也可能對工程化的心臟組織的功能產生影響,并且為了在體外構建用于組織模型的心臟組織,選擇合適的成纖維細胞可能是前提。但是,與其它成纖維細胞以及相關的分子機理相比,尚不明確心臟成纖維細胞是否對心肌細胞具有特別的功能。
如上所述,因為心臟成纖維細胞在心臟發育和心臟病的發病或治愈中具有重要作用,所以需要將專門作用于諸如心肌細胞的心臟細胞的心臟成纖維細胞與其它成纖維細胞分離開并對心臟成纖維細胞進行取樣。以前認為成纖維細胞是均一的細胞種類,最近的研究表明成纖維細胞具有非常多樣的表型,并且表明根據所存在的器官、組織或細胞的負荷狀態,該表型不同。
但是,成纖維細胞的功能不太清楚,并且成纖維細胞僅是在形態學上分類的細胞。因此,在成纖維細胞中,難以僅選擇具有特定功能的一種類型的成纖維細胞。
另一方面,對于VCAM-1和α4整聯蛋白,Kwee等報道了VCAM-1在胎齡11.5天在心外膜、心肌細胞和心室間隔等處表達。還報道了盡管α4整聯蛋白的表達與VCAM-1的表達在類似的區域發現,但是α4整聯蛋白在心室間隔中不表達(非專利文獻6)。此外,報道了在VCAM-1缺失的胚胎中,在胎齡11.5天,存在由胎盤形成受阻引起的胚胎死亡以及歸因于心室間隔和心室肌的致密層的減少的畸形。Yang等還報道了胎齡11.5天的α4整聯蛋白無效(null)的胚胎中的心外膜缺陷(非專利文獻7)。因此,認為VCAM-1和α4整聯蛋白主要有助于在胚胎期的心臟細胞和心外膜的形成。
現有技術文獻
非專利文獻
非專利文獻1:Shimizu T,et al.,Fabrication of pulsatile cardiac tissue grafts using a novel 3-dimensional cell sheet manipulation technique and temperature-responsive cell culture surfaces.Circulation research.2002;90:e40
非專利文獻2:Sekiya S,et al.,Bioengineered cardiac cell sheet grafts have intrinsic angiogenic potential.Biochemical and biophysical research communications.2006;341:573-582
非專利文獻3:Shimizu T,et al.,Cell sheet engineering for myocardial tissue reconstruction.Biomaterials.2003;24:2309-2316
非專利文獻4:Matsuura K,et al.,Hagiwara N,Zandstra PW,Okano T.Creation of mouse embryonic stem cell-derived cardiac cell sheets.Biomaterials 2011;32:7355-7362
非專利文獻5:Deschamps AM,et al.,Disruptions and detours in the myocardial matrix highway and heart failure.Current heart failure reports.2005;2:10-17
非專利文獻6:Kwee L,et al.,Defective development of the embryonic and extraembryonic circulatory systems in vascular cell adhesion molecule(vcam-1)deficient mice.Development(Cambridge,England).1995;121:489-503
非專利文獻7:Yang JT,et al.,Cell adhesion events mediated by alpha 4integrins are essential in placental and cardiac development.Development(Cambridge,England).1995;121:549-560
技術實現要素:
技術問題
本發明的目的是提供特異性地作用于心臟細胞的心臟細胞培養材料,以及提供在具有壁面和/或底面的培養基材的壁面和/或底面上使用該心臟細胞培養材料進行涂覆的細胞培養基材。另外,本發明的另一目的是提供通過使用該心臟細胞培養材料來培養心臟細胞而得到的人工器官材料及其制造方法。
技術手段
已弄清楚的是,在心臟細胞培養中通過使用含有VCAM-1蛋白質的心臟細胞培養材料而良好地構建了功能性心臟組織。因此,將該心臟細胞培養材料涂覆于具有壁面和/或底面的培養基材的壁面和/或底面上,并且可以作為細胞培養基材使用。可以將通過使用心臟細胞培養材料培養的心臟細胞用作人工器官材料。
也就是說,本發明包括下述內容:
[1]含有VCAM-1蛋白質的心臟細胞培養材料。
[2]如[1]所述的心臟細胞培養材料,其中,所述VCAM-1蛋白質是從動物材料分離并純化的VCAM-1、VCAM-1重組蛋白質或表達VCAM-1蛋白質的細胞。
[3]如[1]或[2]所述的心臟細胞培養材料,所述心臟細胞培養材料用于培養以構建心臟組織。
[4]如[2]或[3]所述的心臟細胞培養材料,其中,所述表達VCAM-1蛋白質的細胞是表達VCAM-1蛋白質的成纖維細胞。
[5]如[4]所述的心臟細胞培養材料,其中,所述成纖維細胞是來自于心臟的成纖維細胞。
[6]如[4]或[5]所述的心臟細胞培養材料,其中,所述成纖維細胞是心外膜來源的成纖維細胞。
[7]細胞培養基材,其中,將具有壁面和/或底面的培養基材的壁面和/或底面用[1]-[6]所述的心臟細胞培養材料進行涂覆。
[8]人工器官材料,所述人工器官材料通過將[1]-[6]所述的心臟細胞培養材料與心臟細胞共培養而得到。
[9]制造人工器官材料的方法,所述方法包括將[1]-[6]所述的心臟細胞培養材料與心臟細胞共培養的步驟。
[10]一種試劑,所述試劑用于篩選含有抗VCAM-1抗體的心臟細胞培養材料。
[11]表達VCAM-1蛋白質的來自于心臟的成纖維細胞。
[12]如[9]所述的制造人工器官材料的方法,其中,所述方法進一步包括從培養基材分離和收集經培養的細胞的步驟。
[13]如[12]所述的制造人工器官材料的方法,其中,前述培養基材是溫度敏感性培養皿,前述剝離通過溫度變化進行。
發明的有益效果
通過使用本發明的心臟細胞培養材料培養心臟細胞,可以構建能夠用于再生醫療和組織模型中的功能性心臟細胞。可將該心臟細胞培養材料在具有壁面和/或底面的培養基材的壁面和/或底面上涂覆,可以將其作為細胞培養基材使用。進一步地,可以將通過培養得到的心臟細胞或心臟組織作為人工器官材料使用。
附圖說明
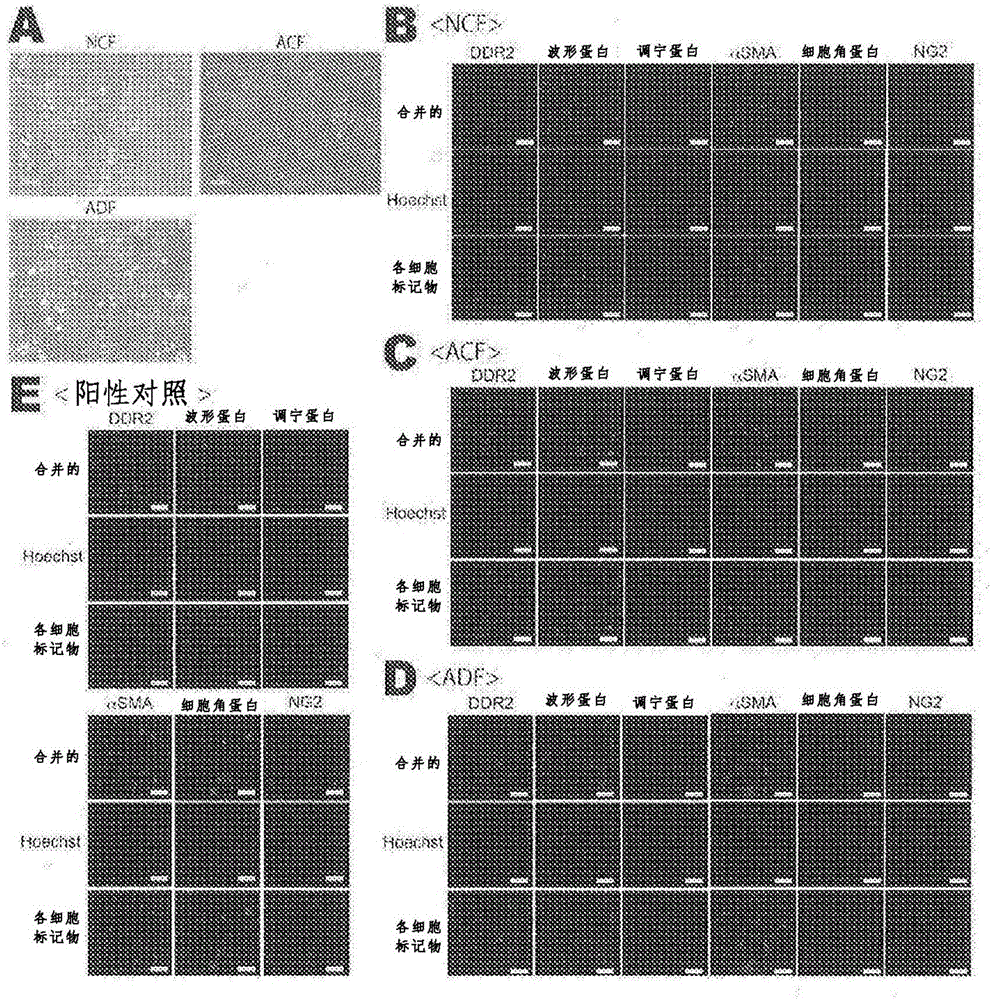
圖1是NCF、ACF和ADF的顯微鏡觀察(照片)。圖1A是各成纖維細胞的明視野顯微鏡圖像。圖1B-圖1E是DDR2、波形蛋白及αSMA表達的代表性圖片(大部分成纖維細胞不表達調寧蛋白、細胞角蛋白11或NG2)。
圖2是與成纖維細胞共培養的mESC來源的心臟細胞片層的特性的差異(照片)。圖2A是在分離前,在NCF和ACF共培養片層上觀察到自律搏動(beating)的許多細胞塊。溫度下降后,在mESC來源的心肌細胞和成纖維細胞(﹣)中未觀察到細胞片層的形成。圖2B是在各細胞片層上的細胞外動作電位。在各通道中觀察到ACF或NCF共培養片層中的動作電位。但是,在ADF共培養膜片上的動作電位以一次性出現(環繞線表示細胞片層的形狀)。圖2C是通過共聚焦顯微鏡觀察到的各細胞培養皿中的免疫熒光染色。YFP發射綠色(黃色)熒光(YFP:激發波長514nm,熒光波長527nm),而波形蛋白發射紅色熒光(cy3:激發波長512nm,熒光波長552nm),且核以hoechst 33258(藍色)(hoechst 33258:激發波長352nm,熒光波長461nm)染色。共聚焦顯微鏡觀察表明,同與成纖維細胞(﹣)或ADF共培養的細胞相比,與NCF或ACF共培養的細胞具有最大數量的YFP(+)細胞。圖2D是通過共聚焦顯微鏡觀察到的各細胞培養皿中的免疫熒光染色。cTnT發射綠色熒光(FITC:激發波長488nm,熒光波長530nm),波形蛋白發射紅色熒光(cy3:激發波長512nm,熒光波長552nm),且核以hoechst 33258(藍色)(hoechst 33258:激發波長352nm,熒光波長461nm)染色。共聚焦顯微鏡觀察表明,同與成纖維細胞(﹣)或ADF共培養的細胞相比,與NCF或ACF共培養的細胞具有最大數量的cTnT(+)細胞。圖2E為顯示出各細胞培養皿中的YFP(+)細胞或cTnT(+)細胞的數量增加的柱形圖。將成纖維細胞(﹣)中的YFP(+)細胞或cTnT(+)細胞的數量設定為1。同ADF共培養或成纖維細胞(﹣)的培養皿中的相比,在NCF或ACF培養皿中觀察到更多數量的YFP(+)和cTnT(+)細胞。此外,在NCF和ACF之間的心肌細胞數量方面沒有顯著性關系。(N=3,**P<0.01)
圖3是在各細胞培養皿中的細胞培養開始第1天和第5天的心肌細胞的數量(照片)。圖3A是使用共聚焦顯微鏡的在各細胞培養皿中的細胞培養開始第1天的免疫熒光染色。YFP發射綠色(黃色)熒光(YFP:激發波長514nm,熒光波長527nm),而cTnT發射紅色熒光(cy3:激發波長512nm,熒光波長552nm),且核以hoechst 33258(藍色)(hoechst 33258:激發波長352nm,熒光波長461nm)染色。圖3B是通過共聚焦顯微鏡觀察到的在各細胞培養皿中的細胞培養開始第5天的免疫熒光染色。YFP發射綠色(黃色)熒光(YFP:激發波長514nm,熒光波長527nm),而cTnT發射紅色熒光(cy3:激發波長512nm,熒光波長552nm),且核以hoechst 33258(藍色)(hoechst 33258:激發波長352nm,熒光波長461nm)染色。圖3C是在各細胞培養皿中的心肌細胞的數量。柱形圖顯示出YFP(+)細胞和cTnT(+)細胞的數量的增加(將成纖維細胞(-)的培養開始第1天的值設為1)。在ACF和NCF培養皿中,與培養開始第1天的心肌細胞相比,在培養開始第5天觀察到更多數量的心肌細胞。但是,在其它的培養皿中,第1天和第5天之間的心肌細胞的數量沒有差異。在ACF和NCF之間,未觀察到顯著差異。(N=3,**P<0.01)
圖4是通過免疫熒光染色進行的心肌細胞增殖的評價(照片)。圖4A是通過使用共聚焦顯微鏡進行的在各個共培養皿中的Ki67陽性心肌細胞的免疫熒光染色觀察。cTnT發射綠色熒光(FITC:激發波長488nm,熒光波長530nm),而Ki67發射紅色熒光(cy3:激發波長512nm,熒光波長552nm),且核以hoechst 33258(藍色)(hoechst 33258:激發波長352nm,熒光波長461nm)染色。圖4B是在各培養皿中的Ki67(+)或磷酸化組蛋白3(phosphor S10;Phh3)(+)心肌細胞的百分比(N=4,**P<0.01)。圖4C是通過使用共聚焦顯微鏡進行的在各培養皿中的磷酸化組蛋白3(phosphor S10;Phh3)陽性心肌細胞的免疫熒光染色觀察。cTnT發射綠色熒光(FITC:激發波長488nm,熒光波長530nm),而磷酸化組蛋白3(phosphor S10;Phh3)發射紅色熒光(cy3:激發波長512nm,熒光波長552nm),且核以hoechst 33258(藍色)(hoechst 33258:激發波長352nm,熒光波長461nm)染色。圖4D是在各培養皿中的磷酸化組蛋白3(phosphor S10;Phh3)(+)心肌細胞的百分比(N=4,**P<0.01)。圖4E、圖4F是在各培養皿中的心肌細胞的BrdU FACS測定(N=3,**P<0.01)。圖4G是通過使用共聚焦顯微鏡進行的在插入式培養皿中的在培養開始第1天和第5天的YFP(+)和cTnT(+)的免疫熒光染色觀察。YFP發射綠色(黃色)熒光(YFP:激發波長514nm,熒光波長527nm),而cTnT發射紅色熒光(cy3:激發波長512nm,熒光波長552nm),且核以hoechst 33258(藍色)(hoechst 33258:激發波長352nm,熒光波長461nm)染色。圖4H為顯示出在第1天和第5天的YFP(+)細胞和cTnT(+)細胞的數量的增加的柱形圖。將第1天的YFP(+)細胞和cTnT(+)細胞的數量設為1。在第5天觀察到心肌細胞的增殖(N=4,**P<0.01)。
圖5A是ADF和NCF的全面的基因簇分析(照片)。該基因熱圖顯示出ADF和NCF之間的顯著的差異。該圖被分為兩個組。第1組僅由ADF構成,而第2組僅由NCF構成。圖5B是通過實時PCR測定的VCAM-1基因的表達水平。在NCF中的VCAM-1的表達水平顯著地高。在NCF中的VCAM-1基因的數量比起在ADF中的更高16倍(N=3,*P<0.05)。圖5C-圖5D是在蛋白質印跡分析中的NCF和ADF中的VCAM-1蛋白質的表達水平。將如下的瞬時過表達細胞裂解物作為陽性對照使用:Sol8(SantaCruz,CA,USA)。將各細胞的β-肌動蛋白的標記峰設為1(N=3,**P<0.01)。圖5E是mESC來源的心肌細胞上的VCAM-1受體(α4β1)的免疫熒光染色。圖5F是mESC來源的心肌細胞上的VCAM-1受體的蛋白質印跡分析。將如下的瞬時過表達細胞裂解物作為陽性對照使用:Jurkat全細胞裂解物。
圖6是通過免疫熒光染色分析進行的心臟生長因子的鑒定(照片)。圖6A-圖6B是第5天中和抗體針對的心肌細胞的效果的免疫熒光染色觀察。YFP發射綠色(黃色)熒光(YFP:激發波長514nm,熒光波長527nm),而cTnT發射紅色熒光(cy3:激發波長512nm,熒光波長552nm),且核以hoechst 33258(藍色)(hoechst 33258:激發波長352nm,熒光波長461nm)染色。當通過使用VCAM-1中和抗體將NCF與心肌細胞進行共培養時,在第5天心肌細胞的數量減少。同時,當使用同種型對照時,對第5天的心肌細胞的數量無影響(N=3,**P<0.01)。圖6C-圖6D是第5天的VCAM-1可溶性蛋白質對心肌細胞的效果的免疫熒光染色觀察。YFP發射綠色(黃色)熒光(YFP:激發波長514nm,熒光波長527nm),而cTnT發射紅色熒光(cy3:激發波長512nm,熒光波長552nm),且核以hoechst 33258(藍色)(hoechst 33258:激發波長352nm,熒光波長461nm)染色。通過與VCAM-1可溶性蛋白質(10μg/mL)一起培養,獲得心肌細胞生長效果。在與NCF共培養和與NCF(-)中的VCAM-1可溶性蛋白質共培養的條件之間,心肌細胞的數量無顯著差別(N=3,*P<0.05,**P<0.01)。
圖7是來自于新生小鼠的心臟成纖維細胞的FACS分析結果。圖7A-圖7C顯示出使用抗VCAM-1抗體染色的結果。圖7D顯示出將皮膚成纖維細胞僅使用二抗染色的陰性對照的結果。
具體實施方式
本發明涉及含有VCAM-1的心臟細胞培養材料。在本發明中,“心臟細胞培養材料”可以是在培養心臟細胞時使用的任何材料。例如,該材料包括但不限于:待添加至培養基的試劑;用于涂覆諸如培養皿和燒瓶等的培養容器的培養基材的底面或壁面的材料等。
血管細胞粘附分子(VCAM-1)是在血管內皮細胞等中表達的作為細胞粘附分子的已知的蛋白質。例如,在人類的情況下,VCAM-1包括但不限于:通過以美國國家生物技術信息中心(NCBI)的登錄號NM_001078等描述的基因編碼的蛋白質,并且還包括通過選擇性剪接獲得的同種型。在本發明中的VCAM-1蛋白質包括:在細胞表面上表達的VCAM-1;可溶性VCAM-1;VCAM-1蛋白質的氨基酸缺失、置換或添加1個或多個(例如,1-20個、1-15個、1-10個或1-5個)氨基酸,且具有與VCAM-1蛋白質相同活性的各種突變體。可以使用動物材料中的VCAM-1蛋白質(通過公知的方法進行分離和純化)、也可以使用重組蛋白質作為本發明中的VCAM-1。還可以使用可商購的重組蛋白質。
此外,可以將表達VCAM-1的細胞用作本發明的VCAM-1。為了篩選表達VCAM-1的細胞,可以使用公眾已知的細胞分選法。例如,細胞分選法包括但不限于:使用抗VCAM-1抗體的流式細胞術、磁珠法、親和柱法和選淘法。
抗VCAM-1抗體并不受到特別限制。可以使用可商購的抗VCAM-1抗體,也可以使用通過采用VCAM-1作為抗原通過已知方法制作的產品。另外,只要可以篩選表達VCAM-1的細胞,可以使用單克隆抗體或多克隆抗體;然而,從特異性的觀點來看,優選使用單克隆抗體。
也就是說,本發明的篩選心臟細胞培養材料的方法包括下述步驟:制備細胞的步驟;通過使用抗VCAM-1抗體對該細胞進行細胞分選的步驟;作為細胞分選的結果,僅收集被判定為表達VCAM-1的細胞的步驟。
作為表達VCAM-1的細胞,只要表達VCAM-1即可,其種類不受到限制。然而,優選使用成纖維細胞。成纖維細胞包括將最終成為成纖維細胞或成肌纖維細胞的所有細胞。也就是說,本發明的成纖維細胞的范圍包括:在分化或成熟階段的過程中的細胞;以及在當時無法被鑒別為成纖維細胞或成肌纖維細胞,只要將最終成為成纖維細胞或成肌纖維細胞的細胞。
成纖維細胞的來源不受限制。可以將諸如ES細胞、iPS細胞和muse細胞的多能干細胞,以及諸如間充質干細胞的成體干細胞進行分化并使用;且可以使用從動物采集的原代細胞;以及可以使用已建立細胞系的細胞。然而,優選使用心臟來源的成纖維細胞,其中,特別優選使用心外膜來源的成纖維細胞。在使用已建立細胞系的細胞的情況下,通過選擇已知表達VCAM-1的細胞,可以省略細胞分選的處理。根據待共培養的細胞的來源的動物,可以適當選擇成纖維細胞的來源的動物。動物例如包括:人;諸如小鼠、大鼠、豚鼠、倉鼠、豬、猴和兔的實驗動物;諸如狗、貓和鳥的寵物;以及諸如牛、馬、綿羊和山羊的家畜。在從動物采集成纖維細胞的情況下,可以使用胎兒、新生兒、幼兒、成體的任何時期的成纖維細胞,但并不加以限制。
為了維持或保存VCAM-1蛋白質或表達VCAM-1蛋白質的細胞,本發明的心臟細胞培養材料可以是包含生理鹽水、細胞培養液或細胞保存液等的組合物等。只要內容物不會損害VCAM-1的功能,該組合物中包含的內容物不受限制。此外,本發明的心臟細胞培養材料的狀態可以是液體、凝膠狀、冷凍或冷凍干燥的,并且其狀態不受限制。
進一步地,心臟細胞培養材料可以含有成纖維細胞,而無關于VCAM-1蛋白質的存在或不存在。成纖維細胞包括將最終成為成纖維細胞或成肌纖維細胞的所有細胞。也就是說,即使細胞處于分化或成熟階段的過程中且在此時無法被識別為成纖維細胞或成肌纖維細胞,如果細胞是最終將成為成纖維細胞或成肌纖維細胞的細胞,則可以使用該細胞,而不受限制。其中,優選表達CD31(血管內皮細胞標志物)的成纖維細胞。在將表達VCAM-1蛋白質的成纖維細胞作為VCAM-1蛋白質使用時,表達VCAM-1蛋白質的細胞(細胞數量):表達CD31的細胞(細胞數量)的比例優選為5∶5-9∶1、更優選5∶5-8∶2,并且甚至更優選6∶4-8∶2。
本發明的一個方面涉及通過將心臟細胞與上述心臟細胞培養材料一起培養而得到的人工器官材料或其制造方法。也就是說,本發明的心臟細胞培養材料可以通過與心臟細胞一起培養來構建可在再生醫療和組織模型中使用的功能性心臟組織。可將該心臟組織用作人工器官材料。人工器官材料可以具有任何形式。例如,人工器官材料可以被附著至諸如處于片狀形式的心臟的器官的損傷部位。在通過使用支架使其聚集或層疊后,人工器官材料也可以被移植入具有某種程度的厚度的器官的缺陷部位。該支架的材料包括但不限于:羥基磷灰石、缺端肽膠原和凝膠。進一步地,由于人工器官材料處于培養細胞的狀態而無需將其制成特定形式,可將人工器官材料用于細胞移植、學術研究等。進一步地,可以通過使用3D打印機從該人工器官材料生產人工器官。所生產的人工器官不僅可以用于移植,而且還可以被廣泛應用于安全性藥理測試和臨床前研究等。
在本發明中,“構建心臟組織”是指構建具有諸如促進心臟細胞的分裂以及提供在整個組織中的均一搏動的至少一種心臟功能的組織,該組織可以用于再生醫療和組織模型。心臟功能包括諸如自律脈動能力、收縮和松弛能力、脈沖傳導能力和激素分泌能力等的所有已知的心臟功能。該心臟功能并不限于僅心臟具有的功能。例如,肌細胞也具有收縮和松弛能力。然而,即使其它細胞具有同等功能,并不會影響本發明的心臟功能的定義。此外,關于心臟功能,只要適合心臟組織的使用目的即可,而并不對功能的高低加以限制。例如,出于制做人工心臟的目的,需要具有達到可以從全身泵出血液的程度的收縮和松弛能力;然而,出于體外的收縮和松弛能力的學術研究等目的,只要收縮和松弛能力可通過一些手段檢測即可。
在本發明的人工器官材料或其制造方法中,待使用的心臟細胞包括諸如心肌細胞、平滑肌細胞、起搏細胞和血管內皮細胞等的所有構成心臟的細胞。該心臟細胞的來源可以根據人工器官材料的使用目的而適當設定。例如,為了向人移植為目的,可以使用人類來源的心臟細胞;而為了在小鼠實驗中的構建組織模型為目的,可以使用小鼠來源的心臟細胞。進一步地,可以使用來自胎兒、新生兒、幼兒和成體的任何時期的心臟細胞,而不對時期加以限制。本發明的心臟細胞優選從如下制造:諸如ES細胞、iPS細胞和muse細胞的多能性干細胞;以及諸如間充質干細胞的成體干細胞。
本發明的“培養”可以通過公眾已知的細胞培養方法進行,并且只要心臟細胞培養材料和心臟細胞存在于培養容器中或浸入同一培養基中,也就不對培養條件進行限制。在心臟細胞培養材料是表達VCAM-1蛋白質的細胞的情況下,表達VCAM-1的細胞(細胞數量)相對于心臟細胞的混合百分比優選為3-20%、更優選6-18%、并且最優選9-16%。
在本發明中,用于培養的培養液可以根據待培養細胞的種類適當設定,例如,可以使用DMEM、α-MEM、RPMI-1640等。可以向培養液中添加諸如FCS和FBS的營養物質和抗生素。
對于培養時期,可以適當設定獲得期望的細胞數量和/或功能的天數。例如,該時期包括:1天、2天、3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、13天、14天、1個月、2個月、3個月、4個月、5個月和6個月。培養溫度可以根據待培養細胞的種類適當設定。例如,溫度可以是10-60℃、優選20-50℃、并且更優選30-40℃。
本發明的制造方法可以進一步包括收集經培養的細胞的步驟。“經培養的細胞”可以包括成纖維細胞和心臟細胞兩種細胞,并且可以僅包括心臟細胞。關于收集細胞的步驟,可以通過使用諸如胰蛋白酶的蛋白酶來分離并收集細胞。然而,優選通過使用可以在保留細胞外基質等的同時分離細胞的溫度應答性培養皿,通過溫度變化將細胞分離并收集。
實施例
以下,參照下述實施例進一步對本發明進行更詳細地描述;但是,應該澄清的是,這些實施例不以任何方式對本發明進行限制。
實施例1
材料和方法
動物和試劑
野生型C57BL/6小鼠購自日本SLC(日本,靜岡)。B6Cg-Tg(CAG-DsRed*MST)1Nagy/J小鼠購自Jackson實驗室(Bar harbor,ME)。所有的實驗規程均通過東京女子醫科大學動物實驗委員會批準。將下述抗體用于免疫細胞化學、蛋白質印跡和流式細胞術分析(FACS):兔多克隆抗盤狀結構域受體蛋白酪氨酸激酶2(DDR2)(GeneTex,Irvine,CA);豚鼠單克隆抗波形蛋白(Progen,Heidelberg,德國);小鼠單克隆抗NG2(Millipore,Temecula,CA);兔多克隆抗α平滑肌肌動蛋白(Abcam,Cambridge,UK);小鼠單克隆抗心臟肌鈣蛋白T(cTnT)(Thermo Scientific,Rockford,IL);小鼠單克隆抗細胞角蛋白11(EXBIO,Nad Safinou,CZ);兔多克隆抗Ki67(Abcam,Cambridge,UK);兔多克隆抗組織蛋白H3(phosphor S10)(Abcam,Cambridge,UK);大鼠單克隆抗整聯蛋白α4/β1(Abcam,Cambridge,UK);重組小鼠VCAM-1/CD106Fc嵌合體(R&D systems,Minneapolis,MN)。除非另有指定,所有的試劑均購自Sigma-Aldrich。二抗購自Jackson免疫研究實驗室(West Grove,PA)。
小鼠ES細胞培養
在α-肌球蛋白重鏈啟動子的調控下的表達新霉素磷酸轉移酶基因的mESC的維持、以及心肌細胞分化和純化在先前的報道中已描述(Matsuura K等,Biomaterials.2011;32:7355-7362)。簡言之,為了心肌細胞誘導和心肌細胞純化,將胰蛋白酶化的ES細胞以5×104細胞/mL接種于旋轉瓶中(Integra Biosciences,Zizers,瑞士)(總計125mL/瓶),并使用添加有10%FBS的DMEM培養10天,之后將這些經分化的細胞使用新霉素再處理8天。
成纖維細胞分離
從野生型C57BL/6小鼠(新生小鼠,1日齡;成體小鼠,10-12周齡)得到成纖維細胞。
新生心臟成纖維細胞(NCF)按照此前報道中的描述(Matsuura K等,Biomaterials.2011;32:7355-7362)從新生小鼠(1日齡)的心臟得到。將3次繼代的NCF用于實驗。
成體心臟成纖維細胞(ACF)使用下述的外植體培養方法從成體小鼠(10-12周齡)的心臟得到。首先,將心臟用PBS(-)清洗并切成約5mm2的片。將這些切片用滅菌的蓋玻片覆蓋,并使用添加有10%FBS的DMEM在10cm培養皿中培養。培養開始2周后,將細胞使用0.25%胰蛋白酶/EDTA進行解離,并在另外的10cm培養皿中進行繼代培養。將3次繼代的ACF用于實驗。
成體的皮膚成纖維細胞(ADF)從成體小鼠(10-12周齡)的背部皮膚組織得到。首先,將采集的皮膚組織用中性蛋白酶I[1000U/mL](エーデイア株式會社)在4℃下處理過夜。然后,將組織切成約1mm2的片。將這些切片用滅菌的蓋玻片覆蓋,并使用添加有10%FBS的DMEM在10cm培養皿中進行培養。培養開始2周后,將細胞使用0.25%胰蛋白酶/EDTA進行解離,并在另外的10cm培養皿中進行繼代培養。將3次繼代的ADF用于實驗。
在一些實驗中,NCF和ADF使用與上述相同的方法從B6.Cg-Tg(CAG-DsRed*MST)1Nagy/J小鼠(新生小鼠,1日齡;成體小鼠,10周齡)得到。
細胞片層制備
在接種細胞前,將溫度應答性培養皿(UpCell;セルシード)的表面使用FBS包被2小時。mESC來源的心肌細胞與各類型的成纖維細胞以8:2的比例用添加有10%FBS的DMEM共培養(3.2×105細胞/cm2)。培養5天后,將細胞在20℃下孵育,以分離細胞片層。樣本的明視野圖像通過Nikon ECLIPSE Ti(尼康,Tokyo,日本)得到。
電生理學分析
如同此前報道中所描述的(Matsuura K等,Biomaterials.2011;32:7355-7362),通過多極陣列(MED)系統(Alpha MED Sciences,Osaka,日本)測定細胞外電位得到心臟細胞片層的電活動。
免疫細胞化學
將細胞用4%多聚甲醛固定,并進行如此前報道中(Matsuura K等,Biomaterials 2011;32:7355-7362)描述的免疫染色。染色樣本的圖像通過ImageXpress Ultra共聚焦高含量篩選系統(Molecular Devices,CA,美國)得到。圖像分析數據通過MetaExpress software(Molecular Devices,CA,美國)得到。
FACS分析
在細胞培養基中用終濃度為10μM的BrdU對孵育細胞(5×105個細胞)進行染色。按照BrdU Flow試劑盒的說明書(BD Pharmingen,Franklin Lakes,NJ)中的描述進行用于FACS分析的BrdU染色。簡單而言,將細胞用BD Cytofix/Cytoperm緩沖液進行固定和透性化處理,然后將摻入的BrdU暴露于DNase。BrdU染色用APC抗BrdU抗體(BD Pharmingen,Franklin Lakes,NJ)進行。樣本使用Gallios(Beckman Coulter,Brea,CA)分析。將下述試劑用于分析:BD Cytofix/Cytoperm緩沖液(BD Pharmingen,Franklin Lakes,NJ);BD Perm/Wash緩沖液(10×)(BD Pharmingen,Franklin Lakes,NJ);BD Cytoperm Plus緩沖液(Buffer)(10×)(BD Pharmingen,Franklin Lakes,NJ);BrdU(10mg/mL)(BD Pharmingen,Franklin Lakes,NJ);DNase(BD Pharmingen,Franklin Lakes,NJ)。
延時攝影
將樣本在5%CO2中于37℃下用BZ-9000熒光顯微鏡(Keyence,Osaka,日本)觀察5天。
RNA提取和全面的基因分析
根據制造商的說明書使用TRIzol試劑(Invitrogen,Carlsbad,CA)提取總RNA。根據制造商的說明書使用Qiagen RNeasy Mini Kit(QIAGEN,Valencia,CA)進一步純化總RNA。
按照所推薦的方法使用Nanodrop ND-1000分光光度計(Thermo Fisher Scientific Inc.,Waltham,MA)和安捷倫生物分析儀(Agilent Technologies,Palo Alto,CA)測定RNA的數量和質量。
為了cRNA擴增和標記,將總RNA擴增并根據制造商的說明書使用Agilent Low Input Quick Amp Labeling Kit,one-color(Agilent Technologies,Palo Alto,CA)用花青素3(Cy3)進行標記。簡單而言,使用多聚dT-T7啟動子引物,將100ng總RNA逆轉錄成為雙鏈cDNA。將引物、模板RNA以及已知濃度和品質的質量控制轉錄本首先在65℃變性10分鐘,并在40℃下使用5×第一鏈緩沖液、0.1M DTT、10mM dNTP混合物和AffinityScript RNase Block混合物孵育2小時。在70℃下使AffinityScript酶失活15分鐘。
此后,將cDNA產物用作在體外轉錄的模板,以產生熒光cRNA。在T7RNA聚合酶和Cy3標記的CTP的存在下,將cDNA產物與transcription master mix混合并在40℃下孵育2小時。使用QIAGEN的RNeasy mini旋轉離心柱對經標記的cRNA進行純化,并以30μl無核酸酶的水進行洗脫。擴增和標記后,使用Nanodrop ND-1000分光光度計和安捷倫生物分析儀測定cRNA的量和花青素的摻入。為了樣本的雜交,將1.65μg Cy3標記的cRNA進行片段化,并在65℃下雜交至安捷倫小鼠GE 4×44Kv2微陣列(Design ID:026655)17小時。清洗后,使用安捷倫DNA微陣列掃描儀對微陣列進行掃描。對于微陣列的數據分析,各經掃描的特征的強度值使用安捷倫feature extraction軟件version 10.7.3.1(進行了背景扣除)進行定量。
僅使用標示為沒有錯誤(存在標示)的特征,并排除如下特征:非陽性、不顯著、不均一、不高于背景、飽和的以及離群值(邊緣和不存在標示)。使用安捷倫GeneSpring GX version 11.0.2.(每個芯片:歸一化至75%位移進行,每個基因:歸一化至所有樣本的中位值)進行歸一化。無對照探針,在安捷倫小鼠GE 4×44Kv2微陣列(Design ID:026655)上存在共計39,429個探針。
變化的轉錄本使用比較法進行定量。在這一研究中,我們在信號強度方面施加≥2倍的變化以識別基因表達的顯著差異。
定量實時PCR分析
使用高容量cDNA逆轉錄試劑盒(Applied biosystems)從總RNA生成互補的DNA。作為PCR相關引物,使用VCAM-1 Gene Expression Assays(life Technology)。各RT-PCR使用iCycler(BIO-RAD),包括:在25℃下10分鐘、在37℃下120分鐘和在85℃下5秒。使用來自于各樣本的cDNA模板(1μg)。TaqMan探針實時PCR研究使用TaqMan Gene Expression Assays(Applied biosystems)進行。所有實驗以三重復進行。樣本用7300實時PCR系統(Applied Biosystems)進行40次如下循環:在50℃下2分鐘,在95℃下10分鐘,此后在95℃下15秒鐘和在60℃下1分鐘循環40次。使用Gap DH基因作為內對照根據用于定量實時PCR的ΔΔCT方法計算相對定量。
蛋白質印跡
將NCF或ADF溶解于Laemmli樣本緩沖液(BIO-RAD,CA,USA)、蛋白酶抑制劑(Boehringer Mannheim,Indianapolis,IN)和2-巰基乙醇(Wako Pure Chemical Industries,日本)中。將樣本在4%-12%Bis-Tris凝膠(Life Technologies,MD,美國)上分離,使用iBlot 7-Minute印跡系統(Life technologies,MD,美國)電轉移至iBlot轉膜堆層(硝酸纖維素,標準尺寸)(Life technologies,MD,美國)上進行,然后使用Amersham ECL Prime蛋白質印跡檢測試劑(GE Healthcare,PA,美國)進行處理處理以用于化學發光分析。條帶的強度使用LAS4000(Fujifilm,Tokyo,日本)和NIH圖像軟件(version 1.46r)進行分析。將下面的細胞瞬時過表達裂解物用于陽性對照:用于Col11a1的K562(人紅白血病細胞系;Human erythromyeloblastoid leukemia cell line)(Abcam,CB,UK);用于Vcam-1的Sol8(SantaCruz,CA,USA);用于β1/CD29的ITGB1 293T(Abnova,臺北,中國臺灣);用于整聯蛋白α4β1的Jurkat全細胞裂解物(SantaCruz,CA,USA)。
中和抗體分析
將下述抗體和培養皿用于中和抗體分析:抗VCAM-1(LifeSpan Biosciences,Seattle,WA),山羊IgG同種型對照(LifeSpan Biosciences,Seattle,WA);用于24孔培養板的細胞培養插件;孔徑0.4μm、半透明、高密度PET膜(BD Pharmingen,Franklin Lakes,NJ)。
用10μg/mL抗體進行30分鐘預處理后,將成纖維細胞接種在插入式培養皿的上層(2.4×105個細胞)。將mESC來源的心肌細胞接種在下層(4.8×105個細胞)。每天更換具有10μg/mL抗體的培養液至5天。
統計分析
所有數據以平均值±SD表示。不同組之間的變化的顯著性通過單因素方差分析確定。之后,兩個組之間的差異使用Statcel軟件通過Tukey-Kramer多重比較法確定。將p值<0.05視為顯著性差異。
2.實驗結果
使用mESC來源的心肌細胞和成纖維細胞制作細胞片層
首先我們對用于共培養實驗的細胞的特性進行評價。相襯圖像表明,從新生小鼠的心臟、成體小鼠的心臟以及成體小鼠的皮膚組織分離的細胞顯示出成纖維細胞樣的形態(參見圖1A)。由于沒有對成纖維細胞具有特異性的抗體,所以嘗試調查了已知在成纖維細胞中表達的諸如DDR2(CD167b)、波形蛋白和αSMA的蛋白質的表達。如圖1B-圖1E所示,幾乎所有的各類型的細胞表達DDR2、波形蛋白和αSMA,然而不表達調寧蛋白(平滑肌細胞標記物)、細胞角蛋白(上皮細胞標記物)和NG2(周皮細胞標記物)。基于這些發現,我們在接下來的實驗中將這些細胞作為成纖維細胞使用。
基于我們此前的發現,需要特定范圍量的成纖維細胞用于構建使用mESC來源的心肌細胞的細胞片層,并且心肌細胞和成纖維細胞的最佳比例為8:2(Biomaterials.2011;32:7355-7362),我們嘗試使用mESC來源的心肌細胞和3種類型的成纖維細胞(ACF、ADF和NCF)在UpCell溫度應答性培養皿上制作心臟細胞片層。當將心肌細胞與ACF或NCF共培養時,搏動的心肌細胞均等地分布在所有的區域。相反,當將心肌細胞與ADF共培養時,附近的搏動細胞聚集。5天培養后,當將培養條件由37℃變更為20℃時,在使用成纖維細胞的各種條件下產生單層細胞片層,然而,在沒有成纖維細胞的條件下不產生單層細胞片層(圖2A)。
接下來,使用MED系統對細胞片層進行電生理學評價(Biomaterials.2011;32:7355-7362;Biomaterials.2006;27:4765-4774)。與顯微鏡觀察相一致(圖2A),在具有ACF和NCF的細胞片層中,在各通道觀察到細胞外動作電位(圖2B)。在這些細胞片層中,由于認識到整個片層均勻地搏動,暗示了在片層中構建了電網絡,并且這些細胞片層可以進行電傳輸。同時,在與ADF共培養的細胞片層中,僅在局部區域觀察到細胞外動作電位。
為了確認細胞片層之間的心肌細胞分布的差異,進行了共聚焦顯微鏡分析。如圖2C-圖2E中所示,在具有ACF和NCF的細胞片層中的YFP(+)細胞的數量和心臟肌鈣蛋白T(cTnT)(+)細胞的數量(顯示mESC來源的細胞的指示物)比起具有ADF的細胞片層中的細胞的數量更多。在具有ADF的細胞片層中的心肌細胞的數量比得上在沒有成纖維細胞的條件下的數量。此外,在與ACF和與NCF共培養的細胞片層之間,心肌細胞數量沒有顯著的相關關系。這些發現表明,各種類的成纖維細胞均用于構建細胞片層,然而,來自于心臟的成纖維細胞可能更適合于構建更具功能性的心臟細胞片層。
細胞片層中的心肌細胞增殖
為了調查與心臟來源的成纖維細胞和皮膚組織來源的成纖維細胞共培養的細胞片層之間的心肌細胞數量不同的原因,檢測了共培養第1天和第5天的心肌細胞數量(圖3A-圖3C)。在第1天,在各條件之間的心肌細胞數量相同,表明各類型的成纖維細胞不會影響接種后的心肌細胞的初期附著。在與ACF和NCF的共培養中,第5天的YFP(+)和cTnT(+)的心肌細胞數量顯著比第1天更高。另一方面,在與ADF共培養或在心肌細胞單獨培養的條件下,第5天的心肌細胞數量與第1天類似。使用分離自DsRed小鼠的成纖維細胞和YFP(+)心肌細胞的時移圖像分析顯示,在與NCF共培養中,心肌細胞遷移并增殖且構建互聯網絡結構。相反,在與ADF共培養中,心肌細胞顯示出較少的增殖,且未構建網絡結構。這些發現表明,來自心臟的成纖維細胞(而不是來自皮膚組織的成纖維細胞)在共培養條件下可能誘導mESC來源的心肌細胞的增殖。
將各條件之間的心肌細胞的增殖通過免疫細胞化學分析進行確認。如圖4A-圖4D所示,與NCF共培養的Ki67(+)細胞和磷酸化組蛋白H3(PHH3)(+)的心肌細胞的百分比顯著高于與ADF共培養和心肌細胞單獨培養的條件下的百分比。進一步的,BrdU摻入分析也顯示出,比起與ADF共培養和在心肌細胞單獨培養條件下的增殖的心肌細胞的百分比,與NCF共培養的增殖的心肌細胞的百分比顯著增加(圖4E和圖4F)。這些發現強烈表明,心臟來源的成纖維細胞誘導心肌細胞的增殖。
為了調查關于與NCF共培養的心肌細胞增殖的潛在機制,將mESC來源的心肌細胞和NCF使用細胞培養插件進行培養。在該實驗中,NCF在上層培養,而心肌細胞在下層培養。在NCF的存在下,第5天的心肌細胞的數量比起第1天顯著更高(圖4G)。然而,在細胞培養插件實驗中,第1天和第5天之間的心肌細胞數量的增加程度(~1.8倍)(圖4H)比起在共培養條件下(~2.5倍)更低。這些發現示出了,從NCF分泌的可溶性因子以及心臟成纖維細胞與心肌細胞之間的細胞-細胞相互作用可能促進心肌細胞增殖。
NCF和ADF的全面的基因分析
為了識別對參與上述效果負責的因子,使用微陣列分析在NCF和ADF之間進行全面的基因分析。如圖5A所示,在NCF和ADF之間觀察到基因表達方面的許多差異。與ADF相比,NCF中的超過500個基因顯示出更高10倍的增強的表達。在從列表中選擇與心血管相關的基因之后,仍然留下了20個基因。進一步地,當選擇被報道導致敲除小鼠模型中的心臟的發育異常的胚胎致死表型、并且還充當了可溶性因子和粘著因子的基因時,留下了Vcam-1。通過定量RT-PCR和蛋白質印跡分析確認了,比起ADF在NCF中的Vcam-1的增強的表達(圖5B-圖5D)。
在與心臟成纖維細胞共培養中的VCAM-1依存性心肌細胞增殖
由于已知整聯蛋白α4β1是VCAM-1的主要的輔助受體,所以檢查了mESC來源的心肌細胞中的整聯蛋白α4β1的表達。如圖5E和圖5F所示,幾乎所有mESC來源的心肌細胞顯示出整聯蛋白α4β1的生成。
接下來,對于VCAM-1使用中和抗體是否有助于心臟成纖維細胞介導的心肌細胞增殖進行了闡釋。在將NCF使用抗VCAM-1抗體進行前處理后,將NCF和mESC來源的心肌細胞使用細胞培養插件進行培養。抗VCAM-1抗體處理顯著抑制了心臟成纖維細胞介導的心肌細胞數量的增加(圖6A和圖6B)。
最后,評價了VCAM-1對心肌細胞增殖的直接效果。培養開始后第1天,將心肌細胞以VCAM-1重組蛋白質處理至第5天。如圖6C和圖6D所示,與對照相比,VCAM-1處理增加了心肌細胞的數量。這些發現表明,心臟來源的成纖維細胞可能通過心肌細胞中的成纖維細胞介導的VCAM-1和整聯蛋白α4β1誘導心肌細胞增殖。
為了確認在構建功能性心臟細胞片層中的VCAM-1陽性細胞的重要性,測定了生物體來源的心臟成纖維細胞中的VCAM-1陽性細胞的百分比。
從C57/BL6小鼠的新生小鼠(1日齡)解剖并收集心臟成纖維細胞,并從成體小鼠(10-12周齡)解剖并收集皮膚成纖維細胞。將各成纖維細胞進行附著培養直至3次繼代,在每個條件下得到1×107個細胞的細胞量。3次繼代與通過細胞片層制作的上述心肌細胞的培養條件相同。
使兩種成纖維細胞經受使用山羊多克隆抗VCAM-1抗體(R&D systems,Minneapolis,MN)的一級免疫熒光染色,并經受使用Alexa Fluor 488驢抗山羊IgG(Life Technologies,MD,美國)的二級免疫熒光染色。隨后,在Gallios(Beckman Coulter,Brea,CA)下進行FACS分析,并測定VCAM-1陽性細胞率(N=3)。顯著性差異的計算使用Student's t檢驗進行。
心臟成纖維細胞(NCF)的結果在圖7A-圖7C中示出。發現了NCF中的VCAM-1陽性細胞的百分比為約60%(圖7A:66.57%;圖7B:58.95%;圖7C:54.73%)。相反,皮膚成纖維細胞(ADF)中的VCAM-1陽性細胞的比例為約5%,這證明比起ADF,NCF中的VCAM-1陽性細胞的百分比顯著更高(P<0.001)。
表明了含有許多VCAM-1陽性細胞的心臟成纖維細胞通過表達VCAM-1使來自于小鼠ES的心肌細胞增殖,從而有助于構建功能性心肌組織。進一步地,認為從胚胎學的觀點來看,VCAM-1陽性的心臟成纖維細胞來自心外膜來源的細胞;并且我們得到啟示,從胚胎學的觀點進行成纖維細胞分類是有效的,作為用于構建功能性組織的細胞源,不是進行形態學分類而是進行功能分類。
認為NCF中的不表達VCAM-1的細胞的大部分表達CD31(血管內皮細胞標記物)。原因如下:已知組織常駐性心臟成纖維細胞從心外膜來源的細胞通過上皮間充質轉化(EMT)產生,并且還通過內皮間充質轉化(EndMT)從血管內皮細胞分化。進一步地,與心臟成纖維細胞一樣,通過EndMT從血管內皮細胞分化的腎臟成纖維細胞表達CD31(J Am Soc Nephrol 19:2282-2287,2008)。這也可以成為支持NCF表達CD31的根據之一。
從上文得到澄清的是,不是皮膚成纖維細胞而是心臟成纖維細胞增強了小鼠胚胎干細胞(mESC)來源的心肌細胞的增殖,并對構建更具功能性的心臟細胞片層做出貢獻。此外,示出了心臟成纖維細胞比皮膚成纖維細胞更豐富地表達VCAM-1,而且心臟成纖維細胞的VCAM-1在心臟細胞的增殖和功能性上生物學設計的心臟組織的構建中起重要作用。
工業實用性
通過使用本發明的心臟細胞培養材料進行培養,有利地構建了功能性心臟組織。通過培養得到的心臟細胞可以用作諸如移植的再生醫療或者用作諸如心臟組織模型的人工器官材料。
- 還沒有人留言評論。精彩留言會獲得點贊!