雜環化合物以及使用該雜環化合物的有機發光器件的制作方法
本申請要求于2014年6月27日向韓國知識產權局提交的韓國專利申請第10-2014-0080226號的優先權和權益,其全部內容通過引用并入本文。
本申請涉及一種新型雜環化合物以及使用該新型雜環化合物的有機發光器件。
背景技術:
電致發光器件是一種自發光型的顯示器件,其優點在于視角寬、對比度優異,以及響應速度快。
有機發光器件具有有機薄膜布置于兩個電極之間的結構。當將電壓施加到具有所述結構的有機發光器件時,從兩個電極注入的電子和空穴在有機薄膜中彼此結合組成一對,且接著,在淬滅的同時發光。在必要時,有機薄膜可由單層或多層構成。
在必要時,用于有機薄膜的材料可具有發光功能。例如,作為用于有機薄膜的材料,還可以使用自身可以單獨構成發光層的化合物,或者也可以使用可用作基于主體-摻雜劑的發光層的主體或摻雜劑的化合物。此外,作為用于有機薄膜的材料,還可以使用可執行如空穴注入、空穴傳輸、電子阻擋、空穴阻擋、電子傳輸或電子注入的功能的化合物。
為了改進有機發光器件的性能、使用壽命或效率,對于開發用于有機薄膜的材料存在持續的需求。
技術實現要素:
[技術問題]
本申請涉及一種新型雜環化合物以及使用該新型雜環化合物的有機發光器件。
[技術方案]
本申請提供一種下式1的化合物。
[式1]
在式1中,
Y為S或O,
X1和X2彼此相同或不同,并且各自獨立地為N或CR10,以及
R1、R2和R4至R10彼此相同或不同,并且各自獨立地選自氫;氘;鹵素;取代或未取代的直鏈或支鏈C1至C60烷基;取代或未取代的直鏈或支鏈C2至C60烯基;取代或未取代的直鏈或支鏈C2至C60炔基;取代或未取代的直鏈或支鏈C1至C60烷氧基;取代或未取代的單環或多環C3至C60環烷基;取代或未取代的單環或多環C2至C60雜環烷基;取代或未取代的單環或多環C6至C60芳基;取代或未取代的單環或多環C2至C60雜芳基;以及未取代的或被C1至C20烷基、取代或未取代的單環或多環C6至C60芳基、或取代或未取代的單環或多環C2至C60雜芳基所取代的胺基。
此外,本申請提供一種有機發光器件,其包括陽極、陰極以及設置在所述陽極和所述陰極之間的一層或更多層有機材料層,其中所述有機材料層中的一層或多層包含所述式1的化合物。
[有益效果]
本申請中的化合物可被用作用于有機發光器件的有機材料層的材料。所述化合物可被用作有機發光器件中的空穴注入材料、空穴傳輸材料、發光材料、電子傳輸材料、電子注入材料等。特別是,式1的化合物可被用作用于有機發光器件的發光層的材料,尤其是,磷光主體。
附圖說明
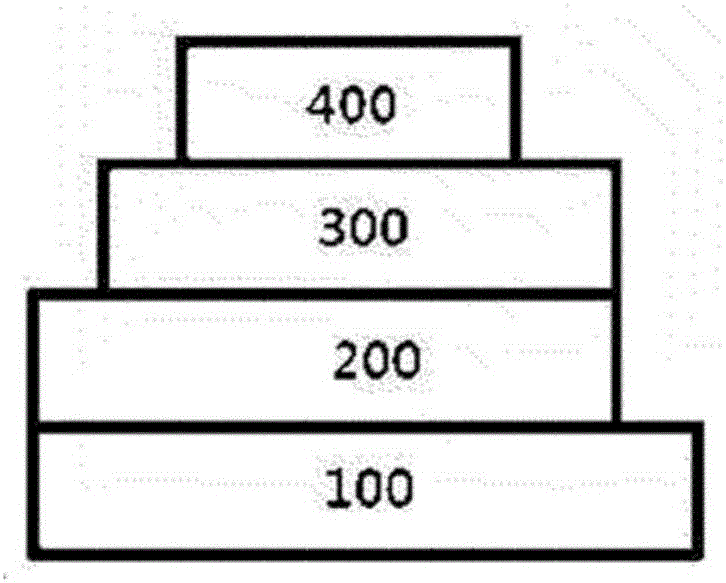
圖1至圖3圖示根據本申請的示例性實施方式的有機發光器件的電極和有機材料層的堆疊次序。
圖4圖示化合物29的UV和PL的測量圖。
圖5和圖6圖示由測量化合物29的CV的結果導出的Eox值。
圖7圖示化合物42的UV和PL的測量圖。
圖8和圖9圖示由測量化合物42的CV的結果導出的Eox值。
圖10圖示化合物87的UV和PL的測量圖。
圖11和圖12圖示由測量化合物87的CV的結果導出的Eox值。
圖13圖示化合物88的UV和PL的測量圖。
圖14和圖15圖示由測量化合物88的CV的結果導出的Eox值。
圖16圖示化合物90的UV和PL的測量圖。
圖17和圖18圖示由測量化合物90的CV的結果導出的Eox值。
圖19圖示化合物91的UV和PL的測量圖。
圖20和圖21圖示由測量化合物91的CV的結果導出的Eox值。
圖22圖示化合物92的UV和PL的測量圖。
圖23和圖24圖示由測量化合物92的CV的結果導出的Eox值。
圖25圖示化合物93的UV和PL的測量圖。
圖26和圖27圖示由測量化合物93的CV的結果導出的Eox值。
圖28圖示由測量化合物73的CV的結果導出的Eox值。
圖29圖示化合物73的UVPL的測量圖。
圖30圖示化合物85的LTPL的測量圖。
圖31圖示化合物85的UVPL的測量圖。
圖32圖示化合物86的LTPL的測量圖。
圖33圖示化合物86的UVPL的測量圖。
圖34圖示化合物87的LTPL的測量圖。
圖35圖示化合物87的UVPL的測量圖。
圖36圖示化合物88的LTPL的測量圖。
圖37圖示化合物88的UVPL的測量圖。
圖38圖示化合物90的LTPL的測量圖。
圖39圖示化合物90的UVPL的測量圖。
圖40圖示化合物91的LTPL的測量圖。
圖41圖示化合物91的UVPL的測量圖。
圖42圖示化合物92的LTPL的測量圖。
圖43圖示化合物92的UVPL的測量圖。
圖44圖示化合物93的LTPL的測量圖。
圖45圖示化合物93的UVPL的測量圖。
圖46圖示化合物245的LTPL的測量圖。
圖47圖示化合物245的UVPL的測量圖。
圖48圖示化合物246的LTPL的測量圖。
圖49圖示化合物246的UVPL的測量圖。
圖50圖示化合物250的LTPL的測量圖。
圖51圖示化合物250的UVPL的測量圖。
圖52圖示化合物253的LTPL的測量圖。
圖53圖示化合物253的UVPL的測量圖。
圖54圖示化合物259的LTPL的測量圖。
圖55圖示化合物259的UVPL的測量圖。
圖56圖示化合物260的LTPL的測量圖。
圖57圖示化合物260的UVPL的測量圖。
圖58圖示化合物409的LTPL的測量圖。
圖59圖示化合物409的UVPL的測量圖。
圖60圖示化合物420的LTPL的測量圖。
圖61圖示化合物420的UVPL的測量圖。
圖62圖示化合物425的LTPL的測量圖。
圖63圖示化合物425的UVPL的測量圖。
圖64圖示化合物427的LTPL的測量圖。
圖65圖示化合物427的UVPL的測量圖。
圖66圖示化合物434的LTPL的測量圖。
圖67圖示化合物434的UVPL的測量圖。
<附圖標記和符號說明>
100:基板
200:陽極
300:有機材料層
301:空穴注入層
302:空穴傳輸層
303:發光層
304:空穴阻擋層
305:電子傳輸層
306:電子注入層
400:陰極
具體實施方式
下文中,將詳細描述本申請。
本說明書中描述的化合物可由式1表示。具體來講,式1的化合物由于以上所述的母核結構和取代基的結構特征,可被用作用于有機發光器件的有機材料層的材料。
在本說明書中,“取代或未取代的”意指未取代的或被一個或更多個取代基取代,所述一個或更多個取代基選自氘;-CN;直鏈或支鏈C1至C60烷基;直鏈或支鏈C2至C60烯基;直鏈或支鏈C2至C60炔基;單環或多環C3至C60環烷基;單環或多環C2至C60雜環烷基;單環或多環C6至C60芳基;單環或多環C2至C60雜芳基;-SiRR’R”;-P(=O)RR’;以及-NRR’,或者意指未取代的或被這些取代基當中兩個或多個取代基連接而成的取代基取代。例如,“所述兩個或多個取代基連接而成的取代基”可為聯苯基團。也就是,所述聯苯基團還可以是芳基,并且可被理解為兩個苯基連接而成的取代基。R、R'、以及R"彼此相同或不同,并且各自獨立地為直鏈或支鏈C1至C60烷基;單環或多環C6至C60芳基;或單環或多環C2至C60雜芳基。
在本說明書中,所述烷基包括具有1至60個碳原子的直鏈或支鏈,并且可額外地被其它取代基取代。所述烷基的碳原子的數目可為1至60個,特別地為1至40個,并且更特別地為1至20個。
在本說明書中,所述烯基包括具有2至60個碳原子的直鏈或支鏈,并且可額外地被其它取代基取代。所述烯基的碳原子的數目可為2至60個,特別地為2至40個,并且更特別地為2至20個。
在本說明書中,所述炔基包括具有2至60個碳原子的直鏈或支鏈,并且可額外地被其它取代基取代。所述炔基的碳原子的數目可為2至60個,特別地為2至40個,并且更特別地為2至20個。
在本說明書中,所述環烷基包括具有3至60個碳原子的單環或多環,并且可額外地被其它取代基取代。此處,所述多環意指環烷基直接連接到另一個環基團或與另一個環基團稠合的基團。此處,另一個環基團還可以是環烷基,但還可為另一種環基團,例如,雜環烷基、芳基、雜芳基等。環烷基的碳原子的數目可為3至60個,特別地為3至40個,并且更特別地為5至20個。
在本說明書中,所述雜環烷基包括O、S、Se、N以及Si中的一種或多種作為雜原子,包括具有2至60個碳原子的單環或多環,并且可額外地被其它取代基取代。此處,所述多環意指雜環烷基直接連接到另一個環基團或與另一個環基團稠合的基團。此處,另一個環基團還可以是雜環烷基,但還可為另一種環基團,例如,環烷基、芳基、雜芳基等。所述雜環烷基的碳原子的數目可為2至60個,特別地為2至40個,并且更特別地為3至20個。
在本說明書中,所述芳基包括具有6至60個碳原子的單環或多環,并且可額外地被其它取代基取代。此處,所述多環意指芳基直接連接到另一個環基團或與另一個環基團稠合的基團。此處,另一個環基團還可以是芳基,但還可為另一種環基團,例如,環烷基、雜環烷基、雜芳基等。所述芳基包括螺環基團。所述芳基的碳原子的數目可為6至60個,特別地為6至40個,并且更特別地為6至25個。所述芳基的具體實例包括苯基、聯苯基、三苯基、萘基、蒽基、基(chrysenyl)、菲基、苝基、熒蒽基、苯并[9,10]菲基(triphenylenyl)、迫苯并萘基(phenalenyl)、芘基、并四苯基、并五苯基、芴基、茚基、苊基、芴基、苯并芴基、螺雙芴基等,或它們稠合的環,但不限于此。
在本說明書中,所述螺環基團是包含螺環結構的基團,并且可具有15至60個碳原子。例如,所述螺環基團可以包括2,3-二氫-1H-茚基團或環己烷螺-鍵合到芴基團的結構。具體來講,所述螺環基團包括一組以下結構式:
在本說明書中,所述雜芳基包括S、O、Se、N以及Si中的一種或更多種作為雜原子,包括具有2至60個碳原子的單環或多環,并且可額外地被其它取代基取代。此處,所述多環意指雜芳基直接連接到另一個環基團或與另一個環基團稠合的基團。此處,另一個環基團還可以是雜芳基,但還可為另一種環基團,例如,環烷基、雜環烷基、芳基等。所述雜芳基的碳原子的數目可為2至60個,特別地為2至40個,并且更特別地為3至25個。所述雜芳基的具體實例包括吡啶基、吡咯基、嘧啶基、噠嗪基、呋喃基、噻吩基、咪唑基、吡唑基、噁唑基、異噁唑基、噻唑基、異噻唑基、三唑基、呋吖基、噁二唑基、噻二唑基、二噻唑基、四唑基、吡喃基、噻喃基、二嗪基、噁嗪基、噻嗪基、二噁烯基(dioxynyl)、三嗪基、四嗪基、喹啉基、異喹啉基、喹唑啉基、異喹唑啉基、萘啶基、吖啶基、菲啶基、咪唑并吡啶基、二氮雜萘基、三氮雜茚基、吲哚基、吲哚嗪基(indolyzinyl)、苯并噻唑基、苯并噁唑基、苯并咪唑基、苯并噻吩基、苯并呋喃基、二苯并噻吩基、二苯并呋喃基、咔唑基、苯并咔唑基、二苯并咔唑基、吩嗪基、二苯并噻咯、螺二(二苯并噻咯)、二氫吩嗪基、吩噁嗪基、菲啶基等、或它們稠合的環、但不限于此。
根據本申請的示例性實施方式,式1中的Y為S。
根據本申請的示例性實施方式,式1中的Y為O。
根據本申請的示例性實施方式,式1中的X1和X2中一個為N而另一個為CR10。
根據本申請的示例性實施方式,式1中的X1和X2中一個為N而另一個為CR10,并且R1、R2和R10中至少一個為–(L)m-(Z)n,
L為取代或未取代的直鏈或支鏈C2至C60亞烷基;取代或未取代的單環或多環C6至C60亞芳基;或取代或未取代的單環或多環C2至C60亞雜芳基,
m為0至3的整數,
n為1或2的整數,以及
Z選自取代或未取代的單環或多環C6至C60芳基;取代或未取代的單環或多環C2至C60雜芳基;-SiR11R12R13;-P(=O)R14R15;以及未取代的或被C1至C20烷基、取代或未取代的單環或多環C6至C60芳基、或取代或未取代的單環或多環C2至C60雜芳基所取代的胺基,并且R11至R15彼此相同或不同,并且各自獨立地為取代或未取代的直鏈或支鏈C1至C60烷基;單環或多環C6至C60芳基;或單環或多環C2至C60雜芳基。
根據本申請的示例性實施方式,m可為0,或1、2或3的整數,當m為2或更大的整數時,各L可以彼此相同或不同。
根據本申請的示例性實施方式,當n為2的整數時,各Z可以彼此相同或不同。
根據本申請的示例性實施方式,L為C2至C60亞烷基;或C6至C60亞芳基;
根據本申請的示例性實施方式,L為亞苯基、亞萘基或亞蒽基。
根據本申請的示例性實施方式,Z為取代或未取代的苯基、取代或未取代的聯苯基、取代或未取代的三苯基、取代或未取代的萘基、取代或未取代的蒽基、取代或未取代的菲基、取代或未取代的茚基、取代或未取代的苝基、取代或未取代的芘基、取代或未取代的苊烯基(acenaphthalenyl)、取代或未取代的芴基、取代或未取代的熒蒽基、取代或未取代的苯并[9,10]菲基、取代或未取代的迫苯并萘基、取代或未取代的吡咯基、取代或未取代的吡啶基、取代或未取代的嘧啶基、取代或未取代的噠嗪基、取代或未取代的三嗪基、取代或未取代的噻吩基、取代或未取代的呋喃基、取代或未取代的苯并呋喃基、取代或未取代的二苯并呋喃基、取代或未取代的苯并噻唑基、取代或未取代的苯并噁唑基、取代或未取代的吲哚基、取代或未取代的咔唑基、取代或未取代的苯并咔唑基、取代或未取代的二苯并咔唑基、取代或未取代的吲哚[2,3-a]咔唑基、取代或未取代的吲哚[2,3-b]咔唑基、取代或未取代的喹啉基、取代或未取代的異喹啉基、取代或未取代的苯硫基(thiophenyl)、取代或未取代的苯并噻吩基、取代或未取代的二苯并噻吩基、取代或未取代的芴基、取代或未取代的二氫吲哚基、取代或未取代的10,11-二氫-二苯并[b,f]氮雜基團、取代或未取代的9,10-二氫吖啶基團、取代或未取代的螺環基團(其中,2,3-二氫-1H-茚或環己烷螺-鍵合(spiro-bonded)到芴)、取代或未取代的二烷基胺、取代或未取代的二芳基胺、取代或未取代的烷基芳基胺、取代或未取代的乙酰苯基團、取代或未取代的二苯甲酮基團、-SiR11R12R13或-P(=O)R14R15,R11至R15彼此相同或不同,并且各自獨立地為直鏈或支鏈C1至C60烷基、單環或多環C6至C60芳基、或單環或多環C2至C60雜芳基。
根據本申請的示例性實施方式,Z選自取代或未取代的苯基、取代或未取代的聯苯基、取代或未取代的三苯基、取代或未取代的萘基、取代或未取代的蒽基、取代或未取代的咔唑基、取代或未取代的苯并咔唑基、取代或未取代的二苯并咔唑基、取代或未取代的吲哚[2,3-a]咔唑基、取代或未取代的吲哚[2,3-b]咔唑基、取代或未取代的芴基、取代或未取代的苯并呋喃基、取代或未取代的二苯并呋喃基、取代或未取代的苯硫基、取代或未取代的苯并噻吩基、取代或未取代的二苯并噻吩基、取代或未取代的苯并[9,10]菲基、取代或未取代的三嗪基、取代或未取代的芘基、-Si(Ph)3、-P(=O)(Ph)2以及取代或未取代的二苯基胺,“取代或未取代的”意指未取代的或被選自甲基、直鏈或支鏈丙基、直鏈或支鏈丁基、直鏈或支鏈戊基、苯基、聯苯基、三苯基、萘基、蒽基、咔唑基、苯并咔唑基、二苯并咔唑基、吲哚[2,3-a]咔唑基、吲哚[2,3-b]咔唑基、芴基、苯并呋喃基、二苯并呋喃基、噻吩基、苯并噻吩基、二苯并噻吩基、苯并[9,10]菲基、三嗪基、芘基、-Si(Ph)3、-P(=O)(Ph)2、以及二苯基胺中的至少一個取代,并且所述取代基可以額外地被進一步取代。
根據本申請的示例性實施方式,R11至R15彼此相同或不同,并且為單環或多環C6至C60芳基。
根據本申請的示例性實施方式,R11至R15彼此相同或不同,并且為苯基、聯苯基、三苯基、萘基或蒽基。
根據本申請的示例性實施方式,R4至R9為氫或氘。
根據本申請的示例性實施方式,式1由下式2或下式3表示。
[式2]
[式3]
在式2和3中,Y、X1、X2、R1、R2以及R4至R9的定義與在式1中定義的那些相同。在本申請的示例性實施方式中,式1由下式4至7中的任一個表示。
[式4]
[式5]
[式6]
[式7]
在式4至7中,Y、R1、R2以及R4至R9與在式1中定義的那些相同,并且R3與式1中的R10的定義相同。
根據本申請的示例性實施方式,在式4至7中,
R1至R3中的至少一個為–(L)m-(Z)n,并且其他取代基與在式1中定義的那些相同,并且
Y、R4至R9、L、m以及Z的定義與在式1中定義的那些相同。
根據本申請的示例性實施方式,在式4至7中,R1為–(L)m-(Z)n,R2和R3為氫、氘或苯基,并且L、m、n以及Z與以上所述的那些相同。
根據本申請的示例性實施方式,在式4至7中,R2為–(L)m-(Z)n,R1和R3為氫、氘或苯基,并且L、m、n以及Z與以上所述的那些相同。
根據本申請的示例性實施方式,在式4至7中,R3為–(L)m-(Z)n,R1和R2為氫、氘或苯基,并且L、m、n以及Z與以上所述的那些相同。
根據本申請的示例性實施方式,在式4至7中,m為0或1。
根據本申請的示例性實施方式,式1由下式8至11中的任一個表示。
[式8]
[式9]
[式10]
[式11]
在式8至11中,
A選自直接鍵;取代或未取代的直鏈或支鏈C2至C60亞烷基;取代或未取代的直鏈或支鏈C2至C60亞烯基;取代或未取代的直鏈或支鏈C2至C60亞炔基;取代或未取代的單環或多環C3至C60亞環烷基;取代或未取代的單環或多環C2至C60亞雜環烷基;取代或未取代的單環或多環C6至C60亞芳基;取代或未取代的單環或多環C2至C60亞雜芳基;以及未取代的或被C1至C20烷基、取代或未取代的單環或多環C6至C60芳基、或取代或未取代的單環或多環C2至C60雜芳基取代的胺基,
R16至R19彼此相同或不同,并且各自獨立地選自氫;氘;鹵素;取代或未取代的直鏈或支鏈C1至C60烷基;取代或未取代的直鏈或支鏈C2至C60烯基;取代或未取代的直鏈或支鏈C2至C60炔基;取代或未取代的直鏈或支鏈C1至C60烷氧基;取代或未取代的單環或多環C3至C60環烷基;取代或未取代的單環或多環C2至C60雜環烷基;取代或未取代的單環或多環C6至C60芳基;取代或未取代的單環或多環C2至C60雜芳基;以及未取代的或被C1至C20烷基、取代或未取代的單環或多環C6至C60芳基、或取代或未取代的單環或多環C2至C60雜芳基取代的胺基,
p、q、r以及s為0至4的整數,并且
Y以及R6至R9的定義與式1中定義的那些相同。
式8至11意指二聚體結構,并且A意指所述二聚體的連接基團。
根據本申請的示例性實施方式,在式8至11中,A選自取代或未取代的單環或多環C6至C60亞芳基;以及取代或未取代的單環或多環C2至C60亞雜芳基。
根據本申請的示例性實施方式,在式8至11中,A為未取代的或被烷基或芳基取代的C6至C60亞芳基;或未取代的或被烷基或芳基取代的C2至C60亞雜芳基。
根據本申請的示例性實施方式,在式8至11中,A為未取代的或被烷基或芳基取代的咔唑基團;或未取代的或被烷基或芳基取代的芴基團。
根據本申請的示例性實施方式,在式8至11中,A為未取代的或被烷基或芳基取代的咔唑基團;或未取代的或被烷基或芳基取代的芴基團,所述烷基為C1至C10直鏈或支鏈,并且所述芳基為C6至C20芳基。
根據本申請的示例性實施方式,式1至7的Y為并且X3和X4可為取代或未取代的單環或多環C6至C60芳烴環;或取代或未取代的單環或多環C2至C60芳雜環。
所述可由以下結構式中的任一個表示,但不限于此。
在所述結構式中,Z1至Z3彼此相同或不同,并且各自獨立地為S或O,
Z4至Z9彼此相同或不同,并且各自獨立地為CR’R”、NR’、S或O,以及
R’與R”彼此相同或不同,并且各自獨立地為氫;取代或未取代的直鏈或支鏈C1至C60烷基;或取代或未取代的單環或多環C6至C60芳基。
根據本申請的示例性實施方式,式1可選自以下化合物。
上述化合物可基于將在下文描述的制備實施例來制備。將在下文描述的制備實施例中描述代表性的實例,但在必要時,可以添加或除去取代基,并且可以改變取代基的位置。此外,可基于本領域已知的技術改變起始原料、反應物、反應條件等。在必要時,本領域的普通技術人員可以通過使用本領域已知的技術改變在其他位置的取代基的種類或位置。
例如,在式4的化合物中,母核結構可按照下式1和2制備。在下式1和2中,例示式4的Y為S的情形,但是Y為氧(O)的情形也是可以的。
可通過本領域已知的方法鍵合取代基,并且可根據本領域已知的技術改變取代基的位置或取代基的數目。
[反應式1]
[反應式2]
反應式1是取代基鍵合到式4的母核結構中R2位置的反應的實例。具體地,反應式1中最后的化合物是式4中的R2為被Ar取代的苯基的情形。Ar與上述Z的定義相同。
反應式2是取代基鍵合到式4的母核結構中R3位置的反應的實例。具體地,反應式2中最后的化合物是式4中的R3為被Ar取代的苯基的情形。Ar與上述Z的定義相同。
例如,在式5的化合物中,可按照下反應式3制備母核結構。可通過本領域已知的方法鍵合取代基,并且可根據本領域已知的技術改變取代基的位置或取代基的數目。
[反應式3]
反應式3是取代基鍵合到式5的母核結構中R3位置的反應的實例。具體地,反應式3中最后的化合物是式5中的R3為被Ar取代的苯基的情形。Ar與上述Z的定義相同。
例如,在式6的化合物中,可按照下反應式4制備母核結構。可通過本領域已知的方法鍵合取代基,并且可根據本領域已知的技術改變取代基的位置或取代基的數目。
[反應式4]
反應式4是取代基鍵合到式6的母核結構中R3位置的反應的實例。具體地,反應式4中最后的化合物是式6中的R3為被Ar取代的苯基的情形。Ar與上述Z的定義相同。
例如,在式7的化合物中,可按照下反應式5制備母核結構。可通過本領域已知的方法鍵合取代基,并且可根據本領域已知的技術改變取代基的位置或取代基的數目。
[反應式5]
反應式5是取代基鍵合到式7的母核結構中R3位置的反應的實例。具體地,反應式5最后的化合物是式7中的R3為被Ar取代的苯基的情形。Ar與上述Z的定義相同。
本申請的另一個示例性實施方式提供包含上述式1化合物的有機發光器件。具體地,根據本申請的有機發光器件包括陽極、陰極以及設置在所述陽極和所述陰極之間的一層或更多層有機材料層,其中所述有機材料層中的一層或更多層包含式1的化合物。
圖1至3圖示根據本申請的示例性實施方式的有機發光器件的電極和有機材料層的堆疊次序。然而,本申請的范圍不意圖受到這些附圖的限制,本領域已知的有機發光器件的結構也可被應用到本申請。
根據圖1,圖示了陽極200、有機材料層300以及陰極400順序堆疊在基板100上的有機發光器件。然而,有機發光器件不限于該結構,并且如在圖2中,也可以實施順序堆疊陰極、有機材料層以及陽極的有機發光器件。
圖3示例有機材料層為多層的情形。根據圖3的有機發光器件包括空穴注入層301、空穴傳輸層302、發光層303、空穴阻擋層304、電子傳輸層305以及電子注入層306。然而,本申請的范圍不限于如上所述的堆疊結構,必要時,可以省略除了發光層的其他層,并且可以進一步添加其它必要的功能層。
除了所述有機材料層中的一層或更多層包含式1的化合物以外,可通過本領域已知的材料和方法制造根據本申請的有機發光器件。
式1的化合物可單獨構成有機發光器件的有機材料層的一層或更多層。然而,必要時,可將式1的化合物與其它材料混合來構成有機材料層。
可將式1的化合物用作有機發光器件中的空穴注入材料、空穴傳輸材料、發光材料、電子傳輸材料、電子注入材料等。
例如,可將根據本申請的示例性實施方式的化合物用作用于有機發光器件中的電子注入層、電子傳輸層、或同時注入和傳輸電子的層的材料。
此外,可將根據本申請的示例性實施方式的化合物用作用于有機發光器件的發光層的材料。具體地,還可以將所述化合物單獨用作發光材料,以及用作發光層的主體材料或摻雜劑材料。
另外,可將根據本申請的示例性實施方式的化合物用作有機發光器件的磷光主體材料。在這種情形中,根據本申請的示例性實施方式的化合物與磷光摻雜劑一起被包含。
另外,可將根據本申請的示例性實施方式的化合物用作用于有機發光器件的空穴阻擋層的材料。
在根據本申請的有機發光器件中,將在下文中例示除了式1的化合物以外的材料,但是提供這些材料僅用于舉例并且不用于限制本申請的范圍,并且這些材料可以用本領域公知的材料代替。
作為陽極材料,可以使用具有相對大的功函數的材料,以及可以使用透明導電氧化物、金屬或導電性聚合物等。
作為陰極材料,可以使用具有相對小的功函數的材料,以及可以使用金屬、金屬氧化物或導電性聚合物等。
作為空穴注入材料,還可以使用公知的空穴注入材料,以及例如,可以使用酞菁化合物,如在美國專利第4,356,429號公開的酞菁銅或在文件[Advanced Material,6,p.677(1994)]中描述的星爆型胺衍生物(starburst-type amine derivatives),例如,TCTA、m-MTDATA、m-MTDAPB、聚苯胺/十二烷基苯磺酸(Pani/DBSA)或聚(3,4-亞乙基二氧噻吩)/聚(4-苯乙烯磺酸鹽)(PEDOT/PSS)(其為可溶性導電聚合物)、聚苯胺/樟腦磺酸(Pani/CSA)或聚苯胺/聚(4-苯乙烯-磺酸鹽)(PANI/PSS)等。
作為空穴傳輸材料,可以使用吡唑啉衍生物、基于芳基胺的衍生物、二苯基乙烯衍生物、三苯基二胺衍生物等,并且還可以使用低分子量材料或聚合物材料。
作為電子傳輸材料,可以使用噁二唑衍生物、蒽醌二甲烷及其衍生物、苯醌及其衍生物、萘醌及其衍生物、蒽醌及其衍生物、四氰基蒽醌二甲烷及其衍生物、芴酮衍生物、二苯基二氰基乙烯及其衍生物、聯苯醌衍生物、8-羥基喹啉的金屬配合物及其衍生物等,并且還可以使用低分子量材料以及聚合物材料。
作為電子注入材料,例如,本領域中通常使用LiF,但本申請不限于此。
作為發光材料,可以使用紅光、綠光或藍光發光材料,而且必要時,可以混合以及使用兩種或更多種發光材料。此外,作為發光材料,還可以使用熒光材料,但是也可以使用磷光材料。作為發光材料,也可以單獨使用通過使從陽極和陰極分別注入的空穴和電子結合來發光的材料,但還可以使用其中主體材料和摻雜劑材料一起作用來發光的材料。
當將根據本申請的化合物用作磷光主體材料時,可以使用本領域已知的材料作為磷光摻雜劑材料來一起使用。
例如,可以使用由LL’MX、LL’L”M、LMXX’、L2MX以及L3M表示的磷光摻雜劑材料,但本申請的范圍不限于這些實例。
此處,L、L’、L”、X以及X’為彼此不同的雙齒配體,并且M為形成八面體配合物的金屬。
M可為銥、鉑、鋨等。
L為通過sp2碳和雜原子在M上配位的陰離子雙齒配體,并且X可執行捕獲電子或空穴的功能。L的非限制性實例包括2-(1-萘基)苯并噁唑、(2-苯基苯并噁唑)、(2-苯基苯并噻唑)、(7,8-苯并喹啉)、(噻吩基吡嗪)、苯基吡啶、苯并噻吩基吡嗪、3-甲氧基-2-苯基吡啶、噻吩基吡嗪、甲苯基吡啶等。X的非限制性實例包括乙酰丙酮化物(acac)、六氟乙酰丙酮化物、亞水楊基、吡啶甲酸鹽(picolinate)、8-羥基喹啉酸鹽(8-hydroxyqunolinate)等。
其更多具體實例將在下文中示出,但是本申請不僅限于這些實例。
[本發明的方式]
下文中,將通過實施例更詳細描述本申請,但是提供這些實施例僅用于例示本申請,并且不用于限制本申請的范圍。
<實施例>
<制備實施例1>化合物1的制備
化合物1-1的制備
將30g(168.5mmol)的苯并[b]噻吩-2-基硼酸、37.8g(202.26mmol)的1-溴-4-甲氧基苯、9.7g(8.4mmol)的Pd(PPh3)4以及35.7g(336.9mmol)的Na2CO3與300mL的甲苯、120mL的乙醇(EtOH)以及120mL的H2O一起放入容器中,使所得的混合物在120℃下回流1小時。反應結束后,將反應產物冷卻至室溫,接著用蒸餾水和乙酸乙酯(EA)萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,接著用乙酸乙酯(EA)和己烷洗滌生成的產物得到18.0g(51%)的目標化合物1-1。
化合物1-2的制備
將8g(38.0mmol)的化合物1-1與400mL的乙酸(AcOH)放入容器中,室溫下攪拌所得的混合物10分鐘,接著混合400mL的乙酸和20mL的HNO3并向其中緩慢添加。1小時后,反應結束,接著將生成的產物冷卻至室溫,并用蒸餾水和二氯甲烷(MC)萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,且接著使用二氯甲烷和己烷作為洗脫溶劑通過柱層析純化生成的產物得到5.8g(53%)的目標化合物1-2。
化合物1-3的制備
將6g(21.0mmol)的化合物1-2、300mL的乙醇以及3.6g(65.1mmol)的鐵(Fe)粉放入容器中,并在室溫下攪拌所得的混合物10分鐘。向其中緩慢滴加30mL的乙酸,接著使所得的混合物在60℃下回流1小時。反應結束后,將反應產物冷卻至室溫,且接著過濾通過向其中添加H2O而產生的固體并接著用H2O和己烷洗滌得到5.3g(99%)的目標化合物1-3。
化合物1-4的制備
將3.9mL的HCOH以及9.77mL的乙酸放入容器中,在60℃下攪拌2小時,接著冷卻至室溫。之后,向其中添加360mL的乙醚以及12g(46.9mmol)的化合物1-3,且在室溫下攪拌所得的混合物。1小時后,過濾所得的固體并用乙醚洗滌得到6.5g(49%)的目標化合物1-4。
化合物1-5的制備
將6.5g(22.94mmol)的化合物1-4、0.43mL(4.59mmol)的POCl3以及30mL的硝基苯放入容器中,將所得的混合物回流1小時并冷卻至室溫,接著向其中緩慢滴加3.76mL(32.12mmol)的SnCl4。在將所得的混合物在回流下攪拌2小時后,結束該反應,接著將所得的產物冷卻至室溫并用蒸餾水和二氯甲烷(MC)萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,接著用甲醇洗滌所得的產物接著純化得到2.74g(45%)的目標化合物1-5。
化合物1-6的制備
使4.0g(15.08mmol)的化合物1-5以及3.65g(45.22mmol)HBr與50mL的H2O一起回流1小時,并將所得的混合物冷卻至室溫,接著用蒸餾水和二氯甲烷(MC)萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,接著用甲醇洗滌所得的產物接著純化得到3.49g(92%)的目標化合物1-6。
化合物1-7的制備
使5.0g(19.89mmol)的化合物1-6以及2.0g(19.89mmol)的三乙胺放入容器中,在室溫下攪拌所得的混合物約1小時,接著向其中逐滴緩慢滴加4.18g(19.89mmol)的Tf2O。在將該所得的混合物回流下攪拌2小時后,結束反應,接著將生成的產物冷卻至室溫并用蒸餾水和二氯甲烷(MC)萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,接著用甲醇洗滌生成的產物接著純化得到6.71g(88%)的目標化合物1-7。
化合物1的制備
使5.0g(13.04mmol)的化合物1-7、4.77g(14.35mmol)的11-苯基-11,12-二氫吲哚[2,3-a]咔唑、0.60g(0.65mmol)的Pd2(dba)3、0.75g(1.30mmol)的4,5-雙二苯基膦-9,9-二甲基氧雜蒽以及5.28g(26.08mmol)的NaOtBu與80mL的甲苯一起在130℃下回流3小時。反應結束后,將反應產物冷卻至室溫,接著用蒸餾水和乙酸乙酯(EA)萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,接著將所得的混合物完全溶解在甲苯中,并用硅膠過濾所得的溶液。之后,用熱甲苯過濾產物并純化得到5.9g(80%)的化合物1。
<制備實施例2>化合物17的制備
化合物2-1的制備
使10g(26.09mmol)的化合物1-7、6.29g(31.31mmol)的(3-溴苯基)硼酸、1.5g(1.3mmol)的Pd(PPh3)4以及5.53g(52.18mmol)的Na2CO3與200mL的甲苯、40mL的乙醇以及40mL的H2O一起在120℃下回流6小時。反應結束后,將反應產物冷卻至室溫,接著用蒸餾水和乙酸乙酯(EA)萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,接著用乙酸乙酯(EA)和己烷洗滌生成的產物得到6.82g(67%)的目標化合物3-1。
化合物17的制備
使5.0g(12.81mmol)的化合物2-1、4.18g(15.37mmol)的苯并菲-2-基硼酸、0.74g(0.64mmol)的Pd(PPh3)4以及2.71g(25.62mmol)的Na2CO3與100mL的甲苯、20mL的乙醇以及20mL的H2O一起在120℃下回流4小時。反應結束后,將反應產物冷卻至室溫,接著用蒸餾水和乙酸乙酯(EA)萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,接著用乙酸乙酯(EA)和己烷洗滌生成的產物得到6.06g(88%)的目標化合物17。
<制備實施例3>化合物29的制備
化合物A-1的制備
在氮氣下在單頸圓底燒瓶中,將1.4mL(0.0374mol)的硫酸逐滴緩慢滴加到30.0g(0.374mol)的1,2-二環己酮和77.37g(0.749mol)的鹽酸苯肼在1,000mL的乙醇中的混合物中,接著在60℃下攪拌所得的混合物4小時。過濾冷卻至室溫的溶液得到黃棕色固體(69g,93%)。在單頸圓底燒瓶中將46.5mL(0.6mol)的三氟乙酸放入68.9g(0.25mol)的該固體和700ml的乙酸的混合物中,在100℃下攪拌所得的混合物12小時。用乙酸和己烷洗滌并過濾冷卻至室溫的溶液得到乳白色的固體A-1(27.3g,42%)。
化合物A-2的制備
在氮氣下在二頸圓底燒瓶中回流下攪拌2.1g(0.0082mol)的化合物A-1、2.5g(0.013mol)的碘苯、0.312g(0.0049mol)的Cu、0.433g(0.0016mol)的18-冠-6-醚以及3.397g(0.0246mol)的K2CO3在20ml的鄰-二氯苯(o-DCB)中的混合物16小時。用二氯甲烷/H2O萃取并濃縮,通過柱層析(SiO2,己烷:乙酸乙酯=10:1)分離冷卻至室溫的溶液得到白色固體化合物A-2(1.76g,64%)。
化合物3-1的制備
使30g(168.5mmol)的苯并[b]噻吩-2-基硼酸、41.2g(202.26mmol)碘苯、19.0g(16.9mmol)的Pd(PPh3)4以及35.7g(336.9mmol)的Na2CO3與300mL的甲苯、120mL的乙醇(EtOH)以及120mL的H2O一起在120℃下回流1小時。反應結束后,將反應產物冷卻至室溫,接著用蒸餾水和乙酸乙酯(EA)萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,接著用乙酸乙酯(EA)和己烷洗滌生成的產物得到18.0g(51%)的目標化合物3-1。
化合物3-2的制備
將10g(47.55mmol)的化合物3-1和400mL的乙酸放入容器中,室溫下攪拌所得的混合物10分鐘,接著混合400mL的乙酸和20mL的HNO3并向其中緩慢添加。1小時后,反應結束,接著將生成的產物冷卻至室溫,并用蒸餾水和二氯甲烷(MC)萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,接著使用二氯甲烷和己烷作為洗脫溶劑通過柱層析純化生成的產物得到5.9g(50%)的目標化合物3-2。
化合物3-3的制備
將6g(23.5mmol)化合物3-2、300mL乙醇以及4.06g(72.8mmol)鐵(Fe)放入容器中,并在室溫下攪拌所得的混合物10分鐘。向其中緩慢滴加30mL的乙酸,接著使所得的混合物回流1小時。反應結束后,將反應產物冷卻至室溫,且接著過濾通過向其中添加H2O而產生的固體并接著用H2O和己烷洗滌得到5.5g(99%)的目標化合物3-3。
化合物3-4的制備
使2.93mL(22.19mmol)的4-溴苯酰氯完全溶解在30mL的二氯甲烷(MC)中,接著向其中添加3.12mL(22.19mmol)的三乙胺(TEA),在室溫下攪拌所得的混合物15分鐘后接著將其保持在0℃,向其中緩慢添加2.93mL(22.19mmol)的化合物3-3。約1小時后,產生白色固體并過濾,且接著用己烷洗滌生成的產物并干燥得到8.0g(87%)的目標化合物3-4。
化合物3-5的制備
將6.5g(22.94mmol)的化合物3-4、0.43mL(4.59mmol)的POCl3以及30mL的硝基苯放入容器中,使所得的混合物回流1小時并冷卻至室溫,接著向其中緩慢滴加3.76mL(32.12mmol)的SnCl4。在回流下攪拌所得的混合物2小時后,反應結束,接著將生成的產物冷卻至室溫并用蒸餾水和二氯甲烷(MC)萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,且接著使用二氯甲烷和己烷作為洗脫溶劑通過柱層析純化生成的產物得到2.74g(45%)的目標化合物3-5。
化合物29的制備
使8g(20.5mmol)的化合物3-5、6.1g(18.44mmol)的化合物A-2、0.38g(0.41mmol)的Pd2(dba)3、0.47g(0.82mmol)的4,5-雙二苯基膦-9,9-二甲基氧雜蒽以及8.3g(41.0mmol)的NaOtBu與80mL的甲苯一起在130℃下回流3小時。反應結束后,將反應產物冷卻至室溫,接著用蒸餾水和乙酸乙酯(EA)萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,接著將所得的混合物完全溶解在甲苯中,并用硅膠過濾所得的溶液。之后,用熱甲苯過濾并純化產物得到8.8g(67%)的化合物29。
<制備實施例4>化合物42的制備
化合物4-1的制備
使2.93mL(22.19mmol)的3-溴苯酰氯完全溶解在30mL的二氯甲烷(MC)中,接著向其中添加3.12mL(22.19mmol)的三乙胺(TEA),在室溫下攪拌所得的混合物15分鐘后接著將其保持在0℃,向其中緩慢添加2.93mL(22.19mmol)的化合物3-3。約1小時后,產生白色固體并過濾,且接著用己烷洗滌生成的產物并干燥得到8.0g(87%)的目標化合物4-1。
化合物4-2的制備
將8.0g(19.59mmol)的化合物4-1、1.8mL(19.59mmol)的POCl3以及80mL的硝基苯放入容器中,使所得的混合物回流1小時并冷卻至室溫,接著向其中緩慢滴加4.5mL(54.85mmol)的SnCl4。在回流下攪拌所得的混合物2小時后,反應結束,接著將生成的產物冷卻至室溫并用蒸餾水和二氯甲烷(MC)萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,且接著用甲醇洗滌并接著純化生成的產物得到5.03g(66%)的目標化合物4-2。
化合物42的制備
使5g(12.81mmol)的化合物4-2、3.5g(15.37mmol)二苯并[b,d]噻吩-4-基硼酸、0.74g(0.64mmol)的Pd(PPh3)4以及3.5g(25.62mmol)的K2CO3與50mL的甲苯、5mL的乙醇以及5mL的H2O一起在120℃下回流5小時。反應結束后,將反應產物冷卻至室溫,接著用蒸餾水和乙酸乙酯(EA)萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,接著使用二氯甲烷和己烷作為洗脫溶劑通過柱層析純化生成的產物得到5.56g(88%)的化合物42。
<制備實施例5>化合物48的制備
化合物5-1的制備
將化合物4-2(10g,25.62mmol)溶解在100mL的THF中,接著將所得的溶液冷卻至-78℃。向其中緩慢滴加正丁基鋰(2.5M,在己烷中)(13.3ml,33.31mmol),接著攪拌所得的混合物1小時。向溶液中逐滴添加二苯基氯化膦(5.65ml,25.62mol),并在室溫下攪拌所得的溶液12小時。用MC/H2O萃取反應混合物,接著減壓蒸餾。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,且接著使用二氯甲烷和己烷作為洗脫溶劑通過柱層析純化生成的產物得到4.19g(33%)的化合物5-1。
化合物48的制備
使5g(10.09mmol)的化合物5-1完全溶解在50mL的二氯甲烷(MC)中,接著在室溫下將所得的混合物與10mL的H2O2水溶液(30重量%)一起攪拌1小時。用MC/H2O萃取反應混合物,接著減壓蒸餾。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,且接著使用二氯甲烷和己烷作為洗脫溶劑通過柱層析純化生成的產物得到1.14g(22%)的化合物48。
<制備實施例6>化合物74的制備
化合物6-1的制備
使20g(112.34mmol)的苯并[b]噻吩-2-基硼酸、20.4g(101.11mmol)的2-溴苯胺、6.5g(5.12mmol)的Pd(PPh3)4、以及31.05g(224.68mmol)的K2CO3與200mL的甲苯、40mL的乙醇以及40mL的H2O一起在120℃下回流16小時。反應結束后,將反應產物冷卻至室溫,接著用蒸餾水和乙酸乙酯(EA)萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,接著使用二氯甲烷和己烷作為洗脫溶劑通過柱層析純化生成的產物得到16.9g(67%)的化合物6-1。
化合物6-2的制備
將10g(44.38mmol)的化合物6-1完全溶解在二氯甲烷(MC)中,接著在室溫下將所得的溶液與6.2mL(44.38mmol)的三乙胺(TEA)一起攪拌15分鐘。之后,將所述溶液保持在0℃,接著向其中緩慢添加9.7g(44.38mmol)的4-溴苯酰氯。約1小時后,生成白色固體并過濾,接著用EA和己烷洗滌生成的產物得到17.2g(95%)的目標化合物6-2。
化合物6-3的制備
將15g(36.74mmol)的化合物6-2、3.4mL(36.74mmol)的POCl3以及150mL的硝基苯放入容器中,將所得的混合物回流1小時并冷卻至室溫,接著向其中緩慢滴加12.04mL(102.87mmol)的SnCl4。在將所得的混合物在回流下攪拌2小時后,結束該反應,接著將生成的產物冷卻至室溫并用蒸餾水和二氯甲烷(MC)萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,接著用甲醇(MeOH)和己烷洗滌生成的產物得到6.17g(43%)的目標化合物6-3。
化合物74的制備
使5g(12.81mmol)的化合物6-3、2.38g(14.09mmol)的二苯胺、0.74g(0.64mmol)的Pd(PPh3)4、以及3.5g(25.62mmol)的K2CO3與50mL的甲苯、5mL的乙醇以及5mL的H2O一起在120℃下回流6小時。反應結束后,將反應產物冷卻至室溫,接著用蒸餾水和乙酸乙酯(EA)萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,接著使用二氯甲烷和己烷作為洗脫溶劑通過柱層析純化生成的產物得到4.72g(77%)的化合物74。
<制備實施例7>化合物85的制備
使5g(12.81mmol)的化合物6-3、6.37g(14.09mmol)的(3,5-二(9H-咔唑-9-基)苯基)硼酸、0.74g(0.64mmol)的Pd(PPh3)4、以及3.5g(25.62mmol)的K2CO3與50mL的甲苯、5mL的乙醇以及5mL的H2O一起在120℃下回流6小時。反應結束后,將反應產物冷卻至室溫,接著用蒸餾水和乙酸乙酯(EA)萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,接著使用二氯甲烷和己烷作為洗脫溶劑通過柱層析純化生成的產物得到6.4g(69%)的化合物85。
<制備實施例8>化合物86的制備
化合物7-1的制備
將10g(44.38mmol)的化合物6-1完全溶解在二氯甲烷(MC)中,接著在室溫下將所得的溶液與6.2mL(44.38mmol)的三乙胺(TEA)一起攪拌15分鐘。之后,將所述溶液保持在0℃,接著向其中緩慢添加9.7g(44.38mmol)的4-溴苯酰氯。約1小時后,生成白色固體并過濾,接著用乙酸乙酯(EA)和己烷洗滌生成的產物得到17.2g(95%)的目標化合物7-1。
化合物7-2的制備
將15g(36.74mmol)的化合物7-1、3.4mL(36.74mmol)的POCl3以及150mL的硝基苯放入容器中,將所得的混合物回流1小時并冷卻至室溫,接著向其中緩慢滴加12.04mL(102.87mmol)的SnCl4。在將所得的混合物在回流下攪拌2小時后,結束該反應,接著將生成的產物冷卻至室溫并用蒸餾水和二氯甲烷(MC)萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,接著用甲醇(MeOH)和己烷洗滌生成的產物得到7.89g(55%)的目標化合物7-2。
化合物86的制備
使8g(20.5mmol)的化合物7-2、6.1g(18.44mmol)的11-苯基-11,12-二氫吲哚[2,3-a]咔唑、0.38g(0.41mmol)的Pd2(dba)3、0.47g(0.82mmol)的4,5-雙二苯基膦-9,9-二甲基氧雜蒽(XantPhos)以及8.3g(41.0mmol)的NaOtBu與80mL的甲苯一起在130℃下回流3小時。反應結束后,將反應產物冷卻至室溫,接著用蒸餾水和乙酸乙酯(EA)萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,接著將所得的混合物完全溶解在甲苯中,并用硅膠過濾所得的溶液。之后,用熱甲苯過濾并純化產物得到7.3g(56%)的化合物86。
<制備實施例9>化合物87的制備
使5g(12.81mmol)的化合物7-2、3.5g(15.37mmol)的二苯并[b,d]噻吩-4-基硼酸、0.74g(0.64mmol)的Pd(PPh3)4以及3.5g(25.62mmol)的K2CO3與50mL的甲苯、5mL的乙醇以及5mL的H2O一起在120℃下回流5小時。反應結束后,將反應產物冷卻至室溫,接著用蒸餾水和乙酸乙酯(EA)萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,接著使用二氯甲烷和己烷作為洗脫溶劑通過柱層析純化生成的產物得到4.80g(76%)的化合物87。
<制備實施例10>化合物88的制備
使5g(12.81mmol)的化合物7-2、5.7g(12.81mmol)的2-(9,9-二苯基-9H-芴-2-基)-4,4,5,5-四甲基-1,3,2-二氧硼戊烷、0.74g(0.64mmol)的Pd(PPh3)4以及3.5g(25.62mmol)的K2CO3與100mL的甲苯、20mL的乙醇以及20mL的H2O一起在120℃下回流24小時。反應結束后,將反應產物冷卻至室溫,接著用蒸餾水和MC萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,接著使用二氯甲烷和己烷作為洗脫溶劑通過柱層析純化生成的產物得到6.0g(74%)的化合物88。
<制備實施例11>化合物90的制備
使5g(12.81mmol)的化合物7-2、5.9g(12.81mmol)的三苯基(4,4,5,5-四甲基-1,3,2-二氧硼戊烷-2-基)硅烷、0.74g(0.64mmol)的Pd(PPh3)4以及3.5g(25.62mmol)的K2CO3與100mL的甲苯、20mL的乙醇以及20mL的H2O一起在120℃下回流24小時。反應結束后,將反應產物冷卻至室溫,接著用蒸餾水和MC萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,接著使用二氯甲烷和己烷作為洗脫溶劑通過柱層析純化生成的產物得到6.5g(78%)的化合物90。
<制備實施例12>化合物91的制備
使5g(12.81mmol)的化合物7-2、5.6g(12.81mmol)的9-(3-(4,4,5,5-四甲基-1,3,2-二氧硼戊烷-2-基)苯基)-9H-咔唑、0.74g(0.64mmol)的Pd(PPh3)4以及3.5g(25.62mmol)的K2CO3與100mL的甲苯、20mL的乙醇以及20mL的H2O一起在120℃下回流24小時。反應結束后,將反應產物冷卻至室溫,接著用蒸餾水和MC萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,接著使用二氯甲烷和己烷作為洗脫溶劑通過柱層析純化生成的產物得到5.0g(70%)的化合物91。
<制備實施例13>化合物92的制備
化合物7-3的制備
使10g(25.6mmol)的化合物7-2、13.0g(51.2mmol)的雙(頻那醇)二硼、0.93g(1.3mmol)的PdCl2(dppf)以及7.5g(51.2mmol)的KOAc與200mL的DMF一起在130℃下回流4小時。反應結束后,將反應產物冷卻至室溫,接著用蒸餾水和MC萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,接著使用二氯甲烷和己烷作為洗脫溶劑通過柱層析純化生成的產物得到7.5g(67%)的化合物7-3。
化合物92的制備
使7.5g(17.1mmol)的化合物7-3、8.35g(17.1mmol)的9,9'-(5-溴-1,3-亞苯基)雙(9H-咔唑)、1.0g(0.85mmol)的Pd(PPh3)4以及4.7g(34.0mmol)的K2CO3與200mL的甲苯、40mL的乙醇以及40mL的H2O一起在100℃下回流24小時。反應結束后,將反應產物冷卻至室溫,接著用蒸餾水和MC萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,接著使用二氯甲烷和己烷作為洗脫溶劑通過柱層析純化生成的產物得到9.0g(73%)的化合物92。
<制備實施例14>化合物93的制備
使6.15g(14.1mmol)的化合物7-3、5.3g(16.9mmol)的2-溴-4,6-二苯基嘧啶、0.81g(0.70mmol)的Pd(PPh3)4以及3.9g(28.1mmol)的K2CO3與100mL的甲苯、20mL的乙醇以及20mL的H2O一起在120℃下回流24小時。反應結束后,將反應產物冷卻至室溫,接著用蒸餾水和MC萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,接著使用二氯甲烷和己烷作為洗脫溶劑通過柱層析純化生成的產物得到7.3g(96%)的化合物93。
<制備實施例15>化合物110的制備
化合物8-1的制備
將10g(46.93mmol)的化合物3-溴苯并[b]噻吩以及400mL的乙酸放入容器中,室溫下攪拌所得的混合物10分鐘,接著混合400mL的乙酸和20mL的HNO3并向其中緩慢添加,1小時后,反應結束,接著將生成的產物冷卻至室溫,并用蒸餾水和二氯甲烷(MC)萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,且接著使用二氯甲烷和己烷作為洗脫溶劑通過柱層析純化生成的產物得到9.34g(77%)的目標化合物8-1。
化合物8-2的制備
將9g(34.87mmol)的化合物8-1、300mL的乙醇以及6.03g(108.1mmol)的鐵(Fe)粉放入容器中,并在室溫下攪拌所得的混合物10分鐘。向其中緩慢滴加30mL的乙酸,接著使所得的混合物在60℃下回流1小時。反應結束后,將反應產物冷卻至室溫,且接著過濾并接著用H2O和己烷洗滌通過向反應產物中添加H2O而產生的固體得到7.9g(99%)的目標化合物8-2。
化合物8-3的制備
將10g(43.84mmol)的化合物8-2、5.87g(48.22mmol)的苯基硼酸、4.27g(3.69mmol)的Pd(PPh3)4以及9.29g(87.66mmol)的Na2CO3與100mL的甲苯、20mL的乙醇以及20mL的H2O一起在120℃下回流1小時。反應結束后,將反應產物冷卻至室溫,接著用蒸餾水和乙酸乙酯(EA)萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,接著用乙酸乙酯(EA)和己烷洗滌生成的產物得到9.08g(92%)的目標化合物8-3。
化合物8-4的制備
將9g(39.94mmol)的化合物8-3完全溶解在二氯甲烷(MC)中,接著在室溫下將所得的溶液與5.6mL(39.94mmol)的TEA一起攪拌15分鐘。之后,將所述溶液保持在0℃,接著向其中緩慢添加8.77g(39.94mmol)的4-溴苯酰氯。約1小時后,生成白色固體并過濾,接著用乙酸乙酯(EA)和己烷洗滌生成的產物得到15.0g(92%)的目標化合物8-4。
化合物8-5的制備
將15g(36.74mmol)的化合物8-4、3.4mL(36.74mmol)的POCl3以及150mL的硝基苯放入容器中,將所得的混合物回流1小時并冷卻至室溫,接著向其中緩慢滴加12.04mL(102.87mmol)的SnCl4。在將所得的混合物在回流下攪拌2小時后,結束該反應,接著將生成的產物冷卻至室溫并用蒸餾水和二氯甲烷(MC)萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,接著用甲醇(MeOH)和己烷洗滌生成的產物得到11.1g(77%)的目標化合物8-5。
化合物110的制備
將5g(12.81mmol)的化合物8-5、6.37g(14.09mmol)的(3,5-二(9H-咔唑-9-基)苯基)硼酸、0.74g(0.64mmol)的Pd(PPh3)4以及3.5g(25.62mmol)的K2CO3與50mL的甲苯、5mL的乙醇以及5mL的H2O一起在120℃下回流6小時。反應結束后,將反應產物冷卻至室溫,接著用蒸餾水和乙酸乙酯(EA)萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,且接著使用二氯甲烷和己烷作為洗脫溶劑通過柱層析純化生成的產物得到7.1g(77%)的化合物110。
<制備實施例16>化合物119的制備
化合物9-1的制備
將10g(44.38mmol)的化合物8-3完全溶解在二氯甲烷(MC)中,接著在室溫下將所得的溶液與6.2mL(44.38mmol)的TEA一起攪拌15分鐘。之后,將所述溶液保持在0℃,接著向其中緩慢添加9.7g(44.38mmol)的3-溴苯酰氯。約1小時后,生成白色固體并過濾,接著用乙酸乙酯(EA)和己烷洗滌生成的產物得到17.7g(98%)的目標化合物9-1。
化合物9-2的制備
將15g(36.74mmol)的化合物9-1、3.4mL(36.74mmol)的POCl3以及150mL的硝基苯放入容器中,使所得的混合物回流1小時并冷卻至室溫,接著向其中緩慢滴加12.04mL(102.87mmol)的SnCl4。在回流下攪拌所得的混合物2小時后,反應結束,接著將生成的產物冷卻至室溫并用蒸餾水和二氯甲烷(MC)萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,且接著用甲醇(MeOH)和己烷洗滌生成的產物得到9.18g(64%)的目標化合物9-2。
化合物119的制備
使8g(20.5mmol)的化合物9-2、6.1g(18.44mmol)的化合物A-2、0.38g(0.41mmol)的Pd2(dba)3、0.47g(0.82mmol)的4,5-雙二苯基膦-9,9-二甲基氧雜蒽以及8.3g(41.0mmol)的NaOtBu與80mL的甲苯一起在130℃下回流3小時。反應結束后,將反應產物冷卻至室溫,接著用蒸餾水和乙酸乙酯(EA)萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,且接著使用二氯甲烷和己烷作為洗脫溶劑通過柱層析純化生成的產物得到6.8g(52%)的目標化合物119。
<制備實施例17>化合物156的制備
化合物10-1的制備
使20g(112.34mmol)的苯并[b]噻吩-3-基硼酸、20.4g(101.11mmol)的2-溴苯胺、6.5g(5.12mmol)的Pd(PPh3)4以及31.05g(224.68mmol)的K2CO3與200mL的甲苯、40mL的乙醇以及40mL的H2O一起在120℃下回流16小時。反應結束后,將反應產物冷卻至室溫,接著用蒸餾水和乙酸乙酯(EA)萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,且接著使用二氯甲烷和己烷作為洗脫溶劑通過柱層析純化生成的產物得到15.1g(60%)的目標化合物10-1。
化合物10-2的制備
使10g(44.38mmol)的化合物10-1完全溶解在二氯甲烷(MC)中,接著在室溫下將所得的溶液與6.2mL(44.38mmol)的三乙胺(TEA)一起攪拌15分鐘。之后,將所述溶液保持在0℃,接著向其中緩慢添加9.7g(44.38mmol)的4-溴苯酰氯。約1小時后,生成白色固體并過濾,接著用乙酸乙酯(EA)和己烷洗滌生成的產物得到15.9g(88%)的目標化合物10-2。
化合物10-3的制備
將15g(36.74mmol)的化合物10-2、3.4mL(36.74mmol)的POCl3以及150mL的硝基苯放入容器中,將所得的混合物回流1小時并冷卻至室溫,接著向其中緩慢滴加12.04mL(102.87mmol)的SnCl4。在將所得的混合物在回流下攪拌2小時后,結束該反應,接著將生成的產物冷卻至室溫并用蒸餾水和二氯甲烷(MC)萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,接著用甲醇(MeOH)和己烷洗滌生成的產物得到9.47g(66%)的目標化合物10-3。
化合物156的制備
使5g(12.81mmol)的化合物10-3、5.1g(15.37mmol)的9H-3,9'-二咔唑、0.74g(0.64mmol)的Pd(PPh3)4、以及3.5g(25.62mmol)的K2CO3與50mL的甲苯、5mL的乙醇以及5mL的H2O一起在120℃下回流5小時。反應結束后,將反應產物冷卻至室溫,接著用蒸餾水和乙酸乙酯(EA)萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,接著使用二氯甲烷和己烷作為洗脫溶劑通過柱層析純化生成的產物得到6.3g(77%)的化合物156。
<制備實施例18>化合物185的制備
化合物11-1的制備
使10g(44.38mmol)的化合物10-1完全溶解在二氯甲烷(MC)中,接著在室溫下將所得的溶液與6.2mL(44.38mmol)的三乙胺(TEA)一起攪拌15分鐘。之后,將所述溶液保持在0℃,接著向其中緩慢添加9.7g(44.38mmol)的3-溴苯酰氯。約1小時后,生成白色固體并過濾,接著用乙酸乙酯(EA)和己烷洗滌生成的產物得到17.3g(96%)的目標化合物11-1。
化合物11-2的制備
將15g(36.74mmol)的化合物11-1、3.4mL(36.74mmol)的POCl3以及150mL的硝基苯放入容器中,將所得的混合物回流1小時并冷卻至室溫,接著向其中緩慢滴加12.04mL(102.87mmol)的SnCl4。在將所得的混合物在回流下攪拌2小時后,結束該反應,接著將生成的產物冷卻至室溫并用蒸餾水和二氯甲烷(MC)萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,接著用甲醇(MeOH)和己烷洗滌生成的產物得到7.89g(55%)的目標化合物11-2。
化合物185的制備
使5g(12.81mmol)的化合物11-2、3.5g(15.37mmol)的(4,6-二苯基-1,3,5-三嗪-2-基)硼酸、0.74g(0.64mmol)的Pd(PPh3)4、以及3.5g(25.62mmol)的K2CO3與50mL的甲苯、5mL的乙醇以及5mL的H2O一起在120℃下回流5小時。反應結束后,將反應產物冷卻至室溫,接著用蒸餾水和乙酸乙酯(EA)萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,接著使用二氯甲烷和己烷作為洗脫溶劑通過柱層析純化生成的產物得到4.80g(69%)的化合物185。
<制備實施例19>化合物243的制備
化合物12-1的制備
使20g(123.49mmol)的化合物苯并呋喃-3-基硼酸、36.4g(123.49mmol)的4-溴-2-碘苯胺、14.2g(12.35mmol)的Pd(PPh3)4、以及51.2g(370.47mmol)的K2CO3與400mL的甲苯、80mL的乙醇以及80mL的H2O一起在120℃下回流24小時。反應結束后,將反應產物冷卻至室溫,接著用蒸餾水和乙酸乙酯(EA)萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,接著使用二氯甲烷和己烷作為洗脫溶劑通過柱層析純化生成的產物得到28.8g(81%)的化合物12-1。
化合物12-2的制備
將3.9mL的HCOH以及9.77mL的乙酸放入容器中,并在60℃下攪拌該所得的混合物2小時,接著冷卻至室溫。之后,向其中添加360mL的乙醚和13.5g(46.9mmol)的化合物12-1,并在室溫下攪拌所得的混合物。1小時后,過濾并用乙醚洗滌生成的固體得到8.45g(57%)的目標化合物12-2。
化合物12-3的制備
將8.45g(26.7mmol)的化合物12-2、3.4mL(36.74mmol)的POCl3以及150mL的硝基苯放入容器中,將所得的混合物回流1小時并冷卻至室溫,接著向其中緩慢滴加12.04mL(102.87mmol)的SnCl4。在將所得的混合物在回流下攪拌2小時后,結束該反應,接著將生成的產物冷卻至室溫并用蒸餾水和二氯甲烷(MC)萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,接著用甲醇(MeOH)和己烷洗滌生成的產物得到7.00g(88%)的目標化合物12-3。
化合物243的制備
使7g(23.48mmol)的化合物12-3、7.1g(23.48mmol)的(3-(二苯并[b,d]噻吩-4-基)苯基)硼酸、2.7g(2.35mmol)的Pd(PPh3)4、以及9.73g(70.44mmol)的K2CO3與150mL的甲苯、30mL的乙醇以及30mL的H2O一起在120℃下回流7小時。反應結束后,將反應產物冷卻至室溫,接著用蒸餾水和乙酸乙酯(EA)萃取。在用無水MgSO4干燥有機層后,通過旋轉蒸發儀除去溶劑,接著使用二氯甲烷和己烷作為洗脫溶劑通過柱層析純化生成的產物得到8.75g(78%)的化合物243。
<制備實施例20>化合物245的制備
化合物6-1的制備
使2-溴苯胺(50g,290mmol)、四(三苯基膦)鈀(0)(16.75g,14.5mmol)以及碳酸氫鈉(58.4g,696mmol)在甲苯/乙醇/水(1,000ml/200ml/200ml)中的混合物在單頸圓底燒瓶中在100℃下回流1小時。
將溫度降低至80℃,向其中添加固體狀態的苯并[b]噻吩-2-基硼酸(62g,348mmol),接著攪拌所得的混合物2小時。用MC萃取混合物,接著用MgSO4干燥有機層。濃縮后,通過柱層析(SiO2,己烷:二氯甲烷=1:1)分離該混合物(50g,76%)。
化合物6-2的制備
氮氣下在單頸圓底燒瓶中將三乙胺(15.5ml,110mmol)添加到6-1(22.6g,100mmol)和四氫呋喃(400ml)的混合物中,接著攪拌所得的混合物10分鐘。將溫度降低至0℃,向其中添加4-溴苯酰氯(26.4g,120mmol)在四氫呋喃(100ml)中的混合物,接著攪拌所得的混合物30分鐘。在用MC萃取該混合物后,濃縮有機層,接著向其中添加甲醇,超聲處理并接著過濾所得的混合物(33g,81%)。
化合物6-3的制備
在充滿氮氣的單頸圓底燒瓶中將三氯氧磷(7.2ml,77.8mmol)添加到6-2(31.8g,77.8mmol)在硝基苯(320ml)中的混合物中,接著在150℃下攪拌所得的混合物2小時。在用0℃飽和碳酸氫鈉水溶液終止反應物的反應,接著用二氯甲烷萃取生成的產物。濃縮后,除去硝基苯,接著向其中添加MeOH,并攪拌并接著過濾所得的混合物(26.6g,87%)。
化合物245-4的制備
在氮氣下在單頸圓底燒瓶中使6-3(26.6g,68.15mmol)、頻那醇二硼(pinacol diboron)(34.6g,136.3mmol)、PdCl2(dppf)(2.5g,3.4mmol)以及KOAc(20g,204mmol)在1,4-二噁烷(70ml)中的混合物在120℃下回流3小時。用二氯甲烷萃取生成的產物,接著用硫酸鎂干燥有機層。濃縮后,通過柱層析(SiO2,己烷:二氯甲烷=1:4)分離該混合物。
化合物245的制備
在單頸圓底燒瓶中120℃下攪拌245-4(6g,13.7mmol)、2-氯-4,6-二苯基-1,3,5-三嗪(4g,15.09mmol)、Pd(PPh3)4(1.58g,1.37mmol)以及K2CO3(3.78g,27.4mmol)在1,4-二噁烷(120ml)/H2O(30ml)中的混合物3小時。在110℃的狀態下過濾反應物,接著用1,4-二噁烷以及用H2O和MeOH洗滌生成的產物(6.4g,87%)。
<制備實施例21>化合物246的制備
除了使用化合物2-(4-溴苯基)-1-苯基-1H-苯并[d]咪唑代替化合物2-氯-4,6-二苯基-1,3,5-三嗪以外,以與在制備實施例20中化合物245的制備方式相同的方式進行制備得到目標化合物246(10.1g,76%)。
<制備實施例22>化合物250的制備
除了使用化合物2-氯-4,6-二苯基嘧啶代替化合物2-氯-4,6-二苯基-1,3,5-三嗪以外,以與在制備實施例20中化合物245的制備方式相同的方式進行制備得到目標化合物250(9.7g,78%)。
<制備實施例23>化合物248的制備
在氮氣下在單頸圓底燒瓶中將10g(25.6mmol)的化合物6-3溶解在20ml的無水THF中,接著將所得的溶液冷卻至-78℃。向其中緩慢滴加正丁基鋰(2.5M,在己烷中)(10.2ml,25.6mmol),接著攪拌所得的混合物1小時。向該溶液中滴加二苯基氯化膦(4.7ml,25.6mmol),并在室溫下攪拌所得的溶液12小時。用MC/H2O萃取反應混合物,接著減壓蒸餾。將反應混合物溶解在MC(200ml)中,接著在室溫下將所得的溶液與30%H2O2水溶液(10ml)一起攪拌1小時。用MC/H2O萃取反應混合物,接著通過柱層析(SiO2,MC:甲醇=25:1)分離濃縮的混合物得到固體化合物248(7.2g,54%)。
<制備實施例24>化合物253的制備
除了使用化合物4-([1,1'-聯苯基]-4-基)-6-氯-2-苯基嘧啶代替化合物2-氯-4,6-二苯基-1,3,5-三嗪以外,以與在制備實施例20中化合物245的制備方式相同的方式進行制備得到目標化合物253(11.5g,82%)。
<制備實施例25>化合物256的制備
除了使用化合物2-(4-溴苯基)-4,6-二苯基-1,3,5-三嗪代替化合物2-氯-4,6-二苯基-1,3,5-三嗪以外,以與在制備實施例20中化合物245的制備方式相同的方式進行制備得到目標化合物256(10.2g,72%)。
<制備實施例26>化合物259的制備
除了使用化合物4-溴-2-苯基喹唑啉代替化合物2-氯-4,6-二苯基-1,3,5-三嗪以外,以與在制備實施例20中化合物245的制備方式相同的方式進行制備得到目標化合物259(7.3g,62%)。
<制備實施例27>化合物260的制備
除了使用化合物2-溴-1,10-鄰二氮雜菲代替化合物2-氯-4,6-二苯基-1,3,5-三嗪以外,以與在制備實施例20中化合物245的制備方式相同的方式進行制備得到目標化合物260(7.7g,69%)。
<制備實施例28>化合物261的制備
化合物7-1的制備
在氮氣下在單頸圓底燒瓶中將三乙胺(26ml,186mmol)添加到6-1(35g,155mmol)和四氫呋喃(600ml)的混合物中,接著攪拌所得的混合物10分鐘。將溫度降低至0℃,向其中添加3-溴苯酰氯(40.8g,186mmol)在四氫呋喃(150ml)中的混合物,接著攪拌所得的混合物30分鐘。在用MC萃取該混合物后,濃縮有機層,接著向其中添加甲醇,超聲處理并接著過濾所得的混合物(58g,91.7%)。
化合物7-2的制備
在充滿氮氣的單頸圓底燒瓶中將三氯氧磷(V)(12ml,127mmol)添加到7-1(52g,127mmol)在硝基苯(1,000ml)中的混合物中,接著在150℃下攪拌所得的混合物3小時。在0℃下用飽和碳酸氫鈉水溶液終止反應物的反應,接著用二氯甲烷萃取生成的產物。濃縮后,除去硝基苯,接著向其中添加MeOH,并且攪拌并接著過濾所得的混合物(43g,86%)。
化合物7-3的制備
在氮氣下在單頸圓底燒瓶中使7-2(43g,110mmol)、頻那醇二硼(pinacol diboron)(56g,220mmol)、PdCl2(dppf)(4g,5.5mmol)以及KOAc(32.3g,330mmol)在1,4-二噁烷(400ml)中的混合物在120℃下回流3小時。用二氯甲烷萃取生成的產物,接著用硫酸鎂干燥有機層。濃縮后,進行硅膠過濾,使混合物與MeOH攪拌接著過濾得到題述化合物(36g,74%)。
化合物261的制備
除了使用化合物7-3代替245-4以外,以與在制備實施例20中化合物245的制備方式相同的方式進行制備得到目標化合物261(9.4g,76%)。
<制備實施例29>化合物274的制備
除了使用化合物4-([1,1'-聯苯基]-4-基)-2-氯-6-苯基嘧啶代替化合物2-氯-4,6-二苯基-1,3,5-三嗪以外,以與在制備實施例28中化合物261的制備方式相同的方式進行制備得到目標化合物274(11.1g,79%)。
<制備實施例30>化合物278的制備
化合物10-1的制備
在單頸圓底燒瓶中使2-溴苯胺(100g,580mmol)、四(三苯基膦)鈀(0)(33.5g,29mmol)以及碳酸氫鈉(116.8g,1,392mmol)在甲苯/乙醇/水(2,000ml/400ml/400ml)中的混合物在100℃下回流1小時。
將溫度降低至80℃,向其中添加固體狀態的苯并[b]噻吩-3-基硼酸(124g,696mmol),接著攪拌所得的混合物3小時。用MC萃取混合物,接著用MgSO4干燥有機層。濃縮后,通過柱層析(SiO2,己烷:二氯甲烷=1:1)分離該混合物(100g,76%)。
化合物10-2的制備
氮氣下在單頸圓底燒瓶中將三乙胺(100ml,707mmol)添加到10-1(145g,643mmol)和四氫呋喃(2,000ml)的混合物中,接著攪拌所得的混合物10分鐘。將溫度降低至0℃,向其中添加4-溴苯酰氯(155.3g,707.9mmol)在四氫呋喃(1,000ml)中的混合物,接著攪拌所得的混合物30分鐘。在用MC萃取該混合物后,濃縮有機層,接著向其中添加甲醇,超聲處理并接著過濾所得的混合物(220g,83%)。
化合物10-3的制備
在充滿氮氣的單頸圓底燒瓶中將三氯氧磷(55ml,592.6mmol)添加到10-2(220g,538.8mmol)在硝基苯(2,000ml)中的混合物中,接著在150℃下攪拌所得的混合物3小時。在0℃下用飽和碳酸氫鈉水溶液終止反應物的反應,接著用二氯甲烷萃取生成的產物。濃縮后,除去硝基苯,接著向其中添加MeOH,并且攪拌并接著過濾產生的混合物(167g,80%)。
化合物278的制備
除了使用化合物10-3代替6-3以外,以與在制備實施例23中化合物248的制備方式相同的方式進行制備得到目標化合物278(8.6g,69%)。
<制備實施例31>化合物294的制備
化合物11-1的制備
氮氣下在單頸圓底燒瓶中將三乙胺(26ml,186mmol)添加到10-1(35g,155mmol)和四氫呋喃(600ml)的混合物中,接著攪拌所得的混合物10分鐘。將溫度降低至0℃,向其中添加4-溴苯酰氯(40.8g,186mmol)在四氫呋喃(100ml)中的混合物,接著攪拌所得的混合物30分鐘。在用MC萃取該混合物后,濃縮有機層,接著向其中添加甲醇,超聲處理并接著過濾所得的混合物(58g,91%)。
化合物11-2的制備
在充滿氮氣的單頸圓底燒瓶中將三氯氧磷(V)(12ml,127mmol)添加到11-1(52g,127mmol)在硝基苯(1,000ml)中的混合物中,接著在150℃下攪拌所得的混合物2小時。在0℃下用飽和碳酸氫鈉水溶液終止反應物的反應,接著用二氯甲烷萃取生成的產物。濃縮后,除去硝基苯,接著向其中添加MeOH,并且攪拌并接著過濾所得的混合物(43g,86%)。
化合物294-3的制備
在氮氣下在單頸圓底燒瓶中使11-2(43g,110mmol)、頻那醇二硼(pinacol diboron)(56g,220mmol)、PdCl2(dppf)(4g,5.5mmol)以及KOAc(32.3g,330mmol)在1,4-二噁烷(400ml)中的混合物在120℃下回流3小時。用二氯甲烷萃取生成的產物,接著用硫酸鎂干燥有機層。濃縮后,進行硅膠過濾,濃縮后,使混合物與MeOH攪拌接著過濾得到題述化合物(36g,74%)。
化合物294的制備
除了使用化合物294-3以及4-溴-2,6-二苯基嘧啶代替245-4以及2-氯-4,6-二苯基-1,3,5-三嗪以外,以與在制備實施例20中化合物245的制備方式相同的方式進行制備得到目標化合物294(9.8g,79%)。
<制備實施例32>化合物309的制備
化合物309-4的制備
除了使用化合物苯并呋喃-2-基硼酸代替苯并[b]噻吩-2-基硼酸以外,以與在制備實施例20中化合物245-4的制備方式相同的方式進行制備得到目標化合物309-4。
化合物309的制備
除了使用化合物309-4以及4-溴-2,6-二苯基嘧啶代替245-4以及2-氯-4,6-二苯基-1,3,5-三嗪以外,以與在制備實施例20中化合物245的制備方式相同的方式進行制備得到目標化合物309(9.2g,73%)。
<制備實施例33>化合物321的制備
化合物321-3的制備
除了使用化合物309-1代替6-1以外,以與在制備實施例28中化合物270-3的制備方式相同的方式進行制備得到目標化合物321-3。
化合物321的制備
除了使用化合物321-3以及2-氯-4,6-二苯基-1,3,5-三嗪代替245-4以及2-氯-4,6-二苯基-1,3,5-三嗪以外,以與在制備實施例20中化合物245的制備方式相同的方式進行制備得到目標化合物321(8.9g,71%)。
<制備實施例34>化合物343的制備
化合物343-3的制備
除了使用化合物343-1代替10-1以外,以與在制備實施例30中化合物10-3的制備方式相同的方式進行制備得到目標化合物343-3。
化合物343-4的制備
在氮氣下在單頸圓底燒瓶中使343-3(21.5g,55mmol)、頻那醇二硼(pinacol diboron)(28g,110mmol)、PdCl2(dppf)(2g,2.7mmol)以及KOAc(14g,165mmol)在1,4-二噁烷(200ml)中的混合物在120℃下回流4小時。用二氯甲烷萃取生成的產物,接著用硫酸鎂干燥有機層。濃縮后,進行硅膠過濾,并在濃縮后,使生成的產物與MeOH攪拌接著過濾得到題述化合物(18g,73%)。
化合物343的制備
除了使用化合物343-4以及4-([1,1'-聯苯基]-4-基)-2-氯喹唑啉代替245-4以及2-氯-4,6-二苯基-1,3,5-三嗪以外,以與在制備實施例20中化合物245的制備方式相同的方式進行制備得到目標化合物343(9.3g,68%)。
<制備實施例35>化合物354的制備
化合物354-3的制備
除了使用化合物343-1代替10-1以外,以與在制備實施例31中化合物294-3的制備方式相同的方式進行制備得到目標化合物354-3。
化合物354的制備
除了使用化合物354-3以及2-(4-溴苯基)-1-苯基-1H-苯并[d]咪唑代替化合物245-4以及2-氯-4,6-二苯基-1,3,5-三嗪以外,以與在制備實施例20中化合物245的制備方式相同的方式進行制備得到目標化合物354(10.2g,76%)。
<制備實施例36>化合物370的制備
化合物370-3的制備
除了使用化合物5-溴吡啶酰氯代替4-溴苯酰氯以外,以與在制備實施例32中化合物309-4的制備方式相同的方式進行制備得到目標化合物370-3。
化合物370的制備
除了使用化合物370-3以及2-氯-4,6-二苯基嘧啶代替化合物245-4以及2-氯-4,6-二苯基-1,3,5-三嗪以外,以與在制備實施例20中化合物245的制備方式相同的方式進行制備得到目標化合物370(9.6g,77%)。
<制備實施例37>化合物373的制備
化合物373-3的制備
除了使用化合物6-1代替309-1以外,以與在制備實施例36中化合物370-3的制備方式相同的方式進行制備得到目標化合物373-3。
化合物373的制備
除了使用化合物373-3以及2-氯-4,6-二苯基嘧啶代替化合物245-4以及2-氯-4,6-二苯基-1,3,5-三嗪以外,以與在制備實施例20中化合物245的制備方式相同的方式進行制備得到目標化合物373(12.4g,87%)。
<制備實施例38>化合物419的制備
化合物419-1的制備
氮氣下在單頸圓底燒瓶中將三乙胺(34ml,244mmol)添加到6-1(50g,221.9mmol)和四氫呋喃(800ml)的混合物中,接著攪拌所得的混合物10分鐘。將溫度降低至0℃,向其中添加3,5-二溴苯酰氯(100g,332.8mmol)在四氫呋喃(200ml)中的混合物,接著攪拌所得的混合物30分鐘。在用MC萃取該混合物后,濃縮有機層,接著向其中添加甲醇,超聲處理并接著過濾所得的混合物(107g,99%)。
化合物419-2的制備
在充滿氮氣的單頸圓底燒瓶中將三氯氧磷(V)(20ml,216mmol)添加到419-1(96g,197mmol)在硝基苯(2,000ml)中的混合物中,接著在150℃下攪拌所得的混合物3小時。在0℃下用飽和碳酸氫鈉水溶液終止反應物的反應,接著向其中輕輕地添加二氯甲烷并接著向其中添加過量甲醇以固化產物,接著過濾該產物(60g,65%)。
化合物419的制備
在單頸圓底燒瓶中在120℃下攪拌419-2(7g,14.91mmol)、二苯并[b,d]噻吩-4-基硼酸(12.12g,37.29mmol)、Pd(PPh3)4(1.72g,1.49mmol)以及K2CO3(8.2g,59.64mmol)在1,4-二噁烷(100ml)/H2O(20ml)中的混合物并持續30小時。在110℃的狀態下過濾反應物,接著在110℃下用1,4-二噁烷洗滌生成的產物(7.5g,74%)。
<制備實施例39>化合物426的制備
化合物426-1的制備
在單頸圓底燒瓶中在110℃下攪拌419-2(60g,127.8mmol)、2-苯基-1-(4-(4,4,5,5-四甲基-1,3,2-二氧硼戊烷-2-基)苯基)-1H-苯并[d]咪唑(55.7g,140.6mmol)、Pd(PPh3)4(14.6g,12.7mmol)以及NaHCO3(21.4g,255.6mmol)在甲苯(1,000ml)/EtOH(200ml)/H2O(200ml)中的混合物并持續3小時。用MC萃取,接著濃縮并通過柱層析(SiO2,乙酸乙酯:二氯甲烷=1:20)分離反應物(47g,55%)。
化合物426的制備
在單頸圓底燒瓶中在110℃下攪拌426-1(10.7g,15.16mmol)、二苯并[b,d]呋喃-2-基硼酸(3.5g,16.67mmol)、Pd(PPh3)4(1.7g,1.5mmol)以及K2CO3(4.19g,30.32mmol)在1,4-二噁烷(100ml)/H2O(20ml)中的混合物并持續6小時。用MC萃取,接著濃縮并通過柱層析(SiO2,乙酸乙酯:二氯甲烷=1:20)分離反應物(8.3g,73%)。
<制備實施例40>化合物437的制備
化合物437-2的制備
除了使用化合物10-1代替6-1以外,以與在制備實施例38中化合物419-2的制備方式相同的方式進行制備得到目標化合物437-2。
化合物437的制備
除了使用化合物437-2以及二苯并[b,d]呋喃-4-基硼酸代替419-2以及二苯并[b,d]呋喃-2-基硼酸以外,以與在制備實施例38中化合物419的制備方式相同的方式進行制備得到目標化合物437(10.5g,76%)。
<制備實施例41>化合物454的制備
化合物454-1的制備
除了使用化合物437-2以及1-苯基-2-(4-(4,4,5,5-四甲基-1,3,2-二氧硼戊烷-2-基)苯基)-1H-苯并[d]咪唑代替419-2以及2-苯基-1-(4-(4,4,5,5-四甲基-1,3,2-二氧硼戊烷-2-基)苯基)-1H-苯并[d]咪唑以外,以與在制備實施例39中化合物426-1的制備方式相同的方式進行制備得到目標化合物454-1。
化合物454的制備
在單頸圓底燒瓶中在110℃下攪拌454-1(11.9g,18mmol)、9H-咔唑(3.62g,21.6mmol)、Pd2(dba)3(1.6g,1.8mmol)、P(t-Bu)3(6ml,5.4mmol)以及NaOt-Bu(3.45g,36mmol)在甲苯(100ml)中的混合物并持續8小時。用MC萃取,接著濃縮并通過柱層析(SiO2,乙酸乙酯:二氯甲烷=1:20)分離反應物(11.5g,85%)。
<制備實施例42>化合物379的制備
除了使用化合物309-1代替6-1以外,以與在制備實施例38中化合物419的制備方式相同的方式進行制備得到目標化合物379。
<制備實施例43>化合物386的制備
除了使用化合物379-2代替419-2以外,以與在制備實施例39中化合物426的制備方式相同的方式進行制備得到目標化合物386。
<制備實施例44>化合物397的制備
除了使用化合物343-1代替10-1以外,以與在制備實施例40中化合物437的制備方式相同的方式進行制備得到目標化合物397。
<制備實施例45>化合物414的制備
除了使用化合物397-2代替437-2以外,以與在制備實施例41中化合物454的制備方式相同的方式進行制備得到目標化合物414。
以在制備實施例中相同的方式制備化合物,其合成確認結果示于表1至3中。
[表1]
[表2]
[表3]
<實驗實施例1>化合物CV、UV以及PL的測量
通過采用NPB(HOMO=-5.5eV)作為參比材料并使用循環伏安(CV)測量裝置(制造商:Princeton Applied Research,型號名稱:Parstat2273)測量CV。
在常溫下通過使用UV-可見光分光光度計(制造商:Perkin Elmer,型號名稱:LS35)測量并通過使用四氫呋喃(THF)分析UV。
在常溫下通過使用光譜儀(設備:Perkin Elmer,型號名稱:LS55)測量并通過使用四氫呋喃(THF)分析PL。
圖4圖示化合物29的UV和PL的測量圖。
圖5和圖6圖示由測量化合物29的CV的結果導出的Eox值。
圖7圖示化合物42的UV和PL的測量圖。
圖8和圖9圖示由測量化合物42的CV的結果導出的Eox值。
圖10圖示化合物87的UV和PL的測量圖。
圖11和圖12圖示由測量化合物87的CV的結果導出的Eox值。
圖13圖示化合物88的UV和PL的測量圖。
圖14和圖15圖示由測量化合物88的CV的結果導出的Eox值。
圖16圖示化合物90的UV和PL的測量圖。
圖17和圖18圖示由測量化合物90的CV的結果導出的Eox值。
圖19圖示化合物91的UV和PL的測量圖。
圖20和圖21圖示由測量化合物91的CV的結果導出的Eox值。
圖22圖示化合物92的UV和PL的測量圖。
圖23和圖24圖示由測量化合物92的CV的結果導出的Eox值。
圖25圖示化合物93的UV和PL的測量圖。
圖26和圖27圖示由測量化合物93的CV的結果導出的Eox值。
圖28圖示由測量化合物73的CV的結果導出的Eox值。
圖29圖示化合物73的UVPL的測量圖。
圖30圖示化合物85的LTPL的測量圖。
圖31圖示化合物85的UVPL的測量圖。
圖32圖示化合物86的LTPL的測量圖。
圖33圖示化合物86的UVPL的測量圖。
圖34圖示化合物87的LTPL的測量圖。
圖35圖示化合物87的UVPL的測量圖。
圖36圖示化合物88的LTPL的測量圖。
圖37圖示化合物88的UVPL的測量圖。
圖38圖示化合物90的LTPL的測量圖。
圖39圖示化合物90的UVPL的測量圖。
圖40圖示化合物91的LTPL的測量圖。
圖41圖示化合物91的UVPL的測量圖。
圖42圖示化合物92的LTPL的測量圖。
圖43圖示化合物92的UVPL的測量圖。
圖44圖示化合物93的LTPL的測量圖。
圖45圖示化合物93的UVPL的測量圖。
圖46圖示化合物245的LTPL的測量圖。
圖47圖示化合物245的UVPL的測量圖。
圖48圖示化合物246的LTPL的測量圖。
圖49圖示化合物246的UVPL的測量圖。
圖50圖示化合物250的LTPL的測量圖。
圖51圖示化合物250的UVPL的測量圖。
圖52圖示化合物253的LTPL的測量圖。
圖53圖示化合物253的UVPL的測量圖。
圖54圖示化合物259的LTPL的測量圖。
圖55圖示化合物259的UVPL的測量圖。
圖56圖示化合物260的LTPL的測量圖。
圖57圖示化合物260的UVPL的測量圖。
圖58圖示化合物409的LTPL的測量圖。
圖59圖示化合物409的UVPL的測量圖。
圖60圖示化合物420的LTPL的測量圖。
圖61圖示化合物420的UVPL的測量圖。
圖62圖示化合物425的LTPL的測量圖。
圖63圖示化合物425的UVPL的測量圖。
圖64圖示化合物427的LTPL的測量圖。
圖65圖示化合物427的UVPL的測量圖。
圖66圖示化合物434的LTPL的測量圖。
圖67圖示化合物434的UVPL的測量圖。
在圖5、6、8、9、11、12、14、15、17、18、20、21、23、24以及26至28的曲線圖中,y-軸表示電流(單位:A),以及x-軸表示電勢(單位:V)。
在圖4、7、10、13、16、19、22以及25的曲線圖中,左曲線圖(藍色)表示UV吸收,而右曲線圖(紅色)表示PL發光值。在圖4、7、10、13、16、19、22、25以及29至67的曲線圖中,y-軸和x-軸各自表示強度和波長(單位:nm)。
此外,可通過以下等式確定化合物的最高占據分子軌道(HOMO)、最低未占分子軌道(LUMO)、以及帶隙。
<等式>
Homo=-5.5-(Eox(待測的化合物)-Eox(NPB))eV
帶隙(Homo-Lumo)=1240/UV吸收限
<實驗實施例2>OLED器件的制造
<對比實施例1>
相繼使用三氯乙烯、丙酮、乙醇以及蒸餾水超聲洗滌由用于OLED的玻璃獲得的透明電極ITO薄膜(康寧三星有限公司制造),每種洗滌5分鐘,接著將所述ITO薄膜置于異丙醇中,保存,接著使用。
然后,將ITO基板布置在真空沉積設備的基板夾中,將以下4,4',4"-三(N,N-(2-萘基)-苯基氨基)三苯基胺(2-TNATA)放置在所述真空沉積設備的小格(cell)中。
隨后,排空小室中的空氣直到小室中的真空度達到10-6托,接著通過將電流施加到所述小格以使2-TNATA蒸發而使得具有厚度的空穴注入層沉積到所述ITO基板上。
通過將以下N,N'-雙(α-萘基)-N,N'-二苯基-4,4'-二胺(NPB)放置在所述真空沉積設備的另一個小格(cell)中并向該小格施加電流使NPB蒸發而使得具有厚度的空穴傳輸層沉積到空穴注入層上。
如上所述形成空穴注入層和空穴傳輸層,接著在其上沉積具有以下結構的藍光發光材料作為發光層。具體地,使所述藍光發光主體材料H1真空沉積在真空沉積設備的一個小格上具有的厚度,并使藍光發光摻雜劑材料D1以相對于主體材料5%的量在其上真空沉積。
隨后,使作為電子傳輸層的具有以下結構式E1的化合物真空沉積為具有的厚度。
通過沉積氟化鋰(LiF)(作為電子注入層)使其具有的厚度并且使得A1陰極具有的厚度來制造OLED器件。
同時,使用于制造OLED器件所需的所有有機化合物在10-6至10-8托下經歷真空升華純化以用于每種材料,并用于制造OLED。
<對比實施例2>
制造如對比實施例1中的器件結構,除了使用E2材料代替E1材料。
<對比實施例3>
通過以下方法制造有機電致發光器件。
用蒸餾水超聲洗滌玻璃基板,其中在所述玻璃基板中薄薄地涂覆有具有厚度的ITO。當用蒸餾水洗滌結束時,用溶劑(如丙酮、甲醇以及異丙醇)超聲洗滌該玻璃基板,干燥并接著在UV洗滌機中使用UV對其進行UVO處理5分鐘。之后,將該基板轉移至等離子洗滌機(PT)中,接著真空狀態下對其進行針對ITO功函數的等離子體處理并除去殘留膜,并且因此,將其轉移至用于有機沉積的熱沉積設備。
在如上制備的ITO透明電極(陽極)上形成空穴注入層4,4′,4″-三[2-萘基(苯基)氨基]三苯基胺(2-TNATA)以及空穴傳輸層N,N′-二(1-萘基)-N,N′-二苯基-(1,1′-聯苯基)-4,4′-二胺(NPB),作為公用層(common layers)。
如下在所述公用層上熱真空沉積發光層。通過使用4,4’-N,N’-二咔唑-聯苯基(CBP)作為主體以及三(2-苯基吡啶)銥(Ir(ppy)3)作為綠色磷光摻雜劑使CBP摻雜有7%的量的Ir(ppy)3)而使得發光層沉積為具有的厚度。之后,使作為空穴阻擋層的BCP沉積為具有的厚度,并在其上使作為電子傳輸層的Alq3沉積為具有的厚度。最后,有機電致發光器件通過以下步驟制造:在電子傳輸層上沉積氟化鋰(LiF)以具有的厚度來形成電子注入層,接著在該電子注入層上沉積鋁(Al)陰極以具有的厚度來形成陰極。
同時,使用于制造OLED器件所需的所有有機化合物在10-6至10-8托下經歷真空升華純化以用于每種材料,并用于制造OLED。
<實施例1至98>
除了使用制備實施例20至45合成的化合物代替在形成對比實施例1和2中的電子傳輸層時使用的E1和E2以外,以對比實施例1和2中相同的方式制造有機電致發光器件。
對在對比實施例1和2以及實施例1至98中制造的每個有機電致發光器件,在700cd/m2的發光亮度下測定并評價驅動電壓、效率、色坐標以及耐久性(使用壽命),結果示于以下表4中。
[表4]
從表4可知,與通過使用對比實施例1和2中使用的電子傳輸層材料E1和E2制造的器件相比,當通過使用本發明的實施例1中所使用的電子傳輸層材料制造器件時,器件的使用壽命延長并且其驅動電壓和效率得到改善。
<實施例99至118>
除了使用制備實施例1至19合成的化合物代替在對比實施例3中發光層形成期間使用的主體CBP以外,以對比實施例3中相同的方式制造有機電致發光器件。
對于對比實施例3和實施例99至118中制造的每個有機電致發光器件,通過McScience公司制造的M7000測量電致發光(EL)性質,并基于其測量結果,當參比亮度為6,000cd/m2時,通過McScience公司制造的使用壽命測量設備(M6000)測量T90。結果示于以下表5中。
[表5]
從表5的結果可見,可知曉將本發明的化合物應用到發光層的有機發光器件具有比對比實施例3中的有機發光器件更低的驅動電壓和更加改善的發光效率,并且其使用壽命也得到顯著改善。
- 還沒有人留言評論。精彩留言會獲得點贊!