對維生素D差向異構體特異性的結合配偶體的制作方法
背景
本發明涉及用于確定懷疑含有維生素D分析物(包括維生素D異構體)及其代謝物的樣品中其存在和/或量的組合物、方法和試劑盒。更具體地,本發明涉及對維生素D的差向異構體特異性的結合配偶體諸如,例如抗體。
許多小分子化合物或半抗原,諸如例如藥物和維生素,以同分異構形式存在,其中只有一種形式是活性的。為了獲得分析物的活性形式的準確測量,必須解決該分析物的非活性同分異構體的存在。分析物的兩種同分異構形式(即活性形式和非活性形式)的測量值可導致可能對個體不利(取決于分析物的活性形式的功能)的不準確性。準確地評價生物樣品中一對同分異構分析物的每種的水平是重要的,尤其當僅一種同分異構體是活性的,并且包括非活性同分異構體的量的測量值扭曲了樣品中分析物的水平。例如,測量生物樣品中的維生素D水平是重要的,因為維生素D缺乏與哺乳動物中許多病癥相關。在嬰兒中,例如,包括3-差向異構體的量的維生素D測量值可導致嬰兒中維生素D水平的不準確評價,這進而可導致缺乏合適的補充。測量維生素D的活性形式是重要的,使得嬰兒可以接受適當的維生素D療法(如果必要)。
術語“維生素D”是指一類脂溶性開環甾類化合物。在人類中,維生素D是獨特的,因為它可作為膽鈣化甾醇(維生素D3)或麥角鈣化甾醇(維生素D2)被攝取,以及因為機體也可以在日照充足時(由膽甾醇)合成維生素D。由于此后一特性,一些人認為維生素D是非必要膳食維生素,盡管大多數人認為它是必要營養素。維生素D在鈣離子體內平衡的正性調節中具有重要的生理作用。維生素D3是由動物合成的維生素形式。其如同維生素D2一樣也是添加至乳制品和某些食品的常見補充劑。
膳食和內在合成的維生素D3兩者都必須經歷代謝活化來生成生物活性代謝物。在人類中,維生素D3活化的初始步驟主要在肝臟中發生并涉及羥基化以形成中間代謝物25-羥基膽鈣化甾醇。鈣二醇是維生素D3在循環系統中的主要形式。維生素D2也經歷類似的代謝活化,成為25-羥基維生素D2。這些化合物共同地被稱作25-羥基維生素D(縮寫為25(OH)D),并且它們是在血清中測量以確定維生素D狀態的主要代謝物;25(OH)D及其差向異構體兩者都為需要被轉化成1,25(OH)D以發揮生物功能的前激素。1,25(OH)D的生物活性與3-差向-1,25(OH)D的生物活性的比較是復雜的。
維生素D化合物25-羥基維生素D3和25-羥基維生素D2在3-位是差向異構的,其中所述差向異構體分別被命名為25-羥基維生素D3和3-差向-25-羥基維生素D3和25-羥基維生素D2和3-差向-25-羥基維生素D2。只有這些差向異構化合物的每種的一種差向異構體,即分別25-羥基維生素D3和25-羥基維生素D2是活性的。25-羥基維生素D3和25-羥基維生素D2的差向異構體的結構在圖1中闡述。
評價生物樣品中的維生素D水平是重要的,因為維生素D缺乏與哺乳動物中的許多疾病相關。需要用于準確和靈敏測定樣品中的維生素D和維生素D的差向異構形式及其代謝物的濃度的試劑和方法。
概述
根據本文所述的原理的一些實例涉及針對式I化合物制備的結合配偶體諸如,例如抗體:
(R1)p-(L)q-Z,其中
或H,其中至少一個R1不是H,
Y是O、S、CR或NR4,
X是-O-(CH2)n-C(O)-、-(CH2)w-C(O)-、-(CH2)w-C(O)-(CH2)x-C(O)-、-(CH2)w-C(O)-NH(CH2)y-C(O)-、-NR3-C(O)-,
R獨立地是H或烷基,
R2獨立地是H或烷基,
R3、R4、R5和R6獨立地是H或烷基,或者R4和R5可以一起形成鍵,或者R5和R6可以一起形成鍵,
R11是H、烷基或酰基,
n是1至10的整數,
w是0至10的整數,
x是1至10的整數,
y是1至10的整數,
p是1至10的整數,
L是連接基團,
q是0或1,且
Z是聚(氨基酸)免疫原性載體或非聚(氨基酸)免疫原性載體。
根據本文所述的原理的一些實例涉及針對式II化合物產生的抗體:
NHR1’-(CH2)r’-NR1’’-((CH2)r’-NR1’’’)s’-(CH2)r’-NR7’-Z’,其中
R1’、R1’’或R1’’’各自獨立地選自
和H,
其中R1’、R1’’或R1’’’中的至少一個不是H,
n’是1至10的整數,
r’獨立地是1至10的整數,
s’是1至10的整數,
R7’是H或烷基,
R11’是H、烷基或酰基,且
Z’是聚(氨基酸)免疫原性載體或非聚(氨基酸)免疫原性載體;
或針對上述化合物中的兩種或更多種的混合物產生的抗體。
根據本文所述的原理的一些實例涉及對3-差向-25-羥基維生素D3特異性且不在任何可檢測程度上結合非-差向-維生素D化合物的抗體。
附圖簡述
本文提供的附圖不是按比例的,并且為了便于理解根據本文所述的原理的某些實例的目的而提供,并且通過說明而非限制所附權利要求的范圍的方式來提供。
圖1是25-羥基維生素D3和25-羥基維生素D2的差向異構形式的化學式的描繪。
圖2是按照根據本文所述的原理的實施例的化合物的合成的示意圖。
圖3是按照根據本文所述的原理的實施例的化合物的合成的示意圖。
圖4是按照根據本文所述的原理的實施例的化合物的合成的示意圖。
圖5是按照根據本文所述的原理的實施例的化合物的合成的示意圖。
圖6是按照根據本文所述的原理的實施例的化合物的合成的示意圖。
圖7是按照根據本文所述的原理的實施例的化合物的合成的示意圖。
圖8是按照根據本文所述的原理的實施例的化合物的合成的示意圖。
圖9說明使用添加和不添加抗-3-差向異構體-VD抗體的試劑產生的標準曲線的比較。
圖10是用于使用抗-3-差向異構體-VD抗體測定樣品中的3-差向-25(OH)D的免疫測定的標準曲線。
具體實施方案的詳述
化合物
如上所提及,根據本文所述的原理的一些實例涉及針對式I化合物產生的結合配偶體諸如,例如抗體:
(R1)p-(L)q-Z,其中
或H,其中至少一個R1不是H,
Y是O、S、CR或NR4,
X是-O-(CH2)n-C(O)-、-(CH2)w-C(O)-或-NR3-C(O)-;例如,在一些實例中,當Y是NR4時,X是-O-(CH2)n-C(O)-,例如當Y是O或S時,X是-(CH2)w-C(O)-、-(CH2)w-C(O)-(CH2)x-C(O)-或-(CH2)w-C(O)-NH(CH2)y-C(O)-,例如,或者,當Y是CR 時,X是-NR3-C(O)-,
R獨立地是H或烷基,
R2獨立地是H或烷基,
R3、R4、R5和R6獨立地是H或烷基,或者R4和R5可以一起形成鍵,或者R5和R6可以一起形成鍵,
R11是H、烷基或酰基,
n是例如1至10,或1至9,或1至8,或1至7,或1至6,或1至5,或1至4,或1至3,或1至2,或2至10,或2至9,或2至8,或2至7,或2至6,或2至5,或2至4,或2至3,或3至10,或3至9,或3至8,或3至7,或3至6,或3至5,或3至4,或4至10,或4至9,或4至8,或4至7,或4至6,或4至5,或5至10,或5至9,或5至8,或5至7,或5至6,或6至10,或6至9,或6至8,或6至7,或7至10,或7至9,或7至8,或8至10,或8至9,或9至10的整數,
w是例如0至10,1至10,或1至9,或1至8,或1至7,或1至6,或1至5,或1至4,或1至3,或1至2,或2至10,或2至9,或2至8,或2至7,或2至6,或2至5,或2至4,或2至3,或3至10,或3至9,或3至8,或3至7,或3至6,或3至5,或3至4,或4至10,或4至9,或4至8,或4至7,或4至6,或4至5,或5至10,或5至9,或5至8,或5至7,或5至6,或6至10,或6至9,或6至8,或6至7,或7至10,或7至9,或7至8,或8至10,或8至9,或9至10的整數,
x是例如1至10,或1至9,或1至8,或1至7,或1至6,或1至5,或1至4,或1至3,或1至2,或2至10,或2至9,或2至8,或2至7,或2至6,或2至5,或2至4,或2至3,或3至10,或3至9,或3至8,或3至7,或3至6,或3至5,或3至4,或4至10,或4至9,或4至8,或4至7,或4至6,或4至5,或5至10,或5至9,或5至8,或5至7,或5至6,或6至10,或6至9,或6至8,或6至7,或7至10,或7至9,或7至8,或8至10,或8至9,或9至10的整數,
y是例如1至10,或1至9,或1至8,或1至7,或1至6,或1至5,或1至4,或1至3,或1至2,或2至10,或2至9,或2至8,或2至7,或2至6,或2至5,或2至4,或2至3,或3至10,或3至9,或3至8,或3至7,或3至6,或3至5,或3至4,或4至10,或4至9,或4至8,或4至7,或4至6,或4至5,或5至10,或5至9,或5至8,或5至7,或5至6,或6至10,或6至9,或6至8,或6至7,或7至10,或7至9,或7至8,或8至10,或8至9,或9至10的整數,
p是例如1至10,或1至9,或1至8,或1至7,或1至6,或1至5,或1至4,或1至3,或1至2,或2至10,或2至9,或2至8,或2至7,或2至6,或2至5,或2至4,或2至3,或3至10,或3至9,或3至8,或3至7,或3至6,或3至5,或3至4,或4至10,或4至9,或4至8,或4至7,或4至6,或4至5,或5至10,或5至9,或5至8,或5至7,或5至6,或6至10,或6至9,或6至8,或6至7,或7至10,或7至9,或7至8,或8至10,或8至9,或9至10的整數,
L是連接基團,
q是0或1,且
Z是聚(氨基酸)免疫原性載體部分或非聚(氨基酸)免疫原性載體部分。
如本文所使用,術語“烷基”包括直鏈、支鏈,或環狀構型的指定碳原子數的那些烷基。“烷基”的實例包括但不限于例如甲基、乙基、丙基、異丙基、丁基、仲丁基和叔丁基、戊基、己基、庚基、環丙基、環丁基、環戊基、環己基、環庚基、降冰片基。在一些實例中,烷基含有1至10,或1至9,或1至8,或1至7,或1至6,或1至5,或1至4,或1至3,或1至2,或2至10,或2至9,或2至8,或2至7,或2至6,或2至5,或2至4,或2至3,或3至10,或3至9,或3至8,或3至7,或3至6,或3至5,或3至4,或4至10,或4至9,或4至8,或4至7,或4至6,或4至5,或5至10,或5至9,或5至8,或5至7,或5至6,或6至10,或6至9,或6至8,或6至7,或7至10,或7至9,或7至8,或8至10,或8至9,或9至10個碳原子,其可以是未取代的或其中的一個或多個可以被羥基,1至5、或1至4、1至3、或1至2、或2至5、或2至4、或2至3、或3至5、或3至4、或4至5個碳原子的烷氧基中的一個或多個取代。
如本文所使用,術語“酰基”意指R12C(O)-,其中R12是烷基或芳基。
如本文所使用,術語“芳基”意指通過去除一個原子衍生自芳族烴且含有一個或多個芳族環、通常一至四個芳族環的有機基團,諸如例如苯基(衍生自苯)、萘基(衍生自萘)等,例如苯基、萘基、菲基。
如本文所使用,短語“連接基團”是指化學部分,其可以包含約2至約50個原子或4至約30個原子(不計算氫),并且可以包含2至約30個原子、或3至約20個原子的鏈,所述原子各自獨立地選自通常由碳、氧、硫、氮和磷組成的組。在一些實例中,部分或全部所述連接基團可以是連接的分子的一部分,諸如但不限于,例如聚(氨基酸)上的氨基酸殘基。連接基團中的雜原子的數目可以是0至約20、或1至約15、或約2至約10。所述連接基團可以是脂族或芳族的。當存在雜原子時,氧通常作為鍵合至碳、硫、氮或磷的氧代或氧基存在,氮通常作為通常鍵合至碳、氧、硫或磷的硝基、亞硝基或氨基存在;硫與氧相似;而磷通常作為膦酸單或二酯和磷酸單或二酯鍵合至碳、硫、氧或氮。在連接基團和待綴合的分子之間形成共價鍵的常見官能團為烷基胺、脒、硫代酰胺、醚、脲、硫脲、胍、偶氮、硫醚和羧酸酯、磺酸酯和磷酸酯、酰胺和硫酯。
在大多數情況下,當連接基團具有連接官能團(用于與基團反應的官能團),諸如例如,包括氮和硫類似物的非氧代羰基基團、磷酸酯基團、氨基基團,烷基化劑諸如鹵代或甲苯磺酰基烷基,氧基(羥基或硫類似物、巰基)氧代羰基(例如,醛或酮),或活性烯烴諸如乙烯基砜或α-、β-不飽和酯時,這些官能團被連接至胺基團、羧基基團、活性烯烴、烷基化劑,例如溴乙酰基。當連接胺和羧酸或其氮衍生物或磷酸時,形成酰胺、脒和磷酰胺。當連接硫醇和活化烯烴時,形成硫醚。當連接硫醇和烷基化劑時,形成硫醚。當在還原條件下連接醛和胺時,形成烷基胺。當連接酮或醛和羥胺(包括其衍生物,其中取代基取代羥基基團的氫)時,形成肟官能團(=N-O-)。當連接羧酸或磷酸和醇時,形成酯。
如本文所使用,術語“免疫原性載體”意指與半抗原綴合的基團或部分。免疫原性載體和半抗原的綴合物可以注射入能夠引發免疫應答的生物體,諸如但不限于哺乳動物、禽類(例如雞或鴿)、兩棲動物或爬行動物;或者所述綴合物可用于接種體外樣品(哺乳動物,包括人、禽類、兩棲動物或爬行動物)或以其它方式可用于產生半抗原的結合配偶體的技術中。短語“結合配偶體”是指作為特異性結合對的成員的分子,其是特異性結合另一分子并因此被定義為與另一分子互補的兩種不同分子之一。例如,特異性結合對的一個成員可以在表面上或在空腔中具有特異性結合特異性結合對的另一成員的特定空間和極性組織的區域。通過說明而非限制的方式,所述結合配偶體可以是例如抗體或適體(例如,核酸適體或肽適體)。在一個實例中,免疫原性載體可以用作免疫原以誘導免疫應答并引發半抗原的結合配偶體的產生。其它技術包括噬菌體展示和體外選擇。免疫原性載體有時也被稱為抗原載體。在根據本文所述的原理的一些實例中,合成包含免疫原性載體(包括聚(氨基酸)和非聚(氨基酸)免疫原性載體)的免疫原,并用于制備抗體。半抗原是能夠特異性結合至相應抗體的化合物,但本身不充當用于制備所述抗體的免疫原(或抗原)。因此,將半抗原連接至可用于例如產生抗體的免疫原性載體。
作為免疫原性載體的聚(氨基酸)的分子量范圍(以道爾頓計)為例如約5,000至約10,000,000,或約20,000至約600,000,或約25,000至約250,000。“聚(氨基酸)免疫原性載體部分”包括蛋白諸如,例如,白蛋白、血清蛋白,例如球蛋白、眼晶狀體蛋白和脂蛋白。說明性蛋白包括但不限于例如牛血清白蛋白(BSA)、匙孔?血藍蛋白(KLH)、卵卵白蛋白和牛γ球蛋白(BGG)。“非聚(氨基酸)免疫原性載體部分”包括多糖、核酸和顆粒(生物材料和合成材料)。各種免疫原性載體公開于Davalian等人,美國專利號5,089,390,第4欄第57行至第5欄第5行中,其通過引用并入本文。
如上所提及,所述免疫原性載體部分可以是多糖,所述多糖是單糖的高分子量聚合物,其可以天然或合成制備并通常涉及單糖的重復縮合。多糖的實例是淀粉、糖原、纖維素、碳水化合物膠,諸如阿拉伯樹膠、瓊脂等等。所述多糖還可含有聚(氨基酸)殘基和/或脂質殘基。
如本文所使用,術語“標記”包括聚(氨基酸)標記和非聚(氨基酸)標記。術語“聚(氨基酸)標記部分”包括作為蛋白的標記,例如但不限于例如酶、抗體、肽和免疫原。對于標記蛋白諸如,例如酶,重均分子量范圍將為約10,000至約600,000,或約10,000至約300,000。例如,每約200,000分子量的蛋白通常存在至少一個根據本文所述的原理的化合物(類似物基團),或每約150,000分子量至少約1個,或每約100,000分子量至少約1個,或每約50,000的分子量至少約1個,或每40,000分子量至少約1個,或每30,000分子量至少約1個,或每20,000分子量至少1個,或每10,000分子量至少1個,或每5,000分子量至少1個。在酶的情況下,類似物基團的數目通常為1至約20,約2至約15,約3至約12,或約6至約10。
通過說明而非限制的方式,酶包括氧化還原酶諸如,例如脫氫酶,例如葡萄糖-6-磷酸脫氫酶(G6PDH)和乳酸脫氫酶;涉及過氧化氫的產生和使用過氧化氫將染料前體氧化為染料的酶諸如,例如辣根過氧化物酶、乳過氧化物酶和微過氧化物酶;水解酶諸如,例如堿性磷酸酶和β-半乳糖苷酶;熒光素酶諸如,例如螢火蟲熒光素酶和細菌熒光素酶;轉移酶;酶的組合,諸如但不限于糖氧化酶,例如葡萄糖和半乳糖氧化酶,或雜環氧化酶,諸如尿酸酶和黃嘌呤氧化酶,其與采用過氧化氫以氧化染料前體的酶(即過氧化物酶諸如辣根過氧化物酶、乳過氧化物酶或微過氧化物酶)偶聯。
如本文所使用,術語“非聚(氨基酸)標記”包括不是蛋白的那些標記。所述非聚(氨基酸)標記能夠直接被檢測或可通過產生可檢測信號的反應檢測。所述非聚(氨基酸)標記可以是同位素的或非同位素的,并且通過說明而非限制的方式,可以是例如放射性同位素、發光化合物(其包括但不限于例如熒光化合物和化學發光化合物)、編碼催化劑的多核苷酸、促進劑(promoter)、染料、輔酶、酶底物、放射性基團、小有機分子(分子量200至2,000)、顆粒和可擴增的多核苷酸序列。
如上所提及,“小有機分子”具有約200至約2,000,或約200至約1,500,或約200至約1,000,或約200至約500的分子量。此類“小有機分子”包括但不限于例如生物素、熒光分子(諸如熒光素和羅丹明)、化學發光分子和二硝基苯酚。小有機分子的結合配偶體是特異性識別并結合至所述小分子的分子。小分子的結合配偶體由所述小分子的性質限定,并且包括但不限于,例如抗生物素蛋白、鏈菌抗生物素蛋白、小有機分子的抗體(其包括但不限于熒光分子的抗體(例如熒光素抗體和羅丹明抗體)、化學發光分子的抗體和二硝基苯酚的抗體)。
如本文所使用,術語“非標記聚(氨基酸)部分”和“非免疫原性載體聚(氨基酸)部分”是指通常不被認為是標記或免疫原性載體的聚(氨基酸),盡管在某些情況下此類部分可以是標記或免疫原性載體。例如,抗體可以不被認為是標記,但如果抗體被修飾以包括信號產生部分或信號產生系統的一部分,則可以是標記。此外,抗體可以不被認為是免疫原性載體,但盡管如此在某些情況下能夠是免疫原性載體,因為其分子量更高。
在一些實例中,非聚(氨基酸)標記可以選自支持物、磁性顆粒、吖啶酯、磁性顆粒和吖啶酯(諸如例如,吖啶酯標記的順磁性顆粒)的組合、化學發光顆粒和敏化劑顆粒。
術語“共價”是指分子的連接,諸如通過直接連接,例如分子之間的化學鍵。術語“非共價”是指分子的連接,其涉及連接至分子的互補特異性結合對(sbp)成員之間的特異性結合。
在一些實例中,根據本文所述的原理的化合物可以與支持物結合,例如通過共價或非共價結合。如上所提及,在根據本文所述的原理的一些實例中,R2可以是支持物,其可以由有機或無機的、固體或液體的水不溶性材料構成,并且其可以是透明的或部分透明的。所述支持物可具有例如許多形狀的任一種,諸如但不限于顆粒(顆粒狀支持物),包括珠粒、薄膜、膜、管、孔、條、棒、纖維或平坦表面,諸如例如板或紙。所述支持物可以或可以不在其中采用它的介質中可懸浮。可懸浮支持物的實例是例如聚合物材料,諸如膠乳、脂質雙層或脂質體、油滴、細胞和水凝膠以及磁性顆粒。其它支持物組合物包括聚合物,通過說明而非限制的方式,諸如硝化纖維素、醋酸纖維素、聚(氯乙烯)、聚丙烯酰胺、聚丙烯酸酯、聚乙烯、聚丙烯、聚(4-甲基丁烯)、聚苯乙烯、聚甲基丙烯酸酯、聚(對苯二甲酸乙二醇酯)、尼龍、聚(丁酸乙烯酯),例如其可以本身使用或與其它材料結合使用。所述支持物可以用或可以不用例如染料、催化劑或其它可檢測基團進一步標記。
在根據本文所述的原理的一些實例中,所述支持物可以是顆粒。所述顆粒具有至少約0.02微米且不大于約100微米的平均直徑。在一些實例中,所述顆粒具有約0.05微米至約20微米,或約0.3微米至約10微米的平均直徑。所述顆粒可以是有機的或無機的、可溶脹的或不可溶脹的、多孔的或非多孔的,優選具有通常為約0.7 g/mL至約1.5 g/mL的接近于水的密度,并且由可以是透明的、部分透明的或不透明的材料構成。所述顆粒可以是例如生物材料,諸如細胞和微生物,例如紅細胞,白細胞,淋巴細胞,雜交瘤,鏈球菌,金黃色葡萄球菌和大腸桿菌,病毒。所述顆粒也可以是由有機和無機聚合物、脂質體、膠乳顆粒、磁性或非磁性顆粒、磷脂囊泡、乳糜微粒、脂蛋白等構成的顆粒。在一些實例中,所述顆粒是二氧化鉻(chrome)顆粒或膠乳顆粒。
磁性顆粒包括順磁性顆粒、鐵磁性顆粒和抗磁性顆粒。此類顆粒包括但不限于例如周期表的周期4-7的過渡金屬,包括鉻、銅、鈷、鋁、錳、鐵和鎳。
化學發光顆粒是具有與之締合的化學發光化合物的顆粒。如本文所使用,短語“與之締合”意味著化合物諸如例如化學發光化合物和顆粒可以通過例如直接或間接鍵合、吸附、吸收、并入或溶解來締合。可以利用的化學發光化合物的實例是美國專利號5,340,716和6,251,581中闡述的那些,其相關公開內容通過引用并入本文。在根據本文所述的原理的一些實例中,化學發光化合物是可光活化物質,其直接或由光敏化激發后,或與單線態氧反應后,經歷化學反應以形成亞穩態反應產物,其能夠分解,同時或隨后發射光(通常在250-1200 nm的波長范圍內)。術語“可光活化的”包括“可光化學活化的”。在一些實例中,所述化學發光化合物是與單線態氧反應以形成二氧雜環丁烷或二氧雜環丁酮的那些。后者通常是富電子烯烴。此類富電子烯烴的示例是烯醇醚、烯胺、9-亞烷基-N-烷基-9,10-二氫化吖啶(alkylacridan)、芳基乙烯基醚、二噁烯(dioxenes)、芳基咪唑、9-亞烷基-蒼耳烷和光澤精。其它化合物包括魯米諾(luminol)和其它鄰苯二甲酰肼,以及借助于通過光化學不穩定保護基團保護它們而被保護免于經歷化學發光反應的化學發光化合物,此類化合物包括,例如,螢火蟲熒光素、水通道蛋白(aquaphorin)和魯米諾。可以利用的此類化學發光化合物的實例是美國專利號5,709,994(其相關公開內容通過引用并入本文)中闡述的那些。
敏化劑顆粒是具有與之締合的敏化劑化合物的顆粒,其包括但不限于光敏劑化合物。可以利用的敏化劑化合物的實例是美國專利號5,340,716和6,251,581(其相關公開內容通過引用并入本文)中闡述的那些。
光敏劑是通常通過用光激發產生單線態氧的敏化劑。在一些實例中,所述光敏劑比所述化學發光化合物吸收更長的波長且具有比所述化學發光化合物更低的能量三重態。所述光敏劑可以是可光活化的(例如,染料和芳族化合物)。所述光敏劑通常是由共價鍵合的原子構成的化合物,其通常具有多個共軛雙鍵或三鍵。所述化合物應當吸收在200-1100 nm,通常300-1000 nm,優選450-950 nm的波長范圍內的光。典型的光敏劑包括但不限于例如丙酮、二苯甲酮、9-噻噸酮、曙紅、9,10-二溴蒽、亞甲基藍、金屬卟啉(例如血卟啉)、酞菁、葉綠素、玫瑰紅、勃克明斯特富勒烯(buckminsterfullerene),以及這些化合物的衍生物。其它光敏劑的實例列舉于N.J. Turro,"Molecular Photochemistry",第132頁,W. A. Benjamin Inc.,N.Y. 1965中。所述光敏劑有助于其中通過單線態氧活化的光活化。通常,所述光敏劑吸收光且因此形成的經激發的光敏劑使氧活化以產生單線態氧,所述單線態氧與化學發光化合物反應以產生亞穩定發光中間體。
在本文闡述的式中,通過鍵的波形線指示式中的部分的連接點。
根據本文所述的原理的一些實例涉及針對式IV化合物(其為式I化合物)產生的結合配偶體諸如,例如抗體,其中:
或H,其中至少一個R1不是H;
或針對上述化合物中的兩種或更多種的混合物產生的結合配偶體諸如,例如抗體。
根據本文所述的原理的一些實例涉及針對(7aS,E)-4-((Z)-2-((R)-5-羥基-2-亞甲基-亞環己基)亞乙基)-7a-甲基八氫-1H-茚-1-酮的衍生物(HMCHEMOIO衍生物)產生的結合配偶體諸如,例如抗體,或者式V化合物,其為式I化合物,其中:
或H,其中至少一個R1不是H;
或針對上述化合物中的兩種或更多種的混合物產生的結合配偶體諸如,例如抗體。
根據本文所述的原理的一些實例涉及針對式VI化合物(其為式I化合物)產生的抗體,其中:
(R1)p-(L)q-是NHR1-(CH2)r-NR1-((CH2)r-NR1)s-(CH2)r-NR7-,其中R1獨立地是
或
或
或H,
其中至少一個R1不是H,
p、q和n如上所定義,
r獨立地是例如1至10,或1至9,或1至8,或1至7,或1至6,或1至5,或1至4,或1至3,或1至2,或2至10,或2至9,或2至8,或2至7,或2至6,或2至5,或2至4,或2至3,或3至10,或3至9,或3至8,或3至7,或3至6,或3至5,或3至4,或4至10,或4至9,或4至8,或4至7,或4至6,或4至5,或5至10,或5至9,或5至8,或5至7,或5至6,或6至10,或6至9,或6至8,或6至7,或7至10,或7至9,或7至8,或8至10,或8至9,或9至10的整數,
s是例如1至10,或1至9,或1至8,或1至7,或1至6,或1至5,或1至4,或1至3,或1至2,或2至10,或2至9,或2至8,或2至7,或2至6,或2至5,或2至4,或2至3,或3至10,或3至9,或3至8,或3至7,或3至6,或3至5,或3至4,或4至10,或4至9,或4至8,或4至7,或4至6,或4至5,或5至10,或5至9,或5至8,或5至7,或5至6,或6至10,或6至9,或6至8,或6至7,或7至10,或7至9,或7至8,或8至10,或8至9,或9至10的整數,且
R7是H或烷基;
或針對上述化合物中的兩種或更多種的混合物產生的抗體。
根據本文所述的原理的一些實例涉及針對式II化合物產生的結合配偶體諸如,例如抗體:
NHR1’-(CH2)r’-NR1’’-((CH2)r’-NR1’’’)s’-(CH2)r’-NR7’-Z’,其中
R1’、R1’’或R1’’’各自獨立地選自
,
,
和H,
其中R1’、R1’’或R1’’’中的至少一個不是H,
n和w如上所定義,
r’ 獨立地是例如1至10,或1至9,或1至8,或1至7,或1至6,或1至5,或1至4,或1至3,或1至2,或2至10,或2至9,或2至8,或2至7,或2至6,或2至5,或2至4,或2至3,或3至10,或3至9,或3至8,或3至7,或3至6,或3至5,或3至4,或4至10,或4至9,或4至8,或4至7,或4至6,或4至5,或5至10,或5至9,或5至8,或5至7,或5至6,或6至10,或6至9,或6至8,或6至7,或7至10,或7至9,或7至8,或8至10,或8至9,或9至10的整數,
s’是例如1至10,或1至9,或1至8,或1至7,或1至6,或1至5,或1至4,或1至3,或1至2,或2至10,或2至9,或2至8,或2至7,或2至6,或2至5,或2至4,或2至3,或3至10,或3至9,或3至8,或3至7,或3至6,或3至5,或3至4,或4至10,或4至9,或4至8,或4至7,或4至6,或4至5,或5至10,或5至9,或5至8,或5至7,或5至6,或6至10,或6至9,或6至8,或6至7,或7至10,或7至9,或7至8,或8至10,或8至9,或9至10的整數,
R7’是H或烷基,
R11’是H、烷基或酰基,且
Z’是聚(氨基酸)免疫原性載體或非聚(氨基酸)免疫原性載體;
或針對上述化合物中的兩種或更多種的混合物產生的結合配偶體諸如,例如抗體。
在一些實例中,s’是1。在一些實例中,R7’是H。在一些實例中,r’是2。在一些實例中,R1’’和R1’’’是H;在一些實例中,R1’和R1’’’是H;且在一些實例中,R1’和R1’’是H。在一些實例中,R1’、R1’’和R1’’’無一是H,即R1’、R1’’和R1’’’都是
或
或
。
根據本文所述的原理的一些實例涉及藥物組合物,其包含有效量的根據本文所述的原理的抗體。
化合物的制備
通過說明而非限制的方式,下文討論制備作為根據本文所述的原理的HMCHEMOIO衍生物的化合物的方法的實例。可以采用其它方法以形成上述化合物和與本文所述的原理一致的其它化合物。
制備式VII化合物((7aS,E)-4-((Z)-2-((R)-5-羥基-2-亞甲基亞環己基)亞乙基)-7a-甲基八氫-1H-茚-1-酮)的實例闡述于圖2中。參考圖2,將式VIII化合物(其中R11O是乙酰基)處理以形成式IX的縮酮。在一個實例中,在芳族溶劑諸如苯中,在強有機酸諸如例如對甲苯磺酸存在下,在形成縮酮的條件(溫度和時間)下,用乙二醇處理式VIII化合物。在一些實例中,反應在回流下進行約10小時至約24小時或約12至約20小時的時段。
處理式IX化合物以引入鹵化物基團諸如,例如氯化物基團或溴化物基團。在一個實例中,在有機溶劑諸如例如烷烴(例如,己烷)中,例如在將溴化物基團引入式IX化合物的條件下,用N-溴代琥珀酰亞胺和自由基引發劑諸如例如偶氮二異丁腈處理式IX化合物,以得到式X化合物。在一些實例中,反應在回流下進行約30分鐘。
去除式X化合物的鹵化物,以得到具有兩個共軛雙鍵的式XI化合物。在一個實例中,在極性有機溶劑諸如例如醚(例如四氫呋喃)中,例如在用于去除鹵化氫的條件下,用弱堿諸如例如四正丁基氟化銨處理式X化合物,以形成雙鍵(式XI化合物)。在一些實例中,反應期間的溫度為約15℃至約25℃。反應時間段為約2小時。
通過在極性有機溶劑諸如例如烷醇(例如,甲醇或乙醇)中用無機堿諸如例如氫氧化鈉或氫氧化鉀處理而去除式XI化合物的乙酰基(R11)。反應組分經受用于去除乙酰基的條件,以得到式XII的化合物。在一些實例中,反應期間的溫度為約15℃至約25℃,或在室溫下。反應時間段為約4小時至約8小時。
在水和極性有機溶劑諸如例如丙酮的混合物中,在用于去除縮酮的條件下,例如使用強有機酸諸如例如對甲苯磺酸,去除式XII化合物的縮酮基團,以得到式XIII化合物。在一些實例中,反應期間的溫度為約15℃至約25℃。反應時間段為約12小時至約48小時。
通過在極性有機溶劑諸如例如烷醇(例如甲醇或乙醇)、醚(例如乙醚)、酮(例如丙酮)或上述中的兩種或更多種的組合中,在用于打開式XIII的環的條件下,用用于打開環的試劑處理式XIII化合物,諸如例如用UV光處理(光反應),來形成式VII化合物。在一些實例中,光反應期間的溫度為約-20℃至約0℃。光反應時間段為約1至約10分鐘或約3至約5分鐘。光反應之后,使中間體在乙醇中回流約3小時。
通過說明而非限制的方式,圖3描述了制備式IIa化合物(通過實例而非限制的方式,其中Z為BSA)的方法的實例。參考圖3,使式VII化合物與氨基氧基乙酸(XIX)反應,以形成式XX的肟(2-((7aS,E)-4-((Z)-2-((R)-5-羥基-2-亞甲基亞環己基)亞乙基)-7a-甲基八氫-1H-茚-1-亞基氨基氧基)乙酸)。在有機溶劑諸如例如醇(例如甲醇或乙醇)中,在用于形成肟的條件下,進行該反應。在一些實例中,反應期間的溫度為約10℃至約30℃或約15℃至約25℃。反應時間段為約1小時至約30小時或約2小時至約24小時。
在單獨反應中,將聚(氨基酸)免疫原性載體(在該實例中,通過說明而非限制的方式,BSA(式II的Z’為BSA))與式XXI化合物組合,以形成式XXIa化合物。反應在約5.0至約7.0或約5.5至約6.5或約6的pH的水性緩沖介質中進行。反應介質中包括用于促進BSA的羧酸官能團與XXI的一個或多個胺基團反應的活化劑。此類偶聯劑包括但不限于1-乙基-3-(3-二甲基氨基丙基)-碳二亞胺(EDAC)、N-羥基琥珀酰亞胺(NHS)或N,N,N′,N′-四甲基-O-(N-琥珀酰亞胺基)脲鎓四氟硼酸鹽或上述中的兩種或更多種的組合。反應在用于形成酰胺的條件下進行。在一些實例中,反應期間的溫度為約15℃至約25℃。反應時間段為例如約3小時至約24小時,或約4小時至約20小時,或約4小時至約10小時。
用活化劑諸如但不限于例如1-乙基-3-(3-二甲基氨基丙基)-碳二亞胺(EDAC)、N-羥基琥珀酰亞胺(NHS)或N,N,N′,N′-四甲基-O-(N-琥珀酰亞胺基)脲鎓四氟硼酸鹽或上述中的兩種或更多種的組合處理式XX化合物,以形成活化的XX。在極性有機溶劑諸如例如烷醇(例如甲醇或乙醇)、醚(例如乙醚或四氫呋喃)、酮(例如丙酮)、二甲基亞砜、乙腈、二氯甲烷或二甲基甲酰胺(DMF)或上述中的兩種或更多種的組合(其也可以含有水)中進行反應。在一些實例中,反應期間的溫度為約15℃至約30℃,或約20℃至約25℃,或約室溫。反應時間段為約12小時至約36小時,或約20至約30小時。使活化的XX與式XXIa化合物反應,以得到式IIa化合物。如所示,R1’是式IIa化合物的部分,且R1’’和R1’’’各自是H。然而,與本文所述的原理一致,所得產物可以是化合物的混合物,其中在混合物的一種化合物中,R1’是式IIa化合物的部分,并且在混合物的另一種化合物中,R1’和R1’’兩者都是式IIa化合物的部分,并且在混合物的另一種化合物中,R1’和R1’’’兩者都是式IIa化合物的部分,并且在混合物的另一種化合物中,R1’和R1’’以及R1’’’所有三者都是式IIa化合物的部分。在有機溶劑諸如例如DMF或DMSO中,例如在用于形成酰胺的條件下,進行該反應。在一些實例中,反應期間的溫度為約15℃至約30℃,或約20℃至約25℃,或約室溫。反應時間段為約12小時至約36小時,或約20至約30小時。
通過說明而非限制的方式,圖4描述了制備式VIa化合物和將式VIa化合物轉化成式IIa化合物(通過實例而非限制的方式,其中Z為BSA)的方法的替代實例。參考圖4,使式VII化合物與氨基氧基乙酸(XIX)反應,以形成式XX的肟。在有機溶劑諸如例如醇(例如甲醇或乙醇)中,在用于形成肟的條件下,進行該反應。在一些實例中,反應期間的溫度為約10℃至約30℃或約15℃至約25℃。反應時間段為約1小時至約30小時或約2小時至約24小時。
將式XX的肟與式XXI化合物組合以形成式VIa化合物。在有機溶劑諸如例如烷烴(例如,己烷或戊烷)中,在用于形成酰胺的條件下,進行該反應。在一些實例中,反應期間的溫度為約15℃至約25℃。反應時間段為約10小時至約48小時。
使式VIa化合物與聚(氨基酸)免疫原性載體(通過說明而非限制的方式,式II的Z’為BSA)反應,以得到式IIa化合物。如所示,R1’是式IIa化合物的部分,且R1’’和R1’’’各自是H。然而,與本文所述的原理一致,所得產物可以是化合物的混合物,其中在混合物的一種化合物中,R1’是式IIa化合物的部分,并且在混合物的另一種化合物中,R1’和R1’’兩者都是式IIa化合物的部分,并且在混合物的另一種化合物中,R1’和R1’’’兩者都是式IIa化合物的部分,并且在混合物的另一種化合物中,R1’和R1’’以及R1’’’所有三者都是式IIa化合物的部分。在有機溶劑諸如例如烷烴(例如,己烷或戊烷)中,在用于形成酰胺的條件下,進行該反應。在一些實例中,反應期間的溫度為約15℃至約25℃。反應時間段為約10小時至約48小時。
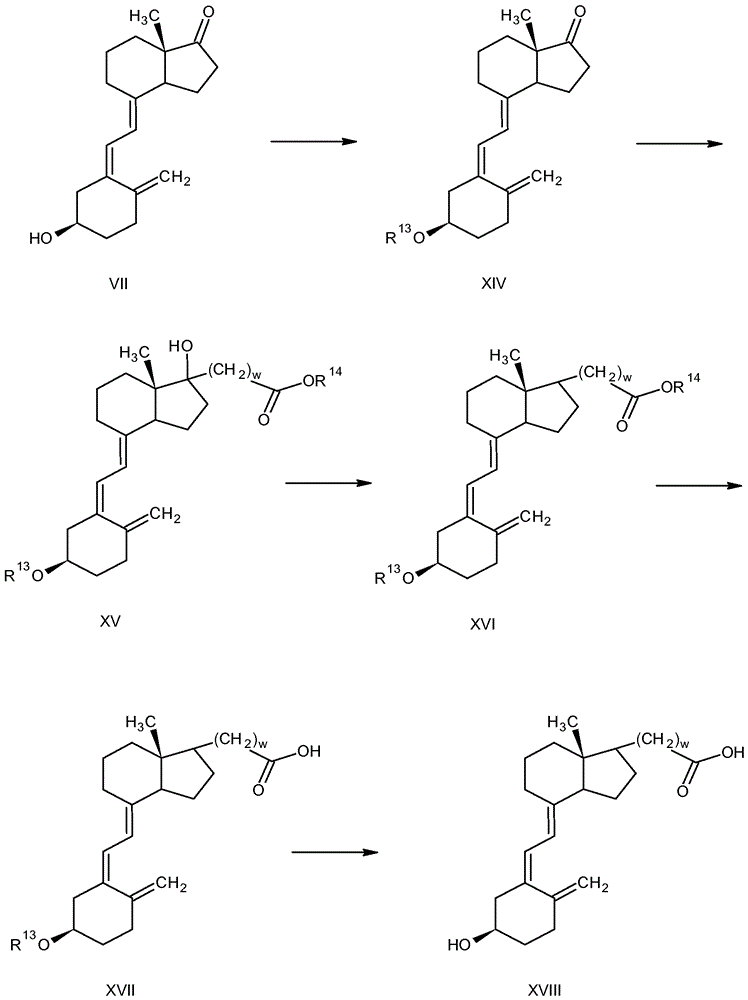
通過說明而非限制的方式,描述了制備根據本文所述的原理的化合物實例的方法的另一個實例,參考圖5。可以采用其它方法以形成與本文所述的原理一致的化合物。式XVIII化合物(Y是式I中的C)的制備闡述于圖5中。參考圖5,處理式VII化合物(例如,如圖3中所討論制備)以保護游離羥基(R13是保護基團),以形成式XIV化合物。反應條件取決于例如保護基團的性質。
在一個實例中,在用于形成甲硅烷基醚的條件下用叔丁基二甲基甲硅烷基氯處理式VII化合物。在極性有機溶劑諸如例如吡啶、二甲基亞砜、醚(例如四氫呋喃、乙醚或1,4-二氧雜環己烷)、乙腈、二氯甲烷或二甲基甲酰胺(DMF)中,進行該反應。在一些實例中,反應期間的溫度為約10℃至約30℃或約15℃至約25℃。反應時間段為約1小時至約30小時或約2小時至約24小時。
通過實例而非限制的方式,保護基團的實例是甲硅烷基(諸如但不限于,例如三甲基甲硅烷基、三甲基甲硅烷基、叔丁基二甲基甲硅烷基、三異丙基甲硅烷基、叔丁基二苯基甲硅烷基)、叔丁氧基羰基(t-Boc)、芴基甲基氧基羰基(Fmoc)、乙酰氨基甲基(Acm)、三苯基甲基(Trt)、芐基氧基羰基、聯苯基異丙基氧基羰基、1-戊基氧基羰基、異冰片基氧基羰基、α-二甲基-3,5-二甲氧基苯基氧基羰基、鄰硝基苯基亞磺酰、2-氰基-1,1-二甲基-乙氧基羰基、溴芐基氧基、氨基甲酰基和甲酰基。
通過例如在鋅存在下與α-鹵代酯反應(Reformatsky反應),從式XIV化合物形成式XV化合物。在該實例中,用Reformatsky試劑諸如例如BrZnCH2COOR14(在所示實例中的Zn和α-溴乙酸乙酯,w = 1)處理式XIV化合物,以得到式XV化合物。在有機溶劑諸如例如醚(例如四氫呋喃或乙醚)或芳族溶劑(例如苯或甲苯)中,進行該反應。在一些實例中,反應期間的溫度為約4℃至約100℃或約10℃至約90℃。反應時間段為約4小時至約24小時。
將式XV化合物的游離羥基還原以形成式XVI化合物。可以通過方法處理式XV化合物以還原羥基,所述方法包括但不限于例如,甲苯磺酸酯形成,隨后用金屬氫化物諸如例如LiAlH4或NaBH4處理;去除羥基以形成烯烴(諸如例如,通過用濃有機酸例如濃硫酸或濃鹽酸處理),隨后在催化劑諸如例如鉑或鈀存在下氫化。反應條件取決于例如,采用的試劑的性質和溶劑的性質中的一者或兩者。
處理所得式XVI化合物以將酯基水解成羧酸基團(脫酯化反應),以得到式XVII化合物。許多方法可用于脫酯化,且包括但不限于例如,皂化或用堿水溶液諸如例如用NaOH或KOH在加熱下處理;或酸水解或用酸水溶液諸如例如無機酸水溶液(諸如例如鹽酸或硫酸)處理。反應條件取決于例如,試劑的性質和酯的性質中的一者或多者。
通過從式XVII化合物去除保護基團R13而形成式XVIII化合物。各種方法可以用于去除保護基團,并且包括但不限于用稀無機酸(諸如例如鹽酸或硫酸)處理;在極性有機溶劑(諸如例如烷醇(例如甲醇或乙醇)、醚(例如乙醚或四氫呋喃)、酮(例如丙酮)、二甲基亞砜、乙腈、二氯甲烷或二甲基甲酰胺(DMF)或上述中的兩種或更多種的組合(其也可以含有水))中,在用于去除保護基的條件下,用有機酸(諸如例如乙酸)處理,以得到式XVIII化合物。反應條件取決于例如,試劑的性質和保護基團的性質中的一者或多者。
通過說明而非限制的方式,圖6描述了制備式VIb化合物和將式VIb化合物轉化成式IIb化合物(通過實例而非限制的方式,其中Z’為KLH)的方法的實例。參考圖6,處理式XVIII化合物以活化羧酸基團諸如但不限于,形成N-羥基琥珀酰亞胺(NHS)酯(式XXII化合物)的反應。在極性有機溶劑諸如例如二甲基亞砜、醚(例如四氫呋喃或乙醚)、乙腈、二氯甲烷或二甲基甲酰胺(DMF)中,例如在用于形成NHS酯的條件下,進行該反應。在一些實例中,反應期間的溫度為約15℃至約25℃。反應時間段為約4小時至約48小時。
將式XXII的NHS酯與式XXI化合物組合以形成式VIb化合物。在有機溶劑諸如例如烷烴(例如,己烷或戊烷)中,例如,在用于形成酰胺的條件下,進行該反應。在一些實例中,反應期間的溫度為約15℃至約25℃。反應時間段為約4小時至約48小時。
使式VIb化合物與聚(氨基酸)免疫原性載體(例如,式II的Z’為KLH)反應,以得到式IIb化合物。如所示,R1’是式IIb化合物的部分,且R1’’和R1’’’各自是H。然而,與本文所述的原理一致,所得產物可以是化合物的混合物,其中在混合物的一種化合物中,R1’是式IIa化合物的部分,并且在混合物的另一種化合物中,R1’和R1’’兩者都是式IIa化合物的部分,并且在混合物的另一種化合物中,R1’和R1’’’兩者都是式IIa化合物的部分,并且在混合物的另一種化合物中,R1’和R1’’以及R1’’’所有三者都是式IIb化合物的部分。在有機溶劑諸如例如烷烴(例如,己烷或戊烷)中,在用于形成酰胺的條件下,進行該反應。在一些實例中,反應期間的溫度為約15℃至約25℃。反應時間段為約4小時至約48小時。
在替代途徑中,可以以與上面對于圖3用于制備式IIa化合物所述的方式類似的方式從式XVIII化合物制備式IIb化合物。
通過說明而非限制的方式,描述了制備根據本文所述的原理的化合物實例的方法的另一個實例,參考圖7。可以采用其它方法以形成與本文所述的原理一致的化合物。式XXVII化合物(Y在式I中為O,且w為0至10或1至10)的制備闡述于圖7中。參考圖7,處理式VII化合物(例如,如圖2中所討論制備)以保護游離羥基(R15是保護基團),以形成式XXIII化合物。反應條件取決于例如保護基團的性質。
在一個實例中,在用于形成甲硅烷基醚的條件下用叔丁基二甲基甲硅烷基氯(通過實例而非限制的方式)處理式VII化合物。在極性有機溶劑諸如例如吡啶、二甲基亞砜、醚(例如四氫呋喃、乙醚或1,4-二氧雜環己烷)、乙腈、二氯甲烷或二甲基甲酰胺(DMF)中,進行該反應。在一些實例中,反應期間的溫度為約15℃至約25℃。反應時間段為約4小時至約48小時。
通過例如將酮基還原成羥基而從式XXIII化合物形成式XXIV化合物。可以通過方法處理式XXIII化合物以還原羥基,所述方法包括但不限于用金屬氫化物諸如例如LiAlH4或NaBH4處理以得到式XXIV化合物。在有機溶劑諸如例如烷醇(例如乙醇)中,進行該反應。在一些實例中,反應期間的溫度為約0℃至約25℃。反應時間段為約0.5小時至約4小時。
通過例如在堿存在下與鹵代酯(諸如,通過實例而非限制的方式)α-鹵代酯反應,從式XXIV化合物形成式XXV化合物。在該實例中,用例如BrCH2COOR16(在所示實例中的α-溴乙酸乙酯,w是1且R16是乙基)處理式XXV化合物,以得到式XXV化合物。通過在堿諸如例如KOH、NaOH、Na2CO3或K2CO3存在下從式XXIV化合物的羥基形成醇鹽離子,并使醇鹽與鹵代酯反應,進行該反應。用于反應的溶劑是水性溶劑,其可以含有1%至40%的極性有機溶劑,諸如如上所述的極性有機溶劑。在一些實例中,反應期間的溫度為例如約50℃至約100℃或約50℃至約90℃。反應時間段為例如約0.5小時至約24小時,或約1至約8小時。
處理所得式XXV化合物以將酯基水解成羧酸基團(脫酯化反應),以得到式XXVI化合物。許多方法可用于脫酯化,且包括但不限于例如,皂化或用堿水溶液諸如例如用NaOH或KOH在加熱下處理;酸水解或用酸水溶液諸如例如無機酸水溶液(諸如例如鹽酸或硫酸)處理。反應條件取決于例如,試劑的性質和酯的性質中的一者或多者。
通過從式XXVI化合物去除保護基團R15而形成式XXVII化合物。各種方法可以用于去除保護基團,并且包括但不限于用稀無機酸(諸如例如鹽酸或硫酸)處理;在極性有機溶劑(諸如例如烷醇(例如甲醇或乙醇)、醚(例如乙醚、四氫呋喃或1,4-二氧雜環己烷)、酮(例如丙酮)、二甲基亞砜、乙腈、二氯甲烷、二甲基甲酰胺(DMF)或上述中的兩種或更多種的組合(其也可以含有水))中,在用于去除保護基的條件下,用有機酸(諸如例如乙酸)處理,以得到式XXVII化合物。反應條件取決于例如,試劑的性質和保護基團的性質中的一者或多者。
通過說明而非限制的方式,圖8描述了制備式VIc化合物和將式VIc化合物轉化成式IIc化合物(通過實例而非限制的方式,其中Z’為酶G6PDH)的方法的實例。參考圖8,處理式XXVII化合物以活化羧酸基團諸如但不限于,形成N-羥基琥珀酰亞胺(NHS)酯(式XXVIII化合物)的反應。在極性有機溶劑諸如例如二甲基亞砜、醚(例如四氫呋喃、乙醚或1,4-二氧雜環己烷)、乙腈、二氯甲烷或二甲基甲酰胺(DMF)中,例如,在用于形成NHS酯的條件下,進行該反應。在一些實例中,反應期間的溫度為約15℃至約25℃。反應時間段為約1小時至約24小時。
將式XXVIII的NHS酯與式XXI化合物組合以形成式VIc化合物。在有機溶劑諸如例如烷烴(例如,己烷或戊烷)中,例如,在用于形成酰胺的條件下,進行該反應。在一些實例中,反應期間的溫度為約15℃至約25℃。反應時間段為約1小時至約24小時。
使式VIc化合物與酶G6PDH(例如式II的Z’為G6PDH)反應,以得到式IIc化合物。如所示,R1’是式IIc化合物的部分,且R1’’和R1’’’各自是H。然而,與本文所述的原理一致,所得產物可以是化合物的混合物,其中在混合物的一種化合物中,R1’是式IIa化合物的部分,并且在混合物的另一種化合物中,R1’和R1’’兩者都是式IIa化合物的部分,并且在混合物的另一種化合物中,R1’和R1’’’兩者都是式IIa化合物的部分,并且在混合物的另一種化合物中,R1’和R1’’以及R1’’’所有三者都是式IIc化合物的部分。在有機溶劑諸如例如烷烴(例如,己烷或戊烷)中,在用于形成酰胺的條件下,進行該反應。在一些實例中,反應期間的溫度為約15℃至約25℃。反應時間段為約1小時至約24小時。
在替代途徑中,可以以與上面對于圖3用于制備式IIa化合物所述的方式類似的方式從式XXVII化合物制備式IIc化合物。
根據本文所述的原理的其它化合物可以以與上述的方式類似的方式制備。
結合配偶體的制備
可以使用根據本文所述的原理的化合物的實例(其中Z是聚(氨基酸)免疫原性載體或非聚(氨基酸)免疫原性載體)來制備維生素D的結合配偶體,諸如例如,例如維生素D的適體或維生素D的抗體,其包括但不限于對維生素D3特異性的抗體,對維生素D2特異性的抗體,對25-羥基維生素D3特異性的抗體,對25-羥基維生素D2特異性的抗體,對3-差向-25-羥基維生素D3特異性的抗體和對3-差向-25-羥基維生素D2特異性的抗體。特別感興趣的是對3-差向-25-羥基維生素D3特異性的抗體,對3-差向-25-羥基維生素D2特異性的抗體和對其它維生素D化合物的差向異構體特異性的抗體(“差向異構維生素D的抗體”),其可用于3-差向-25-羥基維生素D3和3-差向-25-羥基維生素D2的測定中,或其可用于非差向異構維生素D的測定中以減少或消除來自可以存在于待測試維生素D的存在的樣品中的維生素D的差向異構形式諸如例如3-差向-25-羥基維生素D3和3-差向-25-羥基維生素D2的干擾。
抗體可以是單克隆抗體或多克隆抗體,且可以包括完整免疫球蛋白或其片段,所述免疫球蛋白包括,但不限于,各種類別和同種型諸如,例如IgA、IgD、IgE、IgG和IgM。其片段可以包括Fab、Fv和F(ab')2、Fab'等。另外,適當時,可以使用免疫球蛋白或其片段的聚集物、聚合物和綴合物,只要維持對于特定分子的結合親和力。
根據本文所述的原理的抗體可以通過以下技術制備,包括但不限于例如免疫宿主并收集血清(多克隆),制備連續雜交細胞系并收集分泌的蛋白(單克隆),或克隆和表達至少編碼特異性結合天然抗體所需的氨基酸序列的核苷酸序列或其誘變版本。
可以通過技術諸如制備連續雜交細胞系并收集分泌的蛋白(體細胞雜交技術)來制備單克隆抗體。可以根據K?hler和Milstein, Nature265:495-497, 1975的標準技術來產生單克隆抗體。單克隆抗體技術的綜述見于Lymphocyte Hybridomas,編輯Melchers 等人,Springer-Verlag (New York 1978),Nature 266: 495 (1977),Science 208: 692 (1980)和Methods of Enzymology 73 (Part B): 3-46 (1981)。
在用于制備抗體的另一種方法中,可以從染色體DNA切出編碼抗體結合位點的序列,并插入克隆載體,其可以在細菌中表達,以產生具有相應的抗體結合位點的重組蛋白。該方法涉及克隆和表達至少編碼特異性結合天然抗體所需的氨基酸序列的核苷酸序列或其誘變版本。
在用于生產單克隆抗體的一種方法中,第一步驟包括用例如免疫原免疫產生抗體的動物,諸如小鼠、大鼠、山羊、綿羊或牛,所述免疫原包含式I化合物,其中Z為免疫原性載體。免疫可在使用或不使用佐劑下進行,所述佐劑諸如完全弗氏佐劑或其它佐劑,諸如單磷酰脂質A和合成的海藻糖二棒桿菌分枝菌酸酯(trehalose dicorynomycolate)佐劑。下一步驟包括將脾細胞與產生抗體的動物分離,并諸如通過使用聚乙二醇或其它技術使所述產生抗體的脾細胞與適當的融合配偶體,通常是骨髓瘤細胞融合。通常,所使用的骨髓瘤細胞是通常在次黃嘌呤-胸苷(HT)培養基中生長、但不能在次黃嘌呤-氨基喋呤-胸苷(HAT)培養基中生長、用于選擇融合細胞的那些。下一步驟包括選擇融合細胞,通常通過在HAT培養基中選擇。下一步驟包括使用免疫測定諸如例如酶聯免疫吸附測定法(ELISA)或其它適于篩選的免疫測定法來篩選用于產生適當的抗體的克隆雜合體。
可以通過篩選方法來選擇具有必需特異性的抗體(根據本文所述的原理由免疫原制備),所述篩選方法,通過說明而非限制的方式,包括ELISA、斑點印跡、Western分析和表面等離子體共振。以該方式,獲得抗體,其在特定測定中結合目標維生素D分析物并且不在任何可檢測程度上結合非目標維生素D分子。在根據本文所述的原理的一些實例中,結合目標維生素D分析物的抗體對于目標維生素D分析物具有以下結合親和力:例如,約107至約1014升/摩爾,或約107至約1011升/摩爾,或約107至約1012升/摩爾,或約108至約1014升/摩爾,或約108至約1011升/摩爾,或約108至約1012升/摩爾。短語“任何可檢測的程度”意指特異性結合目標維生素D分析物(例如,3-差向-25-羥基維生素D)的抗體對于非目標維生素D分子(例如,非-差向-維生素D化合物)具有以下結合親和力:例如,小于約104升/摩爾,或小于約103升/摩爾,或小于約102升/摩爾,或小于約10升/摩爾。
在根據本文所述的原理的一個實例中,從上述式I化合物(其中Z是免疫原性載體)制備的免疫原用于制備對3-差向-25-羥基維生素D3特異性的抗體,其中所述抗體不在任何可檢測的程度上與25-羥基維生素D3或維生素D的其它變體(包括例如非-差向-維生素D化合物諸如例如25-羥基維生素D;鈣二醇;1,25-二羥基維生素D3;1,25-二羥基維生素D4;1,25-二羥基維生素D5;和1,25-二羥基維生素D6)結合。
在根據本文所述的原理的另一個實例中,從上述式I化合物(其中Z是免疫原性載體)制備的免疫原用于制備對3-差向-25-羥基維生素D2特異性的抗體,其中所述抗體不在任何可檢測的程度上與25-羥基維生素D2或維生素D的其它變體(包括例如非-差向-維生素D化合物諸如例如25-羥基維生素D;鈣二醇;1,25-二羥基維生素D3;1,25-二羥基維生素D4;1,25-二羥基維生素D5;和1,25-二羥基維生素D6)結合。
通過說明而非限制的方式,在一個實例中,采用免疫原,其中式I化合物中的Z是BSA。該免疫原用于腹膜內免疫小鼠(例如,BALB/c小鼠,Swiss Webster小鼠或AJ小鼠品系)。使用3-差向-25-羥基維生素D3和卵白蛋白的綴合物(卵白蛋白綴合物)測試來自這些小鼠的血清樣品的抗-3-差向-25-羥基維生素D3抗體。采用微量滴定板ELISA,并檢測所述抗體與卵白蛋白綴合物、隨后與3-差向-25-羥基維生素D3的結合。在融合前三天加強具有最高滴度的小鼠。在融合當天,從這些小鼠收獲脾細胞,并使用PEG輔助融合方案與骨髓瘤細胞系P3X63Ag8.653融合。約十天之后,使用板ELISA篩選雜交瘤上清液的抗-3-差向-25-羥基維生素D3抗體。將陽性克隆進一步擴增,亞克隆,并使用蛋白A瓊脂糖柱純化上清液。使用ELISA測試純化的抗體樣品與卵白蛋白綴合物的結合以及與游離3-差向-25-羥基維生素D3的結合。
通過說明而非限制的方式,對如上所述制備的對3-差向-25-羥基維生素D3特異性或對3-差向-25-羥基維生素D2特異性的抗體的具體實例包括例如抗體4G8和抗體8F10。
在一些實例中,根據本文所述的原理的抗體可用于純化維生素D化合物。例如,抗體諸如上述那些可以結合支持物,且所述支持物可用于純化維生素D化合物。在一個實例中,3-差向-25-羥基維生素D3的抗體可以結合親和純化色譜基質諸如,例如柱,并且維生素D制備物可以與色譜基質接觸,其中基質上的抗體結合來自維生素D制備物的3-差向-25-羥基維生素D3,而從基質洗脫其它維生素D化合物。
維生素D的測定法的一般描述
根據本文所述的原理的一些實例涉及測定懷疑含有維生素D分析物的樣品中的維生素D分析物的存在和量中的一者或兩者的方法,并且可以在本文中被稱為“維生素D的測定法”。
短語“維生素D”是指25-羥基維生素D;鈣二醇;1,25-二羥基維生素D2;1,25-二羥基維生素D3;1,25-二羥基維生素D4;1,25-二羥基維生素D5;和1,25-二羥基維生素D6中的一種或多種;包括所有上述的差向異構形式和代謝物。因此,維生素D分析物包括如上所定義的維生素D和維生素D的差向異構體。根據本文所述的原理的一些實例涉及測定懷疑含有維生素D的差向異構形式(例如3-差向-25-羥基維生素D3或3-差向-25-羥基維生素D2)的樣品中的維生素D的差向異構形式的存在和量中的一者或兩者的方法,并且可以在本文中被稱為“維生素D的差向異構體的測定法”。
通過說明而非限制的方式,在用于測定維生素D分析物的方法的一個實例中,提供了組合,其包含樣品,根據本文所述的原理產生的維生素D的差向異構體的抗體和包含維生素D類似物和信號產生系統的成員的綴合物。
如上所提及,“在介質中以組合”提供樣品和試劑。盡管添加至介質以形成組合的順序可以變化,但對于本文所述的測定形式的一些實施方案,將存在特定優先性。通過說明而非限制的方式,在一個實例中,添加順序是同時添加所有材料,并測定測定介質對信號具有的影響,如在均質測定法中。通過說明而非限制的方式,在另一個實例中,可以依次組合各試劑,或試劑組。在一些實施方案中,在如上所討論的各添加之后,可以涉及孵育步驟。在非均質測定法中,在一個或多個孵育步驟之后還可以采用分離和洗滌步驟。
短語“維生素D類似物”是指與維生素D分析物競爭受體的化合物,諸如維生素D的抗體或維生素D的差向異構體的抗體。維生素D類似物可以是修飾的維生素D,其中所述修飾提供方式將維生素D接合至另一分子諸如,但不限于,例如支持物、標記、小分子或小分子的結合配偶體。維生素D類似物可以直接或通過連接基團間接地連接至另一分子。維生素D類似物可以是例如與維生素D結構相關的分子或通過連接基團與另一分子綴合的維生素D。在根據本文所述的原理的一些實例中,維生素D類似物可以是式I化合物,其中Z是聚(氨基酸)標記部分或非聚(氨基酸)標記部分,或其中Z是免疫原性載體,其中此類式I化合物與維生素D分析物競爭結合維生素D抗體。
待分析的樣品是懷疑含有維生素D分析物的樣品。所述樣品可以是生物樣品或非生物樣品。生物樣品可以來自哺乳動物受試者或非哺乳動物受試者。哺乳動物受試者可以是,例如,人或其它動物物種。生物樣品包括生物體液,諸如全血、血清、血漿、痰、淋巴液、精液、陰道粘液、排泄物、尿、脊髓液、唾液、糞便、腦脊液、淚液、粘液等;生物組織,諸如毛發、皮膚、來自器官或其它機體部分的切片或切除組織;等等。在許多情況下,所述樣品是全血、血漿或血清。非生物樣品包括但不限于,例如廢物流,其也可以使用根據本文所述的原理的化合物進行分析。
可以在任何適宜的介質中制備樣品,所述介質可以是例如,測定介質,其在下文中更充分地討論。在一些情況下,可以對樣品施加預處理,諸如以裂解血細胞。在一些實例中,此類預處理在隨后不干擾測定的介質中進行。
介質中的組合經受使維生素D分析物和維生素D類似物與維生素D分析物的抗體結合以形成復合物的條件。測量復合物的量,其中復合物的量與樣品中維生素D分析物的存在和量中的一者或兩者相關。
維生素D分析物的測定可以在不分離(均質)或分離(非均質)任何測定組分或產物的情況下進行。非均質測定通常涉及一個或多個分離步驟,并且可以是競爭性或非競爭性的。免疫測定可以涉及標記或未標記的試劑。涉及未標記的試劑的免疫測定通常包括形成相對大復合物,所述相對大復合物涉及由根據本文所述的原理的免疫原性綴合物制備的一種或多種抗體。對于抗體復合物的檢測,此類測定包括例如免疫沉淀素和凝集法,以及相應的光散射技術例如,例如濁度測定法(nephelometry)和比濁法(turbidimetry)。標記免疫測定包括但不限于例如化學發光免疫測定、酶免疫測定、熒光偏振免疫測定、放射免疫測定、抑制測定、誘導發光測定、以及熒光氧通道測定。
一種通常的免疫測定組包括使用有限濃度的根據本文所述的原理的化合物的免疫測定。另一組免疫測定涉及使用過量的一種或多種主要試劑,諸如例如過量的根據本文所述的原理的化合物。另一組免疫測定包括無分離均質測定,其中在標記的維生素D類似物與根據本文所述的原理產生的抗體結合、因此與樣品中可存在的維生素D分析物競爭后,來自標記的維生素D類似物的信號被調節。
如上所提及,所述測定可以在不分離(均質)或分離(非均質)任何測定組分或產物的情況下進行。均質免疫測定由以下例舉:Rubenstein等人,美國專利號3,817,837,第3欄,第6行至第6欄,第64行中公開的EMIT?測定(Siemens Healthcare Diagnostics Inc.,Deerfield,IL);免疫熒光法,諸如Ullman等人,美國專利號3,996,345,第17欄,第59行至第23欄,第25行中公開的那些;酶通道免疫測定(“ECIA”),諸如Maggio等人,美國專利號4,233,402,第6欄,第25行至第9欄,第63行中公開的那些;熒光偏振免疫測定(“FPIA”),如例如尤其是美國專利號5,354,693中公開的那些;和酶免疫測定,諸如酶聯免疫吸附測定(“ELISA”)。非均質測定的示例為放射免疫測定,其公開于Yalow等人,J. Clin. Invest. 39:1157 (1960)中。上述公開內容的相關部分全部通過引用并入本文。
其它酶免疫測定是例如由Ngo和Lenhoff,FEBS Lett. (1980) 116:285-288討論的酶調節介導的免疫測定(“EMMIA”);由Oellerich,J. Clin. Chem. Clin. Biochem. (1984) 22:895-904公開的底物標記的熒光免疫測定(“SLFIA”);由Khanna等人,Clin. Chem. Acta (1989) 185:231-240公開的組合酶供體免疫測定(“CEDIA”);均質顆粒標記的免疫測定,諸如顆粒增強的比濁抑制免疫測定(“PETINIA”),顆粒增強的比濁免疫測定(“PETIA”);親和力二氧化鉻介導免疫測定(“ACMIA”)測定形式,其描述于美國專利號7,186,518、5,147,529、5,128,103、5,158,871、4,661,408、5,151,348、5,302,532、5,422,284、5,447,870和5,434,051中,其公開內容以其整體并入本文。
其它測定包括吖啶酯標記測定,諸如美國專利號6,355,803;6,673,560;7,097,995和7,319,041中討論的那些,其相關公開內容通過引用并入本文。吖啶酯標記測定的一個具體實例為使用順磁性顆粒作為固相的吖啶酯標記免疫測定(“ADVIA”免疫測定)。其它測定包括溶膠顆粒免疫測定(“SPIA”),分散染料免疫測定(“DIA”);金屬免疫測定(“MIA”);酶膜免疫測定(“EMIA”);和發光免疫測定(luminoimmunoassay)(“LIA”)。其它測定類型包括免疫傳感器測定,其涉及在結合維生素D分析物后,監測存在的綴合物的光學、聲學和電學特性的變化。此類測定包括例如光學免疫傳感器測定、聲學免疫傳感器測定、半導體免疫傳感器測定、電化學換能器免疫傳感器測定、電位型免疫傳感器測定、電流型電極測定。
非均質測定通常涉及一個或多個分離步驟,并且可以是競爭性或非競爭性的。各種競爭性和非競爭性非均質測定形式公開于Davalian等人,美國專利號5,089,390,第14欄,第25行至第15欄,第9行,其通過引用并入本文。在競爭性非均質測定的一個實例中,使具有與之結合的維生素D分析物的抗體的支持物與介質接觸,所述介質含有懷疑含有維生素D分析物的樣品和標記的根據本文所述的原理的化合物。樣品中的維生素D分析物與攜帶可檢測標記的維生素D類似物競爭結合維生素D分析物的抗體。將支持物和介質分離之后,支持物或介質的標記活性通過常規技術測定,并且與樣品中的維生素D分析物的量相關。在上述競爭性非均質測定的一個變型中,所述支持物包含維生素D類似物作為標記的試劑,并且維生素D抗體包含標記。
在一些實例中,待分析的樣品在測定介質中與維生素D分析物的抗體和標記的維生素D類似物組合。檢查介質中包含標記的維生素D類似物和維生素D分析物的抗體的復合物的存在和量中的一者或兩者,其中此類復合物的存在和/或量指示樣品中維生素D分析物的存在和/或量。
在根據本文所述的原理的一些實例中,待分析的樣品經受預處理,以從內源性結合物質諸如例如結合維生素D的血漿或血清蛋白釋放維生素D分析物。可以例如通過添加消化劑或釋放劑或依次使用的消化劑和釋放劑的組合,從內源性結合物質釋放維生素D分析物。所述消化劑為分解內源性結合物質、使得它們不再可以結合維生素D的試劑。此類試劑包括但不限于蛋白酶K,以及蛋白酶K和蛋白變性劑諸如,例如洗滌劑(例如十二烷基硫酸鈉)。通過說明而非限制的方式,用于從內源性結合物質釋放維生素D的釋放劑包括酸性變性劑諸如,例如水楊酸、華法林、磺酸類、甲苯磺酸類、萘磺酸、苯胺萘磺酸類(ANS)(包括例如1-苯胺基萘-8-磺酸(1,8-ANS)和8-苯胺基萘-1-磺酸(8-ANS))、水楊酸類和上述的衍生物。
用于進行消化或釋放作用的條件諸如,例如持續時間、溫度、pH和介質中釋放劑的濃度取決于例如內源性結合物質的性質,樣品的性質,以及釋放劑的性質。通常,所述條件足以獲得所需的效果或功能。在根據本文所述的原理的一些實例中,釋放劑的有效濃度為約0.01至約20 mg/mL,或約0.01至約10 mg/mL,或約0.01至約5 mg/mL,或約0.1至約20 mg/mL,或約0.1至約10 mg/mL,或約0.1至約5 mg/mL,或約0.1至約1 mg/mL。從內源性結合物質釋放維生素D分析物的樣品的預處理可以在進行測定之前作為單獨的步驟,或在測定中作為第一個步驟進行。在任一情況下,可能需要一種或多種試劑來停止消化劑和/或釋放劑的作用。
進行測定的條件包括在通常提供最佳測定靈敏度的適度pH下在水性緩沖介質中進行測定。水性介質可以僅為水,或可以包括0.1至約40體積%的助溶劑。介質的pH將在例如約4至約11的范圍內,或約5至約10的范圍內,或約6.5至約9.5的范圍內。pH將通常為任何特異性結合對的結合成員的最佳結合,該測定的其它試劑諸如信號產生系統的成員等等的pH最佳值之間的折中。各種緩沖劑可用來實現所需pH和在測定期間保持pH。通過說明而非限制的方式,說明性緩沖劑包括例如硼酸鹽、磷酸鹽、碳酸鹽、TRIS、巴比妥、PIPES、HEPES、MES、ACES、MOPS和BICINE。所采用的具體緩沖劑不是關鍵的,但在個別測定中,可以優選一種或另一種緩沖劑。
測定方法中可以使用各種輔助材料。例如,除緩沖劑之外,介質可以包含采用的介質和試劑的穩定劑。在一些實施方案中,除這些添加劑之外,可以包括蛋白諸如,例如白蛋白;有機溶劑諸如,例如甲酰胺;季銨鹽;聚陰離子諸如,例如硫酸葡聚糖;結合增強劑,例如聚亞烷基二醇;多糖諸如,例如葡聚糖或海藻糖。介質也可以包含用于防止形成血塊的試劑。此類試劑是本領域中眾所周知的,且包括但不限于例如EDTA、EGTA、檸檬酸鹽、肝素。介質也可以包含一種或多種防腐劑,諸如但不限于例如疊氮化鈉、硫酸新霉素、PROCLIN? 300、鏈霉素。介質可以另外包含一種或多種表面活性劑。如果采用,任何上述材料以足以獲得所需效果或功能的濃度或量存在。
可以以一個或多個時間間隔向介質施加一個或多個孵育時段,所述時間間隔包括添加測定中采用的各種試劑(包括上述那些)之間的任何時間間隔。介質通常在足以發生各種試劑組分的結合以及樣品中的維生素D的結合的溫度和時間下孵育。適度的溫度通常用于實施該方法,且測量時段期間通常為恒溫,優選為室溫。在一些實例中,孵育溫度范圍為例如約5℃至約99℃,或約15℃至約70℃,或約20℃至約45℃。在一些實例中,孵育的時間段為例如約0.2秒至約24小時,或約1秒至約6小時,或約2秒至約1小時,或約1分鐘至約15分鐘。時間段取決于介質的溫度和各種試劑結合的速率,這通過締合速率常數、濃度、結合常數和解離速率常數測定。
在用于測定懷疑含有維生素D分析物的樣品中的維生素D分析物的方法的實例中,在介質中提供組合,其中該組合包括樣品、釋放劑(如果樣品未經預處理以從內源性結合物質釋放維生素D分析物),維生素D的抗體,和標記的維生素D類似物,其中該標記為聚(氨基酸)標記或非聚(氨基酸)標記。檢查該介質的包含維生素D和維生素D的抗體的復合物或包含標記的化合物和維生素D的抗體的復合物中的一者或兩者的存在和/或量。復合物中的一者或兩者的存在和/或量指示樣品中維生素D分析物的存在和/或量。
一些已知的測定法利用信號產生系統(sps),其采用第一和第二sps成員。名稱“第一”和“第二”是完全任意的,且并不意在暗示sps成員間的任何順序或排序,或在本方法中添加sps成員的任何順序。sps成員可以是關聯的,因為sps的一個成員的活化產生產物(諸如,例如光或活化產物),其導致sps的另一個成員的活化。
在測定法的一些實施方案中,sps成員包含敏化劑諸如,例如光敏劑,和化學發光組合物,其中敏化劑的活化產生使化學發光組合物活化的產物。第二sps成員通常產生可檢測信號,所述可檢測信號與結合和/或未結合的sps成員的量(即與所檢測的維生素D分析物或與根據本文所述的原理的化合物結合或未結合的sps成員的量)相關。在根據本文所述的原理的一些實例中,敏化劑試劑或化學發光試劑之一包含本化合物試劑。
在一個具體實例中,可以采用誘導發光免疫測定法。誘導發光免疫測定法在美國專利號5,340,716 (Ullman)(其公開內容通過引用并入本文)中提及。在一種方法中,該測定法使用具有與之締合的光敏劑的顆粒,其中維生素D類似物與該顆粒結合(顆粒-化合物試劑)。化學發光試劑包含維生素D分析物的抗體。維生素D分析物與顆粒-化合物試劑競爭與維生素D的抗體結合。如果存在維生素D分析物,則較少數目的顆粒-化合物試劑分子與化學發光試劑緊密接近。因此,測定信號將減小。當兩種標記緊密接近時,光敏劑產生單線態氧,并活化化學發光試劑。經活化的化學發光試劑隨后產生光。所產生的光的量與所形成的復合物的量相關,其進而與樣品中存在的維生素D分析物的量相關。
在誘導發光免疫測定法的另一個具體實例中,該測定法使用具有與之締合的化學發光化合物的顆粒,其中維生素D類似物與顆粒結合(顆粒-化合物試劑)。光敏劑試劑包含維生素D的抗體。維生素D分析物與顆粒-化合物試劑競爭與維生素D的抗體結合。如果存在維生素D分析物,較少數目的顆粒-化合物試劑分子與光敏劑試劑緊密接近。因此,測定信號將減小。當兩種標記緊密接近時,光敏劑產生單線態氧,并活化顆粒-化合物試劑的化學發光化合物。經活化的化學發光化合物隨后產生光。所產生的光的量與所形成的復合物的量相關,其進而與樣品中存在的維生素D分析物的量相關。
在誘導發光測定法的另一個具體實例中,采用光敏劑顆粒,其與小分子的結合配偶體諸如,例如抗生物素蛋白或鏈菌抗生物素蛋白(其為生物素的結合配偶體)綴合。也采用包含生物素的維生素D類似物(化合物-生物素試劑)。包含維生素D分析物的抗體的化學發光試劑用作檢測系統的一部分。將反應介質孵育以允許光敏劑顆粒的抗生物素蛋白或鏈菌抗生物素蛋白借助于抗生物素蛋白和生物素之間的結合而與化合物-生物素試劑結合,并且還允許作為化學發光試劑的一部分的維生素D分析物的抗體與維生素D分析物或與光敏劑顆粒現在連接的維生素D類似物結合。然后,用光輻照該介質以激發光敏劑,其在其激發態能夠使氧活化為單線態。因為由于存在維生素D分析物,現在較少的化學發光試劑與光敏劑緊密接近,所以單線態氧對化學發光試劑的活化較少,且發光較少。然后檢查介質的發光或發射光的存在和/或量,其存在與維生素D分析物的存在和/或量相關,其中在維生素D分析物存在下,觀察到信號減小。
在誘導發光測定法的另一個具體實例中,采用光敏劑顆粒,其與小分子的結合配偶體諸如,例如抗生物素蛋白或鏈菌抗生物素蛋白(其為生物素的結合配偶體)綴合。綴合試劑包含與生物素綴合的維生素D分析物的抗體。采用維生素D類似物,其中該化合物與化學發光顆粒連接(化學發光-化合物試劑)。將反應介質孵育以允許光敏劑顆粒的抗生物素蛋白或鏈菌抗生物素蛋白借助于抗生物素蛋白和生物素之間的結合而與抗體-生物素試劑結合,并且還允許維生素D分析物的抗體與樣品中如果存在的維生素D分析物和與作為化學發光-化合物試劑的一部分的維生素D類似物結合。然后,用光輻照該介質來激發光敏劑,其在其激發態能夠使氧活化為單線態。因為由于存在維生素D分析物,現在較少的化學發光-化合物試劑與光敏劑緊密接近,所以單線態氧對化學發光試劑的活化較少,且發光較少。然后檢查介質的發光或發射光的存在和/或量,其存在與維生素D分析物的存在和/或量相關,其中在維生素D分析物存在下,觀察到信號減小。
通過說明而非限制的方式,用于檢測維生素D分析物的測定形式的另一個實例為ACMIA測定形式。對于ACMIA測定形式,涂覆有維生素D類似物的二氧化鉻顆粒(二氧化鉻顆粒試劑)用作第一組分。第二組分為維生素D分析物的抗體。與報告酶(例如β-半乳糖苷酶)交聯以形成抗體-酶綴合物的該抗體,以過量(即大于結合樣品中可能存在的所有維生素D分析物所需的量)添加至反應容器中。預先經受用釋放劑處理的樣品用維生素D分析物的抗體來處理,所述抗體與樣品中的維生素D分析物結合。抗體-酶綴合物與樣品在介質中混合,以允許維生素D分析物與抗體結合。接下來,添加二氧化鉻顆粒試劑以結合盡(bind up)任何過量的抗體-酶綴合物。然后,施加磁鐵,其將所有二氧化鉻顆粒和過量抗體-酶從懸浮液中拉出,并將上清液轉移至最終的反應容器。將報告酶的底物添加至最終的反應容器中,并且將酶活性分光光度測量為吸光度隨時間的變化。該信號的量與樣品中維生素D分析物的量相關。
根據本文所述的原理的維生素D測定法的另一個實例為使用順磁性顆粒作為固相的吖啶酯標記免疫測定法(ADVIA免疫測定法)。用于維生素D測定法的該實例的檢測系統包括作為小分子綴合物或捕獲綴合物的小分子-標記的維生素D類似物(捕獲部分),作為固相(SP)的小分子的結合配偶體涂覆的順磁性膠乳顆粒,和吖啶酯標記的維生素D分析物的抗體(檢測抗體)。小分子可以是例如生物素或熒光素,且各個結合配偶體可以是鏈菌抗生物素蛋白或熒光素抗體。維生素D類似物可以與小分子直接連接,或者通過連接基團諸如,例如蛋白,例如牛血清白蛋白(BSA)與小分子連接。患者樣品中的維生素D分析物與捕獲部分的維生素D類似物競爭與吖啶酯標記的檢測抗維生素D抗體結合。懷疑含有維生素D的樣品用1,8-ANS進行預處理。該測定法可以根據隨之提供的制造商說明書,在Centaur?、Centaur? XP或Centaur? CP設備(Siemens Healthcare Diagnostics Inc.,Newark DE)上進行。
根據本文所述的原理的維生素D分析物的測定法的另一個實例是使用順磁性顆粒作為固相的吖啶酯標記免疫測定法(ADVIA免疫測定法)。用于維生素D測定法的該實例的檢測系統包括作為生物素綴合物或捕獲綴合物的小分子-標記的維生素D分析物的抗體(捕獲抗體),作為固相(SP)的鏈菌抗生物素蛋白涂覆的順磁性膠乳顆粒,和吖啶酯標記的維生素D類似物(檢測半抗原)。吖啶酯標記可以與維生素D類似物直接結合以形成檢測半抗原,或者可以使用連接基團,包括例如蛋白諸如,例如BSA。患者樣品中的維生素D分析物與吖啶酯標記的檢測半抗原競爭與抗維生素D抗體結合。懷疑含有維生素D的樣品用1,8-ANS進行預處理。該測定法可以根據隨之提供的制造商說明書,在Centaur?、Centaur? XP或Centaur?CP設備(Siemens Healthcare Diagnostics Inc.,Newark DE)上進行。在上述吖啶酯測定法的變型中,小分子可以是例如生物素或熒光素。
可以測定的樣品中維生素D分析物的濃度通常為例如約10-5至約10-17 M,或約10-6至約10-14 M。考量諸如測定法是定性、半定量還是定量的(相對于樣品中存在的維生素D分析物的量),具體檢測技術,和維生素D分析物的預期濃度通常決定各種試劑的濃度。
測定介質中各種試劑的濃度將通常由維生素D分析物的目標濃度范圍、測定的性質等決定。然而,試劑各自的最終濃度通常憑經驗確定,以優化測定法在目標范圍的靈敏度。也就是說,顯著的維生素D分析物的濃度變化應當提供可精確測量的信號差異。考量諸如信號產生系統的性質和分析物的性質通常決定各種試劑的濃度。
采用根據本文所述的原理的試劑的維生素D的差向異構體的測定法的實例
如上所提及,根據本文所述的原理的一個具體實例涉及測定懷疑含有維生素D的差向異構體的樣品中的維生素D的差向異構體的存在和量中的一者或兩者的方法。可以采用使用針對免疫原產生的抗體的任何上述測定形式,所述免疫原是式I化合物,其中Z是免疫原性載體。在一些實例中,所述免疫原是式IIa化合物(參見圖3)。在一些實例中,所述免疫原是式IIb化合物(參見圖5)。在一些實例中,采用的抗體是抗體4G8.2或抗體8F10.2。可以在任何上述測定形式中采用從與本文所述的原理一致的其它免疫原產生的抗體。
維生素D的差向異構體的測定法的一個實例是用于檢測懷疑含有3-差向-25-羥基維生素D3的樣品中的3-差向-25-羥基維生素D3的誘導發光測定法。用釋放劑處理樣品以從內源性結合部分釋放3-差向-25-羥基維生素D3。然后,在反應介質中組合樣品與包含與生物素綴合的抗體4G8.2(其為3-差向-25-羥基維生素D3的抗體)的試劑(抗體-生物素試劑),將所述反應介質孵育以允許抗體-生物素試劑和3-差向-25-羥基維生素D3分析物之間的結合。然后,添加化學發光試劑,其中所述試劑包含作為附接至化學發光顆粒的維生素D類似物的式IIa化合物。所述化學發光試劑結合過量抗體-生物素試劑,即,不結合樣品中的3-差向-25-羥基維生素D3分析物的抗體-生物素試劑。然后,添加與鏈霉抗生物素蛋白綴合的光敏劑顆粒試劑。將所述反應介質孵育以允許光敏劑顆粒的鏈霉抗生物素蛋白憑借鏈霉抗生物素蛋白和生物素之間的結合而結合抗體-生物素試劑。然后,用光照射介質來激發光敏劑,所述光敏劑在其激發態能夠將氧活化為單線態。因為由于存在3-差向-25-羥基維生素D3分析物而較少化學發光試劑現在緊密接近于光敏劑,所以單線態氧較少活化化學發光試劑且較少發光。 檢查介質中發光或發射光的存在和/或量,其存在與3-差向-25-羥基維生素D3分析物的存在和/或量相關,其中在3-差向-25-羥基維生素D3分析物存在下觀察到信號減少。
采用根據本文所述的原理的抗體作為阻斷抗體的維生素D分析物的測定法的實例
根據本文所述的原理的抗體可用于盡可能減少或消除維生素D分析物的非差向異構形式的測定中的3-差向異構體交叉反應性。采用針對作為式I化合物(其中Z是免疫原性載體)的免疫原制備的抗體作為阻斷劑,可以實質上避免由3-差向異構體維生素D與維生素D分析物的抗體的交叉反應性引起的總非差向異構維生素D分析物的過度估計。
在非差向異構維生素D分析物的測定法的一個實例中,該測定法采用包含烯屬染料的化學發光珠粒(chemibead)試劑作為化學發光試劑和25-羥基維生素D3作為維生素D類似物。將懷疑含有非差向異構維生素D分析物的樣品在測定介質中與生物素化的非差向異構維生素D分析物的抗體和作為抗體8F10的第二抗體組合,然后與化學發光珠粒試劑組合。化學發光珠粒結合未被來自樣品的非差向異構維生素D分析物占據的單克隆抗體結合位點的級分。抗體8F10結合樣品中存在且通過與生物素化抗體的交叉反應干擾測定的3-差向-25-羥基維生素D3。隨后,將包含光敏劑(敏化珠粒)的鏈霉抗生物素蛋白偶聯的敏化劑珠粒添加至反應混合物。這導致形成化學發光珠粒/敏化珠粒對,其濃度與樣品中的非差向異構維生素D分析物的濃度成反比。在680 nm下照射后,敏化劑珠粒產生單線態氧,其擴散至化學發光珠粒中,所述化學發光珠粒與敏化珠粒配對,與化學發光中的烯屬染料反應,并在大約612 nm處觸發化學發光信號,其與非差向異構維生素D分析物濃度成反比。
采用標記的根據本文所述的原理的化合物的維生素D分析物的測定法的實例
可以使用式I化合物(其中Z是聚(氨基酸)標記或非聚(氨基酸)標記或支持物)進行維生素D分析物的測定。
通過說明而非限制的方式,在用于檢測維生素D分析物的測定法的一個實例中,采用ACMIA測定形式。采用涂覆有維生素D類似物(其為式I化合物,其中Z是非聚(氨基酸)標記)的作為二氧化鉻顆粒(二氧化鉻顆粒試劑)的二氧化鉻顆粒作為第一組分。第二組分是維生素D分析物的抗體。將交聯至報告酶(例如,β-半乳糖苷酶)以形成抗體-酶綴合物的該抗體以過量(即大于結合樣品中可能存在的全部維生素D分析物所需的量的量)添加至反應容器。預先經受用釋放劑處理的樣品用維生素D的抗體處理,所述維生素D的抗體結合樣品中的維生素D分析物。在介質中將所述抗體-酶綴合物與樣品混合,以允許維生素D分析物結合至所述抗體。接下來,添加二氧化鉻顆粒試劑以結合盡任何過量抗體-酶綴合物。然后,施加磁體,所述磁體從懸浮液中拉出所有二氧化鉻顆粒和過量的抗體-酶,并且將上清液轉移至最終反應容器。將所述報告酶的底物添加至所述最終反應容器,并且將酶活性分光光度測量為吸光度隨時間的變化。該信號的量與樣品中的維生素D分析物的量相關。
在上述實例中,根據本文所述的原理的抗體可用于阻斷樣品中可存在的3-差向-25-羥基維生素D3與維生素D分析物的抗體的結合。抗3-差向-25-羥基維生素D3抗體可以是針對免疫原產生的抗體,所述免疫原是式I化合物,其中Z是免疫原性載體。
檢查步驟
在測定方法的下一步驟中,檢查介質的包含維生素D分析物和維生素D分析物的抗體的復合物和/或包含維生素D類似物和維生素D的抗體的復合物的存在。復合物中的一者或兩者的存在和/或量指示樣品中維生素D分析物的存在和/或量。
短語“測量維生素D分析物的量”是指維生素D的定量、半定量和定性測定。定量、半定量和定性的方法,以及用于測定維生素D分析物的所有其它方法,都被認為是測量維生素D分析物的量的方法。例如,僅檢測懷疑含有維生素D分析物的樣品中維生素D分析物的存在或不存在的方法被認為包括在本發明范圍內。術語“檢測”和“測定”以及測量的其它常見同義詞被考慮在本發明范圍內。
在許多實施方案中,介質的檢查涉及從介質檢測信號。信號的存在和/或量與樣品中維生素D分析物的存在和/或量相關。檢測的特定模式取決于信號產生系統的性質。如上所討論,存在許多方法,通過該方法,產生信號的信號的標記可以產生可通過外部裝置檢測的信號。信號產生系統的活化取決于信號產生系統成員的性質。
測量期間的溫度通常范圍為例如約10℃至約70℃,或約20℃至約45℃,或約20℃至約25℃。在一種方法中,使用已知濃度的維生素D分析物形成標準曲線。也可以使用校準物和其它對照。
由任何標記產生的發光或光可以目測、攝影、光量測定、分光光度測量,諸如通過使用光電倍增器或光電二極管,或通過測定其與介質中維生素D分析物的量相關的量的任何其它適宜裝置。信號的存在和/或量的檢查還包括信號的檢測,這通常僅是其中閱讀信號的一個步驟。通常使用儀器閱讀信號,所述儀器的性質取決于信號的性質。所述儀器可以是但不限于例如分光光度計,熒光計,吸收分光計,光度計和化學光度計(chemiluminometer)。
用于進行測定法的包含試劑的試劑盒
可以基于特定測定法的性質配制包含用于進行測定法的試劑的試劑盒。在根據本文所述的原理的一些實例中,試劑盒可以包含結合配偶體諸如,例如,針對免疫原產生的抗體,所述免疫原是式I化合物,其中Z是免疫原性載體。在根據本文所述的原理的一些實例中,試劑盒可以包含試劑,所述試劑是式I化合物,其中Z是聚(氨基酸)標記部分或非聚(氨基酸)標記部分,其包括支持物。試劑盒還可以包括用于進行維生素D分析物的特定測定法的其它試劑。在一些實施方案中,試劑盒包含包裝組合的生物素-結合配偶體,諸如例如抗生物素蛋白或鏈菌抗生物素蛋白,其與顆粒,生物素化的式I化合物以及標記的維生素D分析物抗體締合。該試劑盒可以進一步包括用于進行測定的其它試劑,其性質取決于具體測定形式。
所述試劑可以各自在分開容器中,或者各種試劑可以組合于一個或多個容器中,這取決于試劑的交叉反應性和穩定性。該試劑盒可以進一步包括用于進行測定的其它分別包裝的試劑,諸如例如額外的特異性結合對成員,信號產生系統成員,和輔助試劑。
試劑盒中各種試劑的相對量可以在很大程度上變化,以提供顯著優化本發明方法期間需要發生的反應和進一步顯著優化測定靈敏度的試劑濃度。在適當情形下,試劑盒中的一種或多種試劑可以作為通常凍干的干燥粉末(包括賦形劑)提供,其在溶解后將提供用于使用根據本文所述的原理的化合物試劑進行方法或測定的適當濃度的試劑溶液。該試劑盒可以進一步包括利用試劑(其包括根據本文所述的原理的化合物試劑)的方法的書面說明書。
含有根據本文所述的原理的化合物的藥物組合物
根據本文所述的原理的化合物和抗體的實例可以具有治療活性。這些化合物可以以治療有效量施用,所述治療有效量是提供與維生素D相關的特定疾病狀態的治療的量。根據本文所述的原理的化合物的實例的施用可以借助充當類似效用的試劑的任何接受的施用模式。所述化合物可以預防性地和治療性地使用。
施用的化合物的量取決于所治療的受試者和疾病狀態、痛苦的嚴重性、施用(例如,口服施用)的方式和時間表和開處方醫師的判斷中的一種或多種。
在采用本發明化合物用于治療上述病況時,可以使用任何藥學上可接受的施用模式。根據本文所述的原理的化合物可以單獨或與其它藥學上可接受的賦形劑組合施用,所述其它藥學上可接受的賦形劑包括,但不限于例如固體、半固體、液體或氣霧劑劑型,諸如例如片劑、膠囊、粉末、液體、注射劑、懸浮劑、栓劑和氣霧劑。所述化合物還可以以持續或受控釋放劑型(包括儲庫注射劑、滲透泵、丸劑和經皮(包括電轉運)貼劑)施用,例如用于以預定速率、優選以適合于單次施用精確劑量的單位劑型延長施用所述化合物。所述藥物組合物包括一種或多種常規的藥物載體或賦形劑和根據本文所述的原理的化合物。此外,這些組合物可以包括例如其它醫藥劑、藥劑、載體和助劑。
根據預期的施用模式,藥學上可接受的組合物將含有約0.1重量%至約90重量%的根據本文所述的原理的化合物,剩余物是例如合適的藥物賦形劑和載體。
用于上面詳述的病況的一種施用模式是口服,使用適宜的每日劑量方案,其可以根據痛苦的程度進行調整。對于此類口服施用,通過并入例如任何通常使用的賦形劑諸如例如甘露醇、乳糖、淀粉、聚維酮、硬脂酸鎂、糖精鈉、滑石、纖維素、交聯羧甲基纖維素鈉、葡萄糖、明膠、蔗糖和碳酸鎂以及其兩種或更多種的組合而形成藥學上可接受的組合物。此類組合物可以是例如溶液、懸浮液、片劑、可分散片劑、丸劑、膠囊、粉劑或持續釋放制劑。
通過舉例說明而非限制的方式,在一種方法中,組合物可以是丸劑或片劑的形式,并且可以與根據本文所述的原理的化合物一起含有稀釋劑,諸如例如乳糖、蔗糖或磷酸二鈣,或其兩種或更多種的組合;潤滑劑,諸如例如硬脂酸鎂;崩解劑,諸如例如交聯羧甲基纖維素鈉;和粘合劑,諸如例如淀粉、阿拉伯膠、聚乙烯吡咯烷酮、明膠、纖維素及其衍生物。
腸胃外施用通常特征在于皮下、肌肉內或靜脈內注射。可注射劑可以以常規形式制備,作為液體溶液或懸浮液,適用于注射前液體中的溶液或懸浮液的固體形式,或作為乳劑。合適的賦形劑包括,但不限于,例如水、鹽水、右旋糖、甘油和乙醇。此外,待施用的藥物組合物還可以含有少量的無毒輔助物質,諸如例如潤濕劑或乳化劑、pH緩沖劑和溶解度增強劑,諸如例如乙酸鈉、聚氧乙烯、脫水山梨糖醇單月桂酸酯、油酸三乙醇胺和環糊精。
在根據本文所述的原理的一個實例中,藥物組合物包含下式化合物:
其中W是O或N-O-(CH2)n’’C(O)-Z’’,
n’’是1至10的整數,
R11’’是H、烷基或酰基,且
Z’’是OR8,其中R8是H、烷基或NR9R10,其中R9和R10獨立地是H或烷基。
如本文所使用,短語“至少”意味著指定項的數目可以等于或大于所述數目。如本文所使用,短語“約”意味著所述數目可以相差±10%;例如“約5”意指4.5至5.5的范圍。
通過說明而非限制的方式,以下討論涉及根據本文所述的原理的具體實施例;該具體實施例并不意圖限制本公開內容和所附權利要求的范圍。在不背離本公開內容的精神和范圍的情況下,可以設想許多修改和替代組合物、方法和系統。
實施例
除非另有說明,以下實驗中的材料可以購自Sigma-Aldrich Chemical Corporation (St. Louis MO)或Fluka Chemical Corporation (Milwaukee WI)。本文公開的份數和百分數以重量/體積計,除非另有說明。
定義:
mg = 毫克
g = 克
ng = 納克
mL = 毫升
μL = 微升
μmol = 微摩爾
℃ = 攝氏度
min = 分鐘
sec = 秒
hr = 小時
w/v = 重量/體積
TLC = 薄層色譜法
HPLC = 高效液相色譜法
EDA = 乙二胺
EtOAc = 乙酸乙酯
DMF = 二甲基甲酰胺
DMSO = 二甲基亞砜
MeOP = 1-甲氧基-2-丙醇
MES = 2-(N-嗎啉代)乙磺酸
CMO =羧基甲氧基肟
TMB =四甲基聯苯胺
SNHS =磺基-N-羥基琥珀酰亞胺
高pH洗滌緩沖液= 5.5 mM Na3PO4 + 4.4 mM Na2CO3, pH 11
半抗原洗滌緩沖液 = 50 mM HEPES、300mM NaCl、1mM EDTA、0.1% TRITON? X405、0.15% PROCLIN?防腐劑和1mg/ml新霉素
DI = 去離子
ELISA =酶聯免疫吸附測定法
UPA = 超微粒分析儀
LOCI = 發光氧通道免疫測定法
BSA = 牛血清白蛋白
BGG = 牛丙種球蛋白
mIgG = 小鼠免疫球蛋白
MS = 質譜分析法。
實施例1
圖2化合物(其中R11是乙酰基)的制備
使5-雄甾烯-3α-醇-17-酮乙酸酯(VIII)(100 mg)與乙二醇(0.245 ml)和對甲苯磺酸一水合物(4 mg)在苯中在回流下反應過夜,以得到5-雄甾烯-3α-醇-17-酮乙酸酯乙烯縮酮(IX)(112 mg)。在己烷(13 ml)中將乙烯縮酮IX(112 mg)用N-溴代琥珀酰亞胺(69 mg)/偶氮異丁腈(3.3 mg)在回流下溴化30分鐘,以得到化合物X,隨后用四丁基氟化銨(1M,在THF中,1.6 ml)/THF(7.3 ml)在室溫下脫去溴化氫2小時,以得到雄甾-5,7-二烯-3α-醇-17-酮乙酸酯乙烯縮酮(XI)(55 mg)。使雄甾-5,7-二烯-3α-醇-17-酮乙酸酯乙烯縮酮(XI)(55 mg)與1N氫氧化鈉(2 mL)在甲醇(10 ml)中在室溫下反應約5小時,以得到雄甾-5,7-二烯-3α-醇-17-酮乙烯縮酮(XII)(48 mg)。使雄甾-5,7-二烯-3α-醇-17-酮乙烯縮酮(XII)(48 mg)與對甲苯磺酸一水合物(35 mg)在丙酮(5 mL)和水(0.2 mL)的混合物中在室溫下過夜反應,以得到雄甾-5,7-二烯-3α-醇-17-酮(XIII)(43.4 mg)。在乙醚(1100 ml)中在-20至0℃下在具有VYCOR?濾光片(Ace Glass Incorporated, Vineland, NJ)的450 w汞燈下輻照雄甾-5,7-二烯-3α-醇-17-酮(XIII)(43.4 mg) 5分鐘,以得到前-HMCHEMOIO,將其在乙醇(15 ml)中回流3小時,以產生HMCHEMOIO (VII) (13.5 mg)。
使來自上述的HMCHEMOIO (VII) (13.5 mg)與O-(羧甲基)羥胺半鹽酸鹽(12 mg)和乙酸鈉(24 mg)在1 ml甲醇中在室溫下反應過夜,以得到HMCHEMOIO-CMO (13.2 mg)(圖3中的式XX化合物,其中n = 1)。
如下制備陽離子化BSA:將三亞乙基四胺(0.5 mL)(圖3中的式XXI化合物,其中各自r = 1且s = 1)添加至4.5 ml 50 mM MES緩沖液(pH6),并將pH調節至6,隨后添加20 mg BSA。將組合混合以完全溶解組分。每小時將EDAC(5 mg)添加至上述溶液,持續5小時。將溶液在10mL Amicon?室(Amicon Inc., Beverly MA)中用10 x 10 mL洗滌緩沖液(10mM磷酸鹽 + 300nM NaCl)(pH7)洗滌。然后,將100 mg Tween?20添加至50 mL圓底燒瓶。添加洗滌緩沖液(50 mL)并將混合物攪拌10分鐘以分散Tween 20。將陽離子化BSA(圖3中的式XXIa化合物,其中各自r = 1且s = 2)以約5 mg/mL儲存于含有0.2% Tween? 20的洗滌緩沖液中。
為了制備HMCHEMOIO-CMO BSA (圖3中的式IIa化合物),將EDAC (25 mg)和10 mg NHS與如所述制備的13.2 mg HMCHEMOIO-CMO (XX)一起置于10 ml燒瓶中。將DMF (0.5 ml)添加至燒瓶。將混合物在室溫下攪拌24小時,以得到活化的HMCHEMOIO-CMO。溶液是澄清的。TLC(1:1乙酸乙酯:甲醇)指示沒有剩余的起始材料。
將來自上述的活化的HMCHEMOIO-CMO逐滴添加至來自上述的陽離子化BSA溶液,并將混合物在室溫下攪拌過夜。將混合物轉移至AMICON?室(Amicon Inc., Beverly MA),然后用5 x 10 ml洗滌緩沖液洗滌,并濃縮(30,000截止值)至約4 mL。將混合物在SD-25柱(GE Healthcare Bio-Sciences, Pittsburg PA)上使用洗脫緩沖液(pH 7.0)作為洗脫液進一步分離,以得到HMCHEMOIO-CMO BSA化合物的混合物(如上述關于圖3中的式IIa化合物所討論的混合物)。
實施例2
抗體的制備
免疫AJ品系的小鼠(雌性,至少8周齡)以產生單克隆抗體。第一次免疫是含有完全弗氏佐劑(來自Sigma-Aldrich, 目錄# F5881)的100 μl體積中的100 μg來自上述的免疫原(HMCHEMOIO-CMO BSA)。三周后,用含有不完全弗氏佐劑(來自Sigma-Aldrich 目錄# F5506)的100 μL體積中的100μg相同免疫原給予加強免疫。隨后,在另外3周之后,用含有不完全弗氏佐劑的100 μL體積中的100μg相同免疫原給予第二次加強免疫。在最后一次加強免疫后一周,對小鼠采血,并在ELISA中針對抗3-差向異構體抗體測試抗血清。隨后,在連續三天給予融合前加強,然后與相同免疫原(不含任何佐劑的50 μL體積PBS中的20μg)融合。在第四天,處死小鼠并進行脾切除。取出脾細胞,并通過標準方法使用命名為P3-X63Ag8.653 (ATCC CRL-1580?)的非分泌性鼠骨髓瘤細胞系進行融合。通過標準方法進行克隆。
通過結合和抑制ELISA篩選克隆。以下結合ELISA免疫測定程序根據以下方案。以與上述對于BSA綴合物所述的方式類似的方式在每孔50μL的PBS中以1 μg/mL用與卵白蛋白綴合的3-差向異構體包被板。在室溫下進行板包被1小時或更長。然后將板輕輕拍干并用每孔200μL的封閉緩沖液稀釋劑(含有0.05% Tween? 20的PBS中的0.5%酪蛋白溶液)封閉。在2-8℃下進行板封閉1小時或過夜。然后將板洗滌三次并輕輕拍干。然后如下將待篩選的單克隆抗體添加至各孔:將25μL PBS與25μL從融合生長板中的相應孔轉移的培養上清液混合。孵育在室溫下在板振蕩下持續約1小時。將板使用具有板堆垛機的洗板機(BioTek, Winooski VT)洗滌,其中洗滌緩沖液為含有0.05% Tween? 20的Milli-Q?水(Millipore Corporation, Billerica, MA)。以每孔50μL添加酶綴合物(在封閉緩沖液稀釋液稀釋至1:3000的與HRP偶聯的山羊抗小鼠IgG)。在室溫在振蕩下進行孵育約1小時。然后洗滌板,并以每孔100μL的體積添加顯色溶液(TMB,來自Moss Substrates, Pasadena MD),在室溫下持續10分鐘。使用ELISA讀板器在650 nm讀板。
基于上述篩選技術,選擇產生合適單克隆抗體的雜交瘤。一種此類單克隆抗體被命名為抗體8F10,并且是IgG2a κ抗體。另一種此類單克隆抗體被命名為抗體4G8,并且是IgG2a κ抗體。
另外,還根據以下方案使用抑制ELISA程序篩選克隆。以每孔50μL在磷酸鹽緩沖鹽水中以1 μg/mL用與卵白蛋白綴合的3-差向異構體包被板。在室溫下進行板包被1小時或更長,或在約2℃至8℃下進行板包被過夜。然后將板輕輕拍干并用每孔200μL的封閉緩沖液稀釋劑(含有0.05% Tween? 20的PBS中的0.5%酪蛋白溶液)封閉。通過在室溫下在板振蕩下孵育30分鐘或更長而進行板封閉。洗滌板。然后如下將待篩選的單克隆抗體與游離的3-差向異構體一起添加至各孔:從融合生長板中的相應孔轉移每孔25μL培養上清液,并添加25 μL 2μg/mL 3-差向異構體-25OH維生素D3。孵育在室溫下在板振蕩下持續約1小時。將板使用具有板堆垛機的洗板機(BioTek, Winooski VT)洗滌,其中洗滌緩沖液為含有0.05% Tween? 20的Milli-Q?水(Millipore Corporation, Billerica, MA)。以每孔50μL添加酶綴合物(在封閉緩沖液稀釋液稀釋至1:3000的與HRP偶聯的山羊抗小鼠IgG)。在室溫在振蕩下進行孵育約1小時。然后洗滌板,并以每孔100μL的體積添加顯色溶液(TMB,來自Moss Substrates, Pasadena MD)。如果所需抗體存在于雜交瘤上清液中,則觀察到與不含游離3-差向異構體的孔相比光密度降低。使用25OH維生素D3替代游離3-差向異構體-25 OH維生素D3作為對照以監測抗體的特異性。選擇結合3-差向異構體且不結合25OH維生素D3的抗體。
多克隆抗體產生:用500μg/劑量的HMCHEMOIO-CMO BSA免疫兔。進行一次初始免疫和五次加強免疫,分開兩周,收集兩次測試采血和一次生產性出血,并如上所述在ELISA中測試抗血清。
實施例3
25OH維生素D的免疫測定
免疫測定程序
采用的25OH維生素D (25(OH)D)免疫測定形式是基于LOCI?測定技術的均質競爭性化學發光免疫測定法。在Siemens Dimension? EXL自動化集成臨床化學系統(Siemens Healthcare Diagnostics Inc., Deerfield, IL)上進行測定。該測定法測量血清和血漿樣品中的25(OH)D2和/或25(OH)D3的總濃度。LOCI?測定試劑包括一種釋放試劑、兩種合成珠粒試劑和生物素化的單克隆抗25OH維生素D抗體試劑。第一珠粒試劑(命名為“敏化珠粒”)用鏈霉抗生物素蛋白包被并含有光敏染料。第二珠粒試劑(命名為“化學發光珠粒”)用25(OH)D3類似物包被并含有化學發光染料。將樣品與釋放試劑孵育,以便從維生素D結合蛋白釋放25(OH)D分子,包括3-差向異構化合物。然后將反應混合物與生物素化的抗體孵育以形成25(OH)D-生物素化的抗體復合物。因為生物素化的抗體(綿羊單克隆抗體)與3-差向-25(OH)D交叉反應,所以添加100 μg/mL的抗3-差向異構體-VD抗體8F10.1,以盡可能減少來自3-差向異構體維生素D化合物的測定信號。添加化學發光珠粒以結合過量的游離生物素化抗體。然后添加敏化珠粒以結合生物素化抗體的生物素部分。作為結果,形成化學發光珠粒-類似物/抗體-生物素/鏈霉抗生物素蛋白-敏化珠粒的聚集物。用680 nm的光照射反應混合物從敏化珠粒產生單線態氧,其擴散至化學發光珠粒并觸發化學發光反應。在612 nm測量所得化學發光信號,并且其與樣品中的總25(OH)D的濃度成反比。
用于免疫測定的試劑的制備
25(OH)D3化學發光珠粒的合成 – 通過將EPRM-EDA與25(OH)D3氨基甲酸酯偶聯來合成25(OH)D3化學發光珠粒。采用的材料為EPRM-EDA珠粒,1-乙基-3-(3-二甲基氨基丙基)碳二亞胺(EDAC)、Fluka磺基-N-羥基琥珀酰亞胺(SNHS)、25(OH)D3-3-氨基甲酸酯、Gafac?表面活性劑溶液16%、無水DMSO、含有10% MeOP和1% Gafac?表面活性劑的50mM MES pH6緩沖液。
EPRM-EDA珠粒的制備-將EPRM珠粒(2000 mg,20.0 mL)添加至40 mL小瓶。該EPRM珠粒通過與美國專利號7,179,660中所述的程序類似的程序制備,且化學發光化合物為2-(4-(N,N,二-十四烷基)-苯氨基-3-苯基二甲基噻吩與銪的螯合物。將EDA(800 mg,890 μL)與10 mL MES pH 6緩沖液(“緩沖液”)和約4.2 mL 6N HCl組合。該混合物的pH為約6.9,或調節為約6.9。在渦旋下將EDA溶液添加至EPRM珠粒,并在室溫下將混合物搖動15分鐘。在15 mL小瓶中將氰基硼氫化鈉(400 mg)與10 mL DI水組合,并將該組合添加至來自上述的珠粒混合物。將混合物在37℃下搖振18-20小時。將珠粒轉移至六個40 mL離心管。添加MES緩沖液,使體積達到35 mL,將該混合物以19,000 rpm離心處理30分鐘。傾倒上清液,并用攪拌棒使珠粒再懸浮于2 mL緩沖液中,并添加額外的緩沖液至35 mL。將混合物以18瓦特功率超聲處理30秒,使用冰將混合物保持冷卻。洗滌/超聲處理步驟進行4次,以去除所有活化化學品。最后的MES緩沖液離心處理之后,將含有5%MeOP和0.1%Tween?20的2 mL緩沖液 (“第二緩沖液”)添加至管中,用于再懸浮步驟。添加額外的第二緩沖液至35 mL,然后超聲處理。將珠粒懸浮液以19,000 rpm離心處理30分鐘。棄去上清液。最終的超聲處理在各個管中使用12 mL第二緩沖液,以得到25 mg/mL稀釋液。粒徑為277 nm,如在UPA儀器上所測定。
以類似于美國專利號6,153,442和美國專利申請公開號20050118727A(其相關公開內容通過引用并入本文)中所述方法的方式制備EPRM化學發光珠粒。該EPRM化學發光珠粒包含氨基葡聚糖內層和具有游離醛官能團的葡聚糖醛外層。參見例如美國專利號5,929,049、7,179,660和7,172,906,其相關公開內容通過引用并入本文。在利用合適的緩沖劑(諸如例如MES)的緩沖水性介質中,反應在約0至約40℃的溫度,約5.5至約7.0、或約6的pH下進行約16至約64小時。通過添加合適的淬滅劑(諸如例如羧基甲氧基胺半鹽酸鹽(CMO))和隨后洗滌顆粒來淬滅反應。
外部葡聚糖醛層上的醛基在還原胺化條件下與乙二胺反應以形成試劑EPRM-EDA,其具有包含亞乙基鏈和末端胺基的側鏈部分。所述還原胺化條件包括使用還原劑,諸如例如金屬氫化物。該反應在約20℃至約100℃的反應期間溫度下在水性介質中進行約1小時至約48小時。
25(OH)D3-3-氨基甲酸酯(25(OH)D3-3-氨基甲酸酯)的合成 - 在氮氣下在室溫下將5-ml燒瓶(用箔片覆蓋)中的22 mg (55 μmol)購自ChemReagents.com,Sugarland TX的25(OH)D3、100 mg (420 μmol)碳酸二琥珀酰亞胺酯(DSC)、100 μL三乙胺于1 mL無水乙腈中的混合物攪拌18小時,以制備活化的25(OH)D3。TLC (EtOAc:己烷= 2:1)顯示沒有剩余起始材料。通過將150 mg羧基甲氧基胺半鹽酸鹽(CMO)、0.3 ml三乙胺和1 ml DMF添加至10 ml燒瓶添加來制備懸浮液。在攪拌下將含有活化的25(OH)D3的溶液逐滴添加至CMO懸浮液,其再繼續18小時。施加真空以盡可能去除溶劑(保持加熱浴溫度低于50℃)。將EtOAc (25 ml)添加至殘余物,將其用2 ml鹽水洗滌三次。將有機相用無水Na2SO4干燥并過濾;使用旋轉蒸發儀去除溶劑。干燥之后獲得粗產物(42 mg),并通過HPLC純化。在高真空下干燥之后獲得純產物(24 mg)。將產物溶解于1.2 ml無水DMSO中。將等分試樣轉移至小瓶中,將其保持在-70℃下。
將EPRM-EDA與半抗原25(OH)D3-氨基甲酸酯偶聯 - 將1.2 mg半抗原添加至2-mL小瓶。將11.2 mg EDAC和15.5 mg SNHS加上3.73 mL無水DMSO添加至5-mL小瓶。旋轉EDAC/SNHS溶液以溶解內容物。將1.14 mL EDAC/SNHS溶液添加至含有半抗原的小瓶。將混合物旋轉22小時。將EPRM-EDA (200 mg)用高pH洗滌緩沖液洗滌一次,然后用MES pH6緩沖液洗滌。向5-mL小瓶中添加1.08 mL (100 mg)洗滌緩沖液,隨后添加143 mL 1.6% Gafac?表面活性劑。向小試管中添加256μL無水DMSO,隨后添加49 μL EDAC/SNHS/半抗原。將DMSO/半抗原溶液逐滴添加至珠粒混合物(在添加期間進行渦旋)。將珠粒/半抗原混合物在室溫下旋轉過夜。
將珠粒/半抗原混合物轉移至50-mL離心管并用10% 1-甲氧基-2-丙醇/1% Gafac?表面活性劑/MES pH6緩沖液稀釋至35 mL。將管以18,500 rpm在10℃下離心30分鐘。棄去上清液,并用1 mL相同緩沖液替換。用攪拌棒再懸浮沉淀。將小瓶用相同緩沖液填充至35 mL。將管在18-21瓦特下超聲處理1分鐘,使用冰以保持管冷卻。將離心/洗滌重復六次。在第六次洗滌后,將緩沖液切換至半抗原洗滌緩沖液(pH 7.2),并再進行兩次洗滌。在最后一次洗滌并用1 mL 半抗原洗滌緩沖液重懸浮后,添加4 mL 半抗原洗滌緩沖液。將珠粒混合物在杯式超聲波儀中以50%功率超聲處理。通過UPA測量粒徑為298 nm。進行百分比固體測定,并將珠粒混合物稀釋至10 mg/mL。將該化學發光珠粒試劑配制于50 mM MES緩沖液中。
抗25(OH)D抗體的生物素化 – 將NHS-PEO4-生物素(Pierce Chemical Company, Rockford IL)與抗25(OH)D抗體(綿羊單克隆抗體,來自Bioventix, Farnham, Surrey, UK)偶聯。將3 mg抗25(OH)D抗體在10 mL Amicon中用10 ml抗體透析緩沖液(10 mM NaH2PO4pH 7.0/300 mM NaCl)各自緩沖液交換兩次,然后濃縮至3.0 mg/mL。將1mg NHS-PEO4-生物素溶解于100 μL抗體透析緩沖液中,以制備10 mg/mL生物素試劑溶液,將其添加(35 μL)至抗25(OH)D抗體溶液。將反應混合物在室溫下搖動過夜。將混合物在10 mL Amicon中用10 mL抗體透析緩沖液各自洗滌三次,然后濃縮至約1 mL。在UV A280上測量濃度。在水性緩沖液中配制生物素化的抗25(OH)D抗體試劑,所述水性緩沖液含有25 mM檸檬酸緩沖液、300 mM NaCl、1mM EDTA、封閉蛋白和防腐劑(pH 5.0)。
敏化珠粒 - 使用與美國專利號6,153,442、7.022,529、7,229,842和美國專利申請公開號20050118727A中描述的方法類似的方法制備鏈菌抗生物素蛋白-敏化劑珠粒。光敏劑為雙-(三己基)-硅-叔丁基-酞菁。敏化珠粒試劑的濃度在含有150 mM的NaCl的HEPES緩沖液(pH 8.0)中為200 μg/mL。
釋放試劑 - 5 mM HEPES緩沖液中的水楊酸鈉。
免疫測定的結果
添加抗3-差向異構體-VD抗體8F10.1(抗3-差向異構體VD Ab)對測定的3-差向異構體交叉反應性的影響顯示于表1中。含有25(OH)D2或25(OH)D3化合物的十個患者血清摻入100 ng/mL購自Sigma (儲備號751324)的3-差向異構體維生素D3化合物。通過摻入和未摻入3-差向異構體化合物的25(OH)D2或25(OH)D3值之間的差異除以添加的3-差向異構體化合物的量來計算3-差向異構體交叉反應性。在添加100 μg/mL的抗3-差向異構體-VD抗體8F10.1的情況下,平均3-差向異構體交叉反應性從13.7%降低至小于2%。
圖9說明使用添加和不添加抗3-差向異構體-VD抗體8F10.1 (3-差向異構體Ab)的試劑產生的標準曲線的比較。兩條曲線的完全重疊顯示抗3-差向異構體-VD抗體8F10.1不影響25(OH)D3(圖9中的25OH Vit D3)的測量,指示抗體對3-差向異構體化合物是特異性的并且與25(OH)D3沒有可觀察到的交叉反應性。
實施例4
3-差向-25OH維生素D的免疫測定
免疫測定程序
3-差向-25OH維生素D (3-差向-25(OH)D)的測量采用基于類似于上述實施例3中所述的LOCI?測定技術的均質競爭性化學發光免疫測定法。在Siemens Dimension? EXL自動化集成臨床化學系統(Siemens Healthcare Diagnostics Inc.)上進行測定。用于測量3-差向-25(OH)D的LOCI?測定試劑包括一種釋放試劑、兩種合成珠粒試劑和生物素化的單克隆抗3-差向異構體抗體試劑。第一珠粒試劑(敏化珠粒)用鏈霉抗生物素蛋白包被并含有光敏染料。第二珠粒試劑(化學發光珠粒)用以與上述對于實施例1所述的方式類似的方式制備的3-差向異構體類似物(上述式IIa化合物,其中Z’是非聚(氨基酸)標記,即EPRM-EDA化學發光珠粒)包被。將樣品與釋放試劑孵育,以便從維生素D結合蛋白釋放25(OH)D分子,包括3-差向異構化合物。然后將反應混合物與生物素化的抗體孵育以形成3-差向-25(OH)D/生物素化的抗體復合物。添加化學發光珠粒以清除過量的游離生物素化抗體。然后添加敏化珠粒以結合生物素化抗體的生物素部分。作為結果,形成化學發光珠粒-類似物/抗體-生物素/鏈霉抗生物素蛋白-敏化珠粒的聚集物。用680 nm的光照射反應混合物從敏化珠粒產生單線態氧,其擴散至化學發光珠粒并觸發化學發光反應。在612 nm測量所得化學發光信號,并且其與樣品中的總3-差向-25(OH)D的濃度成反比。
用于免疫測定的試劑的制備
3-差向異構體類似物化學發光珠粒的合成 - 以與上述實施例3中對于25(OH)D3化學發光珠粒的合成所述的方式類似的方式制備用于檢測3-差向-25(OH)D的該測定中使用的化學發光珠粒,其中半抗原是式IIa化合物,其中Z’是化學發光珠粒。
化學發光珠粒試劑 - 50 nM MES緩沖液中的3-差向異構體類似物化學發光珠粒。
抗3-差向異構體-VD抗體8F10.1的生物素化 - 以與上文實施例3中對于抗25(OH)D抗體的生物素化所述的方式類似的方式進行抗3-差向異構體-VD抗體8F10.1的生物素化。
生物素化的抗體試劑 - 25 mM檸檬酸緩沖液中的如上所述的生物素化的抗3-差向異構體-VD抗體8F10.1。
敏化珠粒試劑 - 敏化珠粒試劑與實施例3中相同。
免疫測定的結果
圖10說明用于使用抗3-差向異構體-VD抗體8F10.1測定樣品中的3-差向-25(OH)D的免疫測定的標準曲線。化學發光千計數代表如上所述測量的化學發光信號。
本說明書中引用的所有出版物和專利申請通過引用并入本文,如同每個單獨的出版物或專利申請被特別和單獨指明通過引用并入一樣。
應當理解,上述實施例僅說明代表本文所述的原理的許多具體實施例中的一些。明顯地,在不背離如以下權利要求所定義的范圍的情況下,本領域技術人員可以容易地設想出許多其它布置。
- 還沒有人留言評論。精彩留言會獲得點贊!