用于調節mTORC1的組合物和方法與流程
本申請要求于2014年12月22日提交的美國臨時申請No.62/095,512和于2014年5月2日提交的美國臨時申請No.61/987,769的權益,其全部教導內容以引用的方式并入本文中。
政府支持
本發明是在在政府支持下由國家衛生研究院授予的R01CA129105、R01CA103866和R01AI047389來完成。政府對本發明具有一定的權利。
發明背景
本發明涉及鑒別通過調節SLC38A9(NCBI基因ID:153129)的活性來調節細胞中的mTORC1活性的化合物的方法,以及所述鑒別的化合物在調節mTORC1和治療特征在于mTORC1活性異常的疾病和病狀中的用途。
雷帕霉素(rapamycin)的哺乳動物(機械)靶(mTOR)是響應營養素、生長因子和應激因子的細胞、器官和生物體生長的主要調控劑。mTOR是絲氨酸/蘇氨酸激酶,并且使至少兩種不同的復合物mTOR復合物1(mTORC1)和mTOR復合物2(mTORC2)成核。mTORC1活性部分由氨基酸調控。當活化時,mTORC1可通過促進合成代謝過程(例如mRNA轉譯)和通過其下游底物的作用抑制分解代謝過程(例如自噬)來刺激細胞生長。然而,在廣泛范圍的疾病中觀察到異常mTORC1激活,所述疾病包括多種類型的癌癥、代謝功能障礙(例如2型糖尿病、肥胖癥)、自身免疫疾病(例如牛皮癬)和神經變性疾病(例如阿爾茨海默病和帕金森病)、神經精神綜合癥(例如自閉癥和重度抑郁癥)、骨骼肌功能障礙(例如少肌癥、疾病誘導的惡病質和失用性萎縮)以及幾種罕見疾病(包括由遺傳性和獲得性線粒體功能障礙(例如利氏綜合征(Leigh Syndrome))和某些遺傳生長缺陷引起的疾病)。
氨基酸調控mTORC1信號傳導的機制是復雜的,并且以溶酶體為中心。在氨基酸飽和條件下,氨基酸穿過質膜并在溶酶體的內腔中積累。此外,溶酶體內腔中蛋白質通過溶酶體蛋白酶和肽酶的降解也可以促進溶酶體內氨基酸的積累并導致mTORC1活化。mTORC1被募集到溶酶體膜,在所述溶酶體膜中mTORC1與Rag GTP酶(RagA或RagB與RagC或RagD的專性異源二聚體)相互作用。Rag GTP酶異源二聚體不含將復合物束縛于溶酶體的脂質錨定物。相反,其依賴于五聚體Ragulator復合物,其通過Ragulator組分LAMTOR1(p18)的脂化連接至溶酶體膜用于溶酶體定位。此外,與LAMTOR1組裝的Ragulator組分LAMTOR2-5(分別為p14、MP1、C7orf59和HBXIP)用作RagA和RagB的鳥嘌呤核苷酸交換因子,促進其裝載GTP。因此,Ragulator不僅需要將Rag GTP酶異源二聚體定位于溶酶體表面,而且還用于催化RagA/B的活化的核苷酸結合狀態。已經鑒別了響應氨基酸可用性的另外的蛋白質復合物,其調控Ragulator和Rag復合物的活性,但是尚未闡明通過mTORC1路徑物理傳感個別氨基酸的精確機制。
鑒于亮氨酸和精氨酸在活化mTORC1中的已知作用,我們假設存在能夠在溶酶體處特異性傳感亮氨酸或精氨酸的蛋白質,并且響應活化mTORC1上游的溶酶體機構。我們設法通過蛋白質組學和生物化學方法來鑒別這些蛋白質。
鑒于mTORC1調節在合成代謝過程和某些疾病狀態中的重要性,需要鑒別mTORC1活化途徑的其它成員作為調節的潛在靶標,其繼而可調節mTORC1活性。
發明概要
本發明通過鑒別SLC38A9的蛋白質同種型作為mTORC1調控路徑的重要組分并且作為此路徑中的推定氨基酸傳感器來解決此問題,其可以藥理學方式經操縱,導致mTORC1活化的選擇性調節。
在某些實施方案中,本文公開了鑒別mTORC1活性調節劑的方法,所述方法包括以下步驟:(a)使測試化合物與SLC38A9.1或其具有SLC38A9.1活性或特性的片段或突變體接觸;(b)測量在測試化合物存在下的SLC38A9.1活性或特性;和(c)將測量的活性或特性與在不存在測試化合物下相同的活性或特性進行比較,由此確定測試化合物是否是SLC38A9的調節劑。
在某些方面,測試化合物與SEQ ID NO:1的氨基酸1-119、SLC38A9.1或SLC38A9Δ110接觸,或與包含SEQ ID NO:1的氨基酸1-119、SLC38A9.1或SLC38A9Δ110以及異源融合配偶體的融合蛋白接觸。在某些實施方案中,異源融合配偶體選自N-末端His標簽、N-末端多聚-His標簽、表位標簽、配體標簽、N-或C-末端質膜信號序列、熒光多肽或發光多肽。
在某些實施方案中,SLC38A9.1活性或特性是跨膜轉移氨基酸的能力。在某些實施方案中,SLC38A9.1活性或特性是與Ragulator或RagGTP酶中的一種或多種的組分結合的能力。
本文還公開了用于調節細胞中的mTORC1水平或活性的方法,其包括使細胞與調節SLC38A9水平或活性的試劑或組合物接觸。在某些方面,調節細胞中的mTORC1水平或活性包括增加細胞中的mTORC1水平或活性。在某些實施方案中,調節細胞中的mTORC1水平或活性包括降低細胞中的mTORC1水平或活性。
在某些實施方案中,本文還公開了用于增加需要mTORC1活性增加的患者中的mTORC1活性的方法,所述方法包括向患者施用活化或激活SLC38A9的試劑的步驟,由此增加患者中的mTORC1活性。
在其它實施方案中,公開了用于降低需要mTORC1活性降低的患者中的mTORC1活性的方法,其包括向患者施用抑制SLC38A9的試劑的步驟,從而降低患者的mTORC1活性。
本文還公開了用于治療將從增加患者中mTORC1的水平或活化中受益的疾病、病狀或病癥的方法,所述方法包括向受試者施用有效量的活化或激活SLC38A9的試劑,并由此治療所述疾病、病狀或病癥。
在某些方面,本文公開了用于治療將從降低患者中mTORC1的水平或活化中受益的疾病、病狀或病癥的方法,所述方法包括向受試者施用有效量的抑制SLC38A9活性的試劑,并由此治療所述疾病、病狀或病癥。
通過參考本發明的以下詳細說明將更好地理解上文討論的以及本發明的許多其它特征和伴隨的優點。
附圖簡述
專利或申請案文件含有至少一張彩色圖。具有彩色圖的本專利或專利申請公開案的副本將由辦公室根據請求并支付必要的費用提供。
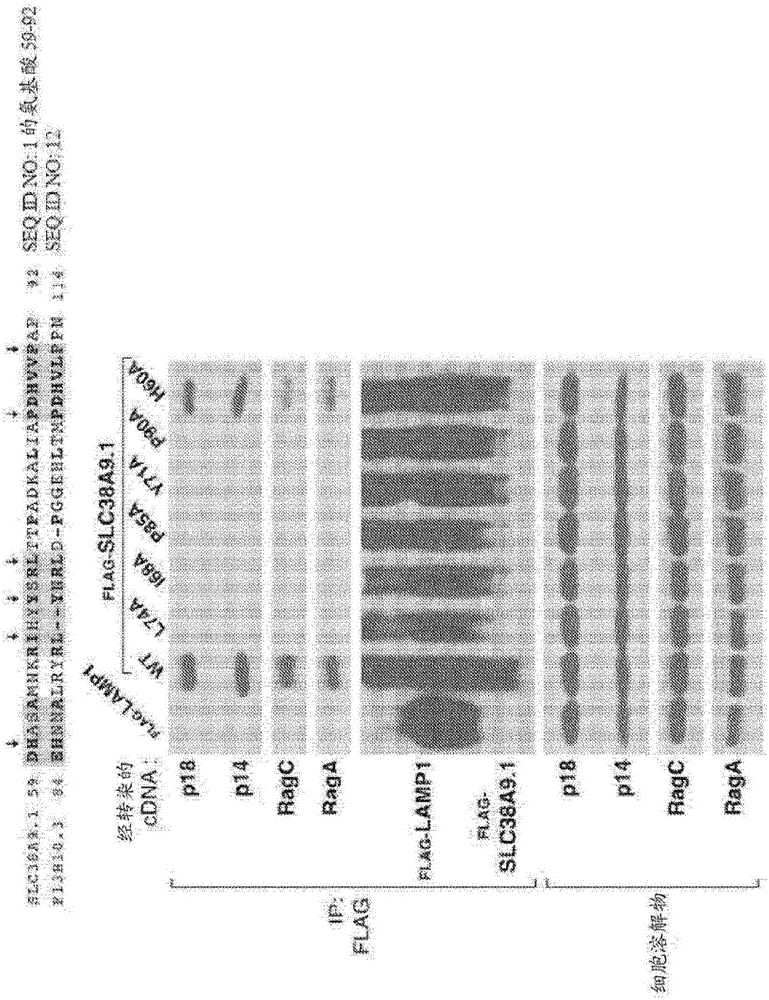
圖1A-1C描述了來自用各種FLAG標記的蛋白質轉染的HEK-293T細胞的細胞裂解物的免疫印跡分析。在表達載體中用指示的cDNA轉染HEK-293T細胞,并制備裂解物。將一部分裂解物進行FLAG免疫沉淀。細胞裂解物和來自細胞裂解物的FLAG-免疫沉淀蛋白質二者都針對指示蛋白質進行免疫印跡分析。圖1A描述了全長SLC38A9.1或其N-末端結構域與內源性Ragulator組分(p18和p14)以及RagA和RagC GTP酶的相互作用。圖1B描述了與Ragulator和Rag GTP酶相互作用所需的SLC38A9.1的N-末端結構域的部分與來自秀麗隱桿線蟲(C.elegans)的SLC38A9.1同源物F13H10.3的比對、以及這種相互作用所需的關鍵氨基酸殘基(下箭頭)、以及SLC38A9.1或SLC38A9.1的各種N-末端突變體與內源性Ragulator(p18和p14)以及RagA和RagC GTP酶的相互作用。圖1C描述了SLC38A9.1與v-ATP酶組分V0d1和V1B2的相互作用。
圖2A-2B描述了氨基酸對SLC38A9.1和溶酶體膜蛋白LAMP-2的定位的效應,以及氨基酸對mTORC1和SLC38A9產生的效應。圖2A描述了展現氨基酸對穩定表達FLAG-SLC38A9.1的HEK-293T細胞中的SLC38A9.1和溶酶體膜蛋白LAMP-2的定位的效應的免疫染色。圖2B描述了描述氨基酸對表達指示的短發夾RNA的HEK-293T細胞中的mTORC1和SLC38A9產生的效應的免疫印跡分析。
圖3A-3D描述了展現氨基酸對經編碼指示的FLAG標記蛋白的慢病毒轉導的HEK-293T細胞中的各種mTORC1組分的效應的免疫印跡分析。圖3A描述了在表達metap2(作為對照)或SLC38A9.1的細胞中的所有氨基酸以及亮氨酸和精氨酸的效應。圖3B描述了在表達metap2、溶酶體標記蛋白LAMP1、SLC38A9.1或SLC38A9.2的細胞中氨基酸的效應。圖3C描述了在表達metap2、LAMP1、SLC38A9.1或SLC38A9.1I68A的細胞中氨基酸的效應。圖3D描述了在表達metap2或SLC38A9.1 1-119的細胞中的氨基酸的效應。
圖4A-4B描述了展現氨基酸對穩定表達指示的FLAG標記蛋白的HEK-293T細胞中的SLC38A9.1與Ragulator和Rag GTP酶之間的相互作用的效應的免疫印跡分析。圖4A描述了在表達Ragulator組分p14或p18的細胞中的氨基酸以及亮氨酸和精氨酸的效應。圖4B描述了在表達metap2、SLC38A9同種型SLC38A9.1、SLC38A9.4、SLC38A9.11-119或SLC38A9.2的細胞中的氨基酸的效應。圖4C描述了展現RagB和RagC中的各種突變對其與具有指示的Rag B和/或RagC突變的經轉染的HEK-293T細胞中內源性SLC38A9和Ragulator組分的相關的效應的免疫印跡分析。
圖5A-5E描述了實驗精氨酸和相關免疫印跡分析的結果,其描述了mTORC1路徑的誘導活化的損害。圖5A描述了含有SCL38A9.1的蛋白磷脂體對[3H]-精氨酸的時間依賴性攝取。圖5B(左圖)描述了給定固定的[3H]精氨酸(0.5μM)和增加濃度的未標記的精氨酸的[3H]精氨酸攝取的時程。圖5B(右圖)描述了從左圖計算的作為總精氨酸濃度的函數的速率。將數據擬合到Michaelis-Menton方程。圖5C描述了在用0.5μM[3H]精氨酸裝載1.5小時后SLC38A9.1蛋白磷脂體的時間依賴性流出。圖5D描述了使用100mM指示的未標記的氨基酸通過SLC38A9.1轉運0.5μM[3H]精氨酸的競爭。圖5A-5D中的誤差條表示從至少3次測量得到的標準偏差。圖5E是描述SLC38A9無效HEK-293T細胞和陰性對照細胞(sgAAVS1_1)中亮氨酸或精氨酸誘導的mTORC1路徑的活化受損的一系列免疫印跡分析。使細胞對指示的氨基酸饑餓50分鐘,并使用指示的氨基酸濃度刺激10分鐘。RPMI中的亮氨酸和精氨酸濃度分別為381μM和1.14mM。
圖6A-6C描述了展現Ragulator和Rag GTP酶特異性結合于表達各種FLAG標記蛋白的HEK-293T細胞中SLC38A9.1的N-末端結構域的免疫印跡分析。圖6A描述了與metap2、LAMP1、SLC38A9.1、SLC38A7(來自與SLC38A9相同家族的已知溶酶體轉運蛋白)和SLC36A1(被認為參與mTORC1調控的已知溶酶體膜蛋白)的相互作用。圖6B描述了與LAMP1、SLC38A9.1和SLC38A9.2的相互作用。圖6C描述了與metap2、LAMP1、SLC38A9.1、SLC38A9.1Δ110、SLC38A9.4和SLC38A9.1 1-119的相互作用。
圖7A-7D描述了所實施免疫染色和免疫印跡分析實驗的結果。圖7A和7B描述了展現SLC38A9.2和SLC38A9.4以及LAMP在穩定表達那些SLC38A9同種型的FLAG標記型式的HEK-293T細胞中的定位的免疫染色。圖7C描述了展現SLC38A9的各種同種型與Ragulator組分的各種突變體在表達指示的同種型和突變體的HEK-293T細胞中的相互作用的免疫印跡分析。圖7D描述了展現在具有短干擾RNA的SLC38A9敲低的HEK-293T細胞中氨基酸對mTORC1的效應(如通過mTORC1底物S6K1的磷酸化所分析)的免疫印跡分析。
圖8A-8C描述了展現SLC38A9.1、SLC38A9.4和/或SLC38A9.1Δ110的表達的效應的免疫印跡分析。圖8A描述了展現SLC38A9.1、SLC38A9.4或SLC38A9.1Δ110的瞬時過表達對HEK-293T細胞中mTORC1對于氨基酸的敏感性的效應的免疫印跡分析。圖8B描述了展現SLC38A9.1在各種細胞中穩定過表達對mTORC1對于氨基酸的敏感性的效應的免疫印跡分析。圖8C描述了展現SLC38A9.1穩定過表達對精氨酸饑餓和氯喹誘導的自噬的效應的免疫印跡分析,如通過自噬p62和LC3水平的標記物所測量。
圖9描述了展現氨基酸對SLC38A9與Rag和Ragulator組分的內源性締合的效應的免疫印跡分析。
圖10A-10F描述了(例如)在HEK-293T細胞中實施的研究的結果。圖10A描述了在導致向質膜溢出的水平下瞬時過表達SLC38A9.1的HEK-293T細胞的免疫染色。圖10B-10D描述了HEK-293T細胞中各種蛋白質瞬時表達對標記的氨基酸攝取的效應(圖10B-[14C]精氨酸;圖10C-[14C]氨基酸混合物);圖10D-[14C]亮氨酸)。圖10E(左圖)描述了在-80mV下來自表達指示的cDNA的HEK-293T細胞的全細胞記錄。定量是在局部施用2.4mM精氨酸、1.6mM亮氨酸和4mM谷氨酰胺(4x DMEM濃度)后穩態電流的變化。圖10E(右圖)描述了各個記錄的代表性實例。灰色條指示氨基酸的施用。圖10F描述了在與0.5μM[3H]精氨酸一起培育60分鐘,隨后在捕獲游離氨基酸的柱上進行色譜法之后,SLC38A9.1蛋白磷脂體或LAMP1蛋白磷脂體對[3H]-精氨酸的攝取。蛋白磷脂體通過柱并進行FLAG免疫印跡分析(上圖)和閃爍計數(下圖)。
圖11描述了給定固定的[3H]精氨酸(0.5μM)在存在或不存在100mM未標記的精氨酸下由SLC38A9.1(“38A9”)脂質體或SLC38A9.1Δ110(“38A9δ110”)脂質體[3H]精氨酸攝取的時程。
具體實施方式
如本文所用,“調節(modulating)”(及其動詞形式,例如“調節(modulates)”)意指引起或促進所關注分子、過程、路徑或現象的定性或定量變化、改變或修飾。非限制性地,這種變化可以是過程、路徑或現象的不同組分或分支的增加、減少、結合特征的變化或相對強度或活性的變化。
如本文所用的術語“抑制劑”(及其動詞形式,例如“抑制”)意指如下試劑:(a)減少通常與被抑制的蛋白質相關的一種或多種活性;(b)降低或以其它方式干擾被抑制的蛋白質與另一種蛋白質或配體或核酸締合(例如結合)的能力;和/或(c)降低自編碼被抑制的蛋白質的基因的轉錄或表達。
如本文所用的術語“活化劑”和“激活劑”(及其動詞形式,例如“活化”和“激活”)意指如下試劑:(a)增加通常與被活化的蛋白質相關的一種或多種活性;(b)增加或以其它方式增強被活化的蛋白質與另一種蛋白質或配體或核酸締合(例如結合)的能力;和/或(c)增加自編碼被活化的蛋白質的基因的轉錄或表達。在某些實施方案中,利用本文所述的任何活化、激活或抑制性體系、方法或試劑的調節、抑制、活化和/或激活可以在體外或離體實施,例如通過將細胞接觸或暴露于活化、激活或抑制性體系、方法或試劑。在某些實施方案中,利用本文所述的任何活化、激活或抑制性體系、方法或試劑的調節、抑制、活化和/或激活可以在體內實施。
術語“SLC38A9”、“全長SLC38A9”、“SLC38A9同種型1”和“SLC38A9.1”可互換使用,并且都指SEQ ID NO:1中所述的完全氨基酸序列。
術語“SLC38A9.2”和“SLC38A9同種型2”可互換使用,并且是指SEQ ID NO:1的氨基酸64-561。
術語“SLC38A9.4”和“SLC38A9同種型4”可互換使用,并且是指SEQ ID NO:1的氨基酸120-561。
術語“SLC38A9Δ110”是指SEQ ID NO:1的氨基酸111-564。
在某些實施方案中,本發明提供了對應于在氨基酸水平上與SLC38A9氨基酸序列(SEQ ID NO:1)的一部分具有至少70%、至少75%、至少80%、至少85%、至少90%或至少95%同源性的SLC38A9或者多肽或肽的部分的肽和多肽。在所述實施方案的一個特定方面,肽或多肽片段至少包含SEQ ID NO:1的氨基酸1-119。SLC38A9的此氨基末端結構域似乎負責結合于Ragulator。在所述實施方案的更具體方面,肽或多肽片段至少對應于SEQ ID NO:1的氨基酸59-90。在替代方面,多肽或肽包含與SEQ ID NO:1的氨基酸1-119或氨基酸59-90至少70%、至少75%、至少80%、至少85%、至少90%或至少95%同源的氨基酸序列。在另一個具體方面,至少70%同源的多肽與SEQ ID NO:1的氨基酸序列的不同之處在于D59、H60、S62、S72、R73、P77、D86和V88中的至少一個或多個經不同的氨基酸取代。在某些方面,D59、H60、S62、S72、R73、P77、D86及V88中的至少一個或多個經丙氨酸取代。在另一個具體方面,至少70%同源多肽至少包含對應于SEQ ID NO:1的I68、Y71、L74、P85、V89和P90的氨基酸。在所述實施方案的另一方面,肽、多肽或其同源物缺乏對應于或定義SLC38A9的任何跨膜結構域的氨基酸序列,例如SEQ ID NO:1的氨基酸120-561都不存在。在某些實施方案中,肽、多肽或其同源物能夠進入細胞。這可以通過本領域已知的方法實現,包括在肽或多肽中添加細胞黏附氨基酸序列(例如Arg-Gly-Asp)、使用構象穩定的“釘接”多肽和使用融合蛋白,其中所述肽、多肽或其同源物的融合配偶體是細胞可滲透的多肽序列。在替代實施方案中,肽或多肽片段由SEQ ID NO:1的氨基酸111-561組成。在此替代實施方案的相關方面,肽或多肽片段基本上由直接或通過連接體與任何上述肽或其多肽片段的N-或C-末端融合的質膜靶向序列組成。在更具體方面,肽或多肽片段基本上由直接或通過連接體與SEQ ID NO:1的氨基酸111-561或SEQ ID NO:1的氨基酸1-561的N-或C-末端融合的質膜靶向序列組成。質膜靶向序列是本領域公知的(參見,例如,Bhardwaj,N.等,Bioinformatics 23:3110-3112(2007))。在更具體方面,質膜靶向序列是H-Ras的C-末端25個氨基酸(QHKLRKLNPPDESGPGCMSCKCVLS=SEQ ID NO:5)。在相關的更具體方面,肽或多肽片段由SEQ ID NO:1中任一個的變體或任何上述肽或其多肽片段組成,其中溶酶體靶向序列已經通過氨基酸取代、插入和/或添加得以消除。
在某些實施方案中,本發明的肽、多肽、融合蛋白及其同源物可用作SLC38A9與Ragulator的結合的競爭性抑制劑。在其它實施方案中,本發明的肽、多肽、融合蛋白及其同源物可用于鑒別SLC38A9的調節劑的分析中。此類調節劑可以改變SLC38A9對一種或多種氨基酸(例如精氨酸、組氨酸或賴氨酸)的親和力,或改變SLC38A9與Ragulator之間的相互作用。
在相關實施方案中,本發明提供了編碼一種或多種上述肽、多肽、融合蛋白及其同源物的核酸序列;包含此類核酸序列的載體;和用所述載體轉化和/或表達所述核酸序列的產物的細胞。
在另一個實施方案中,本發明提供了SLC38A9的蛋白質支架調節劑。蛋白質支架調節劑是能夠進入細胞并結合靶蛋白,并且可能能夠改變靶蛋白的活性的小蛋白。蛋白質支架調節劑包括但不限于親和體、雙螺旋抗體、打結素(knottin)、單體(也稱為阿德樂汀(adnectin))、抗運載蛋白(anticalin)、經設計的錨蛋白重復蛋白(DARPin)、阿爾法抗體TM(AlpahbodiesTM)、高親和性多聚體(avimer)、免疫球蛋白衍生的結合片段、單鏈抗體及其片段、以及天然配體的衍生物,例如VEGF、EGF和膜聯蛋白V。本發明的蛋白質支架調節劑可以是SLC38A9活化的或SLC38A9抑制性的。合適的蛋白質支架調節劑可通過篩選噬菌體、細胞或核糖體展示文庫來鑒別,其可以是市售的或可以由本領域技術人員產生。SLC38A9的蛋白質支架調節劑的活性可(例如)通過其引起SLC38A9對于Ragulator或者一種或多種我們認為與SLC38A9相關的其它蛋白質的親和力的改變的能力來確定,所述其它蛋白質例如TMEM192(NCBI基因ID:201931;SEQ ID NO:2)、SLC12A9(NCBI基因ID:56996;SEQ ID NO:3)或CLCN7(NCBI基因ID:1186;SEQ ID NO:4)。或者,SLC38A9的蛋白質支架調節劑的活性可通過其引起SLC38A9的一種或多種活性的改變的能力來確定。在該實施方案的一個方面,蛋白質支架調節劑是SLC38A9的抑制劑。在替代實施方案中,蛋白質支架調節劑是SLC38A9的活化劑或激活劑。
在另一個實施方案中,本發明提供了SLC38A9的小分子調節劑。在該實施方案的一個方面,小分子調節劑是SLC38A9的抑制劑,并且引起細胞中mTORC1活性的降低。在該實施方案的替代方面,小分子調節劑是SLC38A9的活化劑或激活劑,并且引起細胞中mTORC1活性的增加。在更具體實施方案中,小分子調節劑是SLC38A9的活化劑或激活劑,并且不是精氨酸、賴氨酸或亮氨酸。在另一個實施方案中,小分子調節劑是SLC38A9的活化劑或激活劑,并且是精氨酸、賴氨酸或亮氨酸的功能性模擬物。本文所用的術語“模擬物”是指仿效細胞中mTORC1活化的精氨酸、賴氨酸或亮氨酸的生物學效應(如通過mTORC1底物(例如S6K)響應試劑的mTORC1磷酸化作用所測量)的試劑,或者直接或間接增加細胞中精氨酸、賴氨酸或亮氨酸的水平的試劑。在所述實施方案的某些方面,小分子調節劑不是具有至少10%精氨酸、賴氨酸或亮氨酸含量的肽或肽類似物(例如肽中至少10%的氨基酸是精氨酸、賴氨酸或亮氨酸中的一種)。SLC38A9的小分子調節劑可通過篩選市售的小分子和天然產物文庫來鑒別,并且可通過公知的藥物化學操作和修飾進一步優化SCL38A9調節活性。
在另一個實施方案中,本發明提供了一種或多種TMEM192(NCBI基因ID:201931;SEQ ID NO:2)、SLC12A9(NCBI基因ID:56996;SEQ ID NO:3)或CLCN7(NCBI基因ID:1186;SEQ ID NO:4)的小分子調節劑。在該實施方案的一個方面,小分子調節劑是TMEM192、SLC12A9或CLCN7的抑制劑,并且引起細胞中mTORC1活性的降低。在該實施方案的替代方面,小分子調節劑是TMEM192、SLC12A9或CLCN7的活化劑或激活劑,并且引起細胞中mTORC1活性的增加。在更具體實施方案中,小分子調節劑是TMEM192、SLC12A9或CLCN7的活化劑或激活劑,并且不是精氨酸、賴氨酸或亮氨酸。在另一個實施方案中,小分子調節劑是TMEM192、SLC12A9或CLCN7的活化劑或激活劑,并且是精氨酸、賴氨酸或亮氨酸的模擬物。在所述實施方案的某些方面,小分子調節劑不是具有至少10%精氨酸、賴氨酸或亮氨酸含量的肽或肽類似物(例如肽中至少10%的氨基酸是精氨酸、賴氨酸或亮氨酸中的一種)。TMEM192、SLC12A9或CLCN7的小分子調節劑可通過篩選市售的小分子文庫來鑒別,并且可通過公知的藥物化學操作和修飾進一步優化TMEM192、SLC12A9或CLCN7調節活性。
在另一個實施方案中,本發明提供一種或多種與編碼SLC38A9、TMEM192、SLC12A9或CLCN7中的一種或多種的DNA或mRNA互補并特異性雜交的寡核苷酸,例如siRNA、shRNA或反義寡核苷酸。本發明的寡核苷酸必須能夠降低相應蛋白質的轉錄和/或轉譯。
在另一個實施方案中,本發明提供了調節SLC38A9、TMEM192、SLC12A9或CLCN7中的一種或多種的表達的CRISPR/CAS9體系和方式。CRISPR/CAS9體系及其制備和使用方式是本領域已知的,并且可以用于增加或減少特定基因的表達。因此,在該實施方案的一個方面,CRISPR/CAS9體系引起SLC38A9、TMEM192、SLC12A9或CLCN7中的一種或多種的表達的抑制。在該實施方案的另一方面,CRISPR/CAS9體系引起SLC38A9、TMEM192、SLC12A9或CLCN7中的一種或多種的表達增加。
在另一個實施方案中,本發明提供了一種或多種SLC38A9、TMEM192、SLC12A9或CLCN7基因組開放閱讀框的轉錄的小分子調節劑。所述小分子包括調節一種或多種活化轉錄因子、轉錄共活化劑和轉錄抑制子的存在和活性和/或隨后在SLC38A9、TMEM192、SLC12A9或CLCN7中的一種或多種的啟動子處轉錄機構的募集的小分子。在該實施方案的一個方面,小分子調節劑增加SLC38A9、TMEM192、SLC12A9或CLCN7基因組開放閱讀框中的一種或多種的轉錄。在該實施方案的替代方面,小分子調節劑降低SLC38A9、TMEM192、SLC12A9或CLCN7基因組開放閱讀框中的一種或多種的轉錄。
在另一個實施方案中,本發明提供了SLC38A9、TMEM192、SLC12A9或CLCN7mRNA中的一種或多種的轉譯的小分子調節劑。在該實施方案的一個方面,小分子調節劑增加SLC38A9、TMEM192、SLC12A9或CLCN7mRNA中的一種或多種的轉譯。在該實施方案的替代方面,小分子調節劑降低SLC38A9、TMEM192、SLC12A9或CLCN7mRNA中的一種或多種的轉譯。
在另一個實施方案中,本發明提供了SLC38A9、TMEM192、SLC12A9或CLCN7蛋白水平中的一種或多種的蛋白質降解的小分子調節劑。在該實施方案的一個方面,小分子調節劑增加SLC38A9、TMEM192、SLC12A9或CLCN7蛋白中的一種或多種的降解。在該實施方案的替代方面,小分子調節劑降低SLC38A9、TMEM192、SLC12A9或CLCN7蛋白中的一種或多種的降解。
在另一個實施方案中,本發明提供了減少或消除SLC38A9的糖基化的試劑。在該實施方案的一個方面,所述試劑在SLC38A9的一個或多個氨基酸殘基117、239、248、266或274處引起部分或完全去糖基化。
在相關實施方案中,本發明提供SLC38A9的部分或完全去糖基化形式、SLC38A9的多肽或肽片段、或SLC38A9的多肽或肽片段的同源物。在該實施方案中,SLC38A9或者多肽或肽片段包含SLC38A9的氨基酸殘基117、239、248、266或274中的至少一種。可用于本實施方案的同源物可在對應于殘基SLC38A9中的糖基化信號的一個或多個氨基酸處突變。所述突變可發生在推定為N-糖基化的SLC38A9中的任何天冬酰胺(即,對應于SLC38A9的氨基酸117、239、248、266或274的氨基酸)和/或在緊靠那些推定N-糖基化位點的C-末端的兩個氨基酸中的任一個處,使得三個氨基酸N-糖基化信號被消除。
在另一個實施方案中,本發明提供了增加患者mTORC1活性的方法,其包括向患者施用活化或激活SLC38A9的試劑的步驟。任何上述SLC38A9-活化或激活體系、方法或試劑可用于此目的。
在相關實施方案中,本發明提供了增加患者mTORC1活性的方法,包括向患者施用活化或激活TMEM192、SLC12A9或CLCN7中的一種或多種的試劑的步驟。任何上述TMEM192-、SLC12A9-或CLCN7-活化或激活體系、方法或試劑可用于此目的。
在一些實施方案中,增加mTORC1的方法用于促進肌肉合成代謝,改良肌肉功能,增加肌肉質量,逆轉肌肉萎縮或預防肌肉萎縮。在一些實施方案中,所述方法用于逆轉肌肉萎縮或防止由于因生活方式不活動、由整形外科手術、固定、受試者的年齡或受試者患有或遭受的疾病或病癥引起的不活動引起的肌肉萎縮。在一些實施方案中,所述方法用于逆轉肌肉萎縮或防止由于斷骨、嚴重燒傷、脊柱損傷、截肢、退行性疾病、其中恢復需要受試者臥床休息、留在重癥監護室或長期住院的病狀的肌肉萎縮。在一些實施方案中,所述方法用于治療導致骨骼肌肉萎縮的疾病、病狀或病癥,例如肌肉減少癥、肌肉去神經和肌營養不良。
在一些實施方案中,需要mTORC1活性增加的受試者(例如)由于惡病質或食欲缺乏具有減少的飽腹感。在一些實施方案中,需要mTORC1活性增加的受試者患有或遭受已知與惡病質相關并選自癌癥、AIDS、SARS、慢性心臟衰竭、COPD、類風濕性關節炎、肝病、腎病和創傷的疾病或病狀。在一些實施方案中,受試者患有或遭受已知與吸收障礙相關的疾病或病狀。在一些實施方案中,所述疾病或病狀選自克羅恩氏病(Crohn’s disease)、腸易激綜合征、乳糜瀉和囊性纖維化。在一些實施方案中,受試者患有或遭受營養不良、肌肉減少癥、肌肉去神經、肌營養不良、發炎性肌病、脊髓性肌萎縮(SMA)、肌萎縮性側索硬化(ALS)或重癥肌無力。在一些實施例中,受試者正在準備、參與或最近從空間旅行返回。在一些實施方案中,受試者正在準備、參與或最近從武裝沖突或軍事訓練返回。
在一些實施方案中,所述方法用于治療核糖體病。在一些實施方案中,核糖體病選自戴阿蒙-布粒凡貧血(Diamond-Blackfan anemia)、5q-綜合征、施瓦赫曼戴阿蒙綜合征(Shwachman-Diamond syndrome)、X-連鎖性角化病、軟骨毛發發育不全和特雷徹柯林斯綜合征(Treacher Collins syndrome)。
在一些實施方案中,所述方法用于治療粘連病(例如,羅伯茨綜合征(Roberts syndrome)和狄蘭氏綜合征(Cornelia de Lange syndrome))。
在一些實施方案中,增加mTORC1活性的方法用于防止患者的自噬。在一些實施方案中,受試者以依賴于自噬的誘導的方式患有或遭受療法抗性癌癥。
在一些實施方案中,所述方法用于治療或預防抑郁癥。在一些實施方案中,所述方法用于治療或預防特征在于耗盡的氨基酸水平的孤獨癥形式。在一些實施方案中,增加mTORC1活性的方法用于治療或預防時差反應。
在一些實施方案中,所述方法用于預防或逆轉受試者的心肌萎縮。在一些實施方案中,受試者患有或已經患有選自心臟病發作、充血性心臟衰竭、心臟移植、心臟瓣膜修復、動脈粥樣硬化、其它主要血管疾病和心臟旁路手術的疾病或病狀。
在一些實施方案中,增加mTORC1活性的方法用于增加運動后的強度和/或增加肌肉質量。在一些實施方案中,所述方法與物理治療結合實施,作為全非經腸營養的一部分,或促進功能性電刺激。
在另一個實施方案中,本發明提供了降低患者mTORC1活性的方法,其包括向患者施用抑制SLC38A9的試劑的步驟。任何上述SLC38A9抑制體系、方法或試劑可用于該目的。在該實施方案的一個方面,患者是器官移植受體,需要免疫抑制,是支架受者,患有或遭受動脈狹窄或處于發展動脈狹窄的風險中,或者患有或遭受癌癥,特別是其中由監管機構推薦或批準經雷帕霉素治療的癌癥。在該實施方案的另一方面,患者遭受選自以下的疾病或病狀:代謝性疾病(例如2型糖尿病、肥胖癥、非酒精性脂肪性肝炎(NASH)和高脂血癥)、神經變性疾病(例如阿爾茨海默病、帕金森氏病、亨廷頓氏病(Huntington’s Disease)和肌萎縮性側索硬化)、自身免疫疾病(例如牛皮癬、類風濕性關節炎、多發性硬化、系統性紅斑狼瘡、痛風、過敏性鼻炎、克羅恩氏病和潰瘍性結腸炎)、罕見和線粒體疾病(例如,利氏綜合征、弗里德賴希氏共濟失調(Friedreich’s Ataxia)、心肌病、萊伯氏遺傳性視神經病(Leber’s Hereditary Optic Neuropathy)、淋巴管平滑肌瘤病、結節性硬化、龐貝病(Pompe Disease)(糖原貯積病II)和溶酶體貯積病)、心血管疾病(例如心肌病、心臟衰竭、缺血性心臟病(動脈粥樣硬化疾病)、缺血性中風和肺動脈高壓)、腎病(例如糖尿病性腎病、多囊腎病和急性腎損傷)、神經精神疾病(例如癲癇、孤獨癥譜系病癥和抑郁病癥)和腫瘤疾病(例如腎細胞癌、實體瘤、血液癌癥)。
在相關實施方案中,本發明提供了用于降低患者mTORC1活性的方法,包括向患者施用抑制TMEM192、SLC12A9或CLCN7中的一種或多種的試劑的步驟。任何上述TMEM192-、SLC12A9-或CLCN7-抑制體系、方法或試劑可用于此目的。在所述實施方案的一個方面,患者是器官移植受體,需要免疫抑制,是支架受體,患有或遭受動脈狹窄或處于發展動脈狹窄的危險中,或者患有或遭受癌癥,特別是其中由監管機構推薦或批準經雷帕霉素治療的癌癥、特征在于通過沖擊mTORC1或由mTORC1調節的信號傳導路徑導致活性增加的遺傳擾動的癌癥亞型、或上調自噬的癌癥亞型。在該實施方案的另一相關方面,患者患有或遭受肥胖癥、由代謝功能障礙(例如2型糖尿病、代謝綜合征、β-細胞功能障礙)引起的疾病、心肌病、自身免疫疾病(例如牛皮癬、狼瘡)、神經變性疾病(例如阿爾茨海默氏病、亨廷頓氏病、帕金森氏病)、與異常mTORC1活化相關的神經性病癥(例如結節性硬化癥綜合征、神經纖維瘤病、脆性X染色體綜合征、PTEN相關病狀、孤獨癥和孤獨癥譜系障礙、癲癇和癲癇發作)、導致線粒體功能障礙的遺傳性疾病(例如利氏綜合征、弗里德賴希共濟失調)或導致mTORC1信號傳導活性過度的遺傳性疾病(例如結節性硬化癥、淋巴管平滑肌瘤病)。在該實施方案的替代方面,患者遭受選自以下的疾病或病狀:代謝性疾病(例如2型糖尿病、肥胖癥、非酒精性脂肪性肝炎(NASH)和高脂血癥)、神經變性疾病(例如阿爾茨海默病、帕金森氏病、亨廷頓氏病和肌萎縮性側索硬化)、自身免疫疾病(例如牛皮癬、類風濕性關節炎、多發性硬化、系統性紅斑狼瘡、痛風、過敏性鼻炎、克羅恩氏病和潰瘍性結腸炎)、罕見和線粒體性疾病(例如利氏綜合征、弗里德賴希氏共濟失調性心肌病、萊伯氏遺傳性視神經病、淋巴管平滑肌瘤病、結節性硬化、龐貝病(糖原貯積病II)和溶酶體貯積病)、心血管疾病(例如心肌病、心臟衰竭、缺血性心臟病(動脈粥樣硬化疾病)、缺血性中風和肺動脈高壓)、腎病(例如糖尿病性腎病、多囊腎病和急性腎損傷)、神經精神疾病(例如癲癇、孤獨癥譜系障礙和抑郁病癥)和腫瘤疾病(例如腎細胞癌、實體瘤、血液癌癥)。
在另一個實施方案中,本發明提供了鑒別SLC38A9調節劑的方法,其包括以下步驟:a)使測試化合物與包含SLC38A9.1或SLC38A9.1的片段或突變體的多肽接觸,其中所述多肽具有SLC38A9.1活性或特性;b)測量在測試化合物存在下的SLC38A9.1活性或特性;和c)將測量的活性或特性與不存在測試化合物下的相同活性或特性進行比較,由此確定測試化合物是否是SLC38A9的調節劑。
這些方法可采用細胞體系,其中SLC38A9或其片段或突變體經工程化以駐留在質膜上(例如通過將N末端融合至質膜信號序列,例如H-Ras-的最后25個氨基酸(QHKLRKLNPPDESGPGCMSCKCVLS;SEQ ID NO:5);經工程化以在質膜(例如非洲爪蟾卵母細胞)處表達SLC38A9或其片段或突變體的非哺乳動物細胞體系;體外體系,其中SLC38A9或其片段或其突變體附接到固體載體;以及其中SLC38A9或其片段或突變體在溶液中游離的體外體系。
在這些方法中待測量的活性或特性包括在細胞體系中攝取經標記的(例如,放射性標記的、熒光標記的)氨基酸(例如精氨酸、組氨酸或賴氨酸)、在細胞體系中攝取鈉、在細胞體系中跨膜的膜電位的變化、在體外體系中氨基酸與SLC38A9或其片段或突變體的結合;在體外體系中測試化合物與SLC38A9或其片段或突變體的結合;在體內和體外系統中SLC38A9或其片段或突變體結合Ragulator的能力的變化;和mTORC1的一種或多種活性的變化(例如,S6K1的磷酸化狀態的變化)。
這些活性的測量可通過以下方式來實現:對放射性標記的氨基酸進行閃爍計數;流式細胞術、熒光微板或用于熒光氨基酸的分光熒光光度計,并測量膜電位的變化(例如,響應于膜電位變化而改變熒光的染料,例如FLIPR染料(Molecular Devices);用于測量跨膜的電流的膜片鉗;用以測量測試化合物的氨基酸結合或直接結合的變化的固相表面等離子體共振;以及用以測量測試化合物的氨基酸結合或直接結合的變化的質譜法。
在所述方法中待使用的SLC38A9.1的片段或突變體的選擇將取決于待測量的活性。缺少氨基酸1-110的片段以及SLC38A9同種型2和4不與Ragulator相互作用,且因此當待測量的活性依賴于Ragulator相互作用時應避免。然而,缺少氨基酸1-110的片段仍然結合并轉運氨基酸,且因此可用于直接或間接測量氨基酸結合和轉運的分析中。在一個實施方案中,完整的SLC38A9.1或SLC38A9.1Δ110用于直接或間接測量氨基酸結合和轉運的分析中。
包含SLC38A9.1或SLC38A9的片段或突變體的多肽還可以包括賦予多肽其它所需性質的其它氨基酸序列,其可用于這些方法中。在一些實施方案中,多肽另外包含在N或C末端的標簽,其有助于多肽的重組產生和/或多肽的分離。所述標簽包括組氨酸或多聚組氨酸標簽、表位標簽(例如FLAG或HA多肽融合物)或配體標簽(例如生物素),其可直接或通過連接體共價結合于SLC38A9.1或其片段或突變體。在一些實施方案中,多肽另外包含將多肽靶向質膜的信號序列(例如,H-Ras的最后25個氨基酸-QHKLRKLNPPDESGPGCMSCKCVLS;SEQ ID NO:5)。在一些實施方案中,多肽另外包含熒光或生物發光標簽或多肽序列(例如,與綠色熒光蛋白、黃色熒光蛋白、紅色熒光蛋白或熒光素酶融合)。
所述方法的具體實例闡述于以下實施例中。
應理解,本文公開的本發明在其應用中不限于說明書中闡述的或示例的詳情。本發明涵蓋其它實施方案,并且能夠以各種方式實踐或實施。此外,應理解,本文中使用的措辭和術語是為了說明的目的,而不應被認為是限制性的。
除非明確地指示相反的情形,否則本文在說明書和權利要求書中使用的冠詞“一”(“a”和“an”)應當理解為包括復數個指示物。除非指示相反的情形或從上下文顯而易見,否則如果一個、多于一個或所有組成員存在于、用于或以其它方式與給定產品或過程相關,則認為滿足包括組的一個或多個成員之間的“或”的權利要求書或說明。本發明包括其中組中僅一個成員存在于、用于或以其它方式與給定產品或過程相關的實施方案。本發明還包括其中多于一個或整個組成員存在于、用于或以其它方式與給定產品或過程相關的實施方案。此外,應理解,本發明涵蓋其中來自所列權利要求書中的一個或多個的一個或多個限制、要素、條款、描述性術語等被引入依賴于相同的基本權利要求(或者相關、任何其它權利要求)的另一權利要求中的所有變化、組合和排列,除非另有說明或者除非本領域的普通技術人員明白將會出現矛盾或不一致。在要素提供為列表(例如,以馬庫什組(Markush group)或類似格式)的情況下,應理解,還公開了要素的每個子組,并且可以從組中移除任何要素。應理解,一般來說,在本發明或本發明的方面被稱為包括特定要素、特征等的情況下,本發明的某些實施方案或本發明的方面由所述要素、特征等組成或基本上由其組成。為了簡單的目的,那些實施方案在每種情況下都沒有以這么多詞語具體闡述于本文中。還應理解,本發明的任何實施方案或方面可從權利要求中明確地排除,而不管在說明書中是否列舉了特定的排除。本文引用的描述本發明背景并提供關于其實踐的額外詳情的出版物和其它參考資料通過引用方式并入本文。
實施例
實施例1. SLC38A9與Ragulator相互作用。
尚不清楚氨基酸的存在或缺乏如何觸發介導mTORC1的易位和活化的溶酶體蛋白的復雜網絡。一個假設是推定的氨基酸傳感器將直接與參與mTORC1信號傳導的溶酶體復合物之一相互作用。為了檢驗此假設,我們最初集中于Ragulator復合物,并在保持蛋白質-蛋白質相互作用的條件下執行從穩定表達各種FLAG標記蛋白的HEK-293T細胞的免疫沉淀。
所有人類SLC38A9同種型(天然的和密碼子優化的)的cDNA是由GenScript基因合成的。通過PCR擴增cDNA,并將產物亞克隆到HA-pRK5和FLAG-pRK5的Sal I和Not I位點。使用QuikChange II試劑盒(Agilent)用獲自Integrated DNA Technologies的寡核苷酸誘變cDNA。通過DNA測序驗證所有構筑體。
通過PCR擴增FLAG標記的SLC38A9同種型和SLC38A9N末端1-119并將其克隆到pLJM60的Sal I和EcoR I位點或pMX的Pac I和EcoR I位點。在序列驗證后,如下所述,在cDNA轉染中使用這些質粒或產生生成穩定表達蛋白質的細胞系所需的慢病毒。
將HEK-293T細胞在補充有10%滅活的胎牛血清、青霉素(100IU/mL)和鏈霉素(100μg/mL)的DMEM中培養并保持在37℃和5%CO2下。將200萬個HEK-293T細胞鋪在10cm培養皿中。24小時后,用圖中所示的基于pRK5的cDNA表達質粒以下列量轉染細胞:500ng FLAG-metap2;50ng FLAG-LAMP1;100ng FLAG-RagB和100ng HA-RagC;300ng FLAG-SLC38A9.1;600ng FLAG-SLC38A9.1Δ110;200ng FLAG-SLC38A9.4;400ng SLC38A9.1的FLAG-N-末端119片段;200ng FLAG-RagC;200ng FLAG-RagC S75N;200ng FLAG-RagC Q120L;400ng HAGST-RagB;400ng HAGST-RagB T54N;400ng HAGST-RagB Q99L。
使用空的pRK5將轉染混合物吸收到總共5μg的DNA。將穩定表達FLAG標記的蛋白質的HEK-293T細胞用冰冷的PBS沖洗一次,并在冰冷的溶解緩沖液(40mM HEPES pH7.4、1%Triton X-100、10mMβ-磷酸甘油酯、10mM焦磷酸鹽、2.5mM MgCl2和1片無EDTA的蛋白酶抑制劑(Roche)/25ml緩沖液)中溶解。通過在微量離心機中以13,000rpm離心10分鐘來分離來自細胞溶解物的可溶性級分。對于免疫沉淀,向每個溶解物中添加30μL 50%的抗FLAG親和凝膠(Sigma)漿液,并于4℃下旋轉培育2-3小時。用含有500mM NaCl的溶解緩沖液洗滌免疫沉淀物三次。通過添加50μL試樣緩沖液并在室溫下培育30分鐘使免疫沉淀的蛋白質變性。關鍵的是,在通過SDS-PAGE拆分和通過免疫印跡分析來分析之前,含有SLC38A9的試樣既不煮沸也不冷凍。當制備用于質譜的試樣時使用類似的方案。
如下所述制備來自3000萬個穩定表達FLAG-metap2、FLAG-p18、FLAG-p14、FLAG-HBXIP、FLAG-c7orf59和FLAG-RagB的HEK-293T細胞的免疫沉淀物。將蛋白質用來自抗FLAG親和珠粒的FLAG肽(序列DYKDDDDK)洗脫,在4-12%凝膠(Invitrogen)上拆分,并用SimplyBlueTM SafeStain(Invitrogen)染色。將每個凝膠泳道切成10-12個片,并且將每個凝膠切片中的蛋白質用胰蛋白酶消化過夜。隨后將所得的消化物進行液相色譜,然后進行串聯質譜(LC-MS-MS)以進行蛋白質鑒別。作為共轉運蛋白的氨基酸/鈉家族的成員的SLC38A9(NCBI基因ID:153129)存在于所有Ragulator組分特異性免疫沉淀中,以及在一定程度上存在于RagB的免疫沉淀中,但不存在于對照蛋白Metap2的免疫沉淀中。
為確認LC-MS-MS數據,我們使用上述方案用SLC38A9.1的FLAG標記的構筑體轉染HEK-293T細胞,并且能夠免疫沉淀內源性Ragulator蛋白(如通過其p14和p18組分所檢測)以及RagA和RagC。其它FLAG標記的溶酶體膜蛋白LAMP1、SC36A1和SLC38A7并不免疫沉淀p14、p18、RagA或RagC中的任一種(圖1D和圖6A)。我們還能夠證明重組表位標記的SLC38A9和共表達的表位標記的Ragulator蛋白之間的結合。
已確認指示SLC38A9與Ragulator相互作用的質譜數據,我們開始確定SLC38A9的哪個區域負責其與Ragulator的相互作用。針對SLC38A9存在4種由NCBI注釋之不同同種型;同種型1(SEQ ID NO:1)是全長蛋白;同種型2缺失SEQ ID NO:1的N-末端的前63個氨基酸;同種型3具有較短的經修飾的N-末端和截短的C-末端;并且同種型4缺失在第一跨膜結構域(AA1-119)之前的整個N-末端區。我們在HEK-293T細胞中表達同種型1、2和4、以及缺少其前110個氨基酸的SLC38A9.1的突變體(SLC38A9.1Δ110),并且發現同種型1與Ragulator強烈結合,而同種型2、4或SLC38A9.1Δ110能夠免疫沉淀內源性或共轉染的Ragulator蛋白(圖6,B和C)。
鑒于同種型4不能沉淀Ragulator組分,我們主要關注可能負責介導SLC38A9與Ragulator之間的相互作用的N-末端(AA1-119)。我們開發僅由SLC38A9的N末端氨基酸殘基1-119組成的N末端FLAG標記的構筑體,并且發現對于免疫沉淀來說Ragulator是必要和充分的(圖1A和圖6C)。我們觀察人類、斑馬魚和秀麗隱桿線蟲之間的保守殘基,并且發現氨基酸59-90是強烈保守的。在AA1-119構筑體中用丙氨酸取代每個殘基以下將突變鑒別為破壞SLC38A9的N-末端區域與Ragulator的結合:I68A、Y71A、L74A、P85A、V89A、P90A。在此區域內不破壞相互作用的丙氨酸取代包括D59A、H60A、S62A、S72A、R73A、P77A、D86A和V88A。我們推斷出,Ragulator-SLC38A9.1相互作用需要I68、Y71、L74、P85和P90(圖1E)。
鑒于其與其它氨基酸轉運蛋白的同源性,在氨基酸飽和和氨基酸缺陷培養條件下在全長SLC38A9和Ragulator蛋白之間進行免疫沉淀分析。我們發現SLC38A9與Ragulator蛋白之間的相互作用由類似于在Ragulator與Rag蛋白之間觀察到的氨基酸條件調節。當僅用SLC38A9的N-末端(SEQ ID NO:1的氨基酸1-119)重復此測定時,未觀察到響應氨基酸水平的任何變化。因此,認為SCL38A9與Ragulator之間的相互作用將被氨基酸修飾,并且這種調節對于其作為響應氨基酸的mTORC1信號傳導的調節劑的功能是重要的。很可能SLC38A9的跨膜區域需要介導對氨基酸的反應。
v-ATP酶及其活性對于mTORC1途徑的氨基酸傳感是必需的,并且與SLC38A9.1一樣,其與穩定表達的FLAG標記的Ragulator共免疫沉淀。這指示除了Ragulator和Rag GTP酶之外,還存在與v-ATP酶的內源組分相關的穩定表達的SLC38A9.1、而非LAMP1的超復合物(圖1C)。雖然SLC38A9.2不與Ragulator相互作用,但其與v-ATP酶共免疫沉淀,不過比SLC38A9.1的量更少(圖1C)。這表明SLC38A9.1與v-ATP酶之間的相互作用并非通過Ragulator介導,而是直接或間接通過含有其跨膜結構域的SLC38A9.1區域介導。符合這種解釋,SLC38A9.1的N-末端結構域與Ragulator強烈相互作用,不會共免疫沉淀vATP酶(圖1C)。
實施例2. SLC38A9定位于溶酶體膜。
鑒于SLC38A9與Ragulator的強相互作用及其與含有規范的5+5跨膜結構的其它SLC38家族成員的同源性,預測SLC38A9定位于溶酶體膜。
將HEK-293T細胞以300,000個細胞/孔鋪在6孔組織培養皿中的纖連蛋白涂布的玻璃蓋玻片上。12-16小時后,將載玻片用PBS沖洗一次,并在-20℃下用冰冷的100%甲醇(用于SLC38A9檢測)一步固定和滲透15min。在用PBS沖洗兩次后,在室溫下將載玻片與5%正常驢血清中的一級抗體(FLAG CST 1:300,LAMP2 1:400)一起培育1小時,用PBS沖洗四次,在室溫下在黑暗中與驢中產生的二級抗體(在5%正常驢血清中1:400稀釋)一起培育45分鐘,并用PBS洗滌四次。使用具有DAPI(Vector Laboratories)的Vectashield將載玻片安裝在玻璃蓋玻片上,并在旋轉盤共聚焦系統(Perkin Elmer)上成像。
免疫熒光成像測定SLC38A9的所有表位標記的同種型與lamp 2共定位,指示SLC38A9是溶酶體膜蛋白(圖2A和圖7、A和B)。還對缺乏Ragulator組分的兩種不同的小鼠胚胎成纖維細胞中的SLC38A9和lamp2染色,且SLC38A9繼續定位于溶酶體,指示其不需要Ragulator進行其溶酶體定位。與此發現一致,通過去除其脂質錨定將Ragulator定位于細胞質不改變SLC38A9的溶酶體定位,突變體Ragulator也不與SLC38A9.1相互作用(圖7C)。所述數據指示SLC38A9是溶酶體膜蛋白,其不需要其N末端或Ragulator定位于溶酶體。
制備編碼shRNA的慢病毒,并如下所述轉導至HEK-293T細胞中。通過使用XTremeGene 9轉染試劑(Roche)將pLJM1/pLJM60慢病毒轉移載體與VSV-G包膜和CMVΔVPR包裝質粒共轉染至病毒HEK-293T細胞4中產生慢病毒。對于HeLa細胞、LN229細胞和MEF的感染,通過將pMX逆轉錄病毒轉移載體與VSV-G包膜和Gag/Pol包裝質粒共轉染至病毒HEK-293T細胞中產生逆轉錄病毒。在轉染后24小時,將培養基更換為補充有30%IFS的DME。轉染后48小時收集含有病毒的上清液,并通過0.45μm過濾器以消除細胞。將6孔組織培養板中的靶細胞在含有8μg/mL聚凝胺的培養基中感染,并通過以2,200rpm離心1小時實施自旋感染。感染后24小時,去除病毒并用合適的抗生素選擇細胞。
從RNAi Consortium 3(TRC3)獲得的對照shRNA和靶向人SLC38A9的那些shRNA的序列如下(5'至3'):
SLC38A9編號1:GCCTTGACAACAGTTCTATAT(TRCN0000151238)(SEQ ID NO:6);
SLC38A9編號2:CCTCTACTGTTTGGGACAGTA(TRCN0000156474)(SEQ ID NO:7);
GFP:TGCCCGACAACCACTACCTGA(TRCN0000072186)(SEQ ID NO:8)。
在基于siRNA的實驗中,將200,000個HEK-293T細胞鋪在6孔板中。24小時后,使用DharmaFECT 1(Dharmacon)用250nM靶向SLC38A9的siRNA(Dharmacon)池或非靶向池轉染細胞。轉染后48小時,再次轉染細胞,但此時用雙倍量的siRNA。在第二次轉染后24小時,用冰冷的PBS沖洗細胞,溶解,并如上所述進行免疫印跡分析。使用以下siRNA:非靶向:ON-TARGET加非靶向池(D-001810-10-05)SLC38A9:SMART池:ON-TARGET加SLC38A9(L-007337-02-0005)
HEK-293T細胞中ShRNA-或siRNA介導的SLC38A9的耗盡抑制氨基酸對mTORC1的活化,如通過其已確定的底物核糖體蛋白S6激酶1(S6K1)的磷酸化所檢測(圖2B和圖7D)。因此,如Ragulator的五個已知亞單位一樣,SLC38A9.1是mTORC1路徑的正性組分。不受限于理論,我們認為SLC38A9.1是溶酶體膜蛋白,其通過其N-末端119個氨基酸(“Ragulator-結合結構域”)與Ragulator和Rag GTP酶相互作用,并且是mTORC1活化所需的。
實施例3.SLC38A9過表達活化mTORC1。
已經確定SCL38A9與Ragulator在溶酶體處強烈相互作用,我們希望了解SLC38A9在調節mTORC1活性中的功能。鑒于SLC38家族參與氨基酸的轉運,測試SLC38A9的過表達是否響應氨基酸調節mTORC1信號傳導。在培養基中的野生型細胞中,氨基酸撤除導致mTORC1信號傳導的抑制。
將100萬個HEK-293T細胞鋪在10cm培養皿中。24小時后,用圖中指示的基于pRK5的cDNA表達質粒以下列量轉染細胞:500ng HA-metap2;50ng HA-LAMP1;200ng HA-SLC38A9.1;500ng HA-SLC38A9.1Δ110;200ng HASLC38A9.4;100ng HA-RagB T54N和100ng HA-RagC Q120L;2ng FLAG-S6K1。轉染后72小時,將細胞洗滌一次,之后與不含氨基酸的RPMI一起培育50-min。在收獲前用媒劑或氨基酸(至終濃度等效于RPMI)刺激細胞。
SLC38A9同種型1在HEK-293T細胞中的瞬時或穩定過表達使mTORC1信號傳導對總氨基酸饑餓或僅亮氨酸或精氨酸饑餓具有抗性,如通過外源S6K1(mTORC1活性的確定的報告子)的蘇氨酸389(T398)的磷酸化所測量(圖3A和8A)。與其對mTORC1的效應相稱,SLC38A9.1過表達抑制由氨基酸饑餓引起的自噬的誘導(圖8C)。
不與Ragulator和Rag GTP酶相互作用的SLC38A9的變體(包括SLC38A9.2、SLC38A9.4和SLC38A9.1Δ110和SLC38A9.1I68A突變體)的瞬時過表達在氨基酸撤除后不能維持mTORC1信號傳導(圖3B和C和圖8A)。
SLC38A9.1過表達也在HEK-293E、HeLa和LN229細胞以及小鼠胚胎成纖維細胞(MEF)中不存在氨基酸下活化mTORC1,活化程度與表達的SLC38A9.1的量成正比例(圖8B)。有趣的是,僅SLC38A9.1的Ragulator結合結構域的過表達模擬全長蛋白對mTORC1信號傳導的效應(圖3D),指示當與SLC38A9.1的跨膜部分分離時,其可以采取活性狀態。
我們還使用CRISPR/CAS9制備SLC38A9.1敲除。將設計為SLC38A9的N-末端(氨基酸1-119)或下文公開的AAVS1基因座的CRISPR/CAS9指導序列克隆到pX459中。
AAVS1:GGGGCCACTAGGGACAGGAT(SEQ ID NO:9)
SLC38A9_1:GGCTCAAACTGGATATTCATAGG(SEQ ID NO:10)
SLC38A9_2:GGAGCTGGAACTACATGGTCTGG(SEQ ID NO:11)
將HEK-293T細胞(750,000/孔)鋪在6孔皿中,并且使用XtremeGene9在16小時后用1μg表達上述指導序列(guide)的pX459轉染。48小時后將細胞胰蛋白酶化,施用2mg/mL嘌呤霉素72小時,并允許恢復幾天。當細胞接近匯合時,將其單細胞分選到含有30%血清和條件培養基的96孔板中。擴增克隆并通過SLC38A9的蛋白印跡分析(western analysis)評估敲除狀態。如上所述評價所述克隆的氨基酸反應。
使用CRISPR/CAS9基因組編輯技術的耗盡SLC38A9的HEK-293T細胞展現了響應氨基酸刺激的mTORC1活化的部分抑制。基于所述數據,假設SLC38A9是響應氨基酸的mTORC1信號傳導的正調節子。
實施例4.潛在SLC38A9結合配偶體的LC-MS-MS鑒別。
使用LC-MS-MS,將TMEM192(NCBI基因ID:201931)、SLC12A9(NCBI基因ID:56996)和CLCN7(NCBI基因ID:1186)鑒別潛在蛋白結合配偶體,SLC38A9可與其同源寡聚化和/或異源寡聚化。認為SLC38A9可能與這些其它蛋白質中的一種或多種相關,作為其作為mTORC1上游的氨基酸傳感器的功能的一部分。
實施例5.SLC38A9的糖基化分析。
在通過SDS-PAGE解析SLC38A9的表達中,觀察到比預期更高的分子量的蛋白質條帶。此類似于觀察到的糖基化膜蛋白的型式。因此,我們對SLC38A9的序列進行了生物信息學分析,且發現殘基117、239、248、266和274潛在經N-糖基化。不受限于理論,我們認為糖基化可在作為mTORC1信號傳導的氨基酸傳感器和調節子的SLC38A9的定位和功能中起作用。糖基化還可保護蛋白SLC38A9免于由溶酶體蛋白酶裂解。
實施例6.由氨基酸調節SLC38A9-Rag-Ragulator相互作用
氨基酸調節氨基酸傳感路徑的許多已確定的組分之間的相互作用,因此我們測試SLC38A9.1-Ragulator-Rag復合物是否也是這種情況。
將HEK-293T細胞(150,000/孔)鋪在纖連蛋白涂布的12孔盤上,并在12小時后使用XtremeGene9以下述量用圖中指示的基于pRK5的cDNA表達質粒轉染:400ng LAMP1-FLAG、400ng FLAGSLC38A9.1、400ng SLC38A2-FLAG、150ng PQLC2-FLAG和50ng GFP。使用空的pRK5將轉染混合物吸收到總共2μg DNA。48小時后通過以下方式分析細胞:在轉運緩沖液(140mM NaCl、5mM KCl、2mM MgCl2、2mM CaCl2、30mM Tris-HCl(pH 7.4)、5mM葡萄糖)中洗滌兩次,于37℃下在轉運緩沖液中培育5分鐘,之后于37℃下于指示pH(通過MES緩沖為pH 5、通過Tris緩沖為pH 8)下用補充有氨基酸(未標記和總濃度為380μM的0.1μCi[14C]亮氨酸、或未標記和RPMI中發現的總濃度的0.1μCi[14C]氨基酸、或未標記和總濃度為3mM的0.2μCi[14C]精氨酸)的新鮮緩沖液更換緩沖液達10分鐘。攝取后,將細胞在冰冷的轉運緩沖液中洗滌兩次,并在0.5mL的1%SDS中收獲用于閃爍計數。
實際上,氨基酸饑餓增強了穩定表達的或內源性Ragulator與內源性SLC38A9之間的相互作用(圖4A、圖9);以及穩定表達的SLC38A9.1與內源性Ragulator和Rag之間的相互作用(圖4B)。當細胞被剝奪亮氨酸或精氨酸時和僅用亮氨酸或精氨酸刺激時,我們獲得類似的結果(圖4A)。奇怪的是,盡管SLC38A9.1的N-末端結構域容易結合Ragulator,但是相互作用對氨基酸不敏感(圖4B),表明跨膜區是賦予氨基酸反應性所必需的。
由于氨基酸饑餓改變Rag GTP酶的核苷酸狀態,我們測試SLC38A9是否與鎖定其核苷酸狀態的Rag的突變體有差異地相互作用。含有模擬GDP-結合狀態的RagBT54N的表位標記的RagB-RagC的異源二聚體與含有野生型RagB的異源二聚體相比,與更多的內源性SLC38A9相關(圖4C)。相比之下,含有缺乏GTP酶活性并因此結合于GTP的RagBQ99L的異源二聚體與SLC38A9的相互作用非常弱(圖4C)。因此,如Ragulator一樣,SLC38A9最好與Rag異源二聚體相互作用,其中RagA/B裝載有GDP,此與SLC38A9與Ragulator的結合且Ragulator是RagA/B的GEF一致。所述結果表明,SLC38A9.1與Rag-Ragulator的相互作用的氨基酸調節很大程度上反映氨基酸誘導的Rag GTP酶的核苷酸狀態的改變。由于RagB突變對Rag GTP酶與SLC38A9的相互作用比對于Ragulator的相互作用具有更大的效應(在圖4C中比較SLC38A9印跡與對于p14和p18的印跡),Rag異源二聚體很可能與SLC38A9進行Ragulator非依賴性接觸,此影響Rag-SLC38A9相互作用的穩定性。
實施例6. SLC38A9.1是氨基酸轉運蛋白
我們不能在活細胞中檢測到SLC38A9.1介導的氨基酸轉運或氨基酸誘導的鈉電流,在所述活細胞中SLC38A9.1高度過表達以至于一些到達質膜(圖10,A-E)。由于所述實驗分別被內源性轉運蛋白的存在混雜或依賴于轉運的間接測量,所以將SLC38A9.1或SLC38A9-Δ110重構至脂質體中,以直接分析放射性標記的氨基酸的轉運。
除了將細胞在40mM HEPES(pH7.4)、0.5%Triton X-100、1mM DTT和蛋白酶抑制劑中溶解之外,如上所述收獲穩定表達FLAG-SLC38A9.1的HEK-293T細胞用于免疫沉淀。3小時免疫沉淀后,將FLAG-親和珠粒在補充有500mM NaCl的溶解緩沖液中洗滌兩次,每次5min。用補充有10%甘油的內部緩沖液(20mM MES pH 5、90mM KCl、10mM NaCl)將珠粒洗滌5次以使其平衡。通過旋轉30分鐘在含有1mg/mL FLAG肽的補充有甘油的內部緩沖液中洗脫FLAG親和純化的SLC38A9.1蛋白。使用Amicon離心過濾器將蛋白濃縮至約1mg/mL,并在液氮中快速冷凍并儲存在-80℃下。
如下進行SLC38A9-Δ110的純化。將2升用His-SLC38A9-Δ110瞬時轉染的懸浮液293F細胞沉淀,并將所得細胞漿使用杜恩斯(dounce)勻漿器在25mM Tris、10mM MgCl2、20mM KCl(pH 7.5)中進行3輪勻漿,然后超離心。第三輪后,所得細胞沉淀使用杜恩斯勻漿器在25mM Tris、1M NaCl、10mM MgCl2、20mM KCl(pH 7.5)中進行另外3輪的勻漿,然后超離心。然后將所得沉淀懸浮在25mM Hepes、150mM NaCl、5%甘油、2%DDM(pH7.5)(加蛋白酶抑制劑片劑)中,并培育過夜,然后超離心并收集所得上清液。將His-SLC38A9-Δ110通過鈷親和柱從所得上清液中純化,并在25mM Hepes、150mM NaCl、5%甘油、0.05%DDM(pH7.5)中的250mM咪唑中洗脫。
為形成脂質體,使用干燥氮氣蒸發氯仿溶解的磷脂酰膽堿(PC,50mg)以在圓底燒瓶中產生脂質膜并在真空下干燥過夜。脂質在緩沖液中以50mg/mL在水浴(Branson M2800H)中以輕微超聲處理水合,并在Eppendorf管中分成100μL等分部分。使用水浴超聲處理使等分的脂質澄清,重組并通過具有15個通道的100nm膜(Avanti 61000)擠出。通過在4℃下旋轉30分鐘引發重構反應(15μg FLAG-SLC38A9.1蛋白或15μg His-SLC38A9-Δ110、7.5mg Triton X-100、10mg擠出的PC、1mM DTT,在內部緩沖液中高達700μL)。在僅脂質體對照中使用補充甘油的緩沖液代替SLC38A9.1蛋白。通過在甲醇中洗滌1次、在水中洗滌5次和在內部緩沖液中洗滌2次制備生物珠粒(200mg/反應)。將重構反應應用于生物珠粒1小時,轉移至新鮮生物珠粒過夜,并再次轉移至新鮮的生物珠粒達1小時。
為分析氨基酸轉運,將所有緩沖液冷凍并在4℃冷室中進行分析。對于時程實驗,將SLC38A9.1蛋白磷脂體或脂質體對照上樣于經外部緩沖液(20mM Tris pH 7.4、100mM NaCl)平衡的PD10柱并根據制造商的說明書洗脫。通過添加0.5μM[3H]精氨酸引發氨基酸攝取,并在30℃水浴中培育。通過取分析反應的級分并將其上樣于經外部緩沖液預平衡的PD10柱來收集時間點。將柱以1.75mL的級分或單次洗脫進行洗脫,并添加到5mL閃爍液中。為獲得氨基酸濃度的準確測量,將等體積的外部緩沖液添加到標準品中的閃爍液中。
對于使用未標記的氨基酸的競爭實驗,由于SLC38A9.1輸入活性的高Km(約39mM),需要高濃度的氨基酸。將SLC38A9.1蛋白磷脂體或脂質體對照在TLA-100.3轉子中以100,000g離心30min,并重懸浮于較小體積的外部緩沖液中,使得其可添加到補充有外部緩沖液組分的較大體積的100mM未標記的氨基酸(終濃度)中。由于約130mM的亮氨酸的溶解度限制,我們必須采用此種程序。在這樣高的濃度下,重要的是將所有氨基酸溶液調節至pH 7.4。通過向氨基酸緩沖溶液中添加0.5μM[3H]精氨酸、隨后添加SLC38A9.1蛋白磷脂體或脂質體對照來啟動分析。
對于穩態動力學實驗,如上所述收集時間點并且為了評估底物特異性,在75min收集競爭實驗。對于流出實驗,如上所述用[3H]精氨酸裝載SLC38A9.1蛋白磷脂體或脂質體對照,用于輸入分析1.5小時。為去除外部氨基酸,將反應物上樣于經外部緩沖液預平衡的PD10柱,并如上所述收集時間點。從SLC38A9.1蛋白磷脂體的閃爍計數減去脂質體對照的閃爍計數。
單向插入脂質體中的親和純化的SLC38A9.1或SCL38A9Δ110各自呈現放射性標記的精氨酸的時間依賴性攝取,而含有LAMP1的那些與和脂質體類似量的精氨酸相互作用(圖5A、圖11、圖10F)。穩態動力學實驗顯示,SLC38A9.1具有約39mM的米氏常數(Michaelis constant,Km)和約1.8min-1的催化速率常數(kcat)(圖5B),指示SLC38A9.1是低親和力氨基酸轉運蛋白。SLC38A9.1也可以從蛋白磷脂體中排出精氨酸(圖5C),但是其在脂質體中的取向使得不可能獲得用于此活性的準確的Km和kcat測量。很可能,由于必須以“反向”方向測定轉運蛋白,我們低估了其在從溶酶體中輸出期間對氨基酸的親和力。
為了評估SLC38A9.1的底物特異性,我們使用未標記的氨基酸進行競爭實驗(圖5D)。帶正電荷的氨基酸組氨酸和賴氨酸競爭放射性標記的精氨酸轉運到與精氨酸相似的程度,而亮氨酸具有中等效應,且甘氨酸是最不有效的競爭劑。因此,似乎SLC38A9.1對極性氨基酸優先具有相對非特異性的底物特性。
鑒于SLC38A9.1對運輸精氨酸的偏好,且精氨酸在大鼠肝臟溶酶體和酵母液泡中高度濃縮,我們探尋SLC38A9.1在將精氨酸水平傳遞至mTORC1中是否可能具有重要作用。為此,我們檢查mTORC1信號傳導如何響應于HEK-293T細胞中的一系列精氨酸或亮氨酸濃度,其中使用如上文實施例4中所述的CRISPR/CAS9基因組編輯敲除SLC38A9。有趣的是,精氨酸對mTORC1的活化在SLC38A9敲除中的所有精氨酸濃度下被強烈抑制,而對亮氨酸的響應僅被鈍化,使得高亮氨酸濃度在無效和對照細胞中同樣良好地活化mTORC1(圖5F)。
基于上述發現,并且不受限于理論,我們認為SLC38A9結合鈉和特定氨基酸,并且作為響應可能經歷構象變化,其通過其與Ragulator的相互作用導致mTORC1活化。關于氨基酸底物特異性,我們認為SLC38A9結合對mTORC1重要的氨基酸(例如亮氨酸、精氨酸、賴氨酸)和/或這些氨基酸的天然或合成衍生物,但我們認為SLC38A9.1是用于mTORC1路徑的基于溶酶體的精氨酸傳感器的強候選者。SLC38A9對氨基酸的結合也可導致其跨溶酶體膜的轉運。鑒于其它SLC38家族成員的pH敏感性以及通過mTORC1的氨基酸傳感的pH敏感性,我們認為增加溶酶體內pH可能抑制SLC38A9對mTORC1的信號傳導,而溶酶體的pH波動可能對于調節SLC38A9對mTORC1的活性是重要的。此外,SLC38家族的鈉結合位點特征存在于SLC38A9中;因此,推測它也可在溶酶體膜上傳導鈉電流,并且此種電流可以被氨基酸調節并且可能對mTORC1功能重要。
實施例7.用以測量SLC38A9或SEQ ID NO:1的氨基酸1-119與Rag C/B異源二聚體或Ragulator之間的相互作用的分析。
調節mTORC1活性的測試化合物可通過測定其對SLC38A9.1(或SEQ ID NO:1的氨基酸1-119)與Rag異源二聚體之間的相互作用的效應的分析來鑒別。將測試化合物與培養的細胞系一起培育一段時間,所述細胞系穩定表達:
(i)內源性SLC38A9.1和Rag異源二聚體或Ragulator組分;或
(ii)表位標記的SLC38A9.1(或SEQ ID NO:1的氨基酸1-119)和/或表位標記的RagA或RagB或RagC或RagD、和/或表位標記的Ragulator組分(p18、MP1、p14、HBXIP、C7orf59)的組合,其中標簽不阻止外源氨基酸調節mTORC1信號傳導。
化合物處理后,將細胞溶解,并如本領域中所述(Sancak等,Cell 141,290-303,2010年4月16日)免疫沉淀內源性或表位標記的Rag或Ragulator組分。然后將試樣去糖基化,處理用于SDS-PAGE,并如上文所述針對內源性或表位標記的SLC38A9.1或表位標記的SLC38A9.1或SEQ ID NO:1的表位標記的氨基酸1-119進行免疫印跡分析。
在該分析的另一個實施方案中,內源性或表位標記的Rag或Ragulator組分通過合適的抗體捕獲在固定的表面上,然后對內源性或表位標記的SLC38A9.1或SEQ ID NO:1的氨基酸1-119進行夾心ELISA,如根據本領域所述(Daniele等,Scientific Reports 4,文件號:4749,2014)。
在該測定法的另一版本中,如本領域所述,用熒光或發光底物進行ELISA(參見http://csmedia2.corning.com/LifeSciences/media/pdf/elisa5.pdf)。
此實施例7中所述的分析是在對所有氨基酸饑餓的細胞、對精氨酸饑餓的細胞、對所有氨基酸饑餓并用所有氨基酸刺激的細胞、對精氨酸饑餓并用精氨酸刺激的細胞、和/或對所有氨基酸饑餓并用精氨酸刺激細胞中進行的。
實施例8.用以鑒別SLC38A9活性調節劑的分析
A.SLC38A9或SLC38A9Δ110針對質膜的定位。
在活細胞中進行的需要SLC38A9向質膜表達和定位的某些分析。為了將SLC38A9定位于質膜,SLC38A9的N-或C-末端與H-Ras的最后25個氨基酸(QHKLRKLNPPDESGPGCMSCKCVLS)融合。或者,H-Ras的此25個氨基酸部分可與結合并能夠跨膜轉運氨基酸的SLC38A9的任何肽或多肽片段或突變體(例如SLC38A9Δ110)的N或C-末端融合。此種融合蛋白靶向并在質膜表達。
或者,誘變結合并能夠跨膜轉運氨基酸的SLC38A9或SLC38A9的任何肽或多肽片段或突變體(例如SLC38A9Δ110)的溶酶體定位序列。如本領域所證明,這還將所得的肽、多肽或蛋白質靶向質膜(Biochem J.434(2):219-31,2011)。
任何上述構筑體在選擇的細胞系(例如HEK-239細胞)中瞬時轉染或穩定表達。
B.經放射標記的底物攝取分析:
放射性標記的底物攝取分析是在表達SLC38A9或SLC38A9的任何肽或多肽片段或突變體的黏附或懸浮細胞中進行的,所述肽或多肽片段或突變體結合并能夠跨膜轉運氨基酸,例如SLC38A9Δ110,如本領域中所述(The Journal of Neuroscience,14:5559-5569,1994)。簡言之,在添加放射性標記的氨基酸底物之前或同時,在室溫下、在存在或不存在測試化合物下將細胞在杜貝克氏(Dulbecco’s)磷酸鹽緩沖鹽水(D-PBS)中培育一段時間。為了測試SLC38A9或SLC38A9Δ110的轉運,評估在不同濃度和不同時間段的氚化(3H)-精氨酸、(3H)-組氨酸和(3H)-賴氨酸的轉運。在分析結束時,將黏附細胞在冰冷的D-PBS中洗滌三次,溶解在0.1%SDS中,并在適當的閃爍液(例如,來自Fisher Scientific的ScintiVerse)中處理用于閃爍計數。對于懸浮細胞,在分析結束時,使懸浮液通過Whatman GF/F微纖維過濾器(或類似型式的過濾器),洗滌,并以標準方式處理以進行閃爍計數。來自這些實驗的值可用于計算底物親和力常數。導致較低閃爍計數的化合物被認為是SLC38A9的抑制劑,而增加閃爍計數的化合物被認為是SLC38A9激活劑。
C.熒光底物攝取分析:
也在完整細胞中測量SLC38A9的熒光標記的氨基酸底物的轉運。該分析與針對3H-底物攝取所述相同,其中將測試化合物在熒光氨基酸底物之前或與熒光氨基酸底物同時添加到細胞中。在分析終止時,通過熒光微板讀數器、熒光顯微鏡或通過本領域中進行的流式細胞術(Journal of Neuroscience Methods 169,168-176,2008)測量細胞攝取的熒光底物的量。通過細胞內熒光強度的變化來測量響應化合物的底物攝取的變化。
D.基于完整細胞的閃爍迫近分析:
使用閃爍體涂布的96孔或384孔組織培養處理的微孔板(例如來自Perkin Elmer的Cytostar-T板)根據現有技術(Anal Biochem.366(2):117-25,2007)實現表達質膜定位的SLC38A9或SLC38A9Δ110的細胞的3H-底物攝取的實時分析。簡言之,將黏附細胞或懸浮細胞在閃爍微孔板中生長至匯合,洗滌并用漢克氏(Hank’s)平衡鹽溶液或含有不同濃度的3H-氨基酸底物的D-PBS一起培育。在3H-底物之前或與3H-底物同時,將測試化合物以不同濃度添加到含細胞的孔中。通過將板放置在能夠從96或384孔板讀取信號的基于光電倍增管的輻射檢測器儀器中,測量放射性標記的底物的實時攝取達給定量的時間。
E.基于熒光的轉運蛋白分析以檢測鈉轉運:
SLC38A9屬于鈉依賴性氨基酸轉運蛋白家族,并且含有協調和轉運鈉所需的氨基酸。使用鈉敏感性熒光染料(例如結合鈉的苯并呋喃間苯二甲酸酯(SBFI)(J Biol Chem.264(32):19449-57,1989)、CoroNa Green(J Physiol 498,295-307,1997)或Asante NaTRIUM Green 1(NeuroImage,第58卷:2,572-578,2011))進行檢測鈉攝取的轉運蛋白分析。簡言之,如本領域(Methods Enzymol 192:38-81,1990)中所確定,在質膜上表達SLC38A9、SLC38A9Δ110或對照蛋白的細胞預先裝載有鈉敏感性熒光染料的細胞可滲透的乙酰氧基甲基酯,洗滌,且然后在底物氨基酸和氯化鈉之前或同時與不同濃度的測試化合物一起培育。當將過表達質膜定位的SLC38A9或SLC38A9Δ110的細胞與表達陰性對照蛋白的細胞進行比較時,在與氨基酸底物和氯化鈉一起培育時熒光信號的增加指示由于通過SLC38A9或SLC38A9Δ110轉運而鈉攝取增加。熒光強度的變化可通過流式細胞術、熒光微板或分光熒光光度計測量。
F.膜電位分析:
鈉由SLC38A9的跨膜轉運也可導致膜電位變化。存在多種可用的染料,當與細胞一起預培育時,允許通過熒光的變化測量膜蛋白的變化(例如Molecular Devices的FLIPR膜電位染料)。簡言之,黏附細胞在黑色不透明微孔板中生長,洗滌,在漢克氏平衡鹽溶液和膜電位染料中培育足以使細胞裝載染料的一段時間。然后將細胞與測試化合物一起培育。與測試化合物一起培育后,將裝載有染料的細胞板裝載到FLIPR工作站上,這使得可以在添加氨基酸底物和氯化鈉時實時檢測質膜電位變化(Assay and Drug Development Technologies,6:2,2008)。在與底物和氯化鈉一起培育時防止膜電位變化的測試化合物被認為是SLC38A9的抑制劑,而導致更大膜去極化的化合物被認為是SLC38A9激活劑。
G.全細胞膜片鉗:
通過SLC38A9轉運氨基酸和鈉可產生可通過全細胞膜片鉗檢測的電流。在用硼硅酸鹽玻璃記錄移液管(3-5μM)進行全細胞膜片鉗之前,在質膜上過表達SLC38A9或SLC38A9Δ110的神經元或細胞首先針對氨基酸饑餓。外部和內部溶液經調配以與來自SLC38家族的鈉依賴性氨基酸轉運蛋白的記錄電流相容,如本領域所述(The Journal of Biological Chemistry 284,11224-11236,2009)。在存在或不存在測試化合物下以及在存在或不存在氨基酸底物下,在外部溶液中在電壓鉗(保持電位為-70mV)下記錄微型興奮性突觸后電流(mEPSC)的頻率和振幅。隨后降低興奮性電流的頻率或振幅的化合物被認為是SLC38A9的抑制劑,而增加興奮性電流的頻率或振幅的化合物被認為是SLC38A9的激活劑。
H.內溶酶體膜片鉗:
如本領域(Cell.152(4):778-790,2013)中所述,使用從表達與熒光蛋白(例如綠色熒光蛋白(GFP))融合的野生型SLC38A9或SLC38A9Δ110的細胞分離的內溶酶體的直接修補。簡言之,在質膜處切割表達與熒光蛋白融合的SLC38A9或SLC38A9Δ110的細胞,并通過SLC38A9或SLC38A9Δ110的其熒光染色鑒別的溶酶體被推出用于膜片鉗記錄。根據用于測量其它SLC38A家族成員的活性的領域(Cell.152(4):778-790,2013)調配細胞溶質和內腔緩沖液,并且在存在或不存在SLC38A9底物下和在存在和不存在測試化合物下進行興奮性記錄。調節來自鉗的興奮性信號的測試化合物被認為是SCL38A9的調節劑。
I.基于卵母細胞的轉運蛋白分析:
根據本領域(J.Biol.Chem.286:20500-20511,2011)分離和顯微注射爪蟾卵母細胞,其中體外轉錄的mRNA對應于SLC38A9、SLC38A9Δ110或對照蛋白的質膜定向形式。將所得卵母細胞置于96孔板的孔中,與Krebs-Ringer HEPES(KRH)緩沖液一起培育。在利用添加冷的KRH緩沖液終止分析之前,于30℃下將卵母細胞與在未標記的和3H-標記的氨基酸底物和氯化鈉的組合之前或同時添加的測試化合物一起培育1小時(J.Biol.Chem.286:20500-20511,2011)。終止后,將細胞在10%SDS中溶解并轉移至閃爍管中以定量放射性標記的氨基酸攝取。抑制3H-底物攝取的化合物被認為是SLC38A9的抑制劑,而增加3H-底物攝取的化合物被認為是SLC38A9激活劑。
J.閃爍迫近分析:
使用閃爍迫近分析(SPA)測量放射性標記的氨基酸底物與SLC38A9或SLC38A9Δ110的結合。簡言之,將N-末端His-標記的SLC38A9或N末端His-標記的SLC38A9Δ110固定在含有閃爍體的銅螯合物熒光微球珠粒上。然后使用如本領域所述的這種蛋白質/珠粒復合物加適當的對照進行放射性標記的底物結合測定(Nature Protocols,7:9,1569-1578,2012)。在放射性標記的底物之前或同時添加測試化合物。降低閃爍計數的化合物被認為是SLC38A9的抑制劑,而增加放射性標記底物結合的化合物被認為是SLC38A9激活劑。
K.基于納米圓盤的直接結合分析:
SLC38A9或SLC38A9Δ110如本領域所述組裝到納米圓盤中(FEBS Lett.584(9):1721-7,2010)。一旦組裝到納米圓盤中,多肽變得適合于廣泛范圍的測量小分子和氨基酸底物的直接結合的生物物理分析,包括:
1.固相表面等離子體共振。將含有SLC38A9或SLC38A9Δ110的納米圓盤通過直接胺偶聯或通過與納米圓盤或SLC38A9或SLC38A9Δ110的N末端融合的親合標簽固定在基質板上。一旦固定,如前所述測量小分子結合(Analytical Biochemistry 408,46-52,2011)。
2.小分子結合的溶液相測量。將含有N-末端表位標記的SLC38A9或SLC38A9Δ110的納米圓盤與測試化合物一起培育一段時間。將含有蛋白質的納米圓盤免疫沉淀,并且通過質譜法進行分析保留在溶液中的小分子。這樣可以檢測和鑒別在與含有SLC38A9的納米圓盤、而非陰性對照蛋白一起培育時耗盡的小分子。從溶液中化合物耗盡的程度與測試化合物對蛋白質的親和力相關。
序列
SEQ ID NO:1
>gi|222418629|ref|NP_775785.2|假定鈉偶聯的天然氨基酸轉運蛋白9同種型1[智人]
MANMNSDSRHLGTSEVDHERDPGPMNIQFEPSDLRSKRPFCIEPTNIVNVNHVIQRVSDHASAMNKRIHYYSRLTTPADKALIAPDHVVPAPEECYVYSPLGSAYKLQSYTEGYGKNTSLVTIFMIWNTMMGTSILSIPWGIKQAGFTTGMCVIILMGLLTLYCCYRVVKSRTMMFSLDTTSWEYPDVCRHYFGSFGQWSSLLFSLVSLIGAMIVYWVLMSNFLFNTGKFIFNFIHHINDTDTILSTNNSNPVICPSAGSGGHPDNSSMIFYANDTGAQQFEKWWDKSRTVPFYLVGLLLPLLNFKSPSFFSKFNILGTVSVLYLIFLVTFKAVRLGFHLEFHWFIPTEFFVPEIRFQFPQLTGVLTLAFFIHNCIITLLKNNKKQENNVRDLCIAYMLVTLTYLYIGVLVFASFPSPPLSKDCIEQNFLDNFPSSDTLSFIARIFLLFQMMTVYPLLGYLARVQLLGHIFGDIYPSIFHVLILNLIIVGAGVIMACFYPNIGGIIRYSGAACGLAFVFIYPSLIYIISLHQEERLTWPKLIFHVFIIILGVANLIVQFFM
SEQ ID NO:2
>gi|23273813|gb|AAH36301.1|TMEM192蛋白[智人]
MAAGGRMEDGSLDITQSIEDDPLLDAQLLPHHSLQAHFRPRFHPLPTVIIVNLLWFIHLVFVVLAFLTGVLCSYPNPNEDKCPGNYTNPLKVQTVIILGKVILWILHLLLECYIQYHHSKIRNRGYNLIYRSTRHLKRLALMIQSSGNTVLLLILCMQHSFPEPGRLYLDLILAILALELICSLICLLIYTVKIRRFNKAKPEPDILEEEKIYAYPSNITSETGFRTISSLEEIVEKQGDTIEYLKRHNALLSKRLLALTSSDLGCQPSRT
SEQ ID NO:3
>gi|74752435|sp|Q9BXP2.1|S12A9_人類溶質載體家族12成員9;MASESSPLLAYRLLGEEGVALPANGAGGPGGASARKLSTFLGVVVPTVLSMFSIVVFLRIGFVVGHAGLLQALAMLLVAYFILALTVLSVCAIATNGAVQGGGAYFMISRTLGPEVGGSIGLMFYLANVCGCAVSLLGLVESVLDVFGADATGPSGLRVLPQGYGWNLLYGSLLLGLVGGVCTLGAGLYARASFLTFLLVSGSLASVLISFVAVGPRDIRLTPRPGPNGSSLPPRFGHFTGFNSSTLKDNLGAGYAEDYTTGAVMNFASVFAVLFNGCTGIMAGANMSGELKDPSRAIPLGTIVAVAYTFFVYVLLFFLSSFTCDRTLLQEDYGFFRAISLWPPLVLIGIYATALSASMSSLIGASRILHALARDDLFGVILAPAKVVSRGGNPWAAVLYSWGLVQLVLLAGKLNTLAAVVTVFYLVAYAAVDLSCLSLEWASAPNFRPTFSLFSWHTCLLGVASCLLMMFLISPGAAGGSLLLMGLLAALLTARGGPSSWGYVSQALLFHQVRKYLLRLDVRKDHVKFWRPQLLLLVGNPRGALPLLRLANQLKKGGLYVLGHVTLGDLDSLPSDPVQPQYGAWLSLVDRAQVKAFVDLTLSPSVRQGAQHLLRISGLGGMKPNTLVLGFYDDAPPQDHFLTDPAFSEPADSTREGSSPALSTLFPPPRAPGSPRALNPQDYVATVADALKMNKNVVLARASGALPPERLSRGSGGTSQLHHVDVWPLNLLRPRGGPGYVDVCGLFLLQMATILGMVPAWHSARLRIFLCLGPREAPGAAEGRLRALLSQLRIRAEVQEVVWGEGAGAGEPEAEEEGDFVNSGRGDAEAEALARSANALVRAQQGRGTGGGPGGPEGGDAEGPITALTFLYLPRPPADPARYPRYLALLETLTRDLGPTLLVHGVTPVTCTDL
SEQ ID NO:4
>gi|12644301|sp|P51798.2|CLCN7_人類全=H(+)/Cl(-)交換轉運蛋白7;替換名:全=氯化物通道7α亞單位;替換名:全=氯化物通道蛋白7;短=ClC-7
MANVSKKVSWSGRDRDDEEAAPLLRRTARPGGGTPLLNGAGPGAARQSPRSALFRVGHMSSVELDDELLDPDMDPPHPFPKEIPHNEKLLSLKYESLDYDNSENQLFLEEERRINHTAFRTVEIKRWVICALIGILTGLVACFIDIVVENLAGLKYRVIKGNIDKFTEKGGLSFSLLLWATLNAAFVLVGSVIVAFIEPVAAGSGIPQIKCFLNGVKIPHVVRLKTLVIKVSGVILSVVGGLAVGKEGPMIHSGSVIAAGISQGRSTSLKRDFKIFEYFRRDTEKRDFVSAGAAAGVSAAFGAPVGGVLFSLEEGASFWNQFLTWRIFFASMISTFTLNFVLSIYHGNMWDLSSPGLINFGRFDSEKMAYTIHEIPVFIAMGVVGGVLGAVFNALNYWLTMFRIRYIHRPCLQVIEAVLVAAVTATVAFVLIYSSRDCQPLQGGSMSYPLQLFCADGEYNSMAAAFFNTPEKSVVSLFHDPPGSYNPLTLGLFTLVYFFLACWTYGLTVSAGVFIPSLLIGAAWGRLFGISLSYLTGAAIWADPGKYALMGAAAQLGGIVRMTLSLTVIMMEATSNVTYGFPIMLVLMTAKIVGDVFIEGLYDMHIQLQSVPFLHWEAPVTSHSLTAREVMSTPVTCLRRREKVGVIVDVLSDTASNHNGFPVVEHADDTQPARLQGLILRSQLIVLLKHKVFVERSNLGLVQRRLRLKDFRDAYPRFPPIQSIHVSQDERECTMDLSEFMNPSPYTVPQEASLPRVFKLFRALGLRHLVVVDNRNQVVGLVTRKDLARYRLGKRGLEELSLAQT
SEQ ID NO:5
QHKLRKLNPPDESGPGCMSCKCVLS
SEQ ID NO:6
GCCTTGACAACAGTTCTATAT
SEQ ID NO:7
CCTCTACTGTTTGGGACAGTA
SEQ ID NO:8
TGCCCGACAACCACTACCTGA
SEQ ID NO:9
GGGGCCACTAGGGACAGGAT
SEQ ID NO:10
GGCTCAAACTGGATATTCATAGG
SEQ ID NO:11
GGAGCTGGAACTACATGGTCTGG
SEQ ID NO:12
EHNNALRYRL--YNRLD-PGGEHLTMPDHVLPPN
- 還沒有人留言評論。精彩留言會獲得點贊!