用于檢測和表征微生物的方法與流程
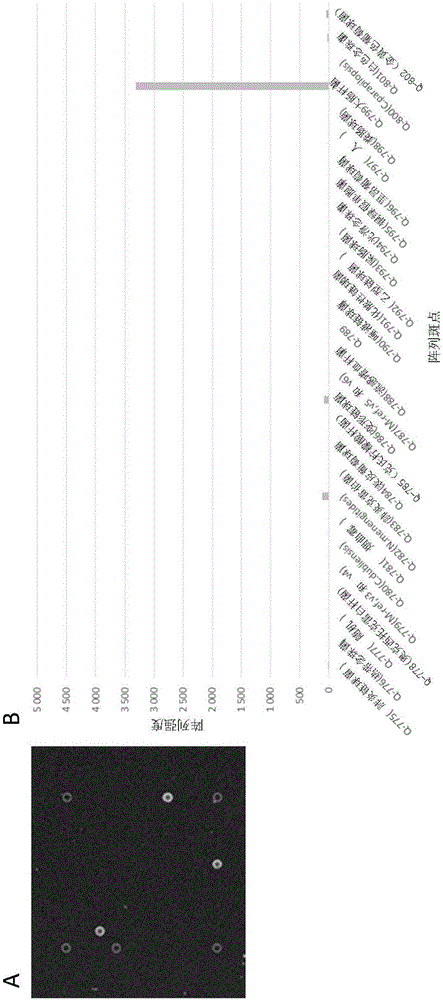
本發明涉及用于檢測和表征臨床樣品中的微生物的方法。更具體地,本發明提供用于微生物的組合檢測和表征的快速分子測試方法,其允許樣品的持續培養用于進一步的測試。
背景技術:
:微生物感染代表一類主要的具有重大臨床和經濟意義的人和動物疾病。盡管多個種類和類型的抗微生物劑可用來治療和/或預防微生物感染,但是抗微生物劑耐藥性(antimicrobialresistance)在現代醫學中是一個巨大且日益嚴重的問題。多種微生物病原體的抗微生物劑耐藥性株的數量在過去20年中已激增,并且微生物持續對日益增多數量的抗微生物劑(特別是抗生素)種類發展耐藥性。隨著耐藥性機制傳播至更多有機體,與抗微生物劑耐藥性相關的公眾健康影響和成本在未來的幾年中將快速增加。在處理微生物感染的情況下,因此可能是期望的并且確實是重要的是具有關于感染微生物的特性及其抗微生物劑敏感性分布的信息,以同時確保有效治療以及減少使用不必要或無效的抗生素,并且由此有助于控制抗生素(或者更通常地抗微生物劑)耐藥性的傳播。這在其中快速有效治療是至關重要的嚴重或威脅生命的感染的情況中尤其如此。膿毒癥(敗血癥,sepsis),其是一種由嚴重感染引起的潛在致命性全身炎癥,在美國是最昂貴的病癥并且是住院費用的推動者,占總的國家住院費用的5%。如果沒有正確治療,對于嚴重膿毒癥,死亡率每小時增加7%,并且升高的引起抗微生物劑耐藥性膿毒癥株的盛行率使得對于膿毒癥的正確治療的預測日益困難。用于診斷引起膿毒癥的微生物的當前黃金標準基于表型和生物化學鑒別技術,其要求分離和培養感染性微生物的純培養物。可能花費若干天來進行微生物鑒別(ID)和抗生素敏感性(AST)試驗以鑒別感染并且確定抗微生物劑耐藥性微生物的敏感性分布。當前的臨床實踐要求基于臨床癥狀在懷疑膿毒癥的1小時內用廣譜抗生素治療。第二次給藥在6-8小時內并且這種施用每第六至第八小時繼續直至鑒別出該微生物及其抗生素敏感性(ID/AST)的鑒別。由于膿毒癥是致死性病癥,所以如果患者經歷臨床反應,醫師則不愿意將治療初始地從廣譜抗生素改變,直至微生物感染的特性被確定并且確立抗微生物劑敏感性。這又導致不必要地高度使用廣譜抗生素,又促進在微生物之中的抗微生物劑耐藥性的上升。傳統測試方法利用濁度測量或紙片擴散來評估抗微生物劑對微生物生長影響,以及傳統生物化學和微生物學技術來鑒別微生物。由于需要延長的孵育期以允許微生物生長所致,這些技術可能花費若干天來鑒別和表征臨床樣品中的微生物。因此對于可以快速鑒別微生物并且確定抗微生物劑耐藥性微生物的抗微生物劑敏感性的技術存在需要,并且近年來已開發了減少樣品收集和診斷之間的時間的多種不同技術。繞過需要長的孵育期的富集臨床樣品中的微生物的方法描述于US8,481,265;微生物細胞可以通過非微生物細胞的選擇性溶解而從臨床樣品富集,富集樣品中的微生物細胞的濃度并且繞過在測試樣品之前需要長時間的孵育。快速微生物鑒別的方法描述于US2010/0124763。其中微生物培養物被富集并且利用光譜法鑒別微生物。利用流式細胞儀(Broeren等人2013ClinMicrobiolInfect19,286-291)和自動化顯微鏡(Price等人2014JMM.9850-59)的快速敏感性測試技術已被開發以減少在敏感性被確定之前對于孵育所需的時間。微生物DNA的定量PCR也已被用作用于微生物生長的量度以確定抗微生物劑敏感性,如在US5,789,173中描述的。組合的微生物鑒別和敏感性測試方法也已被開發。描述于US2005/0095665A1中的是這樣的一種系統,其中多組選取的生長培養基以及顯色和熒光底物聯合以自動微滴定孔形式的微生物生長的濁度測量使用以鑒別微生物并確定抗微生物劑敏感性。自動化顯微鏡方法也已被開發(Metzger等人2014DiagnosticMicrobiologyandInfectiousDisease79160-165)。BDPhoenixTM系統還允許用于快速同時鑒別和表征微生物,并且利用各種各樣的顯色和熒光底物來鑒別樣品中的微生物以及減小微生物生長以確定樣品中的微生物的抗微生物劑敏感性。用于微生物鑒別的分子方法已被開發,其中不是生長和測試微生物的性質,而是使用探針來檢測微生物細胞之中或之上的核酸或蛋白標記物,所述標記物可以鑒別該微生物。已經開發了大量的用于鑒別不同微生物的這樣的分子試驗,并且事實上分子試驗還存在用于鑒別與特定抗微生物劑的耐藥性標記物相關的多種遺傳變體或遺傳特征。然而,雖然開發了這樣的用于鑒別和表征微生物的新技術,但是臨床醫師關于僅依賴于它們相對于傳統培養和表型/生物化學方法的使用仍然保持謹慎,并且這樣的傳統方法迄今在許多臨床實驗室仍然是骨干。特別是關于分子試驗,由于可用的探針可能不會檢測所有可能的潛在病原體的觀念(并且因此感覺缺乏分子試驗的“完整性”)所致,許多臨床醫師不愿意僅依賴于這些并且僅將它們視為補充試驗。因此當前的臨床實踐是用分子測試方法來補充傳統培養方法從而診斷傳染性疾病。盡管這些傳統方法還缺乏完整性,但是它們確立的使用使得它們成為用于診斷傳染性疾病的當前黃金標準。因此當前臨床實踐需要從患者收集雙份臨床樣品以便分子和傳統試驗都可以平行地進行。這可能導致邏輯和人員問題,因為需要另外的職員來收集和處理樣品,并且可能導致在患者體內傳染性疾病的診斷和治療方面的不可接受的延遲。這還帶來由于來自提取臨床樣品的污染的高風險所致的另外的假陽性診斷的風險。這在一些情況下可能導致分子試驗被預知,盡管事實是它們可能潛在地導致較早鑒別和診斷。技術實現要素:本發明尋求解決這些問題,并且特別是提供改進的工作流程,其適應于使用同一臨床樣品的分子和傳統測試方法二者。因此本發明提供一種用于檢測和表征臨床樣品中的微生物的方法,其中同一個臨床樣品可用于分子測試和快速抗微生物劑敏感性試驗(AST),以及用于傳統培養方法,其消除了對于要獲取雙份臨床樣品的需要。事實上,所述方法被設計成在培養樣品以允許在發生分子試驗的時間期間微生物生長的同時,如果分子試驗導致鑒別,則傳統或常規試驗的進行可以是不必要的-分子ID和與快速AST試驗聯合的耐藥性試驗可以是足夠的,由此消除對于任何進一步(常規或傳統)的基于培養物的試驗的需要。盡管如此,所述方法對于同一樣品允許在需要這樣的試驗的情況下保持為培養,或者實際上以允許這樣的另外試驗在任何情形下進行,作為結果的確認或備份。這導致比常規方法更快的診斷,并且可以導致患者的更快治療以及不必要治療的更快淘汰(out-phasing)。如果分子測試不足以鑒別微生物,則進一步的常規試驗可以使用同一樣品進行。對問題的這種優雅方案之前沒有被理解或提出。本發明的一個關鍵特征在于,從患者提取單個樣品-此單個樣品可以在進行根據本發明的分子試驗和AST的同時被放入并保持為培養。然而,不是必須的是,僅制備和孵育(培養)單個培養物。有可能的是,可以建立單個初始培養物(例如,單個培養器皿可以用臨床樣品接種)并且由此可以建立一個或多個繼代培養物,并且初始培養物的繼代培養物可以用于根據本發明的分子和AST試驗。該初始原代培養物在需要或期望進一步試驗的情況下可以保持(即保持為培養)。因此,在一方面,本發明提供一種用于檢測和表征臨床樣品中的微生物,特別是在臨床樣品中可能存在的微生物的方法,所述方法包括:a)將臨床樣品引入至含有培養基的第一培養器皿;b(i))任選地在所述第一培養器皿中預培養所述臨床樣品;b(ii)任選地從所述第一培養器皿移出臨床樣品/培養基混合物或在預培養的情況下臨床樣品培養物的部分,并將所述部分引入至含有培養基的第二培養器皿,并且任選地在所述第二培養器皿中預培養所述部分;c)從所述第一和/或第二培養器皿移出試驗等分試樣,并在所述第一和/或第二培養器皿中培養或繼續培養所述臨床樣品和/或部分;d)從所述試驗等分試樣分離DNA;e)在所述DNA上進行核酸試驗以鑒別微生物以及檢測在所述微生物中存在或不存在一種或多種遺傳抗微生物劑耐藥性標記物,其中所述核酸試驗使用以下各項進行:i)用于微生物鑒別的一種或多種核酸探針和/或引物,所述探針或引物能夠特異性地雜交至或所述引物能夠選擇性地擴增作為給定微生物的認同式的核苷酸序列;和ii)用于抗微生物劑耐藥性標記物檢測的一種或多種核酸探針和/或引物,所述探針或引物能夠特異性地雜交至或所述引物能夠選擇性地擴增代表遺傳抗微生物劑耐藥性標記物的核苷酸序列;并且檢測所述探針和/或引物是否已雜交至所述DNA和/或所述引物是否已被延伸(例如已發生擴增反應);以及f)如果在步驟(e)鑒別出微生物,則在來自步驟(c)的所述經過培養的臨床樣品和/或部分上進行抗微生物劑敏感性試驗,其中在所述抗微生物劑敏感性試驗中的微生物生長通過評估生長或用于生長的標記物進行監測,并且其中在所述抗微生物劑敏感性試驗中使用的抗微生物劑的類型和濃度由在步驟(e)中檢測出的微生物的身份和抗微生物劑耐藥性標記物確定,并且任選地在所述第一和/或第二培養器皿中繼續培養所述臨床樣品和/或部分,或g)如果在步驟(e)中沒有鑒別出微生物株,則進一步培養所述臨床樣品和/或部分以使進一步的微生物鑒別和抗微生物劑敏感性試驗能夠進行,從而鑒別所述微生物并且確定其抗微生物劑耐藥性分布。將看到,本發明的方法依賴于建立臨床樣品的培養物,這最終將使得基于培養物的常規鑒別和敏感性試驗能夠進行,而同時移出培養物的等分試樣(或部分)以使得首先分子試驗并且其次快速AST能夠進行,這可以有利地消除對于常規試驗的需要。因此,所述方法通過進行該分子試驗(步驟(e))和任選地還進行步驟(f)的AST的同時培養臨床樣品而允許分子試驗進行的同時保留將同一臨床樣品用于進一步的常規試驗的選擇。這可以是單個培養物(例如繼續孵育臨床樣品)或可以建立另外的培養物,例如其可以用來提供用于測試的等分試樣同時使第一或初始培養物保持為培養(即繼續被培養)。事實上通過在步驟(e)的分子試驗期間,并且任選地還在步驟(f)期間繼續培養樣品或部分,對于另外的(例如常規)試驗所需的培養與步驟(e)和(f)的分子試驗和AST試驗平行地進行而生效。因此,所述方法的步驟(f)在某些實施方案中可以表述為在來自步驟(c)的經過培養的臨床樣品或部分的另外等分試樣上進行抗微生物劑敏感性試驗。盡管使用單個培養系統,至少直到這樣的當陰性或不確定的結果從分子試驗獲得時的時間,建立和保持單個初始(即“第一級”)培養物可以提供簡單且方便的工作流程,但是在一些情況下可能期望具有靈活性以使用不同的培養系統,這可以通過建立初始第一級培養物的繼代培養物(例如第二級培養物)實現。如在以下更詳細地解釋的,例如,在建立第二級培養物之后,可以將第一級培養物移至不同的培養系統,例如移至常規培養箱,并且第二級培養物可以在用于本發明的分子試驗和快速AST試驗的專用培養系統(例如儀器)中培養(或更特別地保持或繼續)。因此,在一個特別方面,本發明的方法包括:a)將臨床樣品引入至含有培養基的培養器皿;b)任選地在所述培養器皿中預培養所述臨床樣品;c)從所述培養器皿移出試驗等分試樣,并在所述培養器皿中培養或繼續培養所述臨床樣品;d)從所述試驗等分試樣分離DNA;e)在所述DNA上進行核酸試驗以鑒別微生物以及檢測在所述微生物中存在或不存在一種或多種遺傳抗微生物劑耐藥性標記物,其中所述核酸試驗使用以下各項進行:i)用于微生物鑒別的一種或多種核酸探針和/或引物,所述探針或引物能夠特異性地雜交至或所述引物能夠選擇性地擴增作為給定微生物的認同式的核苷酸序列;和ii)用于抗微生物劑耐藥性標記物檢測的一種或多種核酸探針和/或引物,所述探針或引物能夠特異性地雜交至或所述引物能夠選擇性地擴增代表遺傳抗微生物劑耐藥性標記物的核苷酸序列;并且檢測所述探針和/或引物是否已雜交至所述DNA和/或所述引物是否已被延伸(例如已發生擴增反應);以及f)如果在步驟(e)中鑒別出微生物,則在來自步驟(c)的所述經過培養的臨床樣品上進行抗微生物劑敏感性試驗,其中在所述抗微生物劑敏感性試驗中的微生物生長通過評估生長或用于生長的標記物進行監測,并且其中在所述抗微生物劑敏感性試驗中使用的抗微生物劑的類型和濃度由在步驟(e)中檢測出的微生物的身份和抗微生物劑耐藥性標記物確定,并且任選地在所述培養器皿中繼續培養所述臨床樣品;或g)如果在步驟(e)中沒有鑒別出微生物株,則進一步培養所述臨床樣品以使進一步的微生物鑒別和抗微生物劑敏感性試驗能夠進行,從而鑒別所述微生物并且確定其抗微生物劑耐藥性分布。如上所述,在一個另外的方面,可以從臨床樣品建立另外的培養物。在一個這樣的實施方案中,臨床樣品可以被引入到含有培養基的第一培養器皿,并且立即地或在任選的預培養期之后,可以移出第一培養器皿的內容物的部分(即第一培養器皿中的臨床樣品/培養基混合物或臨床樣品的培養物的部分)并且用來接種第二培養器皿。如以上提及的和以下進一步解釋的,可以提供專用儀器或裝置以進行本發明的方法,并且如果期望或需要,其可以與用于進行常規試驗的常規培養系統或儀器一起使用(例如來自BectonDickinson或Biomerieux的培養箱)。這樣的專用儀器/裝置可以設計成接收含有臨床樣品的第一培養器皿,以及從第一培養器皿移出部分并將其引入到第二培養器皿中。這可以允許含有臨床樣品和培養基的第一培養器皿(例如血液培養瓶)經由常規方式被放入用于測試的另外的培養系統(例如孵育器)中,而臨床樣品/培養基混合物的所述部分或由其獲得的臨床樣品培養物保持在本發明的裝置中用于培養(包括任選的預培養)以及AST和ID測試。因此,本發明的方法可以包括:a)將臨床樣品引入至含有培養基的第一培養器皿;b(i))任選地在所述第一培養器皿中預培養所述臨床樣品;b(ii))從所述第一培養器皿移出所述臨床樣品/培養基混合物或者在預培養的情況下所述臨床樣品培養物的部分,并將所述部分引入至含有培養基的第二培養器皿并且任選地在所述第二培養器皿中預培養所述部分;c)從所述第二培養器皿移出試驗等分試樣,并在所述第二培養器皿中培養或繼續培養所述部分;d)從所述試驗等分試樣分離DNA;e)在所述DNA上進行核酸試驗以鑒別微生物以及檢測在所述微生物中存在或不存在一種或多種遺傳抗微生物劑耐藥性標記物,其中所述核酸試驗使用以下各項進行:i)用于微生物鑒別的一種或多種核酸探針和/或引物,所述探針或引物能夠特異性地雜交至或所述引物能夠選擇性地擴增作為給定微生物的認同式的核苷酸序列;和ii)用于抗微生物劑耐藥性標記物檢測的一種或多種核酸探針和/或引物,所述探針或引物能夠特異性地雜交至或所述引物能夠選擇性地擴增代表遺傳抗微生物劑耐藥性標記物的核苷酸序列;并且檢測所述探針和/或引物是否已雜交至所述DNA和/或所述引物是否已被延伸(例如已發生擴增反應);以及f)如果在步驟(e)中鑒別出微生物,則在來自步驟(e)的所述經過培養的部分上進行抗微生物劑敏感性試驗,其中在所述抗微生物劑敏感性試驗中的微生物生長通過評估生長或用于生長的標記物進行監測,并且其中在所述抗微生物劑敏感性試驗中使用的抗微生物劑的類型和濃度由在步驟(e)中檢測出的微生物的身份和抗微生物劑耐藥性標記物確定,并且任選地在所述第二培養器皿中繼續培養所述部分,或g)如果在步驟(e)中沒有鑒別出微生物株,則進一步培養所述臨床樣品和/或部分以使進一步的微生物鑒別和抗微生物劑敏感性試驗能夠進行從而鑒別微生物并且確定其抗微生物劑耐藥性分布。事實上,在本發明的任一個實施方案中,另外的ID和/或AST試驗,無論是否是常規的,可以在培養的樣品或部分上進行,而不論是否在步驟(e)中獲得陽性鑒別結果。因此所述方法允許臨床樣品或部分的培養發生以使得用于另外的鑒別和/或AST試驗可以進行,例如簡單地提供另外的結果,例如作為備份或確認。在另一個的實施方案中,另外的(例如常規)試驗可以進行,無論是否有來自步驟(e)的ID試驗和/或步驟(f)的AST試驗的陽性結果。在一個優選方面,繼續臨床樣品(即第一培養器皿的臨床樣品)的培養以使進一步的微生物鑒別和抗微生物劑敏感性試驗能夠進行。將進一步理解的是,步驟(e)和/或(f)的試驗可以重復或進行一次或多次,也就是說等分試樣可以從第一或第二培養物移出一次或多次,例如以一定時間間隔,以進行步驟(f)的核酸試驗一次或多次(例如兩次或更多次,例如2或3次)。任選地,步驟(f)的AST試驗也可以進行多于一次,如果這是期望的。如上所述,在培養器皿中的臨床樣品的培養可以繼續,而步驟(f)的AST試驗正在進行,并且任選地還在該試驗已經進行之后。因此存在重復AST試驗或繼續培養以允許常規測試的可能性。如從上下文明顯的是,在第一或第二培養器皿中的臨床樣品/培養基混合物或從其移出的部分的等分試樣簡單地是部分,即培養器皿內容物的部分或成分。所述等分試樣可以移出并且直接用于步驟(e)的核酸試驗,(即在步驟(d)中從試驗等分試樣分離DNA之后),或在步驟(f)的AST試驗中,或其可以在進行步驟(d)/(e)和/或步驟(f)的試驗之前進行一段時間的培養。此外,從第一或第二培養器皿移出的試驗等分試樣可以分成繼代等分試樣或等分試樣成分,或者繼代等分試樣或成分可以從其移出,其可以進行測試或進一步培養。移出的試驗等分試樣或等分試樣成分的這種培養可以與培養器皿中的臨床樣品的培養或繼續培養分開或獨立地進行。在培養器皿中培養臨床樣品的步驟或從第一培養器皿移出的部分的步驟,或實際上培養試驗等分試樣/等分試樣成分的步驟,可以以任何方便或所需的方式進行,如在以下更詳細地描述的。在這方面,用于例如診斷或微生物檢測目的的培養臨床樣品的培養設備是已知的并且可以使用。不同的培養設備或培養系統可以用于培養器皿(例如第一和第二培養器皿)的單獨培養,和/或任何移出的試驗等分試樣/等分試樣成分的單獨培養和/或用于在AST試驗期間所需的培養。此外,如以上提及的和在以下更詳細地描述的,根據本發明還設想提供用于進行如本文中描述的微生物檢測和表征方法的設備或裝置。這樣的裝置或系統可以包括用于培養培養器皿的設備或工具。因此所述方法的多個培養步驟,包括第一和/或第二培養器皿的培養/連續培養,任選的在移出試驗等分試樣(例如第一試驗等分試樣)之前的第一和/或第二培養器皿的預培養,試驗等分試樣或等分試樣成分的培養,或事實上還有在步驟(f)的AST試驗期間的培養可以在相同或不同培養系統或培養設備中進行。培養器皿可以轉移至不同培養系統/設備,例如如果有來自步驟(e)的鑒定試驗的陰性結果。培養器皿(例如第一和/或第二培養器皿)的表面在被放入培養設備之前(例如在臨床樣品或部分已被引入培養器皿之后)可以被清潔或凈化。因此例如,在一個實施方案中,培養器皿(例如第一培養器皿)可以在一個系統中培養同時正進行任選的預培養,和測試步驟。如果步驟(e)的鑒別試驗是陰性的和/或不確定的,或者如果步驟(f)的AST試驗是陰性的、不確定的或不完全的,則培養器皿然后可以轉移至另外或分開的培養系統,例如以使常規的鑒別試驗和/或AST試驗能夠進行。例如,這樣的另外或分開的培養系統可以是常規培養箱,或者另外的自動化微生物測試/檢測系統(例如診斷系統)。通過代表性實例的方式,在所述方法的一個實施方案中,將從試驗對象收集的臨床樣品引入到培養器皿(這可以視為第一培養器皿)(步驟(a))。在任何培養發生之前,將試驗等分試樣移出(步驟(c)),并進行步驟(d)和(e)。在此期間期間,對培養器皿進行培養。如果步驟(e)的鑒別試驗得到陽性結果,則從培養器皿移出另外等分試樣并進行步驟(f)的AST。如果步驟(e)中的鑒別試驗是陰性的,則使含有臨床樣品的培養器皿進行另外的培養,例如在分開的系統中。在第二實施方案中,所述方法如上所述進行,但是具有在步驟(c)中的移出試驗等分試樣之前的預培養的步驟。在第三實施方案中,從培養器皿移出試驗等分試樣(如上的步驟(c)),并且使來自該等分試樣的成分進行步驟(d)和(e)(核酸分離和檢測)。在此時間期間,使另外等分試樣成分或所述試驗等分試樣的剩余部分進行培養,如同由其移出試驗等分試樣的培養器皿。分開的等分試樣/等分試驗成分和培養器皿的這種培養可以在相同或不同系統中發生。如果步驟(e)的鑒別試驗得到陽性結果,則使經過培養的另外等分試樣成分/剩余等分試樣進行步驟(f)的AST。如果步驟(e)中的鑒別試驗是陰性的,則使含有臨床樣品的培養器皿進行另外的培養,例如在分開的系統中。在第四實施方案中,從第一培養器皿(無論是在預培養期之前或之后)移出部分并引入到含有培養基的第二培養器皿中。從第二培養器皿移出試驗等分試樣(步驟(c),并進行步驟(d)和(e)。在此時間期間,培養第二培養器皿。如果步驟(e)的鑒別試驗得到陽性結果,則從第二培養器皿移出另外的等分試樣并進行步驟(f)的AST。如果步驟(e)中的鑒別試驗是陰性的,則使含有樣品等分試樣的第二培養器皿進行另外的培養。在另一個實施方案中,第一培養器皿可以另外地或替代地進行另外的培養,例如在分開的系統中。在另一個實施方案中,以上描述的第一、第二、第三和/或第四代表性實施方案可以包括繼續培養含有臨床樣品的培養器皿,而不管在步驟(e)中獲得陽性或陰性鑒別結果。以這種方式,可以從樣品獲得另外的結果。因此將看到,在某些優選實施方案中,在沒有臨床樣品的任何培養的情況下發生分子測試(即步驟(e)的核酸測試)。在如當今實施的許多微生物測試程序中,一旦在微生物培養中已有陽性結果,即一旦已檢測到微生物生長(陽性培養試驗),則進行鑒別試驗(無論是通過常規生物化學試驗還是通過分子試驗)。因此,例如,經血液或其他樣品引入至培養器皿(例如血液培養瓶),并將此進行培養。將培養系統進行設計或選擇以指示(什么時候)已出現微生物生長,例如通過包括產生依賴于微生物生長的信號(例如由于pH變化,或底物的轉化/消耗,或產生微生物代謝產物等)的指示物質或簡單地通過任何手段檢測微生物生長。當/如果出現足夠的微生物生長從而生成信號/給出可檢測的生長時,則這指示在培養/微生物檢測方面的“陽性”結果(即在臨床樣品中存在微生物的生長,盡管在這個階段還不知曉該微生物的身份是什么)。在此階段,通常進行鑒別和/或AST試驗。微生物生長可能會花費幾小時例如6、8、10或12小時以上來進行。本發明具有這樣的優勢,即不必需等待直至在這樣的培養試驗中已獲得陽性結果,意味著微生物鑒別可以更快速地獲得。步驟(b)允許在分子測試之前的任選預培養步驟。這可以持續比對于陽性培養試驗所需更短的時間期。因此,在一個代表性實施方案中,步驟(d)和(e)在有陽性培養試驗結果之前發生。在另一個實施方案中,步驟(d)和(e)首先在獲得陽性培養結果之前(或在獲得陽性培養結果所需的時間之前)進行,并且可以在陽性培養結果(或對于陽性結果所需的時間期)之后重復。換句話說,在一個優選實施方案中,在有陽性培養結果之前,或更特別地在對于要獲得陽性培養結果所需的時間之前,進行至少一組核酸試驗(步驟(e))。在另一個代表性實施方案中,步驟(f)(AST步驟)也可以在培養試驗中獲得陽性結果或可獲得的陽性結果之前進行。然而,根據本發明的方法不排除在陽性培養結果之后進行測試步驟(e)和(f),例如從而在陽性試驗結果之后在步驟(c)中移出試驗等分試樣。在這樣的情況下,可以看到預培養步驟(b)可以涉及培養培養器皿直至獲得陽性培養試驗結果或者直至諸如將預期陽性培養試驗結果的時間。關于步驟(e)的核酸試驗,在一個優選實施方案中,使用第一組核酸探針,其特異性地雜交至作為微生物的認同式的核酸序列,和第二組探針,其特異性地雜交至代表遺傳抗微生物劑耐藥性標記物的核苷酸序列。在這樣的實施方案中,可以涉及探針雜交的檢測,或者可以通過探針擴增發生。因此探針雜交的檢測可以通過檢測探針擴增進行。因此,本發明的方法可以在步驟(e)中包括使用用于探針的一種或多種擴增引物,其是設計或選擇用于已雜交至其靶核苷酸序列的探針的擴增引物。如在以下更詳細地描述的,在某些優選實施方案中,如果探針已雜交至其靶核苷酸序列,則可以將其設計成被連接,例如設計用來使探針環化的連接反應。因此探針連接是存在靶序列的指示。連接的(例如環化的)探針可以通過連接的探針的擴增,例如通過使用該連接的探針作為模板產生擴增產物(例如,環化的探針可以是用于RCA反應的模板)檢測,并且擴增產物可以直接地檢測或通過使用雜交至該擴增產物的檢測探針檢測。如以下進一步描述的,步驟(f)的AST試驗可以以任何方便或所需的方式進行。因此,微生物生長可以在不同抗微生物劑(例如抗生素)和/或量或濃度的抗微生物劑(例如抗生素)存在下進行評估(或確定)。生長可以直接進行評估或者通過評估(確定)標記物生長進行評估。因此,微生物生長可以通過確定樣品中存在的微生物細胞物質(即微生物生物質)的量,特別地通過對此直接評估或確定而進行評估。在一個優選實施方案中,這通過肉眼地,并且尤其通過成像確定微生物生物質的量而實現。特別地,可以獲得2-D圖像并進行評估。因此在一個優選實施方案中,可以確定微生物生物質的面積(更特別地,例如在一個圖像中,在所考察的視野中微生物生物質的面積)。微生物生長可以通過確定樣品中存在的微生物細胞物質(即微生物生物質)的量(這里,具體地,在設置用于AST試驗的試驗微生物培養中),特別地通過對此直接評估或確定而進行評估。在一個優選實施方案中,這通過肉眼地,并且尤其通過成像確定微生物生物質的量實現。特別地,可以獲得與光軸垂直地對齊(這里稱為xy-對齊)的2-D圖像并進行評估。試樣的特定面積在單個xy-對齊圖像中覆蓋,其尺寸依賴于成像設備的光學性能。對于xy-空間的每個位置,沿著光軸或z軸以不同間隔可以收集一個或多個2D圖像。因此,可以產生一系列或一堆2D圖像,提供樣品體積的3D信息。從樣品提取3D信息的備選方法是由Unisensor采用的方法(參見例如US8780181),其中光軸相對于xy-平面傾斜,并且樣品或檢測器沿著x或y平面移動。這里,除了xy空間之外,還獲取具有延伸入z空間的一系列圖像。通過圖像數據的隨后轉換,利用此方法還可以獲得與xy平面垂直地對齊的2D圖像棧。在提取后,在2D圖像棧中固有的3D信息可以用來評估/推斷/推導在所分析體積中存在的總細胞質量。在一個優選實施方案中,通過例如z-棧投影成一個2-D圖像,2-D圖像可以由3-D信息生成。然后可以使用所得的2-D圖像進行分析。然后微生物生物質的面積可以作為指示所考察的視野中,例如在投影的2D圖像中,的微生物生物質的光學密度的面積來確定。這樣的方法在本領域是常例并且可以增加靈敏度,并且用于亮場圖像的用于此的算法可以在公眾可得軟件來自MIT,USA的Cellprofiler中找到。類似的分析可以對于熒光圖像進行,并且存在用于此的許多備選算法,例如在Cellprofiler中,以及在大多數商用圖像分析系統中。在另一個實施方案中,登記在伸展橫跨xy空間中的每個位置的z空間中的強度變化,指示特定位置中的微生物質量。在整個xy空間上積分,這得到總微生物體積的量度。用于此程序的算法還存在于平常可用的圖像分析軟件,例如在免費軟件Cellprofiler中。更通常地,微生物生長可以通過確定微生物和/或微生物集落或聚集體的量和/或數目和/或大小進行評估。如將在以下更詳細地討論的,在某些優選實施方案中,微生物生長通過成像評估(確定),或可選地通過使微生物可視化表達。因此,微生物細胞,其可以包括細胞的聚集體或叢(簇),或微生物集落,可以可視化或成像作為確定(或評估或監測)生長的手段。這可以包括計數細胞或集落,但不限于這樣的方法并且包括肉眼地評估微生物生長的量的任何手段,通過評估(或確定)微生物細胞、集落或聚集體的大小、面積、形狀、形態和/或數目(術語“聚集體”包括物理近似的細胞的任何集合,例如叢或簇;這可以包括細胞的非克隆叢/簇,其已聚集或粘在一起(例如已變得聚集的相鄰細胞)以及克隆集落)。用于測量微生物生長的參數可以但不需要根據微生物的身份(在步驟(e)中確定)和步驟(f)中使用的抗微生物劑變化。實際上,取決于使用的有機體和抗微生物劑,細胞的形態或生長模式可能受影響,并且這可以從“正常”或“典型”形態或生長模式改變或變化,例如在沒有抗微生物劑的情況下。盡管一些AST生長監測方法可以依賴于檢測這樣的變化,但是根據本發明不是必須考慮這樣的變化并且微生物生長或生物質的量(例如面積)可以與形態和/或生長模式無關地確定。因此可以使用同樣的生長監測方法,而不管所使用的微生物細胞和/或抗微生物劑。用于進行AST試驗的方法在以下進一步描述。有利地,在步驟(e)中的陽性結果之后,臨床樣品(例如試驗等分試樣)可以直接用于AST試驗。臨床樣品/部分/試驗等分試樣/等分試樣成分等將會在已進行步驟(d)和步驟(e)的時間期間進行了培養,并且在步驟(f)之前不需要進行任何進一步的繼代培養。實際上,在有利的實施方案中,沒有進一步的繼代培養步驟。特別地,沒有在另外的培養基或培養器皿中的繼代培養步驟。更特別地,沒有繼代培養的步驟以在AST之前獲得微生物的純培養物。這意味著可以進行更快速的AST試驗。有利地,進行快速AST試驗。因此,在一個優選實施方案中,步驟(f)的AST試驗可以在8、7或6小時以下,例如在4或5小時以下給出結果。在AST試驗中微生物生長的監測或評估可以通過在一段時間期(多至6、5、6、7或8小時)內連續地或以時間間隔監測生長或通過比較在AST生長培養啟動時的生長與在后一個時間點(例如,在多至4、5、6、7或8小時)的生長,或實際上比較在兩個以上不同時間點的生長而進行。在優選實施方案中,微生物生長在多于一個時間點,即在至少兩個時間點確定。本發明的方法可以用于檢測和表征任何微生物。一般來講,關注臨床相關微生物。如本文中使用的,術語微生物涵蓋可以落在“微生物”類別的任何微生物。盡管不是必需如此,但是微生物可以是單細胞的,或者可以具有單細胞生命階段。微生物可以是原核的或真核的,并且通常將包括細菌、古生菌、真菌、藻類和原生生物,主要包括原生動物。特別感興趣的是細菌,其可以是革蘭氏陽性或革蘭氏陰性的或革爛氏不確定的貨革蘭氏非響應性的,以及真菌。特別地,臨床相關的細菌屬包括葡萄球菌屬(Staphylococcu)(包括凝固酶陰性葡萄球菌屬Staphylococcus)、梭菌屬(Clostridium)、埃希氏菌屬(Escherichia)、沙門氏菌(Salmonella)、假單胞菌屬(Pseudomonas)、丙酸桿菌屬(Propionibacterium)、芽孢桿菌屬(Bacillus)、乳桿菌屬(Lactobacillus)、軍團桿菌屬(Legionella)、分枝桿菌屬(Mycobacterium)、微球菌屬(Micrococcus)、梭桿菌屬(Fusobacterium)、莫拉氏菌屬(Moraxella)、變形菌屬(Proteus)、埃希氏菌屬(Escherichia)、克雷伯菌屬(Klebsiella)、不動桿菌屬(Acinetobacter)、伯克氏菌屬(Burkholderia)、腸球菌屬(Entercoccus)、腸桿菌屬(Enterobacter)、枸櫞酸桿菌(Citrobacter)、嗜血桿菌屬(Haemophilus)、奈瑟氏菌屬(Neisseria)、沙雷氏菌屬(Serratia)、鏈球菌屬(Streptococcus)(包括α-溶血性鏈球菌和β-溶血性鏈球菌)、變形細菌屬(Bacteriodes)、耶爾森氏菌屬(Yersinia)和螺菌屬(Stenotrophomas),并且實際上任何其他腸道菌或大腸型細菌。β-溶血性鏈球菌將包括A組、B組、C組、D組、E組、F組、G組和H組鏈球菌。革蘭氏陽性菌的非限制性實例包括金黃色葡萄球菌(Staphylococcusaureus)、溶血性葡萄球菌(Staphylococcushaemolyticus)、表皮葡萄球菌(Staphylococcusepidermidis)、腐生性葡萄球菌(Staphylococcussaprophyticus)、里昂葡萄球菌(Staphylococcuslugdunensis)、schleiferei葡萄球菌(Staphylococcusschleiferei)、山羊葡萄球菌(Staphylococcuscaprae)、肺炎葡萄球菌(Staphylococcuspneumoniae)、無乳葡萄球菌(Staphylococcusagalactiae)、釀膿葡萄球菌(Staphylococcuspyogenes)、唾液葡萄球菌(Staphylococcussalivarius)、血液葡萄球菌(Staphylococcussanguinis)、咽峽炎鏈球菌(Staphylococcusanginosus)、肺炎葡萄球菌(Streptococcuspneumoniae)、釀膿葡萄球菌(Streptococcuspyogenes)、緩癥鏈球菌(Streptococcusmitis)、無乳鏈球菌(Streptococcusagalactiae)、咽峽炎鏈球菌(Streptococcusanginosus)、馬腸鏈球菌(Streptococcusequinus)、牛鏈球菌(Streptococcusbovis)、產氣莢膜梭狀芽胞桿菌(Clostridiumperfringens)、糞腸球菌(Enterococcusfaecalis)和屎腸球菌(Enterococcusfaecium)。革蘭氏陰性菌的非限制性實例包括大腸埃希氏菌(Escherichiacoli)、邦戈爾沙門菌(Salmonellabongori)、腸道沙門氏菌(Salmonellaenterica)、克氏檸檬酸桿菌(Citrobacterkoseri)、弗氏檸檬酸菌(Citrobacterfreundii)、肺炎克雷伯氏菌(Klebsiellapneumoniae)、奧克西托克雷白桿菌(Klebsiellaoxytoca)、綠膿假單胞菌(Pseudomonasaeruginosa)、流感嗜血桿菌(Haemophilusinfluenzae)、腦膜炎奈瑟氏菌(Neisseriameningitidis)、陰溝腸桿菌(Enterobactercloacae)、產氣腸桿菌(Enterobacteraerogenes)、粘質沙雷氏菌(Serratiamarcescens)、嗜麥芽窄食單胞菌(Stenotrophomonasmaltophilia)、摩氏摩根氏菌(Morganellamorganii)、脆弱類桿菌(Bacteriodesfragilis)、鮑氏不動桿菌(Acinetobacterbaumannii)和奇異變形桿菌(Proteusmirabilis)。臨床相關真菌可以包括酵母,特別是念珠菌屬(Candida),以及以下屬的真菌:曲霉屬(Aspergillus)、鐮刀霉(Fusarium)、青霉屬(Penicilium)、肺囊蟲(Pneumocystis)、隱球菌屬(Cryptococcus)、球孢子菌屬(Coccidiodes)、馬拉色菌屬(Malassezia)、毛孢子菌屬(Trichosporon)、枝頂孢屬(Acremonium)、根霉屬(Rhizopus)、毛霉屬(Mucor)和犁頭霉屬(Absidia)。特別感興趣的是念珠菌屬(Candida)和曲霉屬(Aspergillus)。真菌的非限制性實例包括煙曲霉(Aspergillusfumigatus)、白念珠菌(Candidaalbicans)、熱帶念珠菌(Candidatropicalis)、光滑念珠菌(Candidaglabrata)、Candidadubliensis、近平滑念珠菌(Candidaparapsilosis)和克魯斯氏念珠菌(Candidakrusei)。術語“檢測”廣義地是指確定微生物存在或不存在的任何手段。因此“檢測”可以包括以任何方式或形式確定、評估或測量微生物是否存在-其可以包括定性、定量或半定量確定。術語“表征”廣義地意指確定關于微生物的性質和/或性能的信息的任何手段,并且特別地包括鑒別微生物。更特別地微生物可以依據至少其屬,并且優選地其種被鑒別。在一些情況下甚至在株水平的鑒別可以是可能。本發明的方法還允許微生物依據確定它對于給出的抗微生物劑是否是敏感的或預期是敏感的、或它是否對任何抗微生物劑表現出耐藥性或預期是耐藥性的(例如確定其抗微生物劑敏感性分布)進行表征。這可以通過測試分子耐藥性標記物(即與一種或多種抗微生物劑或多類抗微生物劑的耐藥性相關或其指示的遺傳變體或特定遺傳序列)的存在進行。這樣的分子試驗當然確鑿地確定該微生物是敏感的并且這通過步驟(f)的AST試驗進行,其中直接測試抗微生物劑對微生物生長的作用。術語“裂解”意指細胞的破裂。特別地,使細胞破裂以釋放細胞內容物,特別地包括核酸。這可以通過任何手段實現,如本領域已知的大量手段,例如通過損害其整體性導致細胞組分的部分或全部釋放到周圍溶液中的病毒、酶、機械、電、化學、熱、冷或滲透機制。臨床樣品可以是可以從試驗對象獲得的任何臨床樣品,試驗對象通常將是人患者但可以是任何人或動物(通常是哺乳動物)受試者。因此它可以是身體組織、細胞或流體的任何樣品,或來源于身體的任何樣品例如拭子、清洗液、吸出物或漂洗液等。合適的臨床樣品包括但不限于血液、血清、血漿、血液成分、關節液、尿液、精液、唾液、糞便、腦脊髓液、胃內容物、陰道分泌物、粘液、組織活檢樣品、組織勻漿、骨髓穿刺液、骨勻漿、痰、吸出物、傷口滲出液、拭子或拭子漂洗液例如鼻咽拭子、其它體液等。在一個優選實施方案中,臨床樣品是血液樣品或血液來源樣品,例如血清或血漿或血液成分。微生物可以是任何微生物,特別地任何致病微生物或引起身體中的感染的任何微生物,并且因此所述方法可以用于檢測或診斷在試驗受試者的身體的任何部分之中或之上的微生物感染(即任何微生物感染)的情形并且臨床樣品的性質可以相應地確定,例如根據感染或疑似感染的癥狀呈現,或受試者的總體臨床狀況。盡管涵蓋了任何微生物感染,但是本發明的方法特別可用于檢測或診斷膿毒癥,或其中懷疑有膿毒癥的情形。因此臨床樣品可以來自患有或懷疑患有膿毒癥或處于膿毒癥風險的受試者。在這樣的情況下,樣品通常是血液或血液來源的樣品。典型地,樣品將是血液。在所述方法的第一步(步驟(a))中,將樣品引入至包含培養基的培養器皿。這是可以根據本領域熟知的標準程序實施且在文獻中廣泛描述的標準步驟。培養器皿可以包括適用于微生物細胞培養的任何器皿或容器,例如盤、孔、試管、小瓶、燒瓶等。方便地,在樣品是血液或血液來源樣品的情況下,培養器皿是血液培養瓶,例如BacT/ALERT(Biomerieux)血液培養瓶、Bactec血液培養瓶(BectonDickinson)或VersaTrek血液培養瓶(ThermoFisher),或實際上已知的用于血液取樣,特別用于培養以檢測微生物的目的的任何試管、燒瓶或小瓶。方便地,培養器皿可以提供有已容納在其中的培養基。然而,培養基可以單獨地提供并在已添加臨床樣品之前、同時或之后引入到培養器皿中。培養基可以是任何合適培養基并且可以根據臨床樣品和/或懷疑微生物的性質、和/或受試者的臨床狀況等選擇。適用于這樣的用途的許多不同微生物培養基是已知的。典型地培養基可以含有足夠的營養成分以促進微生物的快速生長,如在本領域已知的。在許多情況下,恰當培養基是包含介質如胰蛋白胨大豆肉湯、Columbia肉湯、腦心浸劑肉湯、Brucella肉湯以及本領域已知的通用目的的生長培養基的復合生長培養基,并且可以包括添加特定生長因子或補充物。培養基可以已多種形式得到,包括液體、固體和懸浮液等,并且可以使用這些之中的任一種,但方便地所述培養基將是液體培養基。在培養器皿已準備使用血液培養瓶的情況下,如上所述,這些器皿可以含有尤其改性的規定培養基以允許寬范圍的微生物生長。典型地由制造商在血液培養瓶中提供的培養基將含有中和在取自試驗受試者的臨床樣品中存在的任何抗生素的存在的試劑或添加劑。可以使用含有或不含有這樣的中和劑的燒瓶,并且如果期望,中和劑可以添加至培養器皿。如上所述,用于步驟(e)的鑒別試驗的第一試驗等分試樣可以在樣品與培養器皿中的培養基接觸之后立即或基本上立即移出,無論來自第一或第二培養器皿(例如在混合樣品和培養基之后)。這可以例如在將樣品引入至培養器皿的10、15、20或30分鐘內,或者可以更長,例如在1、2或3小時內,這取決于臨床情形。步驟(b)是任選的在培養器皿中預培養臨床樣品(或被引入第二培養器皿中的來自第一培養器皿的部分)的步驟,其在發生分子測試之前允許樣品中存在的任何微生物生長(即成倍地)。這是否進行可以取決于樣品的性質、懷疑的感染、受試者的臨床狀態等。例如,在尿液樣品的情況下,預期大量的微生物細胞存在于樣品中并且因此可能不需要預培養步驟,然而,在例如血液樣品的情況下,細胞的數目通常預期較少并且預培養步驟可能有利于增加可用于分子測試的微生物細胞的數目,或者有利于回收微生物DNA等。這也可以取決于用于微生物鑒別和耐藥性標記物檢測的分子試驗(即探針)的性質以及核酸試驗的靈敏性和/或特異性。預培養通常涉及在有益于或適合于微生物生長的條件下孵育培養器皿,例如在特定溫度(例如,在20至40℃或25至40℃的溫度,例如25至37℃或30至35℃)。取決于器皿的性質、培養基、懷疑的微生物、臨床狀況等,器皿可以攪拌或旋轉、搖晃等。預培養可以發生持續任何合適或所需時間期,但為了使方法加速,將優選持續少于8小時或少于6小時的時間期。例如,在開始測試之前,或更特別地在步驟(c)中的移出試驗等分試樣之前,預培養可以發生持續多至1、2、3、4、5或6小時。可選地,預培養可以發生持續少于1小時。預培養也可以發生持續多于6小時,例如持續7、8或9小時,或多于9小時,例如多至10或12小時,或甚至更長,但為了提供快速方法,通常將其保持為最小,并且優選多至6小時或更特別地多至4或3小時的短預培養期。如上所述,預培養可以發生持續比看到陽性培養結果所需更短的時間期,或者它可以發生直至獲得陽性培養結果。在步驟(c)中的試驗等分試樣的移出可以通過任何方便手段發生,取決于培養器皿的性質和其如何被孵育。例如,在血液培養瓶的情況下,等分試樣可以簡單地使用針頭和注射器取出。根據正常臨床和微生物學實踐,可以采取多個步驟以避免或限制污染,例如這可以在無菌條件下進行。例如,可以對培養器皿如血液培養瓶的隔膜進行清潔或去污染,優選地在取出等分試樣之前和/或取出等分試樣之后。在一個方便的實施方案中,用于移出試驗等分試樣的手段例如,針頭,和任選地注射器)可以以一次使用形式提供,即作為消耗品。換句話說,其可以是可拋棄的并且不再次使用。在繼續培養的同時移出試驗等分試樣的步驟(c)可以進行多于一次。實際上,對于進行步驟(e)的分子試驗和步驟(f)的AST試驗,通常將取兩個分開的等分試樣,并且在每種情況下繼續培養。然而,如以上提及的,提取用于進行分子試驗的等分試樣的部分可以保留并培養。此部分可以用于重復的分子試驗(例如在第二時間點)和/或可以用于AST試驗。然而,也可以提取用于重復分子試驗的分開的等分試樣,例如以隔開的時間間隔。因此分子試驗(步驟(e))可以進行多于一次。在一個這樣的實施方案中,等分試樣可以在步驟(a)之后直接移出用于在預培養步驟(b)之前要進行的初始分子試驗。如果初始分子試驗是陰性的或不是充分確定性的,例如,在預培養期之后可以移出第二等分試樣以實施第二分子試驗。因此,在一個實施方案中,本發明的方法可以包括以下步驟:i)將臨床樣品引入至含有培養基的培養器皿;ii)從所述培養器皿移出試驗等分試樣,iii)從所述試驗等分試樣分離DNA并如以上步驟(e)中所述進行核酸試驗;iv)在步驟(iii)正進行的同時,培養所述培養器皿中的所述臨床樣品;v)從所述培養器皿移出另外的試驗等分試樣,并繼續培養在所述培養器皿中的所述臨床樣品;vi)從所述另外的試驗等分試樣分離DNA并如以上步驟(e)中所述進行核酸試驗;如果此第二(或任何另外的)分子試驗是陰性的,則所述方法可以進行至步驟(g)。因此,培養器皿的培養可以繼續以允許進一步的試驗可以進行。為了使步驟(e)的分子核酸試驗能夠進行,將DNA從移出的等分試樣或等分試樣成分分離(在步驟(d)中)。當然將理解的是,需要微生物DNA用于分子試驗并且取決于臨床樣品的性質,可以有相當大量的來自試驗受試者的細胞存在,這可能在分離或后續測試中變復雜或形成干擾。更特別地,在臨床樣品中在試驗受試者的細胞中存在的非微生物DNA例如人DNA可能使得微生物DNA的檢測和測試困難,特別是在其中存在比微生物細胞多得多的血液細胞(特別白血細胞)的樣品如血液的情況下。因此,可能期望從試驗等分試樣選擇性地分離或富集微生物DNA。實際上,所述方法可以任選地包括在試驗等分試樣中或從試驗等分試樣分離或富集微生物或微生物細胞的步驟,例如在分離DNA或分離微生物DNA的步驟之前或同時。用于富集樣品中的微生物的合適方法可以包括裂解在等分試樣中存在的任何非微生物細胞,或從等分試樣選擇性地移出微生物細胞(即從等分試樣主動或被動選擇微生物細胞)。用于進行此的方法在本領域是已知的。用于選擇性地裂解非微生物細胞以選擇性地富集樣品中的微生物的方法,其不依賴于知曉微生物的身份,例如描述于US2013/0171615、US2012/0231446、US2010/0184210、US7893251和US8481265,并且用于從樣品選擇性地移出真核細胞的方法描述于US2005/0202487。用于分離DNA的方法在本領域是已知的,并且可以使用已知且描述的多種不同方法中的任一種。一般來講,這些涉及裂解細胞,其可以通過多種手段和方式進行,和回收釋放的DNA,同樣用于此的多種手段和程序是已知的和可得的,并且可以使用這些之中的任一種。裂解步驟可以取決于懷疑的微生物的性質,盡管通常許多程序可以裂解微生物。如以上提及的,取決于樣品的性質,優選地此步驟涉及分離微生物DNA,更特別地選擇性地分離或富集微生物DNA。這通常可以通過選擇性地裂解樣品中的試驗受試者細胞,同時保持微生物細胞完整而進行。許多程序,并且實際上試劑盒是已知的和可得的,其可以實現此,例如來自Molzym(德國)。例如,在沒有裂解等分試樣中存在的微生物細胞的情況下,人細胞,例如人血細胞可以容易地被裂解。這同樣適用于可能存在的其它人或哺乳動物細胞,取決于樣品。在血液或血液來源樣品的情況下,優選分離并且特別地選擇性分離微生物DNA。因此,來源于待試驗受試者且試驗等分試樣中存在的臨床樣品中的任何細胞可以使用不裂解微生物細胞的裂解條件進行裂解。例如,恰當裂解試劑,例如裂解緩沖液,可以添加至試驗等分試樣。在此第一裂解步驟中釋放的DNA,或更通常是核酸,例如通過降解(例如DNA-降解酶,例如DNA酶)和/或通過可以從樣品分離或移出DNA或核酸和/或分離任何未裂解的微生物細胞的任何方法,例如諸如過濾、柱分離、沉淀、離心等的分離方法可以移出,盡管在一個實施方案中,所述方法的優選特征在于它不包括離心。因此,在一個實施方案中,DNA分離的步驟不包括離心,并且實際上在另一個優先實施方案中,所述方法作為整體不包括離心。在這些步驟中使用的任何酶、特別地任何DNA-降解酶可以被失活或移出,例如通過加熱或通過添加另外的蛋白降解酶。接下來,保留在或來自處理后的等分試樣(例如來自第一裂解步驟的裂解產物)的微生物細胞接著通過引入裂解條件進行裂解,例如添加用于裂解微生物細胞的恰當裂解試劑(裂解緩沖液)。許多這樣的緩沖液在本領域是已知的和/或商購可得,例如來自Molzym(德國)。然后可以回收在第二微生物裂解步驟中釋放的微生物DNA,例如從反應混合物(裂解產物)分離。如上,用于此的許多技術可得并且可以使用這些中的任一種。在一個優選實施方案中,此步驟不包括離心。然后使回收的DNA或回收的微生物DNA進行步驟(e)的分子試驗。在進行步驟(e)的的分子核酸試驗之前,可能期望使從試驗等分試樣分離或富集的雙鏈DNA,特別地微生物DNA變性。此外,可能有利或期望(但不必需)的是在進行步驟(e)的分子試驗之前使DNA片段化。這樣的步驟可以通過本領域已知的常規方法實現,例如片段化可以通過熱或通過酶降解方法,例如使用限制性或其它核酸內切酶機械地實現。基本地,分子試驗使用核酸探針或引物,其被設計成雜交至特定微生物核酸序列或能夠選擇性地擴增特定微生物序列,并且基于它們是否雜交或延伸(例如成功地啟動擴增反應),其可以用來檢測是否存在特定微生物以及它是否含有遺傳抗微生物劑耐藥性標記物。這樣的核酸試驗,以及用于它們的雜交探針或引物在本領域是已知的并且描述于文獻。雜交探針將包含能夠雜交至所需或所選靶序列,優選地特異性地雜交的核苷酸序列。因此,它可以包含與靶序列互補的序列。不要求絕對或100%互補性,只要所述探針在非靶核苷酸序列存在下能夠特異性地雜交至靶序列。通過檢測雜交,可以檢測是否存在靶序列,并且使用用于檢測核酸探針的雜交的不同模式的許多雜交測定形式是已知的并且可以使用。一般來講,步驟(e)的檢測可以通過檢測雜交探針發生。如以上討論的,雜交探針的檢測可以包括或涉及擴增該雜交探針。因此,除了雜交探針,可以提供一種或多種用于該雜交探針的擴增引物。在本發明的情況下,靶序列首先(在步驟(e)(i))是微生物的核苷酸序列認同式,即是特定微生物的特性,例如屬、種或株的特性并且可以用作用于鑒別該微生物的基礎的核苷酸序列。因此,認同式核苷酸序列可以相應地被視為給定特定微生物的基序或標簽,或序列特性。典型地它可以是對于該微生物是獨特的(在屬、種或株水平)的序列。大量這樣的認同式序列已被鑒別和報道,并且可以使用這些中的任一個。例如,靶序列可以是來自16srRNA基因的核酸序列。可選地將是常規事情的是鑒別這樣的基序/標簽/認同式序列,例如使用生物信息工具來分析微生物基因組序列,以及基于這些設計恰當雜交探針,包含能夠雜交至所鑒別序列的序列。可選地,不是使用雜交探針,可以使用一種或多種引物,并且可以使用基于引物的方法,例如基于聚合酶引物延伸的方法,來檢測和鑒別微生物。典型地,這將是擴增方法,最常見地PCR,但可以使用其它擴增方法或引物延伸方法,包括例如LCR、NASBA、MDA等。引物或引物組可以雜交至認同式核苷酸序列,或它(它們)可以以使得認同式序列可以被擴增的方式(例如使其連接(flank))進行雜交。術語“擴增的”在此上下文(也參見以上)中廣義地用來意指提供認同式或標記物序列的拷貝(包括互補拷貝)的任何方法,并且包括簡單引物延伸反應,和線性以及指數擴增。對于PCR,引物對將用于各個微生物認同式序列。更簡單地說,用于本發明的雜交探針或引物可以對于以下各項是特異性的:(i)作為微生物的認同式的核苷酸序列或(ii)代表遺傳抗微生物劑耐藥性標記物的核苷酸序列。因此,可選地定義的,在如上提出的本發明的方法中,步驟(e)可以表述為以下:e)在所述DNA上進行核酸試驗以鑒別微生物以及檢測在所述微生物中存在或不存在一種或多種遺傳抗微生物劑耐藥性標記物,其中所述核酸試驗使用以下各項進行:i)用于微生物鑒別的一種或多種核酸探針和/或引物,各個所述探針和/或引物對于作為給定微生物的認同式的核苷酸序列是特異性的;和ii)用于抗微生物劑耐藥性標記物檢測的一種或多種核酸探針和/或引物,各個所述探針和/或引物對于代表遺傳抗微生物劑耐藥性標記物的核苷酸序列是特異性的;并且檢測所述探針或引物是否已雜交至所述DNA和/或所述引物是否已延伸(例如已發生擴增反應)。如上所述,檢測步驟可以包括或涉及在探針已雜交至其靶核苷酸序列之后使其擴增。如在以下更詳細描述的,擴增可以設計成依賴于雜交。因此,可以僅擴增已雜交的探針。以這種方式,可以組裝和/或構建雜交探針或引物組或群組,其能夠雜交至或擴增所選微生物的核酸,并由此檢測該微生物是否存在于試驗等分試樣(并由此樣品)中。通過檢測存在哪一種微生物(即哪一種鑒別探針雜交或哪一種引物/引物組被延伸或啟動擴增反應),可以鑒別在樣品中存在哪一種微生物。通過舉例的方式,用于微生物鑒別的雜交探針或引物可以包含各自能夠特異性地鑒別所選微生物組(例如主要或最常見的已知膿毒癥病原體)中的探針或引物。例如以上提供的具體細菌和真菌物種的列表代表大約95%的最常見膿毒癥病原體,并且可以構成根據本發明的代表性微生物群組。因此,在步驟(e)(i)中,鑒別探針和/或引物(或引物組)的多樣性將有利地被使用。多樣性在本文中廣義地定義為兩倍以上,或更特別地,3、4、5、6、7、8、9、10、15、20、30、40、50、60、70、80、100、200、300、400或500倍以上。以及用于鑒別的多種不同微生物,可以使用不同的探針或引物/引物組用于要檢測的給定微生物,例如2、3、4或5種探針或引物或更多/靶標微生物。由于微生物群組可以包括至少10、15、20、25、30、40、50種以上(例如多至60、70、80、90或100種微生物),所以典型地將使用至少30個以上的群組或組,例如50、70、80、100、200、300、400或500個以上的鑒別探針或引物(或引物組)。根據本領域已知的程序,基于探針或引物的核酸試驗可以使用多倍的成千或許多的幾十個或幾千個探針或引物,并且這樣的程序由本發明涵蓋。其次,在所述方法的步驟(e)(ii)中,用于雜交探針或引物的靶序列是作為抗微生物劑耐藥性標記物的核苷酸序列。在現有技術中已經鑒別和報道了大量這樣的標記物,并且已經設計了用于檢測它們的雜交探針/引物。可以使用這些中的任一個或者可選地可以基于這樣的被鑒別出的標記物序列設計另外的探針或引物。此外,另外的標記物序列可以通過常規篩選方法鑒別。抗微生物劑耐藥性標記物可以是編碼耐藥性機制的組分例如酶或修飾蛋白的核苷酸序列,或者它可以簡單地是已被鑒別出與對于抗微生物劑的耐藥性相關的核苷酸序列或序列變體。通過舉例的方式,β-內酰胺酶代表針對用于細菌的抗生素的耐藥性的重要機制并且負責對于某些抗生素類的耐藥性。出現能夠形成擴展譜β-內酰胺酶的細菌(ESBL-形成菌)。ESBL代表快速發展耐藥性問題的近期實例。已報道了能夠鑒別高度多樣的β-內酰胺酶的探針(Barisic等人,2013,DiagnosticMicrobiology&InfectiousDisease,77(2),118-125)。其它已知的遺傳性耐藥性標記物包括mecA、mecC、vanA、vanB、CTX-M、KPC、VIM、NDM和OXA-48。環丙沙星耐藥性突變已經例如在耐抗生素的圖萊里桿菌(F.tularensis)、炭疽芽孢桿菌(B.anthracis)和鼠疫耶氏菌(Y.pestis)中鑒別出來,并且是可得的。雜交探針可以采取多種形式,并且以其最簡單的包括能夠雜交至靶序列的核苷酸序列和通過它們可以直接或間接檢測的另外的序列或部分。因此,這樣的探針可以具有直接或間接可檢測的標記,例如用分光光度法(例如熒光地)可檢測標記,或可以參與給出信號或產生信號的反應的報告分子或部分,例如酶或酶底物或輔因子,或者其可以是親和性標簽,通過該標簽探針可以被選擇性地標記或在雜交反應之后被選擇性地分離或分開。不同形式的標記或被標記的核酸探針是廣泛已知的和報道的,例如分子信標和其它基于FRET的探針。然而,不是借助于在探針之中或之上提供的標記或報告子部分來直接檢測雜交的探針的存在,可以間接地檢測所述探針,例如通過檢測該探針的擴增產物。不同的雜交探針形式是已知的并且可以使用這些之中的任一種,例如分子倒置探針、蝎形探針和扣鎖探針。分子倒置探針和扣鎖探針例如被設計成在雜交至它們的靶序列后通過連接被環化,并且所得的環化探針可以通過擴增例如通過RCA檢測。扣鎖探針代表根據本發明的優選類型的雜交探針。扣鎖探針最初描述于1994(Nilsson等人,1994,Science,265,2085-2088)并且自那時起已被開發和廣泛用于檢測多種核苷酸序列,并且實際上更廣泛地用作寬范圍分子的測定中的報告子(參見例如EP0745140、EP0964704、EP0951565和Hardenbol等人2003.Nat.Biotechnol.21,673-678)。扣鎖探針在其5’和3’末端包含可以雜交至靶核苷酸序列的序列。在一個實施方案中,扣鎖探針的5’和3’末端可以雜交至所述核苷酸序列以使得它們彼此直接相鄰。在另一個實施方案中,扣鎖探針的5’和3’末端可以雜交至所述核苷酸序列以使得它們彼此不是直接相鄰并且介于其間的間隙可以通過被雜交的3’末端的聚合酶延伸或通過間隙填充寡核苷酸而被填充。然后將所述末端連接在一起以形成可以隨后方便地通過基于滾環擴增(RCA)的方法進行檢測的核酸環。雙重識別(兩個靶雜交區)以及對于連接的要求意味著扣鎖探針是高度特異性的并且良好適于檢測在復雜基因組背景中的獨特序列。單分子環化方法和環化的探針的基于RCA的檢測都將它們自己良好地適應于多重檢測,并且大量的探針可以組合使用并且在沒有干擾問題的情況下一起擴增。然而,盡管RCA是優選的用于檢測環化的扣鎖探針的方法,但是本發明不限于此并且可以使用其它擴增方法,包括例如PCR,或其它檢測方法,例如基于選擇性地檢測與線性相對的環形核酸。適用于RCA的鏈置換聚合酶是已知的,例如Φ-29聚合酶。環化的扣鎖探針通過RCA的擴增導致形成多聯RCA產物,其包含扣鎖探針序列的互補序列的幾百個重復。在本發明的一個實施方案中,RCA產物可以通過熒光標記的檢測寡核苷酸的雜交進行檢測。由于RCA反應是線性的,并且因此具有慢的擴增能力,所以已經開發了大量方法,其可以增強擴增并增大來自RCA反應的信號,包括例如高度支化的RCA方法,如由Lizardi描述的(US6,183,960和US6,143,495)。可以使用這些中的任一種。RCA產物也可以通過PCR進一步擴增,或者實際上可以使用核酸擴增的任何其它方法或任何信號擴增方法。用于增強RCA擴增的特別有用的方法是環至環擴增(C2CA)。這描述于Dahl等人,2004,PNASUSA,101,4548-4553和WO03/012199。C2CA涉及將來自第一RCA反應的多聯滾環擴增產物(RCP)裂解成單體(例如各自對應于多聯體的串聯重復,即環化的扣鎖探針的互補拷貝),然后使單體再環化,各自進入可以在進一步的RCA反應(即另一輪的RCA)中用作模板的另外的環中。這可以重復一次或多次。重復RCA導致信號的放大。RCP的裂解可以通過將寡核苷酸雜交至在RCA產物的各個重復(單體)中存在的序列(限制性位點序列)以形成雙鏈限制性裂解或識別位點并用限制性酶裂解以將產物裂解成單體而實現。相同的寡核苷酸,例如以過量添加的,可以用作用于通過裂解釋放的單體的環化的連接模板。在裂解以釋放單鏈單體之后可以包括變性步驟,其可用于雜交至過量的未裂解或添加的寡核苷酸。C2CA反應的更改描述于我們的于2013年11月29日提交的申請號1321123.0的一同待審申請的申請英國專利申請,通過引用結合于此。在此改變的C2CA程序中,第二或任何隨后輪的RCA的效率通過以下得到提高:即減小環化單體的尺寸,使得用于第二輪RCA的環形模板相比于第一RCA模板(這里是環化的扣鎖探針)在尺寸方面被減小,并由此可以增大第二(和隨后的)RCA反應的速度。裂解RCP以使釋放的單體在尺寸上被減小或者用于其它方式實現單體尺寸減小的步驟的多種手段描述于該一同待審的申請。通過進行第二RCA反應來放大來自RCA反應的信號的其它方式也已有報道并且可以使用這些中的任一種。一種這樣的方法是在WO2014/076209中描述的所謂的OlinkAB的超級RCA(sRCA)方法。在此程序中,進行第二RCA反應,其依賴于第二RCA反應,但是其不擴增第一RCA產物。第二RCA產物保持物理地連接至第一RCA產物,以便來自第二RCA產物的信號被定位至第一RCA產物。通過利用被雜交(直接或間接地)至第一RCA產物以擴增第二RCA模板環的RCA引物,第二RCA產物可以通過延伸所述RCA引物產生,依據引物的雜交,該RCA引物被雜交,并且因此連接至第一RCA產物。由于第一RCA產物是包含用于第一RCA反應的模板環的串聯重復互補拷貝的多聯體,所以用于第二RCA的RCA引物將結合至其關聯引物結合序列的重復拷貝,其在整個第一RCA產物中被重復。換句話說,第一RCA產物將包含用于第二RCA的RCA引物的重復結合位點,一個在串聯重復(多聯體的"單體")的每一個中。各個這樣的引物可以啟動第二RCA反應,導致增加的(多于線性的)擴增。RCA或C2CA反應的RCP可以直接檢測,如所指出的,例如借助于被標記的檢測寡核苷酸,其可以雜交至在RCP中的串聯重復中的序列或通過將被標記的核苷酸結合到RCP中,或從RCP釋放的單體可以被檢測。作為極長的核酸多聯體(典型地包含500-1000個模板環序列的拷貝)的RCP分解成DNA的隨機卷繞的無定形“團”或球,其可以容易地被檢測,并且實際上可視化。因此這樣的團可以用顯微鏡或通過任何其它方便手段成像或檢測,從而檢測(間接地)扣鎖探針與其靶標的雜交(以及它們隨后通過RCA/C2CA的連接和檢測)。還存在檢測RCP的其它手段,例如通過流式細胞儀或通過在固體載體上捕獲RCP并借助于被標記的檢測寡核苷酸或其它標記手段,例如結合的被標記寡核苷酸或核酸染色或染料等對其進行檢測。RCP團的檢測提供擴增的單分子檢測(ASMD)的方便手段,這樣的基于C2CA和計數RCP團以檢測細菌和孢子的方法的使用由Goransson等人,2012PLOSone,7(2),e31068描述,并且這樣的方法可以根據本發明使用。在RCP團中的標記的濃縮或富集意味著相比于周圍溶液,在該團中存在高濃度的標記。這消除了對于洗滌的需要并且使得同源方法能夠被使用-反應產物可以在流動池中容易地檢測,例如由Jarvius等人,2006,NatureMethods,3,725-727描述。可選地,不是檢測RCP多聯體本身,RCP可以裂解成單體并且可以檢測單體。同樣這可以借助于直接結合到單體中的標記或通過將檢測寡核苷酸雜交至單體,例如如上所述或根據本領域已知的原理。例如,單體可以結合到微陣列上并且陣列結合(雜交)的單體可以通過被標記的檢測寡核苷酸的雜交進行檢測。因此,可以提供這樣的陣列,其帶有(例如通過沉積到其上)能夠結合(雜交)至RCP單體的寡核苷酸。陣列寡核苷酸可以設計成與RCP單體互補并且可以經由胺、硫醇或環氧基團或者通過任何已知的偶聯化學而共價偶聯至陣列底物,或者可以利用已知技術例如光刻法在陣列上原位合成它們。這樣的陣列然后可以同樣根據本領域熟知的方法進行掃描或成像并分析。因此,通過檢測特定RCP單體是否已雜交至陣列,可以檢測特定扣鎖探針是否雜交至其靶標并且因此連接并擴增。因此,在本發明的某些實施方案中,可以使用基于固體相的方法。固體載體可以用來實施所述方法多個階段或步驟。例如,以及或對以上討論的RCP單體的可能陣列檢測的可選,固體相可以用于所述方法的早期步驟。在一個這樣的實施方案中,來自從用于分子測試的試驗等分試樣分離的DNA或其中的靶標DNA可以固定在固體載體上。因此,可以包含作為用于要在步驟(e)中實施的分子試驗的靶標的核苷酸序列的DNA片段或DNA分子,例如在分子測試之前或與其同時,可以使用捕獲探針從步驟(d)的分離的DNA選擇性地捕獲。可以使用捕獲探針,其雜交至靶標DNA(在不同于雜交位點的位點,用于核酸鑒別和耐藥性檢測探針或引物)。捕獲探針可以添加至分離的或富集的DNA,例如在所述鑒別和耐藥性檢測探針或引物之前或同時。捕獲探針可以利用用于固定化的工具固定或提供有用于固定化的工具,以使它們可以在結合至靶標DNA之后被固定。這樣的用于固定化的工具可以包括例如能夠結合至其關聯結合伴侶(提供在固體載體上)的親和性分子。通過代表性實例的方式,捕獲探針可以是生物素化的,用于結合至鏈霉親和素或抗生物蛋白(或其變體),其偶聯至固體載體。如本領域已知的,可以使用任何方便的固體載體。例如,固體載體可以包括微陣列、印跡膜、凝膠、顯微鏡載玻片、孔、試管或其它容器或器皿,或者珠或粒子,例如玻璃、聚合物、塑料或磁性珠或粒子。靶標DNA分子可以可選地直接固定在固體載體上。因此在本發明的一個優選實施方案中,靶標DNA分子可以固定在經由生物素化的捕獲寡核苷酸綴合至鏈霉親和素的固體載體上。在本發明的一個可選實施方案中,靶標DNA分子可以是生物素化的并固定在綴合至鏈霉親和素的固體載體上。在進行步驟(e)的分子試驗的同時,含有臨床樣品的培養器皿保持在培養(如果進行預培養步驟)或者使其進行培養步驟(步驟(c))。如以上指出的,培養簡單地涉及在適合于或有益于微生物生長的條件下孵育培養器皿。因此這個步驟可以如以上對于預培養指出的那樣進行。這個步驟意味著如果從步驟(e)的分子試驗沒有獲得陽性微生物鑒別,則樣品可用于基于常規表型和/或生物化學試驗的基于傳統培養的鑒別,或實際上通過任何其它手段用于進一步的ID測試-這些試驗不被延遲,因為培養正在進行,并且不需要提取另外的臨床樣品或開始另外的培養。實際上在此時,如果在步驟(e)中沒有鑒別出微生物,則培養如本來那樣繼續,或者培養器皿可以轉移至另一個培養系統(例如設計用于微生物鑒別和任選地還用于抗微生物劑敏感性測試的自動化培養系統或箱)。在適當的培養期之后,可以進行這樣的進一步ID試驗以及敏感性試驗,后者例如通過常規AST測試手段,例如通過濁度計評估的肉湯稀釋培養或紙片擴散試驗以確定MIC。如果在試驗等分試樣中鑒別出微生物,則在步驟(c)中已被保持培養的經過培養的臨床樣品上進行抗微生物劑敏感性試驗。方便地,這可以涉及從培養器皿抽取或移出另外的(例如第二或隨后的,取決于已取出多少等分試樣用于分子測試)等分試樣,并在此上進行AST測試。所述方法還可以包括在此階段的富集用于微生物的等分試樣或經過培養的臨床樣品的另外步驟。適用于此的程序在上文討論,并且可以包括從等分試樣/培養樣品移出或分離非微生物細胞(即試驗受試者細胞)。在一個實施方案中,微生物細胞可以例如通過過濾分離。用于AST測試的識別和規定條件存在,并且可以遵照以便可以獲得易于可比較的結果,其比得上或可以與在其他實驗室中進行的試驗進行比較。這可能涉及例如使用規定的培養基和培養條件。因此,在開始抗微生物劑敏感性試驗之前,用于AST測試的另外的被移出的等分試樣(或等分試樣成分/剩余部分等),或來自其的分離的或富集的微生物,可以轉移到用于微生物培養的合適培養基,例如Mueller-Hinton培養基(MH-培養基)。微生物可以在各種各樣的抗微生物劑存在下生長以確定它們對于給出的抗微生物劑的敏感性。根據本發明,基于微生物的身份,以及基于在微生物內鑒別出的任何遺傳抗微生物劑耐藥性標記物的性質來選擇抗微生物劑。抗微生物劑以及要使用的量,也可以根據當前臨床實踐,例如根據當前在實踐中使用的哪一種抗微生物劑來處理所鑒別出的微生物來選擇,以便可以評估微生物對所選擇的當前接受的或識別的抗微生物劑處理的敏感性。因此抗微生物劑可以基于已知對于所鑒別出的微生物有效的那些,或當前在實踐中用來處理微生物的那些進行選擇,并且排除基于耐藥性標記物的存在可以預期對其具有耐藥性的任何試劑,或者這樣的試劑可以被包括并且使用的量可以進行選擇以允許確定可以是有效的抗微生物劑的量或濃度,而不管耐藥性標記物的存在。將抗微生物劑添加至生長培養基至最終濃度或量的范圍。在本發明的一個優選實施方案中,可以進行抗微生物劑的系列稀釋。在AST試驗中生長或培養樣品/來自其的微生物的步驟可以通過任何已知或方便的手段發生。可以使用固體或液體相培養。因此,例如,在一個優選實施方案中,樣品/微生物可以在含有抗微生物劑的板或其它固體培養基之上或之中培養并且微生物生長可以通過使微生物可視化(例如成像)(即使板等成像)來確定。因此,使培養物可視化或對其進行直接成像作為監測或評估生長的手段。相應地,在一個優選實施方案中,直接分析培養物以監測/評估生長。例如,培養物可以在板的孔中生長并且這些孔可以被成像。可選地,樣品(或等分試樣)可以以時間間隔或在不同時間點從培養物移出(或取出),并且被移出的樣品(等分試樣)可以對于微生物生長進行分析。這可以通過任何手段進行,包括例如借助于分子試驗,例如基于核酸的試驗。因此可以使用檢測探針和/或引物,其結合至微生物細胞或結合至從微生物細胞釋放或分離的組分。這可以包括例如如上對于步驟(e)的鑒別試驗所描述的核酸探針或引物。在其它實施方案中,微生物細胞可以直接檢測,例如通過染色,如在以下更詳細地描述的。除了其中允許微生物在沒有任何抗微生物劑下生長的陽性對照之外,每個抗微生物劑優選以至少一個濃度使用。例如,使用抗微生物劑的2、3、4、5、6、7或8個以上濃度。以稀釋系列使用的濃度在相應濃度之間可以相差兩倍。術語抗微生物劑包括殺滅微生物或抑制其生長的任何試劑。本發明的抗微生物劑可以特別地包括抗生素和抗真菌劑。抗微生物劑可以是殺微生物的或抑制微生物的。多種不同種類的抗生物是已知的,包括針對真菌或特別地多組真菌有活性的抗生素,并且可以使用這些中的任一種或全部。抗生素可以包括β內酰胺抗生素、頭孢菌素、多粘菌素、利福霉素、閏年霉素、喹諾酮、磺胺類、大環內酯類、林可酰胺類、四環素類、氨基糖苷類、環脂肽類、甘氨環素類、惡唑啉酮類、閏年霉素或碳培南類(carbapenams)。本發明的優選抗真菌劑可以包括多烯類、咪唑類、三唑類和噻唑類、烯丙基胺類或棘白菌素類。因此,抗微生物劑敏感性可以通過培養被移出的等分試樣(或等分試樣成分等)或來自步驟(c)的經過培養的臨床樣品,或由其分離或富集的微生物,并在一系列時間點上分析AST培養物而確定。對于以上的培養步驟,用于AST的培養可以在促進微生物生長的任何溫度發生,例如在約20℃至40℃之間,或20至37℃,優選地在約25℃至37℃之間,更優選地在約30℃至37℃之間或30至35℃。在一個實施方案中,AST培養物可以在約35℃培養。AST培養物可以在多個時間點進行分析以監測微生物生長。例如,在開始培養后的時間點0、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23或24小時分析。培養物可以在開始培養后立即(其中t=0)進行分析。培養物也可以在開始培養之后超過24小時的時間期進行分析。典型地,培養物可以在開始培養后的0、1、2、3、4、6和24小時分析。然而,在以下實施例中獲得和報告的結果顯示,短的孵育時間可以足以用于檢測不同的微生物生長例如4小時。因此,也可以使用較短的多至8、7、6、5、4、3或2小時的總孵育時間,例如每小時或每2小時或90分鐘進行分析。如上所述,培養物通常在兩個以上時間點進行分析,例如在多至培養的4、5或6小時的兩個以上時間點。本發明要求在抗微生物劑敏感性試驗期間監測微生物生長。用于監測微生物生長的許多方法是已知的并且用于AST試驗,例如包括濁度測量、色度確定、光檢測、光散射、pH測量、分光測量和熒光檢測。可以使用這些中的任一種。然而,根據本發明的一個優選實施方案,生長可以通過成像方法確定或評估樣品中的微生物細胞的數目和/或量和/或尺寸和/或面積來進行檢測和評估,如上所述,微生物細胞可以包括在集落和/或聚集體中的細胞。這可以通過已知用于測量或檢測微生物的任何方法,通過評估或確定在抗微生物劑存在下生長之前和/或之后樣品中存在的微生物的數目或量而實現。這樣的確定可以涉及確定微生物細胞、聚集體和/或集落的數目和/或尺寸。同樣,用于此的技術是已知的和可得的。因此,生長可以通過隨時間監測樣品中微生物和/或微生物細胞和/或集落和/或聚集體的數目和/或量和/或尺寸而測量。這可以直接或間接進行測量。樣品中微生物的數目或量可以直接通過血球計、流式細胞儀或自動化顯微鏡進行測量。微生物可以在檢測之前被固定和/或滲透。可選地,微生物開在體內條件下進行檢測。用于通過使用流式細胞儀的細菌細胞計數監測的AST測試的方法描述于Broeren等人,2013,Clin.Microbiol.Infect.19.286-291。其中細菌生長并通過多通道流體盒中自動化顯微鏡計數的用于進行AST試驗的方法由Price等人2014,J.Microbiol.Met.98,50-58和由Metzger等人,2014.J.Microbiol.Met.79,160-165,并且由AccelerateDiagnostics(參見例如WO2014/040088A1、US2014/0278136A1和US8,460,887B2)描述。在這些方法中,細菌在表面上固定并生長,并且通過在兩個以上時間點對該表面成像來評估個體細菌和/或集落的存活力和/或生長(包括測量集落生長)。這樣的方法可以根據本發明使用。已知的其它方法如由Fredborg等人,JClinMicrobiol.2013Jul;51(7):2047-53,和由Unisensor(US8780181)描述,其中使用亮場顯微鏡將細菌在溶液中成像,通過提取該溶液的一系列堆疊圖像(物平面),并對樣品中存在的細菌進行計數。盡管可以使用基于利用成像來監測微生物生長的任何方法,但是本發明的方法優選地不依賴于對個體細胞進行計數或依賴于監測個體細胞或集落的生長(例如依賴于監測個體細胞或集落在尺寸方面的增加,例如根據AccelerateDiagnosticsInc.的方法)。因此,本發明不限于(并且在優選實施方案中不涉及)使用固定位置用于對AST培養物或AST培養樣品進行成像。相反,根據本發明優選監測AST培養物或培養樣品中的細胞的大部分生長,例如通過對視野中的大部分細胞進行成像。視野中的微生物細胞物質(生物質)的量(例如面積)可以通過成像確定。細胞/微生物生物質可以直接檢測(例如通過顯微鏡或照相機等),例如使用亮場顯微鏡,或者微生物細胞可以被染色用于檢測,例如通過在預定或要求的生長時間期之后將染料添加至AST培養物或培養樣品。在另一個特別實施方案中,AST培養物或培養樣品可以直接成像或可視化,而使微生物細胞固定化,例如無需施加力如電泳以使細胞定位至用于成像的檢測位置或表面。在這樣的成像方法中,可以應用算法來根據本領域已知的方法和原理從圖像確定微生物生長的量。因此,基于圖像中微生物細胞物質/生物質的數目、尺寸和/或面積(例如圖像/視野中的所有微生物細胞物質,例如被成像的總細胞物質,的量),統計學方法可以應用至微生物細胞的圖像。基于在培養物中存在的微生物和抗微生物劑的身份,可以撰寫算法以考慮不同生長模式和/或形態。這樣的計數或成像方法允許在AST試驗中微生物的數字表型分析。已獲得數據,其顯示這樣的數字表型確定得到與參照技術(微量肉湯稀釋法)類似的MIC值。使用這樣的方法的特別優點在于,抗微生物劑敏感性測試可以在包含寬范圍的微生物的濃度或量的樣品上進行,并且在進行抗微生物劑敏感性測試之前不必需使用標準化微生物滴定。本發明的一個有用特征是使用不同濃度的微生物的能力。包含至少103CFU/ml的樣品可以用于樣品的方法,例如可以使用包含至少104、105、106、107、108或109CFU/ml的樣品。可選地,可以使用包含低于103CFU/ml,例如至少102CFU/ml的樣品。在本發明的方法中,也可以使用包含低于102CFU/ml的樣品。在本發明的一個實施方案中,微生物可以通過在確定樣品中的微生物的數目或量之前添加對微生物染色的標記物(即染色劑或染料),或通過利用微生物內在性質的方法如例如相位對比或本領域已知的用于定量樣品中細菌的數目的任何其它方法進行檢測。合適的染色劑可以包括有色或熒光染料,例如革蘭氏染色或用于肽聚糖或DNA燃燒的其它染色,作為使微生物可視化的手段。在本發明的一個特別實施方案中,微生物內的DNA可以使用DyeCycleTM染色。其它DNA染色劑是熟知的和可得的。實際上在本領域可得用于對細菌染色的染色劑的數目巨大并且大量的這樣的染色劑已被記載,包括在標準參考文本中,并且商購可得,例如自LifeTechnologies。通過染色對微生物的直接標記易于進行、方便和成本有效,并且因此代表優選的實施方案。因此,例如,微生物可以在微滴定板的孔中生長用于AST試驗,并且生長期結束,可以添加染料或染色劑并且板孔可以被成像,并通過確定微生物細胞、聚集體或集落的數目和/或尺寸,例如通過計數或成像,而對微生物的數目或量進行評估。可選地,使用流式細胞儀或類似類型的儀器,例如來自Q-lineaAB(瑞典)的Aquila400儀器,例如如申請號為61/979319的美國專利申請號所述,可以對微生物進行計數。在一個可選實施方案中,微生物可以經由該微生物內或上的生物學特征特異性地標記。“生物學特征”可以例如是微生物之中或之上的分子,例如在細胞表面上表達或定位的蛋白或其他生物分子。例如,標記,例如有色或熒光標記,可以偶聯至特異性地結合至特定生物學特征的蛋白或其它親和性結合分子。在一個實施方案中,所述蛋白可以是凝集素、親合體或抗體,或抗體片段。以這種方式標記的微生物可以如之前描述的進行檢測例如計數。在另一個實施方案中,鄰近探針可以用來檢測微生物內或上的特定生物學特征。在本發明的另一個可選實施方案中,微生物可以使用以上討論(用于分子試驗)的扣鎖探針和基于RCA的被擴增單個分子檢測(ASMD)方法檢測和計數。這樣的方法使得單個微生物細胞能夠被檢測和計數。因此,微生物可以通過扣鎖探針的結合進行檢測并且樣品中的微生物的數目可以間接地通過經由被環化的扣鎖探針的RCA產生的被擴增的信號進行測量。各個RCA產物(團)可以是單個微生物的指示。微生物可以裂解并且可以使用扣鎖探針,其被設計成雜交至微生物的一個或多個核苷酸序列。這可以包括如上討論的分離DNA的步驟,并且優選地選擇性地分離或富集微生物DNA的步驟,同樣如上所討論的。由于在AST試驗中培養物通常沒有初始臨床樣品培養步驟中復雜,所以可以使用簡化的用于分離或富集微生物DNA的方案,涉及例如過濾以分離微生物和微生物細胞裂解或簡單地直接微生物細胞裂解。可選地,可以使用親和性結合分子,其結合至在微生物上存在或被裂解的微生物內的一個或多個分子,這樣的親和性探針具有扣鎖探針可以雜交至其的核酸標記或標簽,即與免疫RCA檢測程序類似。類似地可以使用鄰近探針以結合至微生物之中或之上的靶標,并且鄰近探針的核酸結構域可以用來作為扣鎖探針的連接的模板并且任選地還啟動其通過RCA的擴增。用于此的程序是廣泛已知的并且描述于文獻。如上C2CA可以用于信號擴增。樣品中的微生物的數目因此可以通過計數團的數目進行估算,所述團可以如以上樣品內的‘團’所述進行標記例如熒光標記。這因此提供獲得數字表型敏感性讀出的另一種方便手段。一般來講在進行AST試驗中有利的是處于試驗的微生物培養物是純的,即存在單個微生物。因此,在一個優選實施方案中,在步驟(f),如果在步驟(e)的核酸試驗中鑒別出了單個微生物,則進行AST試驗。即,如果確定臨床樣品僅含有單個微生物,則進行步驟(f)的AST試驗。這確保在AST試驗中可以僅使用純培養物。因此,在某些實施方案中,如果鑒別出了兩種以上微生物,則不進行步驟(f)的AST步驟并且所述方法如在步驟(g)那樣繼續。然而,這不是必要特征,并且有可能使用基于可視化或成像的微生物檢測方法來進行AST試驗,例如如由AccelerateDiagnostics提供的方法,其使用在表面上而不是在溶液中的細菌的成像,或者實際上其中被標記的微生物在流體系統,例如如上討論的Price等人2014,J.Microbiol.Met.98,50-58和Metzger等人,2014.J.Microbiol.Met.79,160-165的基于自動化顯微鏡流體盒的系統中進行檢測的方法。任何逐個細胞檢測和鑒別方法可以用于含有多于一種微生物的樣品的AST測試。方便地本發明的方法可以自動化。任何一個或多個步驟可以自動化,優選地步驟(a)至(f)的任一個或所有步驟可以自動化。以上討論的多個特定或優選步驟使得它們本身良好適合于自動化,例如優選的用于分子測試和/或AST測試的基于扣鎖探針的ASMD方法和微生物/集落計數方法。自動化培養方法已被開發,包括用于微生物鑒別和/或AST測試的血液培養方法,并且可以根據本發明使用或適于使用。自動化將提供速度的優勢和操作的便利以及復用能力,這是在臨床實驗室環境中很重要并且尤其在膿毒癥的診斷中很重要。從另一方面看,本發明提供用于檢測和表征臨床樣品中的微生物的微生物檢測裝置,所述裝置包括:含有培養基并且被布置成容納所述臨床樣品的第一培養器皿;任選地含有培養基的第二培養器皿;任選地部分移出裝置,其用于移出所述第一培養器皿的內容物的部分并將所述部分轉移至所述第二培養器皿;其中所述第一培養器皿用于培養所述臨床樣品;并且其中所述第二培養器皿被布置成接收作為所述第一培養器皿的所述內容物的所述部分的臨床樣品/培養基混合物或臨床樣品培養物,并且被布置成培養所述部分,所述裝置還包括:試驗等分試樣提取裝置,其用于移出第一和/或第二培養器皿的內容物的部分以用作試驗等分試樣;和DNA測試裝置,其用于從所述試驗等分試樣分離DNA,并且在所述DNA上進行核酸試驗以鑒別微生物以及檢測在所述微生物中存在或不存在一種或多種遺傳抗微生物劑耐藥性標記物,其中所述DNA測試裝置被布置成利用以下各項進行所述核酸試驗:i.用于微生物鑒別的一種或多種核酸探針或引物,所述探針或引物能夠特異性地雜交至或所述引物能夠選擇性地擴增作為給定微生物的認同式的核苷酸序列;和ii.用于抗微生物劑耐藥性標記物檢測的一種或多種核酸探針或引物,所述探針或引物能夠雜交至或所述引物能夠選擇性地擴增代表遺傳抗微生物劑耐藥性標記的核苷酸序列;并且檢測所述探針或引物是否已雜交至所述DNA和/或所述引物是否已參與擴增反應;其中所述微生物檢測裝置被布置成使得:如果通過所述DNA測試裝置鑒別出所給定的微生物,則將在提取所述試驗等分試樣之后通過培養由所述第一和/或第二培養器皿生產的經過培養臨床樣品和/或經過培養部分轉至抗微生物劑敏感性試驗裝置,用于通過評估生長或用于生長的標記物監測微生物生長而在所述經過培養的臨床樣品和/或經過培養部分上進行抗微生物劑敏感性試驗,并且其中在所述抗微生物劑敏感性試驗中使用的抗微生物劑的類型和濃度由通過所述DNA測試裝置檢測的所述微生物的身份和抗微生物劑耐藥性標記物確定;并且如果通過所述DNA測試裝置沒有鑒別出所給定的微生物,則所述微生物檢測裝置在所述第一和/或第二培養器皿中進一步培養所述臨床樣品和/或經過培養的部分以使進一步的微生物鑒別和抗微生物劑敏感性試驗按順序在另外的培養之后能夠進行,從而鑒別出所述微生物并且確定其抗微生物劑耐藥性分布。從另一方面看,本發明提供用于檢測和表征臨床樣品中的微生物的微生物檢測裝置,所述裝置包括:含有培養基并且被布置成容納所述臨床樣品的培養器皿;試驗等分試樣提取裝置用于移出所述培養器皿的內容物的部分以用作試驗等分試樣;其中所述培養器皿用于在提取所述試驗等分試樣之后,并且任選地在提取所述試驗等分試樣之前,培養所述臨床樣品;DNA測試裝置,其用于從所述試驗等分試樣分離DNA,并且在所述DNA上進行核酸試驗以鑒別微生物以及檢測在所述微生物中存在或不存在一種或多種遺傳抗微生物劑耐藥性標記物,其中所述DNA測試裝置被布置成利用以下各項進行所述核酸試驗:i.用于微生物鑒別的一種或多種核酸探針或引物,所述探針或引物能夠特異性地雜交至或所述引物能夠選擇性地擴增作為給定微生物的認同式的核苷酸序列;和ii.用于抗微生物劑耐藥性標記物檢測的一種或多種核酸探針或引物,所述探針或引物能夠雜交至或所述引物能夠選擇性地擴增代表遺傳抗微生物劑耐藥性標記的核苷酸序列;并且檢測所述探針或引物是否已雜交至所述DNA和/或所述引物是否已參與擴增反應;其中所述微生物檢測裝置被布置成使得:如果通過所述DNA測試裝置鑒別出所給定的微生物,則將在提取所述試驗等分試樣之后通過培養由所述培養器皿產生的經過培養的臨床樣品轉至抗微生物劑敏感性試驗裝置用于通過評估生長或用于生長的標記物來監測微生物生長而在所述經過培養的臨床樣品上進行抗微生物劑敏感性試驗,并且其中在所述抗微生物劑敏感性試驗中使用的抗微生物劑的類型和濃度由通過所述DNA測試裝置檢測的所述微生物的身份和抗微生物劑耐藥性標記物確定;并且如果通過所述DNA測試裝置沒有鑒別出所給定的微生物,則所述微生物檢測裝置在所述培養器皿中進一步培養所述臨床樣品以使進一步的微生物鑒別和抗微生物劑敏感性試驗按順序在另外的培養之后能夠進行,從而鑒別所述微生物并且確定其抗微生物劑耐藥性分布。從另一個方面看,本發明提供用于檢測和表征臨床樣品中的微生物的微生物檢測裝置,所述裝置包括:含有培養基并且被布置成容納所述臨床樣品的第一培養器皿;含有培養基的第二培養器皿;部分移出裝置,其用于移出所述第一培養器皿的內容物的部分并將所述部分轉移至所述第二培養器皿;其中所述第一培養器皿用于培養所述臨床樣品;并且其中所述第二培養器皿被布置成接收作為所述第一培養器皿的內容物的所述部分的臨床樣品/培養基混合物或臨床樣品培養物,并且被布置成培養所述部分;所述裝置還包括:試驗等分試樣提取裝置,其用于移出所述第二培養器皿的內容物的部分以用作試驗等分試樣;和DNA測試裝置,其用于從所述試驗等分試樣分離DNA,并且在所述DNA上進行核酸試驗以鑒別微生物以及檢測在所述微生物中存在或不存在一種或多種遺傳抗微生物劑耐藥性標記物,其中所述DNA測試裝置被布置成利用以下各項進行所述核酸試驗:i.用于微生物鑒別的一種或多種核酸探針或引物,所述探針或引物能夠特異性地雜交至或所述引物能夠選擇性地擴增作為給定微生物的認同式的核苷酸序列;和ii.用于抗微生物劑耐藥性標記物檢測的一種或多種核酸探針或引物,所述探針或引物能夠雜交至或所述引物能夠選擇性地擴增代表遺傳抗微生物劑耐藥性標記的核苷酸序列;并且檢測所述探針或引物是否已雜交至所述DNA和/或所述引物是否已參與擴增反應;其中所述微生物檢測裝置被布置成使得:如果通過所述DNA測試裝置鑒別出所給定的微生物,則將在提取所述試驗等分試樣之后通過培養由所述第二培養器皿產生的經過培養的部分轉至抗微生物劑敏感性試驗裝置,用于通過評估生長或用于生長的標記物監測微生物生長而在所述經過培養的部分上進行抗微生物劑敏感性試驗,并且其中在所述抗微生物劑敏感性試驗中使用的抗微生物劑的類型和濃度由通過所述DNA測試裝置檢測的所述微生物的身份和抗微生物劑耐藥性標記物確定;并且如果通過所述DNA測試裝置沒有鑒別出所給定的微生物,則所述微生物檢測裝置在所述第一和/或第二培養器皿中進一步培養所述臨床樣品和/或經過培養的部分以使進一步的微生物鑒別和抗微生物劑敏感性試驗按順序在另外的培養之后能夠進行,從而鑒別所述微生物并且確定其抗微生物劑耐藥性分布。在前述三個方面的每一個中,微生物檢測裝置可以布置成進行以上提出的任何或全部的所述方法步驟和優選/任選的步驟。因此,DNA測試裝置可以布置成實施以上所述的任何或全部的DNA測試步驟,并且抗微生物劑敏感性試驗裝置可以布置成實施以上所述的任何或全部的抗微生物劑敏感性測試步驟。所述設備可以包括用于確定樣品中存在的微生物細胞物質(即微生物生物質)的量的工具,特別地通過直接評估或確定此的工具。這可以通過視覺地并且尤其通過成像確定微生物生物質的量實現。因此,所述設備可以包括用于獲得2D圖像的成像工具(例如顯微鏡和任選的照相機)。所述設備可以包括用于處理圖像以確定微生物細胞物質的量的處理器。所述處理器可以配置成確定微生物生物質的面積(更特別地在所考察的視野例如圖像中的微生物生物質的面積)。更通常地,成像工具和處理器可以配置成確定微生物和/或微生物集落或聚集體的量和/或數目和/或尺寸。這可以包括對細胞或集落進行計數,但不限于這樣的方法并且包括通過評估(或確定)微生物細胞、集落或聚集體的尺寸、面積、形狀、形態和/或數目來視覺地評估微生物生長的量的任何工具(術語“聚集體”包括物理上鄰近的細胞的任何集合例如叢或簇;這可以包括已經聚集或粘在一起的細胞的非克隆叢/簇(例如已聚集的相鄰細胞)以及克隆集落。用來測量微生物生長的參數可以(但不需要)根據微生物的身份(在步驟(e)中確定)和步驟(f)中使用的抗微生物劑變化。實際上,取決于有機體和所使用的抗微生物劑,細胞的形態或生長模式可能受影響,并且這可以從“正常”或“典型”的形態或生長模式(例如在沒有抗微生物劑存在下)改變或變化。盡管一些AST生長監測方法可以取決于檢測這樣的變化,但是根據本發明不是必須考慮這樣的變化并且可以確定微生物生長或生物質的量(例如面積),而與形態和/或生長模式無關。因此可以使用同樣的生長監測方法,而不管微生物細胞和/或所使用的抗微生物劑。培養基可以在裝置運行之前添加至第一和/或第二培養器皿,或當供應時第一和/或第二培養器皿用培養基填充。典型地第一和/或第二培養器皿將是消耗品。在臨床樣品在微生物檢測裝置中時其可以添加至第一培養器皿,或在將器皿插入到微生物檢測裝置中之前其可以添加至在裝置外部的器皿。第一培養器皿可以布置成接收臨床樣品,并且這可以在將培養基引入到培養器皿中之前、之后或同時出現。第一和/或第二培養器皿可以是用于處理感興趣的臨床樣品的任何合適類型的器皿。在一個實例中,臨床樣品是血液樣品。對于血液樣品,血液可以從患者抽入到在微生物檢測裝置外部的培養器皿中,然后可以將含有該樣品和培養基的第一培養器皿插入到微生物檢測裝置中。臨床樣品或部分在第一和/或第二培養器皿中的進一步培養可以在如早期測試步驟那樣在設備的相同構件中出現,或可選地第一和/或第二培養器皿可以轉至分開的設備,其中微生物檢測裝置因此包括多個分開的部件。在后一種情況下,第一和/或第二培養器皿可以在提取期間以使得其可以在另一個專用設備中的進一步培養步驟的期間被培養的方式處理,這可以有利地是已在所討論設施(其可以例如是醫院)處的恰當位置的設備。因此,使得第一和/或第二培養器皿可用于繼續培養并且這可以在與之前步驟的相同設備內部或該設備外部并且在所述裝置的另一個分開的部件中。附圖說明本發明現在將參考以下附圖在以下實施例中更詳細地描述,其中:圖1在(A)中示出了用于檢測樣品中的微生物的樣品微陣列組,并且在(B)中示出了對于一系列微生物產生的信號的熒光強度。在圖1A中,在圖像的四個角落處和左手邊中間的斑點是用于圖像比對的參考斑點。三個較亮的斑點指示對大腸桿菌(E.coli)特異性的核苷酸序列使用本發明的檢測方法在樣品中被檢測。圖1B顯示當使用對大腸桿菌特異性的探針時對于一系列不同微生物產生的信號,并且指示本發明的方法能夠檢測樣品中特定微生物-在此情況下為大腸桿菌的存在。圖2顯示相對于在沒有環丙沙星存在下生長的陽性對照樣品,在補充有在一系列不同濃度的環丙沙星的MH肉湯中生長的細菌的相對生長。細胞用DyeCycleTM橙色染色劑染色并通過自動化顯微鏡計數。圖3顯示相對于在沒有任何抗生素存在下生長的陽性對照樣品,在補充有大量不同抗生素(各自處于一系列不同濃度)的MH肉湯中生長的細菌的相對生長(A-頭孢噻肟,B-環丙沙星,C-慶大霉素,D-美羅培南,E-頭孢他啶,F-哌拉西林+他佐巴坦)。細胞用DyeCycleTM橙色染色劑染色并通過Aquila400計數。這些數據表明,不同生長可以在4小時內檢測。在4、6和24小時以及一系列截止值對各個抗生素計算MIC值。圖4在(A)中示出了對于樣品內的細菌的擴增單個分子檢測(ASMD)以確定微生物的抗生素敏感性所需的工作流程,并且在(B)中顯示相對于在沒有任一抗生素存在下生長的陽性對照樣品,在補充有環丙沙星或頭孢噻肟的MH肉湯中生長的細菌的不同生長。在圖4B中,指示特異性微生物DNA序列的存在的RCA產物通過ASMD檢測,并通過Aquila400計數。圖5使出了用于檢測在探針設計中使用的特異性微生物DNA序列的方案。與微生物DNA的區域互補的生物素化的捕獲寡核苷酸結合靶標DNA片段并且將其固定到固體相上。扣鎖探針,其包含兩個靶標-互補部分(5’/3’-臂)和具有用于檢測的位點的骨架(DO-一般性的),限制消化和啟動(RO-一般性的),以及陣列寡核苷酸雜交(AO-獨特的),經由其互補的5’和3’末端序列結合至其靶標,并且可以在RCA擴增和C2CA反應之前連接到環中。具體實施方式實施例實施例1-血液培養和通過分子試驗的微生物鑒別和表征.將利用針頭穿過隔膜用500μl的大腸桿菌細菌懸浮液刺激(spike)以得到103CFU/ml的濃度的血液添加至BacT/ALERTFA+(Biomerieux)血液培養瓶。對于預培養,我們使用來自GrantInstruments(Grant-bioPTR-35)的自己設計的多旋轉器,其被重新設計成血液培養瓶(BCF)攪拌器。樣品在35℃孵育4小時。使用注射器吸出5ml的樣品,相當于1ml的全血。細菌DNA的富集通過來自Molzym(德國)的方法在不需要離心的情況下實施。通過將800μlES添加至160μlMolDNAase制備裂解緩沖液。通過抽吸6x混合并將所有的MolDNAase溶液添加至12800μl裂解緩沖液,接著通過抽吸6x混合。制備蛋白酶K。將1000μlES添加至400μl蛋白酶K并通過抽吸6x混合。裂解將從BCF抽取的5ml樣品添加至4300μl裂解-MolDNAasr緩沖液并通過抽吸8x混合。在45℃孵育10min。使MolDNAase失活并將350μl蛋白酶K添加至裂解產物并通過抽吸8x混合。在45℃孵育10min。樣品捕獲至柱并洗滌3個循環將605μl裂解產物添加至過濾柱(Molzym,Germany),施加15秒真空。將500μlRS添加至過濾柱并施加15秒真空。將605μl裂解產物添加至過濾柱(Molzym,Germany),施加30秒真空。將500μlRS添加至過濾柱并施加15秒真空。將605μl裂解產物添加至過濾柱(Molzym,Germany),施加45秒真空。將500μlRS添加至過濾柱并施加15秒真空。在樣品添加后繼續利用45秒真空直至已添加所有的樣品。如果需要,如果過濾器在過濾期間變得堵塞,可以使用多于一個過濾器以過濾裂解產物。制備用于微生物的裂解緩沖液將5.6μlβ-巰基乙醇添加至600μlRL并通過抽吸6x混合,將所有預混合的BM-RL添加至80μlBugLysis并通過抽吸6x混合。微生物的裂解將170μl所制備的裂解混合物添加至柱并施加真空持續200ms。在45℃孵育10min。將280μl所制備的蛋白酶K-溶液添加中520μl緩沖液RP。通過抽吸6x混合。將200μlPK-RP添加至柱。施加真空持續200ms。在45℃孵育10min。微生物DNA與柱的結合將柱移至小室調節模塊(roomtemperedblock)。等待2分鐘。將500μlCSAB添加至柱。施加真空持續2s。洗滌1將500μlWB添加至柱。施加真空持續2s。洗滌2將500μlWS添加至柱。施加真空持續2s。膜的干燥施加真空持續10min洗脫將200μlET添加至柱施加真空持續200ms。在室溫孵育至少5min施加真空持續1min重復一次以形成兩次洗脫。通過在等人,2012(supra)中的方法在所富集的細菌DNA樣品上實施分子試驗。在細菌的分子鑒別過程期間,剩余的血液樣品保持在攪拌器下。扣鎖探針和靶捕獲探針從IntegratedDNATechnologies(Munich,Germany)訂購。所述探針設計成檢測在經由生物信息工具選擇的各個細菌中的獨特基序。與靶標DNA的捕獲探針的雜交和扣鎖探針的連接同時進行,并且通過在20mMTris-HCl(pH8.3)、25mMKCl、10mMMgCl2、0.5mMNAD、0.01%X-100、100nM扣鎖探針、50nM捕獲探針、0.2μg/μlBSA(NewEnglandBiolabs,MA,USA)和250mU/μlAmpligase(EpicentreBiotechnologies,WI,USA)中在55℃孵育片段化和變性的基因組DNA持續5min而實現。靶標DNA連同經過反應的扣鎖探針經由生物素化的捕獲探針被捕獲在磁性粒子上。這通過將50μgDynabeadsMyOneTM鏈霉親和素T1珠(Invitrogen)添加至雜交/連接反應并在室溫將樣品孵育3min而實現。過量的探針通過用100μl含有5mMTris-HCl(pH7.5)、5mMEDTA、1MNaCl和0.1%吐溫-20的洗滌緩沖液洗滌一次而消除。進行過量的線性扣鎖探針的消除,因為這些可能以其它方式負面地干擾隨后的RCA反應。經過反應的探針通過C2CA擴增,這包括從RCA開始的系列酶促反應。通過添加20μl的含有1×phi29DNA聚合酶緩沖液(Fermentas,Lithuania;33mMTris-乙酸鹽(pH7.9,在37℃)、10mM乙酸Mg、66mM乙酸K、0.1%(v/v)吐溫-20、1mMDTT)、100μMdNTPs、0.2μg/μlBSA、25nM引物和100mU/μlphi29DNA聚合酶的連接混合物起動RCA反應。將反應在37℃孵育11min,并在65℃失活1min。通過添加3單位的AluI(NewEnglandBiolabs)、600nM重復寡核苷酸、0.2μg/μlBSA(在1×phi29DNA聚合酶緩沖液中),將RCA產物在37℃消化1min,并將反應在65℃終止1min。通過添加含有1.36mMATP、100μMdNTPs、0.2μg/μlBSA、28mU/μlT4DNA連接酶和120mU/μlphi29DNA聚合酶(在1×phi29DNA聚合酶緩沖液中)的混合物至50μl的最終體積,進行連接、擴增和標記反應。將反應在37℃孵育7min,并在65℃終止1min。將以上重復一次。在最后的RCA之后,將產物再次消化成單體。現在RCP準備用于分析。將消化的樣品轉移至微陣列,在55℃孵育30分鐘接著在室溫用1xSSC洗滌。然后雜交的RCA單體經由在2xSSC中的10nM濃度的檢測器寡核苷酸在55℃雜交30分鐘進行標記,在室溫在1xSSC中洗滌兩次并旋干。然后將陣列在陣列掃描儀中進行掃描并且結果使用圖像分析軟件分析如下。對陣列圖像進行評價以檢測對應于一個或若干病原體的斑點。亮斑點對應于所檢測的病原體,每個病原體具有三個斑點的冗余。此外,陣列具有用于圖像比對的參考斑點(其總是亮的),和方案參考斑點,其如果是亮的則驗證分子方案的個別步驟成功。分析分成以下步驟:1.檢測參考斑點并將圖像進行相應地比對。2.測量斑點強度和背景并計算背景校正值。3.測量的強度對病原體特定背景進行補償,如例如來自對應于其它病原體的探針組的DNA的非特異性結合。4.使用陣列強度數據來提供關于病原體id的答案和質量值a.當計算ID答案時,算法考慮對應于特定病原體的所有重復斑點的強度值。b.ID答案可以是定性的(報告存在病原體),和/或定量的(報告樣品中存在的病原體的量的指示)c.評價方案參考斑點以驗證分子方案成功。5.收集結果并且可以轉移至下游AST分析和/或在結果報告中匯報。結果包括:a.所檢測病原體的IDb.對于每個所檢測的病原體的半定量值c.指示分子方案的成功率的定性值。樣品陣列圖像示于圖1A。沿著板的邊緣的五個斑點是參考斑點并且用于圖像比對。較亮的斑點指示所檢測的病原體(大腸桿菌)。圖1B顯示對于大腸桿菌特異性地產生熒光信號。實施例2-在實施例1的血液培養物上的AST測試.將5ml來自血液培養瓶中的剩余樣品,其在分子分型期間繼續處于培養條件下,從燒瓶取出。所取出的樣品對細菌進行富集并且同時改變培養基,在這種情況下變為Mueller-Hinton培養基(MH-培養基)。經由通過0.2μm濾器的過濾回收大腸桿菌,然后將回收的細菌重新懸浮在MH-培養基中。將63μl該細菌懸浮液的等分試樣轉移至在微滴定板中的所選孔。每個孔具有不同濃度的抗生素以及不同的抗生素。由于在實施例1中鑒別出的微生物在這種情況下是大腸桿菌,所以選擇以下抗生素用于抗微生物劑敏感性測試:環丙沙星,哌拉西林+他佐巴坦,頭孢噻肟,頭孢他啶,美羅培南和慶大霉素。基于已知的臨床MIC值,對每種抗生素制備一系列六個不同的濃度。含有MH肉湯但不含抗生素的第七個孔用作陽性對照。將微滴定板在35℃孵育4小時,然后對板讀數。將7μl10μMDyeCycleTM橙色染色劑(MolecularLifeTechnologies)添加至各個孔并在37℃孵育30min。對各個微滴定板孔成像并對細菌的數目進行計數。使用相對于陽性對照的差別生長來確定細菌的MIC值。對于環丙沙星的結果示于圖2。實施例3-利用在流式細胞儀類型儀器(Aquila400,Q-lineaAB,Sweden)中的個體細菌的計數來確定AST分布.細菌在如實施例1中描述的血液培養中生長。將5ml來自血液培養瓶中的剩余樣品,其在分子分型期間繼續處于培養條件下,從燒瓶取出。將樣品對細菌進行富集并且同時改變培養基,在這種情況下變為Mueller-Hinton培養基(MH-培養基)。經由通過0.2μm濾器的過濾回收大腸桿菌,并將回收的細菌重新懸浮在MH-培養基中至在MüllerHinton肉湯中的大約108CFU/ml的濃度,然后在MüllerHinton肉湯中稀釋至大約106CFU/ml。在10x試驗濃度的MüllerHinton肉湯中以一系列2:1系列稀釋制備抗生素溶液。基于細菌的身份和抗生素選取抗生素濃度的范圍。由于在實施例1中鑒別出的微生物在這種情況下是大腸桿菌,所以選擇以下抗生素用于抗微生物劑敏感性試驗:環丙沙星,哌拉西林+他佐巴坦,頭孢噻肟,頭孢他啶,美羅培南和慶大霉素。基于已知的臨床MIC值,選擇一系列八個不同的濃度。制備含有100μl處于八個不同濃度的抗生素溶液和800μlMüllerHinton肉湯的八個樣品試管。一個另外的試管含有900μlMüllerHinton肉湯但不含有抗生物作為陽性對照。將100μl細菌懸浮液(106CFU/ml)添加至所有九個試管。制備包含1000μlMüllerHinton肉湯(即沒有細菌)的陰性對照樣品作為陰性對照。將所有試管在35℃孵育并在0、4、6和24小時之后提取樣品。如實施例2中制備細菌樣品用于計數。利用在Aquila400儀器(Q-lineaAB,Sweden)中個體細菌的基于流式細胞儀的計數來確定細菌AST分布。使用alexa488激光器來進行Aquila400分析。從在不同時間點進行的分析明顯的是,4小時足以用于檢測在不同濃度的抗生素下的差異性細菌生長并由此確定抗生素敏感性。在文獻中已顯示更短時間,所以這不是出乎意料的。對于各種抗生素,相對于陽性對照樣品的差異性細菌生長示于圖3。在不同時間點和截止值對于各種抗生素的MIC值基于該差異性細菌生長進行計算。通過此方法獲得的值有利地與之前報道的臨床MIC值進行比較并在以下顯示。結果顯示通過對個體細菌計數代替對測量求平均值獲得了優異的精度和靈敏度。頭孢噻肟利用Macrobroth稀釋的MIC為0.125μg/ml并且另一個實驗室已利用E-檢驗確定MIC至≤0.5μg/ml。截止值4小時6小時24小時5%-0,060,12510%-0,060,12515%0,060,030,0620%0,060,030,06環丙沙星利用Macrobroth稀釋的MIC為0.016μg/ml并且另一個實驗室已利用E-檢驗確定MIC至≤0.03μg/ml。截止值4小時6小時24小時5%0,0160,0080,00810%0,0080,0080,00815%0,0080,0080,00820%0,0080,0040,008慶大霉素利用Macrobroth稀釋的MIC為0.5-1μg/ml并且另一個實驗室已利用E-檢驗確定MIC至1μg/ml。截止值4小時6小時24小時5%10,5110%0,50,5115%0,50,5120%0,50,51美羅培南利用Macrobroth稀釋的MIC為0.25-0.5μg/ml并且另一個實驗室已利用E-檢驗確定MIC至≤0.25μg/ml。利用Macrobroth稀釋和利用Aquila400估算的MIC太高,因為使用了原來的抗生素儲液。截至值4小時6小時24小時5%--0,510%--0,515%-0,50,2520%0,50,250,125頭孢他啶利用Macrobroth稀釋的MIC為0.25μg/ml并且另一個實驗室已利用E-檢驗確定MIC至≤0.5μg/ml。截止值4小時6小時24小時5%0,250,1250,2510%0,250,1250,2515%0,1250,1250,2520%0,1250,1250,25哌拉西林和他佐巴坦利用Macrobroth稀釋的MIC為4-8μg/ml并且另一個實驗室已利用E-檢驗確定MIC至2μg/ml。截止值4小時6小時24小時5%44410%44415%44420%422實施例4-通過使用扣鎖探針和C2CA擴增的AST利用AST確定的方法.如實施例1所述,建立利用大腸桿菌刺激的血液培養物并進行分子分型。將5ml來自血液培養瓶中的剩余樣品,其在分子分型期間繼續處于培養條件下,從燒瓶取出,并將樣品對細菌進行富集并且如實施例2變成MH-培養基。將63μl等分試樣轉移至在微滴定板中的所選孔。每個孔具有不同濃度的抗生素以及不同的抗生素。在一個微滴定板中,放入12種不同的抗生素,各自處于四個不同濃度以及一個空白,即沒有抗生素。在微滴定板中4小時生長之后,使每個孔進行細菌裂解以釋放細菌DNA。利用擴增的單個分子檢測(ASMD,其中提取來自病原體的DNA,接著對擴增產物進行數字計數,而不是通過直接標記細菌,進行抗生素敏感性測試。通過在等人,2012中的方法,在細菌DNA樣品上實施分子檢測試驗。扣鎖探針和靶標捕獲探針從IntegratedDNATechnologies(Munich,Germany)訂購。將所述探針設計成檢測經由生物信息工具選擇的各個細菌中的獨特基序。同時進行至靶標DNA的捕獲探針的雜交和扣鎖探針的連接,并且通過在20mMTris-HCl(pH8.3)、25mMKCl、10mMMgCl2、0.5mMNAD、0.01%X-100、100nM扣鎖探針、50nM捕獲探針、0.2μg/μlBSA(NewEnglandBiolabs,MA,USA)和250mU/μlAmpligase(EpicentreBiotechnologies,WI,USA)中在55℃孵育片段化和變性的基因組DNA持續5min而實現。靶標DNA連同經過反應的扣鎖探針經由生物素化的捕獲探針被捕獲在磁性粒子上。這通過將50μgDynabeadsMyOneTM鏈霉親和素T1珠(Invitrogen)添加至雜交/連接反應并將樣品在室溫孵育3min而實現。過量的探針通過利用100μl含有5mMTris-HCl(pH7.5)、5mMEDTA、1MNaCl和0.1%吐溫-20的洗滌緩沖液洗滌一次而消除。過量的線性扣鎖探針的消除是必需的,因為這些將以其它方式負面地干擾隨后的RCA反應。經過反應的探針通過C2CA擴增,其包括以RCA開始的系列酶促反應。通過添加20μl含有1×phi29DNA聚合酶緩沖液(Fermentas,Lithuania;33mMTris-乙酸鹽(pH7.9在37℃)、10mM乙酸Mg、66mM乙酸K、0.1%(v/v)Tween-20、1mMDTT)、100μMdNTPs、0.2μg/μlBSA、25nM引物和100mU/μlphi29DNA聚合酶的連接混合物,起動RCA反應。將反應在37℃孵育11min,并在65℃失活1min。通過添加3單位的AluI(NewEnglandBiolabs)、600nM重復寡核苷酸、0.2μg/μlBSA(在1×phi29DNA聚合酶緩沖液中),將RCA產物在37℃消化1min,并將反應在65℃終止1min。通過添加含有1.36mMATP、100μMdNTPs、0.2μg/μlBSA、28mU/μlT4DNA連接酶和120mU/μlphi29DNA聚合酶(在1×phi29DNA聚合酶緩沖液中)的混合物至50μl的最終體積,進行連接、擴增和標記反應。將反應在37℃孵育7min,并在65℃終止1min。將以上重復一次。在最后的RCA反應之后,將與RCP互補的熒光標記的寡核苷酸以各自5nM的濃度添加。將反應65℃孵育2分鐘,接著在37℃孵育5分鐘并允許冷卻。然后將樣品注入Aquila400,(美國專利申請號61/979319)并如Jarvius等人,2006(JarviusJ.,等人,NatureMethods3,725-727(2006)中所述記錄RCP產物的數目。對于在各個濃度的環丙沙星和頭孢噻肟下生長的細菌樣品所檢測到的RCP產物的數目示于圖4。利用此數據來估算對于各個抗生素的MIC濃度。實施例5-用于探針設計的策略.病原體的鑒別多重地進行。為此,各個所包括的病原體具有多至三個的用來找出靶標DNA的特異性捕獲寡核苷酸。各個病原體還具有多至三個的雜交至相應捕獲寡核苷酸附近的靶標的特異性扣鎖探針。用于設計ASMD探針組的過程可以分成兩個主要步驟:尋找最佳靶標區和涉及探針序列。以下是設計過程的進一步分解:尋找基因組靶標–從基因組數據庫(例如NCBI)獲取微生物基因組序列–將基因組序列劃分成靶標和背景組。-如果多于一個靶標基因組,則尋找對于所有共通的序列。-應用濾器組以移出低復雜度候選(均聚物,高/低%-GC,重復等)-背景過濾:拋棄與背景劃分中的基因組具有高序列相似性的候選。-報告接受的候選。制備探針-加載將對其設計探針的基因組靶標(在以上步驟中選擇的)-選擇設置(探針長度,熔融溫度,雜/均二聚體濾器,連接濾器等)-尋找最佳探針序列。-提供通過的候選和短的設計概要。用于過濾和識別基因組DNA靶標的探針如圖5所示構成。捕獲探針將靶標片段帶到固體相上,然后所述扣鎖結合至其靶標,連接到環中并在隨后的C2CA反應中擴增。所述扣鎖具有兩個靶標互補部分(5’/3’-臂)和具有用于檢測的位點(一般性的)、限制性消化和啟動(一般性的)和陣列寡核苷酸雜交位點(獨特的)的骨架。骨架部分在圖5中稱為DO、RO和AO。捕獲寡核苷酸由靶標互補部分、CT-接頭和用于連接至固體相的生物素構成。實施例6-血液培養物和臨床樣品通過分子試驗的微生物鑒別.將來自懷疑有膿毒癥的在ICU的患者的血液抽入到Bactec(BectonDickinson)血液培養瓶中并在血液培養箱中培養。在孵育四小時之后,正好在燒瓶已指示在血液培養箱中陽性之前,取出樣品并用于分子試驗。使用注射器吸出5ml的樣品,并如實施例1中所述提取潛在的病原體DNA。通過在等人,2012(supra)中的方法,在所富集的細菌DNA樣品上實施分子試驗。扣鎖探針和靶標捕獲探針從IntegratedDNATechnologies(Munich,Germany)訂購。所述探針設計成檢測經由內部開發的生物信息工具選擇的各個細菌中的獨特基序。同時地進行至靶標DNA的捕獲探針的雜交和扣鎖探針的連接,并且通過在20mMTris-HCl(pH8.3)、25mMKCl、10mMMgCl2、0.5mMNAD、0.01%X-100、100nM扣鎖探針、50nM捕獲探針、0.2μg/μlBSA(NewEnglandBiolabs,MA,USA)和250mU/μlAmpligase(EpicentreBiotechnologies,WI,USA)中在55℃將片段化和變性的基因組DNA孵育5min而實現。靶標DNA連同經過反應的扣鎖探針經由生物素化的捕獲探針被捕獲到磁性粒子上。這通過將50μgDynabeadsMyOneTM鏈霉親和素T1珠(Invitrogen)添加至雜交/連接反應并將樣品在室溫孵育3min而實現。過量的探針通過利用含有5mMTris-HCl(pH7.5)、5mMEDTA、1MNaCl和0.1%吐溫-20的(100μl)洗滌緩沖液洗滌(一次)而消除。進行過量的線性扣鎖探針的消除,因為這些會以其它方式負面地干擾隨后的RCA反應。經過反應的探針通過C2CA擴增,其包括以RCA開始的系列酶促反應。通過添加20μl含有1×phi29DNA聚合酶緩沖液(Fermentas,Lithuania;33mMTris-乙酸鹽(pH7.9at37℃)、10mM乙酸Mg、66mM乙酸K、0.1%(v/v)吐溫-20、1mMDTT)、100μMdNTPs、0.2μg/μlBSA、25nM引物和100mU/μlphi29DNA聚合酶的連接混合物啟動RCA反應。將反應在37℃孵育11min,并在65℃失活1min。通過添加3單位的AluI(NewEnglandBiolabs)、600nM重復寡核苷酸、0.2μg/μlBSA(在1×phi29DNA聚合酶緩沖液中),將RCA產物在37℃消化1min,并將反應在65℃終止1min。通過添加含有1.36mMATP、100μMdNTPs、0.2μg/μlBSA、28mU/μlT4DNA連接酶和120mU/μlphi29DNA聚合酶(在1×phi29DNA聚合酶緩沖液中)的混合物至50μl的最終體積,進行連接、擴增和標記反應。將反應在37℃孵育7min,并在65℃終止1min。將以上重復一次。在最后的RCA之后,將產物再次消化成單體。現在RCP準備用于分析。將消化的樣品轉移至含有微陣列的器皿,在55℃孵育30分鐘,接著在室溫利用1xSSC洗滌。然后經過雜交的RCA單體經由在2xSSC中的10nM濃度的檢測器寡核苷酸在55℃雜交30分鐘進行標記,在室溫在1xSSC中洗滌兩次并旋干。然后將陣列在陣列掃描器中進行掃描并利用圖像分析軟件分析結果。所顯示的數據已進行了歸一化并且僅是高于背景的來自背景的標準偏差的3倍的數據歸類為真實信號。來自10個臨床樣品加上一個刺激樣品的數據示于圖6。刺激的樣品用大腸桿菌刺激入具有來自陰性樣品的血液的血液培養瓶中。如果原始量為10CFU大腸桿菌/ml血液進入BCF中然后生長四小時,則刺激入的細菌的量對應于本應存在的量。發現臨床樣品中的八個通過血液培養是陰性的,并且發現兩個通過血液培養是陽性的。陽性樣品隨后使用標準技術被鑒別為一個大腸桿菌和一個肺炎鏈球菌(S.pneumoniae)。對于每個樣品,僅獲得的陽性信號來自預期的陣列特征。在此測定中,發現臨床樣品中的一個含有大腸桿菌,并且發現臨床樣品中的一個含有肺炎鏈球菌。刺激的樣品還被確認含有大腸桿菌。在后來使用傳統確認測定被確認是陰性的樣品的任一個中,都沒有看到高于背景的信號(定義為在陰性樣品組中平均信號的標準偏差的3倍)。對于大腸桿菌,兩個陣列特征/樣品(Q1101和Q799)產生信號,這是因為在此實驗中使用了都檢測大腸桿菌但報告關于不同陣列特征的兩種不同的探針系統。實施例7-在從血液培養瓶取出等分試樣之后至陽性的時間10組的血液培養瓶用細菌刺激。5組用500CFU/ml血液刺激并且5組用50.000CFU/ml血液刺激。每個血液培養瓶(具有30ml血液培養基)取出來自健康供體的10ml血液以提供40ml/培養瓶的總體積。在將血液培養瓶放入血液培養箱之前,取出5ml的等分試樣。每30分鐘,我們控制血液培養瓶是否已在血液培養箱中指示陽性。至陽性的時間(TTP)示于圖7,并且在所述組之間沒有發現顯著不同。在培養之前已取出等分試樣的燒瓶和沒有取出等分試樣的燒瓶之間沒有發現顯著差異。實施例8-從血液培養瓶的等分試樣的無菌取樣.將分成三組(每組8個)的24個血液培養瓶(BCF)如指示進行處理:第1組:利用針頭刺穿隔膜第2組:在用針頭刺穿之前具有在隔膜上擦拭的大腸桿菌的10^8CFU/ml肉湯第3組:沒有刺穿隔膜用于各個BCF使用無菌一次性使用針頭。將BCF放入血液培養箱中并允許靜置五天。在第1組或第3組BCF中的任一個中都沒有指示生長。在第2組中的八個BCF中的一個在五天內變為陽性,表明如果小瓶被重度污染,在提取等分試樣之前對于隔膜去污染的潛在需要(參見表1)。表1當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1