作為肽性雙重GLP?1/胰高血糖素受體激動劑的毒蜥外泌肽?4衍生物的制作方法
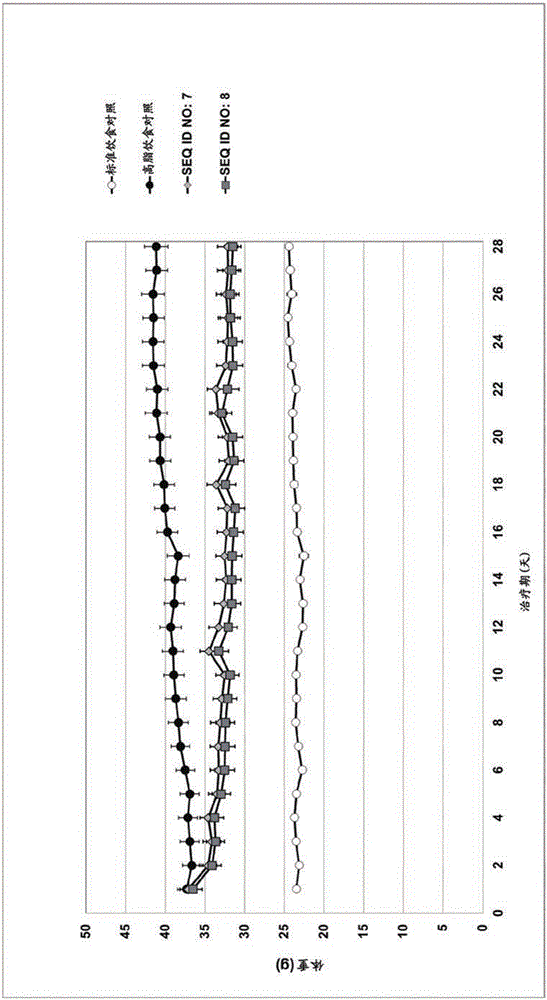
發明領域本發明涉及GLP-1/胰高血糖素受體激動劑及其醫藥用途,例如用于治療代謝綜合征的病癥,包括糖尿病和肥胖癥,以及用于減少過量的食物攝入。這些GLP-1/胰高血糖素受體雙重激動劑在GIP受體上顯示出降低的活性,從而降低低血糖癥的風險,并且其在結構上衍生自毒蜥外泌肽-4(exendin-4),一種純GLP-1受體激動劑。發明背景Pocai等(Obesity2012;20:1566-1571;Diabetes2009,58,2258)和Day等(NatChemBiol2009;5:749)描述了胰高血糖素樣肽-1(GLP-1)和胰高血糖素受體的雙重激動劑,例如通過將GLP-1和胰高血糖素的作用組合在一個分子中,其產生具有優越于純GLP-1激動劑的抗糖尿病作用和顯著降重效果的治療機理,除其他原因外,其是由于胰高血糖素受體介導的增加的飽足及能量消耗所致。Holst(Physiol.Rev.2007,87,1409)和Meier(Nat.Rev.Endocrinol.2012,8,728)描述了GLP-1受體拮抗劑,如GLP-1、利拉魯肽、和毒蜥外泌肽-4,具有3種主要藥理活性,其通過降低空腹和餐后葡萄糖(FPG和PPG)來改善T2DM患者中的血糖控制,所述3種主要藥理活性為:(i)增加的葡萄糖依賴性胰島素分泌(改善的第一階段和第二階段),(ii)在高血糖條件下的抑制胰高血糖素活性,(iii)胃排空速率延緩,其導致進食來源的葡萄糖吸收遲緩。GLP-1(7-36)-酰胺的氨基酸序列如SEQIDNO:2所示。HAEGTFTSDVSSYLEGQAAKEFIAWLVKGR-NH2利拉魯肽是一種市場化的經化學修飾的GLP-1類似物,其中除了其他修飾,將脂肪酸連接至位置20的賴氨酸導致了作用持續期延長(DruckerDJ等,NatureDrugDisc.Rev.9,267-268,2010;Buse,JB等,Lancet,374:39-47,2009)。利拉魯肽的氨基酸序列如SEQIDNO:4所示。HAEGTFTSDVSSYLEGQAAK((S)-4-羧基-4-十六酰基氨基-丁酰基-)EFIAWLVRGRG-OH胰高血糖素是一種29個氨基酸的肽,其在循環葡萄糖低的時候釋放至血液中。胰高血糖素的氨基酸序列如SEQIDNO:3所示。HSQGTFTSDYSKYLDSRRAQDFVQWLMNT-OH在低血糖期間,當血糖水平降低至低于正常時,胰高血糖素向肝提供分解糖原并釋放葡萄糖的信號,導致血糖水平升高達到正常水平。近期的文獻顯示胰高血糖素此外還對減少體脂量、減少食物攝入、和增加能量消耗具有有益效果(KMHeppner,Physiology&Behavior2010,100,545-548)。GIP(葡萄糖依賴性的促胰島素多肽)是一種42個氨基酸的肽,在食物攝入后從腸K-細胞釋放。GIP和GLP-1是兩種來源于腸內分泌細胞的激素,其導致腸降血糖素作用,占了胰島素對口服葡萄糖挑戰的響應的超過70%(BaggioLL,DruckerDJ.Biologyofincretins:GLP-1andGIP.Gastroenterology2007;132:2131-2157)。GIP的氨基酸序列如SEQIDNO:5所示。YAEGTFISDYSIAMDKIHQQDFVNWLLAQKGKKNDWKHNITQ-OH基于GLP-1或胰高血糖素的結構、且結合并激活胰高血糖素和GLP-1受體二者(Hjort等JournalofBiologicalChemistry,269,30121-30124,1994;DayJW等,NatureChemBiol,5:749-757,2009)且抑制體重增加和減少食物攝入的肽描述于專利申請WO2008/071972、WO2008/101017、WO2009/155258、WO2010/096052、WO2010/096142、WO2011/075393、WO2008/152403、WO2010/070251、WO2010/070252、WO2010/070253、WO2010/070255、WO2011/160630、WO2011/006497、WO2011/087671、WO2011/087672、WO2011/117415,WO2011/117416、WO2012/177443WO2012/177444、WO2012/150503、WO2013/004983、WO2013/092703、WO2014/041195和WO2014/041375中,其內容再次通過提述并入本文。顯示體重降低優于純GLP-1激動劑。此外,不僅激活GLP-1和胰高血糖素受體、還激活GIP受體的三重共同激動劑肽描述于WO2012/088116中以及描述于VAGault等(BiochemPharmacol,85,16655-16662,2013;Diabetologia,56,1417-1424,2013)。毒蜥外泌肽-4是一種39個氨基酸的肽,其是由吉拉毒蜥(Gilamonster)(Helodermasuspectum)產生的(EngJ.等,J.Biol.Chem.,267:7402-05,1992)。毒蜥外泌肽-4是胰高血糖素樣肽-1(GLP-1)受體的激活劑,然而其對GLP受體僅顯示出很低的激活作用,并且不激活胰高血糖素受體(參見表1)。表1:毒蜥外泌肽-4在增加的濃度下對人GLP-1、GIP和胰高血糖素受體(以pM表示)的效力,以及如方法中所述測量形成的cAMP毒蜥外泌肽-4的氨基酸序列如SEQIDNO:1所示。HGEGTFTSDLSKQMEEEAVRLFIEWLKNGGPSSGAPPPS-NH2觀察到毒蜥外泌肽-4具有許多用GLP-1觀察到的葡萄糖調控作用。臨床和非臨床研究已顯示毒蜥外泌肽-4具有若干有益的抗糖尿病特性,包括葡萄糖依賴性的胰島素合成和分泌增強、葡萄糖依賴性的胰高血糖素分泌抑制、胃排空放慢、食物攝入和體重減少以及β-細胞群和β-細胞功能標記物的增加(GentilellaR等,DiabetesObesMetab.,11:544-56,2009;NorrisSL等,DiabetMed.,26:837-46,2009;BunckMC等,DiabetesCare.,34:2041-7,2011)。這些效果不僅對于糖尿病人是有益的,并且對罹患肥胖癥的患者也是有益的。患有肥胖者的患者具有更高的患上糖尿病、高血壓、高血脂、心血管疾病和肌肉骨骼疾病的風險。相對于GLP-1,毒蜥外泌肽-4對于由二肽基肽酶-4(DPP4)的切割具有抗性,導致更長的半衰期和體內作用持續期(EngJ.,Diabetes,45(增刊2):152A(摘要554),1996)。與GLP-1、胰高血糖素或胃泌酸調節素相比時,毒蜥外泌肽-4還顯示出對于中性內肽酶(NEP)的降解穩定得多(DruceMR等,Endocrinology,150(4),1712-1721,2009)。但是毒蜥外泌肽-4在化學上是不穩定的,這是由于位置14的甲硫氨酸氧化(HargroveDM等,Regul.Pept.,141:113-9,2007),以及位置28的天冬酰胺的脫酰胺和異構化(WO2004/035623)。本發明的化合物是毒蜥外泌肽-4衍生物,其除了對天然毒蜥外泌肽-4的GLP-1受體的激動性活性之外,還顯示出對胰高血糖素受體的激動性活性,并且其除了其他以外還具有如下修飾:位置14處的側鏈具有-NH2基團的氨基酸,其進一步由親脂性殘基取代(例如結合接頭的脂肪酸)和在位置27處的Aib。Bloom等(WO2006/134340)公開了可從胰高血糖素和毒蜥外泌肽-4構建出結合并激活胰高血糖素和GLP-1受體二者的肽作為雜交分子,其中N末端(例如殘基1-14或1-24)來源于胰高血糖素而C末端(例如殘基15-39或25-39)來源于毒蜥外泌肽-4。此類肽在位置10-13處包含胰高血糖素的氨基酸基序YSKY。Krstenansky等(Biochemistry,25,3833-3839,1986)顯示了胰高血糖素的這些殘基10-13對于其受體相互作用和對腺苷酸環化酶的激活的重要性。在本發明所述的毒蜥外泌肽-4衍生物中,一些原有的(underlying)殘基與胰高血糖素和WO2006/134340中所述的肽是不同的。特別是殘基Tyr10和Tyr13,已知其有助于胰高血糖素的原纖維形成(fibrillation)(DEOtzen,Biochemistry,45,14503-14512,2006),其在位置10由Leu取代,在位置13由非芳香族極性氨基酸Gln取代。該取代(特別是用位置23的異亮氨酸和位置24的谷氨酸的組合)產生具有潛在提高的生物物理特性(如溶解度或在溶液中的聚集現象)的毒蜥外泌肽-4衍生物。出乎意料地,在毒蜥外泌肽-4類似物的位置13用極性氨基酸對芳香族氨基酸的非保守取代產生了對胰高血糖素受體具有高活性的肽,而其對GLP-1受體的活性保持不變(也參見WO2013/186240)。此外,我們令人驚奇地發現,與在天然毒蜥外泌肽-4的位置27處具有Lys的對應衍生物相比,在位置27具有Aib氨基酸的抗體顯示出對GIP受體的降低的活性,如實施例5,表8所示。對GIP受體的降低的激活可能是有益的,因為有文獻報道發現糖尿病患者中高水平的GIP有時導致較頻繁的低血糖癥發作(TMcLaughlin等,JClinEndocrinolMetab,95,1851-1855,2010;AHadji-Georgopoulos,JClinEndocrinolMetab,56,648-652,1983)。此外,本發明的化合物是在位置14處具有脂肪酸酰化殘基的毒蜥外泌肽-4衍生物。這種位置14處的脂肪酸官能化產生這樣的毒蜥外泌肽-4衍生物,其與對應的非酰化毒蜥外泌肽-4衍生物相比不僅對GLP-1受體有高活性,且對胰高血糖素受體也有高活性,例如實施例5,表7中所示的那些。此外,該修飾產生改進的藥代動力學概貌。在文獻(MurageEN等,Bioorg.Med.Chem.16(2008),10106-10112)中描述了在位置14處具有乙酰化賴氨酸的GLP-1類似物與天然GLP-1相比顯示出顯著降低的針對GLP-1受體的效力。本發明的化合物對于由中性內肽酶(NEP)和二肽基肽酶-4(DPP4)的切割更具抗性,導致了與天然GLP-1和胰高血糖素相比更長的體內半衰期和作用持續時間。本發明的化合物優選為不僅在中性pH是可溶的,并且在pH4.5也是可溶的。該特性可能允許用于與胰島素或胰島素衍生物以及優選地與基礎胰島素如甘精胰島素/的組合治療的共制劑。發明概述天然毒蜥外泌肽-4是一種純GLP-1受體激動劑,其對胰高血糖素受體沒有活性而對GIP受體具有低活性。本文提供了基于天然毒蜥外泌肽-4結構但與SEQIDNO:1相比在10個或更多個位置處不同的毒蜥外泌肽-4衍生物,其中所述不同有助于改進胰高血糖素受體處的激動性活性。除其他取代外,位置14處的甲硫氨酸由側鏈中攜帶-NH2基團的氨基酸取代,其進一步由親脂性殘基(例如與接頭組合的脂肪酸)取代。此外,我們令人驚奇地發現用Aib取代位置27處的賴氨酸導致與GLP-1受體活性相比降低的GIP受體活性。對GIP受體的降低的激活可能是有益的,因為有文獻報道發現糖尿病患者中高水平的GIP有時導致較頻繁的低血糖癥發作(TMcLaughlin等,JClinEndocrinolMetab,95,1851-1855,2010;AHadji-Georgopoulos,JClinEndocrinolMetab,56,648-652,1983)。本發明提供具有式(I)的肽化合物或其鹽或溶劑合物:H2N-His-Aib-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Leu-Ser-Lys-Gln-X14-Asp-Glu-Gln-Arg-Ala-Lys-Leu-Phe-Ile-Glu-Trp-Leu-Aib-X28-X29-Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser-R1(I)X14代表具有官能化-NH2側鏈基團的氨基酸殘基,選自下組:Lys、Orn、Dab或Dap,其中-NH2側鏈基團由-Z-C(O)-R5官能化,其中Z代表呈所有立體異構形式的接頭,且R5是包含至多50個碳原子以及選自N與O的雜原子的部分,X28代表選自Ala、Lys和Ser的氨基酸殘基,X29代表選自D-Ala與Gly的氨基酸殘基,R1為NH2或OH。本發明的化合物為GLP-1和胰高血糖素受體激動劑,所述GLP-1和胰高血糖素受體激動劑通過在方法部分所述的測定系統中觀察到它們能刺激細胞內cAMP形成而得以確定。根據本發明化合物的另一實施方案,特別是在位置14處具有賴氨酸的那些(其進一步由親脂性殘基取代),與GLP-1(7-36)酰胺的情況相比對于GLP-1受體表現出至少0.1%的相對活性(即EC50<700pM),更優選為1%(即EC50<70pM)、更優選為5%(即EC50<14pM),以及更優選為10%(即EC50<7pM)的相對活性。此外,所述化合物與天然胰高血糖素的情況相比對于胰高血糖素受體表現出至少0.09%(即EC50<1111pM)、更優選0.45%(即EC50<222pM)以及又更優選0.9%(即EC50<111pM)的相對活性。本文所用的術語“活性”,優選意指化合物激活人GLP-1受體和人胰高血糖素受體的能力。更優選的是,此處所用的術語“活性”意指化合物刺激細胞內cAMP形成的能力。本文所用的術語“相對活性”理解為意指化合物相較于另一種受體激動劑,或相較于另一種受體,以一定比率激活一種受體的能力。激動劑對受體的激活是按照本文所述來確定的(例如通過測量cAMP水平),例如按照實施例4中所述。本發明化合物優選對hGLP-1受體具有450pmol或更低、優選200pmol或更低、更優選100pmol或更低、更優選50pmol或更低、更優選25pmol或更低、更優選10pmol或更低、更優選8pmol或更低以及更優選5pmol或更低的EC50,和/或對人胰高血糖素受體具有500pmol或更低,優選300pmol或更低、優選200pmol或更低、更優選150pmol或更低的EC50,和/或對hGIP受體具有750pmol或更高,優選1500pmol或更高;更優選2000pmol或更高的EC50。更優選為對hGLP-1及人胰高血糖素受體的EC50為250pmol或更低、優選200pmol或更低、更優選150pmol或更低。對hGLP-1受體、人胰高血糖素受體與hGIP受體的EC50可如本文方法中所述測定并用于生成實例4、表6中所述結果。本發明的化合物具有降低腸通過率(intestinalpassage)、增加胃內容物和/或減少患者的食物攝入的能力。本發明化合物的這些活性能在本領域技術人員已知的動物模型中進行評估,并且同樣描述于本文的方法部分中。本發明的化合物具有降低患者血糖水平和/或降低患者HbA1c水平的能力。本發明化合物的這些活性能在本領域技術人員已知的動物模型中進行評估,并且同樣描述于本文的方法部分中。本發明的化合物具有降低患者體重的能力。本發明化合物的這些活性能在本領域技術人員已知的動物模型中進行評估,并且同樣描述于本文的方法部分中以及實施例7中。發現式(I)的肽化合物(特別是在位置14處具有賴氨酸且進一步由親脂性殘基取代的那些)顯示出與具有初始甲硫氨酸(來自毒蜥外泌肽-4)或位置14處的亮氨酸(參見表7)的衍生物相比增加的胰高血糖素受體激活。此外,甲硫氨酸的氧化(體內或體外)不再是可能的。還發現具有位置27處的Aib氨基酸的化合物顯示出與在天然毒蜥外泌肽-4的位置27處具有Lys的對應衍生物相比對GIP受體降低的活性,如實施例5,表8中所示。對GIP受體的降低的激活可能是有益的,因為有文獻報道發現糖尿病患者中高水平的GIP有時導致較頻繁的低血糖癥發作(TMcLaughlin等,JClinEndocrinolMetab,95,1851-1855,2010;AHadji-Georgopoulos,JClinEndocrinolMetab,56,648-652,1983)。在一個實施方案中,本發明化合物在酸性和/或生理pH值具有高溶解度,例如在25℃、pH4.5和/或在pH7.4,在另一個實施方案中,溶解度為至少1mg/ml且在一個特定實施方案中溶解度為至少5mg/ml。此外,本發明的化合物優選地在儲存于溶液中時具有高穩定性。用于確定穩定性的優選測定條件是在40℃于溶液中于pH4.5或pH7.4處儲存7天。如實施例中所述通過色譜分析來確定剩余的肽量。優選的是,在40℃于溶液中于pH4.5或pH7.4處7天后,剩余的肽是至少75%,更優選至少80%、又更優選至少85%且又更優選至少90%。優選的是,本發明的化合物包含肽模塊,所述肽模塊是39個氨基羧酸的線性序列,特別是通過肽(即羧酰胺鍵(carboxamidebond))連接的α-氨基羧酸。在一個實施方案中,R1為NH2且在另一個實施方案中R1為OH。-Z-C(O)-R5基團的特別優選的實例列于下表2中,其選自:(S)-4-羧基-4-十六酰基氨基-丁酰基-、(S)-4-羧基-4-十八酰基氨基-丁酰基-、(S)-4-羧基-4-((S)-4-羧基-4-十六酰基氨基-丁酰基氨基)-丁酰基-、(2-{2-[2-(2-{2-[(4S)-4-羧基-4-十六酰基氨基-丁酰基氨基]-乙氧基}-乙氧基)-乙酰基氨基]-乙氧基}-乙氧基)-乙酰基、(2-{2-[2-(2-{2-[(4S)-4-羧基-4-十八酰基氨基-丁酰基氨基]-乙氧基}-乙氧基)-乙酰基氨基]-乙氧基}-乙氧基)-乙酰基、[2-(2-{2-[2-(2-{2-[2-(2-十八酰基氨基-乙氧基)-乙氧基]-乙酰基氨基}-乙氧基)-乙氧基]-乙酰基氨基}-乙氧基)-乙氧基]-乙酰基-、(2-{2-[2-(2-{2-[(4S)-4-羧基-4-(17-羧基-十七酰基)氨基-丁酰基氨基]-乙氧基}-乙氧基)-乙酰基氨基]-乙氧基}-乙氧基)-乙酰基。更優選為立體異構物,尤其是這些基團的鏡像異構物,S-鏡像異構物或R-鏡像異構物。術語“R”在表2中意在表示在肽骨架處的-Z-C(O)-R5附接位點,即Lys的ε-氨基基團。表2另一個實施方案涉及一組化合物,其中X14代表Lys,其中-NH2側鏈基團經基團-Z-C(O)R5官能化,其中Z代表選自γE、γE-γE、AEEAc-AEEAc-γE及AEEAc-AEEAc-AEEAc的基團,且R5代表選自十五酰基、十七酰基或16-羧基-十六酰基的基團。另一個實施方案涉及一組化合物,其中X14代表Lys,其中-NH2側鏈基團經基團-Z-C(O)R5官能化,其中Z代表選自γE、γE-γE、AEEAc-AEEAc-γE及AEEAc-AEEAc-AEEAc的基團,且R5代表選自十五酰基或十七酰基的基團。另一個實施方案涉及一組化合物或其鹽或溶劑合物,其中X14代表Lys,其中-NH2側鏈基團經(S)-4-羧基-4-十八酰基氨基-丁酰基-官能化,X28代表Ala,X29代表選自Gly與D-Ala的氨基酸殘基,R1代表NH2。另一個實施方案涉及一組化合物或其鹽或溶劑合物,其中X14代表Lys,其中-NH2側鏈基團經(S)-4-羧基-4-十六酰基氨基-丁酰基-官能化,X28代表Ala,X29代表選自Gly與D-Ala的氨基酸殘基,R1代表NH2。另一個實施方案涉及一組化合物或其鹽或溶劑合物,其中X14代表Lys,其中-NH2側鏈基團經(S)-4-羧基-4-((S)-4-羧基-4-十六酰基氨基-丁酰基氨基)-丁酰基-官能化,X28代表選自Ala、Ser與Lys的氨基酸殘基,X29代表選自Gly與D-Ala的氨基酸殘基,R1代表NH2。另一個實施方案涉及一組化合物或其鹽或溶劑合物,其中X14代表Lys,其中-NH2側鏈基團經(S)-4-羧基-4-十六酰基氨基-丁酰基-、(S)-4-羧基-4-十八酰基氨基-丁酰基-、(S)-4-羧基-4-((S)-4-羧基-4-十六酰基氨基-丁酰基氨基)-丁酰基-、(2-{2-[2-(2-{2-[(4S)-4-羧基-4-十六酰基氨基-丁酰基氨基]-乙氧基}-乙氧基)-乙酰基氨基]-乙氧基}-乙氧基)-乙酰基、(2-{2-[2-(2-{2-[(4S)-4-羧基-4-十八酰基氨基-丁酰基氨基]-乙氧基}-乙氧基)-乙酰基氨基]-乙氧基}-乙氧基)-乙酰基、[2-(2-{2-[2-(2-{2-[2-(2-十八酰基氨基-乙氧基)-乙氧基]-乙酰基氨基}-乙氧基)-乙氧基]-乙酰基氨基}-乙氧基)-乙氧基]-乙酰基-、(2-{2-[2-(2-{2-[(4S)-4-羧基-4-(17-羧基-十七酰基)氨基-丁酰基氨基]-乙氧基}-乙氧基)-乙酰基氨基]-乙氧基}-乙氧基)-乙酰基官能化,X28代表Ala,X29代表選自D-Ala與Gly的氨基酸殘基,R1代表NH2。另一個實施方案涉及一組化合物或其鹽或溶劑合物,其中X14代表Lys,其中-NH2側鏈基團經(S)-4-羧基-4-十六酰基氨基-丁酰基-、(S)-4-羧基-4-十八酰基氨基-丁酰基-、(S)-4-羧基-4-((S)-4-羧基-4-十六酰基氨基-丁酰基氨基)-丁酰基-、(2-{2-[2-(2-{2-[(4S)-4-羧基-4-十六酰基氨基-丁酰基氨基]-乙氧基}-乙氧基)-乙酰基氨基]-乙氧基}-乙氧基)-乙酰基、(2-{2-[2-(2-{2-[(4S)-4-羧基-4-十八酰基氨基-丁酰基氨基]-乙氧基}-乙氧基)-乙酰基氨基]-乙氧基}-乙氧基)-乙酰基、[2-(2-{2-[2-(2-{2-[2-(2-十八酰基氨基-乙氧基)-乙氧基]-乙酰基氨基}-乙氧基)-乙氧基]-乙酰基氨基}-乙氧基)-乙氧基]-乙酰基-官能化,X28代表Ala,X29代表選自D-Ala與Gly的氨基酸殘基,R1代表NH2。另一個實施方案涉及一組化合物或其鹽或溶劑合物,其中X14代表Lys,其中-NH2側鏈基團經(S)-4-羧基-4-((S)-4-羧基-4-十六酰基氨基-丁酰基氨基)-丁酰基-官能化,X28代表Ser,X29代表選自D-Ala與Gly的氨基酸殘基,R1代表NH2。另一個實施方案涉及一組化合物或其鹽或溶劑合物,其中X14代表Lys,其中-NH2側鏈基團經(S)-4-羧基-4-((S)-4-羧基-4-十六酰基氨基-丁酰基氨基)-丁酰基-官能化,X28代表Lys,X29代表選自D-Ala與Gly的氨基酸殘基,R1代表NH2。另一個實施方案涉及一組化合物或其鹽或溶劑合物,其中X14代表Lys,其中-NH2側鏈基團經(S)-4-羧基-4-十六酰基氨基-丁酰基-、(S)-4-羧基-4-十八酰基氨基-丁酰基-、(S)-4-羧基-4-((S)-4-羧基-4-十六酰基氨基-丁酰基氨基)-丁酰基-官能化,X28代表選自Ala、Lys與Ser的氨基酸殘基,X29代表D-Ala,R1代表NH2。另一個實施方案涉及一組化合物或其鹽或溶劑合物,其中X14代表Lys,其中-NH2側鏈基團經(S)-4-羧基-4-十六酰基氨基-丁酰基-、(S)-4-羧基-4-十八酰基氨基-丁酰基-、(S)-4-羧基-4-((S)-4-羧基-4-十六酰基氨基-丁酰基氨基)-丁酰基-、(2-{2-[2-(2-{2-[(4S)-4-羧基-4-十六酰基氨基-丁酰基氨基]-乙氧基}-乙氧基)-乙酰基氨基]-乙氧基}-乙氧基)-乙酰基、(2-{2-[2-(2-{2-[(4S)-4-羧基-4-十八酰基氨基-丁酰基氨基]-乙氧基}-乙氧基)-乙酰基氨基]-乙氧基}-乙氧基)-乙酰基、[2-(2-{2-[2-(2-{2-[2-(2-十八酰基氨基-乙氧基)-乙氧基]-乙酰基氨基}-乙氧基)-乙氧基]-乙酰基氨基}-乙氧基)-乙氧基]-乙酰基-、(2-{2-[2-(2-{2-[(4S)-4-羧基-4-(17-羧基-十七酰基)氨基-丁酰基氨基]-乙氧基}-乙氧基)-乙酰基氨基]-乙氧基}-乙氧基)-乙酰基官能化,X28代表選自Ala、Lys與Ser的氨基酸殘基,X29代表Gly,R1代表NH2。另一個實施方案涉及一組化合物或其鹽或溶劑合物,其中X14代表Lys,其中-NH2側鏈基團經(S)-4-羧基-4-十六酰基氨基-丁酰基-、(S)-4-羧基-4-十八酰基氨基-丁酰基-、(S)-4-羧基-4-((S)-4-羧基-4-十六酰基氨基-丁酰基氨基)-丁酰基-、(2-{2-[2-(2-{2-[(4S)-4-羧基-4-十六酰基氨基-丁酰基氨基]-乙氧基}-乙氧基)-乙酰基氨基]-乙氧基}-乙氧基)-乙酰基、(2-{2-[2-(2-{2-[(4S)-4-羧基-4-十八酰基氨基-丁酰基氨基]-乙氧基}-乙氧基)-乙酰基氨基]-乙氧基}-乙氧基)-乙酰基、[2-(2-{2-[2-(2-{2-[2-(2-十八酰基氨基-乙氧基)-乙氧基]-乙酰基氨基}-乙氧基)-乙氧基]-乙酰基氨基}-乙氧基)-乙氧基]-乙酰基-官能化,X28代表選自Ala、Lys與Ser的氨基酸殘基,X29代表Gly,R1代表NH2。另一個實施方案涉及一組化合物或其鹽或溶劑合物,其中X14代表Lys,其中-NH2側鏈基團經(S)-4-羧基-4-((S)-4-羧基-4-十六酰基氨基-丁酰基氨基)-丁酰基-官能化,X28代表Ala,X29代表選自Gly與D-Ala的氨基酸殘基,R1代表NH2。另一個實施方案涉及一組化合物或其鹽或溶劑合物,其中X14代表Lys,其中-NH2側鏈基團經(S)-4-羧基-4-十六酰基氨基-丁酰基-、(S)-4-羧基-4-十八酰基氨基-丁酰基-、(S)-4-羧基-4-((S)-4-羧基-4-十六酰基氨基-丁酰基氨基)-丁酰基-官能化。另一個實施方案涉及一組化合物或其鹽或溶劑合物,其中X14代表Lys,其中-NH2側鏈基團經(S)-4-羧基-4-((S)-4-羧基-4-十六酰基氨基-丁酰基氨基)-丁酰基-官能化。式(I)肽化合物的特定實例為SEQIDNO:6-19的化合物,及其鹽或溶劑合物。式(I)肽化合物的特定實例為SEQIDNO:6-18的化合物,及其鹽或溶劑合物。式(I)肽化合物的特定實例為SEQIDNO:7與8的化合物,及其鹽或溶劑合物。在一些實施方案中,即當式(I)的化合物包含遺傳學編碼的氨基酸殘基時,本發明進一步提供編碼所述化合物的核酸(其可以是DNA或RNA)、包含這種核酸的載體以及含有這種核酸或表達載體的宿主細胞。在進一步的方面,本發明提供包含本發明化合物與載劑混合的組合物。在優選的實施方案中,組合物是藥學上可接受的組合物,而載劑是藥學上可接受的載劑。本發明的化合物可以以鹽的形式,例如藥學上可接受的鹽,或以溶劑合物的形式,例如水合物。在再進一步的方面,本發明提供用于在醫藥治療方法中,特別是在人的醫藥中使用的組合物。在一些實施方案中,核酸或表達載體可以用作治療劑,例如在基因治療中。式(I)的化合物適于沒有額外的治療有效制劑的治療應用。然而,在其他實施方案中,所述化合物與至少一種額外的治療活性劑組合使用,如“組合治療”中所述。式(I)的化合物具體適于治療或預防由糖類和/或脂質代謝失調引起的、與糖類和/或脂質代謝失調相關的和/或伴隨有糖類和/或脂質代謝失調的疾病或病癥,例如用于治療或預防高血糖癥、2型糖尿病、葡糖耐量受損、1型糖尿病、肥胖癥和代謝綜合征。而且,本發明的化合物具體適于治療或預防退行性疾病,特別是神經退行性疾病。除其他之外,發現了所述化合物在預防增重或促進減重中的用途。“預防”指的是與不治療相比的抑制或減少,并且并不一定意味著病癥的完全停止。本發明的化合物可以引起食物攝入減少和/或能量消耗增加,導致觀察到對于體重的效果。與其對體重的效果無關的是,本發明的化合物可以對循環的膽固醇水平具有有益效果,能夠提高脂質水平,特別是LDL,以及HDL水平(例如提高HDL/LDL比率)。因此,本發明的化合物能用于任何由體重過量引起的或表征的病況的直接或間接治療,如對肥胖癥、病態性肥胖癥、肥胖相關的炎癥、肥胖相關的膽囊疾病、肥胖誘導的睡眠呼吸暫停的治療和/或預防。它們還可以用于治療和預防代謝綜合征、糖尿病、高血壓、致動脈粥樣硬化的血脂異常、動脈粥樣硬化、動脈硬化、冠心病或中風。它們在這些病況中的效果可作為與它們對體重的效果的結果或與所述效果相關,或可以與其無關。優選的醫藥用途包括延緩或預防2型糖尿病中的疾病進展,治療代謝綜合征,治療肥胖癥或預防超重,用于減少食物攝入,增加能量消耗,降低體重,延緩從葡糖耐量受損(IGT)至2型糖尿病的進展,延緩從2型糖尿病至需要胰島素的糖尿病的進展,調節食欲,誘導飽足,預防成功減肥后的再次增重,治療超重或肥胖癥相關的疾病或病狀,治療易餓癥(bulimia),治療暴食,治療動脈粥樣硬化、高血壓、2型糖尿病、IGT、血脂異常、冠心病、脂肪肝,治療β受體阻斷劑中毒,用于抑制胃腸道運動的用途,與用如X射線、CT和NMR掃描等的技術的胃腸道研究聯用。進一步優選的醫藥用途包括治療或預防退行性疾病,特別是神經退行性疾病如阿爾茨海默氏病(Alzheimer'sdisease)、帕金森氏癥(Parkinson'sdisease)、亨廷頓氏癥(Huntington'sdisease)、共濟失調(ataxia)(例如,脊髓小腦共濟失調(spinocerebellarataxia))、肯尼迪病(Kennedydisease)、強直型肌肉萎縮癥(myotonicdystrophy)、路易體癡呆(Lewybodydementia)、多系統性萎縮(multi-systemicatrophy)、肌萎縮性側索硬化(amyotrophiclateralsclerosis)、原發性側索硬化(primarylateralsclerosis)、脊椎肌肉萎縮(spinalmuscularatrophy)、朊病毒相關的疾病(prion-associateddiseases,例如庫賈氏病(Creutzfeldt-Jacobdisease))、多發性硬化(multiplesclerosis)、毛細管擴張(telangiectasia)、巴登氏病(Battendisease)、皮質基底核退化(corticobasaldegeneration)、亞急性脊髓聯合退化(subacutecombineddegenerationofspinalcord)、脊髓癆(Tabesdorsalis)、泰-薩克斯病(Tay-Sachsdisease)、中毒性腦病變(toxicencephalopathy)、嬰兒雷夫敘姆病(infantileRefsumdisease)、雷夫敘姆病(Refsumdisease)、神經棘紅細胞增多癥(neuroacanthocytosis)、尼曼匹克病(Niemann-Pickdisease)、萊姆病(Lymedisease)、馬-約病(Machado-Josephdisease)、山多夫氏病(Sandhoffdisease)、夏伊-德雷格綜合征(Shy-Dragersyndrome)、刺猬搖擺不定癥(wobblyhedgehogsyndrome)、蛋白質構像病(proteopathy)、大腦β-淀粉樣血管病變(cerebralβ-amyloidangiopathy)、青光眼的視網膜神經節細胞退化(retinalganglioncelldegenerationinglaucoma)、共核蛋白病(synucleinopathies)、Tau蛋白病變(tauopathies)、額顳葉退化(frontotemporallobardegeneration,FTLD)、癡呆(dementia)、Cadasil綜合征(cadasilsyndrome)、具有淀粉樣變性的遺傳性腦出血(hereditarycerebralhemorrhagewithamyloidosis)、亞歷山大病(Alexanderdisease)、seipinopathies、家族性類淀粉神經病變(familialamyloidoticneuropathy)、老年全身性淀粉樣變性(senilesystemicamyloidosis)、絲胺酸蛋白病變(serpinopathies)、AL(輕鏈)淀粉樣變性(AL(lightchain)amyloidosis)(原發性全身性淀粉樣變性(primarysystemicamyloidosis))、AH(重鏈)淀粉樣變性(AH(heavychain)amyloidosis)、AA(繼發性)淀粉樣變性(AA(secondary)amyloidosis)、主動脈中層淀粉樣變性(aorticmedialamyloidosis)、ApoAI淀粉樣變性(ApoAIamyloidosis)、ApoAII淀粉樣變性(ApoAIIamyloidosis)、ApoAIV淀粉樣變性(ApoAIVamyloidosis)、芬蘭型家族性淀粉樣變性(familialamyloidosisoftheFinnishtype,FAF)、溶菌酶淀粉樣變性(Lysozymeamyloidosis)、纖維蛋白原淀粉樣變性(Fibrinogenamyloidosis)、透析淀粉樣變性(Dialysisamyloidosis)、包涵體肌炎/肌病(Inclusionbodymyositis/myopathy)、白內障(Cataracts)、具有視紫質突變的色素性視網膜炎(Retinitispigmentosawithrhodopsinmutations)、髓質性甲狀腺癌(medullarythyroidcarcinoma)、心房淀粉樣變性(cardiacatrialamyloidosis)、垂體催乳素瘤(pituitaryprolactinoma)、遺傳性格子狀角膜營養不良(Hereditarylatticecornealdystrophy)、苔蘚狀皮膚淀粉樣變性(Cutaneouslichenamyloidosis)、馬洛里小體(Mallorybodies)、角膜乳鐵蛋白淀粉樣變性(corneallactoferrinamyloidosis)、肺泡蛋白沉積癥(pulmonaryalveolarproteinosis)、齒源性(平博氏)腫瘤淀粉樣變性(odontogenic(Pindborg)tumoramyloid)、囊腫纖維化(cysticfibrosis)、鐮狀細胞病(sicklecelldisease)或重病性肌病(criticalillnessmyopathy,CIM)。發明詳述定義本發明的氨基酸序列含有用于天然存在的氨基酸的常規單字母或三字母代碼,以及用于其他氨基酸的普遍承認的三字母代碼,如Aib(α-氨基異丁酸)。術語“天然毒蜥外泌肽-4”意指具有序列HGEGTFTSDLSKQMEEEAVRLFIEWLKNGGPSSGAPPPS-NH2(SEQIDNO:1)的天然毒蜥外泌肽-4。本發明提供如上文定義的肽化合物。本發明的肽化合物包含通過肽鍵即羧酰胺鍵連接的氨基羧酸的線性主鏈。除另有說明外,優選的是,所述氨基羧酸是α-氨基羧酸,并且更優選地是L-α-氨基羧酸。肽化合物優選地包含39個氨基羧酸的主鏈序列。本發明的肽化合物可以具有未修飾的側鏈,但在其中一個側鏈處攜帶至少一個修飾。為了免生疑義,在此處提供的定義中,通常認為肽模塊(I)的序列與天然毒蜥外泌肽-4在那些規定允許變異的位置中的至少一個位置處不同。可以認為肽模塊(I)內的氨基酸是從1至39以常規的N末端至C末端方向連續編號的。對肽模塊(I)內的“位置”的提述應當照此理解,而對天然毒蜥外泌肽-4和其他分子內的位置的提述也應當如此,例如在毒蜥外泌肽-4中,His在位置1處,Gly在位置2處……Met在位置14處……和Ser在位置39處。具有-NH2側鏈基團的氨基酸殘基(例如Lys、Orn、Dab或Dap)經官能化,所述官能化在于-NH2側鏈基團的至少一個H原子由-Z-C(O)-R5取代,其中R5包含親脂性模塊,例如非環狀線性或分支的(C8-C30)飽和或不飽和烴基團,其未經取代或經例如鹵素、-OH和/或CO2H取代而Z包含呈所有立體異構形式的接頭,例如包含一或多個(例如1至5個,優選為1、2或3個)選自下組的氨基酸接頭基團的接頭:γ-谷氨酸(γE)和AEEAc。優選的基團R5包含親脂性模塊,例如非環狀線性或分支的(C12-C20)飽和或不飽和烴基團,例如十五酰基、十六酰基或十七酰基,其未經取代或經CO2H取代,優選為十五酰基、十七酰基或16-羧基-十六酰基。在一些實施方案中,氨基酸接頭基團選自γE、γE-γE、AEEAc-AEEAc-γE和AEEAc-AEEAc-AEEAc。在另一個實施方案中,所述氨基酸接頭基團是γE。在另一個實施方案中,所述氨基酸接頭基團是γE-γE。在另一個實施方案中,所述氨基酸接頭基團是AEEAc-AEEAc-γE。在另一個實施方案中,所述氨基酸接頭基團是AEEAc-AEEAc-AEEAc。在進一步的方面,本發明提供一種組合物,其包含如本文所述的本發明的化合物,或其鹽或溶劑合物,其與載劑混合。本發明還提供了本發明的化合物用作藥物的用途,特別是用于治療如下所述的情況。本發明還提供一種組合物,其中所述組合物是藥學上可接受的組合物,且所述載劑是藥學上可接受的載劑。肽合成技術人員知道用于制備本發明所述肽的多種不同方法。這些方法包括但不限于合成途徑和重組基因表達。因此,制備這些肽的一種辦法是在溶液中或在固體支持物上進行合成,以及隨后的分離和純化。制備所述肽的一種不同的方法是在宿主細胞中進行基因表達,所述宿主細胞中引入了編碼所述肽的DNA序列。或者,可以不利用細胞系統而實現基因表達。上述方法還可以以任意方式組合。制備本發明的肽的優選方法是在合適的樹脂上的固相合成。固相肽合成是一種發展完善的方法學(參見例如:Stewart和Young,SolidPhasePeptideSynthesis,PierceChemicalCo.,Rockford,Ill.,1984;E.Atherton和R.C.Sheppard,SolidPhasePeptideSynthesis.APracticalApproach,Oxford-IRLPress,NewYork,1989)。固相合成是通過如下步驟起始的:將N末端受保護的氨基酸的羧基末端連接到攜帶可切割接頭(cleavablelinker)的惰性固體支持物。這種固體支持物可以是允許起始氨基酸進行偶聯的任何聚合物,例如三苯甲基樹脂、氯三苯甲基樹脂、Wang樹脂或Rink樹脂,其中羧基基團(或Rink樹脂的羧酰胺)對樹脂的連接是對酸敏感的(當使用Fmoc策略時)。聚合物支持物在肽合成期間用于對α-氨基基團進行去保護的條件下必須是穩定的。在第一個氨基酸偶聯到固體支持物上后,將這個氨基酸的α-氨基保護基團去除。然后用合適的酰胺偶聯試劑將剩下的受保護的氨基酸按照肽序列代表的順序一個接一個地進行偶聯,所述偶聯試劑例如BOP、HBTU、HATU或DIC(N,N'-二異丙基碳二亞胺)/HOBt(1-羥基苯并三唑),其中BOP、HBTU和HATU與叔胺堿一起使用。或者,脫去束縛的N末端能用除氨基酸以外的基團進行官能化,例如羧酸等。通常,氨基酸的反應性(reactive)側鏈基團是用合適的阻斷基團來保護的。在所需要的肽被組裝后,除去這些保護基團。在相同條件下伴隨著從樹脂上切割所需要的產品而將這些保護基團除去。保護基團和引入保護基團的步驟可在ProtectiveGroupsinOrganicSynthesis,第三版,Greene,T.W.和Wuts,P.G.M.,Wiley&Sons(NewYork:1999)中找到。在一些情況下,可能需要具有側鏈保護基團,所述基團能在其他側鏈保護基團保持完好的條件下被選擇性地除去。在這種情況下,可以選擇性地將脫去束縛的官能度(functionality)進行官能化。例如,賴氨酸可以用ivDde([1-(4,4-二甲基-2,6-二氧代環己-1-亞基)-3-甲基丁基([1-(4,4-dimethyl-2,6-dioxocyclohex-1-ylidene)-3-methylbutyl))保護基團(S.R.Chhabra等,TetrahedronLett.39,(1998),1603)來保護,所述保護基團對于非常親核的堿基是不穩定的,例如4%肼在DMF(二甲基甲酰胺)中。因此,如果N末端氨基基團和所有側鏈官能體是用酸不穩定的保護基團來保護的,則ivDde基團可以選擇性地用4%肼在DMF中的溶液來除去,并且然后能對相應的游離氨基基團進行進一步修飾,例如通過酰化作用。或者賴氨酸能偶聯到受保護的氨基酸,并且隨后能夠將這個氨基酸的氨基基團去保護,得到另一個游離的氨基基團,所述游離的氨基基團可以被酰化或連接到另一氨基酸。最后,將肽從樹脂切下。這能夠通過使用King’s混合劑(cocktail)(D.S.King,C.G.Fields,G.B.Fields,Int.J.PeptideProteinRes.36,1990,255-266)來實現。然后能通過色譜法,例如制備型RP-HPLC來純化原材料,如果必要的話。效力此處所用的“效力”或“體外效力”是對化合物在基于細胞的測定中激活GLP-1、胰高血糖素、或GIP的能力的量度。從數字上來講,其表示為“EC50值”,這是在劑量響應實驗中誘導響應(例如細胞內cAMP的形成)的最大增加的一半所需的化合物有效濃度。治療用途本發明的化合物是GLP-1受體的激動劑和GIP受體的激動劑,以及選擇性地是胰高血糖素受體的激動劑(例如“雙重激動劑或三重激動劑”)。這些肽是GIP/GLP-1共同激動劑或GIP/GLP-1/胰高血糖素三重激動劑,其可以提供治療益處,以通過允許對糖尿病和肥胖癥的同時治療來滿足對于靶向代謝綜合征的臨床需求。代謝綜合征是一種醫學病癥的組合,當這些病癥一起發生時,則增加患上2型糖尿病以及動脈粥樣硬化血管疾病(例如心臟病和中風)的風險。對代謝綜合征的醫學參數的定義包括糖尿病、葡糖耐量受損、空腹葡萄糖升高、抗胰島素性、尿白蛋白分泌、中心性肥胖癥、高血壓、甘油三酯升高、LDL膽固醇升高和HDL膽固醇降低。肥胖癥是一種醫學病況,其中過量的體脂肪積累到一定程度,可能對健康和預期壽命有不利影響;并且由于其在成人和兒童中愈發流行,肥胖癥成為了當代世界里主要的可預防致死原因中的一種。它增加了多種疾病的可能性,包括心臟病、2型糖尿病、阻塞性睡眠呼吸暫停、一些類型的癌癥、以及骨關節炎,并且它通常大多是由食物攝入過量、能量消耗減少以及遺傳易感性的組合而引起。糖尿病(Diabetesmellitus),通常簡稱為糖尿病(diabetes),是一組代謝性疾病;在這種疾病中人具有高血糖水平,這或是因為身體不產生足夠的胰島素,或是因為細胞不對產生的胰島素進行響應。最常見的糖尿病類型是:(1)1型糖尿病,其中身體無法產生胰島素;(2)2型糖尿病(T2DM),其中身體無法正確地使用胰島素,以及隨時間增加的胰島素缺乏;和(3)妊娠糖尿病,其中女性因其妊娠而患上糖尿病。所有形式的糖尿病都增加長期并發癥的風險,典型的是在許多年后患上所述并發癥。這些長期并發癥大多數基于血管的損害,并且能分為兩個類別,“大血管”疾病(由較大血管的動脈粥樣硬化引起)和“微血管疾病”(由小血管的損害引起)。大血管疾病病況的例子是缺血性心臟病(ischemicheartdisease)、心肌梗塞、中風和周圍血管疾病。微血管疾病的例子是糖尿病性視網膜病、糖尿病性腎病以及糖尿病性神經病變。GLP-1和GIP以及胰高血糖素的受體是7次跨膜的異三聚體G蛋白偶聯受體家族的成員。它們結構上彼此相關,并且不僅具有顯著水平的序列同一性,還具有相似的配體識別機制和細胞內信號傳導途徑。類似地,GLP-1、GIP和胰高血糖素的肽共享具有高序列同一性/相似性的區域。GLP-1和胰高血糖素產生自共同的前體——前胰高血糖素原(preproglucagon),其以組織特異性方式差異性地加工,從而在腸內分泌細胞中產出例如GLP-1以及在胰島的α細胞中產出胰高血糖素。GIP來源于較大的GIP原(proGIP)激素原前體,并從定位于小腸中的K-細胞合成和釋放。肽腸降血糖素(incretin)激素GLP-1和GIP是由腸內分泌細胞響應于食物而分泌的,占了多達70%的進餐刺激性的胰島素分泌。證據說明在患有葡糖耐量受損或2型糖尿病的受試者中GLP-1分泌減少,然而這些患者中依然保留著對GLP-1的響應性。因此,用合適的激動劑靶向GLP-1受體,提供了有吸引力的治療代謝病癥(包括糖尿病)的手段。GLP-1的受體分布廣泛,主要在胰島、腦、心臟、腎臟和胃腸道中發現。在胰腺中,GLP-1以嚴格的葡萄糖依賴性方式,通過增加來自β細胞的胰島素分泌來發揮作用。這種葡萄糖依賴性顯示GLP-1受體的激活不太可能引起低血糖癥。GIP受體也在周圍組織中廣泛表達,所述組織包括胰島、脂肪組織、胃、小腸、心臟、骨骼、肺、腎臟、睪丸、腎上腺皮質、垂體、內皮細胞、氣管、脾、胸腺、甲狀腺和腦。與其作為腸降血糖素激素的生物學功能相一致的是,胰腺的β細胞在人中表達最高水平的GIP受體。有一些臨床證據顯示,在T2DM患者中GIP受體介導的信號傳導可能受到損傷,但顯示GIP作用是可逆的并且可以用糖尿病狀態的改善來恢復。雖然有許多關于GIP對胰島素分泌的作用也與葡萄糖無關的報道,但文獻中也報道了GIP的高血漿水平可能導致更頻繁的低血糖癥發作(TMcLaughlin等,JClinEndocrinolMetab,95,1851-1855,2010;AHadji-Georgopoulos,JClinEndocrinolMetab,56,648-652,1983)。此外,據報道肥胖受試者中的血漿GIP水平高于正常,說明GIP可能誘導肥胖癥和胰島素抗性(WCreutzfeldt等,Diabetologia.1978,14,15-24)。這得到了其他報道的支持,其報道GIP受體的消除可能預防這些病況:用高脂飲食飼喂的GIP受體敲除的小鼠實際上顯示出與野生型小鼠相比的體重抑制(KMiyawaki等,NatMed.2002,8,738-42),并且在小鼠中長期施用GIP受體拮抗劑(Pro3)GIP也預防肥胖癥和胰島素抗性(VAGault等,Diabetologia.2007,50,1752-62)。因此,本發明的目標是提供具有降低的對GIP的活性的GLP-1/胰高血糖素受體雙重激動劑。胰高血糖素是一種29個氨基酸的肽激素,由胰腺的α細胞產生,并在循環的葡萄糖低時釋放到血液中。胰高血糖素的一個重要的生理學作用是在肝中刺激葡萄糖輸出,這個過程在維持體內葡萄糖穩態中針對胰島素提供了主要的反向調節機制。然而胰高血糖素受體也在肝外的組織中表達,如腎臟、心臟、脂肪細胞、淋巴母細胞、腦、視網膜、腎上腺和胃腸道,說明了葡萄糖穩態之外的更廣泛的生理學作用。相應地,近期的研究已報道了胰高血糖素對于能量管理具有治療上的積極效果,包括刺激能量消耗和生熱作用,伴隨著食物攝入減少和體重減少。總的來說,對胰高血糖素受體的刺激可能在治療肥胖癥和代謝綜合征中是有用的。胃泌酸調節素是一種肽激素,由胰高血糖素組成,所述胰高血糖素具有包含8個氨基酸的C末端延伸。像GLP-1和胰高血糖素一樣,它以前胰高血糖素原表現,并被被小腸的內分泌細胞以組織特異性的方式切割和分泌。已知胃泌酸調節素刺激GLP-1和胰高血糖素兩種受體,并因此是雙重激動劑的原型(prototype)。由于GLP-1因其抗糖尿病的效果而為人所知,GLP-1和胰高血糖素都因其食物攝入抑制效果而為人所知,而胰高血糖素還是額外的能量消耗的介導物,因此可以想到這兩種激素的活性結合在一個分子中能產生強效的藥物,用于對代謝綜合征的治療,特別是對其組分糖尿病和肥胖癥的治療。因此,本發明的化合物可用于治療葡萄糖不耐癥、胰島素抗性、前驅糖尿病、空腹葡萄糖升高(高血糖癥)、2型糖尿病、高血壓、血脂異常、動脈硬化、冠心病、外周動脈疾病、中風或這些單個疾病組分的任何組合。此外,它們可用于控制食欲、進食和卡路里攝入、增加能量消耗、防止增重、促進減重、減少多余體重以及整體治療肥胖癥,包括病態肥胖癥。本發明的化合物是用于GLP-1受體和胰高血糖素受體的激動劑(例如“雙重激動劑”),其具有降低的對GIP受體的活性且可能提供治療益處以滿足針對代謝綜合征的臨床需要,其是通過允許對糖尿病和肥胖癥的同時治療來實現。進一步的可用本發明化合物治療的疾病狀態和健康狀況是肥胖癥相關的炎癥、肥胖癥相關的膽囊疾病和肥胖癥誘發的睡眠呼吸暫停。雖然這些病況可以直接或間接地與肥胖癥聯系起來,但本發明化合物的效果可以是整體或部分經由對體重的效果介導的,或是與該效果無關的。進一步地,所要治療的疾病是神經退行性疾病如阿茲海默病或帕金森氏病,或如上所述的其他退行性疾病。在一個實施方案中,所述化合物可用于治療或預防高血糖癥、2型糖尿病、肥胖癥。與GLP-1、胰高血糖素和胃泌酸調節素相比,毒蜥外泌肽-4具有有益的物理化學特性,如溶液中和生理條件下的溶解度和穩定性(包括對于通過酶(如DPP-4或NEP)降解的酶穩定性),這導致了更長的體內作用持續時間。因此,純GLP-1受體激動劑毒蜥外泌肽-4可以充當良好的起始主鏈來獲得具有GLP-1/胰高血糖素受體雙重激動作用的毒蜥外泌肽-4類似物。然而,毒蜥外泌肽-4也顯示了在化學上不穩定,這是由于其位置14處的甲硫氨酸氧化以及位置28處天冬酰胺的脫酰胺和異構化。因此,可能通過位置14處的甲硫氨酸的取代和對已知易于經由天冬酰胺鍵的形成(aspartimideformation)而降解的序列(特別是位置28和29處的Asp-Gly或Asn-Gly)的避免,而進一步改善穩定性。藥物組合物術語“藥物組合物”表示含有在混合時相容的成分并且能夠施用的混合物。藥物組合物可以包含一種或多種藥用的藥物。此外,藥物組合物可以包含載劑、緩沖劑、酸化劑、堿化劑、溶劑、佐劑、張度調節劑(tonicityadjusters)、軟化劑、膨脹劑(expanders)、防腐劑、物理與化學穩定劑例如表面活性劑、抗氧化劑以及其他組分,無論這些被認為是活性還是非活性成分。可以找到供技術人員制備藥物組合物的指導,例如在Remington:TheScienceandPracticeofPharmacy,(第20版)A.R.GennaroA.R.編,2000,LippencottWilliams&Wilkins,和R.C.Rowe等(編),HandbookofPharmaceuticalExcipients,PhP,2013年5月更新。本發明的毒蜥外泌肽-4肽衍生物或其鹽是連同可接受的藥物載劑、稀釋劑或賦形劑(其作為藥物組合物的一部分)一起施用的。“藥學上可接受的載劑”是生理學上可接受(例如生理學上可接受的pH)的載劑,同時所述載劑保持了與其一起施用的物質的治療特性。標準的可接受的藥物載劑及其配制物是本領域技術人員已知的,并且在例如如下文獻中描述:Remington:TheScienceandPracticeofPharmacy,(第20版)A.R.GennaroA.R.編,2000,LippencottWilliams&Wilkins,和R.C.Rowe等(編),HandbookofPharmaceuticalExcipients,PhP,2013年5月更新。一種示例性的藥學上可接受的載劑是生理鹽水溶液。在一個實施方案中,載劑選自下組:緩沖劑(例如檸檬酸鹽/檸檬酸)、酸化劑(例如鹽酸)、堿化劑(例如氫氧化鈉)、防腐劑(例如苯酚)、助溶劑(例如聚乙二醇400)、張度調節劑(例如甘露醇)、穩定劑(例如表面活性劑、抗氧化劑、氨基酸)。使用的濃度在生理學可接受的范圍內。可接受的藥物載劑或稀釋劑包括在適合口服、直腸、鼻或胃腸外(包括皮下、肌內、靜脈內、皮內以及透皮)施用的配制物中使用的那些。典型的本發明的化合物是胃腸外施用的。術語“藥學上可接受的鹽”意指本發明化合物的鹽,所述鹽在哺乳動物中使用時是安全有效的。藥學上可接受的鹽可以包括但不限于酸加成鹽(acidadditionsalt)和堿式鹽。酸加成鹽的例子包括氯化物、硫酸鹽、硫酸氫鹽、磷酸(氫)鹽、乙酸鹽、檸檬酸鹽、甲苯磺酸鹽或甲磺酸鹽。堿式鹽的例子包括具有無機陽離子的鹽,例如堿金屬或堿土金屬的鹽,如鈉、鉀、鎂或鈣鹽;以及具有有機陽離子的鹽,如胺鹽。藥學上可接受的鹽的進一步例子在如下文獻中描述:Remington:TheScienceandPracticeofPharmacy,(第20版)A.R.GennaroA.R.編,2000,LippencottWilliams&Wilkins,或HandbookofPharmaceuticalSalts,Properties,SelectionandUse,P.H.Stahl,C.G.Wermuth編,2002,VerlagHelveticaChimicaActa,Zurich,Switzerland與Wiley-VCH,Weinheim,Germany組合出版。術語“溶劑合物”意指本發明化合物或其鹽與溶劑分子的復合物,所述溶劑分子例如有機溶劑分子和/或水。在藥物組合物中,毒蜥外泌肽-4衍生物可以是單體或寡聚體形式的。術語“治療上有效量”的化合物意指無毒但足以提供所需效果的量的化合物。需要多少量的式(I)的化合物來達到所需的生物學效果取決于一些因素,例如選擇的具體化合物、預期用途、施用模式和患者的臨床情況。在每個個案中合適的“有效”量是本領域普通技術人員可以用常規實驗確定的。例如式(I)的化合物的“治療上有效量”是約0.01-50mg/劑,優選為0.1-10mg/劑。本發明的藥物組合物是適于胃腸外(例如皮下、肌內、皮內和靜脈內)、口服、直腸、局部和經口(例如舌下)施用的藥物組合物,雖然在每個個案中最適合的施用模式依賴于要治療的病況的性質和嚴重程度及每個案例中所用的式(I)化合物的性質。合適的藥物組合物可以是分開的單元的形式,例如小瓶或安瓿中的膠囊、片劑和粉劑,其各自含有限定量的化合物;作為粉劑或顆粒;作為水或非水液體中的溶液或懸液(suspension);或作為水包油或油包水乳劑。它可以以單劑量或多劑量的可注射形式提供,例如以筆的形式。如已經提及的,組合物可以通過任何合適的藥學方法來制備,所述方法包括使活性成分和載劑(可由一種或多種額外成分組成)開始接觸的步驟。在一些實施方案中,所述藥物組合物可以與用于施用的裝置一起提供,例如與注射器、注射筆或自動注射器一起提供。這些裝置可以與藥物組合物分別提供,或是預先裝填所述藥物組合物。組合治療本發明的化合物,GLP-1和胰高血糖素受體的雙重拮抗劑,能廣泛地與其他藥理學活性化合物組合,如RoteListe2014中所提及的所有藥物,例如RoteListe2014第1章中提及的所有減重劑或食欲抑制劑、RoteListe2014第58章中提及的所有降脂劑、RoteListe2014中提及的所有抗高血壓劑和腎保護劑(nephroprotective)、或RoteListe2014第36章中提及的所有利尿劑。活性成分組合特別是可用于在作用上的協同性改善。它們或是能通過分開施用活性成分來應用于患者;或是能以組合產品的形式,其中多數活性成分存在于一個藥物制劑中。當通過分開施用來施用所述活性成分時,可以同時或序貫地進行。下文提到的大多數活性成分在USPDictionaryofUSANandInternationalDrugNames,USPharmacopeia,Rockville2011中公開。其他適合這種組合的活性物質特別包括例如這樣的活性物質,所述活性物質針對一種提到的適應癥加強一種或多種活性物質的治療效果;和/或這樣的活性物質,所述活性物質允許減少一種或多種活性物質的劑量。適于組合的治療劑包括例如抗糖尿病藥,如:胰島素和胰島素衍生物,例如:甘精胰島素270-330U/mL甘精胰島素(insulinglargine)(EP2387989A)、300U/mL甘精胰島素(EP2387989A)、賴谷胰島素地特胰島素賴脯胰島素德谷胰島素(Degludec)/德谷胰島素Plus(DegludecPlus)、門冬胰島素(Aspart)、基礎胰島素和類似物(例如LY-2605541、LY2963016、NN1436)、聚乙二醇化的胰島素Lispro、Linjeta、NN1045、胰島素加Symlin(InsulinplusSymlin)、PE0139、速效和短效胰島素(例如Linjeta、PH20、NN1218、HinsBet)、(APC-002)水凝膠、口服、吸入、經皮和舌下胰島素(例如Afrezza、Tregopil、TPM02、Capsulin、口服胰島素、ORMD-0801、NN1953、NN1954、NN1956、VIAtab、Oshadi口服胰島素)。其他還包括與白蛋白或另一蛋白質通過雙功能接頭鍵合的那些胰島素衍生物。GLP-1、GLP-1類似物和GLP-1受體激動劑,例如:利西拉來(Lixisenatide)/AVE0010/ZP10/Lyxumia、艾塞那肽(Exenatide)/毒蜥外泌肽-4/Byetta/Bydureon/ITCA650/AC-2993、利拉魯肽/Victoza、索馬魯肽(Semaglutide)、他司魯肽(Taspoglutide)、Syncria/阿必魯肽(Albiglutide)、度拉糖肽(Dulaglutide)、rExendin-4、CJC-1134-PC、PB-1023、TTP-054、Langlenatide/HM-11260C、CM-3、GLP-1Eligen、ORMD-0901、NN-9924、NN-9926、NN-9927、Nodexen、Viador-GLP-1、CVX-096、ZYOG-1、ZYD-1、GSK-2374697、DA-3091、MAR-701、MAR709、ZP-2929、ZP-3022、TT-401、BHM-034、MOD-6030、CAM-2036、DA-15864、ARI-2651、ARI-2255、艾塞那肽-XTEN和胰高血糖素-Xten。DPP4抑制劑,例如:阿格列汀(Alogliptin)/Nesina、Trajenta/利拉利汀(Linagliptin)/BI-1356/Ondero/Trajenta/Tradjenta/Trayenta/Tradzenta、沙格列汀(Saxagliptin)/Onglyza、西他列汀(Sitagliptin)/捷諾維(Januvia)/Xelevia/Tesave/Janumet/Velmetia、Galvus/維格列汀(Vildagliptin)、阿拉格列汀(Anagliptin)、吉格列汀(Gemigliptin)、特力利汀(Teneligliptin)、美格列汀(Melogliptin)、曲格列汀(Trelagliptin)、DA-1229、奧格列汀(Omarigliptin)/MK-3102、KM-223、艾格列汀(Evogliptin)、ARI-2243、PBL-1427、哌諾沙星(Pinoxacin)。SGLT2抑制劑,例如:Invokana/卡格列凈(Canaglifozin)、Forxiga/達格列凈(Dapagliflozin)、瑞格列凈(Remoglifozin)、舍格列凈(Sergliflozin)、依帕列凈(Empagliflozin)、伊格列凈(Ipragliflozin)、托格列凈(Tofogliflozin)、魯格列凈(Luseogliflozin)、LX-4211、Ertuglifozin/PF-04971729、RO-4998452、EGT-0001442、KGA-3235/DSP-3235、LIK066、SBM-TFC-039,雙胍類(例如美福明(Metformin)、丁福明(Buformin)、苯乙福明(Phenformin))、噻唑烷二酮類(例如吡格列酮(Pioglitazone)、利格列酮(Rivoglitazone)、羅格列酮(Rosiglitazone)、曲格列酮(Troglitazone))、雙重PPAR激動劑(例如阿格列扎(Aleglitazar)、莫格列扎(Muraglitazar)、替格列扎(Tesaglitazar))、磺酰脲類(例如甲苯磺丁脲(Tolbutamide)、格列苯脲(Glibenclamide)、格列美脲(Glimepiride)/亞莫利(Amaryl)、格列吡嗪(Glipizide))、美格列奈類(例如那格列奈(Nateglinide)、瑞格列奈(Repaglinide)、米格列奈(Mitiglinide))、α-葡糖苷酶抑制劑(例如阿卡波糖(Acarbose)、米格列醇(Miglitol)、伏格列波糖(Voglibose)),胰淀素(Amylin)及胰淀素類似物(例如普蘭林肽(Pramlintide)、Symlin)。GPR119激動劑(例如GSK-263A、PSN-821、MBX-2982、APD-597、ZYG-19、DS-8500),GPR40激動劑(例如呋格列泛(Fasiglifam)/TAK-875、TUG-424、P-1736、JTT-851、GW9508)。其他適合的組合伴侶是塞克洛瑟(Cycloset)、11-β-HSD的抑制劑(例如LY2523199、BMS770767、RG-4929、BMS816336、AZD-8329、HSD-016、BI-135585)、葡糖激酶的活化劑(例如TTP-399、AMG-151、TAK-329、GKM-001)、DGAT的抑制劑(例如LCQ-908)、蛋白質酪氨酸磷酸酶1的抑制劑(例如曲度奎明(Trodusquemine))、葡萄糖-6-磷酸酶的抑制劑、果糖-1,6-二磷酸酶的抑制劑、糖原磷酸化酶的抑制劑、磷酸烯醇丙酮酸羧激酶的抑制劑、糖原合酶激酶的抑制劑、丙酮酸脫氫激酶(pyruvatedehydrokinase)的抑制劑、α2-拮抗劑、CCR-2拮抗劑、SGLT-1抑制劑(例如LX-2761)、雙重SGLT2/SGLT1抑制劑。一種或多種脂質降低劑也適于作為組合伴侶,如例如:HMG-CoA-還原酶抑制劑(例如辛伐他汀(Simvastatin)、阿托伐他汀(Atorvastatin))、貝特類(例如苯扎貝特(Bezafibrate)、非諾貝特(Fenofibrate))、煙酸及其衍生物(例如Niacin)、PPAR-(α、γ或α/γ)激動劑或調節劑(例如阿格列扎)、PPAR-δ激動劑、ACAT抑制劑(例如阿伐麥布(Avasimibe))、膽固醇吸收抑制劑(例如依折麥布(Ezetimibe))、膽汁酸結合物質(例如消膽胺/考來烯胺(Cholestyramine))、回腸膽汁酸轉運抑制劑、MTP抑制劑或PCSK9調節劑。HDL-升高化合物,如:CETP抑制劑(例如托徹普(Torcetrapib)、安塞曲匹(Anacetrapid)、達塞曲匹(Dalcetrapid)、依塞曲匹(Evacetrapid)、JTT-302、DRL-17822、TA-8995)或ABC1調節劑。其他適合的組合伴侶是一種或多種用于治療肥胖癥的活性物質,如例如:西布曲明(Sibutramine)、特索芬辛(Tesofensine)、奧利司他(Orlistat)、大麻素-1受體的拮抗劑、MCH-1受體拮抗劑、MC4受體激動劑、NPY5或NPY2拮抗劑(例如韋利貝特(Velneperit))、β-3-激動劑、瘦素或瘦素模擬物、5HT2c受體的激動劑(例如氯卡色林(Lorcaserin)),或布普品(bupropione)/那曲酮(naltrexone)、布普品/唑尼沙胺(zonisamide)、布普品/芬特明(phentermine)或普蘭林肽/美曲普汀(metreleptin)的組合。其他合適的組合伴侶是:進一步的胃腸肽如肽YY3-36(PYY3-36)或其類似物、胰多肽(PP)或其類似物。胰高血糖素受體激動劑或拮抗劑,GIP受體激動劑或拮抗劑,葛瑞林(ghrelin)拮抗劑或反向激動劑、類爪蟾肽(Xenin)及其類似物。此外,具有影響高血壓、慢性心力衰竭或動脈粥樣硬化的藥物的組合是合適的,如例如:血管緊張素II受體拮抗劑(例如替米沙坦(telmisartan)、坎地沙坦(candesartan)、纈沙坦(valsartan)、氯沙坦(losartan)、依普羅沙坦(eprosartan)、厄貝沙坦(irbesartan)、奧美沙坦(olmesartan)、他索沙坦(tasosartan)、阿齊沙坦(azilsartan))、ACE抑制劑、ECE抑制劑、利尿劑、β-阻斷劑、鈣拮抗劑、中樞作用高血壓藥(centrally-actinghypertensives)、α-2-腎上腺素能受體拮抗劑、中性肽鏈內切酶抑制劑、凝血細胞聚集抑制劑等或其組合。在另一個方面,本發明涉及根據本發明的化合物或其生理學上可接受的鹽與至少一種上述作為組合伴侶的活性物質進行組合用于制備適用于治療或預防疾病或病況的藥物的用途,所述疾病或病況能受到對GLP-1和胰高血糖素受體的結合和對它們活性的調節的影響。優選地,這是代謝綜合征背景下的疾病,特別是上述列出的疾病或病況中的一種,最特別是糖尿病或肥胖癥或其并發癥。根據本發明的化合物或其生理學上可接受的鹽與一種或多種活性物質的組合使用可以同時、分開或序貫地進行。根據本發明的化合物或其生理學上可接受的鹽與另一種活性物質的組合使用可以同時或在錯開的時間進行,但特別要在短時間間隔內進行。如果將它們同時施用,則將兩種活性物質一起給予患者;如果將它們在錯開的時間施用,則將兩種活性物質在少于或等于12小時的時期內給予患者,但特別要少于或等于6小時。因而,在另一個方面,本發明涉及一種藥物,其包含根據本發明的化合物或其生理學上可接受的鹽和作為組合伴侶的上述活性物質中的至少一種,任選地連同一種或多種惰性載劑和/或稀釋劑。根據本發明的化合物或其生理學上可接受的鹽或溶劑合物以及要與之組合的額外的活性物質,可以一起都存在于一種配制物中,所述配制物例如在小瓶或藥匣中,或是分別在兩種相同或不同的配制物中,所述配制物例如所謂的試劑盒的部分(kit-of-parts)。附圖說明圖1.在高脂飼喂的雌性C57BL/6小鼠中用50μg/kg每日兩次(bid)的SEQIDNO:7和SEQIDNO:8進行的4周的皮下治療期間的體重進展。數據為均值+SEM。圖2.在高脂飼喂的雌性C57BL/6小鼠中用50μg/kg每日兩次的SEQIDNO:7和SEQIDNO:8進行的4周的皮下治療期間的百分比相對體重變化。數據為均值+SEM。圖3.在高脂飼喂的雌性C57BL/6小鼠中用50μg/kg每日兩次的SEQIDNO:7和SEQIDNO:8的4周治療前及后2天的總脂肪量的確定,其通過核磁共振(NMR)測得。數據為均值+SEM。圖4.在高脂飼喂的雌性C57BL/6小鼠中皮下施用50μg/kg的化合物SEQIDNO:7和SEQIDNO:8對血糖的急性效果。數據為均值+SEM。圖5.在高脂飼喂的雌性C57BL/6小鼠中皮下施用50μg/kg的化合物SEQIDNO:15對血糖的急性效果。數據為均值+SEM。圖6.在高脂飼喂的雌性C57BL/6小鼠中用50μg/kg每日的SEQIDNO:15進行的4周的皮下治療期間的百分比相對體重變化。數據為均值+SEM。圖7.在高脂飼喂的雌性C57BL/6小鼠中用50μg/kg每日的SEQIDNO:15的4周治療前及后2天的總脂肪量的確定,其通過核磁共振(NMR)測得。數據為均值+SEM。方法采用的縮寫如下:AA氨基酸AEEAc(2-(2-氨基乙氧基)乙氧基)乙酰基cAMP環單磷酸腺苷Boc叔丁氧羰基BOP(苯并三唑-1-基氧基)三(二甲氨基)六氟磷酸鏻BSA牛血清白蛋白tBu叔丁基DCM二氯甲烷Dde1-(4,4-二甲基-2,6-二氧代亞環己基)-乙基ivDde1-(4,4-二甲基-2,6-二氧代亞環己基)3-甲基-丁基DICN,N'-二異丙基碳二亞胺DIPEAN,N-二異丙基乙胺DMEM杜貝可氏修飾伊格氏培養基(Dulbecco’smodifiedEagle’smedium)DMF二甲基甲酰胺DMS二甲基硫醚(dimethylsulfide)EDT乙二硫醇(ethanedithiol)FA甲酸FBS胎牛血清Fmoc芴基甲基氧基羰基(fluorenylmethyloxycarbonyl)HATUO-(7-氮雜苯并三唑-1-基)-N,N,N’,N’-四甲基脲鎓六氟磷酸鹽HBSSHanks’平衡鹽溶液HBTU2-(1H-苯并三唑-1-基)-1,1,3,3-四甲基-脲鎓六氟磷酸鹽HEPES2-[4-(2-羥乙基)哌嗪-1-基]乙磺酸HOBt1-羥基苯并三唑HOSuN-羥基琥珀酰亞胺HPLC高效液相色譜HTRF均相時間分辨熒光IBMX3-異丁基-1-甲基黃嘌呤LC/MS液相色譜/質譜法Mmt單甲氧基-三苯甲基Palm棕櫚酰基PBS磷酸鹽緩沖鹽水PEG聚乙二醇PK藥代動力學RP-HPLC反相高效液相色譜Stea硬脂酰基TFA三氟乙酸Trt三苯甲基UV紫外γEγ-谷氨酸肽化合物的一般合成材料不同的Rink-氨基樹脂(4-(2’,4’-二甲氧基苯基-Fmoc-氨基甲基)-苯氧基乙酰胺基-正亮氨酰基氨基甲基樹脂,MerckBiosciences;4-[(2,4-二甲氧基苯基)(Fmoc-氨基)甲基]苯氧基乙酰胺基甲基樹脂,AgilentTechnologies)用于肽酰胺的合成,其負載在0.2-0.7mmol/g范圍內。受Fmoc保護的天然氨基酸購自ProteinTechnologiesInc.、SennChemicals、MerckBiosciences、Novabiochem、IrisBiotech、Bachem、Chem-ImpexInternational或MATRIXInnovation。在合成過程中自始至終使用了下列標準氨基酸:Fmoc-L-Ala-OH、Fmoc-Arg(Pbf)-OH、Fmoc-L-Asn(Trt)-OH、Fmoc-L-Asp(OtBu)-OH、Fmoc-L-Cys(Trt)-OH、Fmoc-L-Gln(Trt)-OH、Fmoc-L-Glu(OtBu)-OH、Fmoc-Gly-OH、Fmoc-L-His(Trt)-OH、Fmoc-L-Ile-OH、Fmoc-L-Leu-OH、Fmoc-L-Lys(Boc)-OH、Fmoc-L-Met-OH、Fmoc-L-Phe-OH、Fmoc-L-Pro-OH、Fmoc-L-Ser(tBu)-OH、Fmoc-L-Thr(tBu)-OH、Fmoc-L-Trp(Boc)-OH、Fmoc-L-Tyr(tBu)-OH、Fmoc-L-Val-OH。此外,如下特殊氨基酸購自上述相同的供應商:Fmoc-L-Lys(ivDde)-OH、Fmoc-L-Lys(Mmt)-OH、Fmoc-Aib-OH、Fmoc-D-Ser(tBu)-OH、Fmoc-D-Ala-OH、Boc-L-His(Boc)-OH(可以作為甲苯溶劑合物獲得)和Boc-L-His(Trt)-OH。在例如Prelude肽合成儀(ProteinTechnologiesInc)或類似的自動化合成儀上用標準Fmoc化學法和HBTU/DIPEA激活進行固相肽合成。用DMF作為溶劑。去保護:20%哌啶/DMF,進行2x2.5分鐘。洗滌:7xDMF。偶聯2:5:10200mMAA/500mMHBTU/2MDIPEA在DMF中進行2x20分鐘。洗滌:5xDMF。當Lys側鏈經修飾時,將Fmoc-L-Lys(ivDde)-OH或Fmoc-L-Lys(Mmt)-OH用于相應的位置中。合成完成后,根據改良的文獻步驟(S.R.Chhabra等,TetrahedronLett.39,(1998),1603),用4%肼水合物在DMF中的溶液將ivDde基團除去。通過用1%TFA在二氯甲烷中的溶液重復處理,將Mmt基團除去。隨后通過用所需酸的N-羥基琥珀酰亞胺酯處理樹脂或是通過用偶聯試劑如HBTU/DIPEA或HOBt/DIC,以進行酰化。用King’s切割混合劑將所有已合成的肽從樹脂切下,所述混合劑由82.5%TFA、5%苯酚、5%水、5%茴香硫醚、2.5%EDT組成。然后將粗制的肽在二乙醚或二異丙醚中沉淀,離心并凍干。通過分析型HPLC來分析所述肽,并通過ESI質譜法進行檢查。通過常規制備型RP-HPLC純化步驟來純化粗制的肽。或者,通過手動操作合成程序來合成肽:將0.3g經干燥Rink酰胺MBHA樹脂(0.66mmol/g)放入裝有聚丙烯過濾膜的聚乙烯容器中。在DCM(15ml)中使樹脂膨脹1小時并在DMF(15ml)中膨脹1小時。通過以20%(v/v)哌啶/DMF溶液處理兩次歷時5分鐘及15分鐘而將樹脂上的Fmoc基團去保護。以DMF/DCM/DMF(各6:6:6次)洗滌樹脂。使用Kaiser測試(定量法)確認Fmoc從固體支持物的移除。將干燥DMF中的C-端Fmoc-氨基酸(對應于樹脂負載為5當量過量)添加至去除保護的樹脂并且以DMF中5當量過量的DIC與HOBT來開始偶聯。反應混合物中各個反應物的濃度為約0.4M。在轉子上于室溫旋轉混合物2小時。過濾樹脂并且以DMF/DCM/DMF(各6:6:6次)洗滌。肽樹脂等分試樣在偶聯完成時進行的Kaiser測試為陰性(樹脂上無色)。在第一個氨基酸附接之后,使用乙酸酐/吡啶/DCM(1:8:8)將樹脂中的未反應氨基基團(若有的話)封端/加帽(capped)20分鐘,以避免任何的序列刪除。在封端/加帽之后,用DCM/DMF/DCM/DMF(分別為6/6/6/6次)洗滌。通過以20%(v/v)哌啶/DMF溶液處理兩次歷時5分鐘與15分鐘,將附接有C-端氨基酸肽基樹脂上的Fmoc基團去保護。用DMF/DCM/DMF(各6:6:6次)洗滌樹脂。對肽樹脂等分試樣在Fmoc-脫除保護完成時進行的Kaiser測試為陽性。使用FmocAA/DIC/HOBt方法利用對應于DMF中的樹脂負載的5當量過量,將Rink酰胺MBHA樹脂上的靶序列中的其余氨基酸進行偶聯。反應混合物中各反應物的濃度為約0.4M。在轉子上于室溫旋轉混合物2小時。過濾樹脂并用DMF/DCM/DMF(各6:6:6次)進行洗滌。在每一偶聯步驟以及Fmoc去保護步驟之后,進行Kaiser測試以確認反應完成。在線性序列完成之后,用作為分支點或修飾點的賴氨酸的ε-氨基基團通過使用DMF中的2.5%肼水合物去保護15分鐘2次,并用DMF/DCM/DMF(各6:6:6次)洗滌。在DMF中,使用Fmoc-Glu(OH)-OtBu用DIC/HOBt方法(相對于樹脂負載的5當量過量)將谷氨酸的γ-羧基端附接至Lys的ε-氨基基團。在轉子上于室溫旋轉混合物2小時。過濾樹脂并用DMF/DCM/DMF(分別為6x30ml)洗滌。將谷氨酸上的Fmoc基團通過以20%(v/v)哌啶/DMF溶液處理兩次歷時5及15分鐘(分別為25ml)而去保護。用DMF/DCM/DMF(各6:6:6次)洗滌樹脂。在Fmoc-脫除保護完成時對肽樹脂等分試樣進行的Kaiser測試為陽性。若側鏈分支還另含有一個γ-谷氨酸,于DMF中用DIC/HOBt方法(相對于樹脂負載的5當量過量)使用第二個Fmoc-Glu(OH)-OtBu用以附接至γ-谷氨酸的游離氨基基團。在轉子上于室溫旋轉混合物2小時。過濾樹脂并用DMF/DCM/DMF(分別為6x30ml)洗滌。通過以20%(v/v)哌啶/DMF溶液處理兩次歷時5及15分鐘(25mL)而將γ-谷氨酸上的Fmoc基團去保護。用DMF/DCM/DMF(各6:6:6次)洗滌樹脂。在Fmoc-去保護完成時對肽樹脂等分試樣進行的Kaiser測試為陽性。棕櫚酸和硬脂酸附接至谷氨酸的側鏈:向γ-谷氨酸的游離氨基基團添加溶解于DMF中的棕櫚酸或硬脂酸(5當量),并通過添加DMF中的DIC(5當量)及HOBt(5當量)來起始偶聯。用DMF/DCM/DMF(各6:6:6次)洗滌樹脂。從樹脂最終切割肽:用DMC(6x10ml)、MeOH(6x10ml)及醚(6x10ml)來洗滌通過手動合成所合成的肽基樹脂,并在真空烘干箱中干燥過夜。通過用試劑混合物(80.0%TFA/5%硫代苯甲醚/5%苯酚/2.5%EDT,2.5%DMS與5%DCM)在室溫處理肽-樹脂3小時,從而完成從固體支持物對肽的切割。通過過濾收集切割混合物并用TFA(2ml)與DCM(2x5ml)洗滌樹脂。在氮氣下將過量TFA及DCM濃縮至少量并添加少量DCM(5-10ml)至殘余物中且在氮氣下蒸發。重復過程3-4次以去除大部分的揮發性雜質。將殘余物冷卻至0℃并添加無水醚以將肽沉淀。將沉淀的肽離心并去除上清液醚且添加新鮮的醚至肽中并再次離心。粗制樣品經制備型HPLC純化并冷凍干燥。通過LCMS確認肽的身分。分析型HPLC/UPLC方法A:在210-225nm處檢測柱:WatersACQUITYCSHTMC181.7μm(150x2.1mm)于50℃溶劑:H2O+0.5%TFA:ACN+0.35%TFA(流速0.5ml/min)梯度:80:20(0分鐘)至80:20(3分鐘)至25:75(23分鐘)至2:98(23.5分鐘)至2:98(30.5分鐘)至80:20(31分鐘)至80:20(37分鐘)任選地使用質量分析儀:LCTPremier,電噴霧陽離子模式方法B:在210-225nm處檢測柱:AriesprepXBC18(4.6x250mmx3.6μm),溫度:25℃溶劑:H2O+0.1%TFA:ACN+0.1%TFA(流速1ml/min)梯度:用2%緩沖液B來平衡柱并通過2%至70%緩沖液B的梯度在15分鐘過程中進行洗脫。一般制備型HPLC純化步驟將粗制的肽或者在純化系統、Jasco半制備型HPLC系統、或Agilent1100HPLC系統上進行純化。根據要純化的粗制肽的量,使用不同大小和不同流速的制備型RP-C18-HPLC柱。采用乙腈+0.1%TFA(B)和水+0.1%TFA(A)作為洗脫液。收集含有產物的級分并凍干,以獲得純化的產物,通常是作為TFA鹽。毒蜥外泌肽-4衍生物的溶解度和穩定性測試測試一批肽的溶解度和穩定性之前,先確定其純度(HPLC-UV)。對于溶解度測試,靶濃度為10mg純化合物/mL。因此,在不同的緩沖體系中,基于之前確定的%純度以10mg/mL化合物的濃度從固體樣品制備溶液。在溫和攪拌2小時后,從上清進行HPLC-UV,所述上清通過以4500rpm離心20分鐘獲得。然后通過用UV峰面積進行的0.2μL-注射的對比來確定溶解度,所述UV峰面積是用DMSO中濃度為1.2mg/mL的肽儲液(基于%純度),注射范圍為0.2-2μl的各種體積而獲得的。該分析還起到穩定性測試起點(t0)的作用。對于穩定性測試,為溶解度獲得的上清的等分試樣在40℃儲存7天。在這個時間過程后,將樣品在4500rpm離心20分鐘,并用HPLC-UV分析0.2μL的上清液。為了進行剩余肽量的確定,按照如下等式將靶化合物在t0和t7的峰面積進行比較,得到“%剩余肽”,其遵循如下等等式:%剩余肽=[(峰面積肽t7)x100]/峰面積肽t0。穩定性表示為“%剩余肽”。用方法B作為HPLC/UPLC方法,于214nM處檢測。GLP-1、胰高血糖素和GIP受體效力的體外細胞測定通過功能測定法來確定化合物對受體的激動作用,所述測定法測量穩定表達人GLP-1、GIP或胰高血糖素受體的HEK-293細胞系的cAMP響應。用來自CisbioCorp.(目錄號:62AM4PEC)的試劑盒,基于HTRF(均相時間分辨熒光)來確定細胞的cAMP含量。為了制備,將細胞分入T175培養瓶并在培養基(DMEM/10%FBS)中過夜生長至接近匯合狀態(confluency)。然后除去培養基,并用無鈣和鎂的PBS洗滌細胞,然后用Accutase酶(Sigma-Aldrich,目錄號A6964)進行蛋白酶處理。洗滌脫離的細胞并將其重懸于測定緩沖液(1xHBSS;20mMHEPES,0.1%BSA,2mMIBMX)中,并確定細胞密度。然后將其稀釋至400000細胞/ml,并將25μl的等分試樣分裝至96孔板的孔中。為了測量,將25μl的測試化合物在測定緩沖液中的溶液添加到孔中,然后室溫溫育30分鐘。添加稀釋于裂解緩沖液(試劑盒組分)中的HTRF試劑后,將平板溫育1小時,然后測量665/620nm處的熒光比。通過檢測引起最大響應的50%激活的濃度(EC50)來對激動劑的體外效力進行量化。用于在小鼠和豬中量化毒蜥外泌肽-4衍生物的生物分析篩選方法小鼠接受1mg/kg的皮下(s.c.)給藥。將小鼠處死(sacrified)并在施用后0.25,0.5、1、2、4、8、16和24小時后收集血樣。蛋白質沉淀后經由液相色譜質譜法(LC/MS)分析血漿樣品。用5.2.1版WinonLin(非房室模型)計算PK參數和半衰期。雌性小型豬接受0.1mg/kg的皮下(s.c.)給藥。在施用后0.25、0.5、1、2、4、8、24、32、48、56和72小時后收集血樣。蛋白質沉淀后經由液相色譜質譜法(LC/MS)分析血漿樣品。用5.2.1版WinonLin(非房室模型)計算PK參數和半衰期。小鼠中的胃排空和腸通過率使用體重在20-30g的雌性NMRI小鼠。使小鼠適應圈養條件至少1周。使小鼠禁食過夜,而始終保持水的供應。在研究當日將小鼠稱重,單獨籠養,并允許其能接觸500mg的飼料30分鐘,而水則被移除。在30分鐘飼喂期結束時飼料保持已移除,并進行稱重。然后,同時施用測試化合物/參比化合物或其在對照組中的載體(vehicle)。60分鐘后,通過強飼法(gavage)將著色的、非熱量的食團(bolus)灌輸(instilled)到胃中。同時施用測試化合物/參考化合物或其在對照組中的介質,以在施用著色食團時達到Cmax。再過30分鐘后,處死動物,并準備好胃和小腸。將已填滿的胃稱重,排空,小心清潔,并干燥和再次稱重。計算的胃內容物說明胃排空的程度。不用力地將小腸縷直,并測量其長度。然后測量從腸的胃開端至腸內容物食團到達的最遠端的距離。按照后者距離和小腸總長度的百分比來給出腸通過率。對于雌性和雄性小鼠二者可獲得可比較的數據。統計學分析用Everstat6.0通過單因素方差分析,然后用Dunnetts或Newman-Keuls作為事后檢驗(post-hoctest)分別來進行。在p<0.05水平處,認為差異是統計學顯著的。Dunnetts檢驗僅用于比較與介質對照的對比。Newman-Keul's測試用于所有成對比較(即對比介質和參考組)。小鼠中對食物攝入的自動化評估使用體重在20-30g的雌性NMRI小鼠。使小鼠適應豢養條件至少1周,并且在評估設備中單獨籠養至少1天,此時同時記錄基本數據。在研究當天,在接近熄燈階段(lights-offphase)(熄燈12小時)皮下施用測試產品,并且隨后立即啟動飼料消耗評估。評估包括在22小時內連續的監測(每30分鐘)。在數天重復這個操作是可能的。將評估限制至22小時是出于實踐上的理由,以允許在操作之間對動物再次稱重,再次填喂飼料和施用水和藥物。結果可以評估為22小時內的積累數據,或是差別化至30分鐘的間隔。對于雌性和雄性小鼠二者可獲得可比較的數據。統計學分析是用Everstat6.0通過對重復測量的雙因素方差分析和Dunnett's事后分析來進行的。在p<0.05的水平的差異被認為是統計學顯著的。在飲食誘導的肥胖(DIO)C57BL/6雌性小鼠中,在皮下治療后對于血糖和體重的急性和慢性效果使雌性C57BL/6NCrl小鼠以小組養在特定的無病原體屏障設施中,進行12h光照/黑暗循環,其能自由接觸水和標準或高脂肪飲食。在預先飼喂的高脂肪飲食后,將小鼠分層至治療組(n=8),以使每組具有相似的均值體重。包括了年齡一致、能任意接觸標準食物的組作為標準對照組。在實驗之前,用介質溶液皮下注射小鼠并稱重,進行3天,以使其適應該程序。1)在飼養的DIO小鼠中對于血糖的急性效果:在即將首次施用(s.c.)介質(磷酸鹽緩沖溶液)或毒蜥外泌肽-4衍生物(溶于磷酸鹽緩沖液中)之前分別取得初始血樣。施用體積為5mL/kg。動物在實驗期間能接觸到水和它們各自對應的飲食。在t=0小時、t=1小時、t=2小時、t=3小時、t=4小時、t=6小時和t=24小時處測量血糖水平(方法:Accu-Check血糖儀)。血液采樣通過無麻醉尾部切口進行。2)在雌性DIO小鼠中對于體重的慢性效果:小鼠每天一次(皮下在夜晚時間)或每天兩次分別在早晨與晚上,在光照階段開始與結束時利用介質或毒蜥外泌肽-4衍生物處理4周。每天記錄體重。在治療開始前兩天與第26天,通過核磁共振(NMR)來測量總脂肪量。使用Everstat6.0通過對重復量測量的雙因素方差分析與Dunnetts事后檢驗分析(葡萄糖概貌),以及單因素方差分析然后是Dunnetts事后檢驗(體重、體脂肪)來進行統計分析。在p<0.05水平處,與經介質處理的DIO對照小鼠相比的差異被認為是統計學顯著的。在雌性糖尿病dbdb小鼠中的4周處理對于葡萄糖、HbA1c以及口服葡萄糖耐量的效果使用具有平均非空腹葡萄糖值為14.5mmol/l以及體重為37-40g的8周齡雌性糖尿病dbdb小鼠。小鼠被分別標記并使小鼠適應豢養條件至少一周。在研究開始前7天,測量非空腹葡萄糖以及HbA1c的基線值,研究開始前5天,依據其HbA1c值將小鼠分配至數組與數個鼠籠(每個鼠籠5只小鼠,每組10只)以確保組間的較低與較高值平均分布(分層)。通過在早晨與下午每天兩次皮下施用來處理小鼠4周。在研究第21天由尾尖獲得血液樣品供HbA1c之用,并在第4周中評估口服葡萄糖耐量。口服葡萄糖耐量測試是在早晨沒有在先額外化合物施用的情況下完成的,主要是評估長期處理以及較少的急性化合物施用的效果。小鼠在口服葡萄糖施用之前禁食4小時(2g/kg,t=0分鐘)。在葡萄糖施用之前以及在15、30、60、90、120與180分鐘抽取血液樣品。在最后一次血液取樣之后恢復飼喂。結果表示為相對于基線的變化,葡萄糖以mmol/l計而HbA1c以%計。使用Everstat6.0版基于SAS通過單因素方差分析,然后是Dunnett’s事后檢驗相對于介質對照來進行統計分析。在p<0.05水平處,差異被認為是統計學顯著的。在非空腹雌性糖尿病dbdb-小鼠中的葡萄糖降低使用均值非空腹葡萄糖數值為20-22mmol/l且體重為42g+/-0.6g(SEM)的雌性糖尿病dbdb-小鼠。將小鼠分別標記并使小鼠適應豢養條件至少一周。在研究開始前3-5天,依據小鼠的非空腹葡萄糖值將小鼠分配至數組與數個鼠籠(每個鼠籠4只小鼠,每組8只)以確保組間的較低與較高值平均分布(分層)。在研究當天,將小鼠稱重并給藥(t=0)。在即將施用化合物之前移除飼料,但水保持為可取用,且在尾部切割處抽取第一個血液樣品(基線)。在30、60、90、120、240、360以及480分鐘處于尾部切割處抽取進一步的血液樣品。使用Everstat6.0版基于SAS通過雙因素方差分析對重復測量值進行統計分析,然后是Dunnett’s事后檢驗相對于介質對照來進行統計分析。在p<0.05水平處,差異被認為是統計學顯著的。實施例本發明通過如下實施例來進一步闡述。實施例1:合成SEQIDNO:7如方法中所述,在經干燥Rink-酰胺MBHA樹脂(0.66mmol/g)上進行手動合成程序。以DIC/HOBt-活化來實施Fmoc-合成策略。在位置14使用Fmoc-Lys(ivDde)-OH并在位置1使用Boc-His(Boc)-OH。依據經修飾的文獻方法(S.R.Chhabra等,TetrahedronLett.39,(1998),1603)使用于DMF中的4%肼水合物從樹脂上的肽切下ivDde-基團。使用金氏混合物(D.S.King,C.G.Fields,G.B.Fields,Int.J.PeptideProteinRes.36,1990,255-266)將肽從樹脂切下。經由制備型HPLC使用乙腈/水梯度(兩種緩沖液均有0.1%TFA)來純化粗產物。經純化的肽通過LCMS(方法B)進行分析。在峰下發現的保留時間14.29min的質量信號的解卷積揭示肽質量為4649.20,其與預期值4649.29相符。實施例2:合成SEQIDNO:8如方法中所述,在經干燥Rink酰胺MBHA樹脂(0.66mmol/g)上進行手動合成程序。以DIC/HOBT-活化來實施Fmoc-合成策略。在位置14使用Fmoc-Lys(ivDde)-OH并在位置1使用Boc-His(Boc)-OH。依據經修改的文獻方法(S.R.Chhabra等,TetrahedronLett.39,(1998),1603)使用4%于DMF中的肼水合物從樹脂上的肽切下ivDde-基團。使用金氏混合物(D.S.King,C.G.Fields,G.B.Fields,Int.J.PeptideProteinRes.36,1990,255-266)將肽從樹脂切下。經由制備型HPLC使用乙腈/水梯度(兩種緩沖液均有0.1%TFA)來純化粗產物。經純化的肽通過LCMS(方法B)進行分析。在峰下發現的滯留時間14.05min的質量信號的解卷積揭示肽質量為4634.80,其與預期值4635.27相符。以類似的方式合成表3中所示的肽并進行表征。表3:合成肽的列表及計算分子量與實驗分子量的對比SEQIDNO計算的質量實驗質量單同位素或平均質量64545.44546.0單同位素74649.34649.2平均84635.34634.8平均94534.24533.0平均104506.14504.8平均114520.24518.3平均124662.44662.2單同位素134648.44648.4單同位素144703.54703.6單同位素154689.54689.5單同位素164793.54793.6單同位素174821.64821.6單同位素184837.64837.6單同位素204150.14150.2單同位素214675.54675.4單同位素224689.54689.5單同位素234138.64139.4平均244123.64122.6平均254164.14164.1單同位素以類似的方式可合成表4中的下列肽。表4.可以類似方式合成的肽的列表SEQIDNO19實施例3:穩定性及溶解度肽化合物的溶解度及穩定性是如方法中所述來進行評估。結果提供于表5中。表5:穩定性和溶解度實施例4:關于GLP-1、胰高血糖素及GIP受體的體外數據如方法部分所述,通過將表達人胰高血糖素受體(人胰高血糖素R)、人GIP受體(hGIP-R)或人GLP-1受體(hGLP-1R)的細胞暴露于濃度增加的列出的化合物以及測量形成的cAMP,確定了肽化合物在GLP-1、胰高血糖素和GIP受體處的效力。結果示于表6中:表6.毒蜥外泌肽-4衍生物對GLP-1、胰高血糖素及GIP受體的EC50值(以pM表示)SEQIDNOEC50hGLP-1REC50人胰高血糖素-REC50hGIP-R10.4>1000000012500.0614.1136.02760.073.4101.37617.582.328.12140.096.415.41160.0103.552.4890.01110.3261.013400.0123.7130.08290.0131.822.82390.0144.1194.06530.0152.442.61855.0162.042.01870.0172.816.2906.0188.38.62160.0實施例5:比對測試測試了一組選擇的在位置14處包含官能化的氨基酸的創造性的毒蜥外泌肽-4衍生物對比在該位置14處具有非官能化的氨基酸的對應化合物或相同氨基酸序列。參考對化合物和在GLP-1、胰高血糖素和GIP受體處的對應的EC50值(以pM表示)示于表7中。如其所示,創造性的毒蜥外泌肽-4衍生物顯示出相比于在位置14處具有非官能化氨基酸的化合物更為優越的活性。此外,測試了一組選擇的在位置27處包含Aib的創造性的毒蜥外泌肽-4衍生物的選擇對比在位置27處具有賴氨酸的對應化合物(其作為非天然毒蜥外泌肽-4)或相同氨基酸序列。參考對化合物和在GLP-1、胰高血糖素和GIP受體處的對應的EC50值(以pM表示)示于表8中。如其所示,創造性的毒蜥外泌肽-4衍生物顯示出相比于在位置27處具有Lys的非天然毒蜥外泌肽-4的對應衍生物降低的對GIP受體的活性。表7:包含在位置14處的非官能化氨基酸的毒蜥外泌肽-4衍生物對比包含在位置14處的官能化氨基酸的毒蜥外泌肽-4衍生物或相同氨基酸序列的比較。對GLP-1、胰高血糖素和GIP受體的EC50值以pM表示。(K=賴氨酸,L=亮氨酸,γE-x53=(S)-4-羧基-4-十六酰基氨基-丁酰基-,γE-x70=(S)-4-羧基-4-十八酰基氨基-丁酰基-,γE-γE-x53=(S)-4-羧基-4-((S)-4-羧基-4-十六酰基氨基-丁酰基氨基)-丁酰基-))表8:包含在位置27處的Aib的毒蜥外泌肽-4衍生物對比包含在位置27處的Lys的毒蜥外泌肽-4衍生物或相同氨基酸序列的比較。在GLP-1、胰高血糖素和GIP受體處的EC50值以pM表示。實施例6:藥代動力學測試如方法中所述測定藥代動力學概貌。計算出的T1/2以及Cmax值顯示于表9中。表9.毒蜥外泌肽-4衍生物的藥代動力學概貌實例7:飲食誘導的肥胖(DIO)C57BL/6雌性小鼠中SEQIDNO:7和SEQIDNO:8在每日兩次皮下處理后對血糖和體重的急性及慢性效果1)葡萄糖概貌在血液取樣以確定血糖基線水平之后,對喂養飲食誘導的肥胖雌性C57BL/6小鼠皮下施用50μg/kg的SEQIDNO:7、50μg/kg的SEQIDNO:8或磷酸鹽緩沖溶液(標準或高脂飲食的介質對照)。在預定的時間點,取得更多血液樣品來測量血糖并產生24小時的血糖概貌。SEQIDNO:7和SEQIDNO:8證明,相比DIO對照小鼠,在化合物給藥后時間點t=1、2、3、4、6和24小時血糖顯著降低(p<0.0001,雙因子ANOVA-RM,事后Dunnett檢驗;平均值±SEM;參見圖4)。2)體重肥胖的C57BL/6雌性小鼠經每天兩次以50μg/kgSEQIDNO:7、50μg/kgSEQIDNO:8或介質皮下處理4周。每天記錄體重,并在4周的處理開始之前及之后確定了體脂含量。以50μg/kgSEQIDNO:7處理顯示與媒劑DIO對照小鼠相比,于第7天開始在每日體重方面有統計學顯著下降,并持續到研究結束(研究結束為p>0.0001)。以50μg/kgSEQIDNO:8處理顯示當與媒劑DIO對照小鼠相比,于第5天開始在每日體重方面顯著下降,并持續到研究結束(研究結束為p>0.0001,表10,圖1與2)。這些變化是因為體脂降低,如體脂含量的絕對變化所示(表10,圖3)。表10.DIO小鼠在4周處理期內的體重變化(平均值±SEM)樣品(劑量)整體體重變化(g)體脂變化(g)對照標準飲食+0.94±0.4+2.56±0.4對照高脂飲食+3.83±0.5+5.00±0.5SEQIDNO:7(50μg/kg每日兩次)-5.49±0.9-3.73±0.8SEQIDNO:8(50μg/kg每日兩次)-5.38±0.5-3.81±0.6實施例8:飲食誘導的肥胖(DIO)C57BL/6雌性小鼠中SEQIDNO:15在每日一次皮下處理后對血糖和體重的急性及慢性效果1)葡萄糖概貌在血液取樣以確定血糖基線水平之后,對喂養飲食誘導的肥胖雌性C57BL/6小鼠皮下施用50μg/kg的SEQIDNO:15或磷酸鹽緩沖溶液(標準或高脂飲食的介質對照)。在預定的時間點,取得更多血液樣品來測量血糖并產生24小時的血糖概貌。SEQIDNO:15證明與DIO對照小鼠相比,在化合物給藥后時間點t=1、2、3、4、6及24小時血糖顯著降低(p<0.001,2-W-ANOVA-RM,事后Dunnett氏檢驗;平均值±SEM)(參見圖5)。2)體重肥胖的C57BL/6雌性小鼠經每天一次以50μg/kgSEQIDNO:15或媒劑皮下處理4周。每天記錄體重,并在4周的處理開始之前及之后確定了體脂含量。以50μg/kgSEQIDNO:15處理顯示當與媒劑DIO對照小鼠相比,于第4天開始在每日體重方面有統計學顯著下降,并持續到研究結束(研究結束為p>0.001,表11,圖6)。這些變化是因為體脂降低,如體脂含量的絕對變化所示(表11,圖7)。表11.DIO小鼠在4周處理期內的體重變化(平均值±SEM)實例(劑量)整體體重變化(g)體脂變化(g)對照標準飲食+1.71±0.3+0.71±0.4對照高脂飲食+5.41±0.5+3.26±0.4SEQIDNO:15(50μg/kg每日一次)-4.59±1.1-4.01±0.68表12.序列序列表<110>賽諾菲(SANOFI)<120>作為肽性雙重GLP-1/胰高血糖素受體激動劑的毒蜥外泌肽-4衍生物<130>DE2014/029<150>EP14305501.0<151>2014-04-07<160>25<170>PatentInversion3.5<210>1<211>39<212>PRT<213>吉拉毒蜥(Helodermasuspectum)<220><221>MOD_RES<222>(39)..(39)<223>酰胺化的C-末端<400>1HisGlyGluGlyThrPheThrSerAspLeuSerLysGlnMetGluGlu151015GluAlaValArgLeuPheIleGluTrpLeuLysAsnGlyGlyProSer202530SerGlyAlaProProProSer35<210>2<211>30<212>PRT<213>人(Homosapiens)<220><221>MOD_RES<222>(30)..(30)<223>酰胺化的C-末端<400>2HisAlaGluGlyThrPheThrSerAspValSerSerTyrLeuGluGly151015GlnAlaAlaLysGluPheIleAlaTrpLeuValLysGlyArg202530<210>3<211>29<212>PRT<213>人(Homosapiens)<400>3HisSerGlnGlyThrPheThrSerAspTyrSerLysTyrLeuAspSer151015ArgArgAlaGlnAspPheValGlnTrpLeuMetAsnThr2025<210>4<211>31<212>PRT<213>人工序列<220><223>人工多肽<220><221>MOD_RES<222>(20)..(20)<223>Lys在氨基側鏈基團官能化為Lys((S)-4-羧基-4-十六酰基氨基-丁酰基)<400>4HisAlaGluGlyThrPheThrSerAspValSerSerTyrLeuGluGly151015GlnAlaAlaLysGluPheIleAlaTrpLeuValArgGlyArgGly202530<210>5<211>42<212>PRT<213>人(Homosapiens)<400>5TyrAlaGluGlyThrPheIleSerAspTyrSerIleAlaMetAspLys151015IleHisGlnGlnAspPheValAsnTrpLeuLeuAlaGlnLysGlyLys202530LysAsnAspTrpLysHisAsnIleThrGln3540<210>6<211>39<212>PRT<213>人工序列<220><223>人工多肽<220><221>MOD_RES<222>(2)..(2)<223>Xaa是Aib<220><221>MOD_RES<222>(14)..(14)<223>Lys在氨基側鏈基團官能化為Lys((S)-4-羧基-4-十八酰基氨基-丁酰基)<220><221>MOD_RES<222>(27)..(27)<223>Xaa是Aib<220><221>MOD_RES<222>(29)..(29)<223>Xaa是D-Ala<220><221>MOD_RES<222>(39)..(39)<223>酰胺化的C-末端<400>6HisXaaGlnGlyThrPheThrSerAspLeuSerLysGlnLysAspGlu151015GlnArgAlaLysLeuPheIleGluTrpLeuXaaAlaXaaGlyProSer202530SerGlyAlaProProProSer35<210>7<211>39<212>PRT<213>人工序列<220><223>人工多肽<220><221>MOD_RES<222>(2)..(2)<223>Xaa是Aib<220><221>MOD_RES<222>(14)..(14)<223>Lys在氨基側鏈基團官能化為Lys((S)-4-羧基-4-((S)-4-羧基-4-十六酰基氨基-丁酰基氨基)-丁酰基)<220><221>MOD_RES<222>(27)..(27)<223>Xaa是Aib<220><221>MOD_RES<222>(29)..(29)<223>Xaa是D-Ala<220><221>MOD_RES<222>(39)..(39)<223>酰胺化的C-末端<400>7HisXaaGlnGlyThrPheThrSerAspLeuSerLysGlnLysAspGlu151015GlnArgAlaLysLeuPheIleGluTrpLeuXaaAlaXaaGlyProSer202530SerGlyAlaProProProSer35<210>8<211>39<212>PRT<213>人工序列<220><223>人工多肽<220><221>MOD_RES<222>(2)..(2)<223>Xaa是Aib<220><221>MOD_RES<222>(14)..(14)<223>Lys在氨基側鏈基團官能化為Lys((S)-4-羧基-4-((S)-4-羧基-4-十六酰基氨基-丁酰基氨基)-丁酰基)<220><221>MOD_RES<222>(27)..(27)<223>Xaa是Aib<220><221>MOD_RES<222>(39)..(39)<223>酰胺化的C-末端<400>8HisXaaGlnGlyThrPheThrSerAspLeuSerLysGlnLysAspGlu151015GlnArgAlaLysLeuPheIleGluTrpLeuXaaAlaGlyGlyProSer202530SerGlyAlaProProProSer35<210>9<211>39<212>PRT<213>人工序列<220><223>人工多肽<220><221>MOD_RES<222>(2)..(2)<223>Xaa是Aib<220><221>MOD_RES<222>(14)..(14)<223>Lys在氨基側鏈基團官能化為Lys((S)-4-羧基-4-十八酰基氨基-丁酰基)<220><221>MOD_RES<222>(27)..(27)<223>Xaa是Aib<220><221>MOD_RES<222>(39)..(39)<223>酰胺化的C-末端<400>9HisXaaGlnGlyThrPheThrSerAspLeuSerLysGlnLysAspGlu151015GlnArgAlaLysLeuPheIleGluTrpLeuXaaAlaGlyGlyProSer202530SerGlyAlaProProProSer35<210>10<211>39<212>PRT<213>人工序列<220><223>人工多肽<220><221>MOD_RES<222>(2)..(2)<223>Xaa是Aib<220><221>MOD_RES<222>(14)..(14)<223>Lys在氨基側鏈基團官能化為Lys((S)-4-羧基-4-十六酰基氨基-丁酰基)<220><221>MOD_RES<222>(27)..(27)<223>Xaa是Aib<220><221>MOD_RES<222>(39)..(39)<223>酰胺化的C-末端<400>10HisXaaGlnGlyThrPheThrSerAspLeuSerLysGlnLysAspGlu151015GlnArgAlaLysLeuPheIleGluTrpLeuXaaAlaGlyGlyProSer202530SerGlyAlaProProProSer35<210>11<211>39<212>PRT<213>人工序列<220><223>人工多肽<220><221>MOD_RES<222>(2)..(2)<223>Xaa是Aib<220><221>MOD_RES<222>(14)..(14)<223>Lys在氨基側鏈基團官能化為Lys((S)-4-羧基-4-十六酰基氨基-丁酰基)<220><221>MOD_RES<222>(27)..(27)<223>Xaa是Aib<220><221>MOD_RES<222>(29)..(29)<223>Xaa是D-Ala<220><221>MOD_RES<222>(39)..(39)<223>酰胺化的C-末端<400>11HisXaaGlnGlyThrPheThrSerAspLeuSerLysGlnLysAspGlu151015GlnArgAlaLysLeuPheIleGluTrpLeuXaaAlaXaaGlyProSer202530SerGlyAlaProProProSer35<210>12<211>39<212>PRT<213>人工序列<220><223>人工多肽<220><221>MOD_RES<222>(2)..(2)<223>Xaa是Aib<220><221>MOD_RES<222>(14)..(14)<223>Lys在氨基側鏈基團官能化為Lys((S)-4-羧基-4-((S)-4-羧基-4-十六酰基氨基-丁酰基氨基)-丁酰基)<220><221>MOD_RES<222>(27)..(27)<223>Xaa是Aib<220><221>MOD_RES<222>(29)..(29)<223>Xaa是D-Ala<220><221>MOD_RES<222>(39)..(39)<223>酰胺化的C-末端<400>12HisXaaGlnGlyThrPheThrSerAspLeuSerLysGlnLysAspGlu151015GlnArgAlaLysLeuPheIleGluTrpLeuXaaSerXaaGlyProSer202530SerGlyAlaProProProSer35<210>13<211>39<212>PRT<213>人工序列<220><223>人工多肽<220><221>MOD_RES<222>(2)..(2)<223>Xaa是Aib<220><221>MOD_RES<222>(14)..(14)<223>Lys在氨基側鏈基團官能化為Lys((S)-4-羧基-4-((S)-4-羧基-4-十六酰基氨基-丁酰基氨基)-丁酰基)<220><221>MOD_RES<222>(27)..(27)<223>Xaa是Aib<220><221>MOD_RES<222>(39)..(39)<223>酰胺化的C-末端<400>13HisXaaGlnGlyThrPheThrSerAspLeuSerLysGlnLysAspGlu151015GlnArgAlaLysLeuPheIleGluTrpLeuXaaSerGlyGlyProSer202530SerGlyAlaProProProSer35<210>14<211>39<212>PRT<213>人工序列<220><223>人工多肽<220><221>MOD_RES<222>(2)..(2)<223>Xaa是Aib<220><221>MOD_RES<222>(14)..(14)<223>Lys在氨基側鏈基團官能化為Lys((S)-4-羧基-4-((S)-4-羧基-4-十六酰基氨基-丁酰基氨基)-丁酰基)<220><221>MOD_RES<222>(27)..(27)<223>Xaa是Aib<220><221>MOD_RES<222>(29)..(29)<223>Xaa是D-Ala<220><221>MOD_RES<222>(39)..(39)<223>酰胺化的C-末端<400>14HisXaaGlnGlyThrPheThrSerAspLeuSerLysGlnLysAspGlu151015GlnArgAlaLysLeuPheIleGluTrpLeuXaaLysXaaGlyProSer202530SerGlyAlaProProProSer35<210>15<211>39<212>PRT<213>人工序列<220><223>人工多肽<220><221>MOD_RES<222>(2)..(2)<223>Xaa是Aib<220><221>MOD_RES<222>(14)..(14)<223>Lys在氨基側鏈基團官能化為Lys((S)-4-羧基-4-((S)-4-羧基-4-十六酰基氨基-丁酰基氨基)-丁酰基)<220><221>MOD_RES<222>(27)..(27)<223>Xaa是Aib<220><221>MOD_RES<222>(39)..(39)<223>酰胺化的C-末端<400>15HisXaaGlnGlyThrPheThrSerAspLeuSerLysGlnLysAspGlu151015GlnArgAlaLysLeuPheIleGluTrpLeuXaaLysGlyGlyProSer202530SerGlyAlaProProProSer35<210>16<211>39<212>PRT<213>人工序列<220><223>人工多肽<220><221>MOD_RES<222>(2)..(2)<223>Xaa是Aib<220><221>MOD_RES<222>(14)..(14)<223>Lys在氨基側鏈基團官能化為Lys((2-{2-[2-(2-{2-[(4S)-4-羧基-4-十六酰基氨基-丁酰基氨基]-乙氧基}-乙氧基)-乙酰基氨基]-乙氧基}-乙氧基)-乙酰基)<220><221>MOD_RES<222>(27)..(27)<223>Xaa是Aib<220><221>MOD_RES<222>(39)..(39)<223>酰胺化的C-末端<400>16HisXaaGlnGlyThrPheThrSerAspLeuSerLysGlnLysAspGlu151015GlnArgAlaLysLeuPheIleGluTrpLeuXaaAlaGlyGlyProSer202530SerGlyAlaProProProSer35<210>17<211>39<212>PRT<213>人工序列<220><223>人工多肽<220><221>MOD_RES<222>(2)..(2)<223>Xaa是Aib<220><221>MOD_RES<222>(14)..(14)<223>Lys在氨基側鏈基團官能化為Lys((2-{2-[2-(2-{2-[(4S)-4-羧基-4-十八酰基氨基-丁酰基氨基]-乙氧基}-乙氧基)-乙酰基氨基]-乙氧基}-乙氧基)-乙酰基)<220><221>MOD_RES<222>(27)..(27)<223>Xaa是Aib<220><221>MOD_RES<222>(39)..(39)<223>酰胺化的C-末端<400>17HisXaaGlnGlyThrPheThrSerAspLeuSerLysGlnLysAspGlu151015GlnArgAlaLysLeuPheIleGluTrpLeuXaaAlaGlyGlyProSer202530SerGlyAlaProProProSer35<210>18<211>39<212>PRT<213>人工序列<220><223>人工多肽<220><221>MOD_RES<222>(2)..(2)<223>Xaa是Aib<220><221>MOD_RES<222>(14)..(14)<223>Lys在氨基側鏈基團官能化為Lys([2-(2-{2-[2-(2-{2-[2-(2-十八酰基氨基-乙氧基)-乙氧基]-乙酰基氨基}-乙氧基)-乙氧基]-乙酰基氨基}-乙氧基)-乙氧基]-乙酰基)<220><221>MOD_RES<222>(27)..(27)<223>Xaa是Aib<220><221>MOD_RES<222>(39)..(39)<223>酰胺化的C-末端<400>18HisXaaGlnGlyThrPheThrSerAspLeuSerLysGlnLysAspGlu151015GlnArgAlaLysLeuPheIleGluTrpLeuXaaAlaGlyGlyProSer202530SerGlyAlaProProProSer35<210>19<211>39<212>PRT<213>人工序列<220><223>人工多肽<220><221>MOD_RES<222>(2)..(2)<223>Xaa是Aib<220><221>MOD_RES<222>(14)..(14)<223>Lys在氨基側鏈基團官能化為Lys((2-{2-[2-(2-{2-[(4S)-4-羧基-4-(17-羧基-十七酰基)氨基-丁酰基氨基]-乙氧基}-乙氧基)-乙酰基氨基]-乙氧基}-乙氧基)-乙酰基)<220><221>MOD_RES<222>(27)..(27)<223>Xaa是Aib<220><221>MOD_RES<222>(39)..(39)<223>酰胺化的C-末端<400>19HisXaaGlnGlyThrPheThrSerAspLeuSerLysGlnLysAspGlu151015GlnArgAlaLysLeuPheIleGluTrpLeuXaaAlaGlyGlyProSer202530SerGlyAlaProProProSer35<210>20<211>39<212>PRT<213>人工序列<220><223>人工多肽<220><221>MOD_RES<222>(2)..(2)<223>Xaa是Aib<220><221>MOD_RES<222>(27)..(27)<223>Xaa是Aib<220><221>MOD_RES<222>(29)..(29)<223>Xaa是D-Ala<220><221>MOD_RES<222>(39)..(39)<223>酰胺化的C-末端<400>20HisXaaGlnGlyThrPheThrSerAspLeuSerLysGlnLysAspGlu151015GlnArgAlaLysLeuPheIleGluTrpLeuXaaAlaXaaGlyProSer202530SerGlyAlaProProProSer35<210>21<211>39<212>PRT<213>人工序列<220><223>人工多肽<220><221>MOD_RES<222>(2)..(2)<223>Xaa是Aib<220><221>MOD_RES<222>(14)..(14)<223>Lys在氨基側鏈基團官能化為Lys((S)-4-羧基-4-((S)-4-羧基-4-十六酰基氨基-丁酰基氨基)-丁酰基)<220><221>MOD_RES<222>(39)..(39)<223>酰胺化的C-末端<400>21HisXaaGlnGlyThrPheThrSerAspLeuSerLysGlnLysAspGlu151015GlnArgAlaLysLeuPheIleGluTrpLeuLysAlaGlyGlyProSer202530SerGlyAlaProProProSer35<210>22<211>39<212>PRT<213>人工序列<220><223>人工多肽<220><221>MOD_RES<222>(2)..(2)<223>Xaa是Aib<220><221>MOD_RES<222>(14)..(14)<223>Lys在氨基側鏈基團官能化為Lys((S)-4-羧基-4-((S)-4-羧基-4-十六酰基氨基-丁酰基氨基)-丁酰基)<220><221>MOD_RES<222>(29)..(29)<223>Xaa是D-Ala<220><221>MOD_RES<222>(39)..(39)<223>酰胺化的C-末端<400>22HisXaaGlnGlyThrPheThrSerAspLeuSerLysGlnLysAspGlu151015GlnArgAlaLysLeuPheIleGluTrpLeuLysAlaXaaGlyProSer202530SerGlyAlaProProProSer35<210>23<211>39<212>PRT<213>人工序列<220><223>人工多肽<220><221>MOD_RES<222>(2)..(2)<223>Xaa是Aib<220><221>MOD_RES<222>(27)..(27)<223>Xaa是Aib<220><221>MOD_RES<222>(39)..(39)<223>酰胺化的C-末端<400>23HisXaaGlnGlyThrPheThrSerAspLeuSerLysGlnLysAspGlu151015GlnArgAlaLysLeuPheIleGluTrpLeuXaaAlaGlyGlyProSer202530SerGlyAlaProProProSer35<210>24<211>39<212>PRT<213>人工序列<220><223>人工多肽<220><221>MOD_RES<222>(2)..(2)<223>Xaa是Aib<220><221>MOD_RES<222>(27)..(27)<223>Xaa是Aib<220><221>MOD_RES<222>(39)..(39)<223>酰胺化的C-末端<400>24HisXaaGlnGlyThrPheThrSerAspLeuSerLysGlnLeuAspGlu151015GlnArgAlaLysLeuPheIleGluTrpLeuXaaAlaGlyGlyProSer202530SerGlyAlaProProProSer35<210>25<211>39<212>PRT<213>人工序列<220><223>人工多肽<220><221>MOD_RES<222>(2)..(2)<223>Xaa是Aib<220><221>MOD_RES<222>(39)..(39)<223>酰胺化的C-末端<400>25HisXaaGlnGlyThrPheThrSerAspLeuSerLysGlnLeuAspGlu151015GlnArgAlaLysLeuPheIleGluTrpLeuLysAlaGlyGlyProSer202530SerGlyAlaProProProSer35當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1