三功能抗原結合分子的制作方法
雙特異性即雙功能(bifunctional)抗體可用于結合(engage)兩種不同的治療靶標或執行兩種不同的功能。這樣的抗體可用于例如向特定靶細胞募集免疫效應細胞例如T細胞或NK細胞。各種基于抗體片段的分子是已知的并且處于研究之中,例如用于癌癥治療。
可僅使用抗體可變結構域構建雙功能二聚抗體。例如可將VH和VL結構域之間的接頭序列縮短到它們不能折疊(fold over)并且以分子內方式彼此結合的程度。這樣的短接頭,例如2-12個殘基,阻止了scFv分子的上述折疊并且有利于形成二聚“雙價抗體(diabody)”的不同多肽鏈的互補可變結構域之間的分子間VH-VL配對(Holliger et al.,1993,Proc.Natl.Acad.Sci.(美國科學學院學報)USA 90,6444-6448)。這樣的雙價抗體可用于雙功能抗體,其可通過兩個單鏈多肽融合產物的非共價締合(non-covalent association)獲得,每個單鏈多肽融合產物由通過短接頭與一個抗體的VL結構域連接的另一抗體的VH結構域組成。
WO 03/025018公開了雙特異性多聚抗原結合分子,其結構由具有至少四個結合結構域的相同單鏈多肽形成。每條多肽鏈末端部的VH結構域和VL結構域由短接頭連接并且與另一條多肽鏈的相應的VH結構域和VL結構域分子間締合,同時,每條多肽鏈的另一VH結構域和VL結構域在同一條鏈內彼此分子內結合,得到抗原結合ScFv單元。這樣的構建體是同源二聚體,即,它們由彼此締合的相同單鏈多肽組成。
本文提供多功能抗原結合分子,其至少是三功能的。在一些實施方案中,三功能抗原結合分子至少是三特異性的,即,對至少三種不同的抗原表位具有特異性。
本發明的抗原結合分子是僅包含可變(Fv)抗體結構域而不含恒定抗體結構域的Fv-衍生物。所述抗原結合分子的可變(Fv)抗體結構域通過肽接頭或肽鍵彼此連接。本發明的抗原結合分子可以為單個多肽鏈的單體或者為多鏈多肽的多聚體。例如,多聚抗原結合分子可以為例如具有兩條多肽鏈的二聚體、具有三條多肽鏈的三聚體或具有四條多肽鏈的四聚體。
在一些實施方案中,三特異性抗原結合分子至少是四價的。“四價的”意指抗原結合分子包含四個抗原結合位點,其中每個抗原結合位點包含VH/VL對,該VH/VL對具有彼此締合的相同抗原表位特異性的可變重鏈(VH)結構域和可變輕鏈(VL)結構域。因此,這樣的四價抗原結合分子包含至少8個可變抗體結構域,即,四個可變重鏈(VH)結構域和四個可變輕鏈(VL)結構域。三特異性的四價抗原結合分子包含對第一抗原表位有特異性的抗原結合位點、對第二抗原表位有特異性的抗原結合位點以及對第三抗原表位有特異性的兩個抗原結合位點。因此,該三特異性的四價抗原結合分子對三種不同的抗原表位具有不同的特異性。例如,這樣的抗原結合分子包含對第一抗原表位有特異性的第一抗原結合位點、對第二抗原表位有特異性的第二抗原結合位點、對第三抗原表位有特異性的第三抗原結合位點和第四抗原結合位點。在一些實施方案中,當三特異性的四價抗原結合分子是多聚體時,該抗原結合分子是異源二聚體,即,包含至少兩條不同的多肽鏈,其中這兩條多肽鏈在至少一個可變結構域上不同,例如一條多肽鏈僅包含VH結構域,另一條僅包含具有相同抗原表位特異性的對應VL結構域。
因為四價抗原結合分子包含8個抗體可變結構域,所以它的分子量高于100kDa,這導致與三價的三特異性單鏈Fv分子相比,這種分子的半衰期更長。
此外,每個三特異性的四價抗原結合分子包含對同一抗原表位有特異性的兩個抗原結合位點。因此,提高了抗體親抗原性,即,抗原表位和抗原結合位點之間相互作用的強度。較高的抗體親抗原性的優勢在于增強相互作用的穩定性和在靶標上的滯留(retention)。例如,如果靶標是細胞毒性免疫效應細胞例如T細胞或NK細胞,則較高的抗體親抗原性可導致抗原結合分子溶細胞潛能(cytolytic potential)的增加。在另一實例中,如果靶標是腫瘤細胞,則較高的抗體親抗原性提高在靶標上的滯留時間并降低脫離靶標的速率(off-rates from the target)。在本發明的某一實施方案中,三特異性的四價抗原結合分子包含對同一種腫瘤細胞的兩種不同抗原表位有特異性的第一抗原結合位點和第二抗原結合位點,以及對免疫效應細胞例如T細胞或NK細胞上的抗原表位有特異性的第三抗原結合位點和第四抗原結合位點。這種抗原結合分子導致對特定種類的腫瘤細胞的特異性以及抗體親抗原性的增加,并導致對活化免疫效應細胞上的受體的抗體親抗原性增加,這使得抗原結合分子的特異性溶細胞潛能有利地增加。與兩種不同腫瘤抗原表位的結合導致靶向特異性的增加,并通過降低脫靶(off-target)毒性延長治療窗口。重要的是,盡管結構復雜,本發明的這種三特異性四價抗原結合分子依然穩定。
因此,可以不同方式利用本發明的抗原結合分子來重新定向(redirecting)免疫效應細胞的細胞毒性潛能,以破壞腫瘤細胞或致病原。在一些實施方案中,三特異性抗原結合分子可結合靶標上兩種不同的抗原表位。例如,兩種不同的表位可以位于同一抗原上,以防止突變體逃逸(escape mutants)或增強療效,或者,兩種表位可位于靶標的兩種不同的抗原上。在其他實施方案中,三特異性抗原結合分子可結合免疫效應細胞上兩種不同的抗原表位。例如,第一抗原結合位點對活化受體例如CD16A或CD3有特異性,第二抗原結合位點對共刺激受體例如CD137或CD28有特異性。在另一個實例中,第一抗原結合位點對CD16A有特異性,第二抗原結合位點對NK細胞上的另一活化受體例如NKG2D、DNAM、NCR)有特異性。
在另一實施方案中,三特異性抗原結合分子具有對腫瘤細胞上的抗原表位有特異性的第一抗原結合位點、對免疫效應細胞上的抗原表位有特異性的第二抗原結合位點以及對可溶性蛋白上的抗原表位有特異性的第三抗原結合位點,所述可溶性蛋白選自生長因子、細胞因子、趨化因子、有絲分裂原(mitogens)和白蛋白。這種可溶性蛋白的實例為IL-6、BAFF、APRIL、TGF-β、IL-10、VEGF-A、HB-EGF、血管形成素-2(angiopoetin-2)和人血清白蛋白(HSA)。
在可替代的實施方案中,抗原結合分子具有對一種類型的細胞上存在抗原的抗原表位有特異性的一個抗原結合位點和對一種或多種其他類型的細胞上的抗原表位有特異性的三個抗原結合位點。
“效應細胞”是可刺激或引發細胞毒性、吞噬作用、抗原呈遞、細胞因子釋放的免疫系統細胞。這種效應細胞例如但并不限于T細胞、自然殺傷(NK)細胞、粒細胞、單核細胞、巨噬細胞、樹突細胞和抗原呈遞細胞。對效應細胞有合適特異性的實例包括但不限于:對于T細胞,為CD2、CD3和CD3亞基例如CD3ε、CD5、CD28和T細胞受體(TCR)的其他組成部分;對于NK細胞,為CD16、CD16A、CD25、CD38、CD44、CD56、CD69、CD94、CD335(NKP46)、CD336(NKp44)、CD337(NKp30)、NKp80、NKG2C和NKG2D、DNAM和NCR;對于粒細胞,為CD18、CD64和CD89;對于單核細胞和巨噬細胞,為CD18、CD32、CD64、CD89和甘露糖受體;對于樹突細胞,為CD64和甘露糖受體;以及CD35。在本發明的某些實施方案中,效應細胞的這些特異性,即細胞表面分子,適于在三特異性抗原結合分子與這種細胞表面分子結合后介導細胞殺傷,從而誘導細胞溶解或細胞凋亡。
CD3抗原與T細胞上的T細胞受體復合物相關。在CD3對效應細胞有特異性(where specificity for an effector cell is CD3)的情況下,本發明的抗原結合分子與CD3的結合觸發T細胞的細胞毒性活性。通過抗原結合分子與CD3的結合以及抗原結合分子與靶細胞例如腫瘤細胞的結合,可誘導靶細胞的細胞溶解。
CD16A(FcγIIIA)抗原是在NK細胞表面上表達的受體。NK細胞具有固有的溶細胞(cytoloytic)活性,通過本發明的抗原結合分子與CD16或CD16A的結合可觸發NK細胞對靶標的細胞毒性活性。
“靶標”是抗原表位所在的位點,且是抗原結合分子應結合的位點。靶標的實例是細胞、諸如病毒病原體或細菌病原體的致病原,例如登革熱病毒;單純皰疹病毒;流感病毒;HIV;HCV或攜帶諸如IL-2/IL2R的自體免疫靶標、自體免疫標記物或自體免疫抗原的細胞或腫瘤細胞。在實施方案中,其中至少一個抗原結合位點對效應細胞有特異性,靶標可以是腫瘤細胞,效應細胞被重新定向至該腫瘤細胞以誘導或觸發各生物反應,例如免疫反應。
對腫瘤細胞的合適的特異性可以是各腫瘤細胞上的腫瘤抗原和細胞表面抗原,例如特定的腫瘤標記物。本文使用的術語“腫瘤抗原”包括腫瘤相關抗原(TAA)和腫瘤特異性抗原(TSA)。本文使用的“腫瘤相關抗原(TAA)”是指存在于腫瘤細胞上和在胎兒期期間(曾經-胎兒抗原(once-fetal antigens))和出生后在選定器官中以比在腫瘤細胞上低得多的濃度存在于正常細胞上的蛋白。TAA還可存在于腫瘤細胞附近的基質中,但是在身體其他地方的基質中以更低的量表達。相反,術語“腫瘤特異性抗原(TSA)”是指由腫瘤細胞表達的蛋白。術語“細胞表面抗原”是指能夠被細胞表面上的抗體識別的任何抗原或其片段分子。
對腫瘤細胞有特異性(specificities)的實例包括但不限于CD19、CD20、CD26、CD29、CD30、CD33、CD52、CD200、CD267、EGFR、EGFR2、EGFR3、EGFRvIII、HER2、HER3、IGFR、IGF-1R、Ep-CAM、PLAP、Thomsen-Friedenreich(TF)抗原、TNFRSF17、gpA33、MUC-1(粘蛋白)、IGFR、CD5、IL4-Rα、IL13-R、FcεRI、MHCI/肽復合物和IgE。
本發明的抗原結合分子,其中對CD19抗原的腫瘤特異性可用于B-細胞惡性腫瘤的免疫療法,因為CD19抗原幾乎在從淋巴細胞性白血病(ALL)到非霍奇金淋巴瘤(NHL)的所有B系惡性腫瘤上表達。
本發明的抗原結合分子,其中對CD30的腫瘤特異性尤其可用于治療霍奇金病和T細胞淋巴瘤。
為了提高本發明的抗原結合分子在體內的血清半衰期,需要時可將抗原結合分子與諸如HSA的白蛋白融合,或者將其聚乙二醇化、唾液酸化或糖基化(例如參見Stork et al.,2008,J.Biol.Chem.(生物化學雜志),283:7804-7812)。
在一些實施方案中,三特異性抗原結合分子包含至少一個抗原結合位點,其中所述抗原結合位點的VH/VL對的VH結構域和VL結構域彼此非共價結合,即,該VH/VL對的VH結構域和VL結構域不通過肽接頭或肽鍵連接。在某些實施方案中,這些非共價結合的VH結構域和VL結構域位于多聚抗原結合分子的不同多肽鏈即第一多肽鏈和第二多肽鏈上。在其他實施方案中,這些非共價結合的VH結構域和VL結構域位于單體抗原結合分子的同一條多肽鏈上,其中至少一個另外的可變結構域被布置在單體的這些非共價結合的VH結構域和VL結構域之間。在一些實施方案中,該抗原結合位點的這些非共價結合的VH結構域和VL結構域中的每一個都通過肽接頭或肽鍵與并列于抗原結合位點的第二VH/VL對的VH或VL結構域結合。優選地,與并列于抗原結合位點的VH/VL對的VH結構域或VL結構域連接的肽接頭是短的,以防止并列結構域之間的分子內折疊并迫使兩個非共價結合的VH結構域和VL結構域彼此締合。例如,肽接頭包含12個以下的氨基酸殘基,優選3-9個氨基酸殘基。通過非共價結合的VH結構域和VL結構域如此形成至少一個抗原結合位點有利于抗原結合分子的穩定性,因為這導致更緊湊的抗原結合分子。
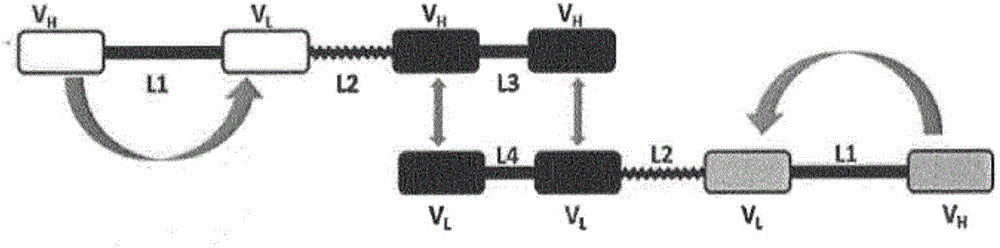
例如,圖1和圖2示出了三特異性抗原結合分子,其中中央的VH/VL對(用黑色示出)的VH結構域和VL結構域彼此非共價結合。在該實例中,非共價結合的VH結構域和VL結構域位于不同的多肽鏈上。該抗原的這些非共價結合的VH結構域和VL結構域中的每一個都通過肽接頭L3或L4與并列于抗原結合位點的第二VH/VL對的VH結構域或VL結構域結合。
在其他實施方案中,三特異性抗原結合分子包含至少一個第一抗原結合位點,其中該第一抗原結合位點的VH/VL對的VH結構域和VL結構域彼此非共價結合,即,該VH/VL對的VH結構域和VL結構域不通過肽接頭或肽鍵連接,并且該第一抗原結合位點的非共價結合的VH結構域通過肽接頭與并列于第一抗原結合位點的第二抗原結合位點的VH/VL對的VH結構域結合,且該第一抗原結合位點的非共價結合的VL結構域通過肽接頭與并列于第一抗原結合位點的第二抗原結合位點的VH/VL對的VL結構域結合。在抗原結合分子為單鏈多肽即單體多肽的實施方案中,VH結構域和VL結構域被布置在同一條多肽鏈上。在抗原結合分子為多聚多肽即多鏈多肽的實施方案中,通過肽接頭或肽鍵與第二抗原結合位點的VH結構域結合的第一抗原結合位點的VH結構域位于第一多肽上,且通過肽接頭或肽鍵與第二抗原結合位點的VL結構域結合的第一抗原結合位點的VL結構域位于第二多肽上。優選地,肽接頭是短的,例如少于12個氨基酸殘基,優選3-9個氨基酸殘基,以分別防止并列的VH-VH結構域和并列的VL-VL結構域之間的分子內折疊,并迫使VH-VH結構域與VL-VL結構域締合以形成第一抗原結合位點和第二抗原結合位點。該VH-VH結構域和VL-VL結構域布置有利于三特異性抗原結合分子的正確折疊。
“抗原結合分子”是指具有多價抗原結合特性,優選具有至少四個抗原結合位點的免疫球蛋白衍生物分子。抗原結合分子可以是單鏈多肽即單體多肽或多鏈多肽即多聚多肽。抗原結合分子的每條多肽包含通過肽接頭或肽鍵彼此連接的抗體可變(Fv)結構域。每個抗原結合位點由與同一抗原表位結合的抗體(即免疫球蛋白)可變重鏈結構域(VH)和抗體可變輕鏈結構域(VL)形成。抗原表位可位于相同或不同的抗原上。優選地,本發明的抗原結合分子沒有免疫球蛋白恒定結構域或其片段。
術語“多肽”是指通過酰胺鍵連接的氨基酸殘基的聚合物。多肽優選為沒有支鏈的單鏈融合蛋白。在多肽內,抗體可變(Fv)結構域順次連接。除了N末端和/或C末端,多肽可具有連續的氨基酸殘基。例如,多肽可包含Tag序列,優選在C末端處,該Tag序列可用于多肽純化。Tag序列的實例為His-Tag如由六個His殘基組成的His-Tag、FLAG如DYKDDDDK八肽(SEQ ID NO:5)或II如WSHPQFEK八肽(SEQ ID NO:6)。對于多聚抗原結合分子,優選地,不同的Tag序列用于不同的多肽。
對于肽接頭的氨基酸組成,選擇不干擾結構域的締合以及不干擾多聚分子的多聚化例如二聚化的肽。例如,含有甘氨酸殘基和絲氨酸殘基的接頭通常提供蛋白酶抗性。可通過例如噬菌體展示法優化接頭的氨基酸序列以改善抗原結合分子的抗原結合和產率。在一個實施方案中,使用了(G2S)x肽接頭。
在本發明的一些實施方案中,至少一個、優選全部的抗體可變結構域是全人結構域、人源化結構域或嵌合結構域。通過廣為接受的方法例如CDR移植(例如參見Antibody engineering:methods and protocols(抗體工程:方法和方案)/由Benny K.C.Lo編輯;Benny K.C.II Series:Methods in molecular biology(Totowa,N.J.))產生人源化抗體。因此,本領域技術人員能夠容易地用本領域已知的降低免疫原性和改善抗原結合分子在人免疫系統中的效率的標準分子生物學技術,由非人來源例如鼠或非靈長類來源制備人源化或全人版的抗原結合分子以及可變結構域。在本發明的優選實施方案中,所有的抗體可變結構域是人源化的或全人的;更優選地,本發明的抗原結合分子是人源化的或全人的。本文使用的術語“全人”意指可變結構域的氨基酸序列以及多肽中連接可變結構域的肽的氨基酸序列源自人類或可在人類中找到。在本發明的某些實施方案中,可變結構域可以是人的或人源化的,但連接抗體可變結構域的肽可以不是人的或人源化的。
在一些實施方案中,本發明提供多功能抗原結合多肽多聚體。
在一些實施方案中,本發明提供被設計成靶向三種不同抗原或表位的三功能抗原結合多肽多聚體的抗原結合分子。這種多聚體包含第一多肽和第二多肽。這兩條多肽中的每一條均為具有從每條多肽的N末端到C末端順次連接的至少四個抗體可變結構域的單鏈融合肽。每條多肽包含通過短接頭連接以防止同一條多肽內分子內配對的兩個抗體可變結構域和單鏈Fv單元,單鏈Fv單元具有另外兩個可變結構域的抗體可變結構域對,其通過同一條多肽內的該可變結構域對能夠分子內形成抗原結合位點。通過兩條多肽之間的非共價締合形成多聚體,然而一條多肽的通過短接頭連接的兩個抗體可變結構域與另一條多肽的兩個相應的抗體可變結構域締合,從而形成兩個另外的抗原結合位點。因此,該多聚體包含至少四個抗原結合位點,并且至少是四價的。在本發明的具體方面,多聚體是二聚體,即由兩條多肽鏈組成。
為了生成這種三特異性四價抗原結合二聚體,兩條多肽應具有不同的抗體可變結構域組成,因為對于三種特異性中的至少一種特異性來說,各個抗體可變輕鏈結構域和可變重鏈結構域應被插入至不同的多肽中,以使得一條多肽僅含有該特異性的可變重鏈結構域,另一條多肽鏈僅含有該特異性的可變輕鏈結構域。因此,本發明的這種二聚體是異源二聚體,因為其由兩條不同的多肽組成。
可采取特定措施以使含有三種不同特異性的抗體可變結構域的兩條不同多肽能夠正確締合并防止兩條相同多肽之間錯誤的同源二聚化。例如,本發明人已經通過在一條多肽中插入由短接頭連接的兩個抗體可變重鏈結構域并在另一條多肽中插入由短接頭連接的兩個相應的抗體可變輕鏈結構域獲得了兩條不同的三特異性多肽的正確異源二聚化。令人驚訝的是,只形成異源二聚體形式(species)的三特異性抗原結合多肽二聚體。
因此,在一個實施方案中,本發明提供:三特異性抗原結合分子,其中所述分子是包含第一多肽和第二多肽的三特異性抗原結合多肽二聚體,每條多肽均具有順次連接的至少四個抗體可變結構域,
(a)所述第一多肽包含通過防止在同一條多肽內分子內配對的第一接頭如具有約12個或更少氨基酸殘基的接頭彼此連接的第一抗體可變重鏈結構域(VH)和第二抗體可變重鏈結構域(VH)以及單鏈Fv抗原結合單元,所述單鏈Fv抗原結合單元具有通過第二肽接頭與抗體可變輕鏈結構域(VL)連接的第三抗體可變重鏈結構域(VH),所述第三抗體可變重鏈結構域(VH)和所述抗體可變輕鏈結構域(VL)能夠締合成第一抗原結合位點,其中所述第二抗體可變重鏈結構域(VH)通過第三肽接頭與所述單鏈Fv抗原結合單元連接;
(b)所述第二多肽包含通過防止在同一條多肽內分子內配對的第二肽接頭如具有約12個或更少氨基酸殘基的接頭彼此連接的第一抗體可變輕鏈結構域(VL)和第二抗體可變輕鏈結構域(VL)以及單鏈Fv抗原結合單元,所述單鏈Fv抗原結合單元具有通過第二肽接頭與抗體可變重鏈結構域(VH)連接的第三抗體可變輕鏈結構域(VL),所述第三抗體可變輕鏈結構域(VL)和所述抗體可變重鏈結構域(VH)能夠締合成第二抗原結合位點,其中所述第二抗體可變輕鏈結構域(VL)通過第三肽接頭與所述單鏈Fv抗原結合單元連接;并且
(c)所述第一多肽的第一抗體可變重鏈結構域(VH)和第二抗體可變重鏈結構域(VH)與第二多聚體的第一抗體可變輕鏈結構域(VL)和第二抗體可變輕鏈結構域(VL)締合成兩個另外的抗原結合位點,即第三抗原結合位點和第四抗原結合位點,然而在優選的實施方案中,所述第一多肽的第一抗體可變重鏈結構域(VH)與所述第二多肽的第二抗體可變輕鏈區(VL)締合成第三抗原結合位點;所述第一多肽的第二抗體可變重鏈結構域(VH)與所述第二多肽的第一抗體可變輕鏈結構域(VL)締合成第四抗原結合位點。
當所述四個抗原結合位點中的兩個對同一抗原有特異性時,形成了三特異性抗原結合多肽二聚體。
這種三特異性二聚體識別三種不同的特異性,例如能夠靶向靶細胞上兩種不同的抗原或表位且具有第三種功能,即特異性結合免疫效應細胞例如T細胞或NK細胞。
可以不同的方式使用本發明的三特異性二聚體。
例如,可將抗體可變結構域布置在多肽內,使得能夠將與另一條多肽的兩個相應的抗體可變結構域締合的兩個抗體可變結構域置于例如該多肽的N末端或C末端。這兩個抗體可變結構域可具有相同的特異性或具有不同的特異性。例如,兩個抗體可變結構域可對相同的免疫效應細胞有特異性,或者對腫瘤細胞上的兩種抗原有不同的特異性。
此外,形成單鏈Fv單元的兩個抗體可變結構域在多肽N末端至C末端的方向上的順序可以為VH-VL或VL-VH。兩條二聚化多肽的單鏈Fv單元可以具有相同或不同的特異性。例如,如果與另一條多肽的兩個相應抗體可變結構域締合的兩個抗體可變結構域具有相同的特異性,則兩條多肽的單鏈Fv單元具有不同的特異性以獲得三特異性二聚體。
因此,例如,可將至少四個抗體可變結構域布置為使得與另一條多肽的兩個相應抗體可變結構域締合的兩個抗體可變結構域對免疫效應細胞有特異性,而兩條多肽的單鏈Fv單元對兩種不同的腫瘤抗原有特異性,或者,與另一條多肽的兩個相應抗體可變結構域締合的兩個抗體可變結構域對不同的腫瘤抗原有特異性,而兩條多肽的兩個單鏈Fv單元對免疫效應細胞的具有相同的特異性。
抗原結合多肽是“二聚體”,術語“二聚體”是指第一多肽單體和第二多肽單體的復合體。在一個方面,抗原結合多肽二聚體是“異源二聚體”,術語“異源二聚體”意指抗原結合多肽由兩條不同的多肽單體組成,所述兩條不同的多肽單體由兩條不同的多核苷酸編碼。
優選地,在抗原結合二聚體中,第一多肽和第二多肽彼此非共價締合,特別地,條件是第一多肽和第二多肽之間沒有共價結合(bound)。然而,如果需要,可通過至少一種共價連接,例如通過不同多肽的半胱氨酸殘基之間的二硫橋來額外地穩定兩條多肽。
接頭的長度影響抗原結合多肽二聚體的柔性(flexibility)。所期望的抗原結合多肽二聚體的柔性依賴于靶抗原密度和靶抗原即表位的可及性。較長的接頭提供具有更多靈活的抗原結合位點且更具柔性的抗原結合多肽二聚體。接頭長度對形成二聚抗原結合多肽的影響描述于例如Todorovska et al.,2001Journal of Immunological Methods(免疫方法雜志)248:47-66;Perisic et al.,1994Structure(結構)2:1217-1226;Le Gall et al.,2004,Protein Engineering(蛋白工程)17:357-366和WO 94/13804。
根據本發明,優選的是,第一多肽中第一抗體可變重鏈結構域和第二抗體可變重鏈結構域的第一肽接頭以及第二多肽中第一抗體可變輕鏈結構域和第二抗體可變輕鏈結構域的肽接頭的長度使得第一多肽的結構域能夠與第二多肽的結構域分子間締合,以形成二聚的抗原結合多肽。這種接頭較“短”,即,由0、1、2、3、4、5、6、7、8、9、10、11或約12個氨基酸殘基組成。在0個氨基酸殘基的情況下,接頭是肽鍵。這樣的短接頭有利于通過在不同多肽的抗體可變輕鏈結構域和抗體可變重鏈結構域之間的結合并形成抗原結合位點來進行第一多肽與第二多肽的正確二聚化。將接頭縮短至約12個或更少氨基酸殘基通常防止同一條多肽鏈的鄰近結構域彼此相互作用。在本發明的實施方案中,這些接頭由約3至約10個例如7個連續的氨基酸殘基組成。此外,可變抗體結構域之間具有多于12個氨基酸殘基的的接頭的兩條多肽彼此正確地二聚化,這在原則上是可能的(例如,參見Le Gall et al.,2004,Protein Engineering(蛋白工程)17:357-366)。
對于多肽的單鏈Fv單元,第二肽接頭是長且有柔性的(通常由約12個或更多氨基酸殘基組成)以分子內頭尾折疊并形成單鏈抗原結合(scFv)單元。另外的氨基酸殘基提供額外的柔性。例如,多肽中單鏈Fv單元的VH和VL之間或VL和VH之間的接頭可由約12至約35個連續的氨基酸殘基組成,尤其是由15-25個連續的氨基酸殘基組成。
用于連接單鏈Fv單元與另外兩個抗體可變結構域(其與另一條多肽的相應可變結構域締合)的多肽的第三肽接頭可以為例如5-30個連續的氨基酸殘基,優選為至少6、7、8、9、10、11或12個連續的氨基酸殘基。
在本發明的實施方案中,三特異性抗原結合多肽二聚體對腫瘤細胞上的兩種不同抗原有雙特異性,并且另外對效應細胞尤其是T細胞或NK細胞有特異性。對腫瘤細胞的合適特異性可以是各腫瘤細胞上的腫瘤抗原和細胞表面抗原,例如特定的腫瘤標記物。這種三特異性抗原結合二聚體雙功能地結合腫瘤細胞和免疫效應細胞,從而觸發由T細胞或NK細胞誘導的細胞毒性反應。
可通過表達編碼形成抗原結合分子的單個多肽鏈的多核苷酸來產生本文之前描述的任一實施方案的抗原結合分子。因此,本發明的另一個實施方案是編碼如上所述的抗原結合分子的多肽鏈的多核苷酸例如DNA或RNA。
多核苷酸可通過本領域技術人員已知的方法構建,例如通過將編碼多肽中被肽接頭隔開或由肽鍵直接連接的抗體可變結構域的基因組合至可操作連接至合適的啟動子以及可選的合適轉錄終止子的基因構建體中,并在細菌或其他合適的表達系統例如CHO細胞中表達該基因構建體。取決于所用的載體系統和宿主,可使用任意數目的合適的轉錄元件和翻譯元件,包括組成型啟動子和誘導型啟動子。選擇啟動子以使得它在各宿主細胞中驅動多核苷酸的表達。
可將多核苷酸插入至載體、優選表達載體中,這代表本發明的另一個實施方案。可根據本領域技術人員熟知的方法構建這些重組載體。
多種表達載體/宿主系統可用于包含并表達編碼本發明的多肽鏈的多核苷酸。用于在大腸桿菌(E.coli)中進行表達的表達載體的實例為pSKK(LeGall et al.,J Immunol Methods.(免疫方法雜志)(2004)285(1):111-27),或用于在哺乳動物細胞中進行表達的表達載體的實例為pcDNA5(Invitrogen)。
因此,可通過將編碼如上所述多肽鏈的載體引入至宿主細胞并在某條件下培養所述宿主細胞,從而表達多肽鏈,來產生本文所述的抗原結合分子,可分離并可選地進一步純化本文所述的抗原結合分子。
在本發明的另一個實施方案中,提供組合物,其包含如上所述的抗原結合分子或多核苷酸以及至少一種其他組分。
本發明還提供了一種方法,其中向個體例如患者施用有效劑量的如上所述的抗原結合分子,以治療癌癥(例如非霍奇金淋巴瘤;慢性淋巴白血病)。抗原結合分子可用作藥物。
本領域技術人員能夠容易地利用已建立的技術和本領域已知的標準方法構建并獲得本文所述的抗原結合分子而無需過度的負擔,例如參見Sambrook,Molecular Cloning A Laboratory Manual(分子克隆實驗手冊),Cold Spring Harbor Laboratory(1989)N.Y.;The Protein Protocols Handbook(蛋白方案手冊),由John M.Walker編輯,Humana Press Inc.(2002);或Antibody engineering:methods and protocols(抗體工程:方法和方案)/由Benny K.C.Lo編輯;Benny K.C.II Series:Methods in molecular biology(Totowa,N.J.))。
附圖說明
圖1示出了用于形成本發明的三功能即三特異性抗原結合多肽二聚體的第一多肽和第二多肽。第一多肽具有順次連接的四個抗體可變結構域VH、VL、VHVH。第一VH抗體可變結構域和第二VH抗體可變結構域(黑色)具有相同的第一特異性并由短接頭L3連接,以防止同一條多肽內的分子內配對,單鏈Fv單元具有通過第二接頭L1連接的另外的第三可變抗體結構域VL和第四可變抗體結構域VH(白色)的抗體可變結構域對,同一條多肽內的該可變結構域對能夠分子內形成第二特異性的抗原結合位點。由第三接頭L2連接特異性不同的第二抗體可變結構域VH和第三抗體可變結構域VL。
第二多肽具有順次連接的四個抗體可變結構域VL、VL、VL、VH。第一VL抗體可變結構域和第二VL抗體可變結構域(黑色)具有相同的第一特異性并由短接頭L4連接,以防止同一條多肽內的分子內配對,單鏈Fv單元具有由第二接頭L1連接的具有第三特異性的另外的第三可變抗體結構域VL和第四可變抗體結構域VH(灰色)的抗體可變結構域對,同一條多肽內的該可變結構域對能夠分子內形成抗原結合位點。由第三接頭L2連接特異性不同的第二抗體可變結構域VL和第三抗體可變結構域VL。
圖2示出了通過圖1的兩條多肽的非共價締合形成的抗原結合多肽二聚體,其中第一多肽由短接頭連接的兩個抗體可變VH結構域與第二多肽的兩個相應的抗體可變VL結構域締合,從而形成具有相同特異性的兩個抗原結合位點(黑色),其中由第一多肽的單鏈Fv單元(白色)提供第二特異性,由第二多肽的單鏈Fv單元(灰色)提供第三特異性。
圖3示出了本發明的三功能抗原結合分子,尤其是三功能抗原結合多肽,其是用于雙靶向腫瘤細胞的三特異性抗體。抗體即抗原結合多肽被設計成靶向腫瘤細胞上兩種不同的靶標/表位且具有以高親和力結合效應細胞的第三功能。抗原結合多肽由四個抗原結合位點組成,其中兩個中央的抗原結合位點結合腫瘤細胞上兩種不同的抗原,兩個外圍(peripheral)抗原結合位點結合效應細胞。
具體實施方式
以下實施例進一步闡述本發明但并不限制本發明的范圍。
實施例1
DNA構建體:
通過DNA工程或通過基因合成和測序來生成編碼多肽鏈的質粒DNA。用于瞬時轉染或穩定轉染哺乳動物細胞的表達構建體基于真核細胞表達載體pCDNA5/FRT(Life Technologies),且包含處于病毒啟動子或普遍存在的啟動子控制之下的目的產物基因以及作為選擇標記物的潮霉素抗性盒。為了進行純化和分析,產物鏈與His-標簽、FLAG-標簽或StrepII-標簽一起表達。
細胞系和細胞培養:
將Flp-In CHO細胞(Life Technologies)即CHO-K1中國倉鼠卵巢細胞的衍生細胞(derivative)(ATCC,CCL-61)(Kao和Puck,1968)培養于補充有L-谷氨酰胺、10%FCS和100μg/ml博來霉素(Zeocin)的Ham's F-12Nutrient Mix中。貼壁細胞用0.25%胰蛋白酶-EDTA分離(detach)并根據標準細胞培養方案進行繼代培養。
為了適應在懸浮液中生長,從組織培養瓶分離細胞并置于無血清培養基中,用于隨后在37℃、5%CO2和120rpm下在搖瓶(Corning)中孵育。用于培養適應懸浮(suspension-adapted)的Flp-In CHO細胞的標準培養基是補充有L-谷氨酰胺(Life Technologies)、HT補充劑(Life Technologies)、青霉素(Penicillin)/鏈霉素(Life Technologies)和100μg/ml博來霉素(Life Technologies)的HyClone CDM4CHO(Thermo Scientific)。每2-3天以2E+6至3E+6個細胞/ml的接種密度繼代培養適應懸浮的細胞。使用臺盼藍排除法測定所有培養物中的細胞濃度和活力。將細胞冷凍保存于具有10%DMSO的培養基中,用MycoAlert支原體檢測試劑盒(Lonza)檢測為支原體陰性。
生成穩定轉染的細胞池(cell pools):
通過轉染適應懸浮的細胞生成穩定表達三特異性候選抗體的重組Flp-In CHO細胞系。為此,在使用聚乙烯亞胺(PEI)用編碼目的蛋白(pcDNA5/FRT)和Flp重組酶(pOG44,Life Technologies)的表達質粒(2.5μg)進行共轉染的前一天,將細胞置于不含博來霉素的標準培養基中。簡言之,將載體DNA和轉染試劑以1:3的DNA:PEI質量比混合在總共100μL的OptiMEM I培養基(Life Technologies)中,孵育10分鐘,然后加入懸浮在1ml CHO-S-SFMII培養基(Life Technologies)中的2E+6個Flp-In CHO細胞。孵育24小時后,通過加入500μg/mL潮霉素B,然后將培養物在CHO-S-SFMII培養基中稀釋至濃度為0.1E+6個活細胞/mL并接種于T75培養瓶中,來開始篩選穩定轉染的細胞。Flp重組酶介導通過位點特異性DNA重組將Flp-In表達構建體在整合(integrated)FRT位點處插入至基因組中(O’Gorman et al 1991)。在篩選期間,每周兩次測量活細胞密度,將細胞離心并以0.1E+6個活細胞/mL的最大密度重懸于新鮮的選擇培養基中。在約三周的篩選之后(此時將細胞轉移至搖瓶中的標準培養基)回收穩定表達重組蛋白產物的細胞池。使用Criterion Stain-Free(Bio-Rad)技術通過細胞培養物上清的蛋白凝膠電泳確認重組分泌蛋白的表達。將穩定的細胞池冷凍保存于含50%ProFreeze(Lonza)和7.5%DMSO的培養基中。
流加式培養(Fed-batch)CHO細胞懸浮培養物中重組蛋白的產生(production):
在穩定轉染的CHO細胞系的10-天流加式培養培養物中,通過分泌至細胞培養物上清液來產生重組蛋白。為此,將穩定表達目的產物的細胞池以6E+5個細胞/mL的初始密度接種于帶有透氣蓋的聚碳酸酯錐形瓶(Corning)中的標準培養基中,并在37℃、5%CO2和140rpm的攪拌下孵育。在流加培養期間,在第0天(起始日)用40mL/L ActiCHO Feed A(PAA)和4mL/L ActiCHO Feed B(PAA)補充培養基,在第3、5和7天用雙倍量補充。10天后(培養物活力通常大于75%)收集細胞培養物上清液。每隔一天在進料前從生產培養物中收集樣品,然后評估細胞密度和活力。在進一步使用之前,在收集當天通過離心和使用Millipore Express PLUS膜過濾器(Millipore)的真空過濾(0.22μm)使細胞培養物上清液澄清。
表達滴度(expression titer)的測定:
在第7天和第10天(0.22μm過濾之前和之后),使用Criterion Stain-Free凝膠成像系統(Bio-Rad)通過SDS-PAGE分析細胞培養物上清液(CCS)中的蛋白表達滴度和產物完整性。通過與已知濃度的參考蛋白進行比較來半定量地測定產物滴度。
三特異性抗原結合多肽的純化:
在包括Ni-NTA-色譜和制備型尺寸排阻色譜的兩步法中,從CHO細胞培養物上清液純化His標記的產物。首先,通過真空過濾(0.22μm)使上清液澄清并調整至5mM咪唑,然后以5mL/分鐘的流速加載到在IMAC緩沖液A中平衡的HisTrap FF色譜柱(GE Healthcare)上。隨后用5柱體積(CV)的IMAC緩沖液A和10柱體積的IMAC緩沖液A與IMAC緩沖液B的混合物(7%)洗滌柱。然后,通過用10柱體積的30%IMAC緩沖液B和5柱體積的100%IMAC緩沖液B以相同的流速順序洗滌來洗脫His標記的產物。收集2.5mL洗脫級分,通過對每個級分(fraction)進行一維SDS-PAGE然后使用Criterion Stain-Free技術(Bio-Rad)使蛋白可視化來評估蛋白含量和純度。將含產物的級分合并并且超濾濃縮。隨后,使用HiLoad 26/600Superdex200pg(GE Healthcare)柱通過凝膠過濾純化濃縮的樣品,并在2.5mL/分鐘下的SEC緩沖液(20mM Tris-HCl,100mM NaCl,pH 7.5)中洗脫。收集并合并通過比較洗脫體積與分子量標記蛋白(GE Healthcare)的柱滯留(column retention)測定的含有純化產物的級分。在使用PD-10脫鹽柱(GE Healthcare)進行最終的緩沖液交換(10mM乙酸鈉,pH 5.0)之后,通過如上所述的超濾將樣品濃縮至1.0-1.5mg/mL。最終樣品的純度和均一性(通常大于90%)分別通過在如上所述的還原SDS-PAGE和非還原SDS-PAGE之后的Criterion Stain-Free凝膠蛋白可視化,和在選定的情況下隨后用特異性抗體進行免疫印跡以及分析型SEC進行評估。將純化的蛋白分等份保存于-80℃下,直至進一步使用。
實施例2CD3×CD19×CD30三特異性分子
根據實施例1產生包含分別源自抗體OKT3、HD37和HRS3的CD3-抗體可變結合結構域、CD19-抗體可變結合結構域和CD30-抗體可變結合結構域的抗原結合多肽二聚體:
三特異性(Trispec)1:
VH(CD3)-(G2S)2-VH(CD3)–(G2S)3-VH(CD30)-(G2S)5-VL(CD30)-His6(SEQ ID NO:1)
VL(CD3)-(G2S)2-VL(CD3)-(G2S)3-VH(CD19)-(G2S)5VL(CD19)-FLAG(SEQ ID NO:2)
三特異性2:
VH(CD30)-(G2S)2-VH(CD19)-(G2S)2-VH(CD3)-(G2S)5-VL(CD3)-His6(SEQ ID NO:3)
VL(CD19)-(G2S)2-VL(CD30)-(G2S)2-VH(CD3)-(G2S)5-VL(CD3)-FLAG(SEQ ID NO:4)
接頭1=(G2S)2,接頭2=(G2S)5,接頭3=(G2S)3
三特異性1和三特異性2的免疫沉淀表明僅檢測到異源二聚體形式的抗原結合多肽二聚體。在40℃下7天后以及在pH 3.5下1小時后,三特異性1和三特異性2展現出了極佳的穩定性。
實施例:評估由三特異性抗體介導的細胞毒性活性
研究過程
從血沉棕黃層分離PBMC和富集T細胞:
通過密度梯度離心從血沉棕黃層分離PBMC。按照制造商的說明書使用用于免疫磁性分離未接觸的人T細胞的EasySepTM人T細胞富集試劑盒和Big Easy EasySepTMMagnet從PBMC群富集T細胞。
基于FACS的細胞毒性測定:
通過所描述的流式細胞術表征用作效應細胞的T細胞。
在如下所述的標準條件下培養靶細胞(MEC-1:DSMZ,目錄號(cat.):ACC 497;NALM-6:DSMZ,目錄號:ACC 128)。為了細胞毒性測定,收集靶細胞,用不含FCS的RPMI 1640培養基洗滌兩次,并重懸于PKH67綠色熒光細胞接頭迷你試劑盒(Green Fluorescent Cell Linker Mini Kit)中提供的稀釋液C中至密度為2×107/mL。然后將細胞懸浮液與等體積的二倍濃縮的PKH67-標記溶液(例如1μL PKH67在250μL稀釋液C中)混合并按照制造商的說明書孵育。終止染色反應。用完全RPMI培養基洗滌標記的靶細胞之后,對細胞計數并將細胞重懸于完全RPMI培養基中至密度為2×105/mL。
然后將2×104個靶細胞與T細胞和所示的抗體一起接種于各個孔中。測定在沒有抗體的情況下自發的細胞死亡和效應分子對靶標的殺傷。
孵育之后,將培養物用FACS緩沖液洗滌一次,然后重懸于150μL補充有2μg/mL PI的FACS緩沖液中。使用Beckman-Coulter FC500MPL流式細胞儀(Beckman-Coulter)或Millipore Guava EasyCyte流式細胞儀(Merck Millipore)測量由陽性綠色PKH67染色和陰性PI染色表征的活靶細胞的絕對量。
基于所測量到的剩余的活靶細胞,按照以下公式計算特異性細胞溶解(specific cell lysis)的百分比:[1-(活靶標的數目(樣品))/(活靶標的數目(自發))]×100%。使用GraphPad Prism軟件(GraphPad Prism Windows 6.00版,GraphPad Software,La Jolla California USA)通過非線性回歸/4-參數邏輯擬合(logistic fit)計算S形劑量反應曲線和EC50值。
統計分析
測定給定抗體濃度所獲得的溶解值(lysis value),并使用Prism軟件(GraphPad Prism Windows 6.00版,GraphPad Software,La Jolla California USA)通過S形劑量反應/4-參數邏輯擬合分析來進行分析,并使用該值計算EC50值、溶解百分比重復測定(replicate)的平均值和SD。
結果:
與各單陽性細胞系相比,三特異性1和三特異性2表現出了對雙陽性細胞系(CD19+和CD30+)更高的細胞毒性效力。
- 還沒有人留言評論。精彩留言會獲得點贊!