共聚物和包含其的有機太陽能電池的制作方法
本申請要求2014年3月27日向韓國知識產權局提交的韓國專利申請第10-2014-0035801號的優先權和權益,以引用的方式將其全文并入本文。
本發明涉及共聚物和包含其的有機太陽能電池。
背景技術:
有機太陽能電池為可通過應用光伏效應直接將太陽能轉化至電能的裝置。根據形成薄膜的材料,將太陽能電池分成無機太陽能電池和有機太陽能電池。典型的太陽能電池是使用通過摻雜無機半導體的晶體硅(Si)的p-n結而制造的。通過光吸收生成的電子和空穴傳播至p-n結點,被電場加速,并向電極移動。將此過程的能量轉換效率定義為提供至外部電路的能量與輸入太陽能電池內的太陽能的比,當在目前標準化理論太陽輻射條件下測量時,已實現高達24%的比率。然而,現有無機太陽能電池在經濟可利用性和材料供應上已有極限,因此,已高度青睞易于加工、廉價且具有多種功能的有機材料半導體太陽能電池作為長期替代能源。
對太陽能電池而言,重要的是提高效率以從太陽能輸出盡可能多的電能。為了提高該太陽能電池的效率,重要的是在半導體內部產生盡可能多的激子,然而,在無損失的情況下將所產生的電荷提取出來也重要。電荷損失的原因之一是所生成的電子和空穴通過復合而耗損。已提出用于在無損失的情況下傳送所生成的電子或空穴的多種方法,然而,大部分方法需要額外過程,且因此,制造成本可能增加。
現有技術文件
專利文件
美國專利第5331183號
美國專利第5454880號
技術實現要素:
技術問題
本發明的目的是提供共聚物和包含其的有機太陽能電池。
技術方案
本發明提供包括由下列化學式1表示的單元的共聚物。
[化學式1]
在化學式1中,
R1和R2彼此相同或不同,且各自獨立地為氫;鹵素基團;硝基;氰基;羧基;羥基;經取代或未經取代的羰基;羰基;經取代或未經取代的烷基;經取代或未經取代的烯丙基;經取代或未經取代的烷氧基;經取代或未經取代的環烷基;經取代或未經取代的烯基;經取代或未經取代的酯基;經取代或未經取代的酰胺基;經取代或未經取代的醚基;經取代或未經取代的磺酰基;經取代或未經取代的亞硫酰基;經取代或未經取代的芳基烷基;經取代或未經取代的芳基;或包括N、O、S和Se原子中的一種或更多種的經取代或未經取代的雜環基,
R3和R4彼此相同或不同,且各自獨立地為氫;或吸電子基團,以及
A為經取代或未經取代的單環或多環芳基;或包括N、O、S和Se原子中的一種或更多種的經取代或未經取代的單環或多環雜環基。
此外,本發明提供有機太陽能電池,其包括第一電極;設置成與第一電極相對的第二電極;和設置于第一電極與第二電極之間并包括光活性層的一個或更多個有機材料層,其中所述一個或更多個有機材料層包括上述共聚物。
有益效果
根據本發明的一個實施方案的共聚物包括連接位點經選擇的由化學式1表示的第一單元和由化學式2表示的第二單元,共聚物具有區域規則性:共聚物中兩單元的連接位點為經選擇的。根據本發明的一個實施方案的具有區域規則性的共聚物具有相對優異的結晶度。
根據本發明的一個實施方案的共聚物包括其中兩噻吩基團被稠合的結構,且因此,可引起裝置中高電子密度和/或共振結構的穩定。
根據本發明的一個實施方案的共聚物可用作有機太陽能電池的有機材料層中的材料,且包括該共聚物的有機太陽能電池可表現出開路電壓和短路電流增加和/或效率增加等方面優異性質。
根據本發明的一個實施方案的共聚物可單獨或作為與其它材料的混合物用于有機太陽能電池中,可預期由于例如化合物的熱穩定性等性質導致的效率提高、裝置使用壽命延長。
附圖說明
圖1為示出根據本發明的一個實施方案的有機太陽能電池的圖。
圖2為示出化學式1-b的NMR譜的圖。
圖3為示出化學式1-c的NMR譜的圖。
圖4為示出化學式1-e的NMR譜的圖。
圖5為示出化學式1-f的NMR譜的圖。
圖6為示出化學式1-g的NMR譜的圖。
圖7為示出化學式1-h的NMR譜的圖。
圖8為示出化學式1-i的NMR譜的圖。
圖9為示出化學式1-j的NMR譜的圖。
圖10為示出化學式2-b的NMR譜的圖。
圖11為示出化學式2-b的MS譜的圖。
圖12為示出化學式3-a的NMR譜的圖。
圖13為示出化學式3-b的NMR譜的圖。
圖14為示出化學式5-e的NMR譜的圖。
圖15為示出化學式6-b的NMR譜的圖。
圖16為示出化學式7-a的NMR譜的圖。
圖17為示出化學式8-b的NMR譜的圖。
圖18為示出化學式8-b的MS譜的圖。
圖19為示出化學式9-b的NMR譜的圖。
圖20為示出化學式10-a的NMR譜的圖。
圖21為示出化學式11-a的MS譜的圖。
圖22為示出化學式11-a的NMR譜的圖。
圖23為示出化學式12-a的NMR譜的圖。
圖24為示出化學式13-b的NMR譜的圖。
圖25為示出根據實驗例1的有機太陽能電池的電流密度對電壓的圖。
圖26為示出根據實驗例2的有機太陽能電池的電流密度對電壓的圖。
圖27為示出根據實驗例3的有機太陽能電池的電流密度對電壓的圖。
圖28為示出根據實驗例4的有機太陽能電池的電流密度對電壓的圖。
圖29為示出根據實驗例5的有機太陽能電池的電流密度對電壓的圖。
圖30為示出根據實驗例6的有機太陽能電池的電流密度對電壓的圖。
圖31為示出根據實驗例7的有機太陽能電池的電流密度對電壓的圖。
圖32為示出根據實驗例8的有機太陽能電池的電流密度對電壓的圖。
圖33為示出根據實驗例9的有機太陽能電池的電流密度對電壓的圖。
圖34為示出根據實驗例10的有機太陽能電池的電流密度對電壓的圖。
圖35為示出根據實驗例11至14的有機太陽能電池的電流密度對電壓的圖。
圖36為示出溶液狀態的化學式1-1-14的UV-Vis吸收光譜的圖。
圖37為示出膜狀態的化學式1-1-14的UV-Vis吸收光譜的圖。
圖38示出化學式1-1-14的電化學(循環伏安法)測量結果。
圖39為示出化學式1-1-14的熱重分析(TGA)結果的圖。
圖40為示出溶液狀態的化學式1-1-15的UV-Vis吸收光譜的圖。
圖41為示出膜狀態的化學式1-1-15的UV-Vis吸收光譜的圖。
圖42示出化學式1-1-15的電化學(循環伏安法)測量結果。
圖43為示出化學式1-1-15的熱重分析(TGA)結果的圖。
圖44為示出溶液狀態的化學式1-1-16的UV-Vis吸收光譜的圖。
圖45為示出膜狀態的化學式1-1-16的UV-Vis吸收光譜的圖。
圖46示出化學式1-1-16的電化學(循環伏安法)測量結果。
圖47為示出化學式1-1-16的熱重分析(TGA)結果的圖。
圖48為示出溶液狀態的化學式1-1-17的UV-Vis吸收光譜的圖。
圖49為示出膜狀態的化學式1-1-17的UV-Vis吸收光譜的圖。
圖50示出化學式1-1-17的電化學(循環伏安法)測量結果。
圖51為示出化學式1-1-17的熱重分析(TGA)結果的圖。
圖52為示出溶液狀態的化學式1-1-14至1-1-17的UV-Vis吸收光譜的圖。
圖53為示出膜狀態的化學式1-1-14至1-1-17的UV-Vis吸收光譜的圖。
圖54示出化學式1-1-14至1-1-17的電化學(循環伏安法)測量結果。
圖55為示出化學式1-1-14至1-1-17的熱重分析(TGA)結果的圖。
具體實施方式
下文中,將具體描述本發明。
在本發明中,“單元”為包括于共聚物單體中的重復結構,且意指其中單體通過聚合結合在共聚物中的結構。
在本發明中,“包括單元”意指包括于聚合物主鏈中。
根據本發明的一個實施方案的共聚物包括由化學式1表示的第一單元和由化學式2表示的第二單元。
提供第一單元和第二單元以使噻吩并噻吩基的S原子選擇性的彼此接近。
換句話說,包括于根據本發明的一個實施方案的共聚物中的由化學式1表示的第一單元和由化學式2表示的第二單元具有沿共聚物的特定方向上結合的區域規則性。根據根據本發明的一個實施方案的具有區域規則性的共聚物相對地具有優異的結晶度。
本發明中的區域規則性意指穩定地保持共聚物中特定結構選擇性結合的方向。
根據本發明的一個實施方案的共聚物包括其中兩個噻吩基團稠合的結構,從而可引起裝置中高電子密度和/或共振結構的穩定。
在本發明的一個實施方案中,R1為經取代或未經取代的羰基。
在另一個實施方案中,R1為經取代或未經取代的酯基。
在本發明的一個實施方案中,R2為經取代或未經取代的羰基。
在另一個實施方案中,R2為經取代或未經取代的酯基。
在本發明的一個實施方案中,由化學式1表示的單元由下列化學式1-1或化學式1-2表示。
[化學式1-1]
[化學式1-2]
在化學式1-1和化學式1-2中,
A、R3和R4與化學式1中限定的那些相同;以及
R5和R6彼此相同或不同,且各自獨立地為氫;鹵素基團;硝基;氰基;羧基;羥基;經取代或未經取代的羰基;羰基;經取代或未經取代的烷基;經取代或未經取代的烯丙基;經取代或未經取代的烷氧基;經取代或未經取代的環烷基;經取代或未經取代的烯基;經取代或未經取代的酯基;經取代或未經取代的酰胺基;經取代或未經取代的醚基;經取代或未經取代的磺酰基;經取代或未經取代的亞硫酰基;經取代或未經取代的芳基烷基;經取代或未經取代的芳基;或包括N、O、S和Se原子中的一種或更多種的經取代或未經取代的雜環基。
在一個實施方案中,R1為用經取代或未經取代的烷氧基取代的羰基。
在一個實施方案中,R2為用經取代或未經取代的烷氧基取代的羰基。
在一個實施方案中,R1為用經取代或未經取代的烷基取代的羰基。
在一個實施方案中,R2為用經取代或未經取代的烷基取代的羰基。
在本發明的一個實施方案中,共聚物包含由下列化學式2表示的單元。
[化學式2]
在化學式2中,
n為1至10000的整數,
R1和R2彼此相同或不同,且各自獨立地為氫;鹵素基團;硝基;氰基;羧基;羥基;經取代或未經取代的羰基;經取代或未經取代的烷基;經取代或未經取代的烯丙基;經取代或未經取代的烷氧基;經取代或未經取代的環烷基;經取代或未經取代的烯基;經取代或未經取代的酯基;經取代或未經取代的酰胺基;經取代或未經取代的醚基;經取代或未經取代的磺酰基;經取代或未經取代的亞硫酰基;經取代或未經取代的芳基烷基;經取代或未經取代的芳基;或包括N、O、S和Se原子中的一種或更多種的經取代或未經取代的雜環基;
R3和R4彼此相同或不同,且各自獨立地為氫;或吸電子基團,以及
A和A’彼此相同或不同,且各自獨立地為經取代或未經取代的單環或多環芳基;或包括N、O、S和Se原子中的一種或更多種的經取代或未經取代的單環或多環雜環基。
在本發明的一個實施方案中,A在共聚物中起電子供體或電子受體的作用。
在本發明的一個實施方案中,A包括下列化學式中的一者、二者或更多者。
在上述結構中,
X1至X6彼此相同或不同,且各自獨立地為CRR’、NR、O、SiRR’、PR、S、GeRR’、Se或Te,
Y1和Y2彼此相同或不同,且各自獨立地為CR”、N、SiR”、P或GeR”,且
R’、R”、R”’、R10至R13彼此相同或不同,且各自獨立地為氫;鹵素基團;硝基;氰基;羧基;羥基;經取代或未經取代的羰基;經取代或未經取代的烷基;經取代或未經取代的烯丙基;經取代或未經取代的烷氧基;經取代或未經取代的環烷基;經取代或未經取代的烯基;經取代或未經取代的酯基;經取代或未經取代的酰胺基;經取代或未經取代的醚基;經取代或未經取代的磺酰基;經取代或未經取代的亞硫酰基;經取代或未經取代的芳基烷基;經取代或未經取代的芳基;或包括N、O、S和Se原子中的一種或更多種的經取代或未經取代的雜環基。
在本發明的一個實施方案中,A和A’彼此相同或不同,且各自獨立地具有下列結構。
在一個實施方案中,A和A’彼此相同或不同,且各自獨立地具有下列結構。
在另一個實施方案中,A和A’彼此相同或不同,且各自獨立地具有下列結構。
在另一個實施方案中,A和A’彼此相同或不同,且各自獨立地具有下列結構。
在另一個實施方案中,A和A’彼此相同或不同,且各自獨立地具有下列結構。
在另一個實施方案中,A和A’彼此相同或不同,且各自獨立地具有下列結構。
在本發明的一個實施方案中,A和A’彼此相同或不同,且各自獨立地具有下列結構。
在另一個實施方案中,A和A’彼此相同或不同,且各自獨立地具有下列結構。
在上述結構中,X1至X6、Y1、Y2、R10至R13與上述那些相同。
在本發明的一個實施方案中,共聚物包括由化學式3至10中任一者表示的單元。
[化學式3]
[化學式4]
[化學式5]
[化學式6]
[化學式7]
[化學式8]
[化學式9]
[化學式10]
在化學式3至10中,
n為1至10000的整數,
X1至X12彼此相同或不同,且各自獨立地為CRR’、NR、O、SiRR’、PR、S、GeRR’、Se或Te,
Y1至Y4彼此相同或不同,且各自獨立地為CR”、N、SiR”、P或GeR”,
R’、R”、R”’、R1、R2、R10至R17彼此相同或不同,且各自獨立地為氫;鹵素基團;硝基;氰基;羧基;羥基;經取代或未經取代的羰基;經取代或未經取代的烷基;經取代或未經取代的烯丙基;經取代或未經取代的烷氧基;經取代或未經取代的環烷基;經取代或未經取代的烯基;經取代或未經取代的酯基;經取代或未經取代的酰胺基;經取代或未經取代的醚基;經取代或未經取代的磺酰基;經取代或未經取代的亞硫酰基;經取代或未經取代的芳基烷基;經取代或未經取代的芳基;或包括N、O、S和Se原子中的一種或更多種的經取代或未經取代的雜環基,以及
R3和R4彼此相同或不同,且各自獨立地為氫;或吸電子基團。
在本發明的一個實施方案中,吸電子基團為吸引電子的官能團,意指具有相對高的電負性的官能團。特別地,吸電子基團為鹵素基團。
在本發明中,“末端”意指共聚物中除重復單元之外的兩端的結構。
取代基的實例描述于下文,然而,上述取代基不限于此。
術語“取代”意指連接至化合物的碳原子上的氫原子變成另一取代基,取代的位置不受限制,只要是氫原子被取代的位置即可,即,取代基可取代的位置,當有兩個或更多個取代基取代時,所述兩個或更多個取代基可彼此相同或不同。
本發明中,術語“經取代或未經取代的”意指用選自以下基團的一個或更多個取代基取代:氘;鹵素基團;烷基;烯基;烷氧基;酯基;羰基;羧基;羥基;環烷基;硅烷基;芳基烯基;芳氧基;烷基硫基;烷基亞硫酰基;芳基亞硫酰基;硼基;烷基胺基;芳烷基胺基;芳基胺基;雜環基;芳基胺基;芳基;腈基;硝基;羥基;和包括N、O和S原子中的一種或更多種的雜環基,或者不具有取代基。
取代基可用另外的取代基取代或未被取代。
本發明中,鹵素基團可包括氟、氯、溴或碘。
在本發明中,羰基可由表示。
Z為氫;經取代或未經取代的具有1至20個碳原子的烷基;經取代或未經取代的具有3至60個碳原子的環烷基;經取代或未經取代的具有1至20個碳原子的烷氧基;經取代或未經取代的具有7至50個碳原子的芳基烷基;具有6至60個碳原子的經取代或未經取代的芳基;或經取代或未經取代的具有2至60個碳原子且包括N、O、S和Se原子中的一種或更多種的雜環基。
在本發明中,在酰胺基中,酰胺基的氮可用氫、具有1至25個碳原子的直鏈、支鏈或環狀烷基或具有6至25個碳原子的芳基進行一次或兩次取代。特別地,可包括具有下列結構式的化合物,但化合物不限于此。
在本發明中,在酯基中,酯基的氧可用具有1至25個碳原子的直鏈、支鏈或環狀烷基或具有6至25個碳原子的芳基取代。特別地,可包括具有下列結構式的化合物,但化合物不限于此。
在本發明中,烷基可為直鏈或支鏈的,且碳原子數無特別限制,但優選為1至50。其具體實例包括甲基、乙基、丙基、正丙基、異丙基、丁基、正丁基、異丁基、叔丁基、仲丁基、1-甲基-丁基、1-乙基-丁基、戊基、正戊基、異戊基、新戊基、叔戊基、己基、正己基、1-甲基戊基、2-甲基戊基、4-甲基-2-戊基、3,3-二甲基丁基、2-乙基丁基、庚基、正庚基、1-甲基己基、環戊基甲基、環己基甲基、辛基、正辛基、叔辛基、1-甲基庚基、2-乙基己基、2-丙基戊基、正壬基、2,2-二甲基庚基、1-乙基-丙基、1,1-二甲基-丙基、異己基、2-甲基戊基、4-甲基己基、5-甲基己基等,但不限于此。
在本發明中,環烷基無特別限制,但優選具有3至60個碳原子。其具體實例包括環丙基、環丁基、環戊基、3-甲基環戊基、2,3-二甲基環戊基、環己基、3-甲基環己基、4-甲基環己基、2,3-二甲基環己基、3,4,5-三甲基環己基、4-叔丁基環己基、環庚基、環辛基等,但不限于此。
在本發明中,烷氧基可為直鏈、支鏈或環狀的。烷氧基的碳原子數無特別限制,但優選為1至20個。其具體實例包括甲氧基、乙氧基、正丙氧基、異丙氧基、正丁氧基、異丁氧基、叔丁氧基、仲丁氧基、正戊基氧基、新戊基氧基、異戊基氧基、正己基氧基、3,3-二甲基丁基氧基、2-乙基丁基氧基、正辛基氧基、正壬基氧基、正癸氧基、苯甲氧基、對-甲基苯甲氧基等,但不限于此。
在本發明中,烯基可為直鏈或支鏈,且碳原子數無特別限制,但優選為2至40。其具體實例可包括乙烯基、1-丙烯基、異丙烯基、1-丁烯基、2-丁烯基、3-丁烯基、1-戊烯基、2-戊烯基、3-戊烯基、3-甲基-1-丁烯基、1,3-丁二烯基、烯丙基、1-苯基乙烯基-1-基、2-苯基乙烯基-1-基、2,2-二苯基乙烯基-1-基、2-苯基-2-(萘基-1基)乙烯基-1-基、2,2-雙(二苯基-1-基)乙烯基-1-基、茋基、苯乙烯基等,但不限于此。
在本發明中,芳基烷基中碳原子數無特別限制,然而,在本發明的一個實施方案中,芳基烷基中碳原子數為7至50個。特別地,芳基部分具有6至49個碳原子,且烷基部分具有1至44個碳原子。其具體實例包括苯甲基、對-甲基苯甲基、間-甲基苯甲基、對-乙基苯甲基、間-乙基苯甲基、3,5-二甲基苯甲基、α-甲基苯甲基、α,α-二甲基苯甲基、α,α-甲基苯基苯甲基、1-萘基苯甲基、2-萘基苯甲基、對-氟苯甲基、3,5-二氟苯甲基、α,α-二-三氟甲基苯甲基、對-甲氧苯甲基、間-甲氧苯甲基、α-苯氧基苯甲基、α-苯甲氧基苯甲基、萘基甲基、萘基乙基、萘基異丙基、吡咯基甲基、吡咯基乙基、胺基苯甲基、硝基苯甲基、氰基苯甲基、1-羥基-2-苯基異丙基、1-氯-2-苯基異丙基等,但不限于此。
在本發明中,芳基可為單環芳基或多環芳基,包括其中具有1至25個碳原子的烷基或具有1至25個碳原子的烷氧基為經取代的情況。此外,本發明中芳基可意指芳族環。
當芳基為單環芳基時,碳原子數無特別限制,但優選為6至25。單環芳基的具體實例可包括苯基、聯苯基、三聯苯基、芪基等,但不限于此。
當芳基為多環芳基時,其碳原子數無特別限制,但優選為10至24。多環芳基的具體實例包括萘基、蒽基、菲基、芘基、苝基、基、芴基等,但不限于此。
在本發明中,芴基可經取代,且相鄰取代基可彼此連接以形成環。
當芴基為經取代時,可包括等。然而,該結構不限于此。
在本發明中,雜環基為包括N、O、S和Se中的一種或更多種作為雜原子的雜環基,雖無特別限制,但其碳原子數目優選為2至60個。雜環基的實例包括噻吩基、呋喃基、吡咯基、咪唑基、噻唑基、唑基、二唑基、三唑基、吡啶基、聯吡啶基、嘧啶基、三嗪基、吖啶基、噠嗪基、吡嗪基、喹啉基、喹唑啉基、喹喔啉基、酞嗪基、吡啶并嘧啶基、吡啶并吡嗪基、吡嗪并吡嗪基、異喹啉基、吲哚基、咔唑基、苯并唑基、苯并咪唑基、苯并噻唑基、苯并咔唑基、苯并噻吩基、二苯并噻吩基、苯并呋喃基、菲咯啉基、噻唑基、異唑基、二唑基、噻二唑基、苯并噻唑基、吩噻嗪基、二苯并呋喃基等,但不限于此。
雜環基可為單環或多環,且可為芳族、脂族、或者芳族和脂族的稠環。
在另一個實施方案中,R1為經取代或未經取代的酯基。
在本發明的一個實施方案中,R1為經烷基取代的酯基。
在另一個實施方案中,R1為經2-乙基己基取代的酯基。
在另一個實施方案中,R1為經取代或未經取代的羰基。
在本發明的一個實施方案中,R1為經烷基取代的羰基。
在另一個實施方案中,R1為經3-庚烯基取代的羰基。
在另一個實施方案中,R2為經取代或未經取代的酯基。
在一個實施方案中,R2為經烷基取代的酯基。
在本發明的一個實施方案中,R2為經2-乙基己基取代的酯基。
在另一個實施方案中,R2為經取代或未經取代的羰基。
在本發明的一個實施方案中,R2為經烷基取代的羰基。
在另一個實施方案中,R2為經3-庚烯基取代的羰基。
在本發明的一個實施方案中,R5為經取代或未經取代的烷基。
在本發明的一個實施方案中,R5為經取代或未經取代的2-乙基己基;或經取代或未經取代的3-庚烯基。
在一個實施方案中,R5為2-乙基己基;或3-庚烯基。
在本發明的一個實施方案中,R6為經取代或未經取代的烷基。
在本發明的一個實施方案中,R6為經取代或未經取代的2-乙基己基;或經取代或未經取代的3-庚烯基。
在一個實施方案中,R6為2-乙基己基;或3-庚烯基。
在本發明的一個實施方案中,R3為氫。
在另一個實施方案中,R4為氫。
在本發明的一個實施方案中,R10為氫。
在本發明的另一個實施方案中,R11為氫。
在本發明的一個實施方案中,R12為氫。
在另一個實施方案中,R13為氫。
在本發明的一個實施方案中,R14為氫。
在本發明的一個實施方案中,R15為氫。
在另一個實施方案中,R16為氫。
在另一個實施方案中,R17為氫。
在本發明的一個實施方案中,X1為S。
在另一個實施方案中,X2為S。
在本發明的一個實施方案中,X2為CRR’。
在另一個實施方案中,X2為NR。
在一個實施方案中,X2為SiRR’。
在本發明的一個實施方案中,X3為S。
在另一個實施方案中,X3為O。
在另一個實施方案中,X3為NR。
在另一個實施方案中,X3為CRR’。
在另一個實施方案中,X3為SiRR’。
在另一個實施方案中,X4為S。
在另一個實施方案中,X4為CRR’。
在另一個實施方案中,X5為S。
在本發明的一個實施方案中,X5為O。
在本發明的一個實施方案中,X5為SiRR’。
在本發明的一個實施方案中,X6為CRR’。
在本發明的一個實施方案中,X6為SiRR’。
在另一個實施方案中,X6為O。
在另一個實施方案中,X6為S。
在本發明的一個實施方案中,X7為O。
在另一個實施方案中,X7為S。
在另一個實施方案中,X7為CRR’。
在本發明的一個實施方案中,X7為SiRR’。
在另一個實施方案中,X8為S。
在本發明的一個實施方案中,X8為NR。
在另一個實施方案中,X9為NR。
在另一個實施方案中,X9為CRR’。
在本發明的一個實施方案中,X10為CRR’。
在另一個實施方案中,X10為S。
在一個實施方案中,X11為O。
在另一個實施方案中,X11為S。
在本發明的一個實施方案中,X12為O。
在另一個實施方案中,X12為S。
在本發明的一個實施方案中,R和R’彼此相同或不同,且各自獨立地為經取代或未經取代的烷基;經取代或未經取代的烷氧基;或經取代或未經取代的芳基。
在本發明的一個實施方案中,R為經取代或未經取代的烷基。
在一個實施方案中,R為直鏈或支鏈烷基。
在一個實施方案中,R為經取代或未經取代的辛基。
在另一個實施方案中,R為辛基。
在本發明的一個實施方案中,R為經取代或未經取代的2-乙基己基。
在一個實施方案中,R為2-乙基己基。
在本發明的一個實施方案中,R為經取代或未經取代的3,7-二甲基辛基。
在本發明的一個實施方案中,R為3,7-二甲基辛基。
在本發明的一個實施方案中,R為經取代或未經取代的芳基。
在本發明的一個實施方案中,R為經取代或未經取代的苯基。
在本發明的一個實施方案中,R為用經取代或未經取代的烷基取代的苯基。
在本發明的一個實施方案中,R為用烷基取代的苯基。
在本發明的一個實施方案中,R為用己基取代的苯基。
在本發明的一個實施方案中,R’為經取代或未經取代的烷基。
在一個實施方案中,R’為直鏈或支鏈烷基。
在另一個實施方案中,R’為經取代或未經取代的辛基。
在另一個實施方案中,R’為辛基。
在本發明的一個實施方案中,R’為經取代或未經取代的2-乙基己基。
在一個實施方案中,R’為2-乙基己基。
在本發明的一個實施方案中,R’為經取代或未經取代的3,7-二甲基辛基。
在本發明的一個實施方案中,R’為3,7-二甲基辛基。
在本發明的一個實施方案中,R’為經取代或未經取代的芳基。
在本發明的一個實施方案中,R’為經取代或未經取代的苯基。
在本發明的一個實施方案中,R’為用經取代或未經取代的烷基取代的苯基。
在本發明的一個實施方案中,R’為用烷基取代的苯基。
在本發明的一個實施方案中,R’為用己基取代的苯基。
在本發明的一個實施方案中,Y1為CR”。
在本發明的一個實施方案中,Y1為N。
在另一個實施方案中,Y2為CR”。
在本發明的一個實施方案中,Y2為N。
在本發明的一個實施方案中,Y3為CR”。
在另一個實施方案中,Y4為CR”。
在本發明的一個實施方案中,R”為經取代或未經取代的烷氧基;或包括N、O、S和Se原子中的一種或更多種的經取代或未經取代的雜環基。
在本發明的一個實施方案中,R”為經取代或未經取代的烷氧基。
在另一個實施方案中,R”為經取代或未經取代的2-乙基己氧基。
在本發明的一個實施方案中,R”為2-乙基己氧基。
在本發明的一個實施方案中,R”為經取代或未經取代的己氧基。
在一個實施方案中,R”為己氧基。
在本發明的一個實施方案中,R”為包括N、O、S和Se原子中的一種或更多種的經取代或未經取代的雜環基。
在本發明的一個實施方案中,R”為包括一個或更多個S原子的經取代或未經取代的雜環基。
在本發明的一個實施方案中,R”為經取代或未經取代的噻吩基。
在本發明的一個實施方案中,R”為用經取代或未經取代的烷基取代的噻吩基。
在本發明的一個實施方案中,R”為用經取代或未經取代的2-乙基己基取代的噻吩基。
在本發明的一個實施方案中,R”為用2-乙基己基取代的噻吩基。
在本發明的一個實施方案中,R”為用經取代或未經取代的己基取代的噻吩基。
在本發明的一個實施方案中,R”為用己基取代的噻吩基。
在本發明的一個實施方案中,R”為包括一個或更多個Se原子的經取代或未經取代的雜環基。
在本發明的一個實施方案中,R”為經取代或未經取代的哂吩(selenophene)基。
在本發明的一個實施方案中,R”為用經取代或未經取代的烷基取代的硒吩基。
在本發明的一個實施方案中,R”為用經取代或未經取代的2-乙基己基取代的硒吩基。
在本發明的一個實施方案中,R”為用2-乙基己基取代的硒吩基。
在本發明的一個實施方案中,R”為用經取代或未經取代的2-己基癸基取代的硒吩基。
在本發明的一個實施方案中,R”為用2-己基癸基取代的硒吩基。
在本發明的一個實施方案中,共聚物由下列化學式1-1-1至化學式1-1-17中的任一者表示。
[化學式1-1-1]
[化學式1-1-2]
[化學式1-1-3]
[化學式1-1-4]
[化學式1-1-5]
[化學式1-1-6]
[化學式1-1-7]
[化學式1-1-9]
[化學式1-1-10]
[化學式1-1-11]
[化學式1-1-12]
[化學式1-1-13]
[化學式1-1-14]
[化學式1-1-15]
[化學式1-1-16]
[化學式1-1-17]
在化學式1-1-1至1-1-17中,n與上文定義的相同。
在本發明的一個實施方案中,共聚物的端基為雜環基或芳基。
在本發明的一個實施方案中,共聚物的端基為4-(三氟甲基)苯基。
根據本發明的一個實施方案,共聚物優選具有500g/mol至1000000g/mol的數均分子量。優選地,共聚物具有10000g/mol至100000g/mol的數均分子量。在本發明的一個實施方案中,共聚物具有30000g/mol至100000g/mol的數均分子量。
根據本發明的一個實施方案,共聚物可具有1至100的分子量分布。優選地,共聚物具有1至3的分子量分布。
隨著分子量分布的降低和數均分子量的增加,電性質和機械性質變得有利。
此外,數均分子量優選為100000g/mol或更低,以具有高于特定水平的溶解度,從而有利于應用溶液涂覆方法。
共聚物可基于下述制備例來制備。
在本發明中,使1當量的溴與各經R1和R2取代的噻吩并噻吩基反應至,且溴化發生在噻吩并噻吩基的S原子方向,通過將各單元聚合,可制備包括第一單元和第二單元的共聚物以及由化學式1-1-1表示的共聚物。
根據本發明的共聚物可使用多步化學反應制備。在通過烷基化反應、格氏(Grignard)反應、Suzuki偶聯反應、Stille偶聯反應等制備單體后,可通過如Stille偶聯反應的碳-碳偶聯反應制備最終共聚物。當待引入的取代基為硼酸或硼酸酯化合物時,可使用Suzuki偶聯反應,當待引入的取代基為三丁基錫或三甲基錫化合物時,可使用Stille偶聯反應,然而該方法不限于此。
本發明的一個實施方案提供一種有機太陽能電池,其包括第一電極;設置成與第一電極相對的第二電極;和設置于第一電極與第二電極之間并包括光活性層的一個或更多個有機材料層,其中所述一個或更多個有機材料層包括上述共聚物。
根據本發明的一個實施方案的有機太陽能電池包含第一電極、光活性層和第二電極。有機太陽能電池可進一步包含基底、空穴傳輸層和/或電子傳輸層。
在本發明的一個實施方案中,當有機太陽能電池接收來自外部光源的光子時,在電子供體與電子受體之間生成電子與空穴。所生成的空穴通過電子供體層傳輸至陽極。
在本發明的一個實施方案中,有機材料層包括空穴傳輸層、空穴注入層或同時進行空穴傳輸和空穴注入的層,且空穴傳輸層、空穴注入層或同時進行空穴傳輸和空穴注入的層包括共聚物。
在另一個實施方案中,有機材料層包括電子注入層、電子傳輸層、或同時進行電子注入和電子傳輸的層,且電子注入層、電子傳輸層、或同時進行電子注入和電子傳輸的層包括共聚物。
圖1為示出根據本發明的一個實施方案的有機太陽能電池的圖。
在本發明的一個實施方案中,當上述有機太陽電池從外部光源接收光子時,在電子供體和電子受體之間產生電子和空穴。產生的空穴通過電子供體層被傳輸到陽極。
在本發明的一個實施方案中,有機太陽能電池還可包含額外的有機材料層。有機太陽能電池可通過使用同時具有各種不同功能的有機材料層來減少有機材料層的數目。
在本發明的一個實施方案中,第一電極為陽極,第二電極為陰極。在另一個實施方案中,第一電極為陰極,第二電極為陽極。
在本發明的一個實施方案中,有機太陽能電池可具有其中陰極、光活性層和陽極按照連續順序布置的結構,或可具有其中陽極、光活性層和陰極按照連續順序布置的結構,然而結構不限于此。
在另一個實施方案中,有機太陽能電池可具有其中陽極、空穴傳輸層、光活性層、電子傳輸層和陰極按照連續順序布置的結構,或可具有其中陰極、電子傳輸層、光活性層、空穴傳輸層和陽極按照連續順序布置的結構,然而結構不限于此。
在本發明的一個實施方案中,有機太陽能電池具有正置結構。
在本發明的一個實施方案中,有機太陽能電池具有倒置結構。
在本發明的一個實施方案中,有機太陽能電池具有串聯結構。
根據本發明的一個實施方案的有機太陽能電池可具有一個、兩個或更多個光活性層。
在另一個實施方案中,可在光活性層與空穴傳輸層之間或在光活性層與電子傳輸層之間提供緩沖層。在此,還可在陽極與空穴傳輸層之間提供空穴注入層。此外,還可在陰極與電子傳輸層之間提供電子注入層。
在本發明的一個實施方案中,光活性層包含選自電子供體和電子受體的一種、兩種或更多種,且電子供體材料包括共聚物。
在本發明的一個實施方案中,電子受體材料可選自富勒烯、富勒烯衍生物、浴銅靈、半導體單質、半導體化合物及其組合物。特別地,可包括選自富勒烯、富勒烯衍生物((6,6)-苯基-C61-丁酸-甲酯(PCBM)或(6,6)-苯基-C61-丁酸-膽固醇酯(PCBCR))、苝、聚苯并咪唑(PBI)和3,4,9,10-苝-四甲酸雙-苯并咪唑(PTCBI)的一種、兩種或更多種。
在本發明的一個實施方案中,電子供體與電子受體形成體異質結(BHJ)。
體異質結意指電子供體材料和電子受體材料在光活性層中混合在一起。
在本發明的一個實施方案中,光活性層具有包括n型有機材料層和p型有機材料層的雙層結構,且p型有機材料層包括共聚物。
在本發明中的基底可包括具有優異的透明度、表面光滑度、操作容易和耐水性的透明塑料基底或玻璃基底,但不限于此,且可不受限制的使用典型地用于有機太陽能電池的基底。其具體實例包括玻璃、聚對苯二甲酸乙二醇酯(PET)、聚萘二甲酸乙二醇酯(PEN)、聚丙烯(PP)、聚酰亞胺(PI)、三乙酰基纖維素(TAC)等,但不限于此。
陽極可包括透明且具有優異導電性的材料,但材料不限于此。陽極材料的實例包括金屬,如釩、鉻、銅、鋅或金,或其合金;金屬氧化物,如氧化鋅、氧化銦、氧化銦錫(ITO)或氧化銦鋅(IZO);以及金屬與氧化物的組合,如ZnO:Al或SnO2:Sb;導電聚合物,如聚(3-甲基噻吩)、聚[3,4-(亞乙基-1,2-二氧)噻吩](PEDOT)、聚吡咯和聚苯胺等,但不限于此。
形成陽極的方法無特別限制,然而陽極可通過使用如濺射、電子束、熱沉積、旋涂、網版印刷、噴墨印刷、刮涂或凹版印刷的方法施加至基底的一個表面或涂布成膜形式而形成。
當在基底上形成陽極時,所得物可經歷清洗、脫水和改性成親水性的過程。
例如,在用清潔劑、丙酮和異丙醇(IPA)按照連續順序清潔經圖案化的ITO基底之后,在加熱板上在100℃至150℃下將ITO基底干燥1分鐘至30分鐘,優選在120℃下干燥10分鐘,以移除水分,當基底完全清潔后,將基底表面改性成親水性。
通過如前述的表面改性,結表面電位可保持在適合光活性層表面電位的水平。此外,當表面被改性時,可容易地在陽極上形成聚合物薄膜,且可改善薄膜質量。
用于陽極的預處理技術包括a)使用平行板放電的表面氧化方法,b)在真空中通過由UV射線產生的臭氧使表面氧化的方法,以及c)使用由等離子體生成的氧自由基的氧化方法。
可根據陽極或基底的條件選擇上述方法之一。然而,不管使用何種方法,通常優選防止陽極或基底的表面上的氧脫離且盡可能抑制水分和有機物的殘留。在這種情況下,預處理的實際效果可最大化。
作為具體實例,可使用通過由UV射線產生的臭氧將表面氧化的方法。在此,可在超聲清洗后通過在熱板上烘烤經圖案化的ITO基底而將經圖案化的ITO基底完全干燥,將經圖案化的ITO基底引入槽內,然后可通過由使用UV燈使氧氣與UV光反應所生成的臭氧清潔。
然而,在本發明中經圖案化ITO基底的表面修飾方法無特別限制,可使用任何將基底氧化的方法。
陰極可包括具有小功函數的金屬,但不限于此。其具體實例可包括金屬,如鎂、鈣、鈉、鉀、鈦、銦、釔、鋰、釓、鋁、銀、錫和鉛,或其合金,或多層結構材料,如LiF/Al、LiO2/Al、LiF/Fe、Al:Li、Al:BaF2和Al:BaF2:Ba,但不限于此。
陰極可通過在真空度為5×10-7托或更低的熱沉積器中沉積而形成,但形成不限于此方法。
空穴傳輸層和/或電子傳輸層材料起使在光活性層中分離的電子和空穴有效地傳輸至電極的作用,材料無特別限制。
空穴傳輸層材料可包括摻雜有聚(苯乙烯磺酸)的聚(3,4-亞乙基二氧噻吩)(PEDOT:PSS)、氧化鉬(MoOx);氧化釩(V2O5);氧化鎳(NiO);和氧化鎢(WOx);等,但不限于此。
電子傳輸層材料可包括電子提取金屬氧化物,且可特別包括8-羥基喹啉的金屬絡合物;包括Alq3的絡合物;包括Liq的金屬絡合物;LiF;Ca;氧化鈦(TiOx);氧化鋅(ZnO);碳酸銫(Cs2CO3)等,但不限于此。
光活性層可通過將光活性材料(如電子供體和/或電子受體)溶解于有機溶劑中,然后使用如旋涂、浸涂、網版印制、噴涂、刮涂和刷涂的方法施加溶液而形成,但所述方法不限于此。
發明方案
下文中,將參照下列制備例和實施例詳述用于制備共聚物的方法和用于制造包括該共聚物的有機太陽能電池的方法。然而,下列實施例僅用于說明目的,且本發明的范圍不限于此。
實施例1.單體1-j的合成
(1)化學式1-b(4,5-二乙基-噻吩-2-甲酸甲酯)的合成
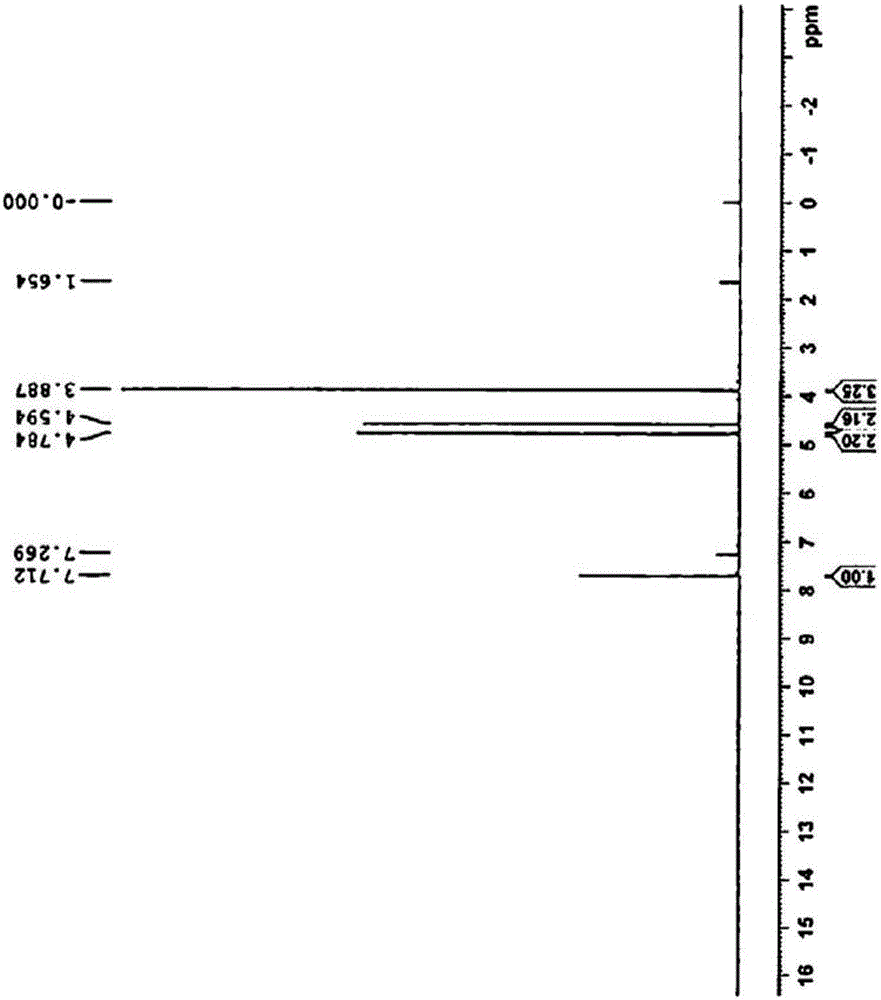
在將2-噻吩甲酸甲酯(4.00g,28.13mmol)和氯甲基甲基醚(11.00g,136.63mmol)置入附接有氮氣吹掃管的100ml燒瓶中之后,在冰水浴中緩緩將四氯化鈦(TiCl4)(8.00g,42.20mmol)注入其中,混合物反應5小時。使用過量蒸餾水和氯甲烷(MC)萃取所得物,使用無水硫酸鈉移除有機層中的水分。通過蒸發移除殘留溶劑,使用己烷使所得物再結晶,將生成的晶體真空過濾以得到5.20g(93.2%)的白色晶體。1HNMR(CDCl3):3.89(3H,s),4.59(2H,s),4.78(2H,s),7.71(1H,s)。
圖2為示出化學式1-b的NMR譜的圖。
(2)化學式1-c(4,6-二氫-噻吩并[3,4-b]噻吩-2-甲酸甲酯)的合成
將化合物1-b(5.20g,21.75mmol)和250ml的甲醇置入附接有回流冷凝器的500ml燒瓶中,在60℃水浴中加熱混合物。將硫化鈉(1.87g,23.92mmol)溶于150ml的甲醇中的溶液以1小時的時間緩緩注入其中,所得物回流2小時。通過真空過濾移除固體雜質,使用蒸發器移除溶劑,使用蒸餾水移除殘余的殘渣。使用柱層析法(MC:Hex=2:1)分離殘余的殘留物以得到1.64g的白色晶體(31.23%)。1HNMR(CDCl3):3.87(3H,s),4.05-4.06(2H,t),4.18-4.20(2H,t),7.48(1H,s)
圖3為示出化學式1-c的NMR譜的圖。
(3)化學式1-e(噻吩并[3,4-b]噻吩-2-甲酸甲酯)的合成
在將乙酸乙酯、化合物1-c(1.64g,8.19mmol)和干冰置入裝配有氮吹掃管的250ml燒瓶中,混合物在干冰浴中冷卻。將溶于乙酸乙酯中的間氯過氧苯甲酸(MCPBA)(2.12g,12.28mmol)緩緩注入其中,所得物反應過夜。使用蒸發器移除溶劑,向其中添加乙酸酐,所得物反應兩個半小時。反應產物在室溫冷卻,然后蒸餾,移除乙酸酐。使用柱層析法(MC:Hex=1:1)分離殘余的殘留物以得到1.31g(80.8%)的白色晶體。1HNMR(CDCl3):3.91(3H,s),7.28-7.29(1H,d),7.59-7.60(1H,d),7.70(1H,s)
圖4為示出化學式1-e的NMR譜的圖。
(4)化學式1-f(噻吩并[3,4-b]噻吩-2-甲酸)的合成
將溶于30ml四氫呋喃(THF)中的化合物1-e(1.31g,6.60mmol)和溶于30ml蒸餾水中的氫氧化鋰(LiOH)(0.32,13.21mmol)置入附接有回流冷凝器的100ml燒瓶中,混合物在水浴中回流一天。所得物使用1N HCl溶液酸化且真空過濾以得到1.10g(90.5%)的深黃色晶體。1HNMR(DMSO):7.98(1H,s),7.73(2H,s)
圖5為示出化學式1-f的NMR譜的圖。
(5)化學式1-g(噻吩并[3,4-b]噻吩-2-甲酸2-乙基-己酯)的合成
在將溶于氯甲烷(MC)中的化合物1-f(1.10g,5.97mmol)置入裝備有氮吹掃管的250ml燒瓶中之后,向其中添加N,N’-二環己基碳化二亞胺(DCC)(1.48g,7.16mmol)、二甲基氨基吡啶(DMAP)(0.26g,2.09mmol)和2-乙基-1-己醇(3.88g,29.85mmol),混合物反應一天。所得物使用蒸餾水和氯甲烷(MC)萃取,使用無水硫酸鈉移除有機層中的水分。通過真空過濾移除固體雜質。通過蒸發移除殘留溶劑,所得物通過柱層析法(MC:Hex=1)分離以得到1.49g(83.9%)的具有微橙色的透明油。1HNMR(CDCl3):0.86-0.96(6H,m),1.25-1.50(8H,m),1.67-1.74(1H,m),4.19-4.27(2H,m),7.23-7.24(1H,d),7.54-7.55(1H,d),7.67(1H,s)
圖6為示出化學式1-g的NMR譜的圖。
(6)化學式1-h(6-溴-噻吩并[3,4-b]噻吩-2-甲酸2-乙基-己酯)的合成
將溶于10ml二甲基甲酰胺(DMF)中的化合物1-g(1.49g,5.03mmol)置入裝備有氮吹掃管的100ml燒瓶中。使用注射筒向其中緩緩注入溶于二甲基甲酰胺(DMF)中的N-溴琥珀酰亞胺(NBS)(0.89g,5.03mmol),混合物反應5分鐘。所得物使用蒸餾水和乙酸乙酯(EA)萃取后,使用無水硫酸鈉移除有機層中的水分,通過真空過濾移除固體雜質。所得物通過柱層析法(MC:氯仿:己烷=1:1:3)分離兩次以得到1.02g(51.4%)具有橙色的透明油。1HNMR(CDCl3):0.86-0.96(6H,m),1.25-1.50(8H,m),1.67-1.74(1H,m),4.20-4.27(2H,m),7.22(1H,d),7.53(1H,d)。
圖7為示出化學式1-h的NMR譜圖。
(7)化學式1-i的合成
將化合物1-h(1.02g,2.72mmol)和2,6-雙(三甲基錫)-4,8-雙(2-乙基己氧基)苯并[1,2-b:4,5-b’]二噻吩(0.84g,1.09mmol)溶于15ml甲苯中的溶液連同Pd(PPh3)4(0.16g,0.14mmol)一起置入裝備有回流冷凝器的100ml燒瓶,混合物在油浴中回流24小時。反應產物在室溫下冷卻,通過蒸發移除殘留的溶劑,通過柱層析法(MC:氯仿:己烷=1:1:3)分離所得物以得到0.48g(41.5%)的紅色晶體。1HNMR(CDCl3):0.83-0.88(6H,m),0.90-1.00(16H,m),1.07-1.11(6H,t),1.36-1.54(22H,m),1.62-1.67(4H,m),1.72-1.77(4H,m),1.84-1.87(2H,m),4.20-4.22(4H,d),4.27-4.29(4H,m),7.22(2H,s),7.57(2H,s),8.05(2H,s)。
圖8為示出化學式1-i的NMR譜的圖。
(8)化學式1-j的合成
將溶解有化合物1-i(0.48g,0.46mmol)的15ml氯仿(CHCl3)置入裝備有氮吹掃管的100ml燒瓶中。溶解在氯仿(CHCl3)中的N-溴琥珀酰亞胺(NBS)(0.18,1.02mmol)使用注射筒緩緩注入其中,混合物在暗處反應4小時。所得物使用蒸餾水和氯甲烷(MC)萃取后,使用無水硫酸鈉移除有機層中的水分,通過真空過濾移除固體雜質。所得物通過柱層析法(MC:Hex=1:2)分離以得到0.36g(65.7%)暗紅色晶體。1HNMR(CDCl3):0.83-0.88(6H,m),0.90-1.00(16H,m),1.07-1.11(6H,t),1.36-1.54(22H,m),1.62-1.67(4H,m),1.72-1.77(4H,m),1.84-1.87(2H,m),4.20-4.22(4H,d),4.27-4.29(4H,m),7.50(2H,s),8.03(2H,s)。
圖9為示出化學式1-j的NMR譜的圖。
實施例2.單體2-b的合成
(1)化學式2-a的合成
將4,8-脫氫苯并[l,2-b:4,5-b’]二噻吩-4,8-二酮(8.0g,36.2mmol)和鋅粉(Zn粉)(5.2g,79.6mmol)置入60ml去離子(DI)水(H2O)中之后,攪拌混合物,向其中添加氫氧化鈉(NaOH,24g),所得物在攪拌下回流1小時。反應期間,溶液顏色從黃色經紅色變成橙色。將2-乙基己基溴(21.0g,108.9mmol)和四丁基溴化銨(作為催化劑)添加至此溶液,所得物攪拌/回流2小時。當溶液顏色為紅色或深紅色時,額外添加鋅粉,所得物攪拌/回流6小時。將此溶液倒入冷水中,使用二乙基醚萃取兩次,之后使用硫酸鎂(MgSO4)移除殘留的水。將殘留溶液抽真空以移除溶劑,通過二氧化硅柱(洗脫液;石油醚:MC=9:1)得到無色液體。
產率:64.9%
(2)化學式2-b的合成
將化合物2-a(10.3g,23.1mmol)置入并溶于50ml的四氫呋喃(THF)中,且將溫度降至-78℃。在此溫度下向其中緩緩添加1.6M正丁基鋰(n-BuLi)的己烷(31.7ml,50.8mmol)溶液,所得物攪拌30分鐘。之后,溫度升至0℃,且所得物在此條件下攪拌1小時。之后,溫度再次降至-78℃,且向其中一次添加1M的氯化三甲基錫的四氫呋喃(THF)(53.1ml,53.1mmol)溶液,將溫度升至室溫,所得物攪拌12小時。將此溶液倒入冰內,使用二乙基醚萃取兩次,用水洗滌兩次,殘留的水使用硫酸鎂(MgSO4)移除。殘留的溶液抽真空以移除溶劑,所得物用乙醇再結晶以得到無色晶體狀固體。
產率:71.4%
圖10為示出化學式2-b的NMR譜的圖。
圖11為示出化學式2-b的MS譜的圖。
實施例3.單體3-b的合成
(1)化學式3-a的合成
將2-(2-乙基己基)硒吩(5.0g,23.2mmol)置入300ml的四氫呋喃(THF)中,且將溫度降至-78℃。在此溫度下向其中緩緩添加在己烷(11.1ml,27.9mmol)中的2.5M正丁基鋰(n-BuLi),所得物攪拌1小時。之后,溫度升至0℃,且所得物在此條件下攪拌1小時。向其中一次添加4,8-脫氫苯并[l,2-b:4,5-b’]二噻吩-4,8-二酮(2.1g,9.28mmol),所得物在50℃下攪拌6小時。此溶液冷卻至室溫后,另外向其中添加氯化錫(II)二水合物(SnCl2·2H2O)(15g)和10%HCl(30ml),所得物進一步攪拌3小時。將冰倒入此溶液中,用二乙醚萃取所得物,使用硫酸鎂(MgSO4)移除殘留水。將殘留溶液抽真空以移除溶劑,通過二氧化硅柱(洗脫液;石油)得到高密度黃色液體。
產率:70%
(2)化學式3-b的合成
將化合物3-a(2.0g,3.24mmol)置入并溶于100ml的四氫呋喃(THF),且將溫度降至0℃。在此溫度下將在己烷中(7.1ml,11.3mmol)的1.6M正丁基鋰(n-BuLi)緩緩添加至其中,所得物在室溫下攪拌1小時。向此溶液中一次添加在THF(8.10ml,8.10mmol)中的1M氯化三甲基錫,所得物攪拌2小時。將水倒入此溶液中,所得物用己烷萃取,然后使用硫酸鎂(MgSO4)移除殘留水。殘留的溶液抽真空以移除溶劑,用乙醇再結晶以得到淡黃色晶體固體。
產率:85%
圖12為示出化學式3-a的NMR譜的圖。
圖13為示出化學式3-b的NMR譜的圖。
實施例4.單體4-b的合成
以與實施例3中相同的方式制備單體4-b,除了使用2-(2-己基癸基)硒吩代替實施例3中的2-(2-乙基己基)硒吩。
實施例5.單體5-e的合成
(1)化學式5-b的合成
將化合物5-a(6.0g,31.2mmol)溶于50ml氯仿(CF):50ml三氟乙酸(TFA)中。向其中一次添加過硼酸鈉單水合物(7.39g,72.8mmol),所得物在室溫下攪拌1小時。將此溶液倒入水中,然后用氯仿萃取。在真空下移除溶劑,通過二氧化硅柱(洗脫液:Hx/MC=1/1)得到白色固體。
產率:35%
(2)化學式5-c的合成
在氮氣下將化合物5-b(2.4g,11.4mmol)溶于60ml的四氫呋喃(THF)。在-25℃將25.4ml的3,7-二甲基辛基溴化鎂(二乙醚中1M溶液)緩緩注入其中。所得物攪拌10小時,同時將溫度升至室溫,在添加50ml的水的同時終止反應。所得物用乙酸乙酯(EA)萃取,使用硫酸鎂(MgSO4)移除殘留水。通過二氧化硅柱得到淡黃色液體。
產率:93%
(3)化學式5-d的合成
化合物5-c(4.5g,12.0mmol)在氮氣下溶于100ml的甲苯。向其中添加300mg的對甲苯磺酸鈉單水合物,所得物在120℃反應3小時。
將反應溶液倒入水中,通過向其中添加甲苯來萃取。使用硫酸鎂(MgSO4)干燥所得物,然后在真空下移除溶劑。通過二氧化硅柱(洗脫液:Hx)得到黃色液體。
產率:95%
(4)化學式5-e的合成
在氮氣下將化合物5-d 0.58g,1.2mmol)溶于20ml的四氫呋喃(THF)。在-78℃將正丁基鋰(1.7ml,1.6M己烷溶液)緩緩添加至其中,所得物攪拌30分鐘,隨后在室溫下攪拌2小時。溫度再次降低至-78℃,向其中添加0.92ml的三丁基氯化錫溶液。在升溫的同時,所得物在室溫下攪拌10小時。將所得物倒入水中,用己烷萃取。在真空下移除溶劑,通過二氧化硅柱(洗脫液:Hx,10%三乙基胺)得到棕色液體。
產率:97%
圖14為示出化學式5-e的NMR譜的圖。
實施例6.單體6-b的合成
3,6-二噻吩-2-基-2,5-二氫吡咯并[3,4-c]吡咯-1,4-二酮(13.0g,43.3mmol)和碳酸鉀(K2CO3,24.0g)置入并通過在145℃加熱良好地溶于350ml的二甲基甲酰胺(DMF)中。使用注射筒向此溶液中一次添加辛基溴(38.6g,200mmol)。所得物在145℃下攪拌15小時或更長后,將溫度降低至室溫。將所得物倒入500ml或更多冷水中,攪拌,然后用水和酒精洗滌數次的同時過濾。干燥后,通過二氧化硅柱(洗脫液;己烷:二氯甲烷=1:10)得到深紫色固體粉末。(產率:87.4%)
在-20℃下,使用注射筒將溶于100ml四氫呋喃(THF)中的化學式6-a的化合物(3g,5.7166mmol)緩緩添加至250ml燒瓶中的2.0M二異丙基酰胺鋰溶液(LDA,6ml,12.0mmol),混合物攪拌1小時。向其中添加1M三甲基氯化錫((CH3)3SnCl,13.14ml,13.14mmol),所得物在溫度升至室溫的同時攪拌12小時。用水和氯仿(CF)萃取此溶液,用水洗滌,使用硫酸鎂(MgSO4)移除殘留水。將殘留溶液抽真空以移除溶劑,用MC/EtOH再結晶得到化合物6-b。(產率42%)
圖15為示出化學式6-b的NMR譜的圖。
實施例7.單體7-a的合成
將2,5-二溴噻吩(9.68g,40.0mmol)置入并溶于200ml的四氫呋喃(THF),且將溫度降至-78℃。在此溫度下向其中緩緩添加1.6M正丁基鋰(n-BuLi)的己烷(55ml,88mmol)溶液,所得物攪拌1小時。之后,向其中一次添加1M三甲基氯化錫的THF溶液(100ml,100mmol),將溫度升至室溫,之后所得物攪拌12小時。將此溶液倒入冰內,所得物用二乙基醚萃取三次,用水洗滌三次,使用硫酸鎂(MgSO4)移除殘留的水。殘留的溶液抽真空以移除溶劑,用甲醇再結晶以得到白色固體。
產率:73.1%
圖16為示出化學式7-a的NMR譜的圖。
實施例8.單體8-b的合成
(1)化學式8-a的合成
將2-己基噻吩(10.0g,59.4mmol)置入并溶于500ml的四氫呋喃(THF),且將溫度降至-78℃。在此溫度下向其中緩緩添加2.5M正丁基鋰(n-BuLi)的己烷溶液(24.0ml,59.4mmol),所得物攪拌30分鐘。之后,溫度升至0℃,所得物在此條件下攪拌1小時,然后向其中一次添加4,8-脫氫苯并[l,2-b:4,5-b’]二噻吩-4,8-二酮(3.3g,14.8mmol),所得物在50℃攪拌3小時。此溶液冷卻至室溫后,向其中添加氯化錫(II)二水合物(SnCl2·2H2O)(26g)和10%HCl(56ml),所得物進一步攪拌3小時。將冰倒入此溶液中,所得物用二乙醚萃取兩次,水洗兩次,使用硫酸鎂(MgSO4)移除殘留水。殘留溶液抽真空以移除溶劑,通過二氧化硅柱(洗脫液;石油)得到高密度黃色液體。
產率:64%
(2)化學式8-b的合成
8-a(3.9g,7.43mmol)置入并溶于100ml的四氫呋喃(THF),且將溫度降至0℃。在此溫度下將1.6M正丁基鋰(n-BuLi)的己烷(10.4ml,16.7mmol)溶液緩緩添加至其中,所得物在室溫下攪拌1小時。向該溶液中一次添加1M三甲基氯化錫的四氫呋喃(THF)溶液(22.7ml,22.7mmol),所得物攪拌2小時。將水倒入此溶液中,所得物用二乙醚萃取兩次,水洗兩次,使用硫酸鎂(MgSO4)移除殘留水。殘留的溶液抽真空以移除溶劑,用乙醇再結晶以得到淡黃色晶體固體。
產率:87%
圖17為示出化學式8-b的NMR譜的圖。
圖18為示出化學式8-b的MS譜的圖。
實施例9.單體9-b的合成
(1)化學式9-a的合成
將2-(2-乙基己基)噻吩(10.0g,59.4mmol)置入并溶于500ml的四氫呋喃(THF),且將溫度降至-78℃。在此溫度下向其中緩緩添加2.5M正丁基鋰(n-BuLi)的己烷(24.0ml,59.4mmol)溶液,所得物攪拌30分鐘。之后,溫度升至0℃,所得物在此條件下攪拌1小時,然后向其中一次添加4,8-脫氫苯并[l,2-b:4,5-b’]二噻吩-4,8-二酮(3.3g,14.8mmol),所得物在50℃攪拌3小時。此溶液冷卻至室溫后,向其中添加氯化錫(II)二水合物(SnCl2·2H2O)(26g)和10%HCl(56ml),所得物進一步攪拌3小時。將冰倒入此溶液中,所得物用二乙醚萃取兩次,用水洗滌兩次,使用硫酸鎂(MgSO4)移除殘留水。殘留溶液抽真空以移除溶劑,通過二氧化硅柱(洗脫液;石油)得到高密度黃色液體。
產率:64%
(2)化學式9-b的合成
化合物5(3.9g,7.59mmol)置入并溶于100ml的四氫呋喃(THF),且將溫度降至0℃。在此溫度下將1.6M正丁基鋰(n-BuLi)的己烷(10.4ml,16.7mmol)溶液緩緩添加至其中,所得物在室溫下攪拌1小時。1M三甲基氯化錫的四氫呋喃(THF)溶液(22.7ml,22.7mmol)一次添加至此溶液中,所得物攪拌2小時。將水倒入此溶液中,所得物用二乙醚萃取兩次,水洗兩次,使用硫酸鎂(MgSO4)移除殘留水。殘留的溶液抽真空以移除溶劑,用乙醇再結晶以得到淡黃色晶體固體。
產率:87%
圖19為示出化學式9-b的NMR譜的圖。
實施例10.單體10-a的合成
以與Wen Wen,z Lei Ying,z Ben B.Y.Hsu,Yuan Zhang,Thuc-Quyen Nguyen and Guillermo C.Bazan,Chem.Commun.,2013,49,7192-7194的合成方法相同的方法制備單體。
圖20為示出化學式10-a的NMR譜的圖。
實施例11.單體11-a的合成
以與Yun-Xiang Xu,Chu-Chen Chueh,Hin-Lap Yip,Fei-Zhi Ding,Yong-XiLi,Chang-Zhi Li,Xiaosong Li,Wen-Chang Chen,and Alex K.-Y.Jen,Adv.Mater.2012,24,6356-6361的合成方法相同的方法制備單體。
圖21為示出化學式11-a的MS譜的圖。
圖22為示出化學式11-a的NMR譜的圖。
實施例12.單體12-a的合成
以與Bob C.Schroeder,Zhenggang Huang,Raja Shahid Ashraf,*Jeremy Smith,Pasquale D’Angelo,Scott E.Watkins,Thomas D.Anthopoulos,James R.Durrant,and Iain McCulloch,Adv.Funct.Mater.2012,22,1663-1670的合成方法相同的方法制備單體。
圖23為示出化學式12-a的NMR譜的圖。
實施例13.單體13-b的合成
將4,4’-雙(2-乙基-己基)-5,5’-二溴二噻吩并[3,2-b:2’,3’-b’]噻咯(5.0g,8.67mmol)溶于50ml的四氫呋喃(THF),且將溫度降至-78℃。向其中添加n-BuLi(8.67ml,2.5M己烷溶液)。30分鐘后,向其中添加(CH3)3SnCl(3.49ml,1M己烷溶液),所得物攪拌18小時。所得物用水和二乙醚萃取,使用硫酸鎂(MgSO4)移除有機層中殘留的水。移除溶劑,所得物在烘箱中干燥。
產率:96.1%
圖24為示出化學式13-b的NMR譜的圖。
實施例14.單體14-d的合成
(1)化學式14-b的合成
將噻吩并[3,4-b]噻吩-2-甲酸2-乙基-己酯(1.49g,5.03mmol)置入10ml的二甲基甲酰胺(DMF)中,向其中逐滴添加N-溴代琥珀酰亞胺(NBS,0.90g,5.03mmol),然后攪拌所得物30分鐘。將去離子(DI)水添加至此溶液,所得物用乙酸乙酯萃取多次。在真空下移除溶劑,使用無水硫酸鈉干燥所得物。通過二氧化硅柱層析法(二氯甲烷和己烷(1:2))從殘留物中得到化學式14-b的油(0.79g,41.8%)。1H NMR(CDCl3,400MHz):7.53(1H,s),7.22(1H,s),4.20-4.27(2H,m),1.67-1.74(1H,m),1.25-1.50(8H,m),0.86-0.96(6H,m)。
(2)化學式14-c的合成
將2,1,3-苯并噻二唑-4,5-雙(硼酸頻哪醇酯(0.33g,0.84mmol)、Pd(PPh3)4(0.05g,0.04mmol)和化學式14-b的化合物(0.79g,2.10mmol)置入20ml的甲苯、碳酸鉀水溶液(10ml)和10ml的乙醇中,混合物在110℃下在氮氣氛下回流并攪拌過夜。將混合物冷卻至室溫,在真空下移除溶劑,所得物用無水硫酸鈉干燥。通過二氧化硅柱層析法(二氯甲烷和己烷(1:2))從殘留物中得到化學式14-c的紅色固體(0.40g,65.7%)。1H NMR(CDCl3,400MHz):8.11(2H,s),8.03(2H,s),7.52(2H,s),4.27-4.28(4H,m),1.64-1.75(2H,m),1.30-1.48(16H,m),0.88-0.96(12H,m)。
(3)化學式14-d的合成
將化學式14-c(0.40g,0.55mmol)和10ml的氯仿置入圓底燒瓶中,向其中逐滴添加N-溴琥珀酰亞胺(NBS,0.22g,1.21mmol),混合物攪拌10分鐘。將去離子(DI)水添加至此溶液,所得物以乙酸乙酯萃取多次。于真空下移除溶劑,所得物使用無水硫酸鈉干燥。經二氧化硅柱層析法(二氯甲烷和己烷(1:1))自殘留物得到化學式14-d的藍色固體(0.37g,76.2%)。1H NMR(CDCl3,400MHz):7.94(1H,s),7.68(1H,s),4.23-4.31(4H,m),1.64-1.75(2H,m),1.30-1.48(16H,m),0.88-0.96(12H,m).GC/MS(m/z)計算值C38H38Br2N2O4S5,881.98;實驗值882.20[M]+。
實施例15.單體15-d的合成
以與實施例1中相同的方式制備化學式15-d,除了使用化學式15-a代替化學式1-g,且使用實施例9的化學式9-a代替實施例1中的2,6-雙(三甲基錫)-4,8-雙(2-乙基己氧基)苯并[1,2-b:4,5-b’]二噻吩。
實施例16.單體16-b的合成
以與實施例1中相同的方式使用化學式15-d,除了使用化學式15-a代替實施例1中的化學式1-g。
制備例1.化學式1-1-1的合成
將18ml的氯苯、1-j(0.700g,0.5866mmol)、2-b(0.2641g,0.5866mmol)、三(二亞芐基丙酮)二鈀(0)(Pd2(dba)3,10mg)和三-(鄰甲苯基)膦(28mg)置入微波反應器瓶中,混合物在170℃的條件下反應1小時。將混合物冷卻至室溫,倒入甲醇內,將固體過濾。所濾得的固體用丙酮、己烷、二氯甲烷和氯仿進行Soxhlet萃取,通過再次在甲醇中沉淀氯仿部分而濾出固體。
制備例2.化學式1-1-2的合成
將18ml的氯苯、以與實施例1中相同的方法制備的化合物(0.700g,0.5731mmol)(除了使用5,5-雙(3,7-二甲基辛基)-5H-二噻吩并[3,2-b:2’,3’-d]吡喃-2,7-二基-雙(三甲基錫烷)代替實施例1中(7)化學式1-i的制備方法中的2,6-雙(三甲基錫)-4,8-雙(2-乙基己氧基)苯并[1,2-b:4,5-b’]二噻吩)、化學式5-e的化合物(0.6033g,0.5731mmol)、三(二亞芐基丙酮)二鈀(0)(Pd2(dba)3,10mg)和三-(鄰甲苯基)膦(28mg)置入微波反應器瓶中,混合物在170℃條件下反應1小時。將混合物冷卻至室溫,倒入甲醇內,過濾固體。所濾得的固體用丙酮、己烷、二氯甲烷和氯仿進行Soxhlet萃取,通過再次在甲醇中沉淀氯仿部分而濾出固體。
產率:47%
數均分子量:33200g/mol
PDI:1.8
制備例3.化學式1-1-3的合成
將18ml的氯苯、以與實施例1中相同的方法制備的化合物(0.700g,0.5505mmol)(除了使用化學式6-b的化合物代替實施例1中(7)化學式1-i的制備方法中的2,6-雙(三甲基錫)-4,8-雙(2-乙基己氧基)苯并[1,2-b:4,5-b’]二噻吩)、化學式6-b的化合物(0.4681g,0.5505mmol)、三(二亞芐基丙酮)二鈀(0)(Pd2(dba)3,10mg)和三-(鄰甲苯基)膦(28mg)置入微波反應器瓶中,混合物在170℃條件下反應1小時。將混合物冷卻至室溫,倒入甲醇內,過濾固體。所濾得的固體用丙酮、己烷、二氯甲烷和氯仿進行Soxhlet萃取,通過再次在甲醇中沉淀氯仿部分而濾出固體。
產率:41%
數均分子量:40800g/mol
PDI:1.7
制備例4.化學式1-1-4的合成
將18ml的氯苯、以與實施例1中相同的方法制備的化合物(0.700g,0.4232mmol)(除了使用化學式10-a的化合物代替實施例1中(7)化學式1-i的制備方法中的2,6-雙(三甲基錫)-4,8-雙(2-乙基己氧基)苯并[1,2-b:4,5-b’]二噻吩)、化學式10-a的化合物(0.5217g,0.4232mmol)、三(二亞芐基丙酮)二鈀(0)(Pd2(dba)3,10mg)和三-(鄰甲苯基)膦(28mg)置入微波反應器瓶中,混合物在170℃條件下反應1小時。將混合物冷卻至室溫,倒入甲醇內,過濾固體。所濾得的固體用丙酮、己烷、二氯甲烷和氯仿進行Soxhlet萃取,通過再次在甲醇中沉淀氯仿部分而濾出固體。
產率:46%。
數均分子量:57000g/mol
PDI:1.4
制備例5.化學式1-1-5的合成
將18ml的氯苯、以與實施例1中相同的方法制備的化合物(0.700g,0.3954mmol)(除了使用化學式11-a的化合物代替實施例1中(7)化學式1-i的制備方法中的2,6-雙(三甲基錫)-4,8-雙(2-乙基己氧基)苯并[1,2-b:4,5-b’]二噻吩)、化學式11-a的化合物(0.5319g,0.3954mmol)、三(二亞芐基丙酮)二鈀(0)(Pd2(dba)3,10mg)和三-(鄰甲苯基)膦(28mg)置入微波反應器瓶中,混合物在170℃條件下反應1小時。將混合物冷卻至室溫,倒入甲醇內,過濾固體。所濾得的固體用丙酮、己烷、二氯甲烷和氯仿進行Soxhlet萃取,通過再次在甲醇中沉淀氯仿部分而濾出固體。
產率:45%
數均分子量:52800g/mol
PDI:1.5
制備例6.化學式1-1-6的合成
將18ml的氯苯、以與實施例1中相同的方法制備的化合物(0.700g,0.6006mmol)(除了使用化學式13-b的化合物代替實施例1中(7)化學式1-i的制備方法中的2,6-雙(三甲基錫)-4,8-雙(2-乙基己氧基)苯并[1,2-b:4,5-b’]二噻吩)、化學式13-b的化合物(0.4470g,0.6006mmol)、三(二亞芐基丙酮)二鈀(0)(Pd2(dba)3,10mg)和三-(鄰甲苯基)膦(28mg)置入微波反應器瓶中,混合物在170℃條件下反應1小時。將混合物冷卻至室溫,倒入甲醇內,過濾固體。所濾得的固體用丙酮、己烷、二氯甲烷和氯仿進行Soxhlet萃取,通過再次在甲醇中沉淀氯仿部分而濾出固體。
產率:49%
數均分子量:41100g/mol
PDI:1.9
制備例7.化學式1-1-7的合成
具有與化學式14-d的化合物相同當量的2,6-雙(三甲基錫)-4,8-雙(2-乙基己氧基)苯并[1,2-b:4,5-b’]二噻吩和Pd(PPh3)4(5mol%)各置入10ml的甲苯中,通過在110℃下回流并攪拌混合物24小時進行Stille偶聯。將混合物冷卻至室溫,并在真空下移除甲苯。所得物用正己烷和甲醇進行Soxhlet萃取,以移除副產物和低聚物,所得物在真空下用氯仿干燥萃取,以得到化學式1-1-7的化合物。
制備例8.化學式1-1-8的合成
具有與化學式14-d的化合物相同當量的9,9-二己基芴-2,7-二硼酸雙(1,3-丙二醇)酯、Pd(PPh3)4(5mol%)各置入10ml的甲苯中,進行Suzuki偶聯。將碳酸鈉水溶液(5ml)和乙醇(5ml)置入圓底燒瓶中,所得物在110℃氮氣氛下回流并攪拌24小時。
將混合物冷卻至室溫,向其中倒入去離子(DI)水,所得物用氯仿萃取。在真空下移除溶劑,所得物使用無水硫酸鈉干燥。所得物用正己烷和甲醇進行Soxhlet萃取,以移除副產物和低聚物,所得物在真空下用氯仿干燥萃取,以得到化學式1-1-8的化合物。
制備例9.化學式1-1-9的合成
將18ml的氯苯、以與實施例1中相同的方法制備的化合物(0.700g,0.5514mmol)(除了使用化學式9-b的化合物代替實施例1中(7)化學式1-i的制備方法中的2,6-雙(三甲基錫)-4,8-雙(2-乙基己氧基)苯并[1,2-b:4,5-b’]二噻吩)、化學式9-b的化合物(0.4987g,0.5514mmol)、三(二亞芐基丙酮)二鈀(0)(Pd2(dba)3,10mg)和三-(鄰甲苯基)膦(28mg)置入微波反應器瓶中,混合物在170℃條件下反應1小時。將混合物冷卻至室溫,倒入甲醇內,過濾固體。所濾得的固體用丙酮、己烷、二氯甲烷和氯仿進行Soxhlet萃取,通過再次在甲醇中沉淀氯仿部分而濾出固體。
產率:46%
數均分子量:32000g/mol
PDI:2.0
制備例10.化學式1-1-10的合成
將18ml的氯苯、以與實施例1中相同的方法制備的化合物(0.700g,0.5280mmol)(除了使用化學式9-b的化合物代替實施例1中(7)化學式1-i的制備方法中的2,6-雙(三甲基錫)-4,8-雙(2-乙基己氧基)苯并[1,2-b:4,5-b’]二噻吩)、化學式9-b的化合物(0.4776g,0.5280mmol)、三(二亞芐基丙酮)二鈀(0)(Pd2(dba)3,10mg)和三-(鄰甲苯基)膦(28mg)置入微波反應器瓶中,混合物在170℃條件反應1小時。將混合物冷卻至室溫,倒入甲醇內,過濾固體。所濾得的固體用丙酮、己烷、二氯甲烷和氯仿進行Soxhlet萃取,通過再次在甲醇中沉淀氯仿部分而濾出固體。
產率:48%
數均分子量:54000g/mol
PDI:1.8
制備例11.化學式1-1-11的合成
將18ml的氯苯、以與實施例1中相同的方法制備的化合物(0.700g,0.4932mmol)(除了使用化學式3-b的化合物代替實施例1中(7)化學式1-i的制備方法中的2,6-雙(三甲基錫)-4,8-雙(2-乙基己氧基)苯并[1,2-b:4,5-b’]二噻吩)、化學式3-b的化合物(0.4923g,0.4932mmol)、三(二亞芐基丙酮)二鈀(0)(Pd2(dba)3,10mg)和三-(鄰甲苯基)膦(28mg)置入微波反應器瓶中,混合物在170℃條件下反應1小時。將混合物冷卻至室溫,倒入甲醇內,過濾固體。所濾得的固體用丙酮、己烷、二氯甲烷和氯仿進行Soxhlet萃取,通過再次在甲醇中沉淀氯仿部分而濾出固體。
產率:48%
數均分子量:54000g/mol
PDI:1.8
制備例12.化學式1-1-12的合成
將18ml的氯苯、以與實施例1中相同的方法制備的化合物(0.700g,0.4258mmol)(除了使用化學式4-b的化合物代替實施例1中(7)化學式1-i的制備方法中的2,6-雙(三甲基錫)-4,8-雙(2-乙基己氧基)苯并[1,2-b:4,5-b’]二噻吩)、化學式4-b的化合物(0.5206g,0.4258mmol)、三(二亞芐基丙酮)二鈀(0)(Pd2(dba)3,10mg)和三-(鄰甲苯基)膦(28mg)置入微波反應器瓶中,混合物在170℃條件下反應1小時。將混合物冷卻至室溫,倒入甲醇內,過濾固體。所濾得的固體用丙酮、己烷、二氯甲烷和氯仿進行Soxhlet萃取,通過再次在甲醇中沉淀氯仿部分而濾出固體。
產率:47%
數均分子量:61000g/mol
PDI:1.6
制備例13.化學式1-1-13的合成
將18ml的氯苯、以與實施例1中相同的方法制備的化合物(0.700g,0.4685mmol)(除了使用化學式12-a的化合物代替實施例1中(7)化學式1-i的制備方法中的2,6-雙(三甲基錫)-4,8-雙(2-乙基己氧基)苯并[1,2-b:4,5-b’]二噻吩)、化學式12-a的化合物(0.5027g,0.4685mmol)、三(二亞芐基丙酮)二鈀(0)(Pd2(dba)3,10mg)和三-(鄰甲苯基)膦(28mg)置入微波反應器瓶中,混合物在170℃條件下反應1小時。將混合物冷卻至室溫,倒入甲醇內,過濾固體。所濾得的固體用丙酮、己烷、二氯甲烷和氯仿進行Soxhlet萃取,通過再次在甲醇中沉淀氯仿部分而濾出固體。
產率:32%
數均分子量:21000g/mol
PDI:2.3
制備例14.化學式1-1-14的合成
將12ml的氯苯、16-b(0.700g,0.6194mmol)、化學式9-b的化合物(0.560g,0.6194mmol)、三(二亞芐基丙酮)二鈀(0)(Pd2(dba)3,10mg)和三-(鄰甲苯基)膦(28mg)置入微波反應器瓶中,混合物在170℃條件下反應1小時。
將混合物冷卻至室溫,倒入甲醇內,過濾固體。所濾得的固體用丙酮、己烷、二氯甲烷和氯仿進行Soxhlet萃取,通過再次在甲醇中沉淀氯仿部分而濾出固體。
產率:43%
數均分子量:38000g/mol
PDI:1.9
圖36為示出溶液狀態的化學式1-1-14的UV-Vis吸收光譜的圖。
圖37為示出膜狀態的化學式1-1-14的UV-Vis吸收光譜的圖。
圖38示出化學式1-1-14的電化學(循環伏安法)測量結果。
圖39為示出化學式1-1-14的熱重分析(TGA)結果的圖。
制備例15.化學式1-1-15的合成
將8ml的氯苯、15-d(0.500g,0.3955mmol)、化學式2-b的化合物(0.3053g,0.3966mmol)、三(二亞芐基丙酮)二鈀(0)(Pd2(dba)3,10mg)和三-(鄰甲苯基)膦(28mg)置入微波反應器瓶中,混合物在170℃條件下反應1小時。將混合物冷卻至室溫,倒入甲醇內,過濾固體。所濾得的固體用丙酮、己烷、二氯甲烷和氯仿進行Soxhlet萃取,通過再次在甲醇中沉淀氯仿部分而濾出固體。
產率:47%
數均分子量:41000g/mol
PDI:2.1
圖40為示出溶液狀態的化學式1-1-15的UV-Vis吸收光譜的圖。
圖41為示出膜狀態的化學式1-1-15的UV-Vis吸收光譜的圖。
圖42示出化學式1-1-15的電化學(循環伏安法)測量結果。
圖43為示出化學式1-1-15的熱重分析(TGA)結果的圖。
制備例16.化學式1-1-16的合成
將8ml的氯苯、16-b(0.500g,0.4416mmol)、化學式2-b的化合物(0.3409g,0.4416mmol)、三(二亞芐基丙酮)二鈀(0)(Pd2(dba)3,10mg)和三-(鄰甲苯基)膦(28mg)置入微波反應器或管瓶中,混合物在170℃條件下反應1小時。將混合物冷卻至室溫,倒入甲醇內,過濾固體。所濾得的固體用丙酮、己烷、二氯甲烷和氯仿進行Soxhlet萃取,通過再次在甲醇中沉淀氯仿部分而濾出固體。
產率:44%
數均分子量:47000g/mol
PDI:1.8
圖44為示出溶液狀態的化學式1-1-16的UV-Vis吸收光譜的圖。
圖45為示出膜狀態的化學式1-1-16的UV-Vis吸收光譜的圖。
圖46示出化學式1-1-16的電化學(循環伏安法)測量結果。
圖47為示出化學式1-1-16的熱重分析(TGA)結果的圖。
制備例17.化學式1-1-17的合成
將8ml的氯苯、15-d(0.500g,0.3955mmol)、化學式9-b的化合物(0.3583g,0.3955mmol)、三(二亞芐基丙酮)二鈀(0)(Pd2(dba)3,10mg)和三-(鄰甲苯基)膦(28mg)置入微波反應器或管瓶中,混合物在170℃條件下反應1小時。將混合物冷卻至室溫,倒入甲醇內,過濾固體。所濾得的固體用丙酮、己烷、二氯甲烷和氯仿進行Soxhlet萃取,通過再次在甲醇中沉淀氯仿部分而濾出固體。
產率:39%。
數均分子量:49000g/mol
PDI:1.9
圖48為示出溶液狀態的化學式1-1-17的UV-Vis吸收光譜的圖。
圖49為示出膜狀態的化學式1-1-17的UV-Vis吸收光譜的圖。
圖50示出化學式1-1-17的電化學(循環伏安法)測量結果。
圖51為示出化學式1-1-17的熱重分析(TGA)結果的圖。
圖52為示出溶液狀態的化學式1-1-14至1-1-17的UV-Vis吸收光譜的圖。
圖53為示出膜狀態的化學式1-1-14至1-1-17的UV-Vis吸收光譜的圖。
圖54示出化學式1-1-14至1-1-17的電化學(循環伏安法)測量結果。
圖55為示出化學式1-1-14至1-1-17的熱重分析(TGA)結果的圖。符號
通過UV-Vis吸收光譜、電化學測量和熱重分析(TGA)測量的制備例14至17中制備的化學式1-1-14至1-1-17的物理性質如下表1中所示。
表1
表1中,Λonset表示膜狀態的吸光度,Egopt表示帶隙,Td表示熱分解溫度。
圖36、圖40、圖44和圖48的UV-Vis吸收光譜是通過使用UV-Vis吸收光譜儀分析來分析將化學式1-1-14、1-1-15、1-1-16或1-1-17溶于氯苯中以具有1wt%的濃度的樣品得到的。
圖37、圖41、圖45和圖49的UV-Vis吸收光譜是通過將化學式1-1-14、1-1-15、1-1-16或1-1-17溶于氯苯中以具有1wt%濃度的溶液滴在玻璃基底上,在1000rpm下旋涂60秒以制備樣品,在80℃下熱處理樣品,使用UV-Vis吸收光譜儀分析樣品而得到的。
圖38、圖42、圖46和圖50的電化學(循環伏安法)測量是通過三電極系統分析的,其中玻璃碳工作電極、Ag/Agcl參比電極和Pt電極放入將Bu4NBF4溶于乙腈以具有0.1M濃度的電解質溶液中。使用滴落涂布法將化學式1-1-14、1-1-15、1-1-16或1-1-17涂布在工作電極上。
圖39、圖43、圖47和圖51是示出化學式1-1-14至化學式1-1-17的熱重分析結果的圖,且圖39、圖43、圖47和圖51中溫度各意指化學式1-1-14、1-1-15、1-1-16或1-1-17以開始分析時的重量為100%計,損失5%時的溫度,即熱分解溫度(Td)。
實驗例1.有機太陽能電池的制造
通過將作為電子供體的制備例2至6、9和10的化合物以及作為電子受體的PC60BM以7:3的混合比(w/w比)溶于氯苯(CB)制備復合溶液。在此,將濃度調整至4.0wt%,有機太陽能電池采用ITO/PEDOT:PSS/光活性層/LiF/Al結構。使用蒸餾水、丙酮和2-丙醇超聲清洗涂布有ITO的玻璃基底,在臭氧處理ITO表面10分鐘之后,用PEDOT:PSS(baytrom P)旋涂表面至45nm的厚度,然后在120℃下熱處理10分鐘。為了涂布光活性層,使用0.45μm的PP注射過濾器過濾化合物-PCBM復合溶液,然后使用熱蒸發器在3×10-8托的真空下用Al旋涂并沉積至200nm的厚度,因此制得有機太陽能電池。
表2
在表2中,Voc意指開路電壓,Jsc意指短路電流,FF意指填充系數,且PCE意指能量轉換效率。開路電壓和短路電流各為電壓-電流密度曲線的四個象限中x軸和y軸截距,且隨著這兩個值的增加,太陽能電池的效率優選地增強。此外,填充系數是將曲線內所能繪出的矩型的面積除以短路電流與開路電壓的乘積所得的值。當這三個值除以輻射光可得到能量轉換效率,且該值優選較高。
圖25為示出根據實驗例1的有機太陽能電池的電流密度對電壓的圖。
圖26為示出根據實驗例2的有機太陽能電池的電流密度對電壓的圖。
圖27為示出根據實驗例3的有機太陽能電池的電流密度對電壓的圖。
圖28為示出根據實驗例4的有機太陽能電池的電流密度對電壓的圖。
圖29為示出根據實驗例5的有機太陽能電池的電流密度對電壓的圖。
圖30為示出根據實驗例6的有機太陽能電池的電流密度對電壓的圖。
圖31為示出根據實驗例7的有機太陽能電池的電流密度對電壓的圖。
圖32為示出根據實驗例8的有機太陽能電池的電流密度對電壓的圖。
圖33為示出根據實驗例9的有機太陽能電池的電流密度對電壓的圖。
圖34為示出根據實驗例10的有機太陽能電池的電流密度對電壓的圖。
實驗例2.有機太陽能電池的制造
通過以下表3中的混合比將作為電子供體的制備例14至17的化合物和作為電子受體的PC71BM溶解在氯苯(CB)中制備復合溶液。在此,添加3v/v%的添加劑二碘辛烷(DIO)。有機太陽能電池采用ITO/ZnO(溶膠-凝膠)/光活性層/MoO3/Ag結構。使用蒸餾水、丙酮和2-丙醇超聲清洗涂布有ITO的玻璃基底,臭氧處理ITO表面10分鐘之后,用混合物(其中將1g乙酸鋅脫水物和0.28g的乙醇胺添加至2-甲氧乙醇)在2000rpm下旋涂表面40秒至40nm的厚度,在200℃下退火一小時。為了涂布光活性層,使用0.45μm的PP注射濾器過濾化合物-PCBM復合溶液,然后在800rpm下旋涂40秒,在2×10-6托的真空下以將MoO3沉積至10nm的厚度且以將Ag沉積至100nm的厚度,因此,制造有機太陽能電池。
表3
在表3中,Voc意指開路電壓,Jsc意指短路電流,FF意指填充系數,且PCE意指能量轉換效率。開路電壓和短路電流各為電壓-電流密度曲線的四個象限中x軸和y軸截距,且隨著這兩個值的增加,太陽能電池的效率優選地增強。此外,填充系數是將曲線內所能繪出的矩型的面積除以短路電流與開路電壓的乘積所得的值。當這三個值除以輻射光可得到能量轉換效率,且該值優選較高。
圖35為示出根據實驗例11至14的有機太陽能電池的電流密度對電壓的圖。
參考數字
101:基底
102:第一電極
103:空穴傳輸層
104:光活性層
105:第二電極
- 還沒有人留言評論。精彩留言會獲得點贊!