葡萄糖1-磷酸的制備方法與流程
本發明涉及葡萄糖1-磷酸的制備方法,尤其涉及無細胞多酶催化將淀粉以及淀粉衍生物轉化為葡萄糖1-磷酸的方法,屬于葡萄糖 1-磷酸的酶催化生產領域。
背景技術:
在生物體中,葡萄糖1-磷酸(G 1-P)是通過葡聚糖磷酸化酶催化糖原,淀粉或者麥芽糊精等多糖和無機磷酸鹽反應產生的,它是糖異生途徑的第一個代謝物,可以在葡萄糖磷酸變位酶(PGM,EC 5.4.2.2)的作用下生成葡萄糖-6-磷酸,進入糖酵解或者其他代謝途徑。作為一種活化葡萄糖,G 1-P在復合糖化合物(比如糖脂,寡糖,糖核苷酸)的合成中是一種重要的前體。此外,該化合物還可以用于合成人工淀粉,通過生物糖電池產生電力,以及高得率產氫。據報道,G 1-P具有抗炎以及免疫抑制治療效果,其鈣鹽具有抗癌作用,因此,G 1-P還具有潛在的醫療應用價值。迄今為止,葡萄糖 1-磷酸的應用仍未得到充分發掘,這可能緣于其過高的生產成本。
由于葡萄糖1-磷酸具有很高的極性,很難通過完整的細胞膜,葡萄糖1-磷酸通常是通過多糖磷酸化酶催化相應的二糖、寡糖或者多糖得到的。然而, 過去單純使用多糖磷酸化酶催化生產葡萄糖1-磷酸的方法具有很多不足。比如說,以二糖(蔗糖,海藻糖或者纖維二糖)作為底物時,首先二糖的價格可能遠高于淀粉,以蔗糖為例,其以葡萄糖計算的葡萄糖1-磷酸的理論最大得率只有50%,同時生產過程中會伴隨著果糖的產生,造成分離成本很高。雖然麥芽糊精以及淀粉的成本比二糖低,但是底物中α-1,6糖苷鍵的存在導致葡聚糖磷酸化酶不能與底物充分反應,同時葡聚糖磷酸化酶的底物選擇傾向于麥芽四糖或者更長的寡糖,麥芽糖以及葡萄糖不能作為葡聚糖磷酸化酶的底物,這些原因都會導致以麥芽糊精或者淀粉作為底物時,產品得率低。比如Weinhausel于1995年以40 g/L麥芽糊精作為底物,使用來源于Corynebacterium callunae的葡聚糖磷酸化酶催化生產葡萄糖1-磷酸的產量為65 mM,轉化率僅為49%(該轉化率為無水葡萄糖 1-磷酸二鈉相對于淀粉的質量轉化率,下同),Bae于2005年以50 g/L可溶性淀粉作為底物,使用來源于Thermus caldophilus GK24葡聚糖磷酸化酶生產葡萄糖 1-磷酸的產量為132 mM,轉化率為80%。
技術實現要素:
本發明所要解決的技術問題是提供一種葡萄糖 1-磷酸的酶催化轉化方法,通過無細胞多酶催化淀粉以及淀粉的衍生物生產葡萄糖 1-磷酸的方法,該方法具有葡萄糖 1-磷酸產率和轉化率高,生產成本低等優點。
為解決上述技術問題,本發明所采取的技術方案是:
本發明首先公開了一種葡萄糖 1-磷酸的制備方法,包括以下步驟:
(1)以淀粉或淀粉衍生物為底物,加入分支酶,葡聚糖磷酸化酶(α-Glucan phosphorylase,EC 2.4.1.1),葡聚糖轉移酶(4-a-glucanotransferase,EC 2.4.1.25)或者麥芽糖磷酸化酶(maltose phosphorylase,EC 2.4.1.8)建立多酶反應體系,進行酶催化反應;(2)將反應產物進行分離、純化,即得。
其中,步驟(1)所述底物的濃度為10 g/L;所述去分支酶為異淀粉酶(isoamylase,EC 3.2.1.68)或普魯蘭酶(pullulanase,EC 3.2.1.41)中的任意一種或兩種,所述葡聚糖磷酸化酶的用量為0.05 U/mL,所述麥芽糖磷酸化酶(maltose phosphorylase,EC 2.4.1.8)或葡聚糖轉移酶(EC 2.4.1.25)的用量為1 U/mL,所述酶催化反應的條件是在20-90℃反應2-100小時;優選為,在70℃反應40小時。
更優選的,所述底物的濃度為10 g/L;所述葡聚糖磷酸化酶的用量為5U/mL,所述淀粉去分支酶的用量為1U/mL,所述麥芽糖磷酸化酶或葡聚糖轉移酶的用量為1U/mL;
所述酶催化反應在20-100℃反應2-100小時;優選的,所述酶催化反應在20-90℃反應40小時;最優選的,所述酶催化反應在70℃反應40小時。
所述多酶反應體系還含有以下各成分:磷酸緩沖液、二價鎂離子;優選的,各成分的用量為:磷酸鹽200 mM,二價鎂離子5 mM;其中,所述緩沖液優選為磷酸鹽緩沖液,更優選的,緩沖液的pH值7.2。
反應結束后,殘余的淀粉殘渣將是低分叉淀粉,此時可加入少量的α淀粉酶 (EC 3.2.1.1)促進淀粉殘渣的水解,進一步提高葡萄糖 1-磷酸的得率。優選的α淀粉酶的用量為0.1 U/ml。
本發明以淀粉或淀粉衍生物為底物,以葡聚糖磷酸化酶作為反應核心酶,通過添加分支酶,葡聚糖轉移酶(EC 2.4.1.25)或者麥芽糖磷酸化酶(maltose phosphorylase,EC 2.4.1.8)建立高得率的葡萄糖1-磷酸反應體系,而高得率可以大大降低最終葡萄糖 1-磷酸的分離成本。
由于淀粉是直鏈淀粉和支鏈淀粉的混合物。支鏈淀粉中的支鏈是以α-1,6糖苷鍵與主鏈相連的,而葡聚糖磷酸化酶并不能分解α-1,6糖苷鍵。為了提高葡萄糖 1-磷酸的轉化率,本發明在多酶反應體系中加入了能夠分解淀粉中α-1,6糖苷鍵的去分支酶—異淀粉酶或普魯蘭酶。由于葡聚糖磷酸化酶水解淀粉的最終產物是麥芽糖,為了利用麥芽糖,本發明還在反應體系中加入(4-a-glucanotransferase, EC 2.4.1.25),該酶可以將短鏈的寡聚糖聚合成為長鏈的寡聚糖,而該長鏈的寡聚糖又可被葡聚糖磷酸化酶重新利用,從而能夠提高淀粉的利用率。將麥芽糖分解為葡萄糖-1-磷酸和葡萄糖;在這里,葡聚糖轉移酶可部分被麥芽糖磷酸化酶替換。
本發明所述淀粉及淀粉衍生物包括未水解淀粉,部分水解淀粉、淀粉糊精、麥芽糊精、麥芽多糖或麥芽糖中的任意一種或多種。
本發明多酶反應體系中的任何一種酶還可以為任何一種具有同等功能的酶所替換,優選為通過蛋白質工程改造所獲得的具有同等功能的突變酶。
本發明體外多酶催化將淀粉轉化為葡萄糖 1-磷酸試驗中,在一個反應體系中,以可溶性淀粉為原料,加入葡聚糖磷酸化酶,最終葡萄糖 1-磷酸的轉化率為67%。在上述反應體系中另外加入異淀粉酶,葡聚糖轉移酶,同時提高葡聚糖磷酸化酶的用量,最終葡萄糖 1-磷酸的轉化率達到114%,轉化率顯著提高。
本發明技術方案與現有技術相比,具有以下有益效果:
本發明在一個多酶反應體系中,以淀粉以及它們的衍生物為原料,通過體外多酶催化轉化為葡萄糖 1-磷酸,并通過過程優化,添加能促進淀粉水解的酶以及利用副產物(麥芽糖)的酶,使轉化效率顯著提高,高得率降低葡萄糖 1-磷酸的分離成本。本發明方法具有簡便,原料利用率高、葡萄糖 1-磷酸產率高,生產成本低,等優點,可以實現葡萄糖 1-磷酸的規模化生產。
本發明所涉及到的術語及定義
除非另外定義,否則本文所用的所有技術及科學術語都具有與本發明所屬領域的普通技術人員通常所了解相同的含義。
術語“酶催化反應”意指在生物催化劑-酶作用下進行的化學反應。
術語“葡萄糖多聚物”意指葡萄糖分子聚合而成的未水解淀粉。
術語“葡萄糖寡聚物”意指部分水解的淀粉、淀粉糊精、麥芽多糖、麥芽糖等。
文中所涉及的轉化率為葡萄糖1-磷酸二鈉(無水)相對于淀粉的質量轉化率(w/w*100%)
附圖說明
圖1為轉化淀粉生成葡萄糖 1-磷酸的無細胞多酶催化途徑1的示意圖;其中,IA,異淀粉酶;PA,普魯蘭酶;αGP,葡聚糖磷酸化酶;4GT,葡聚糖轉移酶;
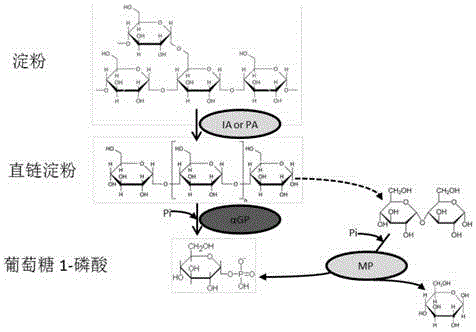
圖2為轉化淀粉生成葡萄糖 1-磷酸的無細胞多酶催化途徑2的示意圖;其中,IA,異淀粉酶;PA,普魯蘭酶;αGP,葡聚糖磷酸化酶;MP,麥芽糖磷酸化酶。
圖3為SDS-PAGE檢測3個關鍵酶;其中,第1列,異淀粉酶;第2列,葡聚糖磷酸化酶;第3列,葡聚糖轉移酶。
圖4為利用HPLC分析葡萄糖 1-磷酸;其中,圖3為用HPLC方式區分葡萄糖 1-磷酸、葡萄糖、磷酸。
圖5為利用HPLC檢測以可溶性淀粉為底物,經過酶促反應后的產物,箭頭所指表示葡萄糖 1-磷酸的特征峰。
圖6為利用HPLC檢測以麥芽糊精為底物,經過酶促反應后的產物,箭頭所指表示葡萄糖 1-磷酸的特征峰。
圖7為不同酶的組合生產葡萄糖 1-磷酸的生產曲線。其中,IA,異淀粉酶;αGP,葡聚糖磷酸化酶;4GT,葡聚糖轉移酶。
具體實施方式
下面結合具體實施例來進一步描述本發明,本發明的優點和特點將會隨著描述而更為清楚。但是應理解所述實施例僅是范例性的,不對本發明的范圍構成任何限制。本領域技術人員應該理解的是,在不偏離本發明的精神和范圍下可以對本發明技術方案的細節和形式進行修改或替換,但這些修改或替換均落入本發明的保護范圍。
實驗材料
可溶性淀粉,soluble starch,ACROS公司產品,產品編號:424490020;
玉米淀粉,corn starch, Sigma購買,產品編號:S4126-2KG
麥芽糊精,ALDRICH公司產品,產品編號:419672;
pET20b載體,Novagen,Madison,WI, USA;
大腸桿菌表達菌BL21(DE3),Invitrogen,Carlsbad,CA, USA;
本發明中的大部分酶(除了葡聚糖轉移酶)能在Sigma公司購買得到;但是都可以按照基因工程方法通過原核生物基因表達獲得;
麥芽糖磷酸化酶可從Sigma公司購買,產品編號為M8284;
α淀粉酶從Sigma公司購買,產品編號為10065;
葡萄糖(HK)測定試劑盒,Sigma公司購買,產品編號為GAHK20-1KT。
實驗例1體外多酶催化將淀粉轉化為葡萄糖 1-磷酸,提高淀粉轉化率
通過一個體外多酶催化體系將淀粉轉化為葡萄糖 1-磷酸(圖1)。這些關鍵酶包括:(1)分支酶IA;(2)葡聚糖磷酸化酶(αGP,EC 2.4.1.1),從淀粉上釋放出葡萄糖-1-磷酸;(3)葡聚糖轉移酶(4-a-glucanotransferase,EC 2.4.1.25)。
由于淀粉是有分支鏈,單純采用葡聚糖磷酸化酶并不能完全將淀粉水解,因為葡聚糖磷酸化酶只會作用于α-1,4糖苷鍵,而分支鏈是以α-1,6糖苷鍵與主鏈連接的。這需要加入異淀粉酶(isoamylase,EC 3.2.1.68)水解α-1,6糖苷鍵。由于葡聚糖磷酸化酶的最小底物是麥芽三糖,為了提升麥芽糊精的利用效率,加入葡聚糖轉移酶,該酶可以將短鏈的寡聚糖聚合成為長鏈的寡聚糖,從而進一步提升淀粉的利用效率。
在本發明中,異淀粉酶來源于Sulfolobus tokodaii,基因在KEGG上的編號為ST0928,該菌株的基因組DNA是德國Albert-Ludwigs-Universit?t Freiburg的Georg Fuchs教授友情提供; 葡聚糖磷酸化酶來源于Thermotoga maritima,基因在KEGG上的編號為TM1168;葡聚糖轉移酶來源于Thermococcus litoralis,基因在KEGG上的編號為OCC10078。以上基因組DNA都可從ATCC的官方網站(www.atcc.org)上獲得,基因可用引物從相應的基因組DNA中通過PCR獲取,并通過Simple Cloning(You, C., et al. (2012). "Simple Cloning via Direct Transformation of PCR Product (DNA Multimer) to Escherichia coli and Bacillus subtilis." Appl. Environ. Microbiol. 78(5): 1593-1595.)的方法克隆至pET20b載體(Novagen, Madison, WI, USA)中,獲得相應的表達載體pET20b-StIA,pET20b-TmaGP, pET20b-Ti4GF。這三個質粒都轉化至大腸桿菌表達菌BL21(DE3) (Invitrogen, Carlsbad, CA)中,并進行蛋白質表達與純化,蛋白質純化的結果如圖2所示。
反應分別在三個0.75毫升的反應體系中進行,反應體系一含有200 mM的磷酸緩沖液(pH 7.2),10 g/L 可溶性淀粉, 5 mM的二價鎂離子,1U/ml的葡聚糖磷酸化酶;反應體系二中含有200 mM的磷酸緩沖液(pH 7.2),10 g/可溶性淀粉,5 mM的二價鎂離子,1 U/ml 的異淀粉酶,1 U/ml的葡聚糖磷酸化酶;反應體系三中含有200 mM的磷酸緩沖液(pH 7.2),10 g/L 可溶性淀粉,5 mM的二價鎂離子,1 U/ml 的異淀粉酶,1 U/ml的葡聚糖磷酸化酶,1 U/ml 的葡聚糖轉移酶。反應在60℃進行催化反應,反應40個小時。
根據保持時間的不同,HPLC可以用來區分反應液中的葡萄糖 1-磷酸、葡萄糖、磷酸;HPLC的流動相為5 mM的稀硫酸。
葡萄糖1-磷酸可使用葡萄糖磷酸變位酶偶聯葡萄糖6-磷酸脫氫酶測定NADH的增加。具體方法為:450 μL反應體系中含有10 mM Mg2+ ,20 U/mL 葡萄糖磷酸變位酶(PGM),葡萄糖1-磷酸待測樣品,400 μL葡萄糖(HK)測定試劑盒測定液,37℃反應20 min,NADH的增加在340 nm下檢測。
反應結束后,在第一個反應體系中葡萄糖 1-磷酸(圖4)的終濃度是3.7g/L,轉化率為37%;第二個反應體系中葡萄糖 1-磷酸(圖4)的終濃度是5.2 g/L,轉化率為52 %;第三個反應體系中葡萄糖1-磷酸(圖4)的終濃度為8.2 g/L,轉化率為82%。
實驗例2體外多酶催化將淀粉轉化為葡萄糖 1-磷酸
異淀粉酶、葡聚糖磷酸化酶、葡聚糖轉移酶的制備同實驗例1。
在一個0.75毫升的反應體系中含有200 mM的磷酸緩沖液(pH 7.2),5 mM的二價鎂離子,0.05 U/mL的葡聚糖磷酸化酶,1 U/mL的異淀粉酶,和1 U/mL的葡聚糖轉移酶,10 g/L的可溶性淀粉,在40℃進行催化反應,反應40個小時。
反應結束后,最終葡萄糖 1-磷酸的終濃度是2.2 g/L,轉化率為22 %。
實驗例3體外多酶催化將淀粉轉化為葡萄糖 1-磷酸
異淀粉酶、葡聚糖磷酸化酶、葡聚糖轉移酶的制備同實驗例1。
在一個0.75毫升的反應體系中含有200 mM的磷酸緩沖液(pH 7.2),5 mM的二價鎂離子,0.05 U/mL的葡聚糖磷酸化酶,1 U/mL的異淀粉酶,和1 U/mL的葡聚糖轉移酶,10 g/L的可溶性淀粉,在80℃進行催化反應,反應40個小時。
反應結束后,最終葡萄糖 1-磷酸的終濃度是12.1 g/L,轉化率為121%。
實驗例4通過過程優化和添加促進葡萄糖轉換的酶,利用體外多酶催化將淀粉轉化為葡萄糖 1-磷酸
葡聚糖磷酸化酶、葡聚糖轉移酶的制備同實驗例1;普魯蘭酶(pullulanase,EC 3.2.1.41)從Sigma公司購買,產品編號為P1067;麥芽糖磷酸化酶從Sigma公司購買,產品編號為M8284。
由于從sigma公司購買的普魯蘭酶不能在高溫(80oC)下反應,因此先在37oC用普魯蘭酶處理可溶性淀粉,隨后再加入其他的酶,再在80oC反應。
在一個0.75毫升的反應體系中含有200 mM的磷酸緩沖液(pH 7.2),5 mM的二價鎂離子,1 U/mL的普魯蘭酶, 10 g/L的可溶性淀粉,在37℃進行催化反應,反應10個小時后加入5 U/mL的葡聚糖磷酸化酶,1 U/mL的麥芽糖磷酸化酶,在80℃進行催化反應,反應40個小時。最終葡萄糖 1-磷酸(圖4)的終濃度為11.7g/L,轉化率達到了117%。
隨后在反應體系中加入少量的α淀粉酶促進殘渣淀粉的水解,提高葡萄糖 1-磷酸的產量,α淀粉酶的用量為0.1 U/ml,反應先在37oC反應6小時,隨后繼續在80oC反應24小時,最終葡萄糖 1-磷酸(圖4)的終濃度為120 g/L,轉化率達到了120 %。
實驗例6體外多酶催化將麥芽糊精轉化為葡萄糖 1-磷酸
異淀粉酶、葡聚糖磷酸化酶,葡聚糖轉移酶的制備同實驗例1,麥芽糖磷酸化酶從Sigma公司購買,產品編號為M8284;
在一個0.75毫升的反應體系中含有200 mM的磷酸緩沖液(pH 7.2),5 mM的二價鎂離子,5 U/mL的葡聚糖磷酸化酶, 1 U/mL的異淀粉酶, 1 U/mL的葡聚糖轉移酶,10 g/L的麥芽糊精(ALDRICH公司產品,產品編號419672),在80℃進行催化反應,反應40個小時。最終葡萄糖 1-磷酸(圖5)的終濃度為121 g/L,轉化率達到了121 %。
實驗例7體外多酶催化將高濃度未水解玉米淀粉轉化為葡萄糖 1-磷酸
異淀粉酶、葡聚糖磷酸化酶,葡聚糖轉移酶的制備同實驗例1,麥芽糖磷酸化酶從Sigma公司購買,產品編號為M8284;
在一個0.75毫升的反應體系中含有1 M的磷酸緩沖液(pH 7.2),5 mM的二價鎂離子,10 U/mL的葡聚糖磷酸化酶, 1 U/mL的異淀粉酶, 2 U/mL的葡聚糖轉移酶,50 g/L的玉米淀粉,在70℃進行催化反應,反應40個小時。最終葡萄糖 1-磷酸(圖7)的終濃度為60.8 g/L,轉化率達到了122%。
- 還沒有人留言評論。精彩留言會獲得點贊!