一種無定型來那替尼或其藥學上可接受的鹽與藥用輔料的固體分散體及其制備方法與流程
本發明屬于藥物制劑領域,具體涉及一種無定型來那替尼和無定型來那替尼馬來酸鹽,還涉及一種無定型來那替尼或其在藥學上可接受的鹽與藥用輔料的固體分散體,又涉及一種含有無定型來那替尼或其在藥學上可接受的鹽與藥用輔料的藥用組合物及其制備方法。
背景技術:
來那替尼(Neratinib,又稱HKI-272),化學名為(2E)-N-[4-[[3-氯-4-[(吡啶-2-基)甲氧基]苯基]氨基]-3-氰基-7-乙氧基喹啉-6-基]-4-(二甲基氨基)丁-2-烯酰胺,是Wyeth公司開發的一種不可逆表皮生長因子受體(EGFR)抑制劑。來那替尼是繼拉帕替尼之后針對HER2和HER1多靶點的小分子酪氨酸激酶抑制劑,是一種不可逆的泛ErbB受體酪氨酸激酶抑制劑,能選擇性抑制EGFR家族中HER-1和HER-2(IC50分別為92nmol/L和59nmol/L)。臨床研究表明,它對非小細胞肺癌、結腸癌、乳腺癌均有明顯治療效果。
雖然來那替尼的療效顯著,但仍然存在一些缺陷。專利US008173814B2公開了來那替尼馬來酸鹽的三種晶型:Form I(無水來那替尼馬來酸鹽)、Form II型(一水合來那替尼馬來酸鹽)和Form III(部分水合來那替尼馬來酸鹽),但并未見無定型的報道。該藥物用于制劑的是馬來酸鹽晶型Form II,雖然Form II是熱力學穩定的晶型,穩定型良好,但從該晶型在水中的溶解度極低,近弱酸性條件下,溶解度僅為0.43毫克/毫升。因此,該藥物為難溶性藥物,其極低的水溶性嚴重影響了藥物的生物利用度。
藥物的固體形態直接影響原料藥的溶解速率、制劑的溶出度和生物利用度,為了提高藥物的生物利用度,降低用量、降低毒副作用,通常會開發藥物的新的固體形態,因此,開發該藥物溶解性更好、生物利用度更高的固體形式就顯得很有必要。
藥物的固體形態除晶態外,還有無定型狀態,藥物的無定型狀態作為固體物質的一種特殊形態,在藥物制備中有著重要的用途。無定型態藥物不僅可以廣泛應用于藥物制劑中,而且可以通過多種技術手段和方法提高無定型態藥物的穩定性,使之成為具有優良品質的藥物。
由于來那替尼在生物利用度方面的不足和無定型藥物活性成分在藥物制劑方面的良好的應用前景,尋找新的無定型來那替尼及其制備方法就顯得十分必要。
技術實現要素:
本發明的目的是提供一種來那替尼或其藥學上可接受的鹽與藥用輔料的固體分散體及其制備方法,得到穩定性及分散性良好的無定型態的來那替尼或其藥學上可接受的鹽與藥用輔料的固體分散體,增加了來那替尼或其鹽的溶出度,該制備方法不受干燥過程的限制,也不受溶劑種類和溶劑量的限制,操作簡便,成本低廉,易于實現,可實現工業化生產。
為了達到上述目的,本發明的技術方案如下:
一種無定型來那替尼,制備方法包括如下步驟:
1)將來那替尼用溶劑溶解后,溶解溫度為-50~150℃,形成含來那替尼的溶液,其中,來那替尼與溶劑的重量比為0.001~100:1;
2)除去步驟1)得到的溶液中的溶劑,或將步驟1)得到的溶液迅速降溫,又或者快速加入不良溶劑,進行析晶,得到來那替尼的無定型形態。
又,步驟1)所述溶劑選自含12個以下碳原子的醇類、酚類、醚類、鹵代烴、酮類、醛類、腈類、酰胺、砜、亞砜、羧酸和水中的至少一種,步驟2)除去溶劑的方法包括:蒸發、真空蒸發、噴霧干燥、冷凍干燥、熱熔擠出、過濾、離心或攪拌薄膜干燥。
一種無定型來那替尼馬來酸鹽,制備方法包括如下步驟:
1)將來那替尼馬來酸鹽用溶劑溶解后,溶解溫度為-50~150℃,形成含來那替尼馬來酸鹽的溶液,其中,來那替尼或其藥學上可接受的鹽與溶劑的重量比為0.001~100:1;
2)除去步驟1)得到的溶液中的溶劑,或將步驟1)得到的溶液迅速降溫,又或者快速加入不良溶劑,進行析晶,得到來那替尼馬來酸鹽的無定型形態。
又,步驟1)所述溶劑選自含12個以下碳原子的醇類、酚類、醚類、鹵代烴、酮類、醛類、腈類、酰胺、砜、亞砜、羧酸和水中的至少一種,步驟2)除去溶劑的方法包括:蒸發、真空蒸發、噴霧干燥、冷凍干燥、熱熔擠出、過濾、離心或攪拌薄膜干燥。
一種來那替尼或其藥學上可接受的鹽與藥用輔料的固體分散體,該固體分散體包含來那替尼或其藥學上可接受的鹽與藥用輔料,兩者的重量比為1:0.1~100,其中,所述的來那替尼或其藥學上可接受的鹽為無定型態,所述固體分散體的X-射線粉末衍射光譜中,扣除藥用輔料的背景峰后無來那替尼或其鹽的晶體的特征峰。
進一步,所述藥用輔料選自稀釋劑、潤滑劑、粘合劑、崩解劑、表面活性劑、成膜材料、包衣材料和膠囊材料中的至少一種。
優選地,所述的藥用輔料選自羥丙甲基纖維素、羥丙基纖維素、聚維酮,聚乙二醇、乙基纖維素、脂質體、甲基丙烯酸共聚物、聚醋酸乙烯、羧甲基乙基纖維素、羧甲基纖維素鄰苯二甲酸酯、羥丙甲基纖維素鄰苯二甲酸酯、羥丙甲基纖維素醋酸酯琥珀酸酯、聚丙烯酸樹脂、聚羧乙烯、藻酸鹽、卡拉膠、羧基乙酸內酯、樹膠、聚乙烯醇、預膠化淀粉、交聯淀粉、羧甲基淀粉鈉、糊精、聚環氧乙烷、殼聚糖、幾丁聚糖、離子交換樹脂和膠原蛋白中的至少一種。
本發明的來那替尼或其藥學上可接受的鹽與藥用輔料的固體分散體的制備方法,包括如下步驟:
1) 將來那替尼或其藥學上可接受的鹽和藥用輔料混合,加熱至藥用輔料熔融;其中,來那替尼或其藥學上可接受的鹽與藥用輔料的重量比為1:0.1~100;
2) 混合均勻后冷卻,將混合物粉碎,得到無定型態的來那替尼或其藥學上可接受的鹽與藥用輔料的固體分散體。
進一步,所述藥用輔料選自稀釋劑、潤滑劑、粘合劑、崩解劑、表面活性劑、成膜材料、包衣材料和膠囊材料中的至少一種。
優選地,步驟1)中所述的藥用輔料選自羥丙甲基纖維素、羥丙基纖維素、聚維酮,聚乙二醇、乙基纖維素、脂質體、甲基丙烯酸共聚物、聚醋酸乙烯、羧甲基乙基纖維素、羧甲基纖維素鄰苯二甲酸酯、羥丙甲基纖維素鄰苯二甲酸酯、羥丙甲基纖維素醋酸酯琥珀酸酯、聚丙烯酸樹脂、聚羧乙烯、藻酸鹽、卡拉膠、羧基乙酸內酯、樹膠、聚乙烯醇、預膠化淀粉、交聯淀粉、羧甲基淀粉鈉、糊精、聚環氧乙烷、殼聚糖、幾丁聚糖和膠原蛋白中的至少一種。
本發明提供另一種來那替尼或其藥學上可接受的鹽與藥用輔料的固體分散體的制備方法,包括如下步驟:
1) 將來那替尼或其藥學上可接受的鹽和藥用輔料在溶劑中混合,混合溫度為-50~150℃,形成含來那替尼或其鹽和藥用輔料的溶液或懸浮液,其中,來那替尼或其藥學上可接受的鹽與溶劑的重量比為0.001~100:1,來那替尼或其藥學上可接受的鹽與藥用輔料的重量比為1:0.1~100;
2) 除去步驟1)得到的溶液或懸浮液中的溶劑,得到無定型態的來那替尼或其藥學上可接受的鹽與藥用輔料的固體分散體。
進一步,所述藥用輔料選自稀釋劑、潤滑劑、粘合劑、崩解劑、表面活性劑、成膜材料、包衣材料和膠囊材料中的至少一種。
優選地,步驟1)中所述的藥用輔料選自羥丙甲基纖維素、羥丙基纖維素、聚維酮、微晶纖維素、聚乙二醇、乙基纖維素、脂質體、甲基丙烯酸共聚物、聚醋酸乙烯、羧甲基乙基纖維素、羧甲基纖維素鄰苯二甲酸酯、羥丙甲基纖維素鄰苯二甲酸酯、羥丙甲基纖維素醋酸酯琥珀酸酯、聚丙烯酸樹脂、聚羧乙烯、藻酸鹽、卡拉膠、羧基乙酸內酯、樹膠、聚乙烯醇、預膠化淀粉、交聯淀粉、羧甲基淀粉鈉、糊精、聚環氧乙烷、殼聚糖、幾丁聚糖、離子交換樹脂和膠原蛋白中的至少一種。
又,步驟1)所述溶劑選自含12個以下碳原子的醇類、酚類、醚類、鹵代烴、酮類、醛類、腈類、酰胺、砜、亞砜、羧酸和水中的至少一種,步驟2)除去溶劑的方法包括:蒸發、真空蒸發、噴霧干燥、冷凍干燥、熱熔擠出、過濾、離心或攪拌薄膜干燥。
本發明中的固體分散體是指混合物、復合物、共聚物、共沉淀物、共晶、固體分散體、溶劑合物和水合物。
本發明的來那替尼或其藥學上可接受的鹽與藥用輔料的固體分散體,使用Cu-Kα輻射,以度2θ表示的X-射線粉末衍射光譜中扣除藥用輔料的背景峰無來那替尼結晶態的特征峰,表明來那替尼或其藥學上可接受的鹽為無定型狀態。現有技術中一般使用來那替尼的結晶態,未見其無定型態的報道。一般由于晶態物質分子的有序和周期性排列,降低了分子間相互作用的能量,能量較低,而本發明的來那替尼或其藥學上可接受的鹽為無定型態,分子處于高度無序狀態,物質的表面自由能更大,固體物質中的分子較晶態固體物質中的分子有更高的能量,更容易分散,增加其溶出度,提高來那替尼或其鹽的生物利用度。
本發明將來那替尼或其藥學上可接受的鹽和藥用輔料混合均勻后,使用“固體分散劑”法,通過藥用輔料的多聚體網狀結構將藥物分子阻隔,抑制結晶的發生,使其保持分散和無定型狀態。本發明采用應用廣泛、價格低廉、溶解性好的藥用輔料,這些藥用輔料與來那替尼或其藥學上可接受的鹽混合,配合蒸發、噴霧干燥、冷凍干燥和熱熔擠出等技術可以得到來那替尼或其藥學上可接受的鹽的無定型形式,增加本發明來那替尼或其藥學上可接受的鹽的固體分散體中的來那替尼或其藥學上可接受的鹽的無定型態的穩定性。
本發明選用在藥學上應用廣泛的、價格低廉的輔料,得到來那替尼或其藥學上可接受的鹽與藥用輔料的固體分散體,易于開發制劑配方,本發明的制備方法不受干燥過程的限制,也不受溶劑種類和溶劑量的限制,操作簡便,成本低廉,易于實現,可實現工業化生產。
與現有技術相比,本發明的有益效果是:
1) 本發明制備的無定型來那替尼和無定型來那替尼馬來酸鹽具有較好的穩定性,與晶型相比,具有更高的溶解度和溶出速度,更有利于機體對藥物的吸收,提高藥物的生物利用度,使藥物能夠更好地發揮臨床疾病治療作用。
2) 本發明制備的無定型來那替尼或其鹽與藥用輔料的固體分散體具有高度分散性及穩定性,在制成固體制劑后,經過崩解可使藥物粒子的分散程度更好,分散及溶出速度更快,有利于藥物的吸收。因此,無定型狀態藥物的溶出度明顯增加,更有利于機體對藥物的吸收,提高藥物的生物利用度,使藥物能夠更好地發揮臨床疾病治療作用。
3) 本發明無定型狀態的來那替尼或其藥學上可接受的鹽與藥用輔料的固體分散體的制備方法不受干燥過程的限制,也不受溶劑種類和溶劑量的限制,操作簡便,成本低廉,易于實現,可實現工業化生產。
4) 本發明制備的無定型狀態的來那替尼或其鹽與藥用輔料的固體分散體在加速試驗條件下(40±2℃,濕度75%±5%),能保持良好的物理穩定性和化學穩定性。因此,本發明將會有廣闊的應用前景。
附圖說明
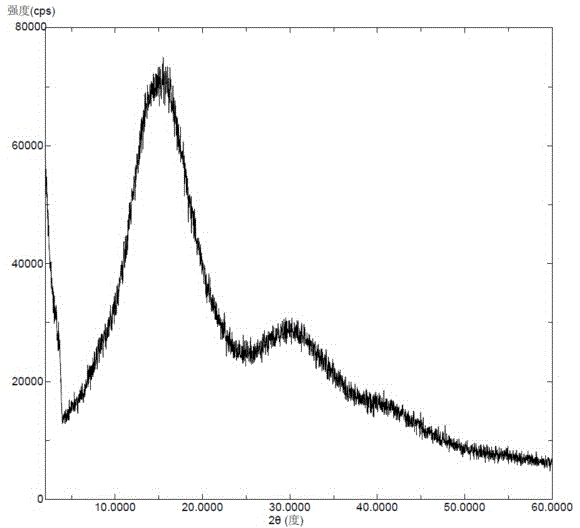
圖1為本發明實施例1的無定型來那替尼的X-射線粉末衍射圖。
圖2為本發明實施例2的無定型來那替尼馬來酸鹽的X-射線粉末衍射圖。
圖3為本發明實施例3的無定型來那替尼和聚維酮-K30的固體分散體的X-射線粉末衍射圖。
具體實施方式
以下結合具體實施例對本發明作進一步說明,但本發明的保護范圍不受以下實施例的限制。
本發明所述的X-射線粉末衍射圖在Ultima IV X-射線衍射儀上采集。本發明所述的X-射線粉末衍射的方法參數如下:
X-射線粉末參數:Cu-Kα
Kα(?):1.5418
電壓:40千伏
電流:40毫安
發散狹縫:自動
掃描模式:連續
掃描范圍:自2.0至60.0度
取樣步長:0.0200度
掃描速率:60度/分鐘
實施例1
將來那替尼(50毫克)溶于正丙醇(600微升)和水(900微升)中,加熱到60℃攪拌溶清。將上述溶液迅速降溫到-10℃,析出白色固體,過濾,干燥,得到無定型來那替尼游離堿, X-射線粉末衍射圖如圖1所示,X-射線粉末衍射圖中無來那替尼晶型的特征峰。
實施例2
將來那替尼馬來酸鹽(50毫克)溶于乙醇(600微升)和水(600微升)中,在40℃下攪拌混合均勻。將上述溶液在旋轉蒸發器中緩慢濃縮至干,得到白色固體,得到無定型來那替尼馬來酸鹽,X-射線粉末衍射圖如圖2所示,X-射線粉末衍射圖中無來那替尼馬來酸鹽晶型的特征峰。
實施例3
將來那替尼馬來酸鹽(5克)和聚維酮K30(10克)加入水(300毫升)中,加熱到60℃攪拌溶清。將上述溶液用JISL微型噴霧干燥機LSD-48干燥,維持進口溫度60℃、出口溫度50℃,收集出口物料,得到白色固體,進一步真空干燥得到無定型來那替尼馬來酸鹽與聚維酮-K30的固體分散體。X-射線粉末衍射圖如圖3所示,該固體分散體的X-射線粉末衍射圖中,扣除藥用輔料的背景峰后無來那替尼馬來酸鹽晶型的特征峰。
實施例4
將來那替尼馬來酸鹽(1克)和羥丙甲基纖維素E50(0.2克)加到水(10毫升)中,加熱到40℃攪拌溶清。將上述溶液冷凍干燥,得到白色固體,即無定型來那替尼馬來酸鹽與羥丙甲基纖維素E50的固體分散體,該固體分散體的X-射線粉末衍射圖中,扣除藥用輔料的背景峰后無來那替尼馬來酸鹽晶型的特征峰。
實施例5
將來那替尼(1克)和聚乙二醇8000(50克)加熱到熔融,攪拌下迅速冷卻到室溫,得到白色固體。將上述固體粉碎,得到白色粉末狀固體,即無定型來那替尼與聚乙二醇8000的固體分散體,該固體分散體的X-射線粉末衍射圖中,扣除藥用輔料的背景峰后無來那替尼晶型的特征峰。
實施例6
將來那替尼(1克)和聚乙二醇10000(100克)加熱到240℃,混合均勻,迅速冷卻到室溫,得到白色固體。將上述固體粉碎,得到白色粉末狀固體,即無定型來那替尼與聚乙二醇10000的固體分散體,該固體分散體的X-射線粉末衍射圖中,扣除藥用輔料的背景峰后無來那替尼晶型的特征峰。
實施例7
將來那替尼(1克)、正丙醇(20克)和脂質體(4克)的混合物加熱到90℃,攪拌,混合均勻,真空蒸發除去溶劑,冷卻到室溫得到白色固體,即無定型來那替尼與脂質體的固體分散體,該固體分散體的X-射線粉末衍射圖中,扣除藥用輔料的背景峰后無來那替尼晶型的特征峰。
實施例8
將來那替尼氫馬來酸鹽(1克)、甲醇(20克)和甲基丙烯酸共聚物A型(4克)的混合物加熱到50℃,攪拌,溶清,真空蒸發除去溶劑,冷卻到室溫得到白色固體,即無定型來那替尼馬來酸鹽與甲基丙烯酸共聚物A型的固體分散體,該固體分散體的X-射線粉末衍射圖中,扣除藥用輔料的背景峰后無來那替尼馬來酸鹽晶型的特征峰。
實施例9
將來那替尼(1克)、正丙醇(20克)和乙基纖維素(2克)的混合物加熱到30℃,攪拌,混合均勻,真空蒸發除去溶劑,冷卻到室溫得到白色固體,即無定型來那替尼與乙基纖維素的固體分散體,該固體分散體的X-射線粉末衍射圖中,扣除藥用輔料的背景峰后無來那替尼晶型的特征峰。
實施例10
將來那替尼馬來酸鹽(1克)、甲醇(20克)和羥丙基纖維素SSL(4克)的混合物加熱到30℃,攪拌溶清,真空蒸發除去溶劑,冷卻到室溫得到白色固體,即無定型來那替尼馬來酸鹽與羥丙基纖維素SSL的固體分散體,該固體分散體的X-射線粉末衍射圖中,扣除藥用輔料的背景峰后無來那替尼馬來酸鹽晶型的特征峰。
實施例11
將來那替尼馬來酸鹽(1克)、甲醇(20克)、水(10克)和聚醋酸乙烯(4克)的混合物加熱到30℃,攪拌溶清,真空蒸發除去溶劑,冷卻到室溫得到白色固體,即無定型來那替尼馬來酸鹽與聚醋酸乙烯的固體分散體,該固體分散體的X-射線粉末衍射圖中,扣除藥用輔料的背景峰后無來那替尼馬來酸鹽晶型的特征峰。
實施例12
將來那替尼(50毫克)和聚丙烯酸樹脂Eudragit L100(100毫克)加入到甲醇(750微升),室溫下攪拌溶清。將上述溶液在旋轉蒸發器中迅速濃縮至干,得到白色固體,即無定型來那替尼馬來酸鹽與聚丙烯酸樹脂Eudragit L100的固體分散體,該固體分散體的X-射線粉末衍射圖如圖2所示,X-射線粉末衍射圖中扣除藥用輔料的背景峰后無來那替尼晶型的特征峰。
實施例13
將來那替尼(50毫克)和聚丙烯酸樹脂Eudragit S100(5毫克)加入到甲醇(4毫升)和乙酸乙酯(1毫升),-30℃下攪拌溶清。將上述溶液在旋轉蒸發器中迅速濃縮至干,得到白色固體,攪拌下析出白色固體,即無定型來那替尼與聚丙烯酸樹脂Eudragit S100的固體分散體,該固體分散體的X-射線粉末衍射圖中,扣除藥用輔料的背景峰后無來那替尼晶型的特征峰。
實施例14
將來那替尼(50毫克)和聚羧乙烯Carbomer 940(50毫克)加入到甲醇(4毫升)和四氫呋喃(1毫升),-30℃下攪拌混合均勻。將上述溶液在旋轉蒸發器中迅速濃縮至干,得到白色固體,攪拌下析出白色固體,即無定型來那替尼與聚羧乙烯Carbomer 940的固體分散體,該固體分散體的X-射線粉末衍射圖中,扣除藥用輔料的背景峰后無來那替尼晶型的特征峰。
實施例15
將來那替尼(50毫克)和預膠化淀粉Pharma-Gel(100毫克)加入到甲醇(4毫升)和水(1毫升),室溫下混合均勻。將上述溶液在旋轉蒸發器中迅速濃縮至干,得到白色固體,攪拌下析出白色固體,即無定型來那替尼與Pharma-Gel預膠化淀粉的固體分散體,該固體分散體的X-射線粉末衍射圖中,扣除藥用輔料的背景峰后無來那替尼晶型的特征峰。
實施例16
將來那替尼(50毫克)和高支鏈交聯淀粉(50毫克)加入到甲醇(4毫升)和水(1毫升),室溫下攪拌溶清,將上述溶液在旋轉蒸發器中迅速濃縮至干,得到白色固體,攪拌下析出白色固體,即無定型來那替尼與高支鏈交聯淀粉的固體分散體,該固體分散體的X-射線粉末衍射圖中,扣除藥用輔料的背景峰后無來那替尼晶型的特征峰。
實施例17
將來那替尼(50毫克)和羧甲基纖維素鈉SCMC(500毫克)加入到二甲基亞砜(5毫升),室溫下攪拌溶清。將上述溶液在旋轉蒸發器中迅速濃縮至干,得到白色固體,即無定型來那替尼與羧甲基纖維素鈉SCMC的固體分散體,該固體分散體的X-射線粉末衍射圖中,扣除藥用輔料的背景峰后無來那替尼晶型的特征峰。
實施例18
將來那替尼(50毫克)和幾丁聚糖(500毫克)加入到乙醇(5毫升),室溫下攪拌溶清,將上述溶液在旋轉蒸發器中迅速濃縮至干,得到白色固體,即無定型來那替尼與幾丁聚糖的固體分散體,該固體分散體的X-射線粉末衍射圖中,扣除藥用輔料的背景峰后無來那替尼晶型的特征峰。
實施例19
將來那替尼(50毫克)和羧甲基淀粉鈉Explotab(500毫克)加入到乙醇(5毫升),室溫下攪拌混合均勻,將上述溶液在旋轉蒸發器中迅速濃縮至干,得到白色固體,即無定型來那替尼與羧甲基淀粉鈉Explotab的固體分散體,該固體分散體的X-射線粉末衍射圖中,扣除藥用輔料的背景峰后無來那替尼晶型的特征峰。
實施例20
將來那替尼(50毫克)和藻酸鹽E401(500毫克)加入到乙醇(5毫升),室溫下攪拌混合均勻。將上述溶液在旋轉蒸發器中迅速濃縮至干,得到白色固體,即無定型來那替尼與藻酸鹽E401的固體分散體,該固體分散體的X-射線粉末衍射圖中,扣除藥用輔料的背景峰后無來那替尼晶型的特征峰。
實施例21
將來那替尼(50毫克)和羧甲基纖維素鄰苯二甲酸酯Agucoat CPD(5克)懸浮于甲醇(30毫升),加熱到50℃攪拌混合均勻。將上述溶液在旋轉蒸發器中迅速濃縮除去大部分溶劑,過濾,干燥,得到白色固體,即無定型來那替尼與羧甲基纖維素鄰苯二甲酸酯Agucoat CPD的固體分散體,該固體分散體的X-射線粉末衍射圖中,扣除藥用輔料的背景峰后無來那替尼晶型的特征峰。
實施例22
將來那替尼(50毫克)和卡拉膠E407(500毫克)懸浮于甲醇(30毫升),加熱到50℃攪拌混合均勻,將上述溶液在旋轉蒸發器中迅速濃縮除去大部分溶劑,過濾,干燥,得到白色固體,即無定型來那替尼與卡拉膠E407的固體分散體,該固體分散體的X-射線粉末衍射圖中,扣除藥用輔料的背景峰后無來那替尼晶型的特征峰。
實施例23
將來那替尼(50毫克)和殼聚糖(5克)懸浮于甲醇(50毫升),加熱到50℃攪拌混合均勻。將上述溶液在旋轉蒸發器中迅速濃縮除去大部分溶劑,過濾,干燥,得到白色固體,即無定型來那替尼與殼聚糖的固體分散體,該固體分散體的X-射線粉末衍射圖中,扣除藥用輔料的背景峰后無來那替尼晶型的特征峰。
實施例24
將來那替尼(30毫克)和聚丙烯酸樹脂 Eudragit E100(30毫克)溶于正丙醇(600微升)和N,N-二甲基甲酰胺(600微升)中,加熱到50℃攪拌溶清,將上述溶液降溫到10℃,析出白色固體,過濾,干燥,得到無定型來那替尼與聚丙烯酸樹脂 Eudragit E100的固體分散體,該固體分散體的X-射線粉末衍射圖中,扣除藥用輔料的背景峰后無來那替尼晶型的特征峰。
實施例25
將來那替尼(30毫克)和膠原蛋白Peptan(300毫克)溶于正丙醇(600微升)和乙腈(600微升)中,加熱到50℃攪拌溶清。將上述溶液降溫到10℃,析出白色固體,過濾,干燥,得到無定型來那替尼與膠原蛋白Peptan的固體分散體,該固體分散體的X-射線粉末衍射圖中,扣除藥用輔料的背景峰后無來那替尼晶型的特征峰。
實施例26
將來那替尼(30毫克)和樹膠Galactosol(300毫克)溶于正丙醇(600微升)和甲醇(600微升)中,加熱到50℃攪拌溶清。將上述溶液降溫到10℃,析出白色固體,過濾,干燥,得到無定型來那替尼與樹膠Galactosol的固體分散體,該固體分散體的X-射線粉末衍射圖中,扣除藥用輔料的背景峰后無來那替尼晶型的特征峰。
實施例27
將來那替尼馬來酸鹽(30毫克)和羥丙甲基纖維素鄰苯二甲酸酯HPMCP(30毫克)加入到乙醇(750微升)和水(750微升),加熱到80℃攪拌混合均勻。將上述溶液在旋轉蒸發器中迅速濃縮除去溶劑,得到白色固體,即無定型來那替尼馬來酸鹽與羥丙甲基纖維素鄰苯二甲酸酯HPMCP的固體分散體,該固體分散體的X-射線粉末衍射圖中,扣除藥用輔料的背景峰后無來那替尼馬來酸鹽晶型的特征峰。
實施例28
將來那替尼馬來酸鹽(30毫克)和離子交換樹脂Amberlite IR-120(300毫克)加入到乙醇(750微升)和水(750微升),加熱到80℃攪拌混合均勻。將上述溶液在旋轉蒸發器中迅速濃縮除去溶劑,得到棕色固體,即無定型來那替尼馬來酸鹽與離子交換樹脂Amberlite IR-120的固體分散體,該固體分散體的X-射線粉末衍射圖中,扣除藥用輔料的背景峰后無來那替尼馬來酸鹽晶型的特征峰。
實施例29
將來那替尼(30毫克)和羧基乙酸內酯(300毫克)加入到乙醇(750微升)和水(750微升),加熱到80℃攪拌混合均勻。將上述溶液在旋轉蒸發器中迅速濃縮除去溶劑,得到棕色固體,即無定型來那替尼與羧基乙酸內酯的固體分散體,該固體分散體的X-射線粉末衍射圖中,扣除藥用輔料的背景峰后無來那替尼晶型的特征峰。
實施例30
將來那替尼(30毫克)和糊精Maltrin M100(300毫克)加入到乙醇(750微升)和水(750微升),加熱到80℃攪拌混合均勻。將上述溶液在旋轉蒸發器中迅速濃縮除去溶劑,得到棕色固體,即無定型來那替尼與糊精Maltrin M100的固體分散體,該固體分散體的X-射線粉末衍射圖中,扣除藥用輔料的背景峰后無來那替尼晶型的特征峰。
實施例31
將來那替尼馬來酸鹽(30毫克)和羧甲基纖維素鈉SCMS(3毫克)加入到水(30毫升),加熱到100℃攪拌混合均勻。將上述溶液在旋轉蒸發器中迅速濃縮除去溶劑,得到白色固體,即無定型來那替尼馬來酸鹽與羧甲基纖維素鈉SCMC的固體分散體,該固體分散體的X-射線粉末衍射圖中,扣除藥用輔料的背景峰后無來那替尼馬來酸鹽晶型的特征峰。
實施例32
將來那替尼馬來酸鹽(30毫克)和β-環糊精(30毫克)加入到甲醇(300微升)和水(300微升),室溫下攪拌溶清。將上述溶液在旋轉蒸發器中迅速濃縮除去溶劑,得到白色固體,即無定型來那替尼馬來酸鹽與β-環糊精的固體分散體,該固體分散體的X-射線粉末衍射圖中,扣除藥用輔料的背景峰后無來那替尼馬來酸鹽晶型的特征峰。
實施例33
將來那替尼(30毫克)和羧甲基纖維素鈉SCMC(30毫克)加入到甲醇(300微升)和水(60微升),60℃下攪拌混合均勻。將上述溶液在旋轉蒸發器中迅速濃縮除去溶劑,得到白色固體,即無定型來那替尼與羧甲基纖維素鈉SCMC的固體分散體,該固體分散體的X-射線粉末衍射圖中,扣除藥用輔料的背景峰后無來那替尼晶型的特征峰。
實施例34
將來那替尼(5毫克)和聚環氧乙烷Polyox WSR301(60毫克)加入到甲醇(300微升)和水(60微升),60℃下攪拌混合均勻。將上述溶液在旋轉蒸發器中迅速濃縮除去溶劑,得到白色固體,即無定型來那替尼與聚環氧乙烷Polyox WSR301的固體分散體,該固體分散體的X-射線粉末衍射圖中,扣除藥用輔料的背景峰后無來那替尼晶型的特征峰。
實施例35
將來那替尼(30毫克)和聚乙烯醇EG-40(60毫克)加入到甲醇(300微升)和水(60微升),60℃下攪拌溶清,將上述溶液在旋轉蒸發器中迅速濃縮除去溶劑,得到白色固體,即無定型來那替尼與聚乙烯醇EG-40的固體分散體,該固體分散體的X-射線粉末衍射圖中,扣除藥用輔料的背景峰后無來那替尼晶型的特征峰。
實施例36
將來那替尼(50毫克)和羥丙甲基纖維素醋酸酯琥珀酸酯Agoat MG(2克)加入到乙醇(10毫升)和水(2毫升),80℃下攪拌混合均勻,將上述溶液在旋轉蒸發器中迅速濃縮至干,得到白色固體,即無定型來那替尼與羥丙甲基纖維素醋酸酯琥珀酸酯Agoat MG的固體分散體,該固體分散體的X-射線粉末衍射圖中,扣除藥用輔料的背景峰后無來那替尼晶型的特征峰。
實施例37
將來那替尼(50毫克)和羧甲基乙基纖維素(2克)加入到乙醇(10毫升)和水(1毫升),80℃下攪拌混合均勻,將上述溶液在旋轉蒸發器中迅速濃縮至干,得到白色固體,即無定型來那替尼與羧甲基乙基纖維素的固體分散體,該固體分散體的X-射線粉末衍射圖中,扣除藥用輔料的背景峰后無來那替尼晶型的特征峰。
實施例38
將來那替尼(50毫克)溶于正丙醇(600微升)和水(900微升)中,加熱到60℃攪拌溶清。將上述溶液在旋轉蒸發器中迅速濃縮至干,得到白色固體,得到無定型來那替尼游離堿。X-射線粉末衍射圖中無來那替尼晶型的特征峰。
實施例39
將來那替尼(50毫克)溶于正丙醇(600微升)和水(900微升)中,加熱到60℃攪拌溶清。將10毫升甲苯加入至上述溶液中,過濾后減壓干燥,得到無定型來那替尼游離堿。X-射線粉末衍射圖中無來那替尼晶型的特征峰。
實施例40
將來那替尼(50毫克)溶于正丙醇(600微升)和水(900微升)中,加熱到60℃攪拌溶清。將上述溶液直接進行冷凍干燥,得到無定型來那替尼游離堿。X-射線粉末衍射圖中無來那替尼晶型的特征峰。
實施例41
將來那替尼(50毫克)溶于正丙醇(600微升)和水(900微升)中,加熱到60℃攪拌溶清。將上述溶液用JISL微型噴霧干燥機LSD-48干燥,維持進口溫度60oC、出口溫度50 oC,收集出口物料,得到白色固體,進一步真空干燥得到無定型來那替尼游離堿。X-射線粉末衍射圖中無來那替尼晶型的特征峰。
實施例42
將來那替尼馬來酸鹽(50毫克)溶于正丙醇(600微升)和水(900微升)中,加熱到60℃攪拌溶清。將上述溶液在旋轉蒸發器中迅速濃縮至干,得到白色固體,得到無定型來那替尼游離堿。X-射線粉末衍射圖中無來那替尼馬來酸鹽晶型的特征峰。
實施例43
將來那替尼馬來酸鹽(50毫克)溶于正丙醇(600微升)和水(900微升)中,加熱到60℃攪拌溶清。將10毫升甲苯加入至上述溶液中,過濾后減壓干燥,得到無定型來那替尼游離堿。X-射線粉末衍射圖中無來那替尼馬來酸鹽晶型的特征峰。
實施例44
將來那替尼馬來酸鹽(50毫克)溶于正丙醇(600微升)和水(900微升)中,加熱到60℃攪拌溶清。將上述溶液直接進行冷凍干燥,得到無定型來那替尼游離堿。X-射線粉末衍射圖中無來那替尼馬來酸鹽晶型的特征峰。
實施例45
將來那替尼馬來酸鹽(50毫克)溶于正丙醇(600微升)和水(900微升)中,加熱到60℃攪拌溶清。將上述溶液直接用JISL微型噴霧干燥機LSD-48干燥,維持進口溫度60oC、出口溫度50 oC,收集出口物料,得到白色固體,進一步真空干燥得到無定型來那替尼馬來酸鹽。X-射線粉末衍射圖中無來那替馬來酸鹽尼晶型的特征峰。
實施例46:無定型來那替尼馬來酸鹽與聚維酮K30固體分散體的影響因素試驗
材料:實施例1所得無定型來那替尼馬來酸鹽與聚維酮K30的固體分散體
表1:
表1說明:無定型來那替尼馬來酸鹽與聚維酮K30固體分散體在高溫、高濕條件下,放置10天,有關物質無顯著改變,無來那替尼結晶析出。
實施例47:無定型來那替尼馬來酸鹽與聚維酮K30固體分散體的影響因素試驗
材料:實施例1所得無定型來那替尼馬來酸鹽與聚維酮K30的固體分散體
實驗條件:溫度40 oC±2oC,濕度75%±5%
表2:
表2說明:無定型來那替尼馬來酸鹽與聚維酮K30固體分散體在加速試驗條件下,放置6個月,有關物質無顯著改變,無來那替尼馬來酸鹽結晶析出。
本發明的來那替尼或其藥學上可接受的鹽與藥用輔料的無定型固體分散體,其溶出度明顯增加,更有利于提高藥物的生物利用度,使藥物能夠更好地發揮臨床疾病治療作用,該無定型物在加速試驗條件下(40±2℃,濕度75%±5%),能保持良好的物理穩定性和化學穩定性。
- 還沒有人留言評論。精彩留言會獲得點贊!