一種用于大腸桿菌發酵的培養基及其制備方法和用途與流程
本發明涉及培養基技術領域,尤其涉及一種用于大腸桿菌發酵的培養基及其制備方法和用途。
背景技術:
通過基因工程手段構建高效表達重組蛋白的表達載體,并轉化到大腸桿菌E.coli Rosetta中,再用異丙基-β-D-硫代半乳糖苷(IPTG)對E.coli Rosetta進行誘導,使其表達重組蛋白。研究中發現,傳統的培養基發酵方式得到的重組蛋白產量很低,而且各個組分的成本又很高。
此外,傳統的培養基中的一種主要成分氯化鈉會腐蝕發酵所使用的不銹鋼罐體。因此,有待開發一種能夠使大腸桿菌高效產生重組蛋白并且保護發酵所采用的罐體免受腐蝕的培養基,來滿足大腸桿菌E.coli Rosetta的發酵需求。
技術實現要素:
本發明提供一種用于大腸桿菌發酵的培養基及其制備方法和用途,該培養基能夠使大腸桿菌高效產生重組蛋白并且保護發酵所采用的罐體免受腐蝕。
根據本發明的第一方面,本發明提供一種用于大腸桿菌發酵的培養基,該培養基包括:用作緩沖基質的磷酸根、磷酸二氫根、銨離子和其它平衡陽離子,以及葡萄糖和酵母浸出物。
作為本發明的優選方案,上述其它平衡陽離子為鈉離子、鉀離子中的一種或兩種。
作為本發明的優選方案,上述酵母浸出物為酵母浸粉。
作為本發明的優選方案,上述培養基包括:用作緩沖基質的7.5~20mmol/L的磷酸根、2.5~7.5mmol/L的磷酸二氫根、15~37.5mmol/L的銨離子和平衡量的其它平衡陽離子,以及15~30g/L的葡萄糖和1~3g/L的酵母浸出物,pH為6.5~7.2。
作為本發明的優選方案,上述培養基包括:2.5~7.5mmol/L可溶性的磷酸金屬鹽、2.5~7.5mmol/L可溶性的磷酸二氫鹽、5~12.5mmol/L磷酸銨,以及15~30g/L的葡萄糖和1~3g/L的酵母浸出物,pH為6.5~7.2。
作為本發明的進一步優選方案,上述培養基包括:5mmol/L可溶性的磷酸金屬鹽、5mmol/L可溶性的磷酸二氫鹽、7.5mmol/L磷酸銨,以及25g/L的葡萄糖和2.5g/L的酵母浸出物,pH為6.5~7.2。
作為本發明的優選方案,上述可溶性的磷酸金屬鹽選自磷酸鈉或磷酸鉀,上述可溶性的磷酸二氫鹽選自磷酸二氫鈉或磷酸二氫鉀。
根據本發明的第二方面,本發明提供一種制備如第一方面的培養基的方法,該方法包括:配制含有磷酸根、磷酸二氫根、銨離子和其它平衡陽離子的緩沖液,將pH調整為6.5~7.2,滅菌備用;配制葡萄糖溶液,過濾除菌備用;配制酵母浸出物溶液,滅菌備用;將上述緩沖液、葡萄糖溶液和酵母浸出物溶液混合形成培養基。
作為本發明的優選方案,按照每1L培養基含有250mL緩沖液、100mL葡萄糖溶液和650mL酵母浸出物溶液的比例混合形成培養基,其中緩沖液中含有10~30mmol/L可溶性的磷酸金屬鹽、10~30mmol/L可溶性的磷酸二氫鹽、20~50mmol/L磷酸銨,100mL葡萄糖溶液中含有15~30g葡萄糖,650mL酵母浸出物溶液中含有1~3g酵母浸出物。
作為本發明的優選方案,上述緩沖液和酵母浸出物溶液在121℃、0.15MPa下滅菌,然后冷卻至40-50℃后,與葡萄糖溶液混合在一起。
根據本發明的第三方面,本發明提供一種如第一方面的培養基在大腸桿菌發酵以生產重組蛋白中的用途。
本發明的培養基以磷酸鹽代替了氯鹽,能夠在使用不銹鋼罐體放大發酵的時候保護設備免受腐蝕;并且本發明的培養基能夠顯著提高重組蛋白的產率。
附圖說明
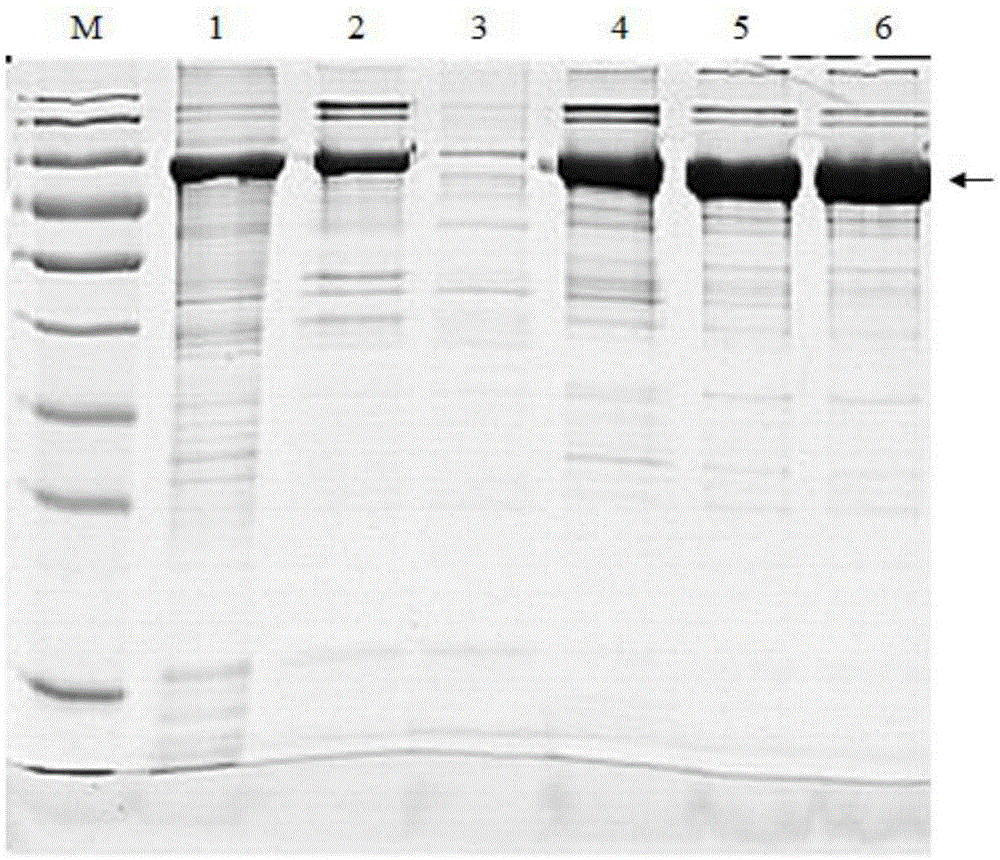
圖1是本發明一個試驗例對不同培養基發酵后獲得的目的蛋白DNA聚合酶粗提物進行SDS-PAGE電泳分析的結果,其中M:蛋白marker;泳道1:LB培養基菌體超聲后上清;泳道2:TB培養基菌體超聲后上清;泳道3:2×YT培養基菌體超聲后上清;泳道4:GYT培養基菌體超聲后上清;泳道5:MBL培養基菌體超聲后上清;泳道6:本發明培養基菌體超聲后上清;箭頭指示目的蛋白的條帶。
圖2是本發明一個試驗例對不同培養基發酵后獲得的目的蛋白DNA連接酶親和層析處理后,進行SDS-PAGE電泳分析結果,其中M:蛋白marker;泳道1:LB培養基菌體親和層析處理后上清;泳道2:TB培養基菌體親和層析處理后上清;泳道3:2×YT培養基菌體親和層析處理后上清;泳道4:GYT培養基菌體親和層析處理后上清;泳道5:MBL培養基菌體親和層析處理后上清;泳道6:本發明培養基菌體親和層析處理后上清;箭頭指示目的蛋白的條帶。
圖3是本發明一個試驗例對不同培養基發酵后獲得的目的蛋白低溫DNA聚合酶粗提物進行SDS-PAGE電泳分析結果,其中M:蛋白marker;泳道1:LB培養基菌體超聲后上清;泳道2:2×YT培養基菌體超聲后上清;泳道3:TB培養基菌體超聲后上清;泳道4:本發明培養基菌體超聲后上清;泳道5:MBL培養基菌體超聲后上清;泳道6:GTY培養基菌體超聲后上清;箭頭指示目的蛋白的條帶。
具體實施方式
下面通過具體實施方式結合附圖對本發明作進一步詳細說明。
本發明的培養基相比現有培養基,比如LB培養基,其關鍵區別之一在于,以磷酸鹽代替了氯鹽,因此能夠在使用不銹鋼罐體放大發酵的時候保護設備免受腐蝕。此外,發明人驚奇地發現采用本發明的培養基能夠顯著提高α蛋白酶的產率。
本發明的培養基基本上包括:緩沖基質、葡萄糖和酵母浸出物。其中緩沖基質包括磷酸根、磷酸二氫根、銨離子和其它平衡陽離子,用作提供緩沖液環境以及氮源;葡萄糖用作提供碳源及能量;酵母浸出物富含蛋白質、多肽、氨基酸、核苷酸、維生素、微量元素等營養成分,為微生物培養提供全面均衡的營養。
本發明中,用作提供緩沖液環境的陰離子是磷酸根、磷酸二氫根,除了銨離子用作平衡陽離子以外還用作提供氮源,其它平衡陽離子沒有特別限定,只要能夠在溶液中完全平衡陰離子,并且不產生沉淀,以及不會對微生物如大腸桿菌的培養產生負面作用即可。這樣的平衡陽離子優選地是鈉離子或鉀離子,可以單獨使用一種也可以混合使用兩種。
酵母浸出物的具體形式可以是酵母浸膏(膏體產品)或酵母浸粉(粉體產 品),在本發明中優選酵母浸粉。
本發明中,緩沖基質、葡萄糖和酵母浸出物的各自含量可以在一定的范圍內變動。本領域的技術人員能夠根據具體需要和通常用量確定各種組分的含量。在本發明的一個較優選的實施方案中,用作緩沖基質的磷酸根的濃度是7.5~20mmol/L,例如8mmol/L、10mmol/L、12mmol/L、15mmol/L、17mmol/L、18.5mmol/L或19mmol/L;磷酸二氫根的濃度是2.5~7.5mmol/L,例如3mmol/L、4mmol/L、4.5mmol/L、5mmol/L、6mmol/L、6.5mmol/L或7mmol/L;銨離子的濃度是15~37.5mmol/L,例如17mmol/L、19mmol/L、20mmol/L、22mmol/L、25mmol/L、28mmol/L、30mmol/L、32mmol/L、35mmol/L或37mmol/L;其它平衡陽離子的含量是“平衡量的”,即能夠使得溶液中電位達到平衡狀態的含量。在本發明的一個較優選的實施方案中,葡萄糖的濃度是15~30g/L,例如16g/L、18g/L、20g/L、22g/L、25g/L、28g/L或29g/L;酵母浸出物的濃度是1~3g/L,例如1.2g/L、1.4g/L、1.5g/L、1.7g/L、2g/L、2.5g/L、2.7g/L或2.9g/L。
本發明中,培養基的pH范圍基本上維持在中性附近,在本發明的一個較優選的實施方案中,pH為6.5~7.2,例如6.7、6.8、6.9或7.2等。
用于提供磷酸根的可以是可溶性的磷酸金屬鹽和磷酸銨,其中可溶性的磷酸金屬鹽優選磷酸鈉或磷酸鉀;用于提供磷酸二氫根的可以是可溶性的磷酸二氫鹽,例如磷酸二氫鈉或磷酸二氫鉀。
如果以鹽的形式來計算培養基中的成分的濃度,在本發明的一個較優選的實施方案中,培養基中含有:2.5~7.5mmol/L可溶性的磷酸金屬鹽,例如3mmol/L、4mmol/L、4.5mmol/L、5mmol/L、6mmol/L、6.5mmol/L或7mmol/L的磷酸鈉或磷酸鉀;2.5~7.5mmol/L可溶性的磷酸二氫鹽,例如3mmol/L、4mmol/L、4.5mmol/L、5mmol/L、6mmol/L、6.5mmol/L或7mmol/L的磷酸二氫鈉或磷酸二氫鉀;5~12.5mmol/L磷酸銨,例如6mmol/L、7mmol/L、8mmol/L、10mmol/L、11mmol/L或12mmol/L的磷酸銨;以及15~30g/L的葡萄糖,例如16、18、20、22、25或28g/L的葡萄糖;和1~3g/L的酵母浸出物,例如1.2、1.4、1.5、1.7、2、2.5、2.7或2.9g/L的酵母浸粉;pH為6.5~7.2,例如6.6、6.7、6.8、6.9或7.1等。
本發明提供的制備上述培養基的方法,包括:配制含有磷酸根、磷酸二氫根、銨離子和其它平衡陽離子的緩沖液,將pH調整為6.5~7.2,滅菌備用;配 制葡萄糖溶液,過濾除菌備用;配制酵母浸出物溶液,滅菌備用;將上述緩沖液、葡萄糖溶液和酵母浸出物溶液混合形成培養基。其中各組分的含量達到培養基的配方量即可。上述緩沖液和酵母浸出物溶液可以在121℃、0.15MPa下滅菌,然后冷卻至40-50℃后,與葡萄糖溶液混合在一起。
本發明提供一個優選的制備上述培養基的方法,按照每1L培養基加入250mL緩沖液、100mL葡萄糖溶液和650mL酵母浸出物溶液的比例混合形成培養基,其中緩沖液中含有10~30mmol/L可溶性的磷酸金屬鹽、10~30mmol/L可溶性的磷酸二氫鹽、20~50mmol/L磷酸銨,100mL葡萄糖溶液中含有15~30g葡萄糖,650mL酵母浸出物溶液中含有1~3g酵母浸出物。
如果在發酵罐中進行本發明的培養基的配制操作,可以先將緩沖液配制滅菌備用,葡萄糖溶液配制好滅菌備用;將酵母浸粉用蒸餾水溶解后在發酵罐中進行實罐滅菌,冷卻后用火圈接種的形式將上述緩沖液和葡萄糖溶液與酵母浸粉溶液進行混合然后使用。
以下通過實施例詳細說明本發明的技術方案以及其效果。應當理解,以下實施例僅是示例性的,并不能理解為對本發明保護范圍的限制,本發明的保護范圍以權利要求的范圍來界定。
實施例1
下面以配制終體積為1L的培養基為例進行詳細說明。
1、取磷酸鈉、磷酸二氫鉀、(NH4)3PO4配成濃度分別為0.02mol/L、0.02mol/L和0.03mol/L,pH調節到6.5~7.2,作為緩沖液,然后將其在121℃、0.15MPa下滅菌備用。
2、配制25%(質量/體積)的葡萄糖溶液200mL,在115℃、0.15Mpa下滅菌30min冷卻備用。
3、稱取2.5g酵母浸粉,用少量蒸餾水溶解后,定容至650mL,在121℃、0.15MPa下滅菌后冷卻備用。
4、當緩沖液、酵母浸粉溶液冷卻至40-50℃時,取緩沖液250mL、葡萄糖溶液100mL與650mL的酵母浸粉溶液在超凈工作臺上進行混合,得到終體積為1L的培養基。
實施例2
下面以配制終體積為1L的培養基為例進行詳細說明。
1、取磷酸鉀、磷酸二氫鈉、(NH4)3PO4配成濃度分別為0.01mol/L、0.01mol/L和0.02mol/L,pH調節到6.5~7.2,作為緩沖液,然后將其在121℃、0.15MPa下滅菌備用。
2、配制30%(質量/體積)的葡萄糖溶液200mL,在115℃、0.15Mpa下滅菌30min冷卻備用。
3、稱取1g酵母浸粉,用少量蒸餾水溶解后,定容至650mL,在121℃、0.15MPa下滅菌后冷卻備用。
4、當緩沖液、酵母浸粉溶液冷卻至40-50℃時,取緩沖液250mL、葡萄糖溶液100mL與650mL的酵母浸粉溶液在超凈工作臺上進行混合,得到終體積為1L的培養基。
實施例3
下面以配制終體積為1L的培養基為例進行詳細說明。
1、取磷酸鈉、磷酸二氫鈉、(NH4)3PO4配成濃度分別為0.03mol/L、0.03mol/L和0.05mol/L,pH調節到6.5~7.2,作為緩沖液,然后將其在121℃、0.15MPa下滅菌備用。
2、配制15%(質量/體積)的葡萄糖溶液200mL,在115℃、0.15Mpa下滅菌30min冷卻備用。
3、稱取3g酵母浸粉,用少量蒸餾水溶解后,定容至650mL,在121℃、0.15MPa下滅菌后冷卻備用。
4、當緩沖液、酵母浸粉溶液冷卻至40-50℃時,取緩沖液250mL、葡萄糖溶液100mL與650mL的酵母浸粉溶液在超凈工作臺上進行混合,得到終體積為1L的培養基。
試驗例1
采用實施例1制備的培養基對大腸桿菌E.coli Rosetta進行發酵培養。表1示出了大腸桿菌E.coli Rosetta分別在六種不同培養基中發酵終止后得到的終止OD600和表達量以及干重。
表1
從表1中可以看出,大腸桿菌E.coli Rosetta在本發明培養基(α)中生產DNA聚合酶的得率最高,達到70%;菌體干重最大,達到20g/L。
表2示出了不同培養基發酵終止后得到的目的蛋白BCA的定量分析結果。
表2
將用以上幾種培養基發酵得到的蛋白粗提物,分別經BCA蛋白定量試劑盒檢測分析后得到目的蛋白的濃度如表2。由表2知:不同培養基發酵所得目的蛋白的濃度結果表明:本發明培養基最適合E.coli Rosetta發酵生產重組蛋白DNA聚合酶。
圖1所示的結果是對不同培養基發酵后獲得的目的蛋白DNA聚合酶粗提物進行SDS-PAGE電泳分析的結果。對比可知,本發明培養基發酵獲得的目的蛋白的灰度比較大,而且條帶比較寬,從而能直觀的顯現出本發明培養基發酵獲得的目的蛋白含量是最大的,進一步證明了本發明培養基是一種最適合于E.coli Rosetta發酵生產重組蛋白DNA聚合酶的培養基。
采用實施例2和實施例3制備的培養基對大腸桿菌E.coli Rosetta進行發酵培養,得到的終止OD600和表達量以及干重,以及目的蛋白BCA的定量分析結果和SDS-PAGE電泳分析的結果與以上采用實施例1制備的培養基的實驗結果接近。
試驗例2
采用實施例1制備的培養基對大腸桿菌E.coli Rosetta進行發酵培養。表3示出了大腸桿菌E.coli Rosetta分別在六種不同培養基中發酵終止后得到的終止OD600和表達量以及干重。
表3
從表3中可以看出,大腸桿菌E.coli Rosetta在本發明培養基中生產DNA連接酶的得率最高,達到60%;菌體干重最大,達到18g/L。
表4示出了不同培養基發酵終止后得到的目的蛋白BCA的定量分析結果。
表4
將用以上幾種培養基發酵得到的蛋白粗提物,分別經BCA蛋白定量試劑盒檢測分析后得到目的蛋白的濃度如表4。由表4知:不同培養基發酵所得目的蛋白的濃度結果表明:本發明培養基最適合E.coli Rosetta發酵生產重組蛋白DNA連接酶。
圖2所示的結果是對不同培養基發酵后獲得的目的蛋白DNA連接酶親和層析處理后,進行SDS-PAGE電泳分析結果。對比可知,本發明培養基發酵獲得的目的蛋白的灰度比較大,而且條帶比較寬,從而能直觀的顯現出本發明培養基發酵獲得的目的蛋白含量是最大的,進一步證明了本發明培養基是一種最適合于E.coli Rosetta發酵生產重組蛋白DNA連接酶的培養基。
采用實施例2和實施例3制備的培養基對大腸桿菌E.coli Rosetta進行發酵培養,得到的終止OD600和表達量以及干重,以及目的蛋白BCA的定量分析結果和SDS-PAGE電泳分析的結果與以上采用實施例1制備的培養基的實驗結果接近。
試驗例3
采用實施例1制備的培養基對大腸桿菌E.coli Rosetta進行發酵培養。表5 示出了大腸桿菌E.coli Rosetta分別在六種不同培養基中發酵終止后得到的終止OD600和表達量以及干重。
表5
從表5中可以看出,大腸桿菌E.coli Rosetta在本發明培養基中生產低溫DNA聚合酶的得率最高,達到40%;菌體干重最大,達到18g/L。
表6示出了不同培養基發酵終止后得到的目的蛋白BCA的定量分析結果。
表6
將用以上幾種培養基發酵得到的蛋白粗提物,分別經BCA蛋白定量試劑盒檢測分析后得到目的蛋白的濃度如表6。由表6知:不同培養基發酵所得目的蛋白的濃度結果表明:本發明培養基最適合E.coli Rosetta發酵生產重組蛋白低溫DNA聚合酶。
圖3所示的結果是對不同培養基發酵后獲得的目的蛋白低溫DNA聚合酶粗提物進行SDS-PAGE電泳分析結果。對比可知,本發明培養基發酵獲得的目的蛋白的灰度比較大,而且條帶比較寬,從而能直觀的顯現出本發明培養基發酵獲得的目的蛋白含量是最大的,進一步證明了本發明培養基是一種最適合于E.coli Rosetta發酵生產重組蛋白低溫DNA聚合酶的培養基。
采用實施例2和實施例3制備的培養基對大腸桿菌E.coli Rosetta進行發酵培養,得到的終止OD600和表達量以及干重,以及目的蛋白BCA的定量分析 結果和SDS-PAGE電泳分析的結果與以上采用實施例1制備的培養基的實驗結果接近。
以上內容是結合具體的實施方式對本發明所作的進一步詳細說明,不能認定本發明的具體實施只局限于這些說明。對于本發明所屬技術領域的普通技術人員來說,在不脫離本發明構思的前提下,還可以做出若干簡單推演或替換,都應當視為屬于本發明的保護范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!