光學純的雙螺旋寡聚四苯并環辛四烯類物質的合成方法與流程
本發明涉及四苯并環辛四烯類物質的合成,特別是涉及一種光學純的雙螺旋寡聚四苯并環辛四烯類物質的合成方法。
背景技術:
四苯并環辛四烯及其衍生物具有獨特的非平面芳香結構,因此具有特殊的物理和化學性質。近年來化學家們對四苯并環辛四烯衍生物性質進行了廣泛的研究,并初步探索了在分子器件設計、液晶材料,分子識別與自組裝以及不對稱催化等方面應用的可行性。四苯并環辛四烯的結構式如下所示:
四苯并環辛四烯并非共軛的平面分子,而是一個在空間上呈現“馬鞍形”的立體分子。由于四苯并環辛四烯具有獨特的“馬鞍形”立體結構,目前,對四苯并環辛四烯衍生物應用于分子器件領域的研究、其生物液晶性質的研究、超分子化學領域的研究、作為不對稱催化劑的研究與應用等已經成為熱點。
目前,四苯并環辛四烯及其衍生物的合成方法主要包括:以四苯并環辛四烯為前體,直接在其苯環上進行芳香親電取代反應引入取代基團;通過使2,2’-二鹵代聯苯化合物先進行鋰鹵交換反應,生成2,2’-雙鋰化聯苯中間體,然后在氧化性的過渡金屬鹽類作氧化劑,發生分子間的氧化偶聯反應生成四苯并環辛四烯等。但現有的方法存在產率較低、偶聯產物多且為難以分離的混合物等缺點。
為了研究四苯并環辛四烯及其衍生物所具有的特殊性質和其具有的潛在應用前景,需要開發出四苯并環辛四烯衍生物的高效合成的方法。
技術實現要素:
為了彌補上述現有技術的不足,本發明提出一種光學純的雙螺旋寡聚四苯并環辛四烯類物質的合成方法。
本發明的技術問題通過以下的技術方案予以解決:
一種光學純的雙螺旋寡聚四苯并環辛四烯類物質的合成方法,包括如下步驟:
(1)由二碘二甲氧基聯苯(51)和2,2’,6,6’-四溴代聯苯(97)兩者發生交叉氧化偶聯得到1,16-二溴-8,9-二甲氧基四苯并環辛四烯(96):
(2)使用樟腦磺酰氯作為拆分試劑,對得到的1,16-二溴-8,9-二甲氧基四苯并環辛四烯(96)進行拆分,得到了帶有手性輔基的一對非對應異構體(S,S)-115a和(R,R)-115a,然后分別將(S,S)-115a和脫去樟腦磺酰基后,使用硫酸二甲酯將其甲基化,分別得到光學純的(S,S)-96和(R,R)-96,反應過程如下:
(3)以步驟(1)中得到的1,16-二溴-8,9-二甲氧基四苯并環辛四烯(96)為原料,使用THF為溶劑、6eq的n-BuLi作鋰化試劑,CuCl2作氧化劑,在-78℃下進行氧化偶聯反應,經純化得到含6個苯環的中間體(116),反應過程如下:
(4)使用樟腦磺酰氯作為拆分試劑,對步驟(3)中得到的中間體(116)進行拆分,分別得到(M)-116和(P)-116,反應過程如下:
(5)以步驟(2)中得到的光學純的(S,S)-96與步驟(4)中得到的(M)-116為原料,反應得到具有8個苯環的目標產物(M)-117、具有10個苯環的目標產物(M)-149和具有12個苯環的目標產物(M)-150,反應過程如下:
和/或:以步驟(2)中得到的光學純的(R,R)-96與步驟(4)中得到的(P)-116為原料,反應得到具有8個苯環的目標產物(P)-117、具有10個苯環的目標產物(P)-149和具有12個苯環的目標產物(P)-150,反應過程如下:
本發明與現有技術對比的有益效果是:本發明設計合成了具有四苯并環辛四烯骨架單元的一系列具有雙螺旋結構、光學純的寡聚四苯并環辛四烯化合物,如果在寡聚四苯并環辛四烯引入不同的官能團,有望在不對稱催化、超分子化學以及液晶材料化學等方面得到應用。
附圖說明
圖1是本發明實施例二中合成的(M)-152a的構型示意圖;
圖2是本發明的實施例中合成的目標化合物145、117、149和150的CD光譜圖。
具體實施方式
下面對照附圖并結合優選的實施方式對本發明作進一步說明。
在以下實施例中:所有原料及溶劑除注明外,均按標準方法處理純化。乙醚(Et2O)、四氫呋喃(THF)和甲苯經鈉絲和二苯甲酮干燥并從其中回流蒸出;二氯甲烷經氫化鈣干燥并從其中回流蒸出;二甲亞砜(DMSO)和N,N-二甲基甲酰胺(DMF)經氫化鈣干燥并從其中減壓蒸出。
無水無氧操作以氬氣作為保護氣,玻璃儀器經火焰干燥。反應通過TLC跟 蹤監測。反應后處理純化中所用柱層析硅膠為硅膠H(中國山東煙臺芝罘黃務硅膠開發試驗廠)。
熔點儀為上海申光SGW XT-4顯微熔點儀,未經校正。旋光值在Rudolph Autopol I上測定。1H NMR譜由Bruker AM 300(300MHz)、Varian Mercury 300(300MHz)或Varian Mercury 400(400MHz)核磁共振儀測定。13C NMR在Bruker DPX-400(100MHz)、Varian Mercury300(75MHz)或Varian Mercury 400(100MHz)上于室溫測定。紅外分析、質譜分析、元素分析和HPLC均由上海有機化學研究所分析測試中心完成:IR(Infrared resonance spectra)以KBr壓片在Bio-Rad FTS-185上測定,單位為cm-1;低分辨質譜(EI)在HP HP5989A或Aglient HP5873上測定;高分辨質譜(EI)在Waters Micromass GCT質譜儀上測定;高分辨質譜(ESI)在Bruker Daltonics FTMS-7上測定;(MADLI)在IonSpec 4.7Tesla FTMS質譜儀上測定;元素分析在Elemantar Vario EL元素分析儀上完成。樣品單晶X-ray衍射分析的數據收集在Brucker SMART APEX CCD(上海有機化學研究所)衍射儀在石墨單色Mo-Kα射線()下于293±1K完成。
以下通過具體的實施例對本發明進行詳細闡述。
實施例一:目標化合物117、149和150的合成
(1)由二碘二甲氧基聯苯(51)和2,2’,6,6’-四溴代聯苯(97)兩者發生交叉氧化偶聯得到1,16-二溴-8,9-二甲氧基四苯并環辛四烯(96):
具體來說,二碘二甲氧基聯苯(51)的合成如下:
在2000mL三頸瓶中,裝好機械攪拌裝置,然后分別2-氨基-3-硝基苯酚103(38.5g,0.25mol),350mL DMSO,250mL水和濃H2SO480mL,得一深紅棕 色溶液。冰鹽浴冷至-5℃,機械攪拌下滴加NaNO2溶液(34.7g,0.50mol,水100mL),保持內溫低于5℃。滴加完畢后繼續攪拌半小時,然后滴加碘化鉀(100g,0.60mol,水150mL),繼續攪拌半小時,保持內溫低于5℃。升溫至50℃,攪拌2小時,冷至室溫,用Et2O(150mL×3)提取,Na2SO4干燥過夜。過濾,蒸去溶劑得黃色晶體。快速柱層析(硅膠H,200g,CH2Cl2:正己烷=1:4)給出化合物99(2-碘-3-硝基苯酚)(59.2g,93%)。熔點為122-123℃。1H NMR(300MHz,CDCl3):δ7.44(dd,J=1.7,8.0Hz,1H),7.37(t,J=8.0Hz,1H),7.23(dd,J=1.7,8.0Hz,1H),6.01(s,1H);MS(EI):m/z(relative intensity)265(M+,100),218(10),92(40)。
將化合物99(1.00g,3.77mmol),NaOH(0.49g),Et4NBr(180mg)溶于水(25mL)中,加入CH2Cl2(25mL),Me2SO4(1.2mL,12.7mmol),室溫下攪拌,待紅色完全褪去(約6小時),停止攪拌,分液,水層用CH2Cl2(25mL×3)萃取;合并有機層,先后用2N NH3水溶液(20mL×2)、2M NaOH水溶液(20mL×2)和飽和NaCl水溶液(20mL×2)洗滌,Na2SO4干燥。快速柱層析(硅膠H,20g,CH2Cl2:正己烷=1:6)得黃色晶體100(2-碘-3-硝基苯甲醚)(1.05g,收率100%),熔點為103-104℃。1H NMR(300MHz,CDCl3):δ7.43(t,J=8.1Hz,1H),7.30(dd,J=1.3,8.1Hz,1H),6.99(dd,J=1.3,8.1Hz,1H),3.96(s,3H);MS(EI):m/z 279(M+,100),218(32),203(27)。
將化合物100(2.2g,7.9mmol)溶于DMF(10mL)中,加入活化銅粉(5.8g),加熱至回流,保持3小時,TLC顯示原料已大部分反應。趁熱過濾,母液冷卻至-10℃,有大量結晶析出。過濾,得黃色晶體101(2,2’-二甲氧基-6,6’-二 硝基聯苯)(0.99g,收率82%)。熔點為232-233℃。1H NMR(300MHz,CD3COCD3):δ7.75(dd,J=1.1,8.3Hz,2H),7.65(t,J=8.3Hz,2H),6.99(dd,J=1.1,8.3Hz,2H),3.76(s,6H);MS(EI):m/z 304(M+,53),258(100),243(20)。
在甲醇(50mL)中,依次加入化合物101(9.88g,32.5mmol),FeCl3(350mg,2.1mmol),活性碳(2g),加熱回流10分鐘。然后慢慢滴加N2H4(12mL,85%質量百分比,318mmol)水溶液,大量冒泡。2小時后黃色不溶物全部消失,TLC顯示原料消失。繼續回流1小時后停止反應,趁熱過濾,不溶物用熱甲醇洗滌三次(20mL×3),所得無色濾液得淺色固體8.35g,甲醇重結晶后得白色結晶102(2,2’-二甲氧基-6,6’-二氨基聯苯)(6.71g,收率85%),熔點為91.5-92.5℃。1H NMR(300MHz,CD3COCD3):δ7.30(t,J=8.1Hz,2H),6.70(d,J=8.1Hz,2H),6.99(d,J=8.1Hz,2H),3.80(s,6H);1H NMR(300MHz,CDCl3):δ7.14(dd,J=8.1,8.3Hz,2H),6.46(d,J=8.1Hz,2H),6.43(d,J=8.3Hz,2H),3.70(s,6H),3.11(s,4H);MS(EI):m/z 244(M+,100),213(54),198(48)。
將濃鹽酸(42mL)和水(55mL)加入到500mL三頸瓶中,再加入化合物102(10.0g,41.0mmol),冰鹽浴冷至-5℃,機械攪拌下滴加NaNO2溶液(6.2g,89.9mmol,水5mL),保持內溫低于5℃。滴加完畢后繼續攪拌30min,然后滴加碘化鉀(28g,169mmol),繼續攪拌30min,保持內溫低于5℃。升溫至80℃,攪拌2h,冷至室溫,用CH2Cl2(50mL×4)提取,提取液用飽和NaHSO3溶液洗滌兩次(30mL×2),Na2SO4干燥。快速柱層析(硅膠H,100g,CH2Cl2:正己烷=1:2)得白色晶體51(2,2’-二甲氧基-6,6’-二碘聯苯)(11.8g,收率62%), 熔點為187.5-188℃。1H NMR(300MHz,CDCl3):δ7.55(dd,J=1.2,7.8Hz,2H),7.10(t,J=8.7Hz,2H),6.96(d,J=8.7Hz,2H),3.74(s,6H)。MS(EI):m/z 466(M+,100),339(33),324(51)。
2,2’,6,6’-四溴代聯苯(97)的合成如下:
500mL三頸瓶烘烤、抽換氬氣三次后,氬氣保護下加入THF 150mL,干冰-丙酮浴冷卻至-78℃,依次加入i-Pr2NH(10mL,71mmol),nBuLi(2.5M inhexane,27mL,67mmol),攪拌30min。然后慢慢加入107(8.0mL,67mmol),攪拌2h。再慢慢加入I2的THF溶液(17g,67mmol,THF 30mL),加完后自然升至室溫。蒸去大部分溶劑,加入乙醚150mL,依次用Na2S2O3溶液(50mL)、飽和NaCl溶液(3×100mL)洗滌,Na2SO4干燥。減壓除去溶劑,所得固體用乙醇(50mL)重結晶,得白色片狀固體108(1,3-二溴-2-碘苯)(20.3g,收率85%),熔點為99-100℃。1H NMR(300MHz,CDCl3):δ7.56(d,J=7.8Hz,2H),7.07(t,J=7.8Hz,1H);MS(EI):m/z361(M+2+,9)。
250mL Schlenk瓶烘烤、抽換氬氣三次后,氬氣保護下依次加入化合物108(10.5g,29mmol),無水乙醚(60mL),干冰-丙酮浴冷卻至-78℃,攪拌15min。然后慢慢加入nBuLi(2.5M in hexane,11.6mL,29mmol),然后加入CuBr2(6.76g,30.2mmol),攪拌45min,加入PhNO2(3.1mL,30mmol),-78℃下攪拌6h。慢慢升至室溫,攪拌過夜。次日,加入12%氨水(40mL),攪拌30min;分液,水相用CH2Cl2(3×30mL)萃取,合并有機層,飽和NaCl溶液(3×50mL)洗滌,Na2SO4干燥。旋去大部分溶劑,過濾得白色晶體55(2,2',6,6'-四溴聯苯)(3.91g,收率60%),熔點為214-215℃。1H NMR(300MHz,CDCl3):δ7.67(d, J=8.1Hz,4H),7.17(t,J=8.1Hz,2H);MS(EI):m/z 468(M+,62),150(100),470(M+2+,93)。
1,16-二溴-8,9-二甲氧基四苯并環辛四烯(96)的合成具體如下:
100mL Schlenk瓶烘烤、抽換氬氣三次后,氬氣保護下依次加入化合物51(233mg,0.50mmol),化合物97(705mg,1.5mmol),無水乙醚(60mL),干冰-丙酮浴冷卻至-78℃,攪拌15min。然后慢慢加入n-BuLi(2.5M in hexane,2.6mL,6.5mmol),-78℃攪拌2h,然后加入無水CuCl2(1.2g,8.9mmol)和硝基苯10mL,-78℃下攪拌4小時。慢慢升至室溫,攪拌過夜。次日,加入12%氨水(20mL),攪拌30min;分液,水相用CH2Cl2(3×30mL)萃取,合并有機層,飽和NaCl溶液(3×50mL)洗滌,Na2SO4干燥。快速柱層析(硅膠H,50g,CH2Cl2:正己烷=1:2)得淡黃色固體,用CH2Cl2-正己烷重結晶,得白色固體96(1,16-二溴-8,9-二甲氧基四苯并環辛四烯)(35mg,收率13%),熔點為319-320℃。1H NMR(300MHz,CDCl3):δ7.45(d,J=7.5Hz,2H),7.25(t,J=7.8Hz,2H),7.20(d,J=7.8Hz,2H),7.11(t,J=7.8Hz,2H),6.94(d,J=7.5Hz,2H),6.81(d,J=8.4Hz,2H),3.65(s,6H);13C-NMR(75MHz,CDCl3):δ156.6,143.2,142.4139.9,130.9,128.7,128.3,126.8,125.4,123.5,119.9,110.4,56.0;IR:max(cm-1)2955,2834,1574,1429,1254,1106,1035,879,786,738;MS(EI):m/z 520(M+,50),522(M+2+,100),524(M+4+,49);HR-MS(EI,M+):Calc.for C26H18O2Br2+519.9674,Found 519.9666;E.A.:Anal.calc.for C44H42O8S2Br2:C,59.80;H,3.47.Found:C,59.99;H,3.51。
(2)使用樟腦磺酰氯作為拆分試劑,對得到的1,16-二溴-8,9-二甲氧基四苯并環辛四烯96進行拆分,得到了帶有手性輔基的一對非對應異構體(S,S)-115a和 (R,R)-115a,然后分別將(S,S)-115a和脫去樟腦磺酰基后,使用硫酸二甲酯將其甲基化,分別得到光學純的(S,S)-96和(R,R)-96,反應過程具體如下:
100mL燒瓶烘烤干燥、氬氣保護下,將化合物96(190mg,0.36mmol)溶解于無水CH2Cl2(50mL),冰水浴冷卻至0℃;向該溶液中緩慢滴加1M BBr3的CH2Cl2溶液(3mL,3mmol);滴加完畢,升至室溫反應12h,TLC檢測反應完全。加入水10mL,分液,水層用CH2Cl2(3×15mL)萃取,合并有機層,用飽和NaCl溶液(3×30mL)洗至中性,Na2SO4干燥。快速柱層析(硅膠H,30g,EtOAc:CH2Cl2:正己烷=1:1:2)得白色固體114(1,16-二溴-8,9-二羥基四苯并環辛四烯)(180mg,收率100%),熔點為269-270℃。1H NMR(300MHz,CDCl3):δ7.48(d,J=7.5Hz,2H),7.27(t,J=8.0Hz,2H),7.20(dd,J=7.2,0.6Hz,2H),7.14(t,J=7.5Hz,2H),6.99(d,J=7.8Hz,2H),6.88(d,J=8.1Hz,2H),4.82(br,2H);13C-NMR(100MHz,CD3COCD3):δ155.3,145.0,144.0141.0131.8,130.0,129.2,127.9,124.2,124.0,119.3,115.6;IR:max(cm-1)3555,3333,1573,1432,1278,1199,919,788,740,729;MS(EI):m/z492(M+,49),494(M+2+,100),496(M+4+,48);HR-MS(EI,M+):Calc.for C24H14O2Br2+491.9361,Found 491.9363。
50mL燒瓶烘烤干燥、氬氣保護下,依次加入化合物114(98.8mg,0.20mmol),R*Cl(250.7mg,1.0mmol),無水CH2Cl2(10mL)溶解,冰水浴冷卻下,滴加Et3N(0.30mL,2.0mmol),加完后升至室溫攪拌7h至TLC檢測反應完成;加入2M稀鹽酸(10mL),分液,水層用用CH2Cl2(3×10mL)萃取,合 并有機層,用飽和NaHCO3(20mL),飽和NaCl溶液(3×20mL)洗至中性,Na2SO4干燥。快速柱層析(硅膠H,30g,EtOAc:正己烷=1:4)可得到一對非對映異構體(S,S)-115a和(R,R)-115a。
首先出來的是(S,S)-115a(69mg,收率37%),熔點為239-242℃;旋光[α]20D:-10.4(CH2Cl2,c=0.48)。1H NMR(300MHz,CDCl3):δ7.50(d,J=8.1,2H),7.40-7.29(m,8H),7.18(t,J=7.8,4H),3.14(d,J=15.0Hz,2H),2.98(d,J=15.0Hz,2H),2.41-2.29(m,2H),2.11-1.98(m,6H),1.93(d,J=18.6Hz,2H),1.55-1.49(m,2H),1.45-1.36(m,2H),1.05(s,6H),0.81(s,6H);13C-NMR(75MHz,CDCl3):δ213.8,146.0,144.3,141.2,139.5,132.0,129.7,129.2,128.3,128.0,126.5,123.6,121.2,57.8,48.7,48.0,42.6,42.4,26.8,24.8,19.7,19.5;IR:max(cm-1)2959,1748,1433,1373,1174,1164,925,802,748;MS(MALDI):m/z 943(M+Na+,46),945(M+Na+2+,100),947(M+Na+4+,72);HR-MS(M+Na+):Calc.for C44H42O8S2Br2Na+943.0580,Found 943.0606。
接著出來的是(R,R)-115a(75mg,收率41%),熔點為215-216℃;旋光[α]20D:+52.8(CH2Cl2,c=0.50)。1H NMR(300MHz,CDCl3):δ7.51-7.48(m,2H),7.42-7.32(m,4H),7.31-7.28(m,2H),7.20-7.11(m,4H),3.53(d,J=14.7Hz,2H),2.79(d,J=15.3Hz,2H),2.40-2.31(m,2H),2.19-1.88(m,8H),1.62-1.53(m,2H),1.44-1.35(m,2H),0.96(s,6H),0.78(s,6H);13C-NMR(100MHz,CDCl3):δ213.4,145.8,144.2,141.1,139.5,131.8,129.6,129.0,128.0,127.8,126.0,123.5,120.7,57.7,48.9,47.7,42.6,42.2,26.7,24.6,19.6,19.4;IR:max(cm-1)2958,1748,1434,1359,1172,1161,929,821,800,786,745;MS(MALDI):m/z 943(M+Na+,46),945(M+Na+2+,100),947(M+Na+4+,72);HR-MS(MALDI,M+Na+):Calc.for C44H42O8S2Br2Na+943.0580,Found 943.0607;E.A.:Anal.calc.for C44H42O8S2Br2:C,57.27;H,4.59.Found:C,57.36;H,4.53。
合成(S,S)-114(即(S,S)-1,16-dibromo-8,9-dihydroxytetraphenylene):
50mL圓底燒瓶中,依次加入(S,S)-115a(0.83g,0.90mmol),甲醇(10mL),KOH水溶液(1M,10mL,10mmol),加熱至60℃攪拌6h直到體系變為黃色澄清液,TLC檢測顯示反應完全;減壓除去大部分甲醇,加入4M HCl酸化,水層用CH2Cl2(3×50mL)萃取,合并有機層,用飽和NaCl溶液(3×100mL)洗至中性,Na2SO4干燥。快速柱層析(硅膠H,30g,EtOAc:CH2Cl2:正己烷=1:1:3)得白色固體(S,S)-114(433mg,收率98%),只測量了旋光[α]20D:42.0(CH2Cl2,c=0.50)。
合成(R,R)-114(即(R,R)-1,16-dibromo-8,9-dihydroxytetraphenylene):
由(R,R)-115a通過相同步驟得到(R,R)-114,產率97%,旋光[α]20D:+49.5(CH2Cl2,c=0.44)。
合成(S,S)-96(即(S,S)-1,16-dibromo-8,9-dimethoxytetraphenylene):
50mL圓底燒瓶中,依次加入(S,S)-114(395mg,0.80mmol),KOH(1.12g,20mmol),冰水浴冷卻,慢慢加入Me2SO4(1.9mL,20mmol),升至室溫,攪拌12h至TLC顯示產物不再增加;加入NH3(25%,5mL)攪拌2h,分液,有機層用水(5×10mL),飽和NaCl溶液(10mL)洗滌至中性,Na2SO4干燥。快速柱層析(硅膠H,30g,CH2Cl2:正己烷=1:2)得白色固體(S,S)-96(360mg,86%);旋光[α]20D:-74.9(CH2Cl2,c=0.49)。其余數值同消旋體。
合成(R,R)-96(即(R,R)-1,16-dibromo-8,9-dimethoxytetraphenylene):
由(R,R)-114通過相同步驟得到(R,R)-96,產率87%,只測量了旋光[α]20D:(CH2Cl2,c=0.49)。
(3)以步驟(1)中得到的1,16-二溴-8,9-二甲氧基四苯并環辛四烯96為原料,使用THF為溶劑、6eq的n-BuLi作鋰化試劑,CuCl2作氧化劑,在-78℃下進行氧化偶聯反應,經純化得到含6個苯環的中間體116,反應過程具體如下:
100mL Schlenk瓶烘烤、抽換氬氣三次后,氬氣保護下依次加入化合物(R,R)-96(522mg,1.0mmol),化合物97(705mg,1.5mmol),THF(50mL), 干冰-丙酮浴冷卻至-78℃,攪拌15min。然后加入n-BuLi(2.5M in hexane,3.0mL,7.5mmol),-78℃攪拌4h,然后加入無水CuCl2(1.5g,11mmol),-78℃下攪拌4小時。慢慢升至室溫,攪拌過夜。次日,加入12%氨水(20mL),攪拌30min;分液,水相用CH2Cl2(3×30mL)萃取,合并有機層,飽和NaCl溶液(3×50mL)洗滌,Na2SO4干燥。快速柱層析(硅膠H,50g,乙酸乙酯:CH2Cl2:正己烷=1:1:10),CH2Cl2-正己烷重結晶得淡黃色固體(P)-116(22mg,收率7%),不純。
(4)使用樟腦磺酰氯作為拆分試劑,對步驟(3)中得到的中間體116進行拆分,分別得到(M)-116和(P)-116,反應過程具體如下:
50mL燒瓶烘烤干燥、氬氣保護下,依次加入化合物116(205mg,0.30mmol),無水CH2Cl2(25mL),冰水浴冷卻至0℃;向該溶液中緩慢滴加BBr3的CH2Cl2溶液(2M,2.0mL,4.0mmol);滴加完畢,升至室溫反應12h,TLC檢測反應完全。加入水10mL,分液,水層用乙酸乙酯(3×15mL)萃取,合并有機層,用飽和NaCl溶液(3×30mL)洗至中性,Na2SO4干燥。快速柱層析(硅膠H,50g,乙酸乙酯:CH2Cl2:正己烷=1:1:2)得白色固體153(194mg,收率100%)。
1H NMR(400MHz,CDCl3):δ7.46(dd,J=8.2,1.0Hz,2H),7.20(dd,J=8.4,7.6Hz,2H)7.13-7.06(m,,6H),6.97(dd,J=7.4,1.8Hz,2H),6.93(dd,J=7.6,1.2Hz,2H),6.87(dd,J=8.2,1.0Hz,2H),6.59(dd,J=7.4,1.0Hz,2H),4.83(br,2H);13C-NMR(100MHz,CDCl3):δ152.1,144.9,143.5,140.4,140.3,140.2,137.8,131.3,129.9,129.0,127.4,127.2,126.5,126.4,123.5,120.9,120,4,114.8;IR:max(cm-1)3544,3309,2953,1571,1431,1403,1384,1287,1287,1159,1060,787,739;MS(MALDI):m/z644.0(M+2+,100);HR-MS(M+H+):Calc.forC36H20O2Br2+641.9825,Found 641.9820。
(M)-154a和(P)-154a的合成如下:
100mL燒瓶烘烤干燥、氬氣保護下,依次加入化合物153(194mg,0.30mmol),R*Cl(500mg,2.0mmol),無水CH2Cl2(50mL),冰水浴冷卻下,滴加Et3N(0.50mL,4.0mmol),加完后升至室溫攪拌過夜,至TLC檢測反應完成,減壓蒸去溶劑。快速柱層析(硅膠H,100g,乙酸乙酯:CH2Cl2:正己烷=1:3:8)可得到一對非對映異構體(M)-154a和(P)-154a。
首先出來的是(M)-154a(158mg,49%);旋光[α]20D:-174.8(CH2Cl2,c=0.50)。
1H NMR(400MHz,CDCl3):δ7.46(dd,J=6.8,2.0Hz,2H),7.32-7.29(m,4H),7.17-7.08(m,8H),6.95-6.92(m,4H),3.21(d,J=15.2Hz,2H),3.00(d,J=14.8Hz,2H),2.39-2.32(m,4H),2.08(t,J=4.4Hz,2H),2.06-1.97(m,2H),1.92(d,J=18.4Hz,4H),1.56-1.50(m,2H),1.43-1.36(m,2H),1.06(s,6H),0.81(s,6H);13C-NMR(100MHz,CDCl3):δ213.8,145.9,145.1,143.4,140.1,139.9,139.0,137.5,131.2,129.3,128.9,128.5,128.2,127.3,126.8,126.6,126.4,123.3,120.7,57.9,48.8,48.0,42.7,42.4,26.9,24.9,19.7,19.6;IR:max(cm-1)3423.1,2959.4,1748.0,1558.8,1374.0,1172.2,1163.4,1053.4,934.1,832.9,790.1,753.5;MS(MALDI):m/z1095(M+Na+,100);HR-MS(M+Na+):Calc.for C56H48O8S2Br2Na+1093.1050,Found 1093.1051。
接著出來的是(P)-154a(152mg,47%);旋光[α]20D:+210.6(CH2Cl2,c=0.49)。
1H NMR(400MHz,CDCl3):δ7.46(dd,J=8.0,1.2Hz,2H),7.39(dd,J=8.4,1.2Hz,2H),7.30(t,J=7.8Hz,4H),7.13-7.07(m,6H),6.96(dd,J=6.6,2.2Hz,2H),6.91(td,J=7.6,1.2Hz,2H),3.56(d,J=14.8Hz,2H),2.84(d,J=15.2Hz,2H),2.35(dt,J=18.6,3.9Hz,2H),2.19-2.11(m,2H),2.07(t,J=4.4Hz,2H),2.01-1.93(m,2H),1.90(d,J=18.4Hz,2H)1.62-1.55(m,2H),1.42-1.35(m,2H),0.94(s,6H),0.78(s, 6H);13C-NMR(100MHz,CDCl3):δ213.6,145.8,145.1,143.3,140.1,140.1,139.1,137.5,131.2,129.3,128.9,128.3,128.1,127.3,126.7,126.4,126.2,123.3,120.2,57.8,49.0,47.9,42.8,42.4,26.8,24.7,19.7,19.6;IR:max(cm-1)3447,2960,1749,1431,1363,1163,1054,934,832,790,753;MS(MALDI):m/z1095(M+Na+,100);HR-MS(M+Na+):Calc.for C56H48O8S2Br2Na+1093.1050,Found 1093.1046。
(M)-153和(P)-153的合成如下:
(M)-153的合成:
100mL圓底燒瓶中,依次加入(M)-154a(0.50g,0.46mmol),甲醇(60mL),LiOH(0.24g,10mmol),加熱至60℃攪拌18h直到體系變為黃色澄清液,TLC檢測顯示反應完全;減壓除去大部分甲醇,加入4M HCl酸化,水層用乙酸乙酯(3×30mL)萃取,合并有機層,用飽和NaCl溶液(3×70mL)洗至中性,Na2SO4干燥。快速柱層析(硅膠H,50g,乙酸乙酯:CH2Cl2:正己烷=1:1:2)得白色固體(M)-153(0.22g,74%),只測量了旋光[α]20D:-257.4(CH2Cl2,c=0.50)。
(P)-153的合成:
由(P)-155b通過與合成(M)-153相同的步驟得到(P)-153,產率71%,旋光[α]20D:+265.6(CH2Cl2,c=0.50)。
(M)-116和(P)-116的合成如下:
(M)-116的合成:
250mL圓底燒瓶中,依次加入(M)-153(0.22g,0.34mmol),KOH(0.56g,10mmol),冰水浴冷卻,慢慢加入Me2SO4(1.0mL,10mmol),升至室溫,攪拌12h至TLC顯示產物不再增加;加入NH3(25%,5mL)攪拌2h,分液,有機層用水(5×10mL),飽和NaCl溶液(10mL)洗滌至中性,Na2SO4干燥。快速柱層析(硅膠H,30g,乙酸乙酯:CH2Cl2:正己烷=1:1:12)得白色固體(M)-116(0.21g,92%);只測量了旋光[α]20D:-284.4(CH2Cl2,c=0.10)。
(P)-116的合成:由(P)-153通過與合成(P)-116相同的步驟得到(P)-116,產率94%,只測量了旋光[α]20D:+289.1(CH2Cl2,c=0.10)。
(5)以步驟(2)中得到的光學純的(S,S)-96與步驟(4)中得到的(M)-116為原料,反應得到具有8個苯環的目標產物(M)-117、具有10個苯環的目標產物(M)-149和具有12個苯環的目標產物(M)-150,反應過程具體如下:
25mL Schlenk瓶烘烤、抽換氬氣三次后,氬氣保護下依次加入化合物(S,S)-96(104mg,0.20mmol),(M)-116(135mg,0.20mmol),經LiAH4處理的絕對無水THF(7.5mL),冷卻至-80℃,攪拌15min。然后加入n-BuLi(2.4M in hexane,0.40mL,1.0mmol),-78℃攪拌4h,然后加入無水CuCl2(0.21g,1.5mmol),-80℃下攪拌4h。慢慢升至室溫,攪拌過夜。次日,加入12%氨水(20mL),攪拌30min;分液,水相用CH2Cl2(3×30mL)萃取,合并有機層,飽和NaCl溶液(3×50mL)洗滌,Na2SO4干燥。快速柱層析(先使用硅膠H,50g,乙酸乙酯:CH2Cl2:正己烷=1:1:12~1:1:8,所得粗產物再使用硅膠H,50g,CH2Cl2:正己烷=2:3)。
首先得到白色固體(M)-117(4.1mg,收率5%)。旋光[α]20D:-483.4(CH2Cl2,c=0.10),其他數據同前。
然后得到白色固體(M)-149(10mg,收率6%)。旋光[α]20D:-690.6(CH2Cl2,c=0.10)。1H NMR(400MHz,CDCl3):δ7.18(t,J=7.8Hz,4H),7.06-6.97(m,10H),6.80(d,J=8.0Hz,4H),6.73(d,J=8.0Hz,8H),6.63(d,J=7.6Hz,4H),3.67(s,12H);13C-NMR(100MHz,CDCl3):δ156.5,143.6,141.0,140.8,140.6,138.8,138.5,128.0,126.6,126.5,126.5,126.3,126.2,126.1,120.5,110.1,56.1;IR:max(cm-1)3440,2932,1575,1456,1430,1255,1045,792,736;MS(MALDI):m/z875(M+H+,82),897(M+Na+,100)。HR-MS(M+):Calc.for C64H43O4+875.3156,Found875.3155。
最后得到白色固體(M)-150(10mg,收率9%)。旋光[α]20D:-978.0(CH2Cl2,c=0.10)。1H NMR(400MHz,CDCl3):δ7.19(t,J=7.8Hz,4H),7.06-6.98(m,12H),6.82-6。72(m,16H),6.63(d,J=7.6Hz,4H),3.67(s,12H);13C-NMR(100MHz,CDCl3):δ156.5,143.6,141.0,140.9,140.7,140.5,138.8,138.6,128.0,126.6,126.5,126.5,126.2,126.2,126.1,126.1,120.5,110.0,56.1;IR:max(cm-1)2956,2925,2853,1734,1575,1458,1430,1256,1076,1046,739,699;MS(MALDI):m/z1025(M+H+,23),1047(M+Na+,100);HR-MS(M+):Calc.for C76H49O4+1025.3625,Found1025.3642。
以步驟(2)中得到的光學純的(R,R)-96與步驟(4)中得到的(P)-116為原料,反應得到具有8個苯環的目標產物(P)-117、具有10個苯環的目標產物(P)-149和具有12個苯環的目標產物(P)-150,反應過程如下:
25mL Schlenk瓶烘烤、抽換氬氣三次后,氬氣保護下依次加入化合物(R,R)-96(104mg,0.20mmol),(P)-116(135mg,0.20mmol),經LiAH4處理的絕對無水THF(7.5mL),冷卻至-80℃,攪拌15min。然后加入t-BuLi(1.6Min pentane,1.1mL,1.8mmol),-78℃攪拌4h,然后加入無水CuCl2(0.26g,1.9mmol),-80℃下攪拌4h。慢慢升至室溫,攪拌過夜。次日,加入12%氨水(20mL),攪拌30min;分液,水相用CH2Cl2(3×30mL)萃取,合并有機層,飽和NaCl溶液(3×50mL)洗滌,Na2SO4干燥。快速柱層析(先使用硅膠H,50g,乙酸乙酯:CH2Cl2:正己烷=1:1:12~1:1:10,所得粗產物再使用硅膠H,50g, CH2Cl2:正己烷=2:3)。
首先得到白色固體(P)-117(9.0mg,收率12%)。旋光[α]20D:+527.7(CH2Cl2,c=0.10)。
然后得到白色固體(P)-149(15mg,收率9%)。旋光[α]20D:+762.0(CH2Cl2,c=0.10)。
最后得到白色固體(P)-150(13mg,收率9%)。旋光[α]20D:+913.0(CH2Cl2,c=0.10)。
實施例二:目標產物145的合成
(1’)二碘二甲氧基聯苯51經n-BuLi反應得相應的鋰化物,加入B(OMe)3反應得芳基硼酸128,然后將芳基硼酸128與四甲基乙二醇反應脫水生成硼酸酯129,反應過程具體如下:
100mL Schlenk瓶烘烤、抽換氬氣三次后,氬氣保護下依次加入化合物51(466mg,1.0mmol),THF(40mL),干冰-丙酮浴冷卻至-78℃,攪拌15min。然后加入n-BuLi(2.5M in hexane,1.0mL,2.5mmol),-78℃攪拌2h,然后加入1M B(OMe)3的THF溶液(5.0mL,5.0mmol),-78℃下攪拌2h。慢慢升至室溫,攪拌過夜。次日,加入2M HCl(20mL),攪拌30min;分液,水相用乙酸乙酯(3×30mL)萃取,合并有機層,飽和NaCl溶液(3×50mL)洗滌,Na2SO4干燥,減壓蒸去溶劑,加入pinacol(236mg,2.0mmol),甲苯(50mL),加熱回流分水2h。減壓蒸去溶劑,快速柱層析(硅膠H,50g,乙酸乙酯:CH2Cl2:正己烷=1:1:12)得白色固體129(2,2'-(6,6'-dimethoxybiphenyl-2,2'-diyl)bis(4,4,5,5-tetramethyl-1,3,2-dioxaborolane))(234mg,50%)。
1H NMR(300MHz,CDCl3):δ7.27(d,J=4.8Hz,4H),6.98(t,J=4.8Hz,2H), 3.71(s,6H),1.06(s,12H),0.99(s,12H);13C-NMR(100MHz,CDCl3):δ157.4,134.6,127.3,126.1,113.2,82.8,56.3,24.7,24.3,(B-C無13C-NMR信號);IR:max(cm-1)2978,2932,2834,1597,1568,2472,1353,1307,1256,1152,1140,1053,965,854,739,677;MS(MALDI):m/z489(M+Na+,100);E.A.:Anal.calc.for C26H36O6B2:C,66.99;H,7.78.Found:C,66.65;H,7.73。
(2’)將實施例一的步驟(1)中得到的1,16-二溴-8,9-二甲氧基四苯并環辛四烯96和所述步驟(1’)中得到的硼酸酯(129)為原料,生成具有6個苯環的目標產物145,反應過程如下:
10mL帶回流Schlenk瓶抽換氬氣三次,氬氣保護下依次加入化合物96(52.2mg,0.10mmol),化合物129(46.6mg,0.10mmol),Pd(dppf)Cl2(7.3mg,0.010mmol),1M K2CO3(aq)(0.6mL,0.6mmol)DME(4mL),液氮冷凍抽換氬氣3次,80℃下反應12h。減壓蒸去溶劑,快速柱層析(硅膠H,25g,CH2Cl2:正己烷=1:1)。得白色固體145(15.3mg,26%),化合物數據同前。
(3’)將目標產物145的甲氧基水解得四羥基化合物151,再使用樟腦磺酰氯作為拆分試劑對四羥基化合物151進行拆分,得到了帶有手性輔基的一對非對應異構體(M)-152a和(P)-152a,將(M)-152a和(P)-152a分別脫去樟腦磺酰基后,使用硫酸二甲酯將其甲基化,得到光學純的(M)-145和(P)-145,反應過程如下:
100mL燒瓶烘烤干燥、氬氣保護下,將化合物145(170mg,0.30mmol)溶解于無水CH2Cl2(60mL),冰水浴冷卻至0℃;向該溶液中緩慢滴加1M BBr3的CH2Cl2溶液(5mL,5mmol);滴加完畢,升至室溫反應12h,TLC檢測反 應完全。加入水10mL,分液,水層用乙酸乙酯(3×15mL)萃取,合并有機層,用飽和NaCl溶液(3×30mL)洗至中性,Na2SO4干燥。快速柱層析(硅膠H,30g,乙酸乙酯:CH2Cl2:正己烷=1:1:1)得白色固體151(138mg,收率89%)。1H NMR(400MHz,CDCl3):δ7.19(t,J=7.8Hz,4H),7.07(dd,J=8.0,6.8Hz,2H),6.97(d,J=7.6Hz,4H),6.86(dd,J=8.2,1.0Hz,4H),6.64(dd,J=7.4,1.0Hz,4H),4.89(br,4H);13C-NMR(100MHz,CDCl3):δ151.9,144.8,140.2,137.9,129.7,127.0,126.9,120.9,120.3,114.6;IR:max(cm-1)3504,1571,1438,1293,1278,1196,1158,957,885,792,737;MS(MALDI):m/z 519.2(M+H+,100);HR-MS(M+H+):Calc.forC36H23O4+519.1591,Found 519.1596。
250mL燒瓶烘烤干燥、氬氣保護下,依次加入化合物151(138mg,0.26mmol),R*Cl(760mg,3.0mmol),無水CH2Cl2(100mL),冰水浴冷卻下,滴加Et3N(0.86mL,6.0mmol),加完后升至室溫攪拌過夜,至TLC檢測反應完成,減壓蒸去溶劑。快速柱層析(硅膠H,100g,乙酸乙酯:CH2Cl2:正己烷=1:1:3)可得到一對非對映異構體(M)-152a和(P)-152a。
首先出來的是(M)-152a(149mg,收率40%),旋光[α]20D:-30.2(CH2Cl2,c=0.51)。1H NMR(400MHz,CDCl3):δ7.33-7.27(m,8H),7.14-7.11(m,6H),6.98(dd,J=6.8,2.0Hz,4H),3.24(d,J=14.8Hz,4H),3.10(d,J=14.8Hz,4H),2.38-2.32(m,8H),2.09-2.06(m,4H),2.05-1.97(m,4H),1.91(d,J=18.4Hz,4H),1.60-1.50(m,4H),1.43-1.36(m,4H),1.06(s,12H),0.81(s,12H);13C-NMR(100MHz,CDCl3):δ213.7,145.8,145.2,138.7,137.4,129.2,128.8,128.2,127.1,126.6,120.6,57.9,48.8,47.9,42.7,42.4,26.9,24.9,19.7,19.6;IR:max(cm-1)3470,2960,1749,1569,1374,1164,957,897,836,797,749;MS(MALDI):m/z1397(M+Na+,100);HR-MS (M+Na+):Calc.for C76H78O16S4Na+1397.4065,Found 1397.4064。
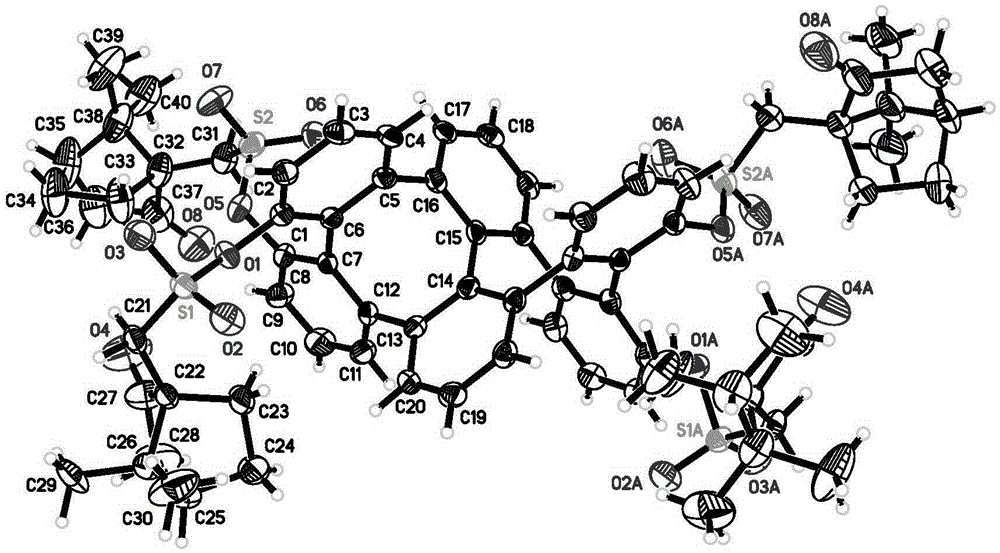
培養了(M)-152a的單晶,通過XRD確認了其絕對構型,如圖1所示。
接著出來的是(P)-152a(150mg,收率41%),旋光[α]20D:+191.8(CH2Cl2,c=0.49)。1H NMR(400MHz,CDCl3):δ7.39(dd,J=8.4,0.8Hz,4H),7.30(t,J=7.8Hz,4H),6.80(t,J=7.6Hz,2H),6.97(d,J=7.2Hz,4H),6.93(dd,J=7.6,0.8Hz,4H),3.57(d,J=14.8Hz,4H),2.86(d,J=14.8Hz,4H),2.35(dt,J=18.4,3.6Hz,4H),2.17-2.10(m,4H),2.08-2.05(m,4H),2.00-1.94(m,4H),1.90(d,J=18.4Hz,4H)1.63-1.56(m,4H),1.42-1.35(m,4H),0.94(s,12H),0.77(s,12H);13C-NMR(100MHz,CDCl3):δ213.6,145.7,145.1,138.8,137.5,129.2,128.6,128.1,127.0,126.3,126.3,120.2,57.8,49.1,47.9,42.7,42.4,26.8,24.7,19.6,19.5;IR:max(cm-1)2959,1749,1569,1438,1363,1218,1160,957,896,835,796,750;MS(MALDI):m/z1397(M+Na+,100);HR-MS(MALDI,M+Na+):Calc.for C76H78O16S4Na+1397.4065,Found1397.4052。
(M)-151的合成如下:
50mL圓底燒瓶中,依次加入(M)-152a(100mg,0.073mmol),甲醇(15mL),KOH水溶液(2.5M,2mL,5mmol),加熱至60℃攪拌18h直到體系變為黃色澄清液,TLC檢測顯示反應完全;減壓除去大部分甲醇,加入4M HCl酸化,水層用乙酸乙酯(3×50mL)萃取,合并有機層,用飽和NaCl溶液(3×100mL)洗至中性,Na2SO4干燥。快速柱層析(硅膠H,50g,乙酸乙酯:CH2Cl2:正己烷=1:1:2)得白色固體(M)-151(39.6mg,99%),只測量了旋光[α]20D:-199.8(CH2Cl2, c=0.10)。
(P)-151的合成如下:
由(P)-152a通過與合成(M)-151相同的步驟得到(P)-151,產率97%,旋光[α]20D:+183.1(CH2Cl2,c=0.10)。
光學純的目標產物(M)-145和(P)-145的合成如下:
(M)-145的合成如下:
50mL圓底燒瓶中,依次加入(M)-151(25.9mg,0.050mmol),KOH(56mg,1.0mmol),冰水浴冷卻,慢慢加入Me2SO4(0.10mL,1.0mmol),升至室溫,攪拌12h至TLC顯示產物不再增加;加入NH3(25%,5mL)攪拌2h,分液,有機層用水(5×10mL),飽和NaCl溶液(10mL)洗滌至中性,Na2SO4干燥。快速柱層析(硅膠H,30g,CH2Cl2:正己烷=1:2)得白色固體(M)-145(26.7mg,93%);只測量了旋光[α]20D:-263.8(CH2Cl2,c=0.10)。
(P)-145的合成:由(P)-151通過與合成(M)-145相同的步驟得到(P)-145,產率94%,旋光[α]20D:+296.9(CH2Cl2,c=0.10)。
實施例三
在實施例二的基礎上,還包括如下步驟:
(4’)以實施例二中的步驟(3’)中合成的四羥基化合物(151)為原料,合成具有6個苯的目標化合物(155),反應過程具體如下:
(M)-155的合成如下:
5mL燒瓶烘烤干燥后,依次加入化合物(M)-151(44mg,0.085mmol),n-C7H15Br(90mg,0.50mmol),Cs2CO3(163mg,0.50mmol),DMF(2mL),80℃加熱攪拌12h。加入H2O(20mL),用CH2Cl2(3×5mL)萃取,合并有機層,飽和NaCl溶液(3×10mL)洗滌,Na2SO4干燥。快速柱層析(先使用硅膠H,25g,乙酸乙酯:正己烷=1:20)得白色油狀物(M)-155(38mg,收率49%)。1H NMR(300MHz,CDCl3):δ7.11(t,J=7.8Hz,4H),7.01(dd,J=8.2,6.7Hz,2H),6.92(d,J=7.2Hz,4H),6.57(d,J=7.8Hz,4H),3.80-3.69(m,8H),1.49(s,br,8H),1.28-1.11(m,32H),0.86(t,J=6.6Hz,12H);13C-NMR(100MHz,CDCl3):δ156.0,143.6,141.0,138.5,127.5,127.1,126.5,126.2,120.1,111.2,68.8,31.8,29.3,29.0,25.8,22.5,14.1;IR:max(cm-1)2954,2927,2856,1574,1460,1438,1256,1138,1060,789,735;MS(MALDI):m/z910.6(M+,65),933.6(M+Na+,100);HR-MS(M+):Calc.for C64H78O4Na+933.5792,Found 933.5790。
(P)-155的合成如下:由(P)-151通過與合成(M)-155相同的步驟得到(P)-155,產率48%,旋光[α]20D:+252.3(CH2Cl2,c=0.10)。
實施例四
在實施例二的基礎上,還包括如下步驟:
(5’)以實施例二中的步驟(3’)中合成的四羥基化合物151為原料,合成具有6個苯的目標化合物156,反應過程具體如下:
(M)-156的合成如下
5mL燒瓶烘烤干燥后,依次加入化合物(M)-151(25.8mg,0.050mmol),n-C12H25Br(71mg,0.30mmol),Cs2CO3(82mg,0.26mmol),DMF(2mL),80℃加熱攪拌12h。加入H2O(20mL),用CH2Cl2(3×5mL)萃取,合并有機層,飽和NaCl溶液(3×10mL)洗滌,Na2SO4干燥。快速柱層析(先使用硅膠H,25g,乙酸乙酯:正己烷=1:20)得白色油狀物(M)-156(41mg,68%),旋光[α]20D:-188.4(CH2Cl2,c=0.10)。1H NMR(300MHz,CDCl3):δ7.11(t,J=8.0Hz,4H),7.01(dd,J=8.1,6.3Hz,2H),6.92(d,J=7.2Hz,4H),6.72(d,J=8.1Hz,4H),6.57(d,J=7.5Hz,4H),3.81-3.69(m,8H),1.49(br,8H)1.34-1.18(m,72H)0.91-0.86(m,12H);13C-NMR(100MHz,CDCl3):δ156.2,143.8,141.2,138.7,127.6,127.3,126.7,126.4,120.2,111.3,68.9,32.1,29.9,29.8,29.8,29.8,29.5,29.5,29.5,26.0,22.9,14.3;IR:max(cm-1)2961,2927,2856,1652,1635,1385,1261,1096,1023,802;
MS(MALDI):m/z1213.9(M+Na+,100);HR-MS(M+):Calc.for C84H118O4Na+1213.8922,Found 1213.8930.
(P)-156的合成如下:由(P)-151通過與合成(M)-156相同的步驟得到(P)-156,產率76%,只測量了旋光[α]20D:+211.4(CH2Cl2,c=0.10)。
通過上述實施例合成了一系列寡聚四苯并環辛四烯系列化合物后,測量了145、117、149和150一系列化合物的CD光譜,如圖2所示,從圖2中可以明顯看出,互為對應異構體的CD曲線呈鏡像分布。隨著手性的四苯并環辛四烯單元的增加,Δε的峰值也隨之上升,同樣證明了分子中的不對稱因素在增加。
以上內容是結合具體的優選實施方式對本發明所作的進一步詳細說明,不能認定本發明的具體實施只局限于這些說明。對于本發明所屬技術領域的技術人員來說,在不脫離本發明構思的前提下,還可以做出若干等同替代或明顯變型,而且性能或用途相同,都應當視為屬于本發明的保護范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 一種具有抗氧化活性的芳基苯并呋喃類化合物及其制備方法和應用與流程
- 一種含苯并雙環酮與乙氧磺隆的除草組合物及其應用的制造方法與工藝
- 一種6?氯呋喃[3,2?B]吡啶的合成方法與流程
- 一類苯并吡喃類化合物及其應用的制造方法與工藝
- 一種以二苯并環庚烯為核心的化合物及其在有機電致發光器件上的應用的制造方法與工藝
- 一種含苯并雙環酮與乙草胺的除草組合物及其應用的制造方法與工藝
- 一種含苯并雙環酮與噁草酮的除草組合物及其應用的制造方法與工藝
- 分解二噁英前體的催化劑篩選系統及其使用方法與流程
- 一種無鹵熱固性樹脂組合物以及含有它的預浸料、層壓板和印制電路板的制造方法與工藝
- 一種以二聯二苯并五元雜環為骨架的有機化合物及其在OLED上的應用的制造方法與工藝
- 6,7,8,9?四氫?5H?苯并[7]輪烯?2?烷基胺類化合物及其用途的制造方法與工藝
- 用于PHOLED的具有氮雜?二苯并噻吩或氮雜?二苯并呋喃核的新材料的制造方法與工藝
- 多孔ZSM?5沸石與γ?Al2O3復合材料的合成及制備加氫脫硫催化劑的制造方法與工藝
- 一種含有氟噻蟲砜和五氟蟲腙的殺蟲組合物的制造方法與工藝
- 苯并雙(噻二唑)衍生物、包含其的油墨、以及使用了其的有機電子裝置的制造方法
- 苯并噻二唑胺的制造方法與工藝
- 用于有機電致發光器件的材料的制造方法與工藝
- 用于有機電致發光器件的材料的制造方法與工藝
- 一種苯并噻咯類衍生物及其制備方法和有機發光器件與制造工藝
- 苯并噻吩并咔唑類衍生物及其制備方法和有機發光器件與制造工藝
- 一種具有阻燃功能的復合紗線的制作方法
- 一種具有阻燃功能的面料的制作方法
- 制動蹄自動鉚壓設備的密封橡膠圈的制作方法
- 一種混合脂肪基雙(苯并咪唑啉季銨鹽)及其制備方法與應用
- Artalbic acid的O?(苯并咪唑基)乙基與O?(二羥乙胺基)乙基衍生物的組合物在抗病毒 ...的制作方法
- 阿掏比克酸苯并咪唑基與二羥乙胺基衍生物的組合物用于制備抗骨質疏松藥物的制作方法
- 阿掏比克酸苯并咪唑基與二羥乙胺基衍生物的組合物用于制備防治胰腺纖維化藥物的制作方法
- 阿掏比克酸苯并咪唑基與二羥乙胺基衍生物的組合物用于制備抗缺氧藥物的制作方法
- 二氮芴基芳香型二酸單體及其聚苯并咪唑聚合物的合成的制作方法
- 一種苯并三唑基?亞烷基雙酚化合物的制備方法