蛋白質PGR5在調控藻類抗氧化性中的應用的制作方法
本發明涉及生物
技術領域:
,尤其涉及蛋白質PGR5在調控藻類抗氧化性中的應用。
背景技術:
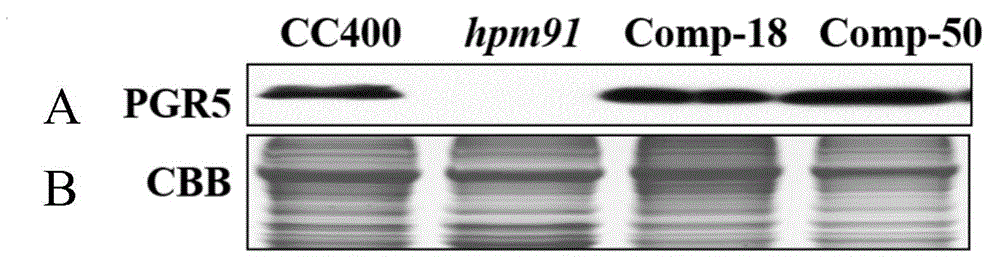
:萊茵衣藻(Chlamydomonasreinhardtii)是單細胞、真核生物,隸屬于綠藻門、團藻目、衣藻科中的衣藻屬,是廣泛用于光合作用與產氫過程和機理研究的重要模式藻種。近年來隨著資源、能源及環境等各種危機的日益加劇,各國政府及工業界都十分重視研究和開發不占用耕地的微藻生物資源。篩選并獲得具有較強抗氧化能力的衣藻株系對有效開發和利用藻類資源,促進藻類資源的可持續發展有重要價值。技術實現要素:本發明要解決的技術問題是如何調控藻類的抗氧化性。為解決上述技術問題,本發明首先提供了蛋白質PGR5在調控藻類抗氧化性中的應用。本發明所提供的蛋白質PGR5為如下a1)或a2)或a3)的蛋白質:a1)氨基酸序列是序列表中序列1所示的蛋白質;a2)在序列表中序列1所示的蛋白質的N端或/和C端連接標簽得到的融合蛋白質;a3)將序列表中序列1所示的氨基酸序列經過一個或幾個氨基酸殘基的取代和/或缺失和/或添加得到的與抗氧化性相關的蛋白質。其中,序列表中序列1由141個氨基酸殘基組成。為了使a1)中的蛋白質便于純化,可在序列表中序列1所示的蛋白質的氨基末端或羧基末端連接上如表1所示的標簽。表1、標簽的序列標簽殘基序列Poly-Arg5-6(通常為5個)RRRRRPoly-His2-10(通常為6個)HHHHHHFLAG8DYKDDDDKStrep-tagII8WSHPQFEKc-myc10EQKLISEEDL上述a3)中的蛋白質PGR5,所述一個或幾個氨基酸殘基的取代和/或缺失和/或添加為不超過10個氨基酸殘基的取代和/或缺失和/或添加。上述a3)中的蛋白質PGR5可人工合成,也可先合成其編碼基因,再進行生物表達得到。上述a3)中的蛋白質PGR5的編碼基因可通過將序列表序列2所示的DNA序列中缺失一個或幾個氨基酸殘基的密碼子,和/或進行一個或幾個堿基對的錯義突變,和/或在其5′端和/或3′端連上表1所示的標簽的編碼序列得到。編碼所述蛋白質PGR5的核酸分子在調控藻類抗氧化性中的應用也屬于本發明的保護范圍。上述應用中,所述編碼所述蛋白質PGR5的核酸分子可為如下b1)或b2)或b3)或b4)所示的基因:b1)核苷酸序列是序列表中序列2的cDNA分子或DNA分子;b2)其編碼序列是序列表中序列2核苷酸所示的DNA分子或cDNA分子;b3)與b1)或b2)限定的核苷酸序列具有75%或75%以上同一性,且編碼所述蛋白質PGR5的cDNA分子或基因組DNA分子;b4)在嚴格條件下與b1)或b2)限定的核苷酸序列雜交,且編碼所述蛋白質PGR5的cDNA分子或基因組DNA分子。其中,所述核酸分子可以是DNA,如cDNA、基因組DNA或重組DNA;所述核酸分子也可以是RNA,如mRNA或hnRNA等。其中,序列表序列2由426個核苷酸組成,序列表序列2的核苷酸編碼序列表序列1所示的氨基酸序列。本領域普通技術人員可以很容易地采用已知的方法,例如定向進化和點突變的方法,對本發明的編碼蛋白質PGR5的核苷酸序列進行突變。那些經過人工修飾的,具有與本發明分離得到的蛋白質PGR5的核苷酸序列80%或者更高同一性的核苷酸,只要編碼蛋白質PGR5且與抗氧化性相關,均是衍生于本發明的核苷酸序列并且等同于本發明的序列。這里使用的術語“同一性”指與天然核酸序列的序列相似性。“同一性”包括與本發明的編碼序列表的序列1所示的氨基酸序列組成的蛋白質的核苷酸序列具有75%或更高,或80%或更高,或85%或更高,或90%或更高,或95%或更高同一性的核苷酸序列。同一性可以用肉眼或計算機軟件進行評價。使用計算機軟件,兩個或多個序列之間的同一性可以用百分比(%)表示,其可以用來評價相關序列之間的同一性。上述應用中,所述藻類是如下c1)-c6)中的任一種:c1)綠藻門藻類;c2)團藻目藻類;c3)衣藻科藻類;c4)衣藻屬藻類;c5)萊茵衣藻;c6)萊茵衣藻藻種(Chlamydomonasreinhardtii)CC400(mt-)。上述應用中,所述抗氧化性為抗外源活性氧化劑。本發明還提供了一種培育重組藻類的方法一。本發明所提供的一種培育重組藻類的方法一,包括如下步驟:向目的藻類中導入所述蛋白質PGR5的編碼基因,得到抗氧化性低于所述目的藻類的重組藻類。所述重組藻類可為萊茵衣藻(Chlamydomonasreinhardtii)91號,于2013年12月31日保藏于中國微生物菌種保藏管理委員會普通微生物中心(簡稱CGMCC,地址為:北京市朝陽區北辰西路1號院3號),保藏編號為CGMCCNO.8706。所述萊茵衣藻(Chlamydomonasreinhardtii)91號為向萊茵衣藻(Chlamydomonasreinhardtii)CC400(mt+)中導入pChlamiRNA3質粒(購買自美國杜克大學萊茵衣藻中心(Chlamycenter,http://www.chlamy.org/),得到的重組衣藻。本發明還提供了一種培育重組藻類的方法二。本發明所提供的一種培育重組藻類的方法二,包括如下步驟:沉默出發藻類基因組中的所述蛋白質PGR5的編碼基因,得到抗氧化性高于所述出發藻類的重組藻類。上述方法中,所述蛋白質PGR5的編碼基因可為如下d1)或d2)或d3)或d4)所示的基因:d1)核苷酸序列是序列表中序列2的cDNA分子或DNA分子;d2)其編碼序列是序列表中序列2核苷酸所示的DNA分子或cDNA分子;d3)與d1)或d2)限定的核苷酸序列具有75%或75%以上同一性,且編碼所述蛋白質PGR5的cDNA分子或基因組DNA分子;d4)在嚴格條件下與d1)或d2)限定的核苷酸序列雜交,且編碼所述蛋白質PGR5的cDNA分子或基因組DNA分子。上述方法中,所述藻類是如下c1)-c6)中的任一種:c1)綠藻門藻類;c2)團藻目藻類;c3)衣藻科藻類;c4)衣藻屬藻類;c5)萊茵衣藻;c6)萊茵衣藻藻種(Chlamydomonasreinhardtii)CC400(mt-)。上述方法中,所述抗氧化性為抗外源活性氧化劑。上述任一所述外源活性氧化劑可為H2O2或tBOOH。實驗證明,將PGR5基因轉入突變藻株91號,得到轉PGR5基因萊茵衣藻。突變藻株91對H2O2和tBOOH的抗性高于轉PGR5基因萊茵衣藻對H2O2和tBOOH的抗性,表明,由于PGR5基因的缺失,導致突變藻株91對H2O2和tBOOH的抗性顯著提高,這對篩選并獲得具有較強抗氧化能力的衣藻株系,對有效開發和利用藻類資源,促進藻類資源的可持續發展有重要價值。附圖說明圖1為轉PGR5基因萊茵衣藻的蛋白水平檢測結果。圖2為H2O2處理轉PGR5基因萊茵衣藻的表型分析及生長曲線。圖3為H2O2和tBOOH處理轉PGR5基因萊茵衣藻的平板恢復實驗。具體實施方式下面結合具體實施方式對本發明進行進一步的詳細描述,給出的實施例僅為了闡明本發明,而不是為了限制本發明的范圍。下述實施例中的實驗方法,如無特殊說明,均為常規方法。下述實施例中所用的材料、試劑等,如無特殊說明,均可從商業途徑得到。萊茵衣藻(Chlamydomonasreinhardtii)CC400(mt-)(簡稱為萊茵衣藻CC400),從美國杜克大學萊茵衣藻中心(Chlamycenter,http://www.chlamy.org/)購買。萊茵衣藻(Chlamydomonasreinhardtii)91號(為突變菌株,因此下文中簡稱突變藻株91號):于2013年12月31日,保藏于中國微生物菌種保藏管理委員會普通微生物中心(簡稱CGMCC,地址為:北京市朝陽區北辰西路1號院3號),保藏編號為CGMCCNO.8706,分類命名為萊茵衣藻(Chlamydomonasreinhardtii)。遺傳背景:向萊茵衣藻(Chlamydomonasreinhardtii)CC400(mt-)中導入pChlamiRNA3質粒(含有巴龍霉素抗性基因,購買與美國杜克大學萊茵衣藻中心(Chlamycenter,http://www.chlamy.org/),得到重組衣藻。質粒pDble:由倫敦大學學院Saulpurton教授提供,記載于“GrovensteinPB,WilsonDA,LennoxCGetal.(2013)IdentificationandmolecularcharacterizationofanovelChlamydomonasreinhardtiimutantdefectiveinchlorophyllbiosynthesisF1000Research2013,2:138”一文,該載體含有博來霉素抗性基因。瓊脂糖凝膠DNA回收試劑盒為天根生化科技(北京)有限公司產品,產品目錄號為DP209-03。pEasy-bluntsimple載體、大腸桿菌(Escherichiacoli)Trans-T1感受態細胞均為北京全式金生物技術有限公司的產品。tBOOH為國藥集團化學試劑有限公司產品。下述實施例中所用的培養基及固體平板:(1)TAP液體培養基:NH4Cl0.4g/L,MgSO4·7H2O0.1g/L,CaC12·2H2O0.05g/L,K2HPO40.108g/L,KH2PO40.056g/L,Trisbase2.423g/L,亨特微量元素(Hunter’straceelements)1mL/L,冰乙酸1ml/L;其余為水;其中亨特微量元素(Hunter’straceelements)配方如下:H3BO411.4g/L,ZnSO4·7H2O22.0g/L,MnCl2·4H2O5.06g/L,CoCl2·6H2O1.61g/L,CuSO4·5H2O1.57g/L,(NH4)6Mo7O24·4H2O1.10g/L,FeSO4·7H2O4.99g/L,其余為水。(2)TAP固體培養基:在TAP液體培養基中加入瓊脂粉并使其濃度為1.5g/100mL。(3)博來霉素平板:含有10μg/L的博來霉素的TAP固體培養基,趁熱倒入培養 皿中,得到博來霉素平板。(4)TAP固體平板:在TAP液體培養基中加入瓊脂粉并使其濃度為1.5g/100mL趁熱倒入培養皿中,得到TAP固體平板。實施例1、PGR5蛋白的功能驗證一、互補載體構建互補載體的構建步驟如下:1、萊茵衣藻CC400總RNA的提取采用植物總RNA提取試劑盒(天根生化科技(北京)有限公司產品)并按使用說明書從萊茵衣藻CC400中提取總RNA。具體步驟如下:(1)用接種針從TAP固體培養基上挑取萊茵衣藻CC400單克隆,接種到TAP液體培養基中,置于恒溫光照培養箱中的搖床上連續光照培養(25℃,60rpm,100μEs-1m-2),,獲得衣藻細胞培養液1(萊茵衣藻CC400的細胞濃度為4-6×106個/mL培養液)。(2)取2mL步驟(1)獲得的衣藻細胞培養液1,5000rpm離心5min后,加入1mL裂解液RZ,振蕩混勻,室溫放置5min,然后4℃、12000rpm離心5min,取上清,轉入新的無RNase的離心管中。(3)向完成步驟(2)的離心管中加200μL氯仿,蓋好管蓋,劇烈振蕩15s,室溫放置3min,然后4℃、12000rpm離心10min,把上層水相轉移到新的無RNase的離心管中。(4)向步驟(3)得到的裝有上層水相的離心管中緩慢加入0.5倍體積的無水乙醇,混勻,將得到的溶液和沉淀全部轉入吸附柱中,然后4℃、12000rpm離心30s,棄廢液。(5)向完成步驟(4)的吸附柱中加500μL去蛋白液,4℃、12000rpm離心30s,棄廢液。(6)向完成步驟(5)的吸附柱中加700μL漂洗液,室溫靜置2min,4℃、12000rpm離心30s,棄廢液。(7)向步驟(6)的吸附柱中加500μL漂洗液,室溫靜置2min,4℃、12000rpm離心30s,棄廢液。(8)將步驟(7)的吸附柱4℃、12000rpm離心2min,去除殘余液體,開蓋晾干。(9)將步驟(8)的吸附柱轉入一個新的無RNase的離心管中,加50μLRNase-freeddH2O,室溫放置2min,4℃、12000rpm離心2min。步驟(9)的離心管中的液體即為萊茵衣藻CC400的總RNA。2、cDNA第一鏈合成以步驟1獲得的萊茵衣藻CC400的總RNA為模板,使用cDNA第一鏈合成試劑盒(北 京全式金生物技術有限公司)合成cDNA第一鏈。反應程序為:50℃溫浴30min,然后70℃加熱15min終止反應。反應體系(20μL):2μL10×TSIImix,1μlOligodT20(在反應體系中的終濃度為10μM),1-5μg萊茵衣藻CC400的總RNA,補滅菌雙蒸水至20μL。3、PGR5基因的獲得(1)引物合成在生工生物工程(上海)股份有限公司合成上游引物和下游引物,引物序列如下:上游引物:5’-CATATGCTGGCCTCCAAGCCCGTTGT-3’(下劃線部分為NdeI的識別序列,該序列的第4-26位為序列表中序列2的第1-23位);下游引物:5’-GAATTCTTAAGCCAGGAAGCCCAGCTTC-3’(下劃線部分為EcoRI的識別序列,該序列的第7-28位為序列表中序列2的第405-426位的反向互補序列)。(2)PCR擴增以步驟2合成的cDNA第一鏈為模板,以上游引物和下游引物為引物,進行PCR擴增,獲得426bp的PCR擴增產物。反應程序:98℃預變性2min;98℃變性10s,60℃退火15s,72℃延伸1min,35個循環;72℃延伸5min。反應體系(25μL):2×HSGCbufferI12.5μL,dNTPmixture(各2.5mM)2μL,模板cDNA1μL,PRIMERSTAR(5U/μL)0.5μL,上游引物1μL,下游引物1μL,補ddH2O至25μL。(3)測序用瓊脂糖凝膠DNA回收試劑盒回收純化步驟(2)獲得的PCR擴增產物,然后與pEasy-bluntsimple載體連接,轉化大腸桿菌(Escherichiacoli)Trans-T1感受態細胞,用藍白斑方法篩選陽性克隆。挑取單克隆培養,用通用引物M13F和M13R進行PCR鑒定,將陽性克隆送至北京三博生物技術有限責任公司測序。測序結果表明,陽性克隆中含有序列表中序列2所示的核苷酸序列,將該陽性克隆的命名為pEasy-PGR5。將序列表中序列2所示基因命名為PGR5基因,編碼序列表中序列1所示的蛋白質,將該蛋白命名為PGR5蛋白,由141個氨基酸殘基組成。經鑒定突變藻株91號中,PGR5基因被沉默了。4、用限制性內切酶NdeI和EcoRI雙酶切步驟3的(2)得到的PCR擴增產物,用瓊脂糖凝膠DNA回收試劑盒回收426bp的DNA片段。5、用限制性內切酶NdeI和EcoRI雙酶切質粒pDble,用瓊脂糖凝膠DNA回收試劑盒回收約7.29kb的載體骨架。6、將載體骨架與步驟4得到的DNA片段連接,得到重組質粒pDble-PGR5。根據測序結果,對重組質粒pCT-fogac進行結構描述如下:將質粒pDble的NdeI識別序列和EcoRI識別序列間的DNA小片段替換為核苷酸序列是序列表的序列2自5'末端第7位至第426位所示的DNA分子,得到重組質粒pDble-PGR5。7、用限制性內切酶KpnI酶切重組質粒pDble-PGR5,用瓊脂糖凝膠DNA回收試劑盒回收約7.7kb的線性化質粒pDble-PGR5。二、轉PGR5基因萊茵衣藻的獲得用玻璃珠法將步驟一中7的線性化質粒pDble-PGR5轉化突變藻株91號,具體步驟如下:1、用接種針從TAP固體培養基上挑取突變藻株91號單克隆,接種到TAP液體培養基中,置于恒溫光照培養箱中的搖床上連續光照培養(25℃,60rpm,100μEs-1m-2),,獲得衣藻細胞培養液2(突變藻株91號的細胞濃度為4-6×106個/mL培養液)。2、稱取0.1g玻璃珠(直徑425-600μm,Sigma公司產品),置于1.5mL離心管中,121℃滅菌20min后,放于室溫待用。3、向完成步驟2的離心管加入100μl步驟1獲得的衣藻細胞培養液2和10μl步驟一中7的線性化質粒pDble-PGR5(5μg/μl),然后渦旋震動15s,室溫25℃放置4min。4、完成步驟3后,將離心管中的藻液轉移到新鮮的TAP液體培養基中,置于恒溫光照培養箱中的搖床上連續光照培養24小時后(25℃,60rpm,110μEs-1m-2),2500rpm離心,收集沉淀用TAP液體培養基重懸,涂布在博來霉素平板上,兩周后,獲得擬轉PGR5基因萊茵衣藻。用質粒pDble代替線性化質粒pDble-PGR5,其它同步驟1-4,得到轉空載體萊茵衣藻,作為對照。三、轉PGR5基因萊茵衣藻的分子水平鑒定以步驟二獲得的擬轉PGR5基因萊茵衣藻中隨機選取的兩株(分別命名為Comp-18和Comp-50)、轉空載體萊茵衣藻、突變藻株91號和萊茵衣藻CC400為實驗材料。在轉錄水平檢測各藻株中PGR5基因的表達量。按照步驟一中1和2的方法,提取各實驗材料的總RNA并反轉錄獲得cDNA。以cDNA為模板,通過實時熒光定量PCR方法分析PGR5基因在各實驗材料中的相對表達量(以CBLP基因為內參基因)。同時以等體積ddH2O為模板,其它步驟均相同,設置陰性對照。擴增PGR5基因的引物序列為:引物1:5’-CCTCTGGTCATCGTTGTTCGC-3’;引物2:5’-TTAAGCCAGGAAGCCCAGC-3’。擴增內參CBLP基因的引物序列為:引物3:5’-ATGACCACCAACCCCATCATC-3’,引物4: 5’-GGTCCCACAGCATGGCAATG-3’。反應程序:94℃預變性4min;94℃變性30s,60℃退火30s,72℃延伸20s,35個循環;72℃延伸5min。反應體系:2×GCIbufferI10μL,dNTPmixture(各2.5mM)2μL,模板cDNA(1μg/μL)1μL,LA-Taq(5U/μL)0.5μL,上游引物(10μM)1μL,下游引物(10μM)1μL,補ddH2O至20μL。結果表明,突變藻株91號和轉空載體萊茵衣藻中擴增不出PGR5基因;而Comp-18和Comp-50中PGR5基因的表達量與萊茵衣藻CC400中PGR5基因的表達量基本一致,無統計學差異。四、轉PGR5基因萊茵衣藻的蛋白水平鑒定以Comp-18、Comp-50、轉空載體萊茵衣藻、突變藻株91號和萊茵衣藻CC400為實驗材料。在蛋白水平檢測各藻株中PGR5蛋白的表達量。用PetersonGL(1977)SimplificationofproteinassaymethodofLowryetal-whichismoregenerallyApplicable.AnalBiochem83:346-356記載的方法提取各實驗材料的總蛋白,進行SDS-PAGE分離,然后通過考馬斯亮藍染色(指示總蛋白的濃度)和Westernblot實驗(以PGR5抗體作為一抗檢測PGR5蛋白),實驗結果見圖1(圖1中A為Westernblot實驗結果,圖1中B為考馬斯亮藍染色結果,其中CC400為萊茵衣藻CC400,hpm91為突變藻株91號,Comp-18和Comp-50為轉入PGR5基因的突變藻株91號的兩個互補藻株)。PGR5抗體為由北京博爾邁生物技術有限公司制備,制備方式具體為用2mgPGR5重組蛋白免疫兔,收集血清得到PGR5抗體。PGR5重組蛋白的制備方法如下:(1)將上述步驟一中的pEasy-PGR5單克隆接種到900mL含50mg/L卡那霉素的LB液體培養基,37℃培養,當大腸桿菌的培養菌液的OD600達到0.6~0.8,加入異丙基β-D-1-硫代半乳糖苷(IPTG),使IPTG在體系中濃度為0.5mM,28℃誘導6h,得到誘導后的培養菌液。(2)將步驟(1)誘導后的培養菌液用4000rpm、離心20min,收集菌體,然后用高壓細胞破碎儀裂解,得到全細胞裂解液,30000g離心50min,經檢測,重組蛋白在沉淀的包涵體中,用洗滌緩沖液(20mMTris-HClpH8.0,500mMNaCl,0.2mMDTT,2%Triton,2MUrea)洗滌包涵體,用溶解緩沖液(20mMTris-HClpH8.0,500mMNaCl,0.2mMDTT,2%Triton,8MUrea)溶解包涵體,離心取上清上樣至鎳離子金屬親和層析柱(鎳-氨乙二酸(Nickel-nitrilotriaceticacid,Ni-NTA)瓊脂糖介質填充的層析柱,層析柱型號E0001V,紐英倫生物技術公司產品),用5mL漂洗液(20mMTris-HClpH8.0,500mMNaCl,10mMimidazole)漂洗去除雜蛋白, 然后用5mL洗脫緩沖液(20mMTris-HClpH8.0,500mMNaCl,300mMimidazole)洗脫并收集重組蛋白。用透析液(50mMTris-HAcpH8.0,1mMdithiothreitol)對洗脫的重組蛋白冰上透析過夜。12%SDS-PAGE檢測純化得到的PGR5重組蛋白。結果表明,突變藻株91號和轉空載體萊茵衣藻中無PGR5蛋白表達;而Comp-18和Comp-50中PGR5蛋白的表達量均與萊茵衣藻CC400中PGR5蛋白的表達量基本一致,無統計學差異。可見,Comp-18和Comp-50均為突變藻株91號的互補藻株。五、抗氧化性比較通過外加活性氧試劑處理衣藻細胞,檢測衣藻細胞(Comp-18、Comp-50、突變藻株91號或萊茵衣藻CC400)的抗氧化性。實驗重復三次,取平均值。1、用接種針從TAP固體培養基上挑取衣藻細胞單克隆,接種到TAP液體培養基中,置于恒溫光照培養箱中的搖床上連續光照培養(25℃,60rpm,100μEs-1m-2),獲得衣藻細胞培養液(衣藻細胞的細胞濃度均為5×106個/mL培養液)。取衣藻細胞培養液,調節衣藻細胞在750nm處光吸收值為0.05,然后加入H2O2,使H2O2在體系中的終濃度1mM,置于恒溫光照培養箱中的搖床上,25℃、60rpm、60μEs-1m-2連續光照培養。從加入H2O2開始計時,在培養過程中每12小時取樣,測定衣藻細胞在750nm處光吸收值。以培養時間為橫坐標,衣藻細胞在750nm處光吸收值為縱坐標,繪制衣藻細胞的生長曲線。實驗結果見圖2(圖2中A為衣藻細胞用1mMH2O2處理24h和48h生長狀態,圖2中B為衣藻細胞用1mMH2O2處理0h-48h的生長曲線;其中CC400為萊茵衣藻CC400,hpm91為突變藻株91號,Comp-18和Comp-50為轉PGR5基因萊茵衣藻的兩個株系)。結果表明,用1mMH2O2處理衣藻細胞,突變藻株91號的細胞生長速率大于萊茵衣藻CC400、Comp-18和Comp-50的細胞生長速率。2、用接種針從TAP固體培養基上挑取衣藻細胞單克隆,接種到TAP液體培養基中,置于恒溫光照培養箱中的搖床上連續光照培養(25℃,60rpm,100μEs-1m-2),懸浮培養衣藻細胞,獲得衣藻細胞培養液(衣藻細胞的細胞濃度均為2×106個/mL培養液)取24孔板,每孔加入1mL衣藻細胞培養液,然后加入H2O2,使H2O2在體系中的濃度為0mM、1mM、3mM或5mM,置于恒溫光照培養箱中的搖床上,25℃、80rpm、50μEs-1m-2連續光照培養,培養24h后,每孔取5μL均勻涂布在TAP固體平板上,置于恒溫光照培養箱連續光照培養(25℃,60μEs-1m-2),從涂布在TAP固體平板上開始計時,一周后觀察恢復情況并拍照記錄,得到不同濃度H2O2處理后的平板恢復實驗結果。每個H2O2濃度設置5個復孔。按照上述方法,將H2O2替換為tBOOH,H2O2在體系中的濃度為0mM、1mM、3mM或5mM替換為tBOOH在體系中的濃度為0μM、60μM、80μM或100μM,其它步驟均不變, 得到不同濃度tBOOH處理后的平板恢復實驗結果。實驗結果見圖3(圖3中左圖為不同濃度H2O2處理后的平板恢復實驗結果,圖3中右圖為不同濃度tBOOH處理后的平板恢復實驗結果;其中CC400為萊茵衣藻CC400,hpm91為突變藻株91號,Comp-18和Comp-50為轉入PGR5基因的突變藻株91號的兩個互補藻株)。結果表明,突變藻株91對H2O2和tBOOH的抗性都高于萊茵衣藻CC400、Comp-18和Comp-50對H2O2和tBOOH的抗性,可見,由于PGR5基因的缺失,導致突變藻株91對H2O2和tBOOH的抗性顯著提高。當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1