一種新型的淀粉酶的制作方法
本發明屬于淀粉酶領域,具體涉及一種新型淀粉酶。
背景技術:
淀粉酶(amylase)是一種可以水解淀粉,糖原和多糖,并使它們轉化為糖的一類酶的統稱。廣泛分布于植物,動物,微生物中,大量生產還是依賴于微生物的發酵,是一種研究最廣,時間最久,應用最早的工業用酶,占整個酶制劑用量的50%以上。主要有以下幾類:
α-淀粉酶:主要水解底物內部的糖苷鍵;
β-淀粉酶:主要從非還原性末端將麥芽糖單位水解下來;
葡萄糖淀粉酶:從底物的非還原性末端將葡萄糖單位水解下來;
脫支酶:只對支鏈淀粉,糖原等分支點的α-1,6糖苷鍵有專一性。可參見張樹正,《酶制劑工業》,北京:科學出版社,1984。
淀粉酶被廣泛應用在不同工業:
1、釀酒應用:將淀粉直接發酵生產乙醇,在酒精生產和釀酒工業中使用淀粉酶,能保證發酵物中的酶活性一致,能夠提高糖化率,酒精出率和酵母的生長,除此以外,還能夠提高啤酒的口感。
2、烘焙應用:面包烘烤工業中,使用淀粉酶可以使產品體積更大,顏色更好,顆粒更柔軟,對面包的口感,品質也都有促進作用。
3、淀粉脫漿:現代纖維制造工藝容易產生大量的細菌,為防止紗線斷裂,往往在表面加一層淀粉,淀粉脫漿可以用淀粉酶水解淀粉,因而容易被洗掉,反應過程綠色,環保,無污染〔呂晶、陳水林,“酶及其在紡織加工中的應用”,《紡織學報》,2002,2(23):155-157〕。
4、除垢劑中的應用:在除垢劑中,淀粉酶也是其中重要成分之一,其主要功能是能夠使除垢劑更加溫和,降低殘留對人體的傷害。目前已經被大量應 用于洗滌行業,市場占有率最高的淀粉酶廠家是諾維信和杰能科,主要優點是通過利用基因改造得技術使得它們的酶具有良好的儲存穩定性〔Van Ee J H、van Rijswijk W C、Bollier M.,Enzymatic automated dish-wash detergents,Chim Oggi,1992,10:21-24〕。
目前國際上只有諾維信,丹尼斯特和帝斯曼等少數幾家公司擁有真菌淀粉酶的先進生產技術與產品,發酵水平在2000U/g以上,我國在淀粉酶上的相關技術還存在不足,國內報道的發酵水平大多數在200-600U/g,國內市場供應的淀粉酶都還是來自國外,國內企業在競爭上還是處于劣勢〔李松、王正祥,“真菌α-淀粉酶的研究進展”,《生物技術通報》,2011(3):67-7〕。
技術實現要素:
本發明提供一種分離的多肽,該多肽含有:
(1)SEQ ID NO:2第1-306位氨基酸序列;或
(2)在(1)所述的氨基酸序列中經過取代、缺失或添加一個或幾個氨基酸,同時保留SEQ ID NO:2第1-306位氨基酸序列所具備的磷脂酶活性的由(1)衍生的多肽。
在一個具體實施方式中,所述分離的多肽:
(a)如SEQ ID NO:2所示,或
(b)含有選自前導肽、末端延伸、GST、麥芽糖E結合蛋白、蛋白A、如6His或Flag的標簽,或Xa因子或凝血酶或腸激酶的蛋白水解酶位點的氨基酸序列。
本發明提供一種分離的多核苷酸序列,選自:
(1)編碼本發明所述分離的多肽的多核苷酸序列;和
(2)(1)所述多核苷酸序列的互補序列。
在一個具體實施方式中,所述多核苷酸序列選自:
(1)SEQ ID NO:1所示的多核苷酸序列;和
(2)(1)所述的多核苷酸序列的互補序列。
本發明還提供一種核酸構建體,該核酸構建體包含本發明多核苷酸序列。
在一個具體實施方式中,所述核酸構建體是表達載體。
本發明還提供一種遺傳工程化的宿主細胞,所述宿主細胞含有本發明的多核苷酸序列或核酸構建體。
本發明還提供一種組合物,該組合物含有本發明多肽。
本發明還提供本發明多肽在酒精生產、釀酒、烘焙、淀粉脫漿和除垢劑制備領域中的應用。
本發明還提供一種調節(提高或抑制)本發明多肽的酶活的方法,所述方法包括:
(1)在所述多肽的使用環境中添加含Mn2+、Mg2+、NH4+、或Ca2+的溶液;和/或
(2)將所述多肽的使用環境的溫度控制在65~70℃之間,優選在67.5~70℃之間;和/或
(3)將所述多肽的使用環境的pH控制在6.5~7.5之間,優選約為7.5。
在一個具體實施例中,所述調節為提高酶活,所述方法包括在所述多肽的使用環境中添加含Mn2+離子的溶液。
在一個具體實施例中,所述調節為抑制酶活,所述方法包括在所述多肽的使用環境中添加含Mg2+、NH4+和/或Ca2+的溶液。
附圖說明
圖1顯示不同溫度下本發明淀粉酶BM4的酶活。
圖2顯示本發明淀粉酶BM4的穩定性測試。
圖3顯示本發明淀粉酶BM4在不同pH條件下的酶活。
圖4顯示本發明淀粉酶BM4在不同pH條件下的穩定性。
圖5顯示金屬離子對本發明淀粉酶BM4酶活的影響。
圖6顯示本發明淀粉酶BM4的凝膠電泳檢測結果,箭頭所指為本發明蛋白。
圖7顯示OD值與淀粉含量相關性標準曲線。
具體實施方式
本發明提供一種新型的淀粉酶,其編碼序列,含編碼序列的核酸構建體或 表達載體,含編碼序列或核酸構建體或表達載體的宿主細胞,以及所述淀粉酶的用途等。
具有淀粉酶活性的多肽
本發明提供氨基酸序列如SEQ ID NO:2所示的多肽。本發明還包括在SEQ ID NO:2的基礎上具有一個或多個(通常為1-10個,例如1、2、3、4、5、6、7、8、9或10個)氨基酸缺失、插入和/或取代,尤其是在C末端和/或N末端添加一個或數個(通常為20個以內,較佳地為10個以內,更佳地為8以內)氨基酸的多肽。優選是保守性變異形式。例如,在本領域中,用性能相近或相似的氨基酸進行保守性取代時,通常不會改變蛋白質或多肽的功能。“性能相近或相似的氨基酸”包括例如,具有相似側鏈的氨基酸殘基的家族,這些家族包括具有堿性側鏈的氨基酸(例如賴氨酸、精氨酸、組氨酸)、具有酸性側鏈的氨基酸(例如天冬氨酸、谷氨酸)、具有不帶電荷的極性側鏈的氨基酸(例如甘氨酸、天冬酰胺、谷氨酰胺、絲氨酸、蘇氨酸、酪氨酸、半胱氨酸)、具有非極性側鏈的氨基酸(例如丙氨酸、纈氨酸、亮氨酸、異亮氨酸脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸)、具有β-分支側鏈的氨基酸(例如蘇氨酸、纈氨酸、異亮氨酸)和具有芳香側鏈的氨基酸(例如酪氨酸、苯丙氨酸、色氨酸、組氨酸)。因此,在本發明多肽中用來自同一側鏈類的另一氨基酸殘基替換一個或幾個位點,將不會在實質上影響其活性。
此外,本領域技術人員公知,在基因克隆操作中,常常需要設計合適的酶切位點,這勢必在所表達的蛋白末端引入一個或多個不相干的殘基,而這并不影響目的蛋白的活性。又如為了構建融合蛋白、促進重組蛋白的表達、獲得自動分泌到宿主細胞外的重組蛋白、或利于重組蛋白的純化,常常需要將一些氨基酸添加至重組蛋白的N-末端、C-末端或該蛋白內的其它合適區域內,例如,包括但不限于,適合的接頭肽、信號肽、前導肽、末端延伸、谷胱甘肽S-轉移酶(GST)、麥芽糖E結合蛋白、蛋白A、如6His或Flag的標簽,或Xa因子或凝血酶或腸激酶的蛋白水解酶位點。應理解,這些氨基酸序列的存在不會影響到所得多肽的活性。因此,本發明也包括在本發明多肽的C末端和/或N末端添加一個或數個氨基酸(例如前述接頭肽、信號肽、前導肽、末端延伸、GST、 麥芽糖E結合蛋白、蛋白A、如6His或Flag的標簽,或Xa因子或凝血酶或腸激酶的蛋白水解酶位點等)所得的多肽,這些多肽仍具有本文所述的磷脂酶活性。
根據重組生產方案所用的宿主,本發明的多肽可以是糖基化的,或可以是非糖基化的。
本發明的多肽可以是天然純化的產物,或是化學合成的產物,或使用重組技術從原核或真核宿主(例如,細菌、酵母、高等植物、昆蟲和哺乳動物細胞)中產生。
多核苷酸
本申請包括編碼本發明多肽的核苷酸序列或其互補序列。SEQ ID NO:1顯示了本發明多肽的編碼序列之一。所述“編碼序列”包括編碼本發明所述多肽的核酸序列。編碼本發明多肽的序列可以與SEQ ID NO:1所示的編碼區序列相同或者是簡并的變異體。如本文所用,“簡并的變異體”在本發明中是指編碼包含SEQ ID NO:2的氨基酸序列,但與SEQ ID NO:1所示的核苷酸序列有差別的核苷酸序列。
編碼本發明多肽的序列包括:只編碼成熟多肽的編碼序列;成熟多肽的編碼序列和各種附加編碼序列;成熟多肽的編碼序列(和任選的附加編碼序列)以及非編碼序列。
本發明還涉及上述多核苷酸的變異體,其編碼與本發明有相同的氨基酸序列的片段、類似物、衍生物和變異形式。此多核苷酸的變異體可以是天然發生的等位變異體或非天然發生的變異體。這些核苷酸變異體包括取代變異體、缺失變異體和插入變異體。如本領域所知的,等位變異體是一個多核苷酸的替換形式,它可能是一個或多個核苷酸的取代、缺失或插入,但不會從實質上改變其編碼的蛋白的功能。
本發明也包括編碼本發明多肽的核酸序列(如SEQ ID NO:1或其互補序列)的片段。如本文所用,“核酸片段”的長度至少含15個核苷酸,較好是至少30個核苷酸,更好是至少50個核苷酸,最好是至少100個核苷酸以上。核酸片段可用于核酸的擴增技術(如PCR)以確定和/或分離編碼本發明多肽的 多核苷酸。因此,在某些實施例中,核酸片段的長度在15-30個堿基。可采用現有技術從本發明的核酸序列中挑選出適當的核酸片段,用作引物或探針。
本發明多肽的編碼序列或其片段通常可以用PCR擴增法、重組法或人工合成的方法獲得。對于PCR擴增法,可根據本發明所公開的有關核苷酸序列,尤其是開放閱讀框序列來設計引物,并用市售的cDNA庫或按本領域技術人員已知的常規方法所制備的cDNA庫作為模板,擴增而得有關序列。當序列較長時,常常需要進行兩次或多次PCR擴增,然后再將各次擴增出的片段按正確次序拼接在一起。
核酸構建體
本發明也涉及包括與指導編碼序列在合適宿主細胞中,在與該調控序列相適合的條件下表達的一個或多個調控序列可操作連接的本發明的分離多核苷酸的核酸構建體。編碼本發明多肽的多核苷酸可以多種方式被操作以保證該多肽的表達。在其插入載體之前該多核苷酸序列的操作可能根據該表達載體是合乎需要或必需的。利用重組DNA方法來改變多核苷酸序列的技術是本領域已知的。
調控序列可以是合適的啟動子序列,由用于表達編碼本發明多肽的多核苷酸的宿主細胞識別的核苷酸序列。啟動子序列包含接到多肽表達的轉錄調控序列。啟動子可以是在所選擇的宿主細胞中顯示轉錄活性的任何核苷酸序列,包括突變的、截短的和雜合啟動子,并且可以從編碼與該宿主細胞同源或異源的胞外或胞內多肽的基因獲得。
用于指導本發明的核酸構建體,特別是在細菌宿主細胞中轉錄的合適啟動子的實例是從噬菌體T7啟動子、大腸桿菌lac操縱子、天藍色鏈霉菌(Streptomyces coelicolor)瓊脂糖酶基因、枯草芽孢桿菌果聚糖蔗糖酶基因、地衣芽孢桿菌α-淀粉酶基因、解淀粉芽孢桿菌α-淀粉酶基因、地衣芽孢桿菌青霉素酶基因等。
用于指導本發明的核酸構建體在絲狀真菌宿主細胞正轉錄的合適啟動子的實例是從米曲霉TAKA淀粉酶、米黑根毛霉(Rhizomucor miehei)天冬氨酸蛋白酶、黑曲霉中性α-淀粉酶、黑曲霉酸穩定的α-淀粉酶、黑曲霉或泡盛曲 霉糖化酶(glaA)、里氏木霉纖維二糖水解酶I、氏木霉纖維二糖水解酶II、米曲霉堿性蛋白酶、米曲霉磷酸丙糖異構酶、里氏木霉葡聚糖內切酶等基因獲得的啟動子及其突變、截短和雜合(hybrid)啟動子。
在酵母宿主中,有用的啟動子可獲得自釀酒酵母烯醇酶(ENO-1)、釀酒酵母半乳糖激酶(GAL1)、釀酒酵母乙醇脫氫酶、3-磷酸甘油醛脫氫酶、釀酒酵母磷酸丙糖異構酶、釀酒酵母3-磷酸甘油酸激酶的基因、巴斯德畢赤酵母醇氧化酶基因。用于酵母宿主細胞的其它有用啟動子由Romanos et al.,1992,Yeast 8:423-488描述。
調控序列也可以是合適的轉錄終止子序列,由宿主細胞識別以終止轉錄的序列。終止子序列與編碼該多肽的核苷酸序列的3′末端可操作連接。在選擇的宿主細胞中有功能的任何終止子都可用于本發明。
用于細菌宿主的優選終止子可以是來自T7噬菌體的終止子。
用于絲狀真菌宿主細胞的優選終止子獲得自米曲霉TAKA淀粉酶、黑曲霉葡萄糖淀粉酶、構巢曲霉鄰氨基苯甲酸合酶、黑曲霉α-葡萄糖苷酶的基因。
用于酵母宿主細胞的優選終止子獲得自釀酒酵母烯醇酶、釀酒酵母細胞色素C、釀酒酵母甘油醛-3-磷酸脫氫酶、巴斯德畢赤酵母醇氧化酶基因等。
調控序列也可以是合適的前導序列,對宿主細胞翻譯重要的mRNA的非翻譯區。簽到序列與編碼該多肽的核苷酸序列的5′末端可操作連接。在選擇的宿主細胞中有功能的任何終止子都可用于本發明。
調控序列也可以是編碼與多肽的氨基酸末端連接的氨基酸序列并且指導該編碼的多肽進入細胞分泌途徑的信號肽編碼區。核苷酸序列編碼序列的5′端可固有地包含天然連接具有編碼分泌多肽的編碼區節段的翻譯閱讀框的信號肽編碼區。備選地,編碼序列的5′端可包含與該編碼區外源的信號肽編碼區。當編碼序列非天然地包含信號肽編碼區時,可能需要外來的信號肽編碼區。備選地,外來的信號肽編碼區可簡單地替換天然的信號肽編碼區以增強多肽的分泌。然而,指導表達的多肽進入選擇的宿主細胞的分泌途徑的任何信號肽編碼區,即分泌進入培養基,都可用于本發明。
表達載體
本發明也涉及包括本發明多核苷酸的重組表達載體。各種核酸和調控序列可被連接在一起,以產生可能包括一個或多個容許在這種位點插入或取代該編碼多肽的核苷酸序列的方便限制性位點的重組表達載體。備選地,本發明的核苷酸序列可通過插入核苷酸序列或包括進入適當表達載體的序列的核酸構建體而被表達。在制造表達載體時,編碼序列位于載體中以使得該編碼序列可操作地連接用于表達適當調控序列。
重組表達載體可以使能夠方便地經受重組DNA方法并且可導致感興趣的核苷酸序列表達的任何載體(如質粒或病毒)。載體的選擇一般取決于載體與其中被導入該載體的宿主細胞的相容性。該載體可以是線性或閉合的環形質粒。
載體可以是自主復制的載體,即作為染色體外實體存在,其復制不依賴于染色體復制的載體,例如質粒、染色體外元件、微型染色體或人工染色體。載體可包含用于保證自我復制的任何方式。備選地,載體可以是當被導入宿主細胞時,整合到基因組中并且與其已經被整合進入的染色體一起復制的載體。此外,可使用一起包含將被導入宿主細胞基因組的總DNA的單個載體或質粒或兩個或多個載體或質粒,或轉座子。
本發明的載體優選包含一個或多個容許容易選擇轉化、轉染、轉導等細胞的可選擇標記。可選擇的標記是基因,其產物提供對抗生素或病毒的抗性、對重金屬的抗性、原養型至營養缺陷型等。
本發明的載體優選包含容許該載體整合進入宿主細胞基因組或該載體在細胞中獨立于基因組自主復制的元件。
一個以上拷貝的本發明的多核苷酸可被插入宿主細胞以增加該基因產物的產量。多核苷酸拷貝數的增加可通過將至少一個附加拷貝的序列整合進入宿主細胞基因組或通過包括可擴增的選擇標記基因和該多核苷酸來獲得,其中包含擴增拷貝的選擇標記基因并且由此包含附加拷貝多核苷酸的細胞可通過在存在適當的選擇劑時培養該細胞來篩選。
本發明的載體優選包含人工合成的一段序列,含有多個限制內切酶識別位點,能為外源DNA提供多種可插入的位置或插入方案。
本發明優選使用能在大腸桿菌中表達的載體,例如pET24a(+)。
宿主細胞
本發明也涉及包括被用于重組生產多肽的本發明多核苷酸的重組宿主細胞。包括本發明多核苷酸的載體被導入宿主細胞以使得該載體如早先說明的作為染色體的組成部分或作為染色體外的自我復制載體來維持。宿主細胞的選擇很大程度上取決于編碼多肽的基因及其來源。
宿主細胞可以是單細胞微生物或非單細胞微生物。單細胞微生物例如革蘭氏陽性細菌,包括但不限于芽孢桿菌細胞,例如,嗜堿芽孢桿菌、解淀粉芽孢桿菌、短芽孢桿菌、巨大芽孢桿菌、枯草芽孢桿菌、地衣芽孢桿菌、凝結芽孢桿菌、嗜熱脂肪芽孢桿菌和蘇云金芽孢桿菌等;或鏈霉菌細胞,例如錢青紫鏈霉菌;或革蘭氏陰性細菌,例如大腸桿菌和假單胞菌屬。
在優選的方面,細菌宿主是枯草芽孢桿菌、大腸桿菌、地衣芽孢桿菌、嗜熱脂肪芽孢桿菌和大腸桿菌細胞。
宿主細胞也可以是真核生物,例如哺乳動物、昆蟲、植物、酵母或真菌細胞。可列舉的“真核”生物包括子囊菌門(Ascomycota)、擔子菌門(Basidiomycota)、壺菌門(Chytridiomycota)、接合菌門(Zygomycota)以及卵菌門等。
因此,在某些實施方式中,宿主細胞可以是是子囊菌門的細胞如酵母屬(Saccharomyces)、畢赤酵母屬(Pichia)、耶氏酵母屬(Yarrowia)、假絲酵母屬(Candida)以及Komagataella屬等。
在其它實施方式中,宿主細胞可以是巴斯德畢赤酵母(Pichia pastoris)、釀酒酵母(Saccharomyces cerevisiae)、解脂耶氏酵母(Yarrowia lipolytica)等。在另外最優選方面,宿主細胞是巴斯德畢赤酵母(Pichia pastoris)細胞。
多肽的性能及用途
本發明的淀粉酶的最適作用溫度在65~70℃之間,在67.5℃左右達到最高酶活;在70℃左右高溫下的穩定性很好;pH為3~7.5時酶活成上升趨勢,在6.5~7.5之間能維持80%以上的酶活,并在pH7.5左右達最高酶活;從pH6到pH7.5,酶活穩定性逐步升高,pH7.5時達到最高位100%;在Mn2+離子存在下, 酶活提高4.5倍,Mg2+、NH4+、Ca2+存在下,酶活被完全抑制。
本發明的淀粉酶可被用在不同領域中,包括但不限于酒精生產、釀酒、烘焙、淀粉脫漿和除垢劑領域等。具體而言,在酒精生產和釀酒工業中使用淀粉酶,能保證發酵物中的酶活性一致,能夠提高糖化率,酒精出率和酵母的生長,除此以外,還能夠提高啤酒的口感。在面包烘烤工業中,使用淀粉酶可以使產品體積更大,顏色更好,顆粒更柔軟,對面包的口感,品質也都有促進作用。現代纖維制造工藝中,為防止紗線斷裂,往往在表面加一層淀粉,淀粉脫漿可以用淀粉酶水解淀粉,因而容易被洗掉,反應過程綠色,環保,無污染。而在除垢劑中,加入淀粉酶能使除垢劑更加溫和,降低殘留對人體的傷害。
本發明的淀粉酶可以純的制品的形式提供,也可以組合物的形式提供。當以組合物的形式提供時,可根據不同的應用領域,組合物中可含有適用于該領域的其它輔料,這類輔料包括但不限于吸附材料,尤其是選自活性炭、氧化鋁、硅藻土、多孔陶瓷、多孔玻璃等的吸附材料。
下文將以具體實施例的方式闡述本發明。下列實施例中未注明具體條件的實驗方法,通常按照常規條件如《分子克隆實驗指南》(第三版,科學出版社2002,[美]J.薩姆布魯克、D.W.拉塞爾著,黃培堂等譯)所述的條件,或按照制造廠商所建議的條件進行。對于試劑的用法和用量,除非另有說明,否則按照常規的用法和用量使用。本發明中所用化學品若無特別說明,均商購自sigma公司,為分析純級。
實施例1:淀粉酶的制備
由生工生物工程(上海)股份有限公司合成SEQ ID NO:1所示序列(其編碼的氨基酸序列如SEQ ID NO:2所示),并克隆在表達載體pET24a(+)上。
將帶有該核苷酸序列的pET24a(+)轉化至大腸桿菌BL21(DE3)進行誘導表達(參考《分子克隆實驗指南》第三版,科學出版社2002,[美]J.薩姆布魯克、D.W.拉塞爾著,黃培堂等譯)。具體過程如下:
挑取陽性轉化子在LB培養基中,于37℃進行過夜種子培養,按1%的接種量,將種子培養液接種到表達培養基中,于37℃,220rpm培養至 OD600=0.6-0.8。
冷卻至16℃后,加入IPTG至1mM進行誘導,16℃,190rpm過夜表達。誘導表達結束后,離心收集菌體。用裂解緩沖液重懸菌體(每克細胞加5毫升緩沖液)。
將重懸的菌體進行低溫超聲破碎細胞(50%電壓輸出,2秒超聲破碎,9秒間隔,共超聲20分鐘),操作時將樣品冰浴冷卻以保護蛋白。細胞破碎后,14000rpm離心20分鐘并收集上清。凝膠電泳檢測結果如圖6所示,命名為BM4。
實施例2:OD值與淀粉含量相關性標準曲線制定
原碘液:稱取11.0g碘和22.0g碘化鉀,用少量水使碘完全溶解,并定容至500ml。
稀碘液:吸取原碘液2.0ml,加20g碘化鉀,用水溶解并定容至500ml。
分別配制0.2,0.4,0.6,0.8,1,1.2,1.4mg/ml的淀粉溶液(用pH7.5的磷酸緩沖液溶解),以1:5的體積比加入稀碘液,測量并記錄混合液的OD660值,做出相關性直線,其線性關系如圖7所示,得出對應公式:n=1.6111OD-0.0939。
實施例3:利用碘液顏色的下降來指示淀粉酶降解淀粉的活力
采用碘-淀粉比色法測BM4的酶活。具體而言,利用淀粉遇碘變藍色的原理進行測試,可參見郭晶、王永軍,“國產染色淀粉片劑法檢測工業α-淀粉酶的活力”,《日用化學品科學》,2000,23(6):39—40。
配制1.5g/l淀粉溶液:稱取1.5g淀粉溶解于1L磷酸緩沖液中。
吸取1ml的淀粉溶液,60℃恒溫水浴預熱8min,加入100μl酶液,準確反應5min。以1:5的比例加入稀碘液。測量并記錄混合液的OD660值,與此同時用滅活的淀粉酶酶液作對照。
酶活定義:1ml液體酶于60℃,pH7.5的磷酸緩沖液條件下1h液化1mg淀粉即為一個酶活力單位以U/ml來表示。
淀粉酶酶活公式為:A=〔(A1-A0)×1.6111-0.0939〕×V1/(V2×t)
V1為總反應體積,V2為酶液體積,A1為混合液OD660值,A0為對照組 OD660值。
淀粉酶BM4酶學性質檢測:
1、最適反應溫度:
在不同(55-75℃)溫度下按照上述方法測定淀粉酶酶活,以測定酶活最高時的酶活力為100%,計算其他溫度下的相對酶活(%)。由圖1可見,該淀粉酶的酶學活力隨著溫度的提高呈現先上升后下降的趨勢,其中67.5℃酶活最高(24.374U/ml),為其最適作用溫度。
2、溫度穩定性
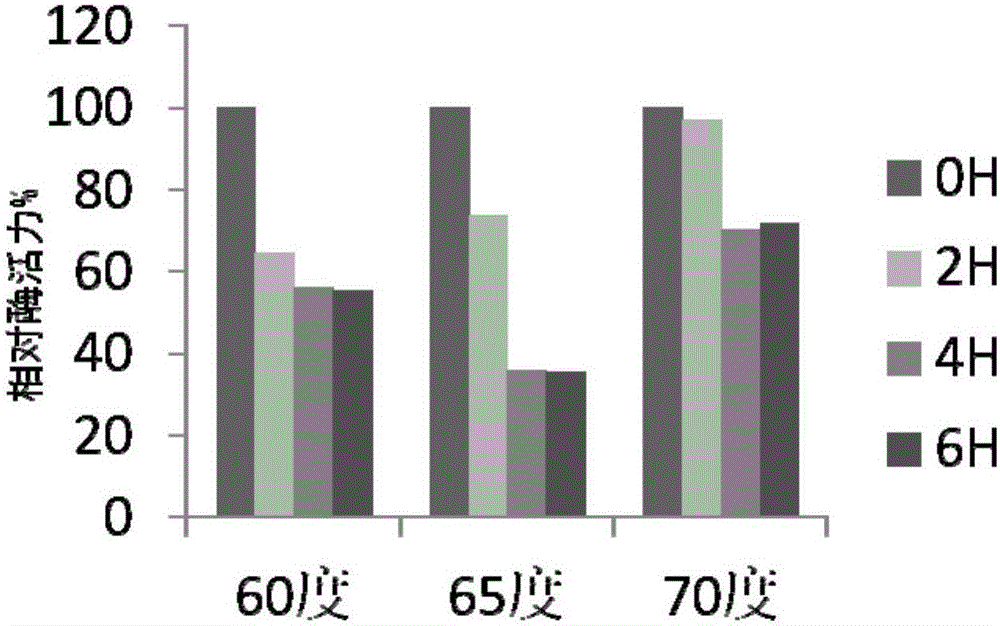
取1微升酶液分別放置60℃,65℃,70℃作為溫度梯度,0H,2H,4H,6H作為時間梯度,用淀粉酶酶活測定方法,在不同的溫度,時間梯度下測量酶活,以OH酶活為100%,計算其他條件下的相對酶活(%)。由圖2可知,在70℃保溫6小時后,按照上述方法測定的酶活依然有70%的活力,酶活在70℃高溫下的穩定性很好。
3、最適反應pH
將酶液分別在不同pH(3.0-10.0)的緩沖體系溶解的淀粉溶液中(50mM NaAc,TrisHCl,MES,Gly-NaOH等),4℃保溫24h,再于67.5℃、pH7.5下用上述方法測定淀粉酶的活力。以酶活測定最高的緩沖液中所測得的酶活力(20.35484U/ml)為100%,計算其他pH下的相對酶活力。由圖3可見pH7.5時酶活最高,3-7.5成上升趨勢,7.5-9.5酶活下降趨勢,降低至零。
4、pH穩定性
將酶液分別在不同pH(3.0-10.0)的緩沖體系(50mM NaAc,TrisHCl,Gly-NaOH等)中以1:1的比例混合,4℃保溫24h,再于67.5℃、pH7.5下按上述方法測定淀粉酶的活力。以酶活測定最高的緩沖液中所測得的酶活力為100%,計算其他pH下的相對酶活力。由圖4可知,從pH6到pH7.5,酶活穩定性逐步升高,pH7.5時達到最高位100%,從pH7.5到pH9穩定性逐步下降至0。
5、金屬離子對淀粉酶活力的影響
配制ZnSO4、MnCl2、CoCl2、CaCl2、MgSO4、CuSO4、KCl、(NH4)2SO4、NaCl、NiSO4、FeCl3等無機鹽貯存液。按照上述方法(底物更換為pNPD),首先配制反應混合液,向每個反應管中分裝200ul混合液,并添加終濃度為5mmol/L的無機鹽貯存液,再按照標準方法測定活性。以超純水作對照(24U/ml)為100%,計算其他各組的相對活力。由圖5可知,在Mn2+離子存在下,酶活提高4.5倍,Mg2+,NH4+,Ca2+存在下,酶活被完全抑制。
應理解,上述實施例僅僅是示例性的,本發明并不限于上述實施例。在不偏離本發明精神和范圍的情況下對本發明作出的任何修改和變動,都在本發明的保護范圍之內。
- 還沒有人留言評論。精彩留言會獲得點贊!