一種異質細胞三維打印系統和方法與流程
本發明屬于生物制造和細胞打印領域,具體地涉及到一種異質細胞精確受控組裝設備和工藝。
背景技術:
近年來,細胞打印技術在組織工程學、病理模型構建、藥物篩選與檢測、細胞行為研究等領域發揮著越來越重要的作用。在組織工程領域,細胞打印技術實現了異種細胞的三維受控組裝,可以在體外構建出復雜組織的結構體,促進了組織工程向規模化、自動化、計算機輔助加工化的方向發展;在病理模型構建領域,細胞打印可以將病變細胞(如腫瘤細胞)與正常細胞進行特定順序的組裝,為醫學工作者研究細胞癌變機理提供了有效的研究手段;在藥物篩選與檢測方面,利用細胞打印技術制造的細胞芯片可以降低藥物篩選的成本、縮短藥物篩選的周期以及減少動物實驗等;在細胞行為研究方面,利用細胞打印技術還可以對特定種類和數量的細胞進行組裝和排列,從而為研究細胞的增殖、遷移和分化等行為提供途徑。
體外三維細胞模型的人工構建是國際生物醫學及工程學科研究的最新前沿。2000年在德國Freiburg大學召開的“RP(快速原型)在生物醫學的應用研討會”首次探討了以RP為基礎的組織工程支架和器官打印技術(cell/organ printing)的發展。隨后以組織器官修復與重建為目的,開發了各種基于微滴噴射的細胞三維直接受控組裝和器官打印的新工藝。包括用于組織構建的基于微噴嘴的連續細胞擠壓;低溫沉積組織工程支架制造工藝;基于噴墨技術的細胞打印;細胞和細菌的激光直接寫入;細胞和細菌的微接觸印刷;通過機械的、光學的、電學的、磁的、超聲的以及離子的方法進行的 細胞操縱及通過照相或電蝕刻以及軟光刻技術進行的細胞仿制。然而人體組織系統極其復雜,如:體內腫瘤組織普遍具有異質性,使得使得腫瘤學、藥理學、藥物開發和臨床治療等研究變得空前復雜。目前的細胞體外三維細胞模型的人工構建技術均采用單一的細胞打印方式,單一的細胞打印方式均存在各自的弊端,如微噴嘴的連續細胞擠壓式有利于構建整體的細胞架構,而無法完成滴落式細胞打印的定點噴射,細胞和細菌的激光直接寫入的方式有利于完成細胞的單個打印,但在無法完成細胞的整體架構的構建。若將不同的打印方式進行結合,剛可將不同打印方式的優點結合,完成高度仿生的復雜三維異質性腫瘤模型的打印,以滿足對多細胞復雜結構組織的仿生構建要求。但是不同的打印方式的驅動不同,控制單元也截然不同,因此目前還沒有將兩種不同驅動的打印方式相結合的細胞打印設備。
技術實現要素:
(一)要解決的技術問題
針對現有技術中沒有可將兩種不同驅動的打印方式結合在一起的打印設備,而無法完成異質細胞三維打印的缺陷,本發明提供一種將兩種不同驅動的打印方式結合在一起的異質細胞三維打印系統。
(二)技術方案
本發明所述的異質細胞三維打印系統,包括運動平臺、固定于所述運動平臺上的擠出式細胞打印機構和滴落式細胞打印機構,用于觀測和反饋細胞打印情況的觀測單元以及控制單元;
所述控制單元首先控制擠出式細胞打印機構完成立體細胞水凝膠結構的打印,然后控制滴落式細胞打印機構在所述立體細胞水凝膠結構上完成單個或多個細胞的打印;在打印的過程中,所述控制單元控制所述運動平臺的三維運動,以實現在所需位置的打印。在打印的過程中,運動平臺需在XY軸和Z軸方向進行較高運動精度的運動,擠 出式細胞打印中需要進行連續信號的輸出,滴落式細胞打印中需進行中脈沖信號的輸出,本發明所述的控制單元可滿足上述三種工作目標,而且具有較高的穩定性和精度。
本發明中,所述控制單元包括工控機、PMAC控制器、信號發生器和功率放大器;
所述工控機與所述PMAC控制器和所述觀測單元相連接,用于接收反饋信息和向PMAC控制器發出指令;所述PMAC控制器控制運動平臺的三維運動和所述擠出式細胞打印機的擠出;進一步的,所述PMAC控制器還調整滴落式細胞打印機構的位置,通過控制信號發生器和功率放大器來控制細胞的滴落式打印。
本發明中,所述擠出式細胞打印機構包括固定于所述運動平臺的Z軸上的注射器驅動電機、壓頭、注射器及其噴頭和保溫套筒,其中,所述噴頭安裝在注射器口部,注射器固定在保溫套筒內;注射器驅動電機在所述PMAC控制器的控制下,通過所述壓頭推動注射器活塞實現內部液體的連續擠出。
本發明中,所述滴落式細胞打印機構包括固定于所述運動平臺的Z軸上的位置微調電機、壓頭、往復運動機構和與之相連的滴落式細胞打印用微噴頭;其中,所述微噴頭固定在往復運動機構上,所述往復運動機構依次與壓頭和位置微調電機相連;所述PMAC控制器與位置微調電機相連,用于微調所述微噴頭的位置;所述PMAC控制器還控制信號發生器產生波形,所述波形經所述功率放大器放大后輸送到所述往復運動機構上,通過往復運動機構的運動實現滴落式打印。
優選的,往復運動機構選擇為封裝壓電陶瓷。利用壓電陶瓷在接受電信號后產生伸長和收縮的特點,帶動微噴頭實現往復運動,利用往復運動中的摩擦力和慣性力實現液滴的滴落。
本發明中,所述觀測單元包括水平觀測顯微鏡和豎直觀測顯微鏡。其中,水平顯微鏡對噴頭工作高度和噴頭內細胞排布進行觀測, 豎直顯微鏡對水凝膠中的細胞進行定位。通過兩個顯微鏡同時從兩個方向進行觀察,一方面可以避免傾斜觀察所造成的視場誤差,提高觀測的精度;另一方面根據觀測得到的結果可以對滴落式打印的液滴位置進行確定,提供了一種根據水凝膠中細胞分布進行打印的實時反饋的隨形打印方法。
本發明的另一目的是提供利用本發明所述的打印系統進行異質細胞三維打印的方法,其特征在于,包括如下步驟:
1)對所述異質細胞三維打印系統進行滅菌處理;
2)根據預先設計的模型,所述控制單元控制所述運動平臺的Z軸高度和XY位置,并控制所述擠出式細胞打印機構進行打印,得到立體細胞水凝膠結構;
3)根據預先設計的模型和觀測單元反饋的信息或僅根據預先設計的模型,所述控制單元調節所述運動平臺的Z軸高度和XY位置,并通過對滴落式細胞打印機構位置的微調,實現雙噴頭工作狀態切換和滴落式細胞打印的位置定位;
4)所述控制單元控制所述滴落式細胞打印機構通過基于交變滯慣力驅動的細胞打印技術,在所述立體細胞水凝膠結構上進行滴落式打印,得到異質細胞三維模型;
5)針對不同的模型需要,重復步驟3)和4),直至構建出所需的異質細胞三維模型。
本發明中,所述微擠出式細胞打印中水凝膠的凝結采用物理交聯和化學交聯,所述物理交聯中,通過低溫使所述立體細胞水凝膠結構中的明膠組分發生交聯,變成凝膠狀態;所述化學交聯中,通過鈣離子使所述立體細胞水凝膠結構中的海藻酸組分進行交聯;具體地,在所述化學交聯的過程中,向打印得到的立體細胞水凝膠結構中加入2~4%的CaCl2溶液至浸沒,并在室內條件下保持2~4min,然后吸走溶液,便實現了所述立體細胞水凝膠結構的化學交聯。打印完畢后水 凝膠絲的直徑在100-800微米之間。
本發明中,所述滴落式細胞打印在擠出式細胞打印完畢后立即開始,或者在所述宏觀水凝膠絲培養形成細胞團簇后再進行。所述兩種不同的打印過程中,前者在構建微環境過程中需利用細胞的增值、遷移和自組裝的特性,后者則直接構建出與體內類似的團簇狀腫瘤組織。兩種不同的方法,得到的模型存在一定的區別,可分別對細胞模型產生過程中的細胞生長等生理活動和腫瘤藥物檢測等進行醫學研究。
本發明中,所述滴落式細胞打印的最終細胞數目是單個或多個。利用該特點,在構建異質細胞體外模型中提出了兩種工藝。一是通過擠出式細胞打印水凝膠絲中的細胞生長增殖形成細胞團簇,并在其周圍滴落打印單個細胞形成微環境;另一種是通過擠出式細胞打印水凝膠絲中的細胞均勻分布形成微環境細胞,并通過滴落打印向水凝膠絲中添加較大細胞密度的細胞團簇,所述較大細胞濃度為106~107;針對這兩種工藝可以應用到不同需求的體外細胞模型構建中。
本發明中,所述滴落式細胞打印的細胞種類與所述宏觀水凝膠絲結構中的細胞種類相同,或者為與所述宏觀水凝膠絲結構中細胞種類不同的一種或多種細胞。當采用同種細胞時,通過滴落式細胞打印方法可以實現局部細胞密度的改變,可以研究不同細胞密度對細胞形態、增殖方式和自組裝方式的影響。當采用多種細胞時,可對不同細胞種類之間的相互作用進行研究,也可構建出與體內多種細胞相類似的人工替代物。
本發明中,所述玻璃微噴管可以懸于含細胞結構體支架的上方一定高度進行特定圖案或形狀的滴落式細胞打印,也可以在支架的網格空隙處進行滴落式細胞打印,以實現在支架特定位置種植特定數量細胞。該方法可以實現在不同的位置的微滴的滴落,保證水凝膠絲內部不同種類細胞分布的可控,保證異質細胞之間的空間排布和信息交 流,避免了由于細胞空間位置分離而造成的異質細胞模型失效。
(三)有益效果
1)本發明綜合利用微擠出式細胞打印技術和滴落式細胞精確打印技術進行集成式異質細胞精確受控組裝,最大的特點是既可以實現宏觀細胞團簇的打印,又可以實現在細胞團簇特定位置進行微觀單個細胞的定點打印,并且打印的細胞團簇和打印的單個細胞可以是任何兩種或多種異種細胞;本發明在滴落式打印的過程中,通過加大細胞溶液中細胞的密度,可直接進行團簇細胞的打印,避免了形成團簇需要進行的培養過程。是一種構建異質細胞模型方法中的新工藝。
2)該技術中擠出式細胞打印采用兩步交聯法,即包括第一步物理交聯和第二步化學交聯;物理交聯是指通過低溫使材料中的明膠組分發生交聯,變成凝膠狀態;化學交聯是指通過鈣離子使材料中的海藻酸組分進行交聯。兩步交聯微擠出式打印技術可以高效構建高密度的細胞/水凝膠材料結構體,得到100~800微米的水凝膠絲結構,研究發現細胞在100-800微米水凝膠絲中經過培養后會聚集成三維團簇狀細胞結構,很高程度的模擬了體內細胞組裝和聚集的形式,具有重要的仿生價值;
3)本發明中而滴落式細胞精確打印采用的是基于交變滯慣力驅動的細胞打印技術,該技術通過交替變化的粘性力和慣性力作用可以精確的控制單個細胞的打印和組裝,實現以單個細胞為最小單元的細胞模型構建,并且該工藝在打印過程中不產生高溫、高壓、強電場和流體流涎現象,細胞打印后成活率在90%以上,非常適合細胞打印工藝。總之,本發明集成了兩步交聯微擠出式打印技術和基于交變滯慣力驅動的滴落式細胞打印技術既保證了宏觀細胞團簇的高效構建,有保證了微觀單個細胞在團簇細胞上的定點打印,具有重要的病理學、藥理學應用潛力。
附圖說明
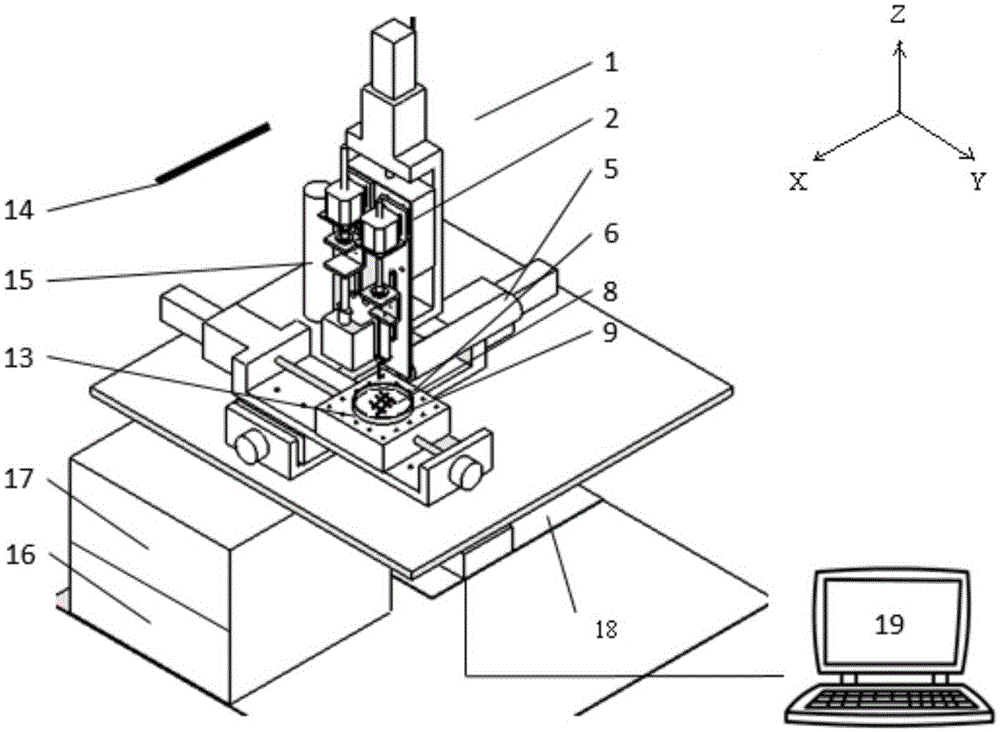
圖1為異質細胞三維打印系統結構示意圖
圖2為異質細胞三維打印系統噴頭結構放大示意圖
圖3為在剛打印完畢的含細胞水凝膠支架上進行滴落式細胞打印示意圖;
圖4為滴落式細胞打印噴頭懸在水凝膠支架外,在水凝膠支架中細胞團簇的特定位置上進行滴落式細胞打印。
圖5為滴落式細胞打印噴頭插入水凝膠支架內,在水凝膠支架中細胞團簇的特定位置上進行滴落式細胞打印。
圖6為在擠出式細胞打印的水凝膠支架上進行多個細胞滴落式打印,打印得到細胞團簇示意圖。
圖中:1、設備成型室,2、Z軸運動平臺,3、噴頭夾持機構,4、壓電陶瓷,5、水平觀測顯微鏡,6、XY軸運動平臺,7、滴落式細胞打印用微噴頭,8、細胞/水凝膠材料結構體,9、培養皿,10、注射器驅動電機,11、保溫套筒,12、1mL注射器及噴頭,13、半導體制冷片,14、紫外滅菌燈,15、垂直觀測顯微鏡,16、信號發生器,17、功率放大器,18、PMAC控制器,19、工控機,20位置微調電機,21壓頭,22螺桿。
具體實施方式
以下實施例用于說明本發明,但不用來限制本發明的范圍。
實施例1
本實施例涉及一種異質細胞三維細胞打印系統,包括運動平臺和固定于所述運動平臺上的擠出式細胞打印機構和滴落式細胞打印機構,用于觀測細胞打印位置的觀測單元和控制單元;
所述控制單元先控制擠出式細胞打印機構完成細胞水凝膠結構的打印,然后控制滴落式細胞打印結構在所述細胞水凝膠結構上完成單個細胞的打印;在打印的過程中,控制單元控制運動平臺在X、Y、Z三個方向移動,以實現所述擠出式細胞打印機構和所述滴落式細胞 打印機構在不同位置的打印。
實施例2
本實施例涉及一種異質細胞三維打印系統,其結構如圖1和圖2所示同實施例1相比,其區別在于,所述打印系統安置于成型室1中,所述成型室中設有紫外滅菌燈14;
所述擠出式細胞打印機構固定于運動平臺的Z軸運動平臺2上,由注射器驅動電機10、保溫套筒11,1mL注射器及其噴頭12組成;所述滴落式細胞打印機構由位置微調電機20、壓頭21、壓電陶瓷4和滴落式細胞打印用微噴頭7組成,均通過噴頭夾持機構3固定于所述Z軸運動平臺2上;
所述觀測單元包括設于噴頭夾持機構3上的水平觀測顯微鏡5和設于所述成型室1底部的垂直觀測顯微鏡15;
所述控制單元包括信號放大器16、功率放大器17、PMAC控制器18和工控機19;其中,所述工控機19為計算機,計算機與所述PMAC控制器18和所述水平觀測顯微鏡5、所述豎直顯微鏡15相連。在運動位置調節上,所述PMAC控制器18分別與所述XY軸運動平臺6、所述Z軸運動平臺2相連,并控制各軸的運動。在擠出式細胞打印控制上,所述PMAC控制器18與所述注射器驅動電機10相連,并對其運動速度等參數進行調整。在滴落式細胞打印控制上,所述PMAC控制器18與信號發生器16和位置微調電機20相連。所述PMAC控制器18控制信號發生器16產生波形,信號發生器16產生的波形經所述功率放大器17放大后輸送到所述壓電陶瓷4上進行微滴的產生。
所述細胞承載器包括位于所述XY軸運動平面上的半導體制冷片13,置于其上的培養皿9和放于所述培養皿的細胞/水凝膠材料結構體8。
實施例3
本實施例涉及一種利用本發明所述的異質細胞三維打印系統進 行腫瘤細胞模型打印的方法,其特征在于,包括如下步驟:
1)配制用于擠出式細胞打印的細胞溶液。將含有A549細胞的培養液離心后在培養基中進行懸浮,達到4×106/ml的細胞密度。之后將所述A549細胞培養液、4%海藻酸鈉溶液和20%明膠溶液按照體積比為1:1:1的比例進行混合,并使最終的細胞密度在1×106/ml左右。
2)配置用于滴落式細胞打印的細胞溶液。將所述A549細胞培養液進行吸取和稀釋,使得最終的細胞密度在5×104/ml。其中,值得說明的是,細胞溶液中的細胞密度根據不同的模型需要可以進行調整,不僅局限于現用的細胞密度。
3)打開紫外滅菌燈15~30min,對所述細胞打印系統進行滅菌處理;
4)分別將所述用于擠出式細胞打印用細胞溶液和滴落式細胞打印用細胞溶液裝入所述注射器中和微噴管中。
5)啟動所述控制單元和觀測單元,結合設計的宏觀模型,首先進行擠出式細胞打印。模型信息通過所述工控機的編譯變成代碼發送給所述PMAC控制器,所述PMAC控制器則根據得到的代碼,控制包括XY軸運動平臺、Z軸運動平臺的運動,以及注射器驅動電機的運動。上述電機軸之間的相互配合和聯動便實現了水凝膠絲的擠出和打印。同時,觀測單元中水平觀測顯微鏡和豎直觀測顯微鏡可以對打印得到的水凝膠絲的情況進行反饋,從工控機的顯示端口上便可以得到水凝膠的成形質量等相關信息。
6)啟動所述控制單元和觀測單元,結合模型設計和實時觀測結果,進行滴落式細胞打印。滴落打印位置根據預先設計模型及水凝膠絲中實際細胞分布進行判斷。觀測單元中水平觀測顯微鏡和豎直觀測顯微鏡通過光學觀察可以得到水凝膠絲中細胞的具體位置等相關信息,從工控機的顯示端口上得到相關信息后,通過向PMAC控制器輸入代碼指令包括XY軸運動平臺、Z軸運動平臺和所述位置微調電機的 運動,使得微噴管管口的位置處在待滴落位置的上方。隨后,通過工控機向所述PMAC控制器輸出代碼指令,所述PMAC控制器控制信號發生器輸出預先設定好的波形給所述功率放大器,所述功率放大器將信號放大后驅動壓電陶瓷的振動。壓電陶瓷振動一次后,便實現液滴的一次形成和滴落。
7)重復步驟6),可以得到異質腫瘤細胞模型。
本實施例所述打印方式為擠出式打印完成后立即進行滴落式打印,其示意圖如圖3。
實施例4
同實施例3相比,本實施例進行腫瘤細胞模型的打印,在所述步驟6)中,滴落式細胞滴落式細胞打印噴頭懸在水凝膠支架外,在水凝膠支架中細胞團簇的特定位置上進行滴落式細胞滴落式細胞打印,其示意圖如圖4。通過該方法打印的異質細胞模型,培養過程中利用細胞的增值、移動和自組裝技術,構建的細胞模型過程中可對細胞的生命活動可進行測試,在進行腫瘤細胞遷移和腫瘤發病機理研究上具有潛在應用。
實施例5
同實施例3相比,本實施例進行腫瘤細胞模型的打印,在所述步驟6)中,滴落式細胞滴落式細胞打印噴頭伸入水凝膠支架內,在水凝膠支架中細胞團簇的特定位置上進行滴落式細胞滴落式細胞打印,其示意圖如圖5。通過該方法打印的異質細胞模型中,異質細胞之間的距離更近,細胞之間的相互作用更直接,構建的細胞模型對體外腫瘤模型的構建,對細胞間相互作用的影響和腫瘤藥物檢測上具有應用。
實施例6
同實施例3相比,本實施例進行腫瘤細胞模型的打印,在所述步驟2)中,調節滴落式打印的細胞濃度至4×106/ml,提高細胞密度后, 便可以通過滴落式細胞打印的方法構建細胞團簇。與實施例3)中的方法相比,避免了形成團簇需要進行的培養過程。是一種構建異質細胞模型方法中的新工藝。其打印示意圖如圖6。
雖然,上文中已經用一般性說明及具體實施方案對本發明作了詳盡的描述,但在本發明基礎上,可以對之作一些修改或改進,這對本領域技術人員而言是顯而易見的。因此,在不偏離本發明精神的基礎上所做的這些修改或改進,均屬于本發明要求保護的范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 一種faslg基因的原位雜交檢測試劑盒及其檢測方法和應用的制作方法
- 一種KiSS1基因的原位雜交檢測試劑盒及其檢測方法和應用的制作方法
- 一種lamb1基因的原位雜交檢測試劑盒及其檢測方法和應用的制作方法
- 一種mcm2基因的原位雜交檢測試劑盒及其檢測方法和應用的制作方法
- 一種mmp2基因的原位雜交檢測試劑盒及其檢測方法和應用的制作方法
- 一種mta1基因的原位雜交檢測試劑盒及其檢測方法和應用的制作方法
- 一種opn基因的原位雜交檢測試劑盒及其檢測方法和應用的制作方法
- 一種pcna基因的原位雜交檢測試劑盒及其檢測方法和應用的制作方法
- 一種plau基因的原位雜交檢測試劑盒及其檢測方法和應用的制作方法
- 一種Survivin基因的原位雜交檢測試劑盒及其檢測方法和應用的制作方法