植物抗旱相關蛋白ZmNAC111及其編碼基因與應用的制作方法
本發明涉及生物
技術領域:
,尤其涉及一種植物抗旱相關蛋白ZmNAC111及其編碼基因與應用。
背景技術:
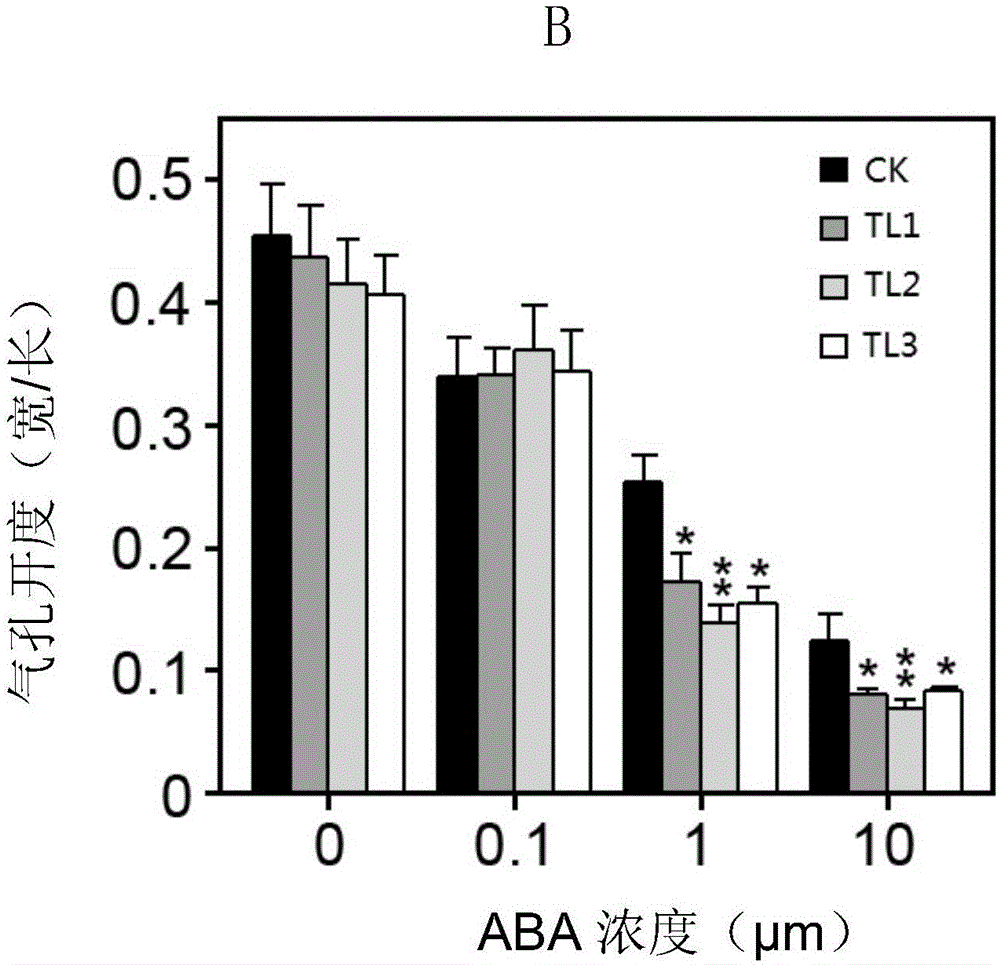
:植物在復雜多變的環境中生長發育,常受到逆境脅迫,其中干旱是影響和限制植物生長發育的主要逆境因子,甚至會導致植物死亡,嚴重影響農業生產。因此,培育抗旱作物品種一直是農業科學技術研究的主要目標之一。玉米(ZeamaysL.)是重要的糧食作物之一,對玉米進行抗旱基因挖掘對培育抗旱玉米品種并提高玉米產量具有重要意義。技術實現要素:本發明的一個目的是提供一種植物抗旱相關蛋白ZmNAC111及其編碼基因。本發明所提供的與植物抗旱相關的蛋白質,來源于玉米(ZeamaysL.),名稱為ZmNAC111,該蛋白質為如下a)或b)的蛋白質:a)由序列表中序列1所示的氨基酸序列組成的蛋白質;b)將序列表中序列1的氨基酸序列經過一個或幾個氨基酸殘基的取代和/或缺失和/或添加且與植物的抗逆性相關的由(a)衍生的蛋白質。上述序列表序列1所示的氨基酸由475個氨基酸殘基組成。為了使上述(a)中的蛋白便于純化,可在由序列表序列1所示的氨基酸序列組成的蛋白質的氨基末端或羧基末端連接上如表1所示的標簽。表1標簽的序列標簽殘基序列Poly-Arg5-6(通常為5個)RRRRRPoly-His2-10(通常為6個)HHHHHHFLAG8DYKDDDDKStrep-tagII8WSHPQFEKc-myc10EQKLISEEDL上述(b)中的蛋白可人工合成,也可先合成其編碼基因,再進行生物表達得到。上述(b)中的蛋白的編碼基因可通過將序列表序列2的第157—1584位所示的DNA序列中缺失一個或幾個氨基酸殘基的密碼子,和/或進行一個或幾個堿基對的錯義突變,和/或在其5′端和/或3′端連上表1所示的標簽的編碼序列得到。編碼上述蛋白質的DNA分子也是本發明保護的范圍。所述DNA分子為如下1)或2)或3)或4)的DNA分子:1)編碼區為序列表中序列2所示的DNA分子;2)編碼區為序列表中序列2的第157位至第1584位所示的DNA分子;3)與1)或2)限定的DNA序列至少具有70%、至少具有75%、至少具有80%、至少具有85%、至少具有90%、至少具有95%、至少具有96%、至少具有97%、至少具有98%或至少具有99%同源性且編碼權利要求1所述蛋白質的DNA分子;4)在嚴格條件下與1)或2)或3)限定的DNA序列雜交且編碼上述蛋白質的DNA分子。上述序列表序列2由1824個脫氧核苷酸組成,為編碼所述蛋白的全長cDNA序列,其中的第157-1584位為編碼區。上述嚴格條件可為如下:50℃,在7%十二烷基硫酸鈉(SDS)、0.5MNa3PO4和1mMEDTA的混合溶液中雜交,在50℃,2×SSC,0.1%SDS中漂洗;還可為:50℃,在7%SDS、0.5MNa3PO4和1mMEDTA的混合溶液中雜交,在50℃,1×SSC,0.1%SDS中漂洗;還可為:50℃,在7%SDS、0.5MNa3PO4和1mMEDTA的混合溶液中雜交,在50℃,0.5×SSC,0.1%SDS中漂洗;還可為:50℃,在7%SDS、0.5MNa3PO4和1mMEDTA的混合溶液中雜交,在50℃,0.1×SSC,0.1%SDS中漂洗;還可為:50℃,在7%SDS、0.5MNa3PO4和1mMEDTA的混合溶液中雜交,在65℃,0.1×SSC,0.1%SDS中漂洗;也可為:在6×SSC,0.5%SDS的溶液中,在65℃下雜交,然后用2×SSC,0.1%SDS和1×SSC,0.1%SDS各洗膜一次。含有上述DNA分子的重組載體、表達盒、轉基因細胞系、重組菌或重組病毒也是本發明保護的范圍。可用現有的植物表達載體構建含有所述基因的重組表達載體。所述植物表達載體包括雙元農桿菌載體和可用于植物微彈轟擊的載體等。如pROKII、pBin438、pCAMBIA1302、pCAMBIA2301、pCAMBIA1301、pCAMBIA1300、pBI121、pCAMBIA1391-Xa或pCAMBIA1391-Xb(CAMBIA公司)等。所述植物表達載體還可包含外源基因的3’端非翻譯區域,即包含聚腺苷酸信號和任何其它參與mRNA加工或基因表達的DNA片段。所述聚腺苷酸信號可引導聚腺苷酸加入到mRNA前體的3’端,如農桿菌冠癭瘤誘導(Ti)質粒基因(如胭脂合成酶Nos基因)、植物基因(如大豆貯存蛋白基因)3’端轉錄的非翻譯區均具有類似功能。使用所述基因構建重組植物表達載體時,在其轉錄起始核苷酸前可加上任何一種增強型啟動子(如花椰菜花葉病毒(CAMV)35S啟動子、玉米的泛素啟動子(Ubiquitin))、組成型啟動子或組織特異表達啟動子(如種子特異表達的啟動子),它們可單獨使用或與其它的植物啟動子結合 使用;此外,使用本發明的基因構建植物表達載體時,還可使用增強子,包括翻譯增強子或轉錄增強子,這些增強子區域可以是ATG起始密碼子或鄰接區域起始密碼子等,但必需與編碼序列的閱讀框相同,以保證整個序列的正確翻譯。所述翻譯控制信號和起始密碼子的來源是廣泛的,可以是天然的,也可以是合成的。翻譯起始區域可以來自轉錄起始區域或結構基因。為了便于對轉基因植物細胞或植物進行鑒定及篩選,可對所用植物表達載體進行加工,如加入可在植物中表達的編碼可產生顏色變化的酶或發光化合物的基因(GUS基因、螢光素酶基因等)、抗生素的標記基因(如賦予對卡那霉素和相關抗生素抗性的nptII基因,賦予對除草劑膦絲菌素抗性的bar基因,賦予對抗生素潮霉素抗性的hph基因,和賦予對methatrexate抗性的dhfr基因,賦予對草甘磷抗性的EPSPS基因)或是抗化學試劑標記基因等(如抗除莠劑基因)、提供代謝甘露糖能力的甘露糖-6-磷酸異構酶基因。上述重組載體為pGZ或pSBIII;重組載體pGZ為將序列表序列2的第157—1584位所示的ZmNAC111替換載體pGKX的NotI和XhoI酶切位點間DNA片段(位于35S啟動子下游),保持載體上其余序列不變。重組載體pSBIII為將序列表序列2的第157—1584位所示的ZmNAC111替換載體pSBⅡ的SmaI和HindⅢ酶切位點間DNA片段(位于Zmubi1啟動子下游),保持載體上其余序列不變。上述蛋白質或上述DNA分子或上述的重組載體、表達盒、轉基因細胞系、重組菌或重組病毒在調控植物抗逆性中的應用也是本發明保護的范圍。上述應用中,調控植物抗逆性為提高植物抗逆性,所述抗逆性為抗旱性;所述植物為單子葉植物或雙子葉植物。上述蛋白質或上述DNA分子或上述的重組載體、表達盒、轉基因細胞系、重組菌或重組病毒在培育抗逆性轉基因植物中的應用也是本發明保護的范圍。上述應用中,所述抗逆性為抗旱性;所述植物為單子葉植物或雙子葉植物。本發明的另一個目的是提供一種培育抗逆性轉基因植物的方法,包括如下步驟:向目的植物中導入上述DNA分子,得到轉基因植物;所述轉基因植物的抗逆性高于所述目的植物。上述方法中,所述抗逆性為抗旱性;所述植物為單子葉植物或雙子葉植物。上述方法中,上述DNA分子通過重組載體pGZ或pSBIII導入目的植物。在上述方法或應用中,所述雙子葉植物具體可為擬南芥(Arabidopsisthaliana),所述單子葉植物具體可為玉米(ZeamaysL.)。上述抗旱性體現在如下:1)在干旱脅迫下轉基因植物的存活率高于目的植物;2)在ABA脅迫下轉基因植物的種子萌發遲于目的植物;3)在ABA脅迫下轉基因植物的氣孔關閉程度或速度高于目的植物;4)在干旱脅迫下轉基因植物的凈光合速率、氣孔導度和/或蒸騰速率低于目的植物。本發明的實驗證明,發現一種來源于玉米(ZeamaysL.)的新基因ZmNAC111,將其轉入擬南芥或玉米,得到轉基因植物,轉基因植物的抗旱性高于未轉基因的目的植物。表明,ZmNAC111及其編碼的蛋白有抗旱的功能,在提高植物抗旱性的育種和研究中具有重要意義。附圖說明圖1為不同單體型編碼的ZmNAC111蛋白的轉錄激活活性。圖2為T3代轉ZmNAC111擬南芥植株的RT-PCR產物的電泳結果。圖3為T3代轉ZmNAC111擬南芥植株經干旱處理并復水6天后的表型。圖4為T3代轉ZmNAC111擬南芥植株經干旱處理并復水6天后的存活率統計結果。圖5為T3代轉ZmNAC111擬南芥植株在ABA脅迫處理下的萌發表型。圖6為T3代轉ZmNAC111擬南芥植株在不同ABA濃度下氣孔開度。圖7為轉ZmNAC111擬南芥正常生長條件下RNA-seq分析。圖8為轉ZmNAC111擬南芥干旱處理下RNA-seq分析。圖9為T2代轉ZmNAC111玉米植株的qPCR結果。圖10為T2代轉基因玉米植株經干旱處理并復水7天后的表型。圖11為T2代轉基因玉米植株經干旱處理并復水7天后的存活率統計結果。圖12為T2代轉ZmNAC111玉米植株光合作用。圖13為轉ZmNAC111玉米正常生長條件下RNA-seq分析。圖14為轉ZmNAC111玉米干旱處理下RNA-seq分析。具體實施方式下述實施例中所使用的實驗方法如無特殊說明,均為常規方法。下述實施例中所用的材料、試劑等,如無特殊說明,均可從商業途徑得到。下述實施例中的生物材料信息如下:載體pGKX:文獻:QinF,SakumaY,TranLS,MaruyamaK,KidokoroS,etal.(2008)ArabidopsisDREB2A-interactingproteinsfunctionasRINGE3ligasesandnegativelyregulateplantdroughtstress-responsivegeneexpression.PlantCell20:1693-1707.公眾可 從中國科學院植物研究所獲得;根癌農桿菌GV3101+pSoup菌株:文獻:ScholthofHB,AlvaradoVY,Vega-ArreguinJC,CiomperlikJ,OdokonyeroD,etal.(2011)IdentificationofanARGONAUTEforantiviralRNAsilencinginNicotianabenthamiana.PlantPhysiol156:1548-1555,公眾可從中國科學院植物研究所獲得;載體pBI121:文獻:QinF,KakimotoM,SakumaY,MaruyamaK,OsakabeY,etal.(2007)RegulationandfunctionalanalysisofZmDREB2AinresponsetodroughtandheatstressesinZeamaysL.PlantJ50:54-69,公眾可從中國科學院植物研究所獲得;根癌農桿菌GV3101菌株:文獻:JingY,ZhangD,WangX,TangW,WangW,etal.(2013)ArabidopsischromatinremodelingfactorPICKLEinteractswithtranscriptionfactorHY5toregulatehypocotylcellelongation.PlantCell25:242-256,公眾可從中國科學院植物研究所獲得;哥倫比亞生態型擬南芥(Arabidopsisthaliana(Columbiaecotype)):文獻:Yamaguchi-ShinozakiK,ShinozakiK(1994)Anovelcis-actingelementinanArabidopsisgeneisinvolvedinresponsivenesstodrought,low-temperature,orhigh-saltstress.PlantCell6:251-264.公眾可從中國科學院植物研究所獲得;根癌農桿菌LBA4404菌株:文獻:Ishida,Y.,Hiei,Y.&Komari,T(2007)Agrobacterium-mediatedtransformationofmaize.Nat.Protoc.2:1614-1621.公眾可從中國科學院植物研究所獲得;玉米自交系A188:文獻:Ishida,Y.,Hiei,Y.&Komari,T(2007)Agrobacterium-mediatedtransformationofmaize.NatureProtocol.2:1614-1621.公眾可從中國科學院植物研究所獲得。載體PSBI和PSBII:文獻:Ishidaetal.,(2007)Agrobacterium-mediatedtransformationofmaize.NatureProtocol.2:1614-1621.公眾可從JapanTobacco公司獲得。玉米自交系B73:文獻:Schnable,P.S.etal(2009)TheB73maizegenome:complexity,diversity,anddynamics.Science326:1112-1115.公眾可從中國科學院植物研究所獲得。實施例1、蛋白ZmNAC111及其編碼基因的獲得1、蛋白ZmNAC111及其編碼基因克隆取玉米自交系B73種子,28℃下催芽三天后,將出芽的種子轉移到營養土或營養液中培養三周,取全株于液氮中速凍、研磨,提取總RNA,進行反轉錄,獲得cDNA,以該cDNA為模板,5’-ATGCCGAGAAGCGGCGGCG-3’和 5’-CTACTGCATCCCGATGTGGC-3’為引物進行PCR擴增。將擴增產物進行瓊脂糖凝膠電泳,得到1.4kb的PCR擴增產物。經過測序,該PCR產物具有序列表序列2的第157—1584位所示核苷酸,其所示的基因命名為ZmNAC111,該基因編碼的蛋白命名為ZmNAC111,該蛋白的氨基酸序列為序列表中序列1。其中序列2中,第1—156位為5’非編碼區,第157—1584位為編碼序列,第1585—1824位為3’非編碼區。2、不同單體型編碼的ZmNAC111蛋白的轉錄激活活性分析以攜帶不同基因型的耐旱型玉米自交系CIMBL55、CIMBL91、CIMBL19、CIMBL22、CIMBL123和敏感型玉米自交系Mo17、D863F、BY4944、SHEN5003以及參照玉米自交系B73的CDNA為模板,5’-ATGCCGAGAAGCGGCGGCG-3’和5’-CTACTGCATCCCGATGTGGC-3’為引物進行PCR擴增,將目的基因克隆并連接入酵母表達載體pGBKT7中,分別轉化酵母菌株AH109(含有報告基因HIS3和ADE2),以轉化空載體pGBKT7為對照,分別獲得重組酵母菌株ZmNAC111-CIMBL55、ZmNAC111-CIMBL91、ZmNAC111-CIMBL19、ZmNAC111-CIMBL22、ZmNAC111-CIMBL123、ZmNAC111-Mo17、ZmNAC111-D863F、ZmNAC111-BY4944、ZmNAC111-SHEN5003、ZmNAC111-B73及pGBKT7-Control。將AH109重組酵母菌株涂到營養缺陷型培養基的板上,通過菌斑生長情況比較不同單體型編碼的ZmNAC111蛋白的轉錄激活活性。結果如圖1所示。十一個重組酵母菌株均能在SD/-Trp(單缺)培養基的板上生長。在SD/-T-H(兩缺)、SD/-T-H-A(三缺)營養缺陷型培養基的板上,含有pGBKT7-Control質粒的酵母菌株不能正常生長,而重組酵母菌株均能夠正常生長,表明:不同單體型編碼的ZmNAC111蛋白具有相似的轉錄激活活性。實施例2、蛋白ZmNAC111及其編碼基因的功能研究一、過表達基因ZmNAC111提高擬南芥抗旱性1、重組載體的構建重組載體pGZ為將序列表序列2的第157—1584位所示的ZmNAC111替換載體pGKX的NotI和XhoI酶切位點間DNA片段(位于35S啟動子下游),保持載體上其余序列不變。2、重組根癌農桿菌的獲得將重組載體pGZ轉化根癌農桿菌GV3101+pSoup菌株,獲得含有重組載體pGZ的重組農桿菌X(提取質粒,測序驗證該質粒為pGZ,則該重組農桿菌為陽性克隆。);將載體pGKX轉化根癌農桿菌GV3101菌株,獲得含有載體pGKX的重組農桿菌CK(提取質粒,測序驗證該質粒為pGKX,則該重組農桿菌為陽性克隆。)。3、轉ZmNAC111擬南芥的獲得將重組農桿菌X用花芽浸泡法轉化野生型哥倫比亞生態型擬南芥,收獲T1代種子;將T1代種子用含有30mg/L卡那霉素的MS培養基篩選并將抗性苗種植收種,獲得T2代種子;將T2代種子用含有30mg/L卡那霉素的MS培養基篩選,挑選卡那霉素抗性分離比符合3:1的卡那霉素抗性苗種植,為T2代轉ZmNAC111擬南芥。提取T2代轉ZmNAC111擬南芥植株RNA,反轉錄得到cDNA為模板,用特異引物F1和R1對基因ZmNAC111的cDNA進行PCR擴增,以擬南芥中的基因Actin2為內參,引物為FC和RC。上述引物的序列如下:F1:5’-ATGCCGAGAAGCGGCGGCG-3’(序列表序列3);R1:5’-CTACTGCATCCCGATGTGGC-3’(序列表序列4);FC1:5’-GGTAACATTGTGCTCAGTGGTGG-3’(序列表序列5);RC1:5’-GCATCAATTCGATCACTCAGAG-3’(序列表序列6)。得到1428bp的為陽性T2代轉ZmNAC111擬南芥。將陽性T2代轉ZmNAC111擬南芥、收種,獲得T3代轉ZmNAC111擬南芥種子,將T3代種子用含有30mg/L卡那霉素的MS培養基篩選得到不再產生卡那霉素抗性分離的純合T3代轉ZmNAC111擬南芥株系3個,分別命名為TL1、TL2和TL3。采用同樣的方法將重組農桿菌CK用花芽浸泡法轉化野生型哥倫比亞生態型擬南芥,按照上述方法篩選,獲得不再產生卡那霉素抗性分離的純合T3代轉空載體擬南芥,命名為CK。T1代表示轉化當代所結的種子及由它所長成的植株;T2代表示T1代自交產生的種子及由它所長成的植株;T3代表示T2代自交產生的種子及由它所長成的植株。上述花芽浸泡法的具體步驟如下:取重組農桿菌X或CK接種于含有50mg/L卡那霉素、和5mg/L四環素的LB液體培養基中,于28℃振蕩培養至OD600為0.8,25℃、5000轉/分鐘離心2分鐘,除去上清液,用重懸溶液(溶劑為水,溶質蔗糖和silwet77的濃度分別為50g/L、0.02%(體積百分含量))重懸菌體,獲得侵染液。用移液器將侵染液點在花蕾及生長點,用薄膜覆蓋,保濕2天后,置于正常條件下生長,收獲種子。提取上述獲得的T3代轉ZmNAC111擬南芥株系(TL1—TL3),T3代轉空載體擬南芥(CK)植株的總RNA,反轉錄得到cDNA作為模板,用特異引物F1和R1對基因ZmNAC111的cDNA進行PCR擴增,以擬南芥中的基因Actin2為內參,引物為FC和RC。PCR擴增產物電泳結果如圖2所示,T3代轉ZmNAC111擬南芥株系均能擴增 1428bp的目標片段,CK植株中不表達目的基因ZmNAC111;表明,ZmNAC111在T3代轉ZmNAC111擬南芥株系中得到表達,且表達量都很高。4、轉ZmNAC111擬南芥的抗旱性表型分析取T3代轉ZmNAC111擬南芥株系(TL1—TL3)、野生型擬南芥(CK)和T3代轉空載體擬南芥株系苗齡7天的植株,轉移到裝有100g營養土的缽中,正常條件下生長25天后,進行干旱處理(即停止澆水),14天后,表型差異明顯即CK株系蓮座葉嚴重干枯而TL1—TL3株系蓮座葉嚴重萎蔫時復水。復水6天后統計各株系植株的存活率(將表現為能正常生長和收種的植株定義為存活植株,將表現為嚴重受旱害且不能正常生長和收種的植株定義為死亡植株;存活率為各株系中存活植株數目占總植株數的百分比)。實驗設3次重復,每次重復各株系的植株數不少于30株,取平均值進行統計分析。結果如表2、圖3和圖4所示,可以看出,在干旱處理后,T3代轉ZmNAC111擬南芥株系(TL1—TL3)的存活率高于野生型擬南芥。T3代轉空載體擬南芥株系(CK)與野生型擬南芥結果無顯著差異。表2、轉ZmNAC111擬南芥植株經干旱處理后的存活率(%)結果株系重復1重復2重復3平均值±標準差TL110075.0096.8890.62±8.62**TL287.5587.4578.1284.38±5.41**TL375.6290.6390.0085.42±4.02**CK25.0033.3325.0027.78±4.81注:*表示與CK結果相比在P<0.05差異顯著,**表示與CK結果相比在P<0.01差異極顯著。5、轉ZmNAC111擬南芥在ABA脅迫處理下的萌發表型T3代轉ZmNAC111擬南芥株系(TL1—TL3)、野生型擬南芥(CK)和T3代轉空載體擬南芥株系種子分別在含0、0.5、1μMABA的MS培養基上生長5天,生長條件為16/8小時的光照/黑暗模式,22℃光照培養箱。實驗設3次重復,每次重復各株系的種子數不少于30株,取平均值進行統計分析。5天后統計萌發率,結果如圖5所示,A為表型觀察,B為萌發率統計結果,可看成,野生型擬南芥100%的種子在1μMABA固體培養基都萌發(需要5天時間)時,過表達材料T3代轉ZmNAC111擬南芥最高只有60.9%。但是T3代轉ZmNAC111擬南芥繼續培養均能萌發(需要7天時間)。野生型擬南芥和T3代轉空載體擬南芥株系(CK)的結果無顯著差異。表明,ZmNAC111在ABA脅迫下延緩種子萌發,其對ABA敏感。6、轉ZmNAC111擬南芥在不同ABA濃度下氣孔開度觀察取正常生長21天左右的T3代轉ZmNAC111擬南芥株系TL1、TL2、TL3和野生型擬南芥CK葉片,浸泡在氣孔開度溶液(10mMKCl,100μMCaCl2和10mMMES,PH6.1)2h后,分別轉移到含有0μΜ、0.1μΜ、1μΜ、10μΜABA的氣孔開度溶液中浸泡2h后,觀察它們的氣孔開度變化。以T3代轉空載體擬南芥為對照。結果如圖6,A為表型觀察,B為氣孔開度統計結果,可以看到,在0μΜABA的氣孔開度溶液中,T3代轉ZmNAC111擬南芥和野生型擬南芥葉片的氣孔開度沒有明顯差異,但是隨著ABA濃度的增加,野生型植株的氣孔開度變化較小,而T3代轉ZmNAC111擬南芥的氣孔開度明顯變小,結果表明T3代轉ZmNAC111擬南芥的ABA誘導的氣孔關閉過程明顯快于野生型植株。T3代轉空載體擬南芥與野生型擬南芥無顯著差異。因此,ZmNAC111在ABA脅迫下促進氣孔關閉。7、轉ZmNAC111擬南芥RNA-seq分析取T3代轉ZmNAC111擬南芥(TL2—TL3)和T3代轉空載體擬南芥株系(CK)苗齡21天的植株,進行臺面干燥0h和1h處理,每個株系至少10棵苗,用TRIZOL(Biotopped)法分離出總RNA,然后用Nanodrop1000(ThermoScientificproduct,USA)測定濃度,合格后送北京貝瑞和康公司進行轉錄組測序,測序深度為3GB,最后用StrandNGS2.0軟件進行數據分析。結果如圖7,圖8所示,表明,正常生長及干旱處理下的轉基因擬南芥材料中,涉及到水分脅迫應答,脫落酸(ABA)脅迫應答及轉錄調控生物學途徑的基因普遍調表達。上述結果表明,蛋白ZmNAC111及其編碼基因具有調控植物抗旱性的功能,在植物中過表達蛋白ZmNAC111的編碼基因,可以提高植物的抗旱性。二、過表達基因ZmNAC111提高玉米抗旱性1、重組載體的構建重組載體pSBIII為將序列表序列2的第157—1584位所示的ZmNAC111替換載體pSBⅡ的SmaI和HindⅢ酶切位點間DNA片段(位于Zmubi1啟動子下游),保持載體上其余序列不變。2、重組根癌農桿菌的獲得將重組載體pSBIII轉化根癌農桿菌LBA4404菌株,獲得含有重組載體pSBIII的重組農桿菌Y(提取質粒,測序驗證該質粒為pSBIII,則該重組農桿菌為陽性克隆。)。采用同樣的方法,將空載體pSBⅡ轉化根癌農桿菌LBA4404,得到含有載體pSBⅡ 的重組農桿菌CK1。3、轉基因玉米的獲得將重組農桿菌Y用農桿菌介導的基因轉化法轉化玉米自交系A188,得到T0代植株,并種植于溫室(16h-光照/8h-黑暗)。提取T2代轉ZmNAC111玉米植株RNA,反轉錄得到cDNA,用特異引物F2和R2對基因ZmNAC111的cDNA進行PCR鑒定。上述引物的序列如下:F2:5’-CTACTATGACGACGACAACT-3’(序列表序列7);R2:5’-CACTCGCTTCCTCTTGTT-3’(序列表序列8);得到1125bp的為陽性T0代轉ZmNAC111玉米。陽性T0代轉ZmNAC111玉米自交后獲得T1代種子;T1代植株再用同樣的方法PCR鑒定后獲得陽性植株,自交后獲得T2代種子。提取T2代轉ZmNAC111玉米的RNA,反轉錄得到cDNA,用特異引物F2和R2對基因ZmNAC111的cDNA進行qPCR定量,以玉米的基因Zmubi2為內參。以野生型玉米為對照。上述引物的序列如下:F2:5’-CTACTATGACGACGACAACT-3’(序列表序列7);R2:5’-CACTCGCTTCCTCTTGTT-3’(序列表序列8);FC2:5’-TGGTTGTGGCTTCGTTGGTT-3’(序列表序列9);RC2:5’-GCTGCAGAAGAGTTTTGGGTACA-3’(序列表序列10)。結果如圖9所示,T2代轉ZmNAC111玉米TML1、TML2和TML3的ZmNAC111表達量高于野生型玉米,表明T2代轉ZmNAC111玉米TML1、TML2和TML3為陽性轉基因玉米。上述T0代表示轉化當代所長成的植株;T1代表示T0代自交產生的種子及由它所長成的植株;T2代表示T1代自交產生的種子及由它所長成的植株。上述農桿菌介導的基因轉化法的具體步驟如下:重組農桿菌Y接種于含有25mg/L壯觀霉素的YEB液體培養基中,于28℃振蕩培養至OD600為0.5。取玉米幼胚放置于裝滿保存液的2mL離心管,46℃熱處理3min,4℃、2000轉/分鐘離心10分鐘。將準備好的重組農桿菌加入處理好的幼胚,22℃黑暗培養3天,轉移到新的培養基上28℃黑暗培養7-10天。通過不同濃度草胺膦篩選,最后轉移到分化培養基上,分化后轉移到生根培養基上培養,一定大小后移入營養土中。將重組農桿菌CK1用農桿菌介導的基因轉化法轉化玉米自交系A188,培育,直 到得到T2代轉空載體玉米。4、轉ZmNAC111玉米的抗旱性表型分析取T2代轉ZmNAC111玉米株系(TML1—TML3)及野生型玉米(WT)植株,轉移到裝有2500g營養土的缽中,正常條件下生長10天后,進行干旱處理(即停止澆水)20復水7天后統計各株系植株的存活率(將表現為能正常生長和收種的植株定義為存活植株,將表現為嚴重受旱害且不能正常生長和收種的植株定義為死亡植株;存活率為各株系中存活植株數目占總植株數的百分比)。實驗設3次重復,每次重復各株系的植株數不少于15株,取平均值進行統計分析。以T2代轉空載體玉米為對照。結果如表3、圖10和圖11所示,可以看出,干旱處理20天,T2代轉ZmNAC111玉米株系葉片干枯程度小于野生型玉米,且統計存活率,T2代轉ZmNAC111玉米存活率高于野生型玉米,T2代轉空載體玉米與野生型玉米結果無顯著差異。表3、轉基因玉米植株經干旱處理后的存活率(%)結果株系重復1重復2重復3平均值±標準差TML180.0086.6787.6484.78±3.85**TML286.6773.3380.0080.00±6.67**TML380.0083.3382.6975.55±1.70**WT74.5477.6774.4428.89±3.85注:*表示與WT結果相比在P<0.05差異顯著,**表示與WT結果相比在P<0.01差異極顯著。因此,ZmNAC111可提高玉米抗旱性。5、轉ZmNAC111玉米光合作用分析葉片凈光合速率(Pn)、氣孔導度(Gs)及蒸騰速率(Tr)采用Li6400便攜式光合測定系統進行測定(LICOR-6400,Lincoln,NE)。于3葉期時測定T2代轉ZmNAC111玉米株系(TML1—TML3)和野生型玉米植株(WT)第三片完全展開的葉片并進行停水處理,之后每隔一天測定一次,并記錄相應的土壤含水量。每個轉化時間隨機測7株,重復兩次,測定結果用平均值表示。結果如圖12所示,A-D分別為光合速率的統計結果、氣孔導度的統計結果、蒸騰速率的統計結果和水分利用效率的統計結果,可以看出,與野生型玉米相比,T2代轉ZmNAC111玉米植株在干旱處理下光合速率、氣孔導度、蒸騰速率變小,進而使得水分利用效率升高,存活率顯著提高。6、轉ZmNAC111玉米RNA-seq分析取T2代轉ZmNAC111玉米的PCR陽性玉米株系(TML1—TML2)及野生型玉米 (WT)苗齡8天的植株,進行臺面干燥0h和2h處理,每個株系至少3棵苗,用TRIZOL(Biotopped)法分離出總RNA,然后用Nanodrop1000(ThermoScientificproduct,USA)測定濃度,合格后送北京貝瑞和康公司進行轉錄組測序,測序深度為3GB,最后用StrandNGS2.0軟件進行數據分析。結果如圖13和圖14所示,表明,正常生長及干旱處理下的轉基因玉米材料中,涉及到水分脅迫應答,ABA脅迫應答及轉錄調控生物學途徑的基因普遍調表達。上述結果表明,蛋白ZmNAC111及其編碼基因具有調控植物抗旱性的功能,在植物中過表達蛋白ZmNAC111的編碼基因,可以提高植物的抗旱性。當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1
- 蝎神經毒素AaIT及其編碼基因與應用的制造方法與工藝
- 腈水解酶突變體及其編碼基因和應用的制造方法與工藝
- 植物抗旱相關蛋白AsTMK1及其編碼基因和應用的制造方法與工藝
- 植物抗旱相關蛋白EtSnRK2.2及其編碼基因和應用的制造方法與工藝
- OsSAPK7蛋白及其編碼基因在提高水稻白葉枯病抗性中的應用的制造方法與工藝
- 一種抗除草劑抗蟲融合基因、編碼蛋白及應用的制造方法與工藝
- 毛果楊PtrZFP103基因及其編碼蛋白和應用的制造方法與工藝
- 大豆bHLH轉錄因子基因GmFER及其編碼蛋白和應用的制造方法與工藝
- 一種花狹口蛙的基因及其編碼的多肽和該多肽的用途的制造方法與工藝
- 一種澤陸蛙基因及其編碼的多肽和該多肽的用途的制造方法與工藝
- 降低種子重量的白樺AP2基因及其編碼蛋白的制造方法與工藝
- 可編碼ArtRD蛋白基因及其蛋白和應用的制造方法與工藝
- 蝎神經毒素AaIT及其編碼基因與應用的制造方法與工藝
- 腈水解酶突變體及其編碼基因和應用的制造方法與工藝
- 植物抗旱相關蛋白AsTMK1及其編碼基因和應用的制造方法與工藝
- 植物抗旱相關蛋白EtSnRK2.2及其編碼基因和應用的制造方法與工藝
- OsSAPK7蛋白及其編碼基因在提高水稻白葉枯病抗性中的應用的制造方法與工藝
- 一種抗除草劑抗蟲融合基因、編碼蛋白及應用的制造方法與工藝
- 毛果楊PtrZFP103基因及其編碼蛋白和應用的制造方法與工藝
- 大豆bHLH轉錄因子基因GmFER及其編碼蛋白和應用的制造方法與工藝
- 腈水解酶突變體及其編碼基因和應用的制造方法與工藝
- 植物抗旱相關蛋白AsTMK1及其編碼基因和應用的制造方法與工藝
- 植物抗旱相關蛋白EtSnRK2.2及其編碼基因和應用的制造方法與工藝
- OsSAPK7蛋白及其編碼基因在提高水稻白葉枯病抗性中的應用的制造方法與工藝
- 一種抗除草劑抗蟲融合基因、編碼蛋白及應用的制造方法與工藝
- 毛果楊PtrZFP103基因及其編碼蛋白和應用的制造方法與工藝
- 大豆bHLH轉錄因子基因GmFER及其編碼蛋白和應用的制造方法與工藝
- 一種花狹口蛙的基因及其編碼的多肽和該多肽的用途的制造方法與工藝
- 一種澤陸蛙基因及其編碼的多肽和該多肽的用途的制造方法與工藝
- 一種水稻MIT1基因、其編碼蛋白及應用的制造方法與工藝
- 植物抗旱相關蛋白EtSnRK2.2及其編碼基因和應用的制造方法與工藝
- OsSAPK7蛋白及其編碼基因在提高水稻白葉枯病抗性中的應用的制造方法與工藝
- 一種抗除草劑抗蟲融合基因、編碼蛋白及應用的制造方法與工藝
- 毛果楊PtrZFP103基因及其編碼蛋白和應用的制造方法與工藝
- 大豆bHLH轉錄因子基因GmFER及其編碼蛋白和應用的制造方法與工藝
- 一種水稻MIT1基因、其編碼蛋白及應用的制造方法與工藝
- 蛋白StTrxF、編碼基因及其在提高植物淀粉含量中的應用的制造方法與工藝
- 蛋白質及其編碼基因在調控植物抗黃萎病性中的應用的制造方法與工藝
- 甘薯耐逆相關蛋白IbFBA2、編碼基因、重組載體與應用的制造方法與工藝
- 植物抗旱相關蛋白ZmNAC111及其編碼基因與應用的制造方法與工藝
- 植物抗旱相關蛋白EtSnRK2.2及其編碼基因和應用的制造方法與工藝
- OsSAPK7蛋白及其編碼基因在提高水稻白葉枯病抗性中的應用的制造方法與工藝
- 一種抗除草劑抗蟲融合基因、編碼蛋白及應用的制造方法與工藝
- 毛果楊PtrZFP103基因及其編碼蛋白和應用的制造方法與工藝
- 大豆bHLH轉錄因子基因GmFER及其編碼蛋白和應用的制造方法與工藝
- 一種水稻MIT1基因、其編碼蛋白及應用的制造方法與工藝
- 蛋白StTrxF、編碼基因及其在提高植物淀粉含量中的應用的制造方法與工藝
- 植物抗旱相關蛋白ZmNAC111及其編碼基因與應用的制造方法與工藝
- 核盤菌凝集素SSL?6蛋白及其編碼基因與應用的制造方法與工藝
- 植物抗病毒相關蛋白GmSN1及其編碼基因和應用的制造方法與工藝
- 植物抗旱相關蛋白EtSnRK2.2及其編碼基因和應用的制造方法與工藝
- OsSAPK7蛋白及其編碼基因在提高水稻白葉枯病抗性中的應用的制造方法與工藝
- 一種抗除草劑抗蟲融合基因、編碼蛋白及應用的制造方法與工藝
- 毛果楊PtrZFP103基因及其編碼蛋白和應用的制造方法與工藝
- 大豆bHLH轉錄因子基因GmFER及其編碼蛋白和應用的制造方法與工藝
- 一種水稻MIT1基因、其編碼蛋白及應用的制造方法與工藝
- 蛋白StTrxF、編碼基因及其在提高植物淀粉含量中的應用的制造方法與工藝
- 蛋白質及其編碼基因在調控植物抗黃萎病性中的應用的制造方法與工藝
- 植物抗旱相關蛋白ZmNAC111及其編碼基因與應用的制造方法與工藝
- 核盤菌凝集素SSL?6蛋白及其編碼基因與應用的制造方法與工藝