一種重組人肝細胞生長因子裸質粒的高密度發酵方法與流程
本發明涉及生物制藥技術領域,具體地涉及一種重組人肝細胞生長因子裸質粒的高密度發酵方法。
背景技術:
重組人肝細胞生長因子裸質粒是一種治療血管缺血性疾病的基因治療藥物,注射于缺血部位的肌肉內,轉染橫紋肌細胞,表達和分泌具有血管生長作用的肝細胞生長因子(HGF),在局部形成側支循環,建立“分子搭橋”機制,增加缺血部位的血液供應,以達到治療動脈缺血性疾病的目的。
重組人肝細胞生長因子裸質粒制備方法采用基因工程方法,即利用生物工程技術構建基因轉移系統,主要在大腸桿菌中進行復制表達,經分離純化而制成;目前仍處于研究階段,國內外尚未有重組人肝細胞生長因子裸質粒產品上市。
本公司將重組人肝細胞生長因子裸質粒(pCK -HGF)轉化到大腸桿菌DH5α中進行增殖生產。雖然目前尚未有與重組人肝細胞生長因子裸質粒發酵工藝直接相關的文獻報道,但是與質粒DNA相關的發酵工藝研究的文獻報道已有許多,例如,鄭淑真在2L發酵罐中(發酵規模1.5L)對重組大腸桿菌生產基因治療質粒DNA發酵工藝進行研究,結果在優化的培養條件下pUK21CMVβ1.2質粒產量可達601.9mg /L(鄭淑真,廈門大學學位論文,2007)。汪永信在5L發酵罐中(發酵規模3L)對pcD-awte候選瘧疾DNA疫苗發酵條件進行研究,結果在優化的培養條件下菌體濃度OD600可達43-45,pcD-awte質粒產量可達125-130mg /L(汪永信等,生物學雜志.2007;24(5):16-19)。柯偉在15L發酵罐中(發酵規模10L)對大腸桿菌DH5A生產核酸疫苗的發酵條件進行研究,結果優化的培養條件下菌體濃度OD600可達22.6以上,pVAX244質粒產量可達75mg /L(柯偉等,華東理工大學學報,2006;31(1)38-42)。郭妍100L發酵罐中(發酵規模50L)對多表位HBV DNA疫苗進行中試制備及質量研究,結果質粒產量可達60mg /L(郭妍等,南方醫科大學學報,2009;29(1)118-120)。總而言之,從有關質粒DNA發酵工藝方面的報道文獻中可知,由于菌種和質粒本身特點等因素影響,使絕大部分的現有發酵工藝雖然在較小規模發酵時可以獲得較高的菌體濃度和質粒含量,但是在較大規模發酵時卻只能得到較低的菌體濃度和質粒含量,因此,現報道的許多質粒發酵工藝中存在的問題是發酵規模、菌體濃度和質粒含量三者不能以較高水平同時呈現,從而導致其總產率達不到規模化要求。
另外,隨著基因治療的快速發展,非病毒載體的研究愈來愈受人們的重視,其使用數量和所占比例逐漸增多,尤其是質粒DNA具有制備容易、宿主反應弱、不整合到宿主DNA等優點,作為基因載體導入靶細胞被公認為比較安全、方便。但是質粒DNA存在細胞轉染效率較低、表達持續時間短、表達量不高、用藥劑量大等不足,因此能否實現大規模質粒DNA的制備成為質粒應用于基因治療的關鍵步驟之一。
基于上述原因,開發一套可實現重組人肝細胞生長因子裸質粒高產率、大規模的發酵工藝,為其產業化研究進展有著重大的意義。
技術實現要素:
發明的目的是提供一種重組人肝細胞生長因子裸質粒的高密度發酵方法,從而達到高效生產重組人肝細胞生長因子裸質粒的目的。
根據本發明的重組人肝細胞生長因子裸質粒的高密度發酵方法,包括以下步驟:
1) 工作種子培養:
將工作種子庫的菌種接種于一級種子培養基中,置于搖床進行培養,控制溫度35-38℃,轉速200-230 rpm,培養7-9h,得到一級種子液;將一級種子液以2-8%的接種量接種于二級種子培養基中,置于搖床進行培養,控制溫度35-38℃,轉速200-230 rpm,培養15-17 h,即得到發酵工作種子液;
2) 接種于發酵罐發酵:
將制備好的發酵工作種子液以2-5%的接種量接種于含發酵培養基的發酵罐中進行發酵,機械攪拌轉速為150-500rpm,通氣量為10-80L/min,罐壓為0.2-0.4par,維持溶氧水平在20-60%,發酵溫度為36-38℃,加入25-28%(v/v)氨水控制發酵pH在6.9-7.2;
用紫外分光光度計測定菌體濃度OD600為1-2時,開始以4mL/L·h的流速補加碳源補料培養基,發酵過程中每隔1h進行離線檢測葡萄糖濃度,根據葡萄糖濃度反饋補料,控制葡萄糖濃度在0.2-0.8g/L;紫外分光光度計測定菌體濃度OD600為4-6時,以5-7mL/L·h的流速開始補加有機氮源補料培養基;培養至菌體生長速度減緩,停止發酵收集菌體。其中所述的碳源補料培養基為50%葡萄糖溶液,所述的有機氮源補料培養基為20%胰蛋白胨與酵母粉(1:3)混合溶液。
本發明的優點在于根據菌體生長規律,結合底物濃度反饋補料,調節碳源和有機氮補料液流加速度,維持葡糖糖濃度在0.2-0.8g/L和控制C:N比例,從而調節菌體的生長速度以及目的產物的合成效率。本發酵方法可實現重組人肝細胞生長因子裸質粒的高效發酵,在100L中試發酵罐(發酵規模50L)發酵獲得的最終菌體濃度OD600可高達55 以上,且質粒含量可高達420 mg/L以上,使其發酵規模、最終菌體濃度和質粒含量三者能夠以較高水平同時呈現,使其發酵工藝的實用性更強,效率性更高,為重組人肝細胞生長因子裸質粒的產業化奠定了堅實基礎。
附圖說明
圖1為30L發酵罐中試高密度發酵時菌體生長曲線圖;圖中,橫坐標為發酵時間,縱坐標為菌體濃度OD600。
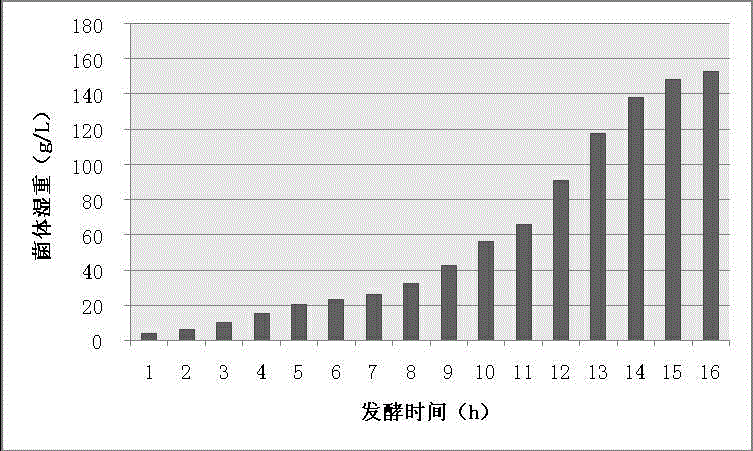
圖2為30L發酵罐中試高密度發酵時菌體濕重變化示意圖;圖中,橫坐標為發酵時間,縱坐標為菌體濕重。
圖3為重組人肝細胞生長因子裸質粒的30L發酵罐中試高密度發酵表達瓊脂糖凝膠電泳圖;圖中,M為Marker,泳道1、2均為發酵結束后的樣品。
圖4為100L發酵罐中試高密度發酵時菌體生長曲線圖;圖中,橫坐標為發酵時間,縱坐標為菌體濃度OD600。
圖5為100L發酵罐中試高密度發酵時菌體濕重變化示意圖;圖中,橫坐標為發酵時間,縱坐標為菌體濕重。
圖6為重組人肝細胞生長因子裸質粒的100L發酵罐中試高密度發酵表達瓊脂糖凝膠電泳圖;圖中,M為Marker,泳道1、2均為發酵結束后的樣品。
具體實施方式
以下通過實施例進一步說明本發明,但是,應當理解,這些實施例僅僅是用于更詳細具體地說明之用,而不應將其理解為用于以任何形式限制本發明。
實施例中所用的材料,如下所示:
工作菌種:采用本公司自行構建的DH5α/ pCK -HGF工程菌作為工作菌種。
主要設備:100L發酵罐(Hanil, LIFLUS SP 100L ),30L發酵罐(上海保興, BIOTECH-30JS),高壓蒸汽滅菌器(江陰濱江, LS-B100L-1),氣浴恒溫振蕩器(江蘇太倉, THZ-22),電子天平(Sartorius, TE4101-L、TE212-L),紫外分光光度計(Agilent Technologies,Cary60),工作超凈臺(蘇州安泰, SW-CJ-1F),pH計(Mettler Toledo, FE20),生化分析儀(山東省科學院生物研究所, SBA-40C),凝膠成像儀(Tanon, 1600) ,臺式離心機(Sigma, 1-13),連續流高速冷凍離心機(HITACHI, CR21GIII)。
種子培養基:胰蛋白胨10g/L 、酵母粉5g/L、氯化鈉1g/L。
發酵培養基:磷酸二氫鉀13.3g/L 、磷酸氫二銨4g/L、一水合檸檬酸1.7g/L 、胰蛋白胨1g/L、酵母粉1g/L 、七水硫酸鎂1.145g/L、葡萄糖1g/L 、微量元素溶液4mL/L、硫酸卡那霉素0.03g/L。
碳源補料培養基:50%葡萄糖溶液。
有機氮源補料培養基:20%有機氮源混合溶液(胰蛋白胨: 酵母粉=1:3)。
實施例1
1. 30L發酵罐中試高密度發酵:
1)工作種子培養
從-80℃保存的工作種子庫中取一支菌種,待其完全融化后取100μL菌液接種于一級種子培養基(250mL三角瓶裝50mL,含50μg/mL卡那霉素)中,置于搖床進行培養,控制溫度37℃,轉速230rpm,培養8h,得到一級種子液;將一級種子液以6 %的接種量接種于二級種子培養基(2L三角瓶分別裝400mL,含50μg/mL卡那霉素)中,置于搖床進行培養,控制溫度37℃,轉速230 rpm,培養15-17 h,即得到發酵工作種子液。
2)接種于30L發酵罐發酵
將制備好的發酵工作種子液以5%的接種量接種于含14L發酵培養基的30L發酵罐中進行發酵;機械攪拌轉速為150-500rpm,通氣量為10-80L/min,罐壓為0.2-0.4par,維持溶氧水平在20-50%,控制發酵溫度37℃,加入25-28%(v/v)氨水控制發酵pH在6.9-7.1。
用紫外分光光度計測定菌體濃度OD600為1.5左右時,開始以4mL/L·h的流速補加碳源補料培養基,發酵過程中每隔1h進行離線檢測葡萄糖濃度,根據葡萄糖濃度反饋補料,控制葡萄糖濃度在0.2-0.5g/L;紫外分光光度計測定菌體濃度OD600為5左右時,以5mL/L·h的流速開始補加有機氮源補料培養基。
3)下罐收集菌體
誘導表達4h后,停止流加碳源補料培養基和有機氮源補料培養基,關閉所有控制參數,結束發酵進程,之后利用罐壓將發酵菌液排放至100L收集罐中。采用連續流離心機離心(9500rpm、4℃、進樣流速100mL/min)收集的發酵菌液,棄上清,收集沉淀物,稱量沉淀物總重即得到總菌體濕重。
2. 主要指標測定方法:
2.1菌體濃度的測定
1) 取樣:每隔1h從發酵罐中進行取樣,每次取樣量100 mL,取樣時棄掉前50 mL發酵菌液,收集后50 mL發酵菌液。
2) 樣品處理:將采集的發酵菌液吹打混勻后,取適量菌液,用純水進行稀釋,使其稀釋液的吸光值OD600讀數在0.2-0.8范圍內。
3) 測定:以純水作為空白對照,采用紫外分光光度計在波長600nm處測定稀釋液的吸光值。
4) 數據處理:根據公式(菌體濃度=稀釋液吸光值×稀釋倍數)計算得出菌體濃度OD600,并以發酵時間為橫坐標,以菌體濃度OD600為縱坐標,繪制出發酵過程菌體生長曲線圖。
2.2菌體濕重的測定
1) 取樣:每隔1h從發酵罐中取樣,每次取樣量100 mL,取樣時棄掉前50 mL發酵菌液,收集后50 mL發酵菌液。
2) 測定:將采集的發酵菌液吹打混勻后,分別取1 mL菌液裝于4支已稱重的1.5mL離心管中,12000rpm離心2 min,棄上清,最后采用電子天平稱量4支離心管的重量,即得到總重。
3) 數據處理:根據公式{菌體濕重=(總重-總皮重)/4×10-3}計算得出單位體積的菌體濕重,并以發酵時間為橫坐標,以菌體濕重為縱坐標,繪制出發酵過程的菌體濕重變化示意圖。
2.3質粒含量的測定:
采用瓊脂糖凝膠電泳法和紫外分光光度法測定質粒含量,具體操作為:
1)取樣:發酵結束時,取適量發酵菌液(100-500μL),2支, 12000rpm離心2min,棄上清,收集菌體。
2)樣品處理:根據柱式質粒提取試劑盒操作說明提取樣品中的質粒 。
3)瓊脂糖凝膠電泳法測定質粒含量
a. 1%瓊脂糖凝膠配制:稱取0.467g瓊脂糖,倒入三角瓶中,再加50mL 1×TAE工作液,放入微波爐中加熱110秒,取出涼至不燙手時(約50-60℃),加3μl Goldview染料,混勻,倒入制膠模具中,涂布均勻,將梳子放在模具的一側,靜置,凝固30min。。
b. 上樣跑電泳:提取質粒后,取5μl樣品與1μl 6×上樣緩沖液混合(兩復孔)、取5μl對照品與1μl 6×上樣緩沖液混合、取分子量標準6μl ,65℃預熱5min,分別加到加樣孔中,72v恒壓電泳,約1h結束,此時電泳指示劑應距玻璃板邊緣約1cm。。
c. 數據處理:電泳結束后,將電泳膠轉移至白色板上,采用Tanon凝膠成像儀拍攝電泳膠,利用Tanon Gel Image System1D分析軟件分析電泳圖片,得出質粒含量。
4) 紫外分光光度法測定質粒含量
a. 樣品稀釋:用注射用水稀釋樣品至實測吸光度OD260值在0.2-1.0范圍內。
b. 檢測:取稀釋后的質粒溶液500μL,放入裝樣體積為500μL的比色皿中,以注射用水作空白對照,用紫外分光光度儀測定260nm與280nm波長處的OD值。
c. 結果計算:
樣品質粒含量(μg)= OD260×50μg/mL×稀釋倍數×0.1 mL ;
單位菌體質粒含量(μg /g)=樣品質粒含量(μg)×發酵液體積(L)÷留樣體積(L)÷菌體質量(g)÷70%。
備注:柱式質粒提取試劑盒質粒提取效率約為70%。
3. 實驗結果:
實施例1,經菌體濃度測定,顯示最終菌體濃度OD600可高達61 以上(見圖1);經菌體濕重測定,顯示最終單位菌體濕重可高達153g/L以上(見圖2);經質粒含量測定,顯示質粒含量可高達428mg/L以上(見圖3)。
實施例2
1. 100L發酵罐中試高密度發酵:
1)工作種子培養
從-80℃工作種子庫中取一支菌種,待其完全融化后取200μL菌液接種于一級種子培養基(500mL三角瓶裝100mL,含50μg/mL卡那霉素)中,置于搖床進行培養,控制溫度37℃,轉速230rpm,培養8h,得到一級種子液;將一級種子液以4%的接種量接種于二級種子培養基(4個2L三角瓶分別裝650mL,含50μg/mL卡那霉素)中,置于搖床進行培養,控制溫度37℃,轉速230 rpm,培養15-17 h,即得到發酵工作種子液。
2)接種于100L發酵罐發酵
將制備好的發酵工作種子液以5%的接種量接種于含50L發酵培養基的100L發酵罐中進行發酵,機械攪拌轉速為150-500 rpm,通氣量為10-80L/min,罐壓為0.2-0.4par,維持溶氧水平在20-50%,發酵溫度37℃,加入25-28%(v/v)氨水控制發酵pH在6.9-7.1。
用紫外分光光度計測定菌體濃度OD600為1左右時,開始以4mL/L·h的流速補加碳源補料培養基,發酵過程中每隔1h進行離線檢測葡萄糖濃度,根據葡萄糖濃度反饋補料,控制葡萄糖濃度在0.2-0.5g/L;紫外分光光度計測定菌體濃度OD600為5左右時,以5mL/L·h的流速開始補加有機氮源補料培養基。
3)下罐收集菌體
誘導表達4h后,停止流加碳源補料培養基和有機氮源補料培養基,關閉所有控制參數,結束發酵進程,之后利用罐壓將發酵菌液排放至100L收集罐中。采用連續流離心機離心(9500rpm、4℃、進樣流速100mL/min)收集的發酵菌液,棄上清,收集沉淀物,稱量沉淀物總重即得到總菌體濕重。
2. 主要指標測定方法:
2.1菌體濃度的測定
1) 取樣:每隔1h從發酵罐中進行取樣,每次取樣量100 mL,取樣時棄掉前50 mL發酵菌液,收集后50 mL發酵菌液。
2) 樣品處理:將采集的發酵菌液吹打混勻后,取適量菌液,用純水進行稀釋,使其稀釋液的吸光值OD600讀數在0.2-0.8范圍內。
3) 測定:以純水作為空白對照,采用紫外分光光度計在波長600nm處測定稀釋液的吸光值。
4) 數據處理:根據公式(菌體濃度=稀釋液吸光值×稀釋倍數)計算得出菌體濃度OD600,并以發酵時間為橫坐標,以菌體濃度OD600為縱坐標,繪制出發酵過程菌體生長曲線圖。
2.2菌體濕重的測定
1)取樣:每隔1h從發酵罐中取樣,每次取樣量100 mL,取樣時棄掉前50 mL發酵菌液,收集后50 mL發酵菌液。
2)測定:將采集的發酵菌液吹打混勻后,分別取1 mL菌液裝于4支已稱重的1.5mL離心管中,12000rpm離心2 min,棄上清,最后采用電子天平稱量4支離心管的重量,即得到總重。
3)數據處理:根據公式{菌體濕重=(總重-總皮重)/4×10-3}計算得出單位體積的菌體濕重,并以發酵時間為橫坐標,以菌體濕重為縱坐標,繪制出發酵過程的菌體濕重變化示意圖。
2.3質粒含量的測定:
采用瓊脂糖凝膠電泳法和紫外分光光度法測定質粒含量,具體操作為:
1)取樣:發酵結束時,取適量發酵菌液(100-500μL),2支, 12000rpm離心2min,棄上清,收集菌體。
2)樣品處理:根據柱式質粒提取試劑盒操作說明提取樣品中的質粒 。
3)瓊脂糖凝膠電泳法測定質粒含量
a. 1%瓊脂糖凝膠配制:稱取0.467g瓊脂糖,倒入三角瓶中,再加50mL 1×TAE工作液,放入微波爐中加熱110秒,取出涼至不燙手時(約50-60℃),加3μl Goldview染料,混勻,倒入制膠模具中,涂布均勻,將梳子放在模具的一側,靜置,凝固30min。。
b. 上樣跑電泳:提取質粒后,取5μl樣品與1μl 6×上樣緩沖液混合(兩復孔)、取5μl對照品與1μl 6×上樣緩沖液混合、取分子量標準6μl ,65℃預熱5min,分別加到加樣孔中,72v恒壓電泳,約1h結束,此時電泳指示劑應距玻璃板邊緣約1cm。。
c. 數據處理:電泳結束后,將電泳膠轉移至白色板上,采用Tanon凝膠成像儀拍攝電泳膠,利用Tanon Gel Image System1D分析軟件分析電泳圖片,得出質粒含量。
4)紫外分光光度法測定質粒含量
a. 樣品稀釋:用注射用水稀釋樣品至實測吸光度OD260值在0.2-1.0范圍內。
b. 檢測:取稀釋后的質粒溶液500μL,放入裝樣體積為500μL的比色皿中,以注射用水作空白對照,用紫外分光光度儀測定260nm與280nm波長處的OD值。
c. 結果計算:
樣品質粒含量(μg)= OD260×50μg/mL×稀釋倍數×0.1 mL ;
單位菌體質粒含量(μg /g)=樣品質粒含量(μg)×發酵液體積(L)÷留樣體積(L)÷菌體質量(g)÷70%。
備注:柱式質粒提取試劑盒質粒提取效率約為70%。
3. 實驗結果:
實施例2,經菌體濃度測定,顯示最終菌體濃度OD600可高達55 以上(見圖4);經菌體濕重測定,顯示最終單位菌體濕重可高達141g/L以上(見圖5);經質粒含量測定,顯示質粒含量可高達423mg/L以上(見圖6)。
- 還沒有人留言評論。精彩留言會獲得點贊!