嘧啶異羥肟酸衍生物及其制備方法和應用與流程
本發明涉及制藥領域,具體涉及一種新的嘧啶異羥肟酸類化合物及其藥學上可接受的鹽,所述化合物的制備方法,所述化合物及其藥學上可接受的鹽在抗癌藥物中的應用。
背景技術:
惡性腫瘤是目前危害人類健康最嚴重的疾病之一,其致死率僅次于心血管疾病,位居第二。據統計,全世界每年死于惡性腫瘤的病人超過600萬,每年有近600萬人發生腫瘤。
目前常規治療腫瘤的方法有外科手術治療、放射治療、化學藥物治療和生物調節治療等。其中化療作為全身性治療手段,在惡性腫瘤治療中具有手術、放療不可替代的重要地位。近年來新化療藥物的出現極大改善了腫瘤患者的預后,但化療藥物的毒性(Kaelin WG.The Concept of Synthetic Lethality in the Context ofAnticancer Therapy.Nat Rev Cancer 2005,5(9),689-698)和腫瘤細胞對藥物的耐藥性(Green DR,Evan GI.A matter oflife and death.Cancer Cell 2002,1(1),19-30.)正成為困擾化療的兩大難題。
多數化療藥物因為不能區分正常細胞和腫瘤細胞,在殺傷腫瘤細胞的同時也會對快速分裂的正常細胞產生毒性,表現為臨床治療過程中的毒副作用。因此,研發能有效殺傷腫瘤細胞且毒性低的新型抗癌藥物具有重要意義。
組蛋白乙酰化和去乙酰化可以影響細胞內染色質結構及形態變化,從而參與特定位點的基因轉錄調控,在細胞生長和分化過程中起重要作用,且該修飾是可逆的。而組蛋白去乙酰化酶(HDACs)抑制劑引起細胞中乙酰化組蛋白的堆積,使p21、p53等基因的表達水平增加,達到抑制腫瘤細胞的增殖、誘導細胞分化和凋亡的目的。體內外實驗證明HDACs抑制劑能抑制多種實體瘤和白血病中腫瘤細胞的生長(包括骨髓瘤、肺癌、乳腺癌等,Pontiki,E.;Hadjipavlou-Litina,D.Histone deacetylase inhibitors(HDACIs).Structure-activity relationships:History and new QSAR perspectives.Medicinal Research Reviews 2012,32(1),1-165.),其對腫瘤細胞的選擇性大于對正常細胞的選擇性,且同時毒副作用較小,與傳統的化療藥物相比具有明顯的優勢。2006年,Merck公司開發的SAHA(Suberoylanilide hydroxamicacid)作為第一個HDACs抑制劑類抗癌藥物經美國FDA批準正式上市,是這一研究領域的一個重大突破。此后,組蛋白去乙酰化酶(HDACs)抑制劑在腫瘤治療中的作用越來越受到重視,組蛋白乙酰化和去乙酰化在基因轉錄調控中的作用機制的研究越來越深入。隨著研究工作的深入開展,人們開發了多種HDACs抑制劑。
本發明選取骨髓瘤細胞RPMI8226作為腫瘤細胞篩選模型,同時以正常人外周血單核細胞(PBMC)為對照,篩選毒性低,抗癌效果好的活性化合物。
技術實現要素:
本發明公開了一類具有抗腫瘤活性的嘧啶異羥肟酸衍生物。本發明提供的化合物通過測定其對骨髓瘤細胞RPMI8226和正常人外周血單核細胞PBMC的抑制效果,揭示其具有選擇性地殺死骨髓瘤細胞而對正常人外周血單核細胞沒有明顯毒性的作用。進一步Western-blot實驗結果表明此類化合物能夠調控HDAC信號轉導通路使細胞中乙酰化組蛋白含量明顯增加。
根據本發明的一個方面,提供了具有通式I所表示的一類化合物及其藥效學上可接受的鹽:
其中:
n=1~3;
R1為R(CH2)m–,其中m=1~8,R為氫、PhNHCO–或PhNHSO2–;
R2為未取代的或取代的苯基;其中所述的取代苯基包括1-5個取代基,該取代基選自鹵素、C1-C8烷基和C1-C8烷氧基。
本發明提供了制備上述嘧啶異羥肟酸類化合物及其藥學上可接受鹽的方法。
本發明提供了通式I所示的嘧啶異羥肟酸類化合物及其藥學上可接受的鹽在制備預防或治療HDAC信號轉導通路相關的疾病和病癥的藥物中的用途。
本發明提供了所述HDAC信號轉導通路相關的疾病是骨髓瘤、肺癌、乳腺癌。
在另一個方面,本發明還提供了抑制腫瘤細胞增長的方法。這種方法包括將一個細胞暴露于所述劑量的化合物、或它的立體異構體、互變異構體、溶劑合物、前體藥物、或藥學上可接受的鹽,這些物質加入后能夠有效降低腫瘤細胞增長的速度和數量。在一些實施例中,腫瘤細胞增長降低的水平至少10%、至少30%、至少50%、或至少90%。
本發明中的化合物在治療上的有效劑量可以依據給藥途徑和劑型而變化。本發明化合物的有效劑量通常在約0.001到100mg/kg/天范圍內。更通常地,在約0.05到10mg/kg/天。通常,選擇一個或多個本發明中的化合物配成具有高治療指數的制劑。治療指數是毒性效果和治療效果之間的劑量比,該指數可以表達為LD50和ED50之間的比率。LD50是50%的群體致死的量,ED50是50%的群體有治療效果的劑量。LD50和ED50在動物細胞培養物和動物實驗中通過標準的藥學程序進行測定。
本發明提供的藥物組合物可以是多種形式,如片劑、膠囊、粉劑、糖漿、溶液狀、懸浮劑和氣霧劑等,并可以存在于適宜的固體和液體的載體或稀釋液中和適宜的用于注射或滴注的消毒器具中。
本發明的化合物和藥物組合物可對哺乳動物(包括人和動物)臨床使用,可以通過口、鼻、皮膚、肺、或者胃腸道等的給藥途徑。最優選的給藥途徑為口服或注射。
在治療方面,本發明所描述的化合物可以與其他療法或活性成份及其制劑聯合使用。聯合用藥的目的是對大多數癌細胞,例如癌,黑色素瘤,淋巴瘤和肉瘤,起到細胞毒協同效應,以及降低或消除耐藥細胞的出現和降低每個藥物的副作用。活性添加劑的具體數量的確定取決于所使用的特定試劑,癌癥類型,嚴重程度和階段,以及本文描述的化合物的劑量和同時給藥的其他活性添加劑劑量。可以與本專利所述的化合物聯合使用的其他附加活性成份在本領域是眾所周知的。
附圖說明
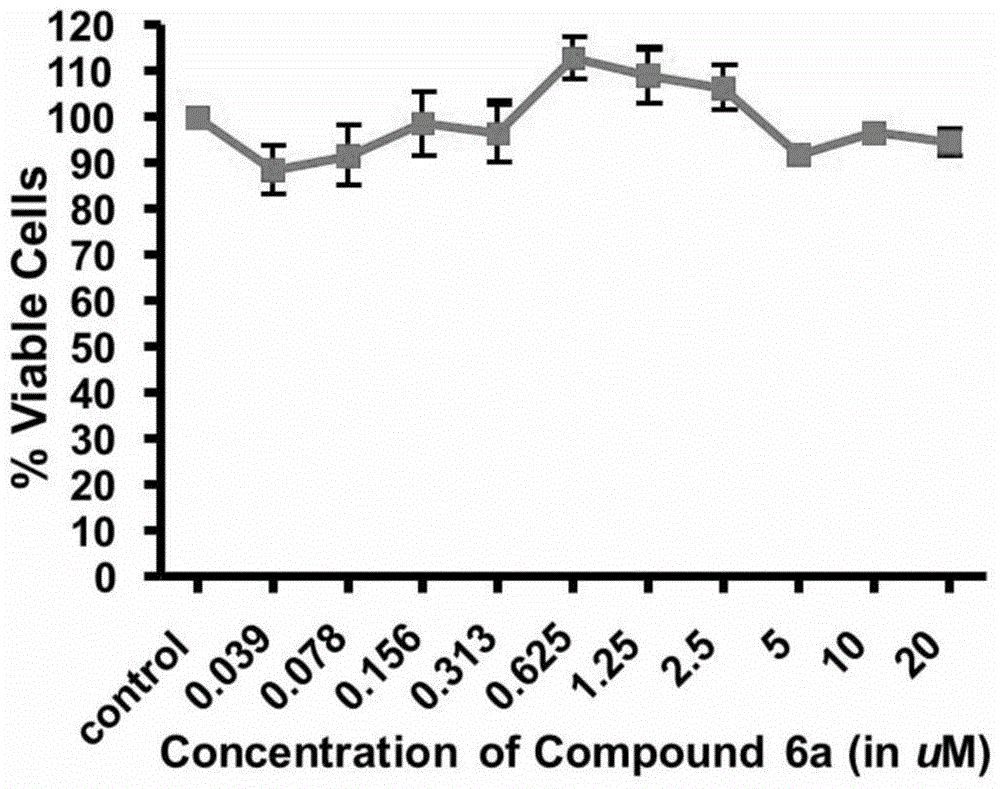
圖1化合物6a對PBMC細胞的生存率試驗結果
圖2化合物6a對RPMI8226細胞凋亡檢測結果
圖3化合物6a和陽性藥物SAHA對RPMI8226細胞乙酰化組蛋白含量檢測結果
具體實施方式
在以下的實施例中將進一步舉例說明本發明,這些實施例僅用于說明本發明,但不以任何方式限制本發明。
實施例1:新型嘧啶異羥肟酸衍生物的合成
實驗路線一:
實驗路線二:
4-(N-芐基-4-甲氧基苯磺酰胺基)-2-甲硫基嘧啶-5-羧酸乙酯2的合成.
將4-氯-2-甲硫基嘧啶-5-羧酸乙酯1(2.0g,8.59mmol)和N-芐基-4-甲氧基苯磺酰胺(3.58g,12.91mmol)溶于CH3CN(60mL)中,加入K2CO3(1.43g,10.36mmol),反應液回流12小時。減壓蒸除溶劑,加入EtOAc(300mL),有機相依次用水(100mL),飽和NaHCO3溶液(100mL)和飽和食鹽水(100mL)洗滌,Na2SO4干燥,減壓蒸干得到粗產物,硅膠柱分離(石油醚/乙酸乙酯=10/1)得目標產物2。收率64%,mp:106–107℃;1HNMR:δ8.86(s,1H),7.57(d,2H,J=8.7),7.41(d,2H,J=6.6),7.26–7.18(m,3H),6.98(d,2H,J=9.0),4.75(s,2H),4.47(q,2H,J=6.9),3.89(s,3H),2.42(s,3H),1.50(t,3H,J=7.2);13C NMRδ174.3,164.8,163.4,159.9,157.1,135.1,129.8,129.2,128.4,128.1,127.5,118.7,114.2,61.7,55.6,50.9,14.1,13.9;MS(ESI):m/z 474.0[M+H+].
4-(N-芐基-4-甲氧基苯磺酰胺基)-2-甲硫基嘧啶-5-羧酸3的合成.
將化合物2(2.5g,5.28mmol)溶于二氧六環(40mL)中,加入0.5N NaOH溶液(42mL),反應液50℃攪拌5小時。減壓蒸除溶劑,加入熱水(50mL),6N HCl調PH=2,攪拌1小時,過濾得目標產物3。收率98%,MS(ESI):m/z 446.0[M+H+].
4-(N-芐基-4-甲氧基苯磺酰胺基)-2-甲硫基嘧啶-5-異羥肟酸4的合成.
0℃條件下,將(COCl)2(4.69mL,49.4mmol)加入到化合物3(2.2g,4.94mmol)和DMF(0.5mL)的CH2Cl2(70mL)溶液中,控溫攪拌30分鐘后,反應液升至室溫攪拌1小時,真空濃縮除去過量的(COCl)2,將濃縮液溶于CH2Cl2(20mL)中得到相應酰氯溶液。在另一圓底燒瓶中,0℃條件下,將鹽酸羥胺(1.37g,19.76mmol)溶于DMF(16mL)中,加入Et3N(3.44mL,24.7mmol),混合液用CH2Cl2(10mL)稀釋。0℃條件下,將酰氯CH2Cl2溶液滴加到羥胺溶液中,反應液升至室溫攪拌1小時,濃縮蒸干,溶于CH2Cl2(300mL)中,依次用水(100mL)和飽和食鹽水(100mL)洗滌,Na2SO4干燥,減壓蒸干得到粗產物,硅膠柱分離(二氯甲烷/甲醇=10/1)得目標化合物4。收率60%,mp:141–143℃;1H NMR(DMSO-d6):δ11.12(s,1H),9.27(s,1H),8.55(s,1H),7.72(d,2H,J=9.0),7.40(d,2H,J=6.0),7.22–7.14(m,5H),4.77(s,2H),3.87(s,3H),2.33(s,3H);13C NMR(DMSO-d6):δ177.2,168.4,166.5,163.1162.3,140.5,135.4,133.7,133.2,133.0,132.5,125.9,119.6,61.0,56.3,18.6;MS(ESI):m/z 461.0[M+H+].
4-(N-芐基-4-甲氧基苯磺酰胺基)-2-甲亞砜基嘧啶-5-異羥肟酸5的合成.
0℃條件下,將m-CPBA(587mg,3.40mmol)的CH2Cl2(50mL)溶液滴加到化合物4(1.3g,2.82mmol)的CH2Cl2(40mL)溶液中,控溫攪拌30分鐘,反應液升至室溫攪拌3小時,依次用飽和NaHSO3(60mL),飽和Na2CO3(60mL)和飽和食鹽水(60mL)洗滌,Na2SO4干燥,減壓蒸干得到粗產物,硅膠柱分離(二氯甲烷/甲醇=50/1~10/1)得目標產物5。收率65%,MS(ESI):m/z 477.0[M+H+].
化合物6a,6b和6d-i的合成通法.
室溫條件下,將Et3N(39μL,0.28mmol)加入到化合物5(90mg,0.19mmol)和硫醇或正戊胺(0.24mmol)的CH3CN(4mL)溶液中,TLC監測直至原料5反應完全,減壓蒸除溶劑,加入CH2Cl2(20mL),依次用飽和NaHCO3(10mL)和食鹽水(10mL)洗滌,Na2SO4干燥,減壓蒸干得到粗產物,硅膠柱分離(二氯甲烷/甲醇=50/1~10/1)得目標化合物6。
4-(N-芐基-4-甲氧基苯磺酰胺基)-2-正戊硫基嘧啶-5-異羥肟酸6a:55%;mp:95–97℃;1H NMR(DMSO-d6):δ11.11(s,1H),9.29(s,1H),8.54(s,1H),7.68(d,2H,J=9.0),7.43(d,2H,J=6.6),7.23–7.13(m,5H),4.78(s,2H),3.85(s,3H),2.82(t,2H,J=7.5),1.45–1.41(m,2H),1.23–1.19(m,4H),0.83(t,3H,J=6.9);13C NMR(DMSO-d6):δ177.0,168.4,166.7,163.2,162.4,140.5,135.3,133.5,133.3,132.8,132.5,126.2,119.6,60.9,56.2,35.6,35.2,33.5,26.7,19.0;MS(ESI):m/z 516.9[M+H+].
4-(N-芐基-4-甲氧基苯磺酰胺基)-2-正戊胺基嘧啶-5-異羥肟酸6b:53%;mp:171–173℃;1H NMR:δ8.29(s,1H),7.69(d,2H,J=8.7),7.26–7.20(m,5H),7.08(br,1H),7.01(d,2H,J=8.7),4.68(s,2H),3.89(s,3H),3.24–3.19(m,2H),1.59–1.55(m,2H),1.38–1.32(m,4H),0.93(t,3H,J=6.9);MS(ESI):m/z 499.9[M+H+].
4-(N-芐基-4-甲氧基苯磺酰胺基)-2-正丁硫基嘧啶-5-異羥肟酸6d:50%;mp:116–118℃;1H NMR(DMSO-d6):δ11.10(s,1H),9.27(s,1H),8.54(s,1H),7.69–7.66(m,2H),7.43(d,2H,J=6.0),7.23–7.14(m,5H),4.78(s,2H),3.86(s,3H),2.83(t,2H,J=7.2),1.43–1.38(m,2H),1.30–1.24(m,2H),0.82(t,3H,J=7.2);13C NMR(DMSO-d6):δ177.1,168.5,66.7,163.3,162.5,140.6,135.4,133.7,133.4,132.9,132.6,126.3,119.7,61.0,56.3,35.8,35.0,26.6,18.5;MS(ESI):m/z 502.9[M+H+].
4-(N-芐基-4-甲氧基苯磺酰胺基)-2-正己硫基嘧啶-5-異羥肟酸6e:51%;MS(ESI):m/z531.0[M+H+].
4-(N-芐基-4-甲氧基苯磺酰胺基)-2-正庚硫基嘧啶-5-異羥肟酸6f:44%;MS(ESI):m/z545.0[M+H+].
4-(N-芐基-4-甲氧基苯磺酰胺基)-2-正辛硫基嘧啶-5-異羥肟酸6g:51%;mp:98–100℃;1H NMR:δ9.80(br,1H),8.87(s,1H),7.62(d,2H,J=6.0),7.26–7.16(m,5H),7.02(d,2H,J=6.0),4.69(s,2H),3.91(s,3H),2.81(t,2H,J=7.2),1.60–1.54(m,2H),1.40–1.18(m,10H),0.87(t,3H,J=7.2);MS(ESI):m/z 559.0[M+H+].
4-(N-芐基-4-甲氧基苯磺酰胺基)-2-(2-氧代-2-苯胺基乙基)硫基嘧啶-5-異羥肟酸6h:60%;mp:94–96℃;1H NMR:δ8.96(s,1H),8.50(s,1H),7.61(d,2H,J=6.0),7.49–7.45(m,2H), 7.34–7.28(m,2H),7.14–7.01(m,8H),4.66(s,2H),3.91(s,3H),3.67(s,2H);MS(ESI):m/z 580.0[M+H+].
4-(N-芐基-4-甲氧基苯磺酰胺基)-2-(3-氧代-3-苯胺基丙基)硫基嘧啶-5-異羥肟酸6i:32%;mp:99–101℃;1H NMR:δ8.83(s,1H),7.64(d,2H,J=6.0),7.55–7.50(m,2H),7.35–7.10(m,8H),6.99(d,2H,J=6.9),4.70(s,2H),3.84(s,3H),3.31(t,1H,J=7.2),2.94(t,1H,J=7.2),2.82(t,1H,J=7.2),2.63(t,1H,J=7.2);MS(ESI):m/z 594.0[M+H+].
4-(N-芐基-4-甲氧基苯磺酰胺基)-2-正戊氧基嘧啶-5-異羥肟酸6c的合成.
將NaH(13mg,0.42mmol,80%dispersion in oil)加入到化合物5(100mg,0.21mmol)的正戊醇(4mL)溶液中,室溫攪拌2小時。減壓蒸除溶劑,加入CH2Cl2(20mL),有機相依次用飽和NaHCO3溶液(10mL)和飽和食鹽水(10mL)洗滌,Na2SO4干燥,減壓蒸干得到粗產物,硅膠柱分離(二氯甲烷/甲醇=50/1~10/1)得目標產物6c。收率28%,mp:94–96℃;MS(ESI):m/z 500.9[M+H+].
5-(乙氧羰基)-6-氧代-1,6-二氫嘧啶基-2-硫化鈉8的合成.
40℃條件下,將硫脲(4.18g,55mmol)加入到Na(1.61g,70mmol)的無水乙醇(100mL)溶液中,隨后將乙氧基亞甲基丙二酸二乙酯(11mL,55mmol)滴加到上述溶液中,回流攪拌2小時,室溫靜置過夜,過濾得固體,依次用冷的乙醇和乙醚洗滌,干燥得目標產物8。收率98%,mp:270–272℃;1H NMR(DMSO-d6):δ8.20(s,1H),4.11(q,2H,J=6.9),1.22(t,3H,J=6.9).
4-羥基-2-正戊硫基嘧啶-5-羧酸乙酯9的合成.
將NaI(11.49g,76.6mmol)和四丁基溴化銨(8.21g,25.5mmol)加入到化合物8(11.5g,51.8mmol)的CHCl3(330mL)和水(330mL)的溶液中,隨后將1-碘戊烷(10mL,76.6mmol)滴加到上述溶液中,50℃控溫反應12小時,分離有機相,水相用CHCl3(2x100mL)萃取,有機相合并后用飽和食鹽水(300mL)洗滌,Na2SO4干燥,減壓蒸干得到粗產物,硅膠柱分離(石油醚/乙酸乙酯=20/1~10/1)得目標產物9。收率53%,mp:95–96℃;1HNMR:δ8.73(s,1H),4.42(q,2H,J=3.9),3.20(t,2H,J=7.5),1.78–1.69(m,2H),1.48–1.32(m,7H),0.91(t,3H,J=6.9);MS(ESI):m/z 271.0[M+H+].
4-氯-2-正戊硫基嘧啶-5-羧酸乙酯10的合成.
將化合物9(5.67g,21mmol)溶于POCl3(260mL),混合液回流攪拌12小時,減壓蒸除過量的POCl3,將殘留液倒入冰水中,Et2O(4x70mL)萃取,有機相依次用飽和NaHCO3溶液(140mL)和飽和食鹽水(140mL)洗滌,Na2SO4干燥,減壓蒸干得到粗產物,硅膠柱分離(石油醚/乙酸乙酯=10/1)得目標產物10。收率89%,oil;1H NMR:δ8.93(s,1H),4.46–4.37(m,2H),3.18(t,2H,J=6.9),1.80–1.70(m,2H),1.49–1.33(m,7H),0.92(t,3H,J=7.5);MS(ESI):m/z 289.0 [M+H+].
2-正戊硫基嘧啶-5-羧酸乙酯11j,11k和11m-s的合成通法.
將K2CO3(382mg,2.76mmol)加入到化合物10(400mg,1.38mmol)和相應磺酰胺或芐胺(2.08mmol)的CH3CN(10mL)溶液中,混合液回流攪拌,TLC監測直至原料10反應完全,減壓蒸除溶劑,加入水(25mL),EtOAc(3x15mL)萃取,有機相用飽和食鹽水(25mL)洗滌,Na2SO4干燥,減壓蒸干得到粗產物,硅膠柱分離(石油醚/乙酸乙酯=10/1)得目標產物11。
4-(4-甲氧基苯磺酰胺基)-2-正戊硫基嘧啶-5-羧酸乙酯11j:63%;oil;MS(ESI):m/z 440.1[M+H+].
4-芐胺基-2-正戊硫基嘧啶-5-羧酸乙酯11k:72%;oil;MS(ESI):m/z 360.0[M+H+].
4-(N-芐基-4-氟苯磺酰胺基)-2-正戊硫基嘧啶-5-羧酸乙酯11m:81%;mp:77–79℃;1H NMR:δ8.87(s,1H),7.68–7.65(m,2H),7.39(d,2H,J=7.2),7.26–7.18(m,5H),4.76(s,2H),4.46(q,2H,J=6.9),2.95(t,2H,J=7.2),1.61–1.57(m,2H),1.48(t,3H,J=7.2),1.34–1.27(m,4H),0.90(t,3H,J=6.9);MS(ESI):m/z 518.2[M+H+].
4-(N-芐基苯磺酰胺基)-2-正戊硫基嘧啶-5-羧酸乙酯11n:78%;mp:79–81℃;1H NMR:δ8.87(s,1H),7.64–7.62(m,3H),7.55–7.50(m,2H),7.42–7.39(m,2H),7.24–7.19(m,3H),4.77(s,2H),4.47(q,2H,J=6.9),2.93(t,2H,J=7.2),1.59–1.54(m,2H),1.49(t,3H,J=7.2),1.34–1.26(m,4H),0.89(t,3H,J=6.9);MS(ESI):m/z 500.1[M+H+].
4-(N-芐基-3-甲氧基苯磺酰胺基)-2-正戊硫基嘧啶-5-羧酸乙酯11o:83%;mp:86–88℃;1H NMR:δ8.88(s,1H),7.45–7.40(m,3H),7.27–7.14(m,5H),7.07–7.05(m,1H),4.77(s,2H),4.47(q,2H,J=6.9),3.79(s,3H),2.95(t,2H,J=7.2),1.62–1.56(m,2H),1.49(t,3H,J=7.2),1.35–1.25(m,4H),0.89(t,3H,J=6.9);MS(ESI):m/z 530.2[M+H+].
4-(N-(吡啶-3-基甲基)-4-甲氧基苯磺酰胺基)-2-正戊硫基嘧啶-5-羧酸乙酯11p:34%;mp:82–84℃;1H NMR:δ8.86(s,1H),8.56(d,1H,J=1.8),8.49–8.47(m,1H),8.00(d,1H,J=7.8),7.57–7.54(m,2H),7.30–7.26(m,1H),7.00–6.97(m,2H),4.79(s,2H),4.46(q,2H,J=7.2),3.89(s,3H),2.97(t,2H,J=7.2),1.62–1.56(m,2H),1.48(t,3H,J=7.2),1.36–1.28(m,4H),0.89(t,3H,J=6.9);MS(ESI):m/z 531.2[M+H+].
4-(N-苯基-4-甲氧基苯磺酰胺基)-2-正戊硫基嘧啶-5-羧酸乙酯11q:82%;mp:63–65℃;1H NMR:δ8.84(s,1H),7.58(d,2H,J=8.7),7.32–7.26(m,5H),6.90(d,2H,J=8.7),4.32(q,2H,J=6.9),3.87(s,3H),2.99(t,2H,J=7.2),1.62–1.58(m,2H),1.40(t,3H,J=7.2),1.34–1.27(m,4H),0.89(t,3H,J=6.9);MS(ESI):m/z 516.2[M+H+].
4-(N-苯乙基-4-甲氧基苯磺酰胺基)-2-正戊硫基嘧啶-5-羧酸乙酯11r:52%;mp:103–105℃;1HNMR:δ8.93(s,1H),7.49(d,2H,J=8.4),7.26–7.12(m,5H),6.90(d,2H,J=8.7),4.44(q,2H,J=6.9),3.87–3.82(m,5H),2.98–2.88(m,4H),1.66–1.58(m,2H),1.45(t,3H,J=6.9),1.34–1.22(m,4H),0.86(t,3H,J=6.9);MS(ESI):m/z 544.0[M+H+].
4-(N-(3-苯丙基)-4-甲氧基苯磺酰胺基)-2-正戊硫基嘧啶-5-羧酸乙酯11s:57%;mp:78–80℃;1H NMR:δ8.95(s,1H),7.48–7.45(m,2H),7.27–7.09(m,5H),6.93–3.90(m,2H),4.46(q,2H,J=6.9),3.85(s,3H),3.64(t,2H,J=6.9),2.86(t,2H,J=7.5),2.74(t,2H,J=7.5),1.89–1.84(m,2H),1.58–1.53(m,2H),1.46(t,3H,J=6.9),1.28–1.21(m,4H),0.86(t,3H,J=6.9);MS(ESI):m/z 558.2[M+H+].
2-甲硫基嘧啶-5-羧酸乙酯12的合成.
將Zn粉(1.17g,18mmol)和3M NH4Cl(5.2mL)加入到化合物1(466mg,2mmol)的甲苯(2.5mL)溶液中,混合液80℃攪拌36小時,過濾,CH2Cl2洗滌,濾液真空濃縮,加入CH2Cl2(30mL)和水(30mL),水相用CH2Cl2(30mL)萃取,有機相合并后用飽和食鹽水(40mL)洗滌,Na2SO4干燥,減壓蒸干得到粗產物,硅膠柱分離(石油醚/乙酸乙酯=10/1)得目標產物12。收率56%,oil;MS(ESI):m/z 199.0[M+H+].
2-甲砜基嘧啶-5-羧酸乙酯13的合成.
0℃條件下,將m-CPBA(458mg,2.65mmol)的CH2Cl2(18mL)溶液滴加到化合物12(210mg,1.06mmol)的CH2Cl2(18mL)溶液中,控溫攪拌30分鐘,反應液升至室溫攪拌6小時,依次用飽和NaHSO3(18mL),飽和NaHCO3(3x18mL)和飽和食鹽水(18mL)洗滌,Na2SO4干燥,減壓蒸干得目標產物13。收率76%,MS(ESI):m/z 231.0[M+H+].
2-正戊硫基嘧啶-5-羧酸乙酯11l的合成.
將Et3N(114μL,0.82mmol)加入到化合物13(124mg,0.54mmol)和1-戊硫醇(86μL,0.70mmol)的CH3CN(15mL)溶液中,室溫攪拌2小時。減壓蒸除溶劑,加入CH2Cl2(20mL),有機相依次用飽和NaHCO3溶液(10mL)和飽和食鹽水(10mL)洗滌,Na2SO4干燥,減壓蒸干得到粗產物,硅膠柱分離(石油醚/乙酸乙酯=10/1)得目標產物11l。收率89%,oil;MS(ESI):m/z 255.0[M+H+].
2-正戊硫基嘧啶-5-羧酸14的合成通法.
將化合物11(0.40mmol)溶于二氧六環(6mL)中,加入0.5N NaOH溶液(3.34mL),反應液50℃攪拌,TLC監測直至原料11反應完全,減壓蒸除溶劑,加入熱水(2.5mL),6N HCl調PH=2,攪拌1小時,過濾得目標產物14。
4-(4-甲氧基苯磺酰胺基)-2-正戊硫基嘧啶-5-羧酸14j:99%;mp:56–58℃;1H NMR:δ8.83(s,1H),8.03–7.98(m,2H),7.00–6.93(m,2H),3.85(s,3H),3.04(t,2H,J=6.9),1.69–1.62(m, 2H),1.43–1.25(m,4H),0.92(t,3H,J=6.9);MS(ESI):m/z 412.1[M+H+].
4-芐胺基-2-正戊硫基嘧啶-5-羧酸14k:72%;mp:285–287℃;MS(ESI):m/z 332.0[M+H+].
2-正戊硫基嘧啶-5-羧酸14l:95%;mp:130–132℃;MS(ESI):m/z 227.0[M+H+].
4-(N-芐基-4-氟苯磺酰胺基)-2-正戊硫基嘧啶-5-羧酸14m:90%;mp:48–50℃;1H NMR:δ8.97(s,1H),7.71–7.66(m,2H),7.37(d,2H,J=6.6),7.23–7.17(m,5H),4.78(s,2H),2.95(t,2H,J=6.9),1.62–1.58(m,2H),1.38–1.26(m,4H),0.91(t,3H,J=6.9);MS(ESI):m/z 490.1[M+H+].
4-(N-芐基苯磺酰胺基)-2-正戊硫基嘧啶-5-羧酸14n:98%;mp:45–47℃;1H NMR:δ8.98(s,1H),7.68–7.64(m,3H),7.57–7.53(m,2H),7.40–7.37(m,2H),7.26–7.19(m,3H),4.79(s,2H),2.92(t,2H,J=6.9),1.60–1.54(m,2H),1.34–1.26(m,4H),0.90(t,3H,J=6.9);MS(ESI):m/z472.2[M+H+].
4-(N-芐基-3-甲氧基苯磺酰胺基)-2-正戊硫基嘧啶-5-羧酸14o:98%;mp:166–167℃;1H NMR:δ8.96(s,1H),7.45–7.38(m,3H),7.26–7.09(m,6H),4.78(s,2H),3.80(s,3H),2.93(t,2H,J=6.9),1.62–1.58(m,2H),1.34–1.28(m,4H),0.90(t,3H,J=6.9);MS(ESI):m/z 502.1[M+H+].
4-(N-(吡啶-3-基甲基)-4-甲氧基苯磺酰胺基)-2-正戊硫基嘧啶-5-羧酸14p:93%;mp:156–158℃;1H NMR(DMSO-d6):δ8.95(s,1H),8.92(s,1H),8.76–8.72(m,1H),8.52–8.47(m,1H),7.92–7.86(m,1H),7.57(d,2H,J=9.0),7.15(d,2H,J=9.3),5.00(s,2H),3.87(s,3H),2.89(t,2H,J=7.2),1.50–1.42(m,2H),1.22–1.16(m,4H),0.83(t,3H,J=6.9);MS(ESI):m/z 502.8[M+H+].
4-(N-苯基-4-甲氧基苯磺酰胺基)-2-正戊硫基嘧啶-5-羧酸14q:99%;mp:38–40℃;1H NMR:δ8.95(s,1H),7.59(d,2H,J=9.3),7.32–7.30(m,5H),6.91(d,2H,J=9.0),3.87(s,3H),3.03(t,2H,J=7.5),1.67–1.60(m,2H),1.38–1.28(m,4H),0.90(t,3H,J=6.9);MS(ESI):m/z487.9[M+H+].
4-(N-苯乙基-4-甲氧基苯磺酰胺基)-2-正戊硫基嘧啶-5-羧酸14r:89%;mp:119–121℃;MS(ESI):m/z 515.9[M+H+].
4-(N-(3-苯丙基)-4-甲氧基苯磺酰胺基)-2-正戊硫基嘧啶-5-羧酸14s:75%;mp:97–98℃;1H NMR:δ9.05(s,1H),7.48(d,2H,J=8.4),7.26–7.09(m,5H),6.92(d,2H,J=8.7),3.86(s,3H),3.65(t,2H,J=6.6),2.85(t,2H,J=7.2),2.71(t,2H,J=7.2),1.90–1.81(m,2H),1.58–1.51(m,2H),1.30–1.22(m,4H),0.87(t,3H,J=6.9);MS(ESI):m/z 530.3[M+H+].
化合物嘧啶-5-異羥肟酸6k-p和6r的合成通法.
0℃條件下,將(COCl)2(42μL,0.44mmol)的CH2Cl2(0.5mL)溶液滴加到化合物14(2.2g,4.94mmol)的DMF(0.3mL)溶液中,控溫攪拌30分鐘后,反應液升至室溫攪拌2小時,得相應酰氯溶液。在另一圓底燒瓶中,0℃條件下,將Et3N(0.45mL,3.2mmol)的THF(1mL)溶液滴到鹽酸羥胺(139mg,2mmol)的THF(1mL)和水(0.5mL)的溶液中,室溫攪拌1小時。0℃條件下,將相應酰氯溶液滴加到羥胺溶液中,反應液升至室溫攪拌3小時,加入水(10mL),CH2Cl2(3x8mL)萃取,有機相用飽和食鹽水(10mL)洗滌,Na2SO4干燥,減壓蒸干得到粗產物,硅膠柱分離(二氯甲烷/甲醇=20/1~10/1)得目標化合物6。
4-芐胺基-2-正戊硫基嘧啶-5-異羥肟酸6k:93%;mp:159–160℃;1H NMR:δ8.60(br,1H),8.27(br,1H),7.35–7.26(m,5H),4.75(s,2H),3.03(t,2H,J=7.2),1.72–1.60(m,2H),1.38–1.24(m,4H),0.87(t,3H,J=6.6);MS(ESI):m/z 347.0[M+H+].
2-正戊硫基嘧啶-5-異羥肟酸6l:53%;mp:105–107℃;1H NMR(DMSO-d6):δ8.88(s,2H),3.15(t,2H,J=7.2),1.72–1.62(m,2H),1.42–1.26(m,4H),0.88(t,3H,J=6.6);MS(ESI):m/z242.0[M+H+].
4-(N-芐基-4-氟苯磺酰胺基)-2-正戊硫基嘧啶-5-異羥肟酸6m:39%;mp:84–86℃;1H NMR:δ8.86(s,1H),7.74–7.70(m,2H),7.28–7.18(m,7H),4.70(s,2H),2.85(t,2H,J=7.5),1.63–1.56(m,2H),1.35–1.28(m,4H),0.91(t,3H,J=6.9);MS(ESI):m/z 504.9[M+H+].
4-(N-芐基苯磺酰胺基)-2-正戊硫基嘧啶-5-異羥肟酸6n:47%;mp:104–105℃;1H NMR:δ8.88(s,1H),7.71–7.59(m,5H),7.30–7.18(m,5H),4.72(s,2H),2.76(t,2H,J=6.9),1.60–1.54(m,2H),1.32–1.25(m,4H),0.90(t,3H,J=6.9);MS(ESI):m/z 486.8[M+H+].
4-(N-芐基-3-甲氧基苯磺酰胺基)-2-正戊硫基嘧啶-5-異羥肟酸6o:40%;mp:81–83℃;1H NMR:δ8.88(s,1H),7.52–7.46(m,1H),7.34–7.12(m,8H),4.72(s,2H),3.83(s,3H),2.80(t,2H,J=7.2),1.61–1.57(m,2H),1.35–1.27(m,4H),0.91(t,3H,J=6.9);MS(ESI):m/z 517.2[M+H+].
4-(N-(吡啶-3-基甲基)-4-甲氧基苯磺酰胺基)-2-正戊硫基嘧啶-5-異羥肟酸6p:17%;mp:68–69℃;1H NMR:δ8.79(s,1H),8.47(br,2H),7.74–7.71(m,1H),7.62(d,2H,J=8.7),7.26–7.22(m,1H),7.02(d,2H,J=8.7),4.71(s,2H),3.91(s,3H),2.83(t,2H,J=7.2),1.62–1.54(m,2H),1.34–1.25(m,4H),0.90(t,3H,J=6.9);MS(ESI):m/z 518.1[M+H+].
4-(N-苯乙基-4-甲氧基苯磺酰胺基)-2-正戊硫基嘧啶-5-異羥肟酸6r:7%;mp:76–78℃;1H NMR:δ9.04(s,1H),7.52–7.46(m,2H),7.36–7.24(m,3H),7.11–7.04(m,2H),6.97–6.93(m,2H),3.88–3.81(m,5H),2.83–2.75(m,4H),1.62–1.52(m,2H),1.33–1.26(m,4H),0.88(t,3H,J=5.4); MS(ESI):m/z 531.1[M+H+].
化合物嘧啶-5-異羥肟酸6j,6q和6s的合成通法.
將O-(四氫-2H-吡喃-2-基)羥基胺(37mg,0.32mmol)和Et3N(45μL,0.32mmol)加入到化合物14(0.23mmol),HOBt(43mg,0.32mmol)和EDC·HCl(61mg,0.32mmol)的CH2Cl2(2mL)和THF(2mL)溶液中,混合液室溫攪拌24小時,減壓蒸除溶劑,加入水(8mL),EtOAc(3x8mL)萃取,有機相用飽和食鹽水(10mL)洗滌,Na2SO4干燥,減壓蒸干得到粗產物,硅膠柱分離(二氯甲烷/甲醇=100/1)得相應四氫-2H-吡喃-2-基保護的嘧啶異羥肟酸化合物,將上述保護的嘧啶異羥肟酸化合物溶于CH2Cl2(1mL)和MeOH(1mL)的混合液中,0℃條件下,加入CF3CO2H(0.63mL),室溫攪拌24小時,減壓蒸干得到粗產物,硅膠柱分離(二氯甲烷/甲醇=100/1~10/1)得目標化合物6。
4-(4-甲氧基苯磺酰胺基)-2-正戊硫基嘧啶-5-異羥肟酸6j:35%;mp:148–150℃;1H NMR(DMSO-d6):δ8.59(s,1H),7.91(d,2H,J=8.4),7.11(d,2H,J=9.0),3.84(s,3H),2.96(t,2H,J=7.2),1.62–1.53(m,2H),1.36–1.25(m,4H),0.87(t,3H,J=6.9);MS(ESI):m/z 427.0[M+H+].
4-(N-苯基-4-甲氧基苯磺酰胺基)-2-正戊硫基嘧啶-5-異羥肟酸6q:30%;mp:56–58℃;1H NMR:δ8.82(s,1H),7.63–7.58(m,2H),7.32–7.26(m,5H),6.97–6.92(m,2H),3.89(s,3H),3.01(t,2H,J=7.2),1.72–1.60(m,2H),1.38–1.28(m,4H),0.92(t,3H,J=6.9);MS(ESI):m/z 503.1[M+H+].
4-(N-(3-苯丙基)-4-甲氧基苯磺酰胺基)-2-正戊硫基嘧啶-5-異羥肟酸6s:28%;mp:56–58℃;1HNMR:δ8.66(s,1H),7.90(s,1H),7.55(d,2H,J=8.7),7.21–7.09(m,5H),7.00(d,2H,J=9.0),3.88(s,3H),3.58(t,2H,J=6.6),2.76(t,2H,J=7.2),2.67(t,2H,J=7.2),1.76–1.70(m,2H),1.53–1.47(m,2H),1.26–1.21(m,4H),0.86(t,3H,J=6.9);MS(ESI):m/z 545.1[M+H+].
實施例2:細胞活力檢測
實驗方法:將RPMI 8226細胞與PBMC細胞以3x104個細胞/100μL/孔的濃度接種于96孔板中。過夜培養后,將一系列等比/差濃度的化合物6加入相應96孔板的孔中,并繼續培養。細胞活力以CellTiterAQueous Non-Radioactive Cell ProliferationAssay來進行檢測,即44小時后加入MTS(3-(4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium,inner salt),并在4小時后檢測490nm波長處的光吸收。RPMI 8226細胞以四次結果的平均值和標準差做圖并確定IC50。
實驗結果:化合物6a,6e-i,6m,6o和6s對RPMI8226細胞的抑制活性IC50值低于10μM(表1),代表性化合物6a對PBMC細胞沒有明顯的抑制作用(圖1)。
表1.細胞生存率試驗結果
實施例3:Annexin V染色法檢測細胞凋亡
實驗方法:化合物6a處理RPMI 8226細胞(5x105/mL)24小時。室溫下,細胞在300μLAnnexin V binding buffer(Biovision,Mountain View,CA)中,用0.5μL FITC標記的Annexin V(Biovision,MountainView,CA)染色。使用細胞流試儀CytomicsFC500和軟件CXP(Beckman Coulter,Miami,FL)檢查分析細胞凋亡。
實驗結果:代表性化合物6a能夠有效誘導RPMI8226細胞凋亡,并存在良好的劑效關系(圖2)。
實施例4:Western Blot分析
實驗方法:RPMI 8226細胞用化合物6a處理24小時后,用Allegra X22R離心機(Beckman Coulter,Fullerton,CA)以1000rpm離心5min收集。細胞用冰冷的PBS洗滌后,用含有0.5mM釩酸鈉(Sigma,St.Louis,MO)和protease inhibitors cocktail set III(Calbiochem,San Diego,CA)的RIPA buffer(Pierce,Rockford,IL)裂解10分鐘。然后樣品用Eppendorf5415R離心機在4℃以13200rpm離心5分鐘。用protein assay dye(Bio-Rad,Hercules,CA)測定細胞裂解物上清中的蛋白濃度。裂解蛋白上樣至預制的4%-20%Acrylamide/Bis gel(Invitrogen,Carlsbad,CA)進行電泳。然后電轉分離的蛋白到硝酸纖維素膜。在含有0.05%Tween-20和5%脫脂奶粉的PBS中封閉后加入抗體檢測相應蛋白。使用的抗體包括:anti-acetyl-Histone H4(Lysine 12),購買于Upstate Biotechnology(Lake Placid,NY);anti-β-actin-HRP,購買于Sigma(St.Louis,MO);anti-rabbit Ig-HRP購買于Jackson ImmunoResearch Laboratories(West Grove,PA)。對于再次印跡,印有蛋白的硝酸纖維素膜用Restore Western Blot Stripping Buffer(Pierce,Rockford,IL)在室溫下孵育15分鐘,用PBS-Tween-20洗膜后,再加其它抗體孵育。
實驗結果:代表性化合物6a能夠有效調控HDAC信號轉導通路使細胞中乙酰化組蛋白含量明顯增加(圖3)。
- 還沒有人留言評論。精彩留言會獲得點贊!