一種以細菌纖維素為載體的固定化酶及其制備方法與流程
本發明涉及固定化酶技術領域,具體涉及一種以細菌纖維素為載體的固定化酶及其制備方法。
背景技術:
固定化酶(immobilized enzyme)是通過物理的或化學的方法,將酶束縛于水不溶性載體上或一定的空間內,從而達到限制酶分子的自由流動,但能使酶充分發揮催化作用的技術,反應結束后并能使酶與底物、產物分開,酶能夠重復使用。固定化酶的制備方法可分為以下幾種:吸附、共價結合、包埋和交聯。共價結合方式是將酶與載體通過共價鍵連接起來。為了達到有效的共價連接,必須先活化載體或酶上的有關官能團。與其它非共價、吸附作用的固定化方法相比,共價結合能給酶與載體之間提供最強的結合力,酶與載體的連接很牢,使用過程中酶漏出量最少,穩定性良好。
然而綜合現有共價結合固定化酶的技術,發現這些方法存在以下弊端:(1)、載體的活化及固定化操作復雜,過程繁瑣;(2)、載體的活化及固定化反應條件較劇烈,極易影響載體和酶的活性;(3)、載體的形狀和尺寸過于單一,不利于制備形狀和尺寸多樣性的固定化酶。
技術實現要素:
為解決上述問題,本發明提供了一種以細菌纖維素為載體的固定化酶及其制備方法。本發明固定化酶的制備方法工藝簡單,反應條件溫和,制得的固定化酶采用形狀和尺寸可控的細菌纖維素作為載體,有利于獲得形狀與尺寸多樣化的固定化酶。
本發明第一方面提供了一種以細菌纖維素為載體的固定化酶,包括細菌纖維素和酶,所述細菌纖維素和所述酶通過C-N鍵進行共價結合。
優選地,所述細菌纖維素為細菌纖維素膜、細菌纖維素球或細菌纖維素棒。
優選地,所述細菌纖維素球的直徑為1μm-0.5cm。
優選地,所述細菌纖維素膜的邊長為1μm-3cm,厚度為1μm-3cm。
優選地,所述細菌纖維素棒的長度為1μm-3cm,所述細菌纖維素棒的截面為圓形,直徑為1μm-0.5cm。
所述酶為含有氨基基團的酶。優選地,所述酶為淀粉酶、脂肪酶、纖維素酶、果膠酶、乳糖酶或蛋白酶。
本發明第一方面提供的一種以細菌纖維素為載體的固定化酶,細菌纖維素的尺寸和形狀可控,有利于獲得形狀與尺寸多樣化的固定化酶。
本發明第二方面提供了一種以細菌纖維素為載體的固定化酶的制備方法,包括以下步驟:
(1)提供細菌纖維素,將所述細菌纖維素置于氧化劑溶液中,室溫下避光攪拌8-12小時,所述細菌纖維素結構中的鄰二羥基被氧化成醛基,洗滌后,得到活化后的細菌纖維素;所述氧化劑選自高碘酸鈉、偏高碘酸鉀、偏高碘酸鈉和四醋酸鉛中的至少一種;所述氧化劑和所述細菌纖維素的質量比為10:1-135:1;
(2)將所述活化后的細菌纖維素置于酶溶液中,室溫下避光攪拌2-6小時,所述活化后的細菌纖維素和所述酶的質量比為0.72:1-4.28:1;然后加入還原劑氰基硼氫化鈉,室溫下繼續避光攪拌8-40小時,洗滌后,真空干燥,得到以細菌纖維素為載體的固定化酶,所述還原劑與所述酶的質量比為1:1-6.5:1,所述以細菌纖維素為載體的固定化酶包括細菌纖維素和酶,所述細菌纖維素和所述酶通過C-N鍵進行共價結合。
優選地,所述細菌纖維素為細菌纖維素膜、細菌纖維素球或細菌纖維素棒。
優選地,所述細菌纖維素球的直徑為1μm-0.5cm。
優選地,所述細菌纖維素膜的邊長為1μm-3cm,厚度為1μm-3cm。
優選地,所述細菌纖維素棒的長度為1μm-3cm,所述細菌纖維素棒的截面為 圓形,直徑為1μm-0.5cm。
所述酶為含有氨基基團的酶。優選地,所述酶為淀粉酶、脂肪酶、纖維素酶、果膠酶、乳糖酶或蛋白酶。
優選地,所述酶溶液中的溶劑為蒸餾水或磷酸鹽緩沖液。
優選地,所述氧化劑溶液中的溶劑為去離子水。
本發明第二方面提供的一種以細菌纖維素為載體的固定化酶的制備方法,活化和固定化條件溫和,工藝簡單,所制得的以細菌纖維素為載體的固定化酶形狀和尺寸可控,固定化酶的形狀和尺寸可靈活設計。
綜上,本發明有益效果包括以下幾個方面:
1、本發明提供的以細菌纖維素為載體的固定化酶在制備過程中,活化和固定化反應條件溫和、操作簡單,降低了活化和固定化過程中對載體和酶活力的損失,十分適用于固定化酶的工業化生產;
2、本發明以細菌纖維素作為載體,其形狀和尺寸具有可被靈活設計的特點,有利于獲得形狀與尺寸可控性良好的固定化酶。
附圖說明
圖1為本發明實施例中不同尺寸的細菌纖維素球的照片;
圖2為本發明實施例以細菌纖維素為載體的固定化酶的制備流程圖;
圖3為本發明實施例細菌纖維素的活化反應以及活化后的細菌纖維素和酶固定反應的示意圖;
圖4為本發明實施例1的以細菌纖維素為載體的固定化脂肪酶的顯色反應圖。
具體實施方式
以下所述是本發明的優選實施方式,應當指出,對于本技術領域的普通技術人員來說,在不脫離本發明原理的前提下,還可以做出若干改進和潤飾,這些改進和潤飾也視為本發明的保護范圍。
本發明第一方面提供了一種以細菌纖維素為載體的固定化酶,包括細菌纖維素和酶,細菌纖維素和酶通過C-N鍵進行共價結合。
通過合適工藝獲得不同形態、尺寸及微觀結構的細菌纖維素作為載體,細菌纖維素的來源不限。
優選地,細菌纖維素為細菌纖維素膜、細菌纖維素球或細菌纖維素棒。
優選地,細菌纖維素球的直徑為1μm-0.5cm。
優選地,細菌纖維素膜的邊長為1μm-3cm,厚度為1μm-3cm。
優選地,細菌纖維素棒的長度為1μm-3cm,所述細菌纖維素棒的截面為圓形,直徑為1μm-0.5cm。
要獲得理想的固定化酶,載體的作用十分關鍵。細菌纖維素是指在不同條件下,由醋酸均屬(Acetobacter)、土壤桿菌屬(Agrobacterium)、根瘤菌屬(Rhizobium)和八疊球菌屬(Sarcina)等中的某種微生物合成的纖維素的統稱。細菌纖維素與植物或海藻生產的天然纖維素具有相同的分子結構單元,但有許多不同于天然纖維素的結構特質:(1)、超精細的網狀結構,細菌纖維素是由直徑3~4納米的微纖組合成40~60納米粗的纖維束,并相互交織形成發達的超精細網絡結構;(2)、細菌纖維素有很強的持水能力(water retention values,WRV),未經干燥的細菌纖維素的WRV值高達1000%以上,冷凍干燥后的持水能力仍超過600%。(3)、細菌纖維素生物的合成具有可調控性,改變不同的生物碳源,可控制微纖維的納米尺寸。運用不同的模型,可形成各種形狀的功能材料。本發明以細菌纖維素作為固定化酶的載體,原料方便易得,形狀和尺寸可控,可以得到形狀和尺寸可控性良好的固定化酶,對于固定化酶的工業化生產和靈活應用十分有利。
酶為含有氨基基團的酶。優選地,酶為淀粉酶、脂肪酶、纖維素酶、果膠酶、乳糖酶或蛋白酶。
細菌纖維素與酶通過穩定的C-N鍵進行共價結合,這一結合方式對得到穩定性好的固定化酶十分有利,便于酶的回收和再利用。
本發明第一方面提供的以細菌纖維素為載體的固定化酶,細菌纖維素的形狀與尺寸可控,采用形狀與尺寸可控的細菌纖維素為固定化酶的載體,有利于獲得 形狀與尺寸多樣化的固定化酶,對于固定化酶的工業化生產和靈活應用十分有利。
本發明第二方面提供了一種以細菌纖維素為載體的固定化酶的制備方法,包括以下步驟:
(1)提供細菌纖維素,將細菌纖維素置于氧化劑溶液中,室溫下避光攪拌8-12小時,細菌纖維素結構中的鄰二羥基被氧化成醛基,洗滌后,得到活化后的細菌纖維素;氧化劑選自高碘酸鈉、偏高碘酸鉀、偏高碘酸鈉和四醋酸鉛中的至少一種;氧化劑和細菌纖維素的質量比為10:1-135:1;
(2)將活化后的細菌纖維素置于酶溶液中,室溫下避光攪拌2-6小時,活化后的細菌纖維素和酶的質量比為0.72:1-4.28:1;然后加入還原劑氰基硼氫化鈉,室溫下繼續避光攪拌8-40小時,洗滌后,真空干燥,得到以細菌纖維素為載體的固定化酶,還原劑和酶的質量比為1:1-6.5:1,以細菌纖維素為載體的固定化酶包括細菌纖維素和酶,細菌纖維素和酶通過C-N鍵進行共價結合。
細菌纖維素的來源不限,可按照現有的制備方法制得。
通過合適工藝獲得不同形態、尺寸及微觀結構的細菌纖維素作為載體,細菌纖維素的來源不限。
優選地,細菌纖維素為細菌纖維素膜、細菌纖維素球或細菌纖維素棒。
優選地,細菌纖維素球的直徑為1μm-0.5cm。
優選地,細菌纖維素膜的邊長為1μm-3cm,厚度為1μm-3cm。
優選地,細菌纖維素棒的長度為1μm-3cm,所述細菌纖維素棒的截面為圓形,直徑為1μm-0.5cm。
優選地,氧化劑溶液中的溶劑為去離子水。
優選地,氧化劑溶液的濃度為0.1-1.1mol/L。
酶為含有氨基基團的酶。優選地,酶為淀粉酶、脂肪酶、纖維素酶、果膠酶、乳糖酶或蛋白酶。
優選地,酶溶液中的溶劑為蒸餾水或磷酸鹽緩沖液。
優選地,酶溶液的濃度為1-30mg/ml。
步驟(1)中所述細菌纖維素結構中的鄰二羥基為細菌纖維素結構中D-吡喃葡萄糖單元中相鄰的兩個羥基,經過氧化劑的氧化反應,細菌纖維素結構中D-吡喃葡萄糖單元中相鄰的兩個羥基被氧化成兩個醛基。
優選地,步驟(2)中活化后的細菌纖維素和酶發生反應生成席夫堿,然后加入還原劑,席夫堿被還原,得到以細菌纖維素為載體的固定化酶。
優選地,步驟(2)中加入所述還原劑氰基硼氫化鈉后,室溫下繼續避光攪拌8-15小時。
優選地,步驟(1)洗滌方法為:將細菌纖維素先采用乙二醇溶液洗滌,然后采用雙蒸水洗滌,得到活化后的細菌纖維素。
優選地,步驟(2)洗滌方法為:使用蒸餾水洗滌2到3次。
優選地,將以細菌纖維素為載體的固定化酶進行冷凍干燥。
采用氧化劑在室溫下將富含羥基的細菌纖維素進行活化,使細菌纖維素結構中的鄰二羥基被氧化成醛基,得到活化后的細菌纖維素,然后將活化后的細菌纖維素和酶反應,以酶活性蛋白中賴氨酸殘基上的氨基作為活性位點,與活化后富含醛基的細菌纖維素載體在室溫下先形成席夫堿(Schiff base),進一步在極其溫和的條件下進行還原,席夫堿亞胺基團中的C=N鍵被還原成C-N鍵,使細菌纖維素和酶通過C-N鍵進行共價結合,結合方式穩定,有利于得到穩定性高的固定化酶。
本發明第二方面提供的一種以細菌纖維素為載體的固定化酶的制備方法,活化和固定化條件溫和,工藝簡單,所制得的以細菌纖維素為載體的固定化酶形狀和尺寸可控,可靈活設計。
本發明旨在提供一種采用形狀與尺寸可控的細菌纖維素作為載體的新型固定化酶及其制備方法,首先,通過合適工藝獲得不同形態、尺寸及微觀結構的細菌纖維素作為載體,然后,室溫下采用十分溫和的氧化劑一步得到活化的載體,進一步在室溫下采用活化的載體與活性酶蛋白進行處理,使其互相進行共價結合,制得一種以形狀與尺寸可控的細菌纖維素為載體的固定化酶。所制得的以形狀與尺寸可控的細菌纖維素為載體的固定化酶具有載體形狀多樣化,酶活收率 高、穩定性好的優點,所采用的制備方法具有載體活化及固定化操作簡單,反應條件溫和的優點。所制得的固定化酶因載體形狀與尺寸可控性良好,對于固定化酶的工業化生產和使用十分有利。
圖1為本發明實施例中不同尺寸的細菌纖維素球的照片;從圖1中可以看出,可以根據不同的需要,制備出不同尺寸的細菌纖維素球。從左到右,瓶中細菌纖維素球的尺寸依次為0.5mm、1mm、2mm和3mm。
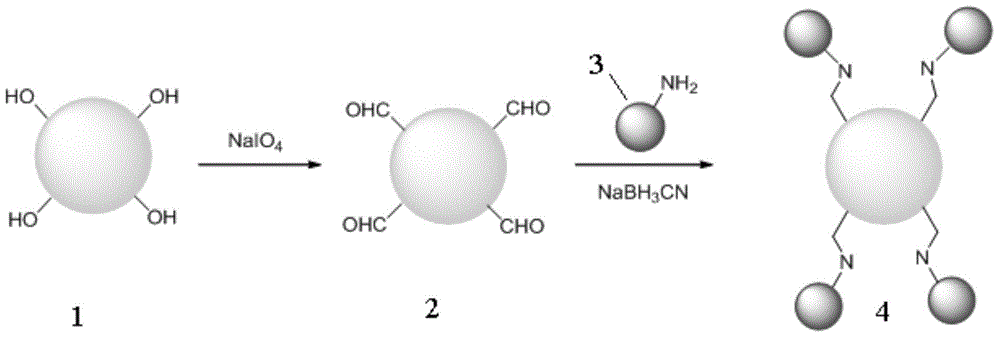
圖2為本發明實施例以細菌纖維素為載體的固定化酶的制備流程圖;細菌纖維素1被氧化劑(如高碘酸鈉,NaIO4)氧化后,細菌纖維素中的鄰二羥基被氧化成醛基,得到活化后的細菌纖維素2,將活化后的細菌纖維素2和酶3混合,并在還原劑的作用下,得到以細菌纖維素為載體的固定化酶4,細菌纖維素和酶通過C-N鍵進行共價結合。
圖3為細菌纖維素的活化反應以及活化后的細菌纖維素和酶反應的示意圖。從圖3中可以看出,通過調整氧化劑(如高碘酸鈉,NaIO4)與細菌纖維素載體的質量比,可得到不同活化程度的細菌纖維素載體,例如圖3中的(a)、(b)為不同活化程度的細菌纖維素;不同活化程度的纖維素載體用于制備固定化酶時,調整酶(用R-NH2表示)和活化后的細菌纖維素載體的質量比,可以進一步控制載體上酶的負載量,從而控制固定化酶催化活性大小,如圖3中的(c)、(d)、(e)、(f)、(g)、(h)和(i))為具有不同酶負載量的細菌纖維素載體。本發明以細菌纖維素為載體的固定化酶活性在一定程度上具有可控性。
實施例1:
一種以細菌纖維素為載體的固定化酶的制備方法,包括以下步驟:
(1)取10.6950g(濕重,含水量為99.2%)直徑為1.0cm的細菌纖維素球,加入到50ml 0.1mol/L的高碘酸鈉溶液中,室溫下避光攪拌8小時,細菌纖維素結 構中的鄰二羥基被氧化成醛基,反應后分別用0.2mol/L的乙二醇溶液和雙蒸水先后洗滌,獲得活化后的細菌纖維素;
(2)取10ml 2mg/ml的脂肪酶溶液,加入上述活化后的細菌纖維素,室溫下避光充分攪拌2小時,然后加入0.1258g氰基硼氫化鈉,室溫下繼續避光攪拌8小時,蒸餾水充分洗滌,凍干,得以細菌纖維素為載體的固定化脂肪酶0.9056g。細菌纖維素和酶通過C-N鍵進行共價結合。
取0.02g上述以細菌纖維素為載體的固定化脂肪酶與0.02g細菌纖維素分別加入到0.2%的茚三酮溶液中,沸水浴中加熱片刻,圖4為本發明實施例1的以細菌纖維素為載體的固定化脂肪酶的顯色反應圖。從圖4a左圖中可以看出,經去離子水充分透析、洗滌后的以細菌纖維素為載體的固定化脂肪酶使茚三酮溶液變藍;圖4a右圖中細菌纖維素沒有使茚三酮溶液變藍;同時,取0.02g經去離子水充分透析、洗滌后的以細菌纖維素為載體的固定化脂肪酶與0.02g細菌纖維素加入到濃硝酸溶液中,沸水浴中加熱片刻,從圖4b左圖中可以看出,硝酸溶液使以細菌纖維素為載體的固定化脂肪酶變黃。圖4b右圖中細菌纖維素沒有變色。說明本實施例通過上述制備方法獲得具有一定酶負載量的以細菌纖維素為載體的固定化酶。
測試上述制得的以細菌纖維素為載體的固定化脂肪酶的活力:以4ml橄欖油乳化液為底物,加5ml,0.25M,pH=7.5的PBS緩沖液,在40℃下保溫5分鐘,加入0.02g上述以細菌纖維素為載體的固定化脂肪酶,精確計時保溫30min,最后加15ml,95%乙醇,終止酶反應。加3滴酚酞用0.05mol/LNaOH滴定產生的酸,消耗氫氧化鈉溶液4.9ml,我們定義在40℃,pH=7.5,每分鐘水解釋放出1μmol游離有機酸所需的脂肪酶的量為一個活力單位,活力計算方法如下:固定化酶的活力:U(u/mg)=V(氫氧化鈉溶液體積)×N(氫氧化鈉溶液濃度)×103/t(反應時間)=9.8×10-6。由此可知,本發明實施例1制得的固定化酶具有較高的酶活力。
實施例2:
一種以細菌纖維素為載體的固定化酶的制備方法,包括以下步驟:
(1)取10.3711g(濕重,含水量為99.2%)邊長為2.5cm×2.5cm、厚度為0.2mm的細菌纖維素膜,加入到50ml 0.3mol/L的高碘酸鈉溶液中,室溫下避光攪拌12小時,細菌纖維素結構中的鄰二羥基被氧化成醛基,反應后分別用0.2mol/L的乙二醇溶液和雙蒸水先后洗滌,獲得活化后的細菌纖維素。
(2)取10ml 4mg/ml的脂肪酶溶液,加入上述活化后的細菌纖維素,室溫下避光充分攪拌6小時,加入0.1258g氰基硼氫化鈉,室溫下繼續避光攪拌10小時,蒸餾水充分洗滌,凍干,得到以細菌纖維素為載體的固定化脂肪酶0.8936g。細菌纖維素和酶通過C-N鍵進行共價結合。
取0.02g上述以細菌纖維素為載體的固定化脂肪酶與0.02g細菌纖維素分別加入到0.2%的茚三酮溶液中,沸水浴中加熱片刻,以細菌纖維素為載體的固定化脂肪酶使茚三酮溶液變藍;細菌纖維素沒有使茚三酮溶液變藍;同時,取0.02g以細菌纖維素為載體的固定化脂肪酶與0.02g細菌纖維素加入到濃硝酸溶液中,沸水浴中加熱片刻,硝酸溶液使以細菌纖維素為載體的固定化脂肪酶變黃。細菌纖維素沒有變色。說明本實施例通過上述制備方法獲得具有一定酶負載量的以細菌纖維素為載體的固定化酶。
測試上述制得的以細菌纖維素為載體的固定化脂肪酶的活力:以4ml橄欖油乳化液為底物,加5ml,0.25M,pH=7.5的PBS緩沖液,在40℃下保溫5分鐘,然后加入0.02g上述以細菌纖維素為載體的固定化脂肪酶,精確計時保溫30min,最后加15ml,95%乙醇,終止酶反應。加3滴酚酞用0.05mol/L NaOH滴定產生的酸,消耗氫氧化鈉1.4ml,我們定義在40℃,pH=7.5,每分鐘水解釋放出1μmol游離有機酸所需的脂肪酶的量為一個活力單位,活力計算方法如下:固定化酶的活力:U(u/mg)=V(氫氧化鈉溶液體積)×N(氫氧化鈉溶液濃度)×103/t(反應時間)=2.3×10-6。由此可知,本發明實施例2制得的固定化酶具有較高的酶活力。
實施例3:
一種以細菌纖維素為載體的固定化酶的制備方法,包括以下步驟:
(1)取10.2349g(濕重,含水量為99.2%)邊長為3.0cm×3.0cm、厚度為0.2mm的細菌纖維素膜,加入到50ml 0.5mol/L的高碘酸鈉溶液中,室溫下避光攪拌10小時,細菌纖維素結構中的鄰二羥基被氧化成醛基,反應后分別用0.2mol/L的乙二醇溶液和雙蒸水先后洗滌,獲得活化后的細菌纖維素。
(2)取10ml 6mg/ml的脂肪酶溶液,加入上述活化后的細菌纖維素,室溫下避光充分攪拌4小時,加入0.1258g氰基硼氫化鈉,室溫下繼續避光攪拌12小時,蒸餾水充分洗滌,凍干,得到以細菌纖維素為載體的固定化脂肪酶0.8973g。細菌纖維素和酶通過C-N鍵進行共價結合。
取0.02g上述以細菌纖維素為載體的固定化脂肪酶與0.02g細菌纖維素分別加入到0.2%的茚三酮溶液中,沸水浴中加熱片刻,以細菌纖維素為載體的固定化脂肪酶使茚三酮溶液變藍;細菌纖維素沒有使茚三酮溶液變藍;同時,取0.02g以細菌纖維素為載體的固定化脂肪酶與0.02g細菌纖維素加入到濃硝酸溶液中,沸水浴中加熱片刻,硝酸溶液使以細菌纖維素為載體的固定化脂肪酶變黃。細菌纖維素沒有變色。說明本實施例通過上述制備方法獲得具有一定酶負載量的以細菌纖維素為載體的固定化酶。
測試上述制得的以細菌纖維素為載體的固定化脂肪酶的活力:以4ml橄欖油乳化液為底物,加5ml,0.25M,pH=7.5的PBS緩沖液,在40℃下保溫5分鐘,然加入0.02g上述纖維素固定化的脂肪酶,精確計時保溫30min,最后加15ml,95%乙醇,終止酶反應。加3滴酚酞用0.05mol/L NaOH滴定產生的酸,消耗氫氧化鈉0.7ml,我們定義在40℃,pH=7.5,每分鐘水解釋放出1μmol游離有機酸所需的脂肪酶的量為一個活力單位,活力計算方法如下:固定化酶的活力:U(u/mg)=V(氫氧化鈉溶液體積)×N(氫氧化鈉溶液濃度)×103/t(反應時間)=1.2×10-6。由此可知,本發明實施例3制得的固定化酶具有較高的酶活力。
實施例4:
一種以細菌纖維素為載體的固定化酶的制備方法,包括以下步驟:
(1)取10.3902g(濕重,含水量為99.2%)直徑為0.2cm的細菌纖維素球, 加入到50ml 0.7mol/L的高碘酸鈉溶液中,室溫下避光攪拌8小時,細菌纖維素結構中的鄰二羥基被氧化成醛基,反應后分別用0.2mol/L的乙二醇溶液和雙蒸水先后洗滌,獲得活化后的細菌纖維素。
(2)取10ml 8mg/ml的1,4-α-D-葡聚糖水解酶溶液,加入上述活化后的細菌纖維素,室溫下避光充分攪拌2小時,加入0.1258g氰基硼氫化鈉,室溫下繼續避光攪拌40小時,蒸餾水充分洗滌,凍干,得到以細菌纖維素為載體的固定化的1,4-α-D-葡聚糖水解酶0.9012g。細菌纖維素和酶通過C-N鍵進行共價結合。
取0.02g上述以細菌纖維素為載體的固定化1,4-α-D-葡聚糖水解酶與0.02g細菌纖維素分別加入到0.2%的茚三酮溶液中,沸水浴中加熱片刻,以細菌纖維素為載體的固定化1,4-α-D-葡聚糖水解酶使茚三酮溶液變藍;細菌纖維素沒有使茚三酮溶液變藍;同時,取0.02g以細菌纖維素為載體的固定化1,4-α-D-葡聚糖水解酶與0.02g細菌纖維素加入到濃硝酸溶液中,沸水浴中加熱片刻,硝酸溶液使以細菌纖維素為載體的固定化1,4-α-D-葡聚糖水解酶變黃。細菌纖維素沒有變色。說明本實施例通過上述制備方法獲得具有一定酶負載量的以細菌纖維素為載體的固定化酶。
測試上述制得的以細菌纖維素為載體的固定化1,4-α-D-葡聚糖水解酶的活力:將上述細菌纖維素固定化的1,4-α-D-葡聚糖水解酶加到蒸餾水中配制成濃度為2mg/ml的細菌纖維素固定化的1,4-α-D-葡聚糖水解酶溶液,取1ml 2mg/ml的細菌纖維素固定化的1,4-α-D-葡聚糖水解酶溶液,加入到50ml錐形瓶中,加入2ml10mg/ml的3,5-二硝基水楊酸,同時,另取1ml 10mg/ml的淀粉溶液于10ml錐形瓶中,將上述兩個錐形瓶分別置40℃恒溫水浴中保溫10min,然后將上述兩個錐形瓶中的淀粉溶液和1,4-α-D葡聚糖水解酶溶液混合后置40℃下準確保溫5min后,取少量溶液,測定淀粉在1,4-α-D-葡聚糖水解酶催化下降解產生的麥芽糖含量C為2.83mg。我們定義在40℃,pH=5.6下,每分鐘釋放出的麥芽糖含量占淀粉總質量的百分數為一個活力單位,活力計算方法如下:U=(/min)=C(麥芽糖質量)/w(淀粉質量)t(反應時間)=5.6%/min。由此可知,本發明實施例4制得的固定化酶具有較高的酶活力。
實施例5:
一種以細菌纖維素為載體的固定化酶的制備方法,包括以下步驟:
(1)取10.9382g(濕重,含水量為99.2%)直徑為0.3cm的細菌纖維素球,加入到50ml 0.9mol/L的高碘酸鈉溶液中,室溫下避光攪拌8小時,細菌纖維素結構中的鄰二羥基被氧化成醛基,反應后分別用0.2mol/L的乙二醇溶液和雙蒸水先后洗滌,獲得活化后的細菌纖維素。
(2)取10ml 10mg/ml的1,4-α-D葡聚糖水解酶溶液,加入上述活化后的細菌纖維素,室溫下避光充分攪拌2小時,加入0.1258g氰基硼氫化鈉,室溫下繼續避光攪拌8小時,蒸餾水洗滌3次,凍干,得到以細菌纖維素為載體的固定化的1,4-α-D-葡聚糖水解酶0.9321g。細菌纖維素和酶通過C-N鍵進行共價結合。
取0.02g上述以細菌纖維素為載體的固定化1,4-α-D-葡聚糖水解酶與0.02g細菌纖維素分別加入到0.2%的茚三酮溶液中,沸水浴中加熱片刻,以細菌纖維素為載體的固定化1,4-α-D-葡聚糖水解酶使茚三酮溶液變藍;細菌纖維素沒有使茚三酮溶液變藍;同時,取0.02g以細菌纖維素為載體的固定化1,4-α-D-葡聚糖水解酶與0.02g細菌纖維素加入到濃硝酸溶液中,沸水浴中加熱片刻,硝酸溶液使以細菌纖維素為載體的固定化1,4-α-D-葡聚糖水解酶變黃。細菌纖維素沒有變色。說明本實施例通過上述制備方法獲得具有一定酶負載量的以細菌纖維素為載體的固定化酶。
測試上述制得的以細菌纖維素為載體的固定化1,4-α-D-葡聚糖水解酶的活力:將上述細菌纖維素固定化的1,4-α-D-葡聚糖水解酶加到蒸餾水中配制成濃度為2mg/ml的細菌纖維素固定化的1,4-α-D-葡聚糖水解酶溶液,取1ml 2mg/ml細菌纖維素固定化的1,4-α-D-葡聚糖水解酶溶液,加入到50ml錐形瓶中,加入2ml10mg/ml的3,5-二硝基水楊酸,同時,另取1ml 10mg/ml的淀粉溶液于10ml錐形瓶中,將上述兩個錐形瓶分別置40℃恒溫水浴中保溫10min,然后將上述兩個錐形瓶中的淀粉溶液和1,4-α-D葡聚糖水解酶溶液混合后置40℃下準確保溫5min后,取少量溶液,測定淀粉在1,4-α-D-葡聚糖水解酶催化下降解產生的麥芽糖含量C為 2.95mg。我們定義在40℃,pH=5.6下,每分鐘釋放出的麥芽糖含量占淀粉總質量的百分數為一個活力單位,活力計算方法如下:U=(/min)=C/wt=5.6%/min。由此可知,本發明實施例5制得的固定化酶具有較高的酶活力。
實施例6:
一種以細菌纖維素為載體的固定化酶的制備方法,包括以下步驟:
(1)取10.8361g(濕重,含水量為99.2%)細菌纖維素棒,細菌纖維素棒的長度為3cm,橫截面為圓形,直徑為0.5cm,加入到50ml 1.1mol/L的高碘酸鈉溶液中,室溫下避光攪拌8小時,細菌纖維素結構中的鄰二羥基被氧化成醛基,反應后分別用0.2mol/L的乙二醇溶液和雙蒸水先后洗滌,獲得活化后的細菌纖維素。
(2)取10ml 12mg/ml的脂肪酶溶液,加入上述活化后的細菌纖維素,室溫下避光充分攪拌2小時,加入0.1258g氰基硼氫化鈉,室溫下繼續避光攪拌15小時,蒸餾水洗滌2到3次,凍干,得到以細菌纖維素為載體的固定化的1,4-α-D-葡聚糖水解酶0.9348g。細菌纖維素和酶通過C-N鍵進行共價結合。
取0.02g上述以細菌纖維素為載體的固定化1,4-α-D-葡聚糖水解酶與0.02g細菌纖維素分別加入到0.2%的茚三酮溶液中,沸水浴中加熱片刻,以細菌纖維素為載體的固定化1,4-α-D-葡聚糖水解酶使茚三酮溶液變藍;細菌纖維素沒有使茚三酮溶液變藍;同時,取0.02g以細菌纖維素為載體的固定化1,4-α-D-葡聚糖水解酶與0.02g細菌纖維素加入到濃硝酸溶液中,沸水浴中加熱片刻,硝酸溶液使以細菌纖維素為載體的固定化1,4-α-D-葡聚糖水解酶變黃。細菌纖維素沒有變色。說明本實施例通過上述制備方法獲得具有一定酶負載量的以細菌纖維素為載體的固定化酶。
測試上述制得的以細菌纖維素為載體的固定化1,4-α-D-葡聚糖水解酶的活力:將上述細菌纖維素固定化的1,4-α-D-葡聚糖水解酶加到蒸餾水中配制成濃度為2mg/ml的細菌纖維素固定化的1,4-α-D-葡聚糖水解酶溶液,取1ml 2mg/ml細菌纖維素固定化的1,4-α-D-葡聚糖水解酶溶液,加入到50ml錐形瓶中,加入2ml10mg/ml的3,5-二硝基水楊酸,同時,另取1ml 10mg/ml的淀粉溶液于10ml錐形瓶 中,將上述兩個錐形瓶分別置40℃恒溫水浴中保溫10min,然后將上述兩個錐形瓶中的淀粉溶液和1,4-α-D葡聚糖水解酶溶液混合后置40℃下準確保溫5min后,取少量溶液,測定淀粉在1,4-α-D-葡聚糖水解酶催化下降解產生的麥芽糖含量C2.99mg。我們定義在40℃,pH=5.6下,每分鐘釋放出的麥芽糖含量占淀粉總質量的百分數為一個活力單位,活力計算方法如下:U=(/min)=C/wt=5.6%/min。由此可知,本發明實施例6制得的固定化酶具有較高的酶活力。
以上所述實施例僅表達了本發明的幾種實施方式,其描述較為具體和詳細,但并不能因此而理解為對本發明專利范圍的限制。應當指出的是,對于本領域的普通技術人員來說,在不脫離本發明構思的前提下,還可以做出若干變形和改進,這些都屬于本發明的保護范圍。因此,本發明專利的保護范圍應以所附權利要求為準。
- 還沒有人留言評論。精彩留言會獲得點贊!