一種改善絲狀真菌蛋白分泌能力的方法與流程
本發明屬于基因工程領域,一種生產纖維素酶,提升木質纖維素降解能力和/或提高蛋白分泌能力的方法,所涉及絲狀真菌蛋白分泌相關蛋白基因包括:NCU01928, NCU01856、NCU03998, NCU06569, NCU03459,NCU05836和 NCU07516。
背景技術:
隨著化石能源的日益耗竭和環境形勢的日益嚴峻,清潔可再生的新型能源越來越受到人們的重視,比如核能,生物能源等。其中生物能源的主要原料為秸稈等木質纖維素類物質,具有來源廣泛,成本低廉,環境友好,不額外造成碳排放等優勢,因此受到國際社會廣泛的關注。然而,生物質原料需先轉化為單糖等易利用物質,才能進一步轉化為生物乙醇等生物燃料,整個過程中生物質原料的轉化尤其是木質纖維素的轉化一直是制約生物能源產業的重要瓶頸,構成了生物燃料生產的主要成本,而利用絲狀真菌生產纖維素酶降解木質纖維素被認為是經濟,環保的生物質原料轉化策略,因此研發高產纖維素酶絲狀真菌菌株一直受到各國政府,企業,科研機構的廣泛關注。
絲狀真菌纖維素酶合成分泌涉及轉錄調控,翻譯,折疊修飾,轉運,分泌出細胞膜等多個系統,幾乎涉及已知的細胞內所有代謝和調控途徑,是一個非常復雜的過程。例如在轉錄調控階段, 敲除CRE1可以解除了碳阻遏效應,極大提高了纖維素酶的表達水平;在轉錄后的調控階段,大量的纖維素酶產生會引發內質網應激反應從而激活非折疊蛋白效應和內質網偶聯的蛋白質降解途徑,提高細胞分泌能力和內質網承載能力。
絲狀真菌高產纖維素酶不僅要在表達水平上提高纖維素酶相關基因的RNA豐度,還需要我們進一步了解纖維素酶在分泌過程中的效應,減輕甚至消除分泌途徑的瓶頸,進一步提高絲狀真菌分泌能力。
技術實現要素:
本發明的主要目的是提供一種提高真菌產纖維素酶生產能力和蛋白分泌能力的菌種改造方法,是通過改造絲狀真菌蛋白分泌相關蛋白基因可改善絲狀真菌纖維素酶產量和蛋白分泌能力。
第一方面,本發明提供一種提高真菌產纖維素酶生產能力和蛋白分泌能力的菌種改造方法,敲除六個蛋白之一可提高纖維素酶產量和木質纖維素降解能力和蛋白分泌能力。
另一方面,本發明提供用于生產纖維素酶的多基因突變菌株,得到的突變菌株與出發菌株相比,獲得更強的纖維素酶分泌能力和木質纖維素降解能力;為以下菌株之一:
a. 命名為ΔucpΔcre1的基因突變菌株,是敲除NCU01928和碳分解代謝物阻遏效應轉錄因子CRE1(NCU08807)的微生物菌株;
b. 命名為ΔucpΔcre1::Pccg1-hac1s的基因突變菌株,是敲除NCU01928和碳分解代謝物阻遏效應轉錄因子CRE1(NCU08807)以及過表達非折疊蛋白效應剪切形式HAC1S(NCU01856)的微生物菌株;
所述微生物為脈孢菌屬、曲霉屬、木霉屬、青霉屬、鐮刀霉屬、毀絲霉屬或側孢霉屬;優選為粗糙脈孢菌和嗜熱毀絲霉。
所述基因的核苷酸序列及其編碼蛋白的氨基酸序列如下:
1)來源于粗糙脈孢菌的NCU01928氨基酸序列如序列表中SEQ ID NO.1所示;
2)來源于粗糙脈孢菌的NCU01928核苷酸序列如序列表中SEQ ID NO.2所示;
3)非折疊蛋白效應剪切形式HAC1S(NCU01856)氨基酸序列如序列表中SEQ ID NO.3所示;
4)非折疊蛋白效應剪切形式HAC1S(NCU01856)核苷酸序列如序列表中SEQ ID NO.4所示;
5)來源于粗糙脈孢菌的NCU03998氨基酸序列如序列表中SEQ ID NO.5所示;
6)來源于粗糙脈孢菌的NCU03998核苷酸序列如序列表中SEQ ID NO.6所示;
7)來源于粗糙脈孢菌的NCU06569氨基酸序列如序列表中SEQ ID NO.7所示;
8)來源于粗糙脈孢菌的NCU06569核苷酸序列如序列表中SEQ ID NO.8所示;
9)來源于粗糙脈孢菌的NCU03459氨基酸序列如序列表中SEQ ID NO.9所示;
10)來源于粗糙脈孢菌的NCU03459核苷酸序列如序列表中SEQ ID NO.10所示;
11)來源于粗糙脈孢菌的NCU05836氨基酸序列如序列表中SEQ ID NO.11所示;
12)來源于粗糙脈孢菌的NCU05836核苷酸序列如序列表中SEQ ID NO.12所示;
13)來源于粗糙脈孢菌的NCU07516氨基酸序列如序列表中SEQ ID NO.13所示;
14)來源于粗糙脈孢菌的NCU07516核苷酸序列如序列表中SEQ ID NO.14所示;
所述一種生產纖維素酶或者提升木質纖維素降解能力或蛋白分泌能力的方法包括以下方法之一:
1)敲除上述微生物菌株中序列SEQ ID NO.1、5、7、9、11、13所述六個蛋白之一的編碼基因;
2)敲除上述微生物菌株中NCU01928(UCP)蛋白的編碼基因和CRE1蛋白的編碼基因;
3)敲除上述微生物菌株中NCU01928(UCP)蛋白的編碼基因和CRE1蛋白的編碼基因并過表達HAC1S的編碼mRNA的反轉錄cDNA。
本發明另一貢獻是通過多基因改造獲得的突變體菌株ΔucpΔcre1和ΔucpΔcre1::Pccg1-hac1s,這兩株突變菌株能夠纖維素為誘導物表達生產纖維素酶,提升木質纖維素降解能力和纖維素酶生產能力,在添加有機氮源酵母提取物的條件下,搖瓶發酵蛋白產量均超過1g/L。
本發明通過對纖維素酶合成分泌中不同階段進行改造有效的提高了菌株纖維素酶生產能力和木質纖維素降解能力,包括提高mRNA轉錄水平,提高內質網承載能力和細胞分泌能力,以及緩解纖維素酶蛋白在胞內被降解。這種不同針對蛋白合成分泌不同階段的改造方法對絲狀真菌高產纖維素酶菌株的改造以及異源蛋白表達系統的構建具有重要的指導意義。
下面結合具體實施例對本發明做進一步詳細說明。
附圖說明
圖1A:ncu01928(ucp)基因敲除的粗糙脈孢菌在2%微晶纖維素生長條件下發酵上清的蛋白分泌和纖維素酶生產
圖1B:ncu01928 (ucp)基因敲除的粗糙脈孢菌在2%微晶纖維素生長條件下發酵上清的SDS-PAGE圖
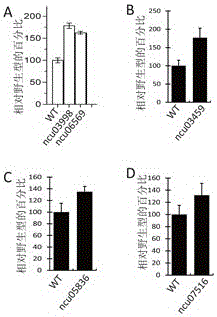
圖2A:ncu03998和ncu06569基因敲除的粗糙脈孢菌在2%微晶纖維素生長條件下發酵上清的蛋白分泌
圖2B:ncu03459基因敲除的粗糙脈孢菌在2%微晶纖維素生長條件下發酵上清的蛋白分泌
圖2C:ncu05836基因敲除的粗糙脈孢菌在2%微晶纖維素生長條件下發酵上清的蛋白分泌
圖2D:ncu07516基因敲除的粗糙脈孢菌在2%微晶纖維素生長條件下發酵上清的蛋白分泌
圖3A:多基因突變體在2%微晶纖維素生長條件下發酵上清的蛋白分泌和纖維素酶生產
圖3B:多基因突變體在2%微晶纖維素生長條件下發酵上清的SDS-PAGE圖
圖4A:多基因突變體在添加酵母提取物的2%微晶纖維素生長條件下發酵上清的蛋白分泌和纖維素酶生產
圖4B:多基因突變體在添加酵母提取物的2%微晶纖維素生長條件下發酵上清的SDS-PAGE圖。
具體實施方式
下述實施例中所用方法如無特別說明均為常規方法,具體步驟可參見:《Molecμlar Cloning: A Laboratory Manual》(Sambrook,J.,Russell, David W.,Molecμlar Cloning: A Laboratory Manual,3rd edition,2001,NY,Cold Spring Harbor)。
所出現的百分比濃度如無特別說明均為質量百分濃度。
實施例中描述到的的各種生物材料的取得途徑僅是提供一種實驗獲取的途徑以達到具體公開的目的,不應成為對本發明生物材料來源的限制。事實上,所用到的生物材料的來源是廣泛的,任何不違反法律和道德倫理能夠獲取的生物材料都可以按照實施例中的提示替換使用。
實施例中所采用的原始出發菌株和部分原始單基因敲除菌株均購買于美國真菌遺傳資源中心(Fungal Genetics Stock Center,縮寫FGSC) 真菌菌種保存庫,為商業渠道獲得。
實施例在以本發明技術方案為前提下進行實施,給出了詳細的實施方式和具體的操作過程,實施例將有助于理解本發明,但是本發明的保護范圍不限于下述的實施例。
實施例1、ucp基因敲除的粗糙脈孢菌Δucp纖維素產酶功能驗證實驗
將ucp基因敲除的粗糙脈孢菌Δucp(NCU01928)和野生型菌株FGSC2489(WT)分別在2%(2g/100mL)微晶纖維素培養基(配方:50× Vogel’s鹽2mL,微晶纖維素2g,定容體積到100mL,高壓滅菌)上25℃光照培養7d,樣品離心取上清液,測定蛋白濃度,跑SDS-PAGE和測定纖維素酶活。
1.1上清蛋白濃度測定
使用伯樂Bradford蛋白快速測試試劑盒檢測上清中的蛋白濃度,結果如圖1A所示。與野生型相比,ucp基因敲除的粗糙脈孢菌Δucp分泌蛋白濃度高于粗糙脈孢菌野生型菌株。
1.2上清SDS-PAGE電泳檢測
根據蛋白濃度吸取等體積上清液進行4-12% SDS-PAGE電泳檢測,結果如圖1B所示。發現ucp基因敲除的粗糙脈孢菌Δucp纖維素酶對應條帶相比野生型明顯加深,說明Δucp分泌更多纖維素酶。
1.3上清纖維素酶酶活檢測
根據蛋白濃度稀釋上清進行外切纖維素酶酶活,內切纖維素酶酶活和葡萄糖苷酶酶活測定,結果如圖1A所示。微晶纖維素生長條件下,Δucp的纖維素酶酶活顯著高于野生型菌株(WT)。
實施例2、ncu03998和ncu06569基因敲除的粗糙脈孢菌在2%微晶纖維素生長條件下蛋白分泌驗證實驗
將ncu03998和ncu06569基因敲除的粗糙脈孢菌和野生型菌株FGSC2489(WT)分別在2%(2g/100mL)微晶纖維素培養基(配方:50× Vogel’s鹽2mL,微晶纖維素2g,定容體積到100mL,高壓滅菌)上25℃光照培養7d,樣品離心取上清液,測定蛋白濃度。
2.1上清蛋白濃度測定
使用伯樂Bradford蛋白快速測試試劑盒檢測上清中的蛋白濃度,結果如圖2A所示。與野生型相比,ncu03998和ncu06569基因敲除的粗糙脈孢菌分泌蛋白濃度都高于粗糙脈孢菌野生型菌株。
實施例3、ncu03459基因敲除的粗糙脈孢菌在2%微晶纖維素生長條件下蛋白分泌驗證實驗
將ncu03459基因敲除的粗糙脈孢菌和野生型菌株FGSC2489(WT)分別在2%(2g/100mL)微晶纖維素培養基(配方:50× Vogel’s鹽2mL,微晶纖維素2g,定容體積到100mL,高壓滅菌)上25℃光照培養7d,樣品離心取上清液,測定蛋白濃度。
3.1上清蛋白濃度測定
使用伯樂Bradford蛋白快速測試試劑盒檢測上清中的蛋白濃度,結果如圖2B所示。與野生型相比,ncu03459基因敲除的粗糙脈孢菌分泌蛋白濃度高于粗糙脈孢菌野生型菌株。
實施例4、ncu05836基因敲除的粗糙脈孢菌在2%微晶纖維素生長條件下蛋白分泌驗證實驗
將ncu05836基因敲除的粗糙脈孢菌和野生型菌株FGSC2489(WT)分別在2%(2g/100mL)微晶纖維素培養基(配方:50× Vogel’s鹽2mL,微晶纖維素2g,定容體積到100mL,高壓滅菌)上25℃光照培養7d,樣品離心取上清液,測定蛋白濃度。
4.1上清蛋白濃度測定
使用伯樂Bradford蛋白快速測試試劑盒檢測上清中的蛋白濃度,結果如圖2C所示。與野生型相比,ncu05836基因敲除的粗糙脈孢菌分泌蛋白濃度高于粗糙脈孢菌野生型菌株。
實施例5、ncu07516基因敲除的粗糙脈孢菌在2%微晶纖維素生長條件下蛋白分泌驗證實驗
將ncu07516基因敲除的粗糙脈孢菌和野生型菌株FGSC2489(WT)分別在2%(2g/100mL)微晶纖維素培養基(配方:50× Vogel’s鹽2mL,微晶纖維素2g,定容體積到100mL,高壓滅菌)上25℃光照培養7d,樣品離心取上清液,測定蛋白濃度。
4.1上清蛋白濃度測定
使用伯樂Bradford蛋白快速測試試劑盒檢測上清中的蛋白濃度,結果如圖2D所示。與野生型相比,ncu07516基因敲除的粗糙脈孢菌分泌蛋白濃度高于粗糙脈孢菌野生型菌株。
實施例6、構建用于生產纖維素酶的多基因突變菌株(ΔucpΔcre1和ΔucpΔcre1::Pccg1-hac1s)
6.1ΔucpΔcre1雙突變體的構建
6.1.1 雜交
1)配型為A的碳分解代謝物阻遏轉錄因子CRE-1(NCU08807)缺失菌株由實驗室利用FGSC 18633 (配型a)同野生型粗糙脈胞菌WT,FGSC 2489(配型A)雜交獲得,CRE-1(NCU08807,配型A)作為父本在MM斜面培養基【50×Vogel’s鹽20mL,蔗糖20g,瓊脂15g,定容體積到1L,高壓滅菌。50×Vogel’s鹽(1L):檸檬酸三鈉(1/2H2O)150g,無水KH2PO4 250g,無水NH4NO3 100g,MgSO4?7H2O 10g,CaCl2?2H2O 5g,微量元素鹽溶液5mL,生物素(0.1mg/mL)2.5mL, 定容體積到1L。】上28℃培養7天后待用。
2)作為母本的UCP單突變體菌株UCP(NCU01928),FGSC 14652 (配型a)在Westergaards平板培養基【4×Westergaards鹽溶液250mL,蔗糖15g,瓊脂15g,調PH值6.5,定容到1L,高壓滅菌,倒平板。4×Westergaards鹽溶液(1L):KNO3 4g,KH2PO44g,MgSO4?7H2O 2g,微量元素鹽溶液4mL,生物素(0.1mg/mL)200μl,定容體積到1L。】上28℃培養10天,在體式顯微鏡下觀察子囊,若有子囊產生,則進行雜交試驗,若未產生子囊則繼續培養,直至看到大量子囊產生為止。
3)取1mL無菌水沖洗在MM斜面培養基上培養的CRE-1(NCU08807)菌株孢子,制成孢子懸液,濃度為1×107,均勻滴到Westergaards平板培養基上,用無菌槍頭均勻涂布,盡量涂成規則形狀,以便觀察是否污染。
3)雜交后的平板28℃培養大約2周后,在體式顯微鏡下觀察培養皿上蓋上是否有子囊孢子,若發現噴發出的子囊孢子,則取1mL無菌水沖洗培養皿上蓋,收集子囊孢子,4℃或常溫保存。
4)取收集的子囊孢子3μl加入30μl無菌水放于60℃水浴熱激半小時,殺死子囊孢子里混合的紅色分生孢子。
5)采用玻璃珠子法涂BDES(雜交篩選培養基)+hph(潮霉素)平板【配方:BDES平板培養基(1L):50×Vogel’s鹽20mL,瓊脂15g,定容到950mL,高壓滅菌,再加50mL 20×BDES鹽溶液,倒平板(潮霉素hph終濃度200ug/mL)】,28℃培養12小時后在顯微鏡下挑單菌落(挑單菌落過程中,挑取發生菌絲交叉的單菌落),轉接到MM+hph斜面培養基【配方:50×Vogel’s鹽20mL,蔗糖20g,瓊脂15g,組氨酸(50mg/mL)20mL,定容體積到1L,高壓滅菌。50X Vogel’s鹽(1L):檸檬酸三鈉(1/2H2O)150g,無水KH2PO4 250g,無水NH4NO3 100g,MgSO4?7H2O 10g,CaCl2?2H2O 5g,微量元素鹽溶液5mL,生物素(0.1mg/mL)2.5mL,定容體積到1L。】中28℃培養3天。
6)將挑取的菌轉接到MM斜面培養基上28℃培養3天,然后放于室溫下培養7天,提孢子DNA進行PCR驗證。
6.1.2 提基因組DNA
采用酚氯仿法從UCP(NCU01928)& CRE-1(NCU08807)雜交菌產生的孢子中提取基因組DNA,具體包括以下操作:
1)2.0mL的無菌的DNA提取管中加入200mg的鋯珠,標號準備下一步用.
2)加1mL的裂解液(lysis buffer,配方:0.2M Tris?HCl (pH 7.5),0.5M NaCl,10mM EDTA,1% SDS (w/v))于每個斜面培養基試管中,用1mL槍頭將孢子輕輕刮下,將孢子溶解。
3)漩渦震蕩10s,取400μl孢子懸液預先準備好的DNA提取管中。
4)將所有DNA提取管置于助磨器上,最大轉速振蕩30s,重復兩次。
5)65℃水浴30分,在水浴過程中每個幾分鐘取出漩渦振蕩。
6)水浴結束后取出,每管加入80μl pH 7.5的1M的Tris?HCl中和。
7)加入400μl的酚:氯仿(1:1),13000rpm離心5分鐘。
8)取300μl上清液于新的1.5mLEP管中,加入600μl 95%的乙醇(DNA級)。
9)冰上孵育一小時,隨后4℃、13000rpm離心,可看到白色的DNA沉淀到EP管底部。
10)用75%的酒精400μl清洗,4度13000rpm離心,輕輕取出上清液。
11)將EP管置于真空濃縮儀中,真空干燥酒精。
12)加入50μl ddH2O溶解DNA,用NanoDrop測DNA濃度,測完濃度后將提取的DNA置于-20冰箱保存,以備下一步進行PCR驗證。
6.1.3 PCR驗證突變體
UCP(NCU01928)& CRE-1(NCU08807)雜交菌中提取基因組DNA,以提取的基因組DNA為模版進行基因UCP(NCU01928)& CRE-1(NCU08807)的PCR驗證。
1) 20μl RCR體系包括:10μl DreamTaq PCR Master Mix,7μl水,上、下游引物各1μl,基因組DNA 1μl。引物1928-inF和1928-inR用于驗證ncu01928的開放閱讀框是否被敲除,引物1928-outF和1928-outR用于驗證ncu01928基因是否被潮霉素磷酸轉移酶基因取代;引物cre1-orf-F和cre1-orf-R用于驗證ncu08807的開放閱讀框是否被敲除, cre1-5out-F和hph-5out-R用于驗證ncu08807基因是否被潮霉素磷酸轉移酶基因取代,。上述所用引物如下所示:
1928-inF:ATTTGAGGAGTATTATGGCAC (SEQ ID NO: 15)
1928-inR:AGCACGCCATCTCCTCCACTG (SEQ ID NO: 16)
1928-outF:CCGAGAGCTGCATCAGGT (SEQ ID NO: 17)
1928-outR:CCACTTCCTGCTATACAAGC (SEQ ID NO: 18)
cre1-orf-F:CGAGGATACACAGCAATCC (SEQ ID NO: 19)
cre1-orf-R:CGATAGCGAGTCGTGAGAG (SEQ ID NO: 20)
cre1-5out-F:GGAGAAGTGATCAAGGTCAC (SEQ ID NO: 21)
hph-5out-R:ACCTGCCTGAAACCGAAC (SEQ ID NO: 22)
2) PCR擴增條件為:先95℃預變性5分鐘;然后95℃變性30秒,55℃退火30秒,72℃延伸2分鐘,共34個循環;最后72℃退火10分鐘。
3)對PCR擴增產物進行1%瓊脂糖凝膠電泳(110V電壓,30分鐘),在凝膠成像系統下看基因擴增條帶,顯示利用1928-outF和1928-outR經PCR擴增獲得了1500bp 目的條帶,而利用1928-inF和 1928-inR未擴增出長637bp的目的條帶,說明ncu01928基因已經被潮霉素磷酸轉移酶hph基因替代;利用cre1-5out-F和hph-5out-R經PCR擴增獲得了1800bp 目的條帶,而利用cre1-orf-F和 cre1-orf-R未擴增出長550bp的目的條帶,說明ncu08807基因已經被潮霉素磷酸轉移酶hph基因替代。該結果確證已獲得了ΔucpΔcre1雙突變體。
6.2 ΔucpΔcre1::Pccg1-hac1s三突變體的構建
6.2.1 構建hac1s過表達質粒
使用引物hac1-orfF和hac1s-orfR從粗糙脈孢菌的cDNA中PCR擴增hac1scDNA片段,PCR反應體系為:5×phusion HF buffer 10μl,10mM dNTPs 1μl,引物各 2.5μl,cDNA 1μl,Phusion DNA polymerase 0.5μl,水 32.5μl。PCR反應條件為:先98oC 30s;然后98oC 10s,55oC 30s,72oC 1min,35個循環;最后72oC 10min,4oC 10min。PCR反應結束后,使用限制性內切酶PacI和XbaI將PCR產物和質粒pMF272進行雙酶切,并將兩種雙酶切產物進行連接,進行測序驗證,得到正確的質粒。再利用ccg1-hac1s-F和ccg1-hac1s-R從上述質粒中擴增帶有ccg1啟動子的hac1s片段,反應體系和條件同上,使用限制性內切酶ClaI和EcoRV將PCR產物和質粒pUC118-SUR進行雙酶切,并將兩種雙酶切產物進行連接,測序正確的質粒命名為pUC118-SUR-ccg1-hac1s,提取足夠濃度的質粒用于轉化粗糙脈孢菌。
上述實驗所用引物如下所示:
hac1-orfF:ATTTGCGGCCGCATGGATTCCTGGGCCGCCCACTC (SEQ ID NO: 23)
hac1s-orfR:CCTTAATTAATCAGATACAACCCACCGCAATAC (SEQ ID NO: 24)
ccg1-hac1s-F:CCATCGATGGATGCAGCTACCAGAAG (SEQ ID NO: 25)
ccg1-hac1s-R:CCGATATCTCAGATACAACCCACCGCAATAC (SEQ ID NO: 26)
6.2.2 電擊轉化粗糙脈孢菌ΔucpΔcre1
1) 50 mL冰冷的1 M sorbitol溶液洗下 MM固體(50×Vogel’s鹽20mL,蔗糖20g,瓊脂15g,定容體積到1L,高壓滅菌。50×Vogel’s鹽(1L))培養超過10d的ΔucpΔcre1老孢子,4℃,2000rpm離心2min去菌絲,用單層滅菌玻璃紙過濾一次,置于冰上。
2) 4℃,4000 rpm離心10 min,去上清,再加入冰冷的1 M的sorbitol,離心,重復1-2次。
3) 調整孢子濃度到2×109個/mL以上。分裝40μL到1.5 mL滅菌離心管中,加入10 μL pUC118-SUR-ccg1-hac1s質粒(5-10 μg),混勻,冰浴15 min。
4) 2 KV,0.2 CM電擊,加入冰冷的1 M的sorbitol溶液1mL,轉移至離心管中,冰浴15 min。
5) 取出 50℃保溫的top agar(20 mL 50×Vogel’s, 10 g瓊脂粉,定容至900 mL,121°C滅菌20 min后加入100 mL 10×FIGS(5 葡萄糖,5 g果糖,200 g L-山梨糖,定容至1 L,過濾除菌)),加入5μL 20μg/mL氯嘧磺隆溶液,混勻,加入冰浴的孢子,混勻倒在兩個bottom agar(20 mL 50×Vogel’s, 15 g瓊脂粉,定容至900 mL,121°C滅菌20 min后加入100 mL 10×FIGS和終濃度10μg/mL氯嘧磺隆)平板上, 28℃黑暗培養2-3 d挑取轉化子。
6) 將挑取的菌轉接到MM斜面培養基上28℃培養3天,然后放于室溫下培養7天,提孢子DNA進行PCR驗證。
6.2.2 提取基因組并PCR驗證轉化子
以提取的轉化子基因組為模板進行PCR驗證,利用引物ccg1-hac1s-F和ccg1-hac1s-R進行擴增,目的條帶為2400bp。PCR擴增產物進行1%瓊脂糖凝膠電泳(110V電壓,30分鐘),在凝膠成像系統下顯示一條2400bp的條帶,說明ΔucpΔcre1::Pccg1-hac1s構建成功。
實施例7、多基因突變粗糙脈孢菌纖維素產酶功能驗證實驗
7.1多基因突變粗糙脈孢菌在簡單微晶纖維素培養基中纖維素產酶功能驗證實驗
將野生型菌株FGSC2489(WT)、Δucp、Δcre1、ΔucpΔcre1和ΔucpΔcre1::Pccg1-hac1s分別在2%(2g/100mL)微晶纖維素培養基(配方:50× Vogel’s鹽2mL,微晶纖維素2g,定容體積到100mL,高壓滅菌)上25℃光照培養7d,樣品離心取上清液,測定蛋白濃度,跑SDS-PAGE和測定纖維素酶活。
7.1.1上清蛋白濃度測定
使用伯樂Bradford蛋白快速測試試劑盒檢測上清中的蛋白濃度,結果如圖3A所示。與野生型相比,ΔucpΔcre1和ΔucpΔcre1::Pccg1-hac1s相比出發菌株Δucp和Δcre1以及野生型菌株,蛋白產量都有非常顯著的提高,ΔucpΔcre1::Pccg1-hac1s蛋白產量高于ΔucpΔcre1。
7.1.2上清SDS-PAGE電泳檢測
根據蛋白濃度吸取等體積上清液進行4-12% SDS-PAGE電泳檢測,結果如圖3B所示。ΔucpΔcre1和ΔucpΔcre1::Pccg1-hac1s相比出發菌株Δucp和Δcre1以及野生型菌株,纖維素酶對應條帶都顯著加深,ΔucpΔcre1::Pccg1-hac1s蛋白量高于ΔucpΔcre1。
7.1.3上清纖維素酶酶活檢測
根據蛋白濃度稀釋上清進行外切纖維素酶酶活,內切纖維素酶酶活和葡萄糖苷酶酶活測定,結果如圖3A所示。微晶纖維素生長條件下,ΔucpΔcre1和ΔucpΔcre1::Pccg1-hac1s相比出發菌株Δucp和Δcre1以及野生型菌株,纖維素酶酶活都有非常顯著的提高,ΔucpΔcre1::Pccg1-hac1s酶活高于ΔucpΔcre1。
7.2多基因突變粗糙脈孢菌在添加有機氮源的微晶纖維素培養基中纖維素產酶功能驗證實驗
將野生型菌株FGSC2489(WT)、Δucp、Δcre1、ΔucpΔcre1和ΔucpΔcre1::Pccg1-hac1s分別在添加有機氮源的微晶纖維素培養基(配方:50× Vogel’s鹽2mL,微晶纖維素2g,酵母提取物0.75g,定容體積到100mL,高壓滅菌)上25℃光照培養7d,樣品離心取上清液,測定蛋白濃度,跑SDS-PAGE和測定纖維素酶活。
7.2.1上清蛋白濃度測定
使用伯樂Bradford蛋白快速測試試劑盒檢測上清中的蛋白濃度,結果如圖4A所示。與野生型相比,ΔucpΔcre1和ΔucpΔcre1::Pccg1-hac1s相比出發菌株Δucp和Δcre1以及野生型菌株,蛋白產量都有非常顯著的提高,達到1g/L以上的產量,ΔucpΔcre1::Pccg1-hac1s蛋白產量高于ΔucpΔcre1。
7.2.2上清SDS-PAGE電泳檢測
根據蛋白濃度吸取等體積上清液進行4-12% SDS-PAGE電泳檢測,結果如圖4B所示。ΔucpΔcre1和ΔucpΔcre1::Pccg1-hac1s相比出發菌株Δucp和Δcre1以及野生型菌株,纖維素酶對應條帶都顯著加深,ΔucpΔcre1::Pccg1-hac1s蛋白量高于ΔucpΔcre1。
7.2.3上清纖維素酶酶活檢測
根據蛋白濃度稀釋上清進行外切纖維素酶酶活,內切纖維素酶酶活和葡萄糖苷酶酶活測定,結果如圖4A所示。微晶纖維素生長條件下,ΔucpΔcre1和ΔucpΔcre1::Pccg1-hac1s相比出發菌株Δucp和Δcre1以及野生型菌株,纖維素酶酶活都有非常顯著的提高,ΔucpΔcre1::Pccg1-hac1s酶活高于ΔucpΔcre1。
- 還沒有人留言評論。精彩留言會獲得點贊!