豬ApoE基因敲除載體及其構建方法與應用與流程
本發明涉及基因工程領域,涉及豬ApoE基因敲除載體及其構建方法與應用。
背景技術:
ApoE(載脂蛋白E)是脂代謝中重要的蛋白分子,在脂代謝過程中主要作為乳糜微粒(CM)、極低密度脂蛋白(VLDL)、中間密度脂蛋白(IDL)以及高密度脂蛋白(HDL)的重要組成部分。ApoE基因的突變極易引發不同類型的疾病包括糖尿病、動脈粥樣硬化以及阿爾茨海默病(Alzheimer'sdisease,AD)。基因打靶制備的ApoE敲除小鼠在正常生長條件下9周齡時表現為主動脈弓動脈硬化斑塊,當用高脂料飼喂時第7周即出現泡沫樣的動脈硬化斑塊。除此之外該敲除鼠在生長老年階段會發生阿爾茨海默病類似的病變。因此用ApoE敲除小鼠作為研究動脈硬化以及阿爾茨海默病具有重要的醫學研究價值。但是鑒于小鼠和人在脂代謝中的差異使用小鼠作為動脈硬化研究模型具有一定的局限性,因此使用與人代謝模式更接近的小型豬作為材料制作ApoE敲除豬,有望更好地模擬人類動脈硬化發病過程以供其機理研究。
基因打靶技術是利用同源重組的原理將外源基因片段插入特定位置,以期將目的基因部分或者全部敲除。同源重組是指姐妹染色單體之間或者同一染色體上含有同源序列的DNA分子之間發生序列交換的過程。隨著80年代初胚胎干細胞的分離和體外培養技術的不斷成熟,利用同源重組原理使得對基因進行特定修飾改造成為可能。到目前為止嚙齒類動物如小鼠等已經有成熟的胚胎干細胞培養體系和基因打靶技術對基因進行需要的修飾。但是對于偶蹄類動物如豬、牛、羊等一直沒有成熟的胚胎干細胞系作為基因打靶的材料,所以在這些動物上進行基因打靶 具有一定的技術難度。伴隨著體細胞克隆技術的不斷成熟和完善,使得在這些動物中進行基因打靶成為可能。雖然體細胞的基因打靶效率很低,通常為10-6左右,但是通過正負篩選的方式仍然可以獲得中靶克隆。影響打靶效率的因素有多種,其中最主要的就是同源臂的長度以及同源序列的同源性,一般來說同源臂在10kb以內和同源重組效率成正比,序列的同源性越高重組效率也會隨之升高。因此在制作打靶載體過程中同源臂的長度和同源序列的同源性是首要考慮的兩個問題。
技術實現要素:
本發明的目的在于提供豬ApoE基因敲除載體;本發明的另一個目的在于提供豬ApoE基因敲除載體的構建方法及其應用。
為達到上述目的,本發明的技術方案是從中國農業大學自主繁育的貴州小香豬體細胞組織中提取基因組DNA,設計長短同源臂引物,通過PCR方法從基因組DNA中克隆同源臂,將同源臂分別克隆到表達載體,經過限制性內切酶酶切和測序分析確定同源臂的準確性后,采用酶切和連接的方法將長短同源臂分別連接到載體pEASY-T中,通過限制性內切酶酶切鑒定同源臂連接的正確性,為了方便去除Neo標記基因,在pApoEKO-DTA打靶載體基礎上用同源重組的方法在長短臂之間插入一段受豬精原細胞特異性啟動子調控的Cre基因。這樣可以在雜交F2代獲得去除Neo標記基因的敲除豬模型。
具體地,本發明提供的豬ApoE基因敲除載體,包含ApoE基因上下游同源臂的長臂和短臂,所述長臂的核苷酸序列如SEQ ID NO:1的第1~第5387位;所述短臂的核苷酸序列如SEQ ID NO:1的第9604~第11855位;在同源臂之間還具有標記基因。
本發明的豬ApoE基因敲除載體命名為pApoEKO-DTA-M,其核苷酸序列如SEQ ID NO.1所示。
本發明的豬ApoE基因敲除載體上的標記基因包括帶有豬精原細胞特異性啟動子Cre以及新霉素抗性選擇基因Neo。
本發明提供了豬ApoE基因敲除載體在制備ApoE基因敲除的豬中的應用。
本發明提供了豬ApoE基因敲除載體在制備動脈硬化模型動物中的應用。
本發明提供了一種擴增豬ApoE基因側翼序列的引物組合,其包括擴增上下游同源臂長臂的引物對和短臂的引物對,用于擴增短臂的引物對其核苷酸序列如SEQ ID NO.2-3所示,用于擴增長臂的引物對其核苷酸序列如SEQ ID NO.4-5所示。
本發明提供了一種構建豬ApoE基因敲除載體的方法,包括如下步驟:
(1)擴增豬ApoE基因側翼序列作為基因打靶的長臂Larm和短臂Sarm;將擴增出的長、短臂分別連入pEASY-T載體,得到長臂質粒載體和短臂質粒載體;
(2)短臂質粒載體與打靶載體ploxp分別酶切、連接后得到ploxp-Sarm質粒,再與長臂質粒載體連接得到ploxp-Sarm-Larm;
長短臂連接完成后的質粒載體用HindⅢ和Mlu Ⅰ酶切連接的方式將ploxp載體骨架上的tk負篩選基因替換成dta負篩選基因;
(3)在長、短臂之間插入豬精原細胞特異性啟動子Cre,構建得到ApoE基因敲除載體。
本發明方法中,步驟(1)中擴增短臂的引物序列如SEQ ID NO.2-3所示,擴增長臂的引物序列如SEQ ID NO.4-5所示。
本發明的一個實施例中,步驟(1)的T載體為pEASY-T載體。
本發明方法中,步驟(2)先將短臂與打靶載體ploxp分別用EcoRI和SalI雙酶切。
其中,步驟(2)ploxp-Sarm質粒與長臂質粒載體連接前,分別用NotI單酶切,純化回收后連接得到ploxp-Sarm-Larm載體。
其中,步驟(3)用同源重組的方法在長短臂之間插入一段受豬精原 細胞特異性啟動子調控的Cre基因,具體方法為:使用同源臂引物CR-F和CR-R從ptACE載體中擴增出同源重組的目的片段;取和同源重組目的片段混合后電轉感受態細胞,培養挑取單克隆菌落鑒定正確的為打靶載體pApoEKO-DTA-M;所述同源臂引物CR-F和CR-R的核苷酸序列如SEQ ID NO.6、7所示。
ptACE載體構建方法為:用PCR方法(引物序列:CRE-NHE1-F:GCTTCGTCAGAACAAACGACCCAACACCCGTGC/CRE-R:CTCTTCTTCTTGGGCATAGTAGGAGCAGGGCAGTC)從豬基因組中擴增出angiotensin-converting enzyme基因5’啟動子區(組織特異性啟動子序列),同時用引物(CRE-F:GACTGCCCTGCTCCTACTATGCCCAAGAAGAAGAG/CRE-NHE1-R:TTCGAGAACTGGATCTCGGGGCAAGACAAATGTC)以ploxp上的Cre基因為模板擴增Cre基因片段。利用重疊PCR原理將組織特異性啟動子序列和Cre基因片段連接,連接后用引物中添加的Nhe Ⅰ酶切位點(下劃線加粗部分)插入PL452骨架質粒(購自Addgene)的Nhe Ⅰ酶切位點中獲得。
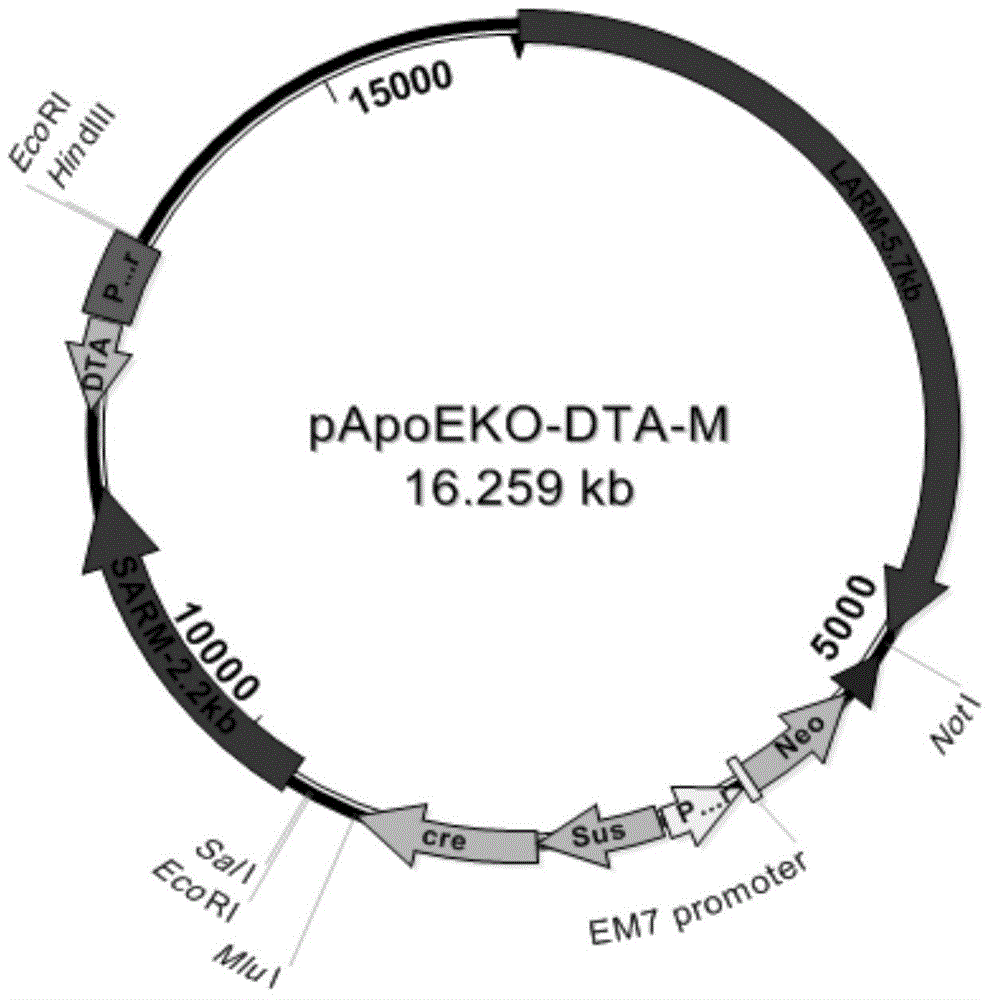
采用基因抓捕方法,設計同源臂引物CR-F/CR-R(即普通引物后加上一段100bp的同源序列)用于同源重組。從ptACE載體中擴增出同源重組的目的片段包含Cre基因以及啟動子區和Neo抗性篩選基因。在本發明的實施例中,ploxp-Sarm-Larm載體10ng和含有同源重組目的片段的PCR產物600ng混合后電轉SW102大腸桿菌感受態細胞電轉化采用的感受態細胞。電轉后涂LB培養基平板培養,挑取較大的單克隆菌落提取質粒酶切鑒定結果見圖1。鑒定質粒為最終的打靶載體pApoEKO-DTA-M,圖譜見圖2。
本發明的優點:(1)插入的白喉毒素基因(在基因抓捕步驟前進行dta基因的插入)提高正負篩選的陽性克隆率,原tk基因在篩選過程中需要添加毒性因子GANC,替換成dta后不用添加任何因子即可以篩選從而提 高篩選效率;(2)同時敲入特異啟動子啟動的Cre基因方便標記基因的去除,由于Cre基因與標記基因Neo同時位于兩個loxp位點內,而且Cre基因被豬精原特異性啟動子啟動,因此在打靶豬雜交過程中精原細胞中特異表達的Cre基因能夠有效識別loxp位點,從而將標記基因同時去除;(3)能夠大片段地刪除ApoE基因序列以確保其功能完全缺失,本發明同源重組完成后將缺失ApoE基因的2-4個外顯子區域。
附圖說明
圖1為本發明的小型豬ApoE基因敲除載體pApoEKO-DTA-M酶切鑒定電泳圖。
圖2為打靶載體pApoEKO-DTA-M結構示意圖。
圖3為ApoE基因敲除后的小型豬成纖維細胞系。
圖4為打靶載體pApoEKO-DTA-M轉染后獲得的ApoE基因敲除小型豬成纖維細胞系鑒定結果。圖中25為同批次克隆細胞混合物,結果表明篩選的克隆中有陽性克隆,31、37、46為該批次挑取的克隆號,結果表明37號為陽性中靶克隆,而31和46號為陰性克隆,“+”條帶為建立的陽性樣品,能擴增出來說明已經發生同源重組,目的片段已經插入細胞中。
圖5為獲得的ApoE敲除小型豬基因型鑒定。圖中1、2、3、4、12、14為出生小型豬耳號,陰性對照組為未敲除目的基因的小型豬基因組。
具體實施方式
以下實施例進一步說明本發明的內容,但不應理解為對本發明的限制。在不背離本發明精神和實質的情況下,對本發明方法、步驟或條件所作的修改或替換,均屬于本發明的范圍。
若未特別指明,實施例中所用的技術手段為本領域技術人員所熟知的常規手段。本發明實施例中的各類限制性內切酶以及連接酶購自NEB、使用的其它試劑均從Sigma購買,打靶載體ploxp為實驗室保存,該載體的構建方法已在文獻X.Yang,C.Li,X.Xu,C.Deng,Proc Natl Acad Sci USA 95,3667,Mar 31,1998中公開。
本發明所述的小型豬為中國農業大學涿州小型豬廠飼養的貴州小香豬。實施例中所述的小型豬基因組DNA為根據常規方法從貴州小香豬肌肉組織中提取得到的基因組DNA。
實施例1 小型豬ApoE基因側翼序列長臂和短臂的獲得
分別設計小型豬ApoE基因側翼序列長臂Larm和短臂Sarm的上、下游引物
以小型豬基因組DNA為模板,分別進行PCR擴增基因小型豬ApoE基因側翼序列長臂Larm和短臂Sarm。
擴增長臂的PCR反應為20μL反應體系:上下游引物各0.6μL,模板DNA1.0μL,5×GCBuffer 4.0μL,dNTPs0.6μL,KAPA Hifi Taq 0.4μL,滅菌ddH2O 12.8μL。
PCR反應條件:95℃預變性5min;95℃變性20s,62℃退火15s,72℃延伸5min,共35個循環;72℃5min。
擴增短臂的PCR反應為20μL反應體系:上下游引物各0.6μL,模板DNA1.0μL,5×GCBuffer 4.0μL,dNTPs0.6μL,KAPA Hifi Taq 0.4μL,滅菌ddH2O 12.8μL。
PCR反應條件:95℃預變性5min;95℃變性20s,62℃退火15s,72℃延伸2min,共30個循環;72℃5min。
分別將PCR產物進行瓊脂糖凝膠電泳后,利用DNA凝膠回收試劑盒回收獲得ApoE基因長臂和短臂,并將它們連接到pEASY-T載體上,連接產物分別轉化大腸桿菌DH5α,分別挑取連接陽性菌落進行菌體擴培和質粒提取,獲得ApoE基因同源臂pEASY-Larm和pEASY-Sarm兩種質粒。
實施例2 打靶載體pApoEKO-DTA-M的構建
1、短臂質粒pEASY-Sarm與打靶載體ploxp的連接得到ploxp-Sarm
打靶載體ploxp和短臂質粒載體pEASY-Sarm分別用EcoRI和SalI雙酶切,DNA產物純化回收試劑盒回收ploxp載體的酶切片段,對pEASY-Sarm質粒載體酶切產物用瓊脂糖凝膠試劑盒回收2.4kb短臂片段,回收后按照ploxp質粒與短臂片段1:3的比例用T4連接酶連接,轉化Trans-1感受態細胞后挑取單克隆測序鑒定,進行DNA測序分析,結果表明短臂Sarm成功連接入打靶載體ploxp。
2、長臂質粒pEASY-Larm與ploxp-Sarm的連接得到ploxp-Sarm-Larm載體
陽性克隆質粒和長臂質粒載體pEASY-Larm分別用NotI單酶切,DNA產物純化回收ploxp-Sarm質粒片段,瓊脂糖凝膠回收pEASY-Larm酶切下來的5.7kb長臂片段,回收產物用堿性磷酸酶處理后再次純化回收,回收獲得的片段按照質粒與長臂DNA片段摩爾比1:3的比例用T4連接酶連接,連接反應完成后轉化Trans-1感受態細胞,培養24h后挑取單克隆菌落進行PCR鑒定,陽性克隆提取質粒用于酶切鑒定,酶切鑒定正確的樣品送樣測序。測序正確質粒即為目的ploxp-Sarm-Larm打靶載體。
ploxp-Sarm-Larm打靶載體上tk基因替換:
以tk作為負篩選基因需要加入丙氧鳥苷(GANC),但是添加的劑量需要根據實驗的細胞類型進行耐受實驗,因此會增加實驗難度和降低篩選效率。通過直接插入白喉毒素dta基因可以提高篩選效率。將打靶載體ploxp-Sarm-Larm用HindⅢ和Mlu Ⅰ對載體進行酶切,1%瓊脂糖凝膠電泳后切膠回收目的片段。用PCR方法從PGKdtabpA(Addgene plasmid#13440)中擴增dta的表達序列(引物序列:DTA-MLU1-F:GCTTCGTCAGACGCGTCTCGAGGTCGAGCCCCAGCT/DTA-HIND3-R:TTCGAGAACTAAGCTTAGGGGTTCCGCGCACATTTCC)擴增出的 含dta基因的片段經過HindⅢ和Mlu Ⅰ雙酶切后回收酶切片段。將ploxp-Sarm-Larm酶切膠回收產物與dta基因片段酶切產物以摩爾比1:3的比例混合用T4DNA連接酶進行連接。連接后獲得打靶載體pApoEKO-DTA。
3、修飾pApoEKO-DTA打靶載體得到打靶載體pApoEKO-DTA-M
為了加速獲得去除標記基因的打靶模型,利用同源重組的原理將pApoEKO-DTA載體的原有Neo基因前端添加豬精原細胞特異啟動的Cre基因,其序列為SEQ ID NO.1的第8021~第9139位。采用基因抓捕方法,設計同源臂引物CR-F和CR-R(即普通引物后加上一段100bp的同源序列)用于同源重組。引物CR-F和CR-R的核苷酸序列分別如SEQ ID NO.6、7所示。
以ptACE載體為模板,先用引物CR-F和CR-R擴增出同源重組的目的片段(包含Cre基因以及啟動子區和Neo抗性篩選基因)并用DNA產物回收試劑盒回收目的片段。吸取待打靶載體pApoEKO-DTA 10ng和上一步驟中DNA產物回收試劑盒回收到的PCR產物600ng混合后電轉SW102大腸桿菌感受態細胞。電轉后涂LB板培養,挑取較大的單克隆菌落提取質粒酶切鑒定,鑒定結果見圖1。鑒定正確的質粒為最終的打靶載體pApoEKO-DTA-M,圖譜見圖2。
ptACE載體構建方法為:用PCR方法(引物序列:CRE-NHE1-F:GCTTCGTCAGAACAAACGACCCAACACCCGTGC/CRE-R:CTCTTCTTCTTGGGCATAGTAGGAGCAGGGCAGTC)從豬基因組中擴增出angiotensin-converting enzyme基因5’啟動子區(組織特異性啟動子序列),同時用引物(CRE-F:GACTGCCCTGCTCCTACTATGCCCAAGAAGAAGAG;CRE-NHE1-R:TTCGAGAACTGGATCTCGGGGCAAGACAAATGTC)以ploxp上的Cre基因為模板擴增Cre基因片段。利用重疊PCR原理將組織特異性啟動子序列和Cre基因片段連接,連接后用引物中添加的Nhe Ⅰ酶切位點(下劃線加粗部分)插入PL452骨架質粒(購自Addgene)的Nhe Ⅰ酶切位點中獲得。
實施例3 載體pApoEKO-DTA-M的打靶實例
1、打靶載體轉染成纖維細胞
利用抗性基因Amp內的單酶切位點ScaI線性化pApoEKO-DTA-M質粒,37℃酶切3-5h后乙醇沉淀回收目的片段,目的片段溶于ddH2O后調整濃度約1μg/μL備用。
2、細胞系轉染以驗證其功能
轉染從中國農業大學涿州小型豬基地分離的貴州小香豬成纖維細胞系,用含G418的培養基對轉染細胞進行10天左右的篩選獲得抗性細胞克隆點。消化選取部分細胞克隆點提取DNA進行跨長短臂PCR鑒定,用跨短臂引物(SARM-S-F:GGCTTTGGTTCCAGAGTTCACAGTC;CRE-NHE1-R:TTCGAGAACTGCTAGCGGATCTCGGGGCAAGACAAATGTC)PCR擴增鑒定中靶克隆,鑒定的陽性克隆點進一步測序驗證,獲得ApoE基因敲除的小型豬成纖維細胞系圖3,PCR鑒定結果見圖4,圖中結果表明37號單克隆樣本為陽性打靶細胞系,說明已經發生同源重組,目的片段已經插入細胞中。
實施例4 ApoE基因敲除小型豬制備及鑒定
用體細胞核移植的方法將鑒定為陽性的成纖維細胞的細胞核作為供體轉移至受體卵母細胞中,獲得的核移植胚胎通過胚胎移植手術注入發情期母豬子宮內妊娠。總共移植1240枚胚胎,移植14頭母豬,其中三頭母豬成功妊娠。獲得6頭F0代小型豬個體,用跨短臂引物(SARM-S-F:GGCTTTGGTTCCAGAGTTCACAGTC/CRE-NHE1-R:TTCGAGAACTGCTAGCGGATCTCGGGGCAAGACAAATGTC)以6頭F0代個體基因組為模板進行常規PCR擴增鑒定,能夠擴增出5kb大小條帶的個體為重組后的敲除豬,鑒定結果見圖5,由此可見鑒定的6個樣本均為陽性。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 基于CRISPR/Cas9技術的單子葉植物基因敲除載體及其應用的制作方法與工藝
- 一種T1R2基因過表達慢病毒載體、慢病毒及其構建方法與流程
- 一種Gα基因過表達慢病毒載體、慢病毒及其構建方法與流程
- 弱毒力CMV載體表達抗性基因增強植物抗重金屬性能的應用的制作方法與工藝
- 豬ApoE基因敲除載體及其構建方法與應用與流程
- 基于CRISPR/Cas9技術的單子葉植物基因敲除載體及其應用的制作方法與工藝
- 敲除衣藻內源基因和表達外源基因的載體構建方法及應用與流程
- 一種能夠快速構建植物基因定點敲除載體的新反應體系的制造方法與工藝
- 介導整合的HIV?1前病毒基因敲除的鋅指核酸內切酶及其制法和應用的制造方法與工藝
- 病毒載體、細胞及構建體的制造方法與工藝