衍生自北極假交替單胞菌PAMC21717的適冷蛋白酶及其用途的制作方法
本發明涉及衍生自北極假交替單胞菌(Pseudoalteromonasarctica)PAMC21717的適冷蛋白酶或通過在大腸桿菌中表達編碼適冷蛋白酶的基因獲得的重組適冷蛋白酶,并且更具體地,涉及在低溫下顯示活性的蛋白酶的晶體,用于結晶所述蛋白酶的方法,用于制備所述蛋白酶的方法,表達所述蛋白酶的重組微生物,用于制備所述重組微生物的方法,用于制備所述重組蛋白酶的方法和所述適冷蛋白酶的用途。
背景技術:
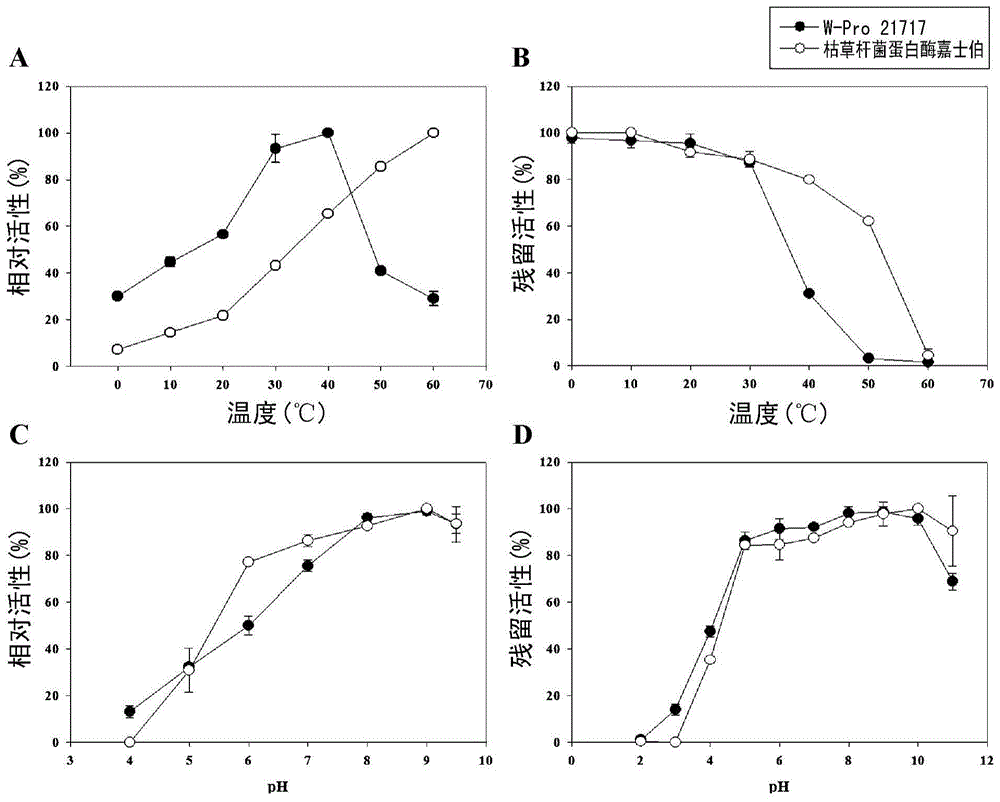
:蛋白酶被用于各種應用,包括藥物組合物,例如用于緩解胃腸道紊亂的消化酶劑、溶血栓劑或消炎劑,和用于衣服、隱形眼鏡或清潔劑的組合物以及化妝品、皮革處理劑、食物軟化劑、肉增強劑(meatenhancer)、飼料或食物添加劑、油和脂肪分離劑、廢水處理等。微生物產品中酶的效用已經廣為人知。蛋白酶占工業酶市場的最高百分比(60%或更高),并且其適銷性越來越高。大約25%的工業蛋白酶以去污劑在市場上銷售,并且用于去污劑的蛋白酶被要求具有能夠降解食物、血液或體液成分的廣譜的底物特異性和堿性環境,并且應當是穩定的,這樣它們在高溫或低溫下不會失去它們的表面活性劑活性和酶活。過去,主要采用植物來源的蛋白酶,但近年來,微生物已被頻繁用于生產蛋白酶。如果蛋白酶將被用于工業應用,那么要求它們是非常穩定的。例如,在表面活性劑存在的情況下,大多數蛋白的活性降低或完全消失,并且由于這個原因,在去污劑中所采用的蛋白酶是極其有限的。而且如果在高濃度下使用去污劑,難以預期其中含有的蛋白酶的活性。此外,諸如暴露于極端pH、暴露于重金屬或氧化還原的程度的條件均強烈影響酶的活性,并因此如果這些條件超出了合適的范圍,酶迅速喪失其活性。由于這個原因,為了使蛋白酶常規用于工業應用,要求蛋白酶甚至在極端和不穩定的物理和化學條件下保持其活性。基于絲氨酸的蛋白酶(例如枯草桿菌蛋白酶)已被最廣泛地用于去污劑工業。此類堿性蛋白酶甚至在存在表面活性劑和氧化劑的高pH條件下可靠地保持它們的活性(Guptaetal.,ApplMicrobiolBiotechnol,59:15-32,2002;Haddaretal.,BioresourTechnol,100:3366-3373,2009),并因此可用于各種工業應用中。近年來,對冷活性酶的需要有所增加。具體地,已經將低活性蛋白酶加入去污劑,并在15℃或更低的洗滌溫度保持它們的高活性。在迄今為止所報道的關于適冷蛋白酶的文獻中,有以下報道:衍生自嗜冷微生物希瓦氏菌(Shewanella)的基于絲氨酸的冷活性蛋白酶基因的克隆、酶的純化和表征(Kulakovaetal.,ApplEnvironMicrobiol,65:611-617,1999),嗜冷海洋微生物Colwelliapsychrerythraea純化、表征和測序(Hustonetal.,ApplEnvironMicrobiol,70:3321-3328,2004),衍生自科爾韋爾氏菌(Colwelliasp.)的基于絲氨酸的適冷蛋白酶的純化和表征(Wangetal.,BiotechnolLett,27:1195-1198,2005)等。因此,本發明人已經做了廣泛的努力通過采用分離自南極海洋沉積物的北極假交替單胞菌PAMC21717產生的適冷和堿性的基于絲氨酸蛋白酶來開發用于各種工業應用的蛋白酶。作為結果,本發明人已經分離了在0至60℃和pH5.0至11.0的條件下顯示酶活的適冷蛋白酶,然后已經鑒定了所述適冷蛋白酶的晶體結構,并已經發現所述適冷蛋白酶在相對低溫下(與例如枯草桿菌蛋白酶的蛋白酶相比)顯示高活性,從而完成了本發明。技術實現要素:本發明的一個目的是提供或是衍生自北極假交替單胞菌PAMC21717的適冷蛋白酶或是通過在大腸桿菌中表達編碼適冷蛋白酶的基因獲得的重組適冷蛋白酶的晶體,和用于結晶所述適冷蛋白酶的方法。本發明的另一個目的是提供用于制備所述適冷蛋白酶的方法。本發明的又一個目的是提供表達所述適冷蛋白酶的產酶重組微生物,和用于制備所述重組微生物的方法。本發明的另一個目的是提供采用所述重組微生物用于制備所述適冷蛋白酶的方法。本發明的再一個目的是提供用于外科或治療裝置的消毒組合物、去污劑組合物、飼料添加劑組合物、食物添加劑組合物和纖維或皮革處理組合物,所述組合物含有作為活性成分的所述適冷蛋白酶。為了達到上述目的,本發明提供了或是衍生自北極假交替單胞菌PAMC21717的適冷蛋白酶或是通過在大腸桿菌中表達編碼適冷蛋白酶的基因獲得的重組適冷蛋白酶的晶體,其中所述適冷蛋白酶的晶體具有以下特點:(i)具有枯草桿菌蛋白酶樣折疊;(ii)具有四個鈣離子和兩個二硫鍵(Cys439-Cys442和Cys207-Cys254);(iii)形成由十個α-螺旋組成的三維結構,所述十個α-螺旋環繞中央6個β-鏈(β-strand)和兩個β-鏈;以及(iv)具有P212121空間群的結晶結構,所述P212121空間群具有晶胞參數α=β=γ90°或者表1中所列的2374個原子坐標(包括4個鈣離子)。本發明還提供了用于結晶衍生自北極假交替單胞菌PAMC21717的適冷蛋白酶或通過在大腸桿菌中表達編碼適冷蛋白酶的基因獲得的重組適冷蛋白酶的方法,其中所述方法包括在20℃采用含有20mMTris-HCl(pH8.0)和150mMNaCl的蛋白溶液和含有0.1M乙酸鈉(pH4.4)和3M氯化鈉的防腐溶液進行結晶。本發明還提供了用于制備適冷蛋白酶的方法,所述方法包括:(a)在含有脫脂牛奶、胰蛋白胨、Fe(C6H5O7)、NaCl、MgCl2、Na2SO4、CaCl2、NaHCO3和KBr的培養基中分批補料培養北極假交替單胞菌PAMC21717以產生適冷蛋白酶(W-pro21717);以及(b)回收所產生的適冷蛋白酶。本發明還提供了產酶的重組微生物,其中引入含有采用SEQIDNOs:7和8的一組引物通過PCR獲得的擴增產物的重組載體。本發明還提供了用于制備適冷蛋白酶的方法,所述方法包括:(a)在含有葡萄糖、KH2PO4、(NH4)2PO4、檸檬酸、MgSO47H2O、硫胺素、抗生素和痕量金屬元素的培養基中培養上述的重組微生物;(b)表達所述重組微生物中的適冷蛋白酶成pH-穩定的分批培養物,同時當培養基的pH和DO增加時供給含有葡萄糖、酵母提取物、(NH4)2PO4、MgSO47H2O和抗生素的預定量的培養基;以及(c)回收所表達的適冷蛋白酶。本發明還提供了用于外科或治療裝置的消毒組合物,所述組合物含有作為活性成分的所述適冷蛋白酶或所述適冷蛋白酶的晶體。本發明還提供了含有作為活性成分的所述適冷蛋白酶或所述適冷蛋白酶的晶體的去污劑組合物。本發明還提供了含有作為活性成分的所述適冷蛋白酶或所述適冷蛋白酶的晶體的飼料添加劑組合物。本發明還提供了含有作為活性成分的所述適冷蛋白酶或所述適冷蛋白酶的晶體的食物添加劑組合物。本發明還提供了含有作為活性成分的所述適冷蛋白酶或所述適冷蛋白酶的晶體的纖維或皮革處理組合物。附圖說明圖1顯示了北極假交替單胞菌PAMC21717的培養物的酶譜分析的結果。(A):通過酶譜對所述培養物的時間依賴性分析;以及(B)部分分離自96-hr培養物的W-Pro21717。圖2顯示了作為溫度和pH的函數分析W-Pro21717的活性和穩定性的結果。(A):W-Pro21717的活性的最佳溫度;(B)W-Pro21717的穩定性的最佳溫度;(C)W-Pro21717的活性的最佳pH;(D)W-Pro21717的穩定性的最佳pH。圖3顯示了分析W-Pro21717在金屬離子和表面活性劑存在下的活性和穩定性的結果。圖4顯示了采用脫脂牛奶分析W-Pro21717與市售蛋白酶的相容性的結果。圖5顯示了為了檢查碳和氮對培養基的優化作用在3小時的培養之后測量細胞濃度和W-Pro21717的活性的結果。(A):碳源對含有脫脂牛奶的培養基的作用;(B):碳源對不含有脫脂牛奶的培養基的作用(A:對照,B:葡萄糖,C:半乳糖,D:果糖,E:乳糖,F:蔗糖,G:麥芽糖,H:甘油,I:淀粉,J:纖維素);以及(C):氮對含有脫脂牛奶的培養基的作用(A:對照,B:蛋白胨,C:胰蛋白胨,D:酵母提取物,E:大豆蛋白胨,F:胰蛋白酶大豆肉湯)圖6描繪了顯示礦物對生產培養基的優化的作用的三維反應曲線。(A):Fe(C6H5O7)和NaCl;(B):Fe(C6H5O7)和Na2SO4;(C):Fe(C6H5O7)和KCl;(D):NaCl和Na2SO4;(E):NaCl和KCl;以及(F):Na2SO4和KCl。圖7顯示了在分批補料培養過程中W-Pro21717的時間依賴性活性。(A)●:不含有脫脂牛奶的基本培養基,■:含有脫脂牛奶的基本培養基,▲:優化的礦物培養基;(B)◇:細胞濃度,◆:W-Pro21717的活性。圖8顯示了重組蛋白酶R-Pro21717的SDS-PAGE和酶譜分析的結果。(A):由pDOC載體表達的重組蛋白;(B)在重折疊過程中的重組蛋白;(C)重折疊之后純化的重組蛋白酶R-Pro21717。(1至5:pDOC122、pDOC125、pDOC128、pDOC131和pDOC131洗滌后的包涵體,6:重折疊48小時后的pDOC131,7:重折疊72小時后的pDOC131,8:重折疊后通過色譜純化的pDOC131的表達產物R-Pro21717)。圖9顯示了作為溫度和pH的函數分析重組R-Pro21717的活性和穩定性的的結果。(A):R-Pro21717的活性的最佳溫度;(B)R-Pro21717的穩定性的最佳溫度;(C)R-Pro21717的活性的最佳pH;以及(D)R-Pro21717的穩定性的最佳pH。圖10顯示了分析重組R-Pro21717在金屬離子和表面活性劑存在下的活性和穩定性的結果。將R-Pro21717加入含有1mM的每種材料的標準緩沖液并然后使得R-Pro21717在冰上1小時之后,測量活性。圖11顯示了具有四個鈣離子鍵和由催化三聯體組成的活性位點的適冷蛋白酶(R-Pro21717)的三維晶體結構,所述催化三聯體由Asp185、His244和Ser425組成。本發明涉及的北極假交替單胞菌(Pseudoalteromonasarctica)PAMC21717,保藏在韓國典型培養物保藏中心(KCTC),該保藏機構位于韓國大田市(305-806)廣域市汝城區科學路125號的韓國生物科學和生物技術研究所(KRIBB),保藏日期是2013年9月3日,保藏號是KCTC12482BP。實施本發明的最佳方式除非另有定義,本文使用的所有技術和科學術語均具有本發明所屬領域技術人員通常理解的相同含義。一般地,本文所使用的命名法和實驗方法是本領域公知的并且通常使用的。在本發明中,檢查了由分離自南極海洋沉積物的北極假交替單胞菌PAMC21717所制備的適冷、堿性的基于絲氨酸的蛋白酶的三維晶體結構和活性位點,并分析了所述蛋白酶的特征。本發明中所使用的北極假交替單胞菌PAMC21717于2013年9月3日以保藏號KCTC12482BP被保藏。在一個方面,本發明涉及衍生自北極假交替單胞菌PAMC21717的適冷蛋白酶或是通過在大腸桿菌中表達編碼適冷蛋白酶的基因獲得的重組適冷蛋白酶的晶體,其中所述適冷蛋白酶的晶體具有以下特點:(i)具有枯草桿菌蛋白酶樣折疊;(ii)具有四個鈣離子和兩個二硫鍵(Cys439-Cys442和Cys207-Cys254);(iii)形成由十個α-螺旋組成的三維結構,所述十個α-螺旋環繞中央6個β-鏈和兩個β-鏈;以及(iv)具有P212121空間群的結晶結構,所述P212121空間群具有晶胞參數α=β=γ90°或者表1中所列的2374個原子坐標(包括4個鈣離子)。在本發明中,所述蛋白酶的晶體包括由氨基酸殘基Asp185、His244和Ser425的催化三聯體組成的酶活性位點。本發明的適冷蛋白酶的三維晶體結構可以由下表1中所示的原子坐標來表示。表1在表1中,A:原子(atom);B:原子序數;C:原子名稱;D:殘基名稱;E:鏈名稱;F:殘基序數;G:x軸信息;H:y軸信息;I:z軸信息;J:占位率;以及K:溫度因子。在另一方面,本發明涉及用于結晶衍生自北極假交替單胞菌PAMC21717的適冷蛋白酶或通過在大腸桿菌中表達編碼適冷蛋白酶的基因獲得的重組適冷蛋白酶的方法,其中所述方法包括在20℃采用含有20mMTris-HCl(pH8.0)和150mMNaCl的蛋白溶液以及含有0.1M乙酸鈉(pH4.4)和3M氯化鈉的防腐溶液進行結晶。通常采用x射線晶體學進行此結晶步驟,并且在x射線晶體學之前應當進行多種結晶過程作為預處理步驟。在本發明的一個實施方案中,基于濃度平衡的傳統方法可以被用作此結晶方法。例如,可以采用蒸發平衡法、坐滴或懸滴氣相擴散法或透析法(連續或分批)。在本發明的例子中,坐滴法被用于結晶并濃縮所述適冷蛋白酶。在又一個方面,本發明涉及用于制備適冷蛋白酶的方法,所述方法包括:(a)在含有脫脂牛奶、胰蛋白胨、Fe(C6H5O7)、NaCl、MgCl2、Na2SO4、CaCl2、NaHCO3和KBr的培養基中分批補料培養北極假交替單胞菌PAMC21717以產生適冷蛋白酶(W-pro21717);以及(b)回收所產生的適冷蛋白酶。在又一個方面,本發明涉及用于制備表達適冷蛋白酶的產酶重組微生物的方法,所述方法包括:(a)用SEQIDNOs:7和8的一組引物進行PCR以獲得編碼衍生自北極假交替單胞菌PAMC21717的適冷蛋白酶(W-pro21717)的基因;(b)將所述基因插入重組表達載體pEXP5-CT/TOPO;以及(c)用所述重組表達載體轉化宿主大腸桿菌。如本文所使用的術語“載體”是指含有DNA序列的DNA構建體,所述DNA序列可操作性連接至能夠在合適的宿主中表達所述DNA的合適的控制序列。所述載體可以是質粒、噬菌體顆粒、或簡單地為潛在的基因組插入物。一旦被轉化入合適的宿主,載體可以復制并獨立于宿主基因組發揮功能,或在某些情況下可以將其自身整合入基因組。在本說明書中,質粒和載體有時可互換使用,因為質粒是目前最常使用的載體形式。出于本發明的目的,優選采用質粒載體。可用于此目的的典型的質粒載體具有:(a)復制起點,通過它可以有效進行復制這樣每個宿主細胞可以制造幾百個質粒載體;(b)抗生素抗性基因,通過它可以選擇轉化了質粒載體的宿主細胞;以及(c)限制性酶切位點,在此可插入外源DNA片段。即便載體中不存在合適的限制性酶切位點,使用常規合成的寡核苷酸接頭能夠很容易地連接載體和外源DNA。連接之后,載體應當被轉化入合適的宿主細胞。可以采用Sambrook,etal.(同上)的1.82節中所述的氯化鈣法很容易地進行轉化。或者,也可以采用電穿孔(Neumann,etal.,EMBOJ.,1:841,1982)轉化此類細胞。對于本發明的基因的過表達,可以采用本領域已知的表達載體。本領域公知,為了提供轉化的基因在宿主細胞中的表達水平,基因應當可操作地連接至能夠在所選擇的表達宿主中發揮功能的轉錄和翻譯控制序列。優選地,相應的基因和表達控制序列包含于含有細菌選擇性標記和復制起點的單個表達載體中。用上述重組載體轉化的宿主細胞構成本發明的另一個方面。如本文所使用的術語“轉化”是指將DNA引入宿主細胞使得DNA能夠或者作為染色體整合體或者作為染色體外元件復制。當然,應該理解的是,所有載體并不同等地發揮作用來表達本發明的DNA序列。同樣,所有宿主細胞對于同一表達系統并不同等地發揮作用。但是,本領域的任何技術人員可以在不偏離本發明的保護范圍并且無需過度實驗的情況下正確地選擇載體、表達控制序列和宿主細胞。例如,在選擇載體時應當考慮宿主細胞,因為載體應當可以在其中被復制。而且,應當考慮載體的復制數、控制復制數的能力和由載體編碼的其它蛋白(例如抗生素標記)的表達。本發明所使用的重組載體優選是包括在pEXP5-CT/TOPO中引入的pro21717-I基因的pDOC載體,并且更優選pDOC131。重組微生物優選大腸桿菌,如大腸桿菌DH5α、大腸桿菌JM101、大腸桿菌K12、大腸桿菌W3110、大腸桿菌X1776、大腸桿菌XL-1Blue(Stratagene)、大腸桿菌BL21等。在另一個方面,本發明涉及用于制備適冷蛋白酶的方法,所述方法包括:(a)在含有葡萄糖、KH2PO4、(NH4)2PO4、檸檬酸、MgSO47H2O、硫胺素、抗生素和痕量金屬元素的培養基中培養本文所述的重組微生物;(b)表達所述重組微生物中的適冷蛋白酶成pH-穩定的分批培養物,同時當培養基的pH和DO增加時供給預定量的培養基,所述培養基含有葡萄糖、酵母提取物、(NH4)2PO4、MgSO47H2O和抗生素;以及(c)回收所表達的適冷蛋白酶。在本發明中,所述蛋白酶特征在于它在0至60℃和pH5.0至11.0的條件下顯示酶活性,并采用解折疊緩沖液(pH8.5;8M尿素,50mM巰基乙醇和20mMTris-HCl)、重折疊緩沖液(20mMTris-HCl、100mMNaCl、20mMCaCl2和0.05%Tween20)通過SephacrylS-100柱純化,和透析步驟。在又一個方面,本發明涉及用于外科或治療裝置的消毒組合物、去污劑組合物、飼料添加劑組合物、食物添加劑組合物和纖維或皮革處理組合物,所述組合物含有作為活性成分的適冷蛋白酶或適冷蛋白酶的晶體。本發明的蛋白酶可以用作用于外科或治療裝置的消毒組合物。外科或治療裝置可以是被插入身體的醫療裝置,例如內窺鏡、導管等。本發明的蛋白酶可以用作去污劑組合物。去污劑組合物可以用于各種應用,包括洗衣、餐具洗滌、隱形眼鏡的洗滌、假牙的洗滌等。除了本發明的蛋白酶外,去污劑組合物可以包括其它酶組分和添加劑。本發明的去污劑組合物可以包括至少一種表面活性劑,并且表面活性劑為陰離子表面活性劑、非離子表面活性劑、陽離子表面活性劑、兩性或兩性離子表面活性劑或以上兩種或更多的混合物。此外,本發明的去污劑組合物還可以包括其它本領域已知的去污劑組分,例如,摩擦劑、漂白劑、表面活性劑、抗腐蝕劑、金屬離子螯合劑、抗污漬復位劑、用于香料、酶和漂白劑的穩定劑、制劑助劑、光學增亮劑、泡沫促進劑、螯合劑、填充劑、織物柔軟劑等。此外,本發明的去污劑組合物可以配制成例如粉末、液體等的任意便利形式。本發明的蛋白酶可以是飼料添加劑、食物添加劑或藥物組合物。所述蛋白酶可以被用于包括食物軟化劑、肉增強劑、油和脂肪分離劑等的應用。此外,它可以被用作緩解胃腸道紊亂、消化異常和胃腸道手術后的異常疾病的消化酶制劑、直接作用于血栓以溶解纖維蛋白的溶血栓劑、作為體內防御系統防御外來毒性物質以去除炎性物質或壞死組織的消炎酶或者用于手術后或創傷后水腫的消炎劑。根據本發明的藥物組合物包括本發明的蛋白酶混合物中的藥學上可接受的載體。藥物制劑是本領域公知的,并且包含所述蛋白酶的藥物組合物可以由本領域技術人員容易地配制。藥物組合物可以腸胃外(例如,靜脈內、皮下或肌內)施用。優選地,它是靜脈內施用的。藥物組合物優選被以含有足夠量的使得溶液等滲的鹽、葡萄糖或葡聚糖的無菌水溶液的形式使用。對于口服施用,藥物組合物可以被以片劑、膠囊、錠劑、含片、粉末、糖漿、酏劑、溶液或懸液的形式使用,并可以包含各種崩解劑(例如淀粉)和潤滑劑。本發明的蛋白酶可以被用作纖維或皮革處理劑,并可被用于從絲纖維去除橡膠材料、浸泡皮革等。實施例在下文中,將參照實施例對本發明進行更詳細地說明。對本領域的普通技術人員來說顯而易見的是,這些實施例是示例的目的,并且不應被解釋為限制本發明的范圍。實施例1:衍生自北極假交替單胞菌PAMC21717的蛋白酶(W-Pro21717)的檢測1-1:培養并檢測W-Pro21717的生產在含有葡萄糖的ZoBell培養基(每升,5g蛋白胨、1g酵母提取物、0.01gFePO4、750ml海水和250ml蒸餾水)中在三個溫度條件(5℃、15℃和25℃)下培養北極假交替單胞菌PAMC21717,然后在25℃培養1天。為了測量W-Pro21717的降解活性,培養的PAMC21717細胞在4℃以12,000xg離心30分鐘,上清與含有0.65%偶氮酪蛋白底物的50mM磷酸鈉緩沖液(pH7.6)混合,并在25℃置1小時,然后在向其加入110mM三氯乙酸之后37℃額外反應1小時。離心反應溶液,然后通過具有0.45μm的孔徑的濾器進行過濾,將濾液混合并與Folin&Ciocalteu的苯酚溶液和500mM碳酸鈉溶液37℃反應30分鐘。接著,在660nm基于L-酪氨酸標準曲線測量反應產物的酶活性,將25℃下1納摩爾/min/mg的氨基酸產量定義為蛋白酶的1個活性單位。結果顯示,W-Pro21717的最大活性在15℃為2.7U/ml,在5℃為2.1U/ml,在25℃為1.4U/ml,這表明所述蛋白酶生產的最佳溫度為15℃。1-2:W-Pro21717的酶譜分析和類型北極假交替單胞菌PAMC21717在15℃培養96小時,然后從細胞分離的酶蛋白在包含0.3%脫脂牛奶和1%明膠的10%的SDS-PAGE凝膠上進行電泳。PAGE凝膠與變性緩沖液(27g/LTritonX-100)反應,然后在凝膠用考馬斯亮藍染色之后,與顯影緩沖液(每升蒸餾水,1.21gTris堿、6.3gTris-HCl、11.7gNaCl、0.74gCaCl2、0.02%Brij35)反應30分鐘,并通過酶譜分析檢測蛋白的降解活性。結果顯示,在酶譜中發現了兩個蛋白(37kDa和74kDa)其N末端含有氨基酸序列GAQNSSWH,并且所述氨基酸序列與衍生自假交替單胞菌菌種的許多絲氨酸蛋白酶的序列一致。衍生自北極假交替單胞菌PAMC21717的37kDa和74kDa蛋白被命名為“W-Pro21717”(圖1),具有更高活性的74kDa的蛋白可能是37kDa蛋白的同型二聚體。W-Pro21717的類型通過與各種蛋白酶抑制劑反應來進行分析。結果如下表2中所能看到的,W-Pro21717的活性被PMSF和HgCl2抑制,但不受其它半胱氨酸蛋白酶抑制劑的影響。而且,W-Pro21717的活性略微被金屬蛋白酶抑制劑EDTA抑制。因此,發現二硫鍵對于酶活性是重要的并且W-Pro21717是基于絲氨酸的蛋白酶。表2抑制劑濃度(mM)剩余活性(%)無-100EDTA175±9PMSF140±8HgCl2123±8碘乙酰胺194±3APMA1131±2N-乙基馬來酰亞胺1107±8亮肽素198±2Na-對-甲苯磺酰基-L-賴氨酸氯甲基酮1137±13實施例2:衍生自北極假交替單胞菌PAMC21717的蛋白酶(W-Pro21717)的表征2-1:在溫度和pH條件下W-Pro21717的活性和穩定性在0至60℃的溫度范圍內分析了W-Pro21717活性的最佳溫度,并通過在50mM乙酸鈉(pH2.0-6.0)、50mM磷酸鉀(pH7.0-10.0)和50mM四硼酸鈉(pH10.0)中反應1小時分析了最佳pH。采用3μm市售蛋白酶嘉士伯枯草桿菌蛋白酶作為對照。結果顯示,W-Pro21717在30~40℃的溫度顯示出最高活性并且W-Pro21717活性的最佳溫度為40℃(圖2A)。對照枯草桿菌蛋白酶嘉士伯(subtilisinCarlsberg)在60℃顯示出最佳活性。此外,在大約0℃,W-Pro21717顯示出30%的活性。在40℃反應1小時后,W-Pro21717顯示出活性降低30%(圖2B),但枯草桿菌蛋白酶嘉士伯顯示出活性降低80%。因此,發現W-Pro21717是具有高的低溫活性和穩定性的適冷蛋白酶。W-Pro21717在pH8.0-9.5顯示出高活性,并且在pH9.0顯示出最高活性(圖2C)。此外,它在相對寬的pH范圍(pH5.0-10.0)內顯示出穩定性,但在低于5.0的pH和高于10.0的pH喪失其活性(圖2D)。2-2:在金屬離子和表面活性劑存在下W-Pro21717的活性和穩定性為了分析金屬離子和去污劑的影響,W-Pro21717與含有1mMBaCl2、CuSO4、MgSO4、CaCl2、ZnSO4、FePO4、KCl、NaCl、N2SO4、直鏈烷基苯磺酸鈉(LAS)或SDS的標準緩沖液中冰上反應1小時。此外,采用脫脂牛奶在10℃和30℃的溫度分析W-Pro21717與市售去污劑(LGHousehold&HealthCare,韓國;含有枯草桿菌蛋白酶嘉士伯)的相容性。結果顯示,CuSO4提高了W-Pro21717的活性大約60%,Ba2+、Mg2+、Ca2+、Zn2+、Fe2+、K+和Na2+不影響W-Pro21717的活性(圖3)。此外,在一般市售去污劑的標準成分(Na2SO4和LAS)存在下W-Pro21717顯示出足夠的穩定性。而且,W-Pro21717與一般去污劑的相容性的測量結果表明,W-Pro21717在30℃和10℃分別顯示出54.9±2.2U/mg和20.7±3.4U/mg的活性(圖4)。2-3:W-Pro21717的底物特異性采用5mM每種的以下7種不同的合成肽分析了W-Pro21717的底物特異性:N-琥珀酰-Ala-Ala-Val-對-硝基苯胺(AAV)、N-琥珀酰-Ala-Ala-Pro-Leu-對硝基苯胺(AAPL)、N-琥珀酰-Ala-Ala-Ala-對硝基苯胺(AAA)、N-琥珀酰-Gly-Gly-Phe-對硝基苯胺(GGF)、N-琥珀酰-Thr-Leu-Val-對硝基苯胺(TLV)、N-琥珀酰-Ala-Ala-Pro-Phe-對硝基苯胺(AAPF)和N-琥珀酰-Ala-Ala-Val-Ala-對硝基苯胺(AAVA)。W-Pro21717與含有0.83mM底物的標準緩沖液在25℃反應10分鐘,然后在410nm測量其相對活性。結果如下表3中能夠看到的,W-Pro21717針對AAPF(100%)和AAPL(66.5%)顯示出高活性,并且枯草桿菌蛋白酶嘉士伯也具有100%和68.3%的底物特異性,與W-Pro21717相似。表3:在W-Pro21717和枯草桿菌蛋白酶嘉士伯之間多種底物特異性的比較實施例3:生產衍生自北極假交替單胞菌PAMC21717的適冷蛋白酶(W-Pro21717)的培養優化在該實施例中,為了W-Pro21717生產的統計學優化,通過在15℃分批補料培養確定了生產衍生自北極假交替單胞菌PAMC21717的W-Pro21717的最佳條件。對于碳、氮和礦物培養基的優化,采用了Plackett-Burman設計。結果是,果糖被選為碳源,并且顯示酶活性在含有脫脂牛奶的培養基中為8.0U/L和在不含有脫脂牛奶的培養基中為3.4U/L,這表明脫脂牛奶使酶活增加了2.3倍(圖5A和5B)。氮源對酶活性沒有顯示出差異,但是胰蛋白胨被選為氮源(圖5C),并且當Fe(C6H5O7)、NaCl、Na2SO4和KCl作為礦物源含量分別為0.1、24.8、4.4和0.7g/L的時顯示酶活性增加了3.4倍(圖6)。在含有10g/L脫脂牛奶、0.6g/L胰蛋白胨、0.1g/LFe(C6H5O7)、24.8g/LNaCl、5.9g/LMgCl2、4.4g/LNa2SO4、1.8g/LCaCl2、0.16g/LNaHCO3和0.08g/LKBr的培養基組合物中在15℃進行分批補料培養。在所述培養基中誘導的W-Pro21717的活性為53.4U/L,其至少15倍高于非優化過的培養基中的活性(圖7A和7B)。實施例4:基于W-Pro21717的遺傳信息的重組蛋白酶(R-Pro21717)的構建4-1:含有編碼W-Pro21717基因的載體在該實施例中,采用CopyControlFosmid文庫生產試劑盒(Epicentre)構建北極假交替單胞菌PAMC21717的基因組文庫。在13個具有蛋白水解活性的克隆中,EPI-P38被選中并用8種不同的限制性酶酶切,之后,將其引入pUC19載體,從而獲得具有蛋白水解活性的克隆Rosetta-P38-4。用下面的引物擴增編碼適冷蛋白酶的W-Pro21717基因,然后插入表達載體pEXP5-CT/TOPO,從而構建并選擇具有優異蛋白水解活性的質粒。采用北極假交替單胞菌PAMC21717菌株的染色體DNA作為模板和以下引物組通過PCR擴增W-Pro21717基因:用于pDOC122的SEQIDNos:1和2的引物組,用于pDOC125的SEQIDNos:3和4的引物組,用于pDOC128的SEQIDNos:5和6的引物組或用于pDOC131的SEQIDNos:7和8的引物組。pDOC122SEQIDNOs:1:5'-ATGACAACAAGTAAAACTTTTAAAAGATGCGC-3'SEQIDNOs:2:5'-CACTTAGCGGACAATACCAACCG-3'pDOC125SEQIDNOs:3:5'-ATGCAATCAGTTTCAAGTTCAATGGC-3'SEQIDNOs:4:5'-CACTTAGCGGACAATACCAACCG-3'pDOC128SEQIDNOs:5:5'-ATGACAACAAGTAAAACTTTTAAAAGATGCGC-3'SEQIDNOs:6:5'-GCAGCTGTTGCAGCAGCAAGT-3'pDOC131SEQIDNOs:7:5'-ATGCAATCAGTTTCAAGTTCAATGGC-3'SEQIDNOs:8:5'-GCAGCTGTTGCAGCAGCAAGT-3'4-2:R-Pro21717的表達和純化在該實施例中,分析了衍生自北極假交替單胞菌PAMC21717的蛋白酶(W-Pro21717)的重組蛋白R-Pro21717的功能。過表達實施例4-1中所構建的四個質粒,通過在10%SDS-PAGE凝膠上的酶譜分析了R-Pro21717的包涵體(IB)。結果是,沒有觀察到72.6kDa的pDOC122和49.7kDa的pDOC128蛋白的表達。但是,觀察到了69.9kDapDOC125和47kDapDOC131的表達(圖8A)。最終選擇了在酶譜分析中顯示出顯著高蛋白水解活性的pDOC131。在含有氨芐青霉素的LB培養基中培養含有pDOC131的大腸桿菌BL21star(DE3)pLysS。當達到1.0的OD600時,向細胞加入IPTG,然后細胞培養24小時,從而誘導R-Pro21717重組蛋白的表達。離心細胞,用解折疊緩沖液洗滌被解折疊的IB(包涵體)。用重折疊緩沖液稀釋被解折疊的蛋白溶液,并通過FPLC透析和純化。純化的蛋白是具有蛋白水解活性的Pro21717重組蛋白。可以觀察到重組蛋白的不溶性部分而不是水溶性部分的表達,在重折疊過程中發生大小的轉變(shift)。在48小時的重折疊之后蛋白從50kDa變成37kDa并且在72小時的重折疊之后變成63kDa(圖8B)。可以看到,W-Pro21717的酶活性是42.1±3.5U/mg,但R-Pro21717重組蛋白的酶活是116.4±2.7U/mg,其是W-Pro21717的2.8倍。通過尺寸排阻色譜法純化重折疊的蛋白酶,從而構建顯示酶活為268.6±7.5U/mg(其是W-Pro21717的6.4倍)的R-Pro21717重組蛋白(圖8C)。實施例5:重組蛋白酶(R-Pro21717)的活性和穩定性5-1:溫度和pH的影響在該實施例中,分析了在低溫和高pH下R-Pro21717的活性和穩定性。為了確定蛋白酶活性最佳的溫度,使R-Pro21717在0~70℃的不同溫度下進行反應,然后進行分析。通過使R-Pro21717在0~70℃的不同溫度下1小時分析R-Pro21717針對溫度的穩定性,然后將R-Pro21717與含有0.65%的偶氮酪蛋白的標準緩沖液在30℃反應30分鐘。嘉士伯枯草桿菌蛋白酶用作對照酶。為了確定蛋白酶活性最佳的pH,將具有不同pH的含有R-Pro21717的緩沖液在30℃進行反應,然后對其進行分析。通過將具有不同pH的含有R-Pro21717的緩沖液在冰上反應1小時,然后R-Pro21717在含有0.65%的偶氮酪蛋白的標準緩沖液在30℃反應30分鐘,分析R-Pro21717針對pH的穩定性。嘉士伯枯草桿菌蛋白酶用作對照酶,并在40℃的反應溫度下進行分析。結果顯示R-Pro21717蛋白酶在范圍從30至40℃的溫度下顯示出最高活性,并且R-Pro21717蛋白酶的活性最佳的溫度為30℃,并且在0℃,R-Pro21717蛋白酶顯示出在30℃的最高活性的50%的蛋白水解活性(圖9A)。但是,對照酶嘉士伯枯草桿菌蛋白酶在60℃顯示出最高活性,并且與其顯示最高活性的60℃相比在0℃并未顯示出蛋白水解活性。此外,顯示R-Pro21717蛋白酶針對溫度的穩定性在20℃或更高處降低(圖9B),并且對照酶嘉士伯枯草桿菌蛋白酶在50℃或更高處顯示出酶活的降低。此外,顯示R-Pro21717蛋白酶在pH9.0顯示出最高活性(圖9C),所述酶的穩定性的最佳pH為5.0-11.0(圖9D),并且對照酶嘉士伯枯草桿菌蛋白酶(堿性酶)也顯示出與R-Pro21717相同的結果。5-2:金屬離子和表面活性劑的影響在所述實施例中,分析了在金屬離子和表面活性劑存在下R-Pro21717蛋白酶的活性和穩定性。通過將R-Pro21717加入含有CaCl2、CuSO4、NaCl、N2SO4、LAS、SDS、PMSF或1%H2O2的標準緩沖液進行分析,使混合物在冰上反應1小時,然后向其加入0.65%的偶氮酪蛋白(圖10)。結果顯示,在金屬離子和表面活性劑的存在下,R-Pro21717蛋白酶的活性和穩定性比諸如對照酶嘉士伯枯草桿菌蛋白酶的一般去污劑酶更好。5—3:底物特異性在所述實施例中,分析了在合成肽底物存在下R-Pro21717蛋白酶的活性。結果顯示R-Pro21717蛋白酶顯示出與對照酶嘉士伯枯草桿菌蛋白酶相似的活性,并且在包括膠原蛋白和角蛋白的復雜底物的存在下顯示出相對低的活性(表4)。因此,發現根據本發明的衍生自北極假交替單胞菌PAMC21717的適冷蛋白酶在低溫下顯示高活性,并甚至在包含于去污劑組合物中的各種金屬離子和表面活性劑存在下可靠地保持其酶活。這表明衍生自北極假交替單胞菌PAMC21717的適冷蛋白酶能夠被用于各種工業應用。表4實施例6:生產重組蛋白酶(R-Pro21717)的培養優化在該實施例中,為了優化重組蛋白酶R-Pro21717的生產,通過分批型培養和分批補料培養確定了在實施例4中制備的重組微生物中生產R-Pro21717的最適條件。在含有葡萄糖、KH2PO4、(NH4)2PO4、檸檬酸、MgSO47H2O、硫胺素、抗生素和痕量金屬元素的培養基中在37℃進行培養,然后當由于葡萄糖的完全消耗導致培養基的pH和DO上升時,進行至少15小時的pH-穩定分批補料同時加入含有葡萄糖、酵母提取物、(NH4)2PO4、MgSO47H2O和抗生素的預先確定量的培養基,從而表達適冷蛋白酶。以這種方式,R-Pro21717的生產得到優化。實施例7:適冷蛋白酶的結晶和結構分析純化的蛋白酶被濃縮至250mg/ml的濃度,然后采用坐滴蒸發擴散法在20℃進行結晶。針對結晶,采用0.81μl的蛋白溶液(含有250mg/ml蛋白、20mMTris-HCl(pH8.0)和150mMNaCl)和0.81μl的防腐溶液(0.1M乙酸鈉(pH4.4)和3M氯化鈉)的蛋白溶液。單晶以針的形式生長,這樣2天后最長的軸具有大約0.5mm或更小的長度。對于低溫試驗,蛋白酶晶體被浸入paratone油中,并且2分鐘后,浸入液氮中。在浦項加速實驗室(韓國浦項)的7A光束以的分辨率對X射線衍射數據進行分析并采用HKL2000程序進行索引。結果顯示蛋白酶晶體具有P212121空間群,晶胞尺寸為和蛋白酶晶體具有下表5和上表1中所示的原子坐標。此外,通過分子替換方法采用MOLREP程序和AprV2結構(PDB碼3LPA)作為模板分析了晶體的結構,并采用REFMAC5和Coot程序進行結構的細化。所述蛋白酶的整體結構具有枯草桿菌蛋白酶樣折疊并由環繞中央6個β-鏈和兩個β-鏈的十個α-螺旋組成。酶促活性位點是由催化三聯體組成的,所述催化三聯體由三個殘基(Asp159、His218和Ser399)組成。因此,可以從所述蛋白酶的結構信息發現所述蛋白酶是基于絲氨酸的蛋白酶。此外,所述蛋白酶具有協助蛋白酶的穩定的四個鈣離子鍵(圖11)。表5雖然本發明已經參考具體的特征進行了詳細描述,對本領域技術人員來說顯而易見的是,該說明書僅為優選的實施方案并非限制本發明的保護范圍。因此,本發明的實質保護范圍將由所附的權利要求書及其等同物定義。當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1