分析信號通路的活化狀態的方法和利用此方法選擇個性化藥品的方法與流程
本發明涉及一種通過實時單分子蛋白-蛋白的相互作用分析來分析從受試者分離的細胞或組織中信號通路的活化狀態的方法以及利用此方法選擇個性化藥品或預測藥品的治療效果的方法。
背景技術:
最近,對疾病的個性化診斷、預后預測以及治療主要集中于基因分析。但是,包括癌癥的特定疾病的發病原因是由于構成人體的細胞的異常活動,更具體而言是由于構成細胞并調節細胞的多種蛋白之間的異常相互作用而引起的。因此,僅通過基因分析來單獨觀察蛋白無法提供更多的指導。事實上,通過基因分析具有同樣基因特征的患者,對靶向抗癌劑具有不同的易感性,并且他們的預后也不同。在單分子水平上蛋白-蛋白相互作用的分析,可提供關于細胞內信號網絡如何變化的更準確信息,而且還能提供特定癌癥的發展和特性以及其治療方法的信息。
最近,通過引入個人的基因分析進行考慮個體患者的特性的個性化診斷及個性化藥品的研究。但是,如上所述,因疾病的性質由蛋白-蛋白相互作用引起的細胞活動所決定,因此,需要研究通過蛋白相互作用形成的信號網絡,為了相對于在基因水平上分析每個蛋白的零碎方法的更準確的理解。為了充分理解生命現象,在分子及相互作用的網絡水平上理解信號轉導是必要的。例如,即便具有相同基因突變的患者,對同樣的靶向藥品也會顯示出不同的反應,因為細胞信號轉導基于復雜的蛋白-蛋白相互作用。相同的癌癥蛋白表達可能誘導不同的信號通路。
蛋白-蛋白相互作用的準確分析是診斷疾病、預后評價及藥品開發的重要基礎。常規技術基于測量活性和理解相互作用的方法驗證蛋白的相互作用。例如,使用利用X射線結晶法等驗證在原子水平上與相互作用相關的氨基酸殘基或原子的方法、利用酵母雙雜交體系等確認兩個蛋白之間的二元相互作用的方法、通過免疫沉淀及質量分析來確定復合體相互作用的方法。除了這些生物體外方法之外,還使用熒光共振能量轉移法(FRET,Fluorescence Resonance Energy Transfer)以及雙分子熒光互補法(BiFC,Bimolecular Fluorescence Complementation)的細胞內分析方法。
但是,在色譜分析的情況下,因為蛋白質被純化之后進行分析,在單一分子水平上很難確認與混合有其他蛋白等的實際細胞環境中類似的蛋白之間的相互作用。在酵母雙雜交體系的情況下,因細胞的混合蛋白表達而引起的轉錄活性的影響,分析的準確度也會不同。FRET法是使用熒光轉移至相鄰部分的方法,因此,僅在產生熒光轉移時蛋白之間的結合才有可信性,故有成功率低的缺點。尤其,蛋白的結合在短時間內以較弱的結合出現時,不斷被提出由上述的方法是不能準確地測定的缺點。
因此,需要準確地分析蛋白之間的相互作用,進而在復雜的環境中預測疾病的途徑,從而能找出并篩選個性化靶向藥品的新的方法。
遍及本說明書,參考并引用了許多論文及專利文獻。在本說明書中作為參考引用的論文及專利文獻的公開內容,使得更加明確地說明本發明所屬領域的技術水平及本發明的內容。
技術實現要素:
鑒于上述的問題,本發明人開發了以能同時實時分析信號路徑上的靶蛋白和其他蛋白之間的蛋白-蛋白相互作用的方法為基礎的分析細胞或組織中信號通路的活化狀態的方法及利用此方法的選擇個性化藥品的方法。
因此,本發明的目的是提供一種分析從受試者分離的細胞或組織中信號通路的活化狀態的方法。
本發明的另一目的是提供一種選擇個性化藥品的方法。
本發明的另一目的是提供一種預測對藥品的治療反應性的方法。
本發明的其他目的及優點從下面的本發明的詳細說明、權利要求以及附圖將會更加明顯。
根據本發明的一個方面,提供了分析從受試者分離的細胞或組織中信號通路的活化狀態的方法,其包括下述步驟:
(a)通過用包括第一蛋白的細胞或組織的提取物處理基板,使從受試者分離的信號通路中的第一蛋白固定在基板上;
(b)通過向基板提供與第一蛋白相互作用的熒光標記的第二蛋白,誘導形成第一蛋白與熒光標記的第二蛋白的復合體;以及
(c)基于第二蛋白的熒光標記的熒光信號來分析第一蛋白和第二蛋白之間的相互作用,以及信號通路的活化狀態。
本發明人開發了一種基于同時實時分析信號通路中靶蛋白和其他蛋白之間的蛋白-蛋白相互作用的方法,分析細胞或組織中信號通路的活化狀態的方法,以及利用此方法選擇個性化藥品的方法。
下面,將詳細描述本發明。
(a)將第一蛋白固定在基板上
在步驟(a)中,通過用包括第一蛋白的細胞或組織的提取物處理基板,使信號通路中的第一蛋白固定在基板上。
根據本發明的示例性實施方式,第一蛋白的固定可通過將第一蛋白固定至預先固定在基板上的抗第一蛋白抗體而實現。在這種情況下,與抗體結合的第一蛋白的抗原決定部位和與第二蛋白結合的第一蛋白的結合部位優選間隔預定的距離。
根據本發明的另一示例性實施方式,基板是涂層聚乙二醇的石英載玻片。
包括第一蛋白的細胞或組織可為正常細胞或正常組織,但是也可以為異常細胞或異常組織。
根據本發明的示例性實施方式,細胞或組織的提取物是癌細胞或癌組織的提取物。本發明通過使用裂解從受試者(例如癌患者)中分離的癌細胞或癌組織而得到的細胞或組織的提取物,而沒有復雜的預處理過程來進行分析,可以縮短時間和工作量。細胞提取物可以是細胞原液,或稀釋的細胞質原液或稀釋的細胞原液。
對于細胞溶解,可利用物理方法、化學方法、酶方法等而沒有限制。
根據本發明的示例性實施方式,為了去除未固定在基板上的第一蛋白,在進行步驟(b)之前進行洗滌過程。洗滌可利用通常的洗滌緩沖液(例如,PBS)來進行。
根據本發明的示例性實施方式,第一蛋白是膜蛋白。
根據本發明的示例性實施方式,膜蛋白是受體。在這種情況下,本發明通過分析信號通路的起始點的受體以及與受體相互作用的多種蛋白之間的相互作用,可以確定活化的通路。
受體可以是受體酪氨酸激酶、Toll樣受體以及G蛋白偶聯受體,但不限于此。
根據本發明的示例性實施方式,受體酪氨酸激酶選自由表皮生長因子受體(EGFR)、人表皮生長因子受體2(HER2)、人表皮生長因子受體3(HER3)、人表皮生長因子受體4(HER4)以及肝細胞生長因子受體(HGFR,c-MET)組成的群。
根據本發明的示例性實施方式,當第一蛋白為受體酪氨酸激酶時,下面詳細描述的第二蛋白可選自由ρ85α、STAT3、Grb2和PLCγ組成的組。例如,當第一蛋白為EGFR時,第二蛋白可選自由ρ85α、STAT3、Grb2和PLCγ組成的組。當第一蛋白為HER2或HGFR時,第二蛋白可選自由ρ85α、Grb2及PLCγ組成的組,并且當第一蛋白為HER3時,第二蛋白可為ρ85α。
(b)誘導第一蛋白和熒光標記的第二蛋白之間形成復合體
在步驟(b)中,向基板提供與第一蛋白相互作用的熒光標記的第二蛋白,以誘導形成第一蛋白和熒光標記的第二蛋白的復合體。
根據本發明的示例性實施方式,第二蛋白是位于第一蛋白下游的蛋白。
根據本發明的示例性實施方式,第二蛋白可以以包含在提取物中的形式提供至基板。例如,可以向基板提供裂解細胞而獲得的細胞提取物,所述細胞以熒光標記的形式表達作為第一蛋白下游的蛋白的第二蛋白。為了獲得包含熒光標記的第二蛋白的細胞提取物,可通過基因修飾細胞,在細胞中表達熒光標記的第二蛋白。例如,將編碼第二蛋白的全長ORF或部分的多核苷酸引入編碼熒光基因的載體來制備重組載體,接著利用重組載體轉化適當的宿主細胞(例如,哺乳動物細胞)而表達熒光標記的第二蛋白。就轉化的方法而言,可使用電穿孔、質粒融合、磷酸鈣(CaPO4)沉淀、氯化鈣(CaCl2)沉淀、利用碳化硅纖維進行攪拌、農桿菌介導的轉化、PEG、硫酸葡聚糖、脂質體及干燥/抑制介導的轉化方法等。作為另一例子,還可以利用物理化學方法將第二蛋白進行熒光標記。
熒光標記可以為,例如綠色熒光蛋白(GFP)、黃色熒光蛋白(YFP)、藍色熒光蛋白(BFP)、青色熒光蛋白等。
根據本發明,當將包含第二蛋白的細胞提取物提供至附著有第一蛋白的基板的表面上時,則基板表面的第一蛋白將與第二蛋白以與共同存在第二蛋白和其他蛋白的細胞內環境類似的方式相互作用。這意味著本發明的分析方法可在與細胞內環境相同的條件下觀察蛋白-蛋白相互作用。即,通過檢測第二蛋白中標記的特定波段的熒光信號,可在與細胞內環境相同的環境下分析第一蛋白與第二蛋白之間的相互作用。在本發明中,因為第一蛋白和第二蛋白彼此相互作用,并且是信號通路中相鄰的蛋白,因此通過本發明能分析實際細胞中信號通路的活化狀態。
(c)通過分析第一蛋白和第二蛋白之間的相互作用來分析信號通路的活化狀態。
在步驟(c)中,基于第二蛋白的熒光標記的熒光信號,來分析第一蛋白和第二蛋白之間的相互作用和信號通路的活化狀態。
第一蛋白和第二蛋白之間的相互作用的分析可利用產生近場的光學裝置測定由熒光標記的第二蛋白發出的特定波長的熒光信號來進行。即,利用全內反射顯微鏡等產生近場的光學裝置來觀察基板的表面,分析基板表面上的第一蛋白和熒光標記的第二蛋白之間的結合與分離的頻率等的相互作用,可以確認第一蛋白和第二蛋白之間的相互作用。
根據本發明的示例性實施方式,利用全內反射顯微鏡進行第一蛋白和第二蛋白之間的相互作用的分析。在這種情況下,可在形成第一蛋白和第二蛋白的復合體的步驟中實時測量熒光信號。與常規的一般免疫沉淀方法不同,本發明將實時分析單分子蛋白-蛋白相互作用的免疫沉淀和熒光成像結合的方法在反應腔中實時進行未純化的細胞或組織提取物的單分子成像,并且可實時確認單分子水平上的結合。
根據本發明的示例性實施方式,熒光信號的分析可以在預定的時間內對代表熒光標記的特定波長熒光信號進行積分和測量。即,通過全內反射顯微鏡測定到基板表面的波長變化時,可在預定的時間內對波長變化進行積分。
利用本發明的方法,可以確認(分析)從受試者,包括人受試者中分離的細胞或組織中信號通路中活化的通路。在下面的實施例中,利用來自癌癥患者的各種癌細胞系和組織來分析已知與癌癥密切相關的EGFR和其下游蛋白的ρ85α、STAT3、Grb2以及PLCγ之間的相互作用。確認了每個細胞系或癌組織與正常組織之間EGFR的活性水平存在差異(見實驗例3和4)。進一步,在下面的實施例中,通過靶向各種癌細胞系,分析了EGFR之外的其他RTK和其下游蛋白之間的相互作用(見實驗例5和6)。這種結果顯示通過本發明的方法可以發現從各個受試者中分離的細胞或組織處于特別活化狀態的信號通路,并且顯示基于分析的信號通路的活化狀態預測各個受試者的疾病的預后,選擇適合各個受試者特性的藥品(例如,靶向活化的信號通路的藥品)等,個性化的預后預測及治療是可能的。
根據本發明,本發明可選擇與第一蛋白相互作用的一種蛋白作為第二蛋白,或也可使用如下面實驗例3所描述的與第一蛋白相互作用的各種蛋白。例如,在分析第一蛋白與其各種下游蛋白(多種第二蛋白)之間的相互作用的情況下,可將多種第二蛋白同時或依次提供至基板。例如,在將第二蛋白依次提供至基板的情況下,首先在分析提供的第二蛋白和第一蛋白之間的相互作用完成之后,通過洗滌過程去除分析的第二蛋白,然后可進行其他的第二蛋白提供至基板的過程。
具體而言,根據本發明的示例性實施方式,在將各種第二蛋白依次提供至基板的情況下,本發明的方法在步驟(c)之后進一步包括將與在步驟(b)和(c)中分析相互作用使用的第二蛋白不同的蛋白(與第一蛋白相互作用)作為第二蛋白重復執行步驟(b)和(c)的步驟(d)。在這種情況下,在分析第二蛋白和第一蛋白之間的相互作用之后,可通過洗滌過程去除第二蛋白之后,將不同類型的第二蛋白提供至基板,再次分析與第一蛋白的相互作用。因為將第一蛋白固定在基板的過程只進行一次,就能分析與各種第二蛋白的相互作用,因此,使用少量的樣品進行分析是可能的。考慮到人體組織的提取量非常有限并且不存在用于蛋白的擴增方法,比如PCR等,這非常有利。
在本發明中,可使用各種第一蛋白和各種第二蛋白進行步驟(a)至(c)。即,本發明可通過在將多種第一蛋白(靶蛋白)固定在基板上之后,通過處理與第一蛋白相互作用的多種第二蛋白(候選蛋白,例如第一蛋白的下游蛋白),分析第一蛋白與第二蛋白之間的相互作用。例如,在將各種第一蛋白固定在附著有各種抗體的基板上之后,將第一蛋白和第二蛋白分別設置為X軸和Y軸,并且基于熒光信號分析蛋白之間的相互作用。將第一蛋白的數量調整至平行線,以形成微流體通道。使用根據第一蛋白的數量的抗體,將微流體通道固定在基板上。通過第二蛋白的數量在垂直線上形成通道。可以使用雙層結構,第二個微流體通道可堆疊在用作交叉反應點的第一個微流體通道的頂部。可選地,可在安裝第二個微流通道之后,以可連接或可拆開的方式施加第一個微流體通道。根據本方法,由于獨立反應腔中的獨立反應,可分析相互作用的模式。圖9是相互作用分析方法的示意圖,并且圖10顯示了基于熒光信號,分析第一蛋白-第二蛋白之間的相互作用。紅色信號表示活化程度最強的蛋白之間的結合。通過本發明,可以確認從各個患者提取的細胞或組織中活化的特定信號通路(特定蛋白之間的結合),因此,能提前預測各個患者對藥物的耐性并且通過選擇能夠獲得最佳治療效果的靶向藥品,使個性化治療成為可能。
進一步,常規的基因分析是側重于細胞信號轉導上的節點(node),而本發明則注重連接節點的線。一個節段可擁有多個節點,一個上游蛋白可與多個下游蛋白關聯,一個下游蛋白可與很多上游蛋白關聯。本發明可以全方位地觀察一個上游蛋白在細胞信號通路中如何會聚和分支。
根據發明的另一方面,本發明提供了選擇個性化藥品的方法,其包括下述步驟:
(a)通過上面提到的方法,分析從受試者分離的細胞或組織中信號通路的活化狀態;以及
(b)檢索靶向在步驟(a)中確認的活化的信號通路藥品,選擇檢索到的藥品作為個性化藥品。
上面已經闡釋了使用分析從上面提到的受試者中分離的細胞或組織中的信號通路的活化狀態的方法的步驟(a)。
在步驟(b)中,基于步驟(a)的分析結果檢索靶向活化的信號通路的藥品。例如,在使用各種第一蛋白和各種第二蛋白進行分析從上面提到的受試者中分離的細胞或組織中的信號通路的活化狀態的方法之后,確認了從受試者中分離的細胞或組織中活化的特定信號通路或特定蛋白之間的結合。然后檢索靶向確認的信號通路或蛋白的藥品,并且可將該藥品選擇作為個性化藥品。
例如,就步驟(b)中選擇個性化藥品的方法而言,在從已知靶向步驟(a)中確認的活化的信號通路藥品中選擇個性化藥品,或測試品在步驟(a)中確認的信號通路被活化的細胞系或組織中被處理之后,通過驗證測試品是否抑制信號通路的活化,或候選藥物是否抑制細胞系或組織的生長等的篩選過程,選擇個性化藥品。測試品可以使用低分子量化合物、高分子量化合物、核酸分子(例如DNA、RNA、PNA以及適配體)、蛋白、糖、脂質和天然物質等。
根據本發明的示例性實施方式,藥品是抗癌劑。
根據本發明的另一方面,本發明提供了預測藥品的治療效果的方法,其包括下述步驟:
(a)通過使用上面提到的方法分析從要預測藥品的治療效果的人中分離的細胞或組織中的信號通路的活化狀態;以及
(b)基于在步驟(a)中確認的有關信號通路的活化狀態的分析信息,預測靶向信號通路的藥品的治療效果。
在步驟(a)中,從預測的人分離細胞或組織之后,分析分離的細胞或組織中的信號通路的活化狀態。上面已經描述了步驟(a)中分析信號通路的活化狀態的方法,而不再進一步闡釋。
例如,在治療癌癥時,經常使用靶向特定信號通路(如,EGFR通路、HER2通路等)的抗癌劑進行治療。但是,每個人被抗癌劑靶向的信號通路的活化程度不同,尤其,當抗癌劑靶向的信號通路處于失活狀態,或活化程度較低時,難以從抗癌劑得到治療效果。因此,在施用抗癌劑之前預測對抗癌劑的治療效果并且選擇適當的治療方法和藥物是重要的。利用本發明的方法,可提前預測抗癌劑的治療效果。
在步驟(b)中,基于有關信號通路的活化狀態分析信息,預測靶向信號通路的治療劑的治療效果。在下面的實驗例6中,確認了每個癌細胞系的信號通路的活化程度有差異,并且靶向信號通路的抗癌劑的敏感性也有差異。通過這些結果,確認了基于根據本發明的方法分析的信號通路的活化信息,可提前預測靶向信號通路的靶向抗癌劑對受試者的治療效果。
根據本發明的示例性實施方式,藥品是抗癌劑,并且抗癌劑是靶向特定信號通路的靶向抗癌劑。
有益效果
下面總結了本發明的特點以及優點:
(i)本發明涉及分析從受試者中分離的細胞或組織中的信號通路的活化狀態的方法,以及利用此方法選擇個性化藥品或預測對藥品的治療效果的方法。
(ii)本發明的方法是個性化診斷以及藥品治療的新方法,并且可分析靶向藥品如何影響信號通路以及患者。
(iii)本發明通過分析特定疾病的信號如何會聚及分支,不僅能全方面地理解信號通路,而且通過確認在整個信號網絡中哪個信號出現歪曲,而用作開發個性化藥品的平臺。最近出現了癌組織對靶向抗癌劑的耐性問題,但是預期,通過本平臺可預測到耐性,并且設計針對耐性的二線藥品,以大大降低癌癥的復發。
附圖說明
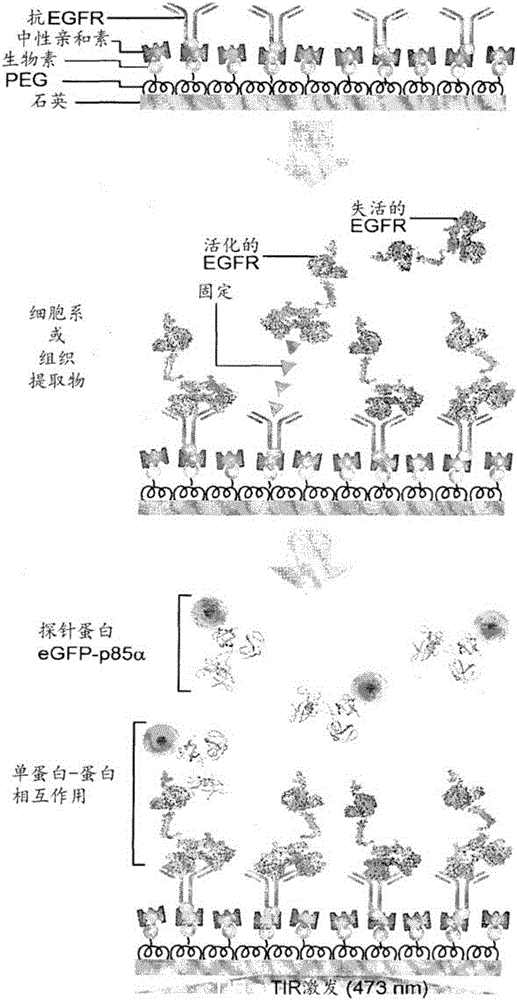
圖1示出了在以下實驗例中使用的實驗是示意圖。
圖2示出了在以下實施例中使用的觀測系統的構造圖。
圖3示出了對單分子熒光分子的觀測以及定量化的結果。
圖4示出了EGFR與其下游蛋白以及探針蛋白之間的替換而產生的熒光信號強度。
圖5示出了活化的EGFR與失活的EGFR的熒光信號強度。
圖6示出了在12種肺癌細胞系中EGFR和ρ85α之間的相互作用程度。
圖7示出了基于各個細胞系中EGFR與其下游蛋白之間的相互作用程度的相對強度。
圖8示出了來自同一患者的癌組織和正常組織中EGFR的活化程度。
圖9示出了靶蛋白(第一蛋白)和候選蛋白(第二蛋白)之間的結合圖。
圖10示出了利用圖9的方法測定的信號通路的熒光信號。
圖11示出了各個乳腺癌細胞系中HER2和其下游蛋白之間以及HER3和其下游蛋白之間的相互作用程度的相對強度。
圖12示出了基于各個肺癌細胞系中HGFR(c-MET)與其下游蛋白之間的相互作用程度的相對強度。
圖13a示出了基于各個細胞系中EGFR和其下游蛋白之間、HGFR和其下游蛋白之間,以及HER2和其下游蛋白之間的相互作用程度的相對強度。
圖13b示出了各個細胞系對作為EGFR靶向抗癌劑的吉非替尼(Gefitinib)的反應性。
圖13c綜合示出了與圖13a示出的EGFR的Grb2的相互作用程度和圖13b測定的各個細胞系對靶向抗癌劑的敏感性。
具體實施方式
下面通過實施例更加詳細地闡釋本發明。這些實施例僅僅為了更加詳細地描述本發明,對本領域技術人員顯而易見,本發明的范圍并不局限于這些實施例。
實施例
實施例1.提取物緩沖液的制備
將150mM NaCl、1mM EDTA和l%(vol/vol)Triton100溶于蒸餾水中,以制備裂解緩沖液。制備2倍濃縮的原料緩沖液,儲存在4℃冰箱中。制備細胞提取物之前,利用2倍濃縮的原料緩沖液以所述的最終濃度稀釋裂解緩沖液。此時,分別添加蛋白酶抑制劑(Sigma P8340,Sigma)和磷酸酶抑制劑(P5726,Sigma),抑制細胞提取物中存在的蛋白酶和磷酸酶的功能。對每5mg/ml的細胞提取物的各抑制劑以1:100的濃度稀釋。確定提取物的量,從而細胞系提取物或組織提取物的最終濃度為5mg/ml至10mg/ml。一般,將5×106個細胞溶解在200μl的裂解緩沖液中時,能制備約6mg/ml至10mg/ml的總蛋白量,并且將20mg的人肺組織溶解在1ml的裂解緩沖液中時,能制備10mg/ml至13mg/ml的總蛋白量。
實施例2.靶蛋白(第一蛋白)的制備
靶蛋白是指通過本發明分析特性的靶蛋白。在下述實驗例中,作為致癌蛋白之一的EGFR、HER2、HER3或HGFR用作靶蛋白。直接從細胞系或實際患者的組織樣品中提取使用沒有經過熒光標記或利用Tag的提純等過程的天然蛋白。為了從細胞系制備靶蛋白,重復進行將實施例1中制備的適量裂解緩沖液加入細胞系中,并且通過100-200μl的吸液管均勻釋放聚集的細胞系的過程。所有反應在冰塊上進行。然后,將制備的樣品在冰上溶解30分鐘。為了從組織中制備靶蛋白,利用手術刀將組織剪成小塊,通過增加組織和裂解緩沖液接觸面積使細胞容易裂解。這里,加入適量的裂解緩沖液,并且利用1ml吸液管混勻釋放。然后,利用機械勻漿器(IKA,cat.No.3737000)將組織磨碎。反應30分鐘后,將組織在10,000g×下4℃下保持10分鐘,離心分離。去除沉淀的部分(pellet),只取溶液部分。此溶液部分包括要觀察的靶蛋白和其它蛋白。然后,在進行所有實驗期間,將提取物儲存在冰中,以最穩定的狀態儲存蛋白。利用DC蛋白定量檢測試劑盒(Bio-Rad,#500-0111)或蛋白定量試劑盒測定細胞或組織的提取物中的蛋白總量。
實施例3.探針蛋白(第二蛋白)的制備
探針蛋白使用與靶蛋白相互作用的伴侶蛋白作為熒光標記的蛋白。將整個探針蛋白(全長ORF)或預定結構域加入具有好的熒光特性的eGFP載體(pEGFP-C1載體,Clontech),以制備eGFP-探針蛋白形式的質粒。將質粒通過電穿孔方法注入HEK293細胞中,使探針蛋白表達,并且接著獲取細胞,存儲在-80℃下。制備探針蛋白的過程與實施例2中制備靶蛋白的過程相同。但是,因為探針蛋白附著有eGFP,因此,為了測定表達的探針蛋白的量,需利用熒光強度測定儀(Fluorometer;Perkin Elmer Enspire2300)檢測表達的熒光蛋白的量,來定量包括了多少探針蛋白。
實施例4.靶蛋白的固定
利用全內反射熒光顯微鏡(TIRFM)進行了測量。為此,在由石英載玻片制作的基板上涂布用于捕獲的聚乙二醇(PEG)以及生物素-PEG。為了洗滌,將在基板上形成的腔室用200μl的PBS連續洗滌兩次,并且在每個腔室中分別注入50μl的中性親和素(neutravidin)。將該中性親和素蛋白通過結合基板表面上的生物素而附著至表面。使中性親和素蛋白在室溫下反應5分鐘后,接著用上述方法洗滌。將針對靶蛋白的抗體(對于EGFP,EGFR Ab-10,克隆111.6生物素標記的鼠單克隆抗體;Thermo Scientific,#MS-378-B)注入在基板上并固定。之后,將包含靶蛋白的提取物(細胞提取物或組織提取物)注入至基板(濃度范圍:0.1mg/ml至10mg/ml;反應時間;至少10分鐘至30分鐘)。然后,利用200μl的PBS連續洗滌2次(圖1)。
實施例5.探針蛋白的注入及檢測
將包含熒光標記的探針蛋白的細胞提取物注入至固定有適當濃度的實施例4的靶蛋白的基板上。在利用全內反射熒光顯微鏡的情況下,50nM eGFP是能正常觀測的閾值濃度值。閾值濃度值可根據光學觀測設備及基板的形式而改變(圖1的最后步驟)。然后,利用全內反射顯微鏡觀察基板。為了觀測蛋白的相互作用,利用50ms的曝光時間測定短時間內發生的信號。圖2是包括基板、顯微鏡以及分析程序的觀測系統的構造圖。
將注入探針蛋白的基板利用熒光顯微鏡實時記錄約5秒(0.05秒曝光時間,100幀)。利用單分子熒光蛋白觀測算法觀測在預定幀上與表面的靶蛋白結合的探針蛋白的數量。一般而言,平均3至10幀產生一個圖像,并且通過分析這圖像測定單分子信號的數量。在測定幀數的過程中,首先通過實時分析單分子蛋白的相互作用,分析兩個蛋白的相互作用的動力學(圖3的第一張圖)。當測量了兩個蛋白多長時間結合或多長時間彼此分離時,就測定了平均幀數。在該實驗中,5幀(250ms)測定為最適合的平均幀數(圖3的第二張圖),以25幀單位為準計算。例如通過平均1至5幀,之后25至29幀、50至54幀、75至79幀,總共形成4個數據點。
找到了最合適的平均幀的起點。這是基于表示陽性對照組(固定有靶蛋白的表面)和陰性對照組(只固定有一級抗體的表面)之間最大的差異的點進行的。從最合適的時間,測定第75幀(圖3的第三張圖)。在一個腔室中移動位置收集5個數據,以通過計算總平均值和標準偏差制作一個數據。改變靶蛋白的提取物的濃度,重復上述的過程,以比較各種樣品中靶蛋白的活化程度。
實施例6.探針蛋白的替換
本發明的優點在于在一個制備的基板上能簡單地施加各種探針蛋白(第二蛋白)。如EGFR蛋白具有各種下游信號通路,因此,測定多個信號通路對于確定生物信息傳遞的起到重要的作用。此外,靶蛋白只要制備一次即可,因此,具有可以使用少量細胞提取物或組織提取物的優點。下面詳述探針蛋白的替換過程。一個探針蛋白的測定結束后,通過洗滌過程去除腔室中殘留的蛋白,然后,注入其他探針蛋白,重復前面的測定過程。
一方面,檢查前面的探針蛋白是否妨礙下一個探針蛋白的觀測的結果。當引入下一個探針蛋白時,殘留的第一個探針蛋白也已經通過競爭結合被分離(圖4的最后一張圖)。結果顯示,通過僅替換探針蛋白,也可以在短時間內測定一個靶蛋白和多個探針蛋白。
實驗例1.EGFR的活化狀態分析
在本發明中,使用歸類為最常見致癌膜蛋白中受體酪氨酸激酶(RTK)的表皮生長因子(EGFR),以研究實驗的適用性,并且收集實際數據。根據上述方法進行實驗過程。
使用表達正常的EGFR稱為肺癌細胞系的NCI-H1666細胞系。EGFR是被稱為EGF的配體磷酸化,以與下游信號蛋白相互作用。在本實驗中,使用通過eGFP與ρ85α結合形成的eGFP-ρ85α作為探針蛋白,ρ85α是EGFR的代表性的下游信號蛋白磷酸肌醇(3-激酶(PI3K)的子單元。首先,將H1666細胞系分兩組培養。通過無血清培養基將H1666細胞系饑餓24小時。此時,因為培養基沒有營養,細胞停止生長,已知EGFR處在未磷酸化的狀態。然后,用100ng/ml的EGF對一組細胞處理3分鐘。這是對EGFR賦予活化信號的外部因素,使EGFR變成磷酸化狀態。收集兩個組的細胞系之后,觀察兩個細胞系的EGFR狀態。
如圖5所示,在具有磷酸化EGFR的細胞系中,圖表的斜率陡,但是在失活的細胞系中,過程到了相對平緩的斜率(圖5)。結果顯示,通過本發明測定的斜率值可作為細胞中多少靶蛋白被活化的指標。
實驗例2.利用ρ85α分析各種非小細胞肺癌細胞系的EGFR的活化程度
利用eGFP-ρ85α探測蛋白對總共12個非小細胞肺癌(NSCLC)細胞系(從American Type Culture Collection獲得H1975、H1650、HCC827、H4006、H358、H1666、H2291及A549;從延世大學附屬醫院(Yonsei University Hospital)獲得的HCC827-GR、H4006-ER、PC9及PC-GR)的EGFR的狀態。大體上,EGFR通常通過外顯子19缺失突變或外顯子21點突變(L858R)始終以活化形態存在并導致癌癥。本實驗中使用的12個細胞系中H1975、H1650、HCC827、HCC827-GR、H4006、H4006-ER、PC9及PC9-GR是具有EGFR突變的癌細胞系,而其他4個細胞系是具有正常EGFR的癌細胞系。
按照上述的方法測定EGFR和ρ85α之間的反應性,以定量各個細胞系的EGFR的狀態。測定了H4006(外顯子19缺失)、H1975(外顯子21突變)以及H2291(正常EGFR)細胞系的反應性,并且呈現在圖中。如圖6中的上圖所示,確認了與具有正常EGFR的H2291細胞系相比,具有突變的EGFR的其他兩個細胞系中EGFR的活化程度更高。此外,可看到H4006和H1975之間也存在著差異。
就12個NSCLC癌細胞系而言,測定EGFR的活化程度并且由熱圖表示。如圖6的下圖所示,將在H1975細胞系產生的信號歸一化為“1”,并且獲得剩下細胞系的信號強度的相對值。
在本發明中,可測量作為一種RTK的EGFR和作為其下游蛋白的ρ85α之間的相互作用的強度。此外,當選出合適的抗體時,除了EGFR外,本發明還可用于各種RTK,以測量各個細胞系中產生的靶蛋白的信號以及靶蛋白和探針蛋白之間的相互作用的程度。
實驗例3.利用4種EGFR下游蛋白分析非小細胞肺癌細胞系的EGFR活化程度
通過采用實驗例2中定量的信號強度利用多個探針蛋白分析EGFR的相對信號強度。如圖7所示,觀察到了從EGFR開始的各種信號通路對各個細胞系的作用,以及比較各個細胞系。結果確認了本發明有助于選擇靶向特定的信號通路的抗癌劑。類似地,圖7示出基于H1975細胞系,測量各個細胞系的相對信號值的結果。
實驗例4.人癌癥組織的特征分析
通過使用上面所述的所有方法確認了人癌癥組織(肺癌)和正常組織之間的差異。肺癌組織是從乙支大學醫院(Eulji University Hospital)獲得的。通過使用10mg的組織提取物進行實驗。通過利用本發明并且相對于H1975進行比較,測定了癌癥組織和正常組織中EGFR的活化程度的差異。
如圖8的下端所示,可以確認癌癥組織和正常組織中EGFR的活化程度有很大的差異。該結果確認了,通過檢查從各個患者提取的未知組織,并且驗證活化的具體信號通路,可以為每個患者提供適當的治療。
實驗例5.各種RTK的活化狀態分析
為了證明本發明還可以適用于除了上述實驗例中的EGFR以外的其他RTK,對HER2、HER3以及HGFR(c-MET)進行了實驗。使用Grb2、PLCγ以及ρ85α作為靶蛋白HER2和HGFR的探針蛋白,并且使用ρ85α作為HER3靶蛋白的探針蛋白。
對HER2/HER3而言,測定總共10個乳腺癌細胞系(從American Type Culture Collection獲得的SKBR3、T47D、MDAMB231、MDAMB453、H1419、H1954及MCF7;從首爾大學附屬醫院獲得的SKBR3LR9、SKBR3HR30及SNU21)中HER2和HER3的活化程度,并且用熱圖表示(圖11)。圖11是將在SKBR3細胞系測定的信號歸一化為1后,用相對值表示剩下的細胞系的信號強度的結果。
對于HGFR而言,測定了總共15個NSCLC細胞系(從American Type Culture Collection獲得的HCC827、H4006、H1650、H1975、H358、H1666、H2291及A549;從延世大學附屬醫院(Yonsei University Hospital)獲得的PC9、HCC827-GR#13、H4006-ER、YU-01、YU-06、HCC827-GR#5及PC-GR)的活化程度,類似地,將HCC826的細胞系歸一化為1后,用相對值表示剩下的細胞系的信號強度(圖12)。
圖11和圖12的結果表示本發明并不局限于特定的RTK,也適用于包括RTK的所有受體。
實驗例6.蛋白-蛋白相互作用(PPI)和藥物反應相關關系的分析
利用本方法對總共15個NSCLC細胞系分析了蛋白-蛋白相互作用(PPL)和對作為EGFR靶向抗癌劑的吉非替尼的反應性之間的相關關系。圖13c綜合示出了圖13a示出的EGFR和Grb2之間的相互作用程度和圖13b中測定的各個細胞系對靶向抗癌劑的敏感性。圖13c的橫軸表示EGFR的信號往右側逐漸增加,縱軸表示靶向抗癌劑的敏感性往上側逐漸增加。
圖13c顯示了測定的EGFR的信號強度與對靶向抗癌劑的敏感性呈正相關。結果顯示,針對未知的檢查樣品,通過利用本發明測定靶向抗癌劑針對的信號通路的活化程度,以提前預測對靶向抗癌劑的敏感性。
盡管已經詳細描述了本發明的具體部分,但是對本領域的技術人員顯而易見,這些具體的說明只是優選的實施方式而已,并不限制本發明的范圍。因此,本發明的范圍應由所附的權利要求以及其等同范圍來限定。
- 還沒有人留言評論。精彩留言會獲得點贊!