瓊膠寡糖水解酶及通過使用該瓊膠寡糖水解酶從瓊脂糖中生成3,6-脫水-L-半乳糖和半乳糖的方法與流程
本發明涉及一種對瓊膠寡糖具有水解活性的新型β-瓊膠寡糖水解酶,且還涉及一種通過使用β-瓊膠寡糖水解酶從瓊脂糖中生成3,6-脫水-L-半乳糖和半乳糖的方法。
背景技術:
相比于最近在諸多領域中使用的植物生物量,藻類具有含量較低的難以利用的成分,如所使用的木質素。因此,藻類的優點在于,它們可以更為容易地轉化成作為用來生成生物能源和生化物的基底的單糖。此外,通過不去使用食物資源,藻類則不存在使用食物資源來生成能源的問題。基于這些原因,在生成包括有可替代能源的生化物質上,藻類作為重要生物量而備受關注。
在藻類中,尤其,紅藻(如,石花菜(Gelidium amansii))不僅是生成這種生物能源和生化物質的原材料,據報道,它還含有瓊膠寡糖(agarooligosaccharides),而被用作成分的瓊膠寡糖顯示出優異的生理活性,如抗氧化、抗炎、抗癌、抗過敏、美白和保濕性,從而在制藥和化妝品領域中紅藻被有效使用(U.S. Patent No. 76622291 by Tomono et al. (2009); U.S. Patent No. 691143282 by Enoki et al. (2005))。
紅藻包含作為主要組成的瓊脂糖,瓊脂糖為以新瓊脂二糖(neoagarobiose)(即,通過α-1,3-鍵相結合的3,6-脫水-L-半乳糖和D-半乳糖)作為基本單元的聚合物,其中作為基本單元的新瓊脂二糖與其他單元通過β-1,4-鍵相連。本發明的發明人以實驗為依據證明了3,6-脫水-L-半乳糖的生理功能起源于包含有新瓊脂二糖的瓊膠寡糖(Yun et al (2013) Appl Microbiol Biotechnol. 97(7):2961-70)的這一事實。此外,據報道,關于3,6-脫水-L-半乳糖的生成,有一種通過溫和的化學預處理和酶糖化制備3,6-脫水-L-半乳糖和D-半乳糖的過程,來替代產率極低且具有水解過度的可能性高的化學處理方法(Jol et al (1999) Anal Biochem. 268, 213-222; Kim et al (2010) Bull Korean Soc. 31(2) 511-514)。
待經過化學預處理后,瓊脂糖被外切型Aga50D酶解聚成作為主要反應產物的新瓊脂二糖和瓊脂三糖(agarotriose)(D-半乳糖-β-1,4鍵-3,6-脫水-L-半乳糖-α-1,3鍵-D-半乳糖)。然后,新瓊脂二糖被作為α-瓊脂二糖水解酶的SdNABH最終水解成3,6-脫水-L-半乳糖和D-半乳糖(韓國專利號10-1293668)。期間,在溫和條件下的化學預處理對提高所述Aga50D酶的反應性來說是不可或缺的。然而,通過使用經化學預處理的基底,所生成的瓊脂三糖最終無法被分解成3,6-脫水-L-半乳糖和D-半乳糖,反而作為反應剩余物被殘留下來。
如果所殘留的瓊脂三糖最終可以被分解成3,6-脫水-L-半乳糖和D-半乳糖時,能夠預期的是,3,6-脫水-L-半乳糖和D-半乳糖的產量將得到更大的提高。由于內切型和外切型β-瓊膠酶無法水解如瓊脂三糖的基底,也嘗試過另一種通過利用β-半乳糖苷酶將瓊脂三糖分解成D-半乳糖和新瓊脂二糖的方法,然而可商購的β-半乳糖苷酶并沒有展示出對瓊脂寡糖的水解活性。
技術實現要素:
技術問題
本發明在于,提供一種通過使用新型酶提高瓊脂糖糖化的效率的方法,且所述新型酶對瓊脂寡糖具有水解活性。
本發明還在于,提供一種通過使用新型酶生成半乳糖的方法,且所述新型酶對瓊脂寡糖具有水解活性。
技術方案
為了實現上述目的,本發明提供一種用于瓊脂糖糖化的組合物,該組合物包含:瓊膠酶;對瓊脂三糖具有水解活性且以氨基酸序列SEQ ID NO:1表示的β-瓊膠寡糖水解酶;和α-瓊脂二糖水解酶。
本發明還提供一種通過使基底與本發明的用于瓊脂糖糖化的組合物進行反應來糖化瓊脂糖的方法,其中所述基底選自瓊脂糖、瓊脂三糖和新瓊脂二糖。
本發明還提供一種用于生成半乳糖的組合物,該組合物包含β-瓊膠寡糖水解酶,且所述β-瓊膠寡糖水解酶對瓊脂三糖、瓊脂戊糖(agaropentaose)或瓊脂庚糖(agaroheptaose)具有水解活性并被表示為氨基酸序列SEQ ID NO:1。
此外,本發明提供一種通過使基底與本發明的β-瓊膠寡糖水解酶反應來生成半乳糖的方法,其中所述基底選自瓊脂三糖、瓊脂戊糖和瓊脂庚糖。
有益效果
通過利用能將瓊脂三糖水解成半乳糖和新瓊脂二糖上表現出活性的β-瓊膠寡糖水解酶,本發明有效地提高了來自瓊脂糖的3,6-脫水-L-半乳糖和D-半乳糖的產量,也就是說,有效地改善了糖化產量。
附圖說明
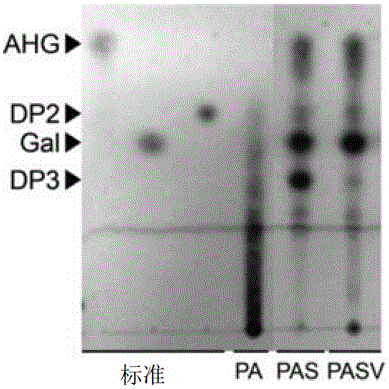
圖1為用于各種酶(PA:經預處理的瓊脂糖;PAS:相對于所述經預處理的瓊脂糖的Aga50D和SdNABH的反應產物;PASV:相對于所述經預處理的瓊脂糖的Aga50D、SdNABH與附加弧菌EJY3初始提取物時的反應產物)的反應產物的TLC照片。
圖2以柱形圖總結并展示了通過DNS試驗對圖1的PAS和PASV的還原當量。
圖3為本發明的經提純的β-瓊膠寡糖水解酶的SDS-PAGE照片。
圖4展示了本發明的β-瓊膠寡糖水解酶的最佳溫度的pH結果。圖4A展示了所述β-瓊膠寡糖水解酶相對于瓊脂三糖基底的最佳pH,而圖4B展示了所述β-瓊膠寡糖水解酶相對于瓊脂三糖基底的最佳溫度(M:蛋白標記;第1道:通過HisTrap HP柱經過第一次提純的β-瓊膠寡糖水解酶:第2道:通過HisTrap Q FF柱經過第二次提純的β-瓊膠寡糖水解酶)。
圖5證明了本發明的β-瓊膠寡糖水解酶對瓊脂三糖基底的酶活性。圖5A為隨著所述β-瓊膠寡糖水解酶與瓊脂三糖基底之間的各反應時間所顯示的所述基底和產物的變化的HPLC結果,而圖5B為隨著所述β-瓊膠寡糖水解酶和α-瓊脂二糖水解酶與瓊脂三糖基底之間的各反應時間所顯示的所述基底和產物的變化的HPLC結果。
圖6展示了本發明的β-瓊膠寡糖水解酶相對于瓊脂三糖、瓊脂戊糖和瓊脂庚糖基底的酶活性。圖6A通過利用TLC展示了所述β-瓊膠寡糖水解酶相對于每種基底的反應產物,而圖6B通過利用TLC展示了所述β-瓊膠寡糖水解酶和α-瓊脂二糖水解酶相對于每種基底的反應產物。
圖7展示了本發明的β-瓊膠寡糖水解酶相對于各種基底(使用葡萄糖和半乳糖作為基底)的酶活性。
圖8展示了源自大腸桿菌的β-半乳糖苷酶相對于各種基底(使用葡萄糖和半乳糖作為基底)的酶活性。圖8A展示了分別相對于乳糖、乳糖-N-新四糖、乳果糖、4-β-半乳糖和α-1,3-β-1,4-半乳二糖的酶的反應的結果,而圖8B展示了分別相對于瓊脂三糖、瓊脂戊糖和瓊脂庚糖的酶的反應的結果。
圖9為通過使用本發明的β-瓊膠寡糖水解酶(β-AOH)所展示的瓊脂糖糖化過程的示意圖。
具體實施方式
下面,將具體說明本發明的構成。
本發明涉及一種用于瓊脂糖糖化的組合物,該組合物包含:瓊膠酶;對瓊脂三糖具有水解活性且以氨基酸序列SEQ ID NO:1表示的β-瓊膠寡糖水解酶;和α-瓊脂二糖水解酶。
本發明的用于瓊脂糖糖化的組合物的特征在于,通過在瓊脂糖糖化中利用能夠水解瓊脂三糖的β-瓊膠寡糖水解酶來有效地分解那些過去在常規領域中不能水解而殘留下來的瓊脂三糖,其中β-瓊膠寡糖水解酶能使作為瓊脂寡糖的產物的瓊脂三糖水解成新瓊脂二糖和D-半乳糖,從而顯著地改善來自瓊脂糖的3,6-脫水-L-半乳糖和D-半乳糖的產率(即,瓊脂糖糖化的效率)。
根據本發明的一個實施例,通過DNS方法所確認的還原當量的結果表明,當僅預處理瓊脂糖時糖化率為約20%,而當采用常規酶處理(即,用瓊膠酶與新瓊脂二糖水解酶進行的處理)時所述比率會增加到50%。反之,在所述酶處理期間,當另外再處理β-瓊膠寡糖水解酶來水解瓊脂三糖時,所述糖化率為70%。
所述β-瓊膠寡糖水解酶并未展示由已報道的β-半乳糖苷酶所顯示的活性。反之,通過作用于瓊脂三糖及各種如瓊脂戊糖和瓊脂庚糖的瓊脂寡糖(n)的未還原端,所述β-瓊膠寡糖水解酶可將瓊脂寡糖水解成D-半乳糖和新瓊脂二糖(n-1)。
所述β-瓊膠寡糖水解酶可以源自弧菌EJY3(Vibrio sp. EJY3),但不限于此。
所述β-瓊膠寡糖水解酶不僅包括以SEQ ID NO: 1表示的氨基酸序列,且還包括蛋白質,該蛋白質作為所述酶經過取代、缺失、轉位、添加等中的一種或多種的變異蛋白并在本發明的酶的范圍內對瓊脂三糖具有水解活性,而且,所述β-瓊膠寡糖水解酶優選地包括與SEQ ID NO: 1所公開的所述氨基酸序列具有80%或以上、85%或以上、90%或以上、93%或以上、94%或以上、95%或以上、96%或以上、97%或以上、98%或以上、以及99%或以上的序列相同性的氨基酸序列(也被指為'AOH')。
在本發明中,一種多肽相對于其他序列具有特定百分比(如,80%、90%、95%或99%)的序列相同性,這表示,當比對并比較所述兩種序列時,所述兩種序列中占上述比例的氨基酸殘基彼此相同。所述比對和百分比同源性(或相同性)可通過使用本領域熟知的軟件程序,如在文獻(CURRENT PROTOCOLS IN MOLECULAR BIOLOGY (F. M. Ausubel et al. (eds) 1987 Supplement 30 section 7.7.18))中公開的軟件程序來確定。優選程序包括GCG Pileup程序、FASTA(Pearson et al. 1988 Proc. Natl Acad. Sci USA 85:2444-2448)和BLAST(BLAST Manual, Altschul et al., Natl. Cent. Biotechnol. Inf., Natl Lib. Med. (NCIB NLM NIH), Bethesda, MD, and Altschul et al. 1997 NAR25:3389-3402)。其他優選的比對程序為ALIGN Plus (Scientific and Educational Software, PA),此程序使用默認參數。其他可利用的序列軟件程序為TFASTA數據檢索程序,此程序可在Sequence Software Package Version 6.0(Genetics Computer Group, University of Wisconsin, Madison, WI)中使用。
在本發明中,“蛋白質”與“多肽”在本文中可互換使用。此時,氨基酸殘基使用常規的單字母代碼或三字母代碼。
在本發明中,當涉及到細胞、核酸、蛋白質或載體時,術語“重組”表示,通過引入異源核酸或蛋白質或者通過天然核酸或蛋白質的改變進行的修飾來對所述細胞、核酸、蛋白質或載體進行修飾,又或者,所述術語可以指源自所修飾細胞的細胞。換言之,例如,重組細胞會表達該細胞的固有形式中未被發現的基因,又或者,它會表達經過異常表達或根本未被表達的原始基因。
在本發明中,“核酸”包括單鏈或雙鏈DNA、RNA及它們的變形體。“核酸”和“多核苷酸”可以在本文中互換使用。由于遺傳密碼被兼并(degeneracy),一種或多種遺傳密碼子可被用來編碼特定的氨基酸,且本發明包括能編碼特定氨基酸序列的多核苷酸。
用于將核酸序列插入于細胞的術語,“導入”,是指“轉染”、“轉化”或“轉導”,還包括一種將所述核酸序列融進真核或原核細胞內的說法。此時,所述核酸序列被融進所述細胞的基因組(如,染色體、質粒、質體和線粒體DNA)內,而被轉化成自主復制子或者被瞬時表達。
所述β-瓊膠寡糖水解酶不僅在酶的編碼區中上游或下游段內進行轉錄或翻譯,且所述β-瓊膠寡糖水解酶還通過與單個編碼片段之間包含有間插序列的多肽的形成有關的DNA片段,即編碼基因,進行轉錄或翻譯。例如,所述轉錄或翻譯可以通過序列SEQ ID NO: 2來實現,但并不限于此。
所述β-瓊膠寡糖水解酶可從弧菌EJY3培養基的上清液中分離并提純,且通過利用重組基因工程技術,可利用弧菌EJY3以外的菌株、人工化學合成方法等來生成并分離所述β-瓊膠寡糖水解酶。
當利用重組技術時,為了使通常的重組蛋白易于表達,會使用一些因子,如抗生素對抗性基因及可用于親和柱層析的報告蛋白或多肽等,且這種技術在本發明所屬技術領域的技術人員可容易實施的范疇內。此外,例如,經轉化的大腸桿菌(E. coli)的培養基上清液可代替本發明的β-瓊膠寡糖水解酶而被使用。
通過使用HisTrap HP柱和HisTrap FF柱,可提純所述β-瓊膠寡糖水解酶。根據一個實施例,SDS-PAGE分析結果表明,所提純的β-瓊膠寡糖水解酶的分子量可以為約90 kDa。
所述β-瓊膠寡糖水解酶為一種屬于GH家族2的酶,當與GH家族2內的其他β半乳糖苷酶做活性比較時,已被報道的常用的β-半乳糖苷酶沒有顯示出能使瓊膠三糖水解成D -半乳糖和新瓊脂二糖的酶活性。然而,只有本發明的源自弧菌EJY3的β-瓊膠寡糖水解酶才顯示出瓊膠三糖水解活性。
所述β-瓊膠寡糖水解酶可以在約30-40℃的溫度范圍和約5-9.6的pH范圍內對瓊膠三糖顯示最佳水解活性。
此外,用于本發明的瓊脂糖糖化的組合物包含瓊膠酶,瓊膠酶能將瓊脂寡糖水解成瓊膠三糖和作為二塘的新瓊脂二糖。
作為所述瓊膠酶,可以使用一種能使瓊脂糖中的D-半乳糖與3,6-脫水-L-半乳糖之間的β-1,4-糖苷鍵斷裂的酶(被指作“ga50D”)。
所述瓊膠酶不僅包括以SEQ ID NO: 3表示的氨基酸序列,還包括蛋白質,該蛋白質作為所述酶經過取代、缺失、轉位、添加等中的一種或多種的變異蛋白并在本發明的酶的范圍內具有瓊膠寡糖水解活性,而且,所述瓊膠酶優選地包括與SEQ ID NO:3所表示的所述氨基酸序列具有80%或以上、85%或以上、90%或以上、93%或以上、94%或以上、95%或以上、96%或以上、97%或以上、98%或以上、以及99%或以上的序列相同性的氨基酸序列。
所述酶可源自Saccharophagus degradans 2-40T,但不限于此。
所述瓊膠酶可以從Saccharophagus degradans 2-40T的培養基上清液中分離并提純,且通過利用重組基因工程技術,可利用Saccharophagus degradans 2-40T以外的菌株、人工化學合成方法等來生成并分離所述瓊膠酶。
當利用重組技術時,可以使用食用菌株如經轉發的酵母的培養基上清液,來代替所述瓊膠酶。
此外,本發明的用于瓊脂糖糖化的組合物包含α-瓊脂二糖水解酶(被指為“sdNABH”),α-瓊脂二糖水解酶可以將新瓊脂二糖水解成3,6-脫水-L-半乳糖和D-半乳糖。
所述α-瓊脂二糖水解酶不僅包括以SEQ ID NO: 4表示的氨基酸序列,還包括蛋白質,該蛋白質作為所述酶經過取代、缺失、轉位、添加等中的一種或多種的變異蛋白并在本發明的酶的范圍內具有新瓊脂二糖水解活性,而且,所述α-瓊脂二糖水解酶優選地包括與SEQ ID NO:4所表示的所述氨基酸序列具有80%或以上、85%或以上、90%或以上、93%或以上、94%或以上、95%或以上、96%或以上、97%或以上、98%或以上、以及99%或以上的序列相同性的氨基酸序列。
所述酶可源自Saccharophagus degradans 2-40T,但不限于此。
所述α-瓊脂二糖水解酶可以從Saccharophagus degradans 2-40T的培養基上清液中分離并提純,且通過利用重組基因工程技術,可利用Saccharophagus degradans 2-40T以外的菌株、人工化學合成方法等來生成并分離所述α-瓊脂二糖水解酶。
當利用重組技術時,可代替使用食用菌株如經轉化的酵母的培養基上清液。
本發明的用于瓊脂糖糖化的組合物,可通過使經預處理的瓊脂糖與所述瓊膠酶、所述β-瓊膠寡糖水解酶和α-瓊脂二糖水解酶的酶混合物反應,或者通過使所述瓊膠酶、所述β-瓊膠寡糖水解酶和α-瓊脂二糖水解酶相繼與所述經預處理的瓊脂糖反應,而從瓊脂糖中生成3,6-脫水-L-半乳糖和D-半乳糖。
本發明還涉及一種通過使基底與本發明的用于瓊脂糖糖化的組合物來糖化瓊脂糖的方法,其中所述基底選自瓊脂糖、瓊脂三糖和新瓊脂二糖。
本發明的用于糖化瓊脂糖的方法的特征在于,使瓊膠酶(即,外切型β-瓊脂糖酶)、β-瓊膠寡糖水解酶和α-瓊脂二糖水解酶與經預處理的瓊脂糖反應而生成3,6-脫水-L-半乳糖和D-半乳糖。
所述經處理的瓊脂糖是指一種經弱酸處理時會生成瓊脂寡糖的瓊脂糖。
所述弱酸可以為乙酸、甲酸、琥珀酸、檸檬酸、蘋果酸、馬來酸、草酸等中的一種或多種。
考慮到生產成本及經所述弱酸進行中和后的鹽分離,所述弱酸優選使用0.5-60 % (w/v)的濃度范圍。更具體地,所述弱酸可使用20-40 % (w/v)法人濃度范圍。
所述瓊脂糖與所述弱酸的反應可在40-150℃的溫度范圍和100 -200 rpm的條件下持續進行30分鐘至6小時。當滿足所述范圍時,可以最大程度減少當利用所述弱酸時瓊脂糖的過量水解產物。
所得反應產物為瓊脂寡糖,是通過清洗和干燥去處所殘留的弱酸和過量水解產物來獲得的。
所述清洗溶劑可以為具有1-6個碳原子的低級醇,但不限于此。
為了對所得瓊脂寡糖進行酶水解,會使用外切型瓊膠酶、β-瓊膠寡糖水解酶和α-瓊脂二糖水解酶。
所述瓊膠酶能將瓊脂寡糖水解成瓊脂三糖和新瓊脂二糖,所述β-瓊膠寡糖水解酶能將瓊脂三糖水解成D-半乳糖和新瓊脂二糖,且所述α-瓊脂二糖水解酶能將新瓊脂二糖水解成D-半乳糖和3,6-脫水-L-半乳糖。
因此,過去在瓊脂寡糖的常規酶水解中殘留下來所述瓊脂三糖會被所述β-瓊膠寡糖水解酶水解,從而提高了D-半乳糖和3,6-脫水-L-半乳糖的產率。
通過使所述經預處理的瓊脂糖與所述瓊膠酶、所述β-瓊膠寡糖水解酶和α-瓊脂二糖水解酶的酶混合物反應,或者通過使所述瓊膠酶、所述β-瓊膠寡糖水解酶和α-瓊脂二糖水解酶相繼與所述經預處理的瓊脂糖反應,可以生成3,6-脫水-L-半乳糖和D-半乳糖。
瓊脂寡糖與所述酶混合物之間的反應、或瓊脂寡糖與所述酶之間的連續反應可在20-40℃的溫度范圍和0-200 rpm的條件下連續進行30分鐘至7天。更具體地,這些反應可在25-35℃的溫度范圍和100-150 rpm的條件下連續進行1-4天。
當所述瓊脂寡糖為粉狀時,可將它溶解于通常的緩沖液中而進行使用,但不限于此。
本發明還涉及一種用于生成半乳糖的組合物,該組合物包含對瓊脂三糖、瓊脂戊糖或瓊脂庚糖具有水解活性且以氨基酸序列SEQ ID NO:1表示的β-瓊膠寡糖水解酶。
此外,本發明提供一種通過使基底與本發明的β-瓊膠寡糖水解酶進行反應而生成半乳糖的方法,其中所述基底選自瓊脂三糖、瓊脂戊糖和瓊脂庚糖。
所述β-瓊膠寡糖水解酶可以源自弧菌EJY3,但不限于此。
由于所述β-瓊膠寡糖水解酶能從瓊脂三糖、瓊脂戊糖或瓊脂庚糖中生成D-半乳糖和新瓊脂二糖,所述β-瓊膠寡糖水解酶可以用來生成D-半乳糖。
所述酶反應可在約20-40℃的溫度范圍和約5-9.6的pH范圍內進行。
下面,通過參考示例性實施例,將具體描述本發明。然而,以下示例性實施例只意在舉例說明本發明,并不會限制本發明的范圍。
實施例
<實施例1> 從弧菌EJY3的初始酶提取物中β-瓊膠寡糖水解酶的酶活性的確定
為了確認弧菌EJY3對所述瓊脂三糖的水解具有酶活性,獲得初始提取物并對所述活性進行評估。
為了獲得所述初始提取物,使弧菌EJY3在含有海鹽的培養基內生長到中期指數階段,然后離心分離40 mL的培養基,通過使用超聲器使細胞破裂,從而獲得初始提取物。通過使用作為所述基底的瓊脂糖,利用TLC來觀察(TLC溶劑的組成:容量比為3:1:1的正丁醇:乙醇:水)通過β瓊膠酶的分解產物。
基于3,6-脫水-L-半乳糖、半乳糖、新瓊脂二糖的標準,在圖1中展示了用于各種酶的反應產物的TLC結果。PA表示通過與3%醋酸在130℃下反應30分鐘來進行預處理的瓊脂糖,PAS為從所述經預處理的瓊脂糖與外切型β瓊膠酶(Aga50D)及α-瓊脂二糖水解酶(SdNABH)進行反應而獲得的產物,且PASV為將弧菌EJY3初始提取物(或初始酶)加入到所述PAS中而獲得的產物。
如圖1中所示,將弧菌EJY3初始酶被附加加入到所述反應中時,觀察到瓊脂三糖有減少。由此可確定,所述弧菌EJY3初始酶含有能水解瓊脂三糖的酶。
此外,使瓊脂三糖完全水解,且通過還原糖定量方法(DNS法:50μl DNS試劑與稀釋25倍的100μl酶反應產物混合,在95℃下處理5分鐘,然后在540 nm測量吸光度),測量還原當量。
如圖2中所示,確認了3,6-脫水-L-半乳糖和半乳糖的產率有增加。當只進行預處理時糖化率為約20%,然而當進行酶的預處理時該糖化率增加到50%。對此,通過用弧菌EJY3初始酶進行附加處理,致使糖化率變為70%,認為這是因為瓊脂三糖最終被水解而引起的。
<實施例2> 在弧菌EJY3的酶候選物中對β-瓊膠寡糖水解酶的研究
在有關弧菌EJY3的報告中所涉及的酶中,克隆那些在報告中對瓊膠酶和β-半乳糖苷酶具有活性的8種酶,以生成重組菌株,然后評估每種初始酶對瓊脂三糖的活性。其中,發現只有一種酶(VEJY3_09170)對瓊脂三糖具有水解活性。通過在UniProt(http://www.uniprot.org)中確認并基于由本發明的發明人第一次揭示的弧菌EJY3全基因組序列數據,鑒定結果表明,VEJY3_09170為一種基于堿基序列被分類為β-半乳糖苷酶的酶,且VEJY3_09170屬于具有諸多其他β-半乳糖苷酶的GH家族2。然后,將大腸桿菌Rosetta(DE3)用作所述重組菌株的宿主,且將pET-21a用作載體。將接種于具有50 μg/mL的氨芐西林濃度的固體培養基上并通過轉化而獲得的菌落再次接種在含有50 μg/mL氨芐西林的LB(盧里亞肉湯)中,然后在37℃和220 rpm下孵化12小時(兩個20ml的容量)。然后,分別在兩個3 L錐形瓶中進行孵化,這兩個3 L錐形瓶各含有1 L的LB肉湯,在相同條件下進行3小時(OD= 0.8)震蕩培養,用冰冷卻1小時,而后加入0.1 mM IPTG,以在16℃和120rpm的條件下誘導表達12小時。所述培養基通過離心分離(6000 rpm, 4℃, 15分鐘)回收細胞,而后所收回的細胞被懸浮在20 mM的Tris緩沖液(Tris-HCl, 1 M NaCl pH 8)中并利用超聲器使之破裂,然后所述懸浮液通過離心分離從上清液中分離出β-瓊膠寡糖水解酶,再利用HisTrap HP柱和HisTrap Q FF柱(GE Healthcare, Piscataway, NJ, USA)進行提純,而后通過8 % SDS-PAGE進行觀察。
圖3為經提純的β-瓊膠寡糖水解酶的SDS-PAGE照片。M表示蛋白標記,第1道表示通過HisTrap HP柱被第一次提純的β-瓊膠寡糖水解酶,且第2道表示HisTrap Q FF柱被第二次提純的β-瓊膠寡糖水解酶。
如圖3中所示,在相當于約90 kDa相的位置處發現了所述β-瓊膠寡糖水解酶。
<實施例3> β-瓊膠寡糖水解酶的最佳反應條件的確認
對β-瓊膠寡糖水解酶的僅由溫度和pH組成的最佳條件進行確認。作為所述基底使用瓊脂三糖(Aglyco, 中國北京),且在10、20、30、35、40、45和50℃的溫度及pH 4、5、6、7、8、9和10下確定結果。
圖4展示了本發明的β-瓊膠寡糖水解酶的最佳溫度及pH結果。圖4A展示了相對于瓊脂三糖基底的β-瓊膠寡糖水解酶的最佳pH,而圖4B展示了相對于瓊脂三糖基底的β-瓊膠寡糖水解酶的最佳溫度。
如圖4中所示,瓊脂三糖的相對活性達到50%的溫度范圍為約30-40℃,且所述pH的范圍在5-9.6。在35℃和pH7上達到最佳酶活性。
<實施例4> 所述最佳條件下的β-瓊膠寡糖水解酶的生化活性的確定
在所述實施例3中被確認為最佳條件的35℃和pH7的條件下,對相對于瓊脂三糖、瓊脂戊糖和瓊脂庚糖的β-瓊膠寡糖水解酶活性進行測試。
通過HPLC (KS-802柱)和TLC(TLC溶劑條件:正丁醇:乙醇:水=3:1:1)分析,當觀察隨著所述β-瓊膠寡糖水解酶與所述瓊脂三糖基底之間的反應時間發生在所述基底和產物中的變化時,可見所述β-瓊膠寡糖水解酶通過水解能使一個分子的瓊脂寡糖分解成一個分子的新瓊脂寡糖和一個分子的D-半乳糖(圖5 A)。
此外,通過HPLC,當分析隨著所述β-瓊膠寡糖水解酶與所述瓊脂三糖基底之間的反應時間發生在所述基底和產物中的變化時,可見通過組合使用β-瓊膠寡糖水解酶和α-瓊脂二糖水解酶,最終會從瓊脂寡糖中生成3,6-脫水-L-半乳糖和D-半乳糖(圖5B)。
圖6展示了本發明的β-瓊膠寡糖水解酶相對于瓊脂三糖、瓊脂戊糖和瓊脂庚糖基底的活性的TLC結果。如圖6A中所示,β-瓊膠寡糖通過水解酶水解瓊脂三糖、瓊脂戊糖和瓊脂庚糖而生成D-半乳糖,然而,當組合使用β-瓊膠寡糖水解酶和α-瓊脂二糖水解酶時,所觀察到的最終產物為3,6-脫水-L-半乳糖和D-半乳糖(圖6B)。
<實施例5> β-瓊膠寡糖水解酶和源自大腸桿菌的β-半乳糖苷酶的活性對比
當與其他屬于GH家族2中的β-半乳糖苷酶作活性比較時,發現源自弧菌EJY3的所述β-瓊膠寡糖水解酶為一種屬于GH家族2的酶,但顯示出有別于先前有被報道的β-半乳糖苷酶的新活性。測試源自大腸桿菌的β-半乳糖苷酶的活性(Sigma-Aldrich, 3050 spruce street, USA)相對于每個基底的活性,然后測試β-瓊膠寡糖水解酶相對于上述相同的基底的活性。
圖7展示了β-瓊膠寡糖水解酶相對于各種基底的活性的結果。針對乳糖、乳糖-N-新四糖、乳果糖、4-β-半乳糖和α-1,3-β-1,4-半乳二糖分別進行酶反應性測試,結果表明,相對于任何的所述基底均沒有反應性。
圖8展示了源自大腸桿菌的β半乳糖苷酶水解酶相對于各種基底的活性的結果。針對于乳糖、乳糖-N-新四糖、乳果糖、4-β-半乳糖和α-1,3-β-1,4-半乳二糖分別進行酶反應性的測試,從而確認β-半乳糖苷酶的已知活性(圖8A)。此外,分別測試相對于瓊脂三糖、瓊脂戊糖和瓊脂庚糖的酶反應性,且其結果確認了所述源自大腸桿菌的β-半乳糖苷酶無法水解瓊脂寡糖(圖8B)。
上述結果能夠證明,通過使用β半乳糖苷酶水解酶,本發明可以提高瓊脂糖糖化的產率和效率,且圖9展示了所述糖化過程的示意圖。
工業應用性
本發明的3,6-脫水-L-半乳糖和D-半乳糖可用作食品、化妝品和藥物領域中的有益材料。
- 還沒有人留言評論。精彩留言會獲得點贊!