抗-B7-H5抗體及其用途的制作方法
本發明是用美國國立衛生研究院(NIH)的授予號ROl CA97085和ROl A 172592,以及美國國家癌癥研究所(NCI)的U19 CA113341下的政府支持做出的。政府具有本發明的某些權利。
序列表的引用
本申請包括依據37 C.F.R.§1.821以及下列等的一個或多個序列表,這些序列表披露于論文和計算機可讀介質這二者中,并且通過引用以其全文將這些論文和計算機可讀披露結合在此。
發明領域
本發明涉及抗體和它們的抗原結合片段,并且涉及能夠結合B7-H5:CD28H通路的B7-H5配體的其他分子,并且涉及此類分子在治療和診斷自身免疫性疾病、移植排斥和其他炎癥疾病中的用途。
發明背景
人和其他哺乳動物的免疫系統負責提供針對感染和疾病的保護。此類保護是通過體液免疫應答和通過細胞介導的免疫應答二者來提供的。體液應答導致抗體和能夠識別并且中和外源靶標(抗原)的其他生物分子的產生。相比之下,細胞介導的免疫應答涉及響應于對抗原的識別,通過T細胞來活化巨噬細胞、自然殺傷細胞(NK)、和抗原特異性細胞毒T淋巴細胞的活化,并且釋放不同的細胞因子(董(Dong),C.等人(2003)“通過新穎的共刺激分子的免疫調節(Immune Regulation by Novel Costimulatory Molecules)”,免疫學研究(Immunolog.Res.)28(1):39-48)。
T細胞最佳地介導針對抗原的免疫應答的能力需要兩種不同的信號傳導相互作用(維格里埃塔(Viglietta),V.等人(2007)“調節共刺激(Modulating Co-Stimulation)”,神經治療學(Neurotherapeutics)4:666-675;科爾曼(Korman),A.J.等人(2007)“癌癥免疫療法中的檢查點阻斷(Checkpoint Blockade in Cancer Immunotherapy)”,免疫學進展(Adv.Immunol.)90:297-339)。第一,已經排列在抗原呈遞細胞(APC)的表面上的抗原必須被呈遞到抗原特異性原初CD4+T細胞。這種呈遞通過T細胞受體(TCR)遞送信號,該信號指導T細胞起始免疫應答,該免疫應答對所呈遞的抗原將是特異性的。第二,通過APC與不同的T細胞表面分子之間的相互作用介導的一系列共刺激性以及共抑制性信號首先觸發T細胞的活化以及增殖并且最終觸發它們的抑制。因此,該第一信號為該免疫應答賦予了特異性,而該第二信號用以確定該應答的性質、幅度以及持續時間。
免疫系統受共刺激性以及共抑制性配體和受體的緊密控制。這些分子提供了用于T細胞活化的第二信號,并且提供了正信號和負信號的平衡網絡,以最大化針對感染的免疫應答同時限制對自身的免疫性(王(Wang),L.等人(2011年3月7日)“VISTA,負向調節T細胞應答的新穎小鼠Ig超家族配體(VISTA,A Novel Mouse Ig Superfamily Ligand That Negatively Regulates T Cell Responses)”,實驗醫學雜志(J.Exp.Med.)10.1084/jem.20100619:1-16;萊布尼茲(Lepenies),B.等人(2008)“寄生蟲感染期間負向共刺激分子的作用(The Role Of Negative Costimulators During Parasitic Infections)”,內分泌、代謝和免疫的失調-藥物靶標(Endocrine,Metabolic and Immune Disorders-Drug Targets)8:279-288)。特別重要的是抗原呈遞細胞的B7.1(CD80)和B7.2(CD86)配體與CD4+T淋巴細胞的CD28和CLTA-4受體之間的結合(夏普(Sharpe),A.H.等人(2002)“B7-CD28超家族”,自然綜述免疫學(Nature Rev.Immunol.)2:116-126;董(Dong),C.等人(2003)“通過新穎共刺激分子的免疫調節(Immune Regulation by Novel Costimulatory Molecules)”,免疫學研究(Immunolog.Res.)28(1):39-48;林德利(Lindley),P.S.等人(2009)“抑制CD28介導的共刺激的臨床應用(The Clinical Utility Of Inhibiting CD28-Mediated Costimulation)”,免疫學評論(Immunol.Rev.)229:307-321)。B7.1或B7.2至CD28的結合刺激T細胞活化;B7.1或B7.2至CTLA4的結合抑制此類活化(董(Dong),C.等人(2003)“通過新穎共刺激分子的免疫調節(Immune Regulation by Novel Costimulatory Molecules)”,免疫學研究(Immunolog.Res.)28(1):39-48;林德利(Lindley),P.S.等人(2009)“抑制CD28介導的共刺激的臨床效用(The Clinical Utility Of Inhibiting CD28-Mediated Costimulation)”,免疫學評論(Immunol.Rev.)229:307-321);格林沃爾德(Greenwald),R.J.等人(2005)“再論B7家族(The B7 Family Revisited)”,免疫學年鑒(Ann.Rev.Immunol.)23:515-548)。CD28組成型地表達于T細胞表面上(格羅斯(Gross),J.等人(1992)“小鼠中共刺激受體CD28的鑒定和分布(Identification And Distribution Of The Costimulatory Receptor CD28 In The Mouse)”,免疫學雜志(J.Immunol.)149:380-388),而在T細胞活化后CTLA4表達迅速上調(林斯利(Linsley),P.等人(1996)“CTLA4的細胞內轉運和朝向TCR識別的位點的病灶定位(Intracellular Trafficking Of CTLA4 And Focal Localization Towards Sites Of TCR Engagement)”,免疫性(Immunity)4:535-543)。由于CTLA4是更高親和力受體(夏普(Sharpe),A.H.等人(2002)“B7-CD28超家族”,自然評論:免疫學(Nature Rev.Immunol.)2:116-126),所以結合首先啟動T細胞增殖(經由CD28),并且然后抑制它(經由CTLA4的新生表達),由此當不再需要增殖時削弱該作用。
對CD28受體的配體的進一步研究已經導致一組相關B7分子的鑒定和表征(“B7超家族”)(科伊爾(Coyle),A.J.等人(2001)“擴大的B7超家族:增加調節T細胞功能的共刺激信號中的復雜性(The Expanding B7 Superfamily:Increasing Complexity In Costimulatory Signals Regulating T Cell Function)”,自然免疫學(Nature Immunol.)2(3):203-209;夏普(Sharpe),A.H.等人(2002)“B7-CD28超家族”,自然評論:免疫學(Nature Rev.Immunol.)2:116-126;格林沃爾德(Greenwald),R.J.等人(2005)“再論B7家族(The B7 Family Revisited)”,免疫學年鑒(Ann.Rev.Immunol.)23:515-548;柯林斯(Collins),M.等人(2005)“免疫調節配體的B7家族(The B7 Family Of Immune-Regulatory Ligands)”,基因組生物學(Genome Biol.)6:223.1-223.7;洛克(Loke),P.等人(2004)“免疫調節的形成機制:擴展的B7家族和調節性T細胞(Emerging Mechanisms Of Immune Regulation:The Extended B7 Family And Regulatory T Cells)”,關節炎研究治療(Arthritis Res.Ther.)6:208-214;科爾曼(Korman),A.J.等人(2007)“癌癥免疫療法中的檢查點阻斷(Checkpoint Blockade in Cancer Immunotherapy)”,免疫學進展(Adv.Immunol.)90:297-339;弗萊斯(Flies),D.B.等人(2007)“新B7:在腫瘤免疫性中起到關鍵作用(The New B7s:Playing a Pivotal Role in Tumor Immunity)”,免疫治療學雜志(J.Immunother),30(3):251-260;阿加瓦爾(Agarwal),A.等人(2008)“移植和耐受性中正向共刺激分子的作用(The Role Of Positive Costimulatory Molecules In Transplantation And Tolerance)”,器官移植新見(Curr.Opin.Organ Transplant.)13:366-372;蘭斯喬(Lenschow),D.J.等人(1996)“T細胞共刺激的CD28/B7系統)”,免疫學年鑒(Ann.Rev.Immunol.)14:233-258;王(Wang),S.等人(2004)“T淋巴細胞響應的正向和負向調節中B7-CD28家族的共同信號分子(Co-Signaling Molecules Of The B7-CD28 Family In Positive And Negative Regulation Of T Lymphocyte Responses)”,微生物感染(Microbes Infect.)6:759-766)。目前存在該家族的九個已知成員:B7.1(CD80)、B7.2(CD86)、可歸納的共刺激因子配體(ICOS-L、B7-H2),程序化死亡-1配體(PD-L1;B7-H1),程序化死亡-2配體(PD-L2;B7-DC),B7-H3、B7-H4(也稱為B7x、B7-H6和B7S1;西卡(Sica),G.L.等人(2003)“B7-4,B7家族的分子,負向地調節T細胞免疫性(B7-4,A Molecule Of The B7 Family,Negatively Regulates T Cell Immunity)”,免疫性(Immunity)18:849-861;臧(Zang),X.等人(2003)B7x:抑制T細胞活化的廣泛表達的B7家族成員(B7x:A Widely Expressed B7 Family Member That Inhibits T Cell Activation)”,美國國家科學院院刊(Proc.Natl.Acad.Sci.(USA))100:10388-10392;普拉薩德(Prasad),D.V.等人(2003)“B7S1,負向地調節T細胞活化的新穎的B7家族成員(B7S1,A Novel B7 Family Member That Negatively Regulates T Cell Activation)”,免疫性(Immunity)18:863-873),B7-H6(柯林斯(Collins),M.等人(2005)“免疫調節配體的B7家族(The B7 Family Of Immune-Regulatory Ligands)”,基因組生物學(Genome Biol.)6:223.1-223.7)和B7-H5(弗萊尼克(Flajnik),M.F.等人(2012)“B7家族的演化:B7H6和Nkp30的共演化,新B7家族成員B7H7的鑒定,以及B7與MHC的歷史關系的鑒定(Evolution Of The B7 Family:Co-Evolution Of B7H6 And Nkp30,Identification Of A New B7 Family Member,B7H7,And Of B7’s Historical Relationship With The MHC)”,免疫遺傳學(Immunogenetics)64:571-590)。B7基因家族在適應性免疫系統的調節中是至關重要的。大部分B7家族成員包含免疫球蛋白超家族(IgSF)的可變(V)-類型域以及恒定(C)-類型域兩者。
B7配體表達在很多不同細胞類型(包括抗原呈遞細胞(APC))的細胞表面上,并且它們與T細胞上的受體分子的相互作用提供了調節T細胞活化和耐受性的活化和/或抑制性信號(柯林斯(Collins),M.等人(2005)“免疫調節配體的B7家族(The B7 Family Of Immune-Regulatory Ligands)”,基因組生物學(Genome Biol.)6:223.1-223.7)。一些抑制性B7配體還表達在腫瘤細胞上,導致免疫應答的抑制(凱依爾(Keir),M.E.等人(2008)“在耐受性和免疫性中的PD-1及其配體(PD-1 And Its Ligands In Tolerance And Immunity)”,免疫學年鑒(Annu.Rev.Immunol.)26:677-704;鄒(Zou),W.等人(2008)“腫瘤微環境中的抑制性B7家族分子(Inhibitory B7-Family Molecules In The Tumour Microenvironment)”,自然評論:免疫學(Nat.Rev.Immunol.)8:467-477)。因此,刺激或弱化B7配體及其受體的相互作用保持了對自身免疫性疾病、癌癥和感染性疾病的治療潛力(WO 2011/020024;弗萊尼克(Flajnik,M.F.)等人(2012)“B7家族的演化:B7H6和Nkp30的共演化,新B7家族成員B7H7的鑒定,以及B7與MHC的歷史關系的鑒定(Evolution Of The B7 Family:Co-Evolution Of B7H6 And Nkp30,Identification Of A New B7 Family Member,B7H7,And Of B7’s Historical Relationship With The MHC)”,免疫遺傳學(Immunogenetics)64:571-590)。
盡管存在炎癥疾病或自身免疫性疾病的治療中的所有現有進展,但是仍對能夠提供用于此類病癥的治療的增強的免疫療法的組合物存在需要。本發明是針對此類組合物和它們的治療炎癥疾病、自身免疫性疾病、與特征在于高活性免疫系統的類似疾病和病癥的用途。
發明概述
提供了抗體和它們的抗原結合片段,和能夠免疫特異性地結合B7-H5:CD28H通路的B7-H5配體的其他分子,以及此類分子在治療和診斷自身免疫性疾病、移植排斥和其他炎癥疾病中的用途。
一個實施例提供了抗體或具有免疫特異性地結合哺乳動物B7-H5(并且具體地,人類B7-H5)的抗體的抗原結合片段的其他分子。例如,B7-H5可以排列在活細胞的表面上。
示例性活細胞包括但不限于巨噬細胞或樹突細胞。
另一實施例提供了免疫特異性地結合B7-H5并且基本上能夠阻滯B7-H5與CD28H的相互作用的分子。仍另一實施例提供了免疫特異性地結合B7-H5并且基本上不能夠阻滯B7-H5與CD28H的相互作用的分子。
B7-H5結合分子可以具有包含六個CDR的抗原結合片段。這些CDR可以包括抗B7-H5抗體的CDR的至少一個共有CDR:2D3和18C3,其中所有剩余的CDR選自:
(A)抗B7-H5抗體2D3的三個輕鏈CDR和三個重鏈CDR;或
(B)抗B7-H5抗體18C3的三個輕鏈CDR和三個重鏈CDR。
另一實施例提供了B7-H5結合分子,其中六個CDR是:
(A)抗B7-H5抗體2D3的三個輕鏈CDR和三個重鏈CDR;或
(B)抗B7-H5抗體18C3的三個輕鏈CDR和三個重鏈CDR。
在一些實施例中,分子是包括來自兩個或更多個不同B7-H5抗體的抗原結合片段(Fab)的嵌合抗體。
B7-H5結合分子可以是單克隆抗體、人類抗體、嵌合抗體或人源化抗體和/或是雙特異性的、三特異性的或多特異性的抗體。
B7-H5結合分子可以被可檢測地標記或包括軛合的毒素、藥物、受體、酶、或受體配體。
仍另一實施例提供了包含治療有效量的或預防有效量的任何上述B7-H5結合分子和生理學上可接受的載體或賦形劑的藥用組合物。
在其他實施例中,基本上能夠阻滯B7-H5與CD28H的相互作用的分子是CD28H融合蛋白、優選是CD28H-Ig融合蛋白。
還提供了在疾病治療中使用藥用組合物的方法。
用于診斷受試者中疾病的方法包括針對它們結合任何上述B7-H5結合分子的能力測定受試者的細胞,其中該方法提供了用于診斷受試者中疾病的存在的細胞學測定。
披露的B7-H5結合分子可以用于自身免疫性疾病或移植排斥。
附圖簡要說明
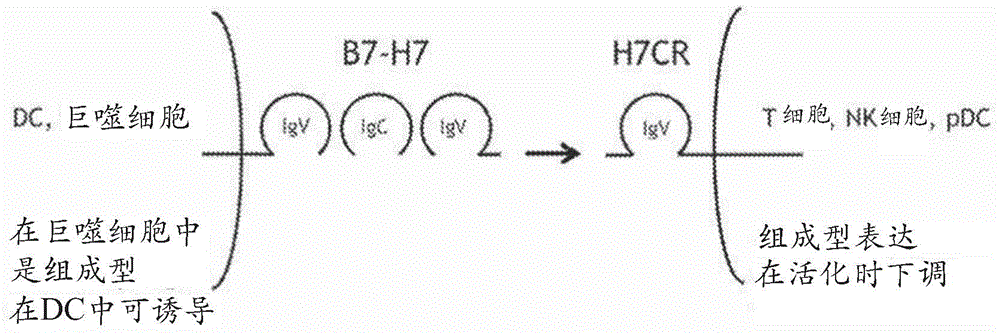
圖1提供了B7-H5及其反受體CD28H的示意性描繪。
圖2,小圖A-J示出B7-H5組成型地表達在巨噬細胞上并且在樹突細胞上可誘導。
圖3,小圖A-D示出CD28H表達在T細胞和自然殺傷(NK)細胞上,但并不表達在B細胞上。
圖4A-4B示出由克隆2D3和18C3產生的抗體結合由CHO轉染子表達的人類B7-H5的能力。
圖5A-5C示出分離的抗體和對照Ig阻滯B7-H5:CD28H相互作用的能力。
圖6示出B7-H5Ig融合體刺激T細胞應答的能力。
圖7示出B7-H5Ig誘導以下細胞因子的表達的能力:IL-2、IFN-γ和IL-10。
圖8示出本發明的抗B7-H5抗體2D3能夠結合B7-H5,以便阻滯B7-H5與其CD28H反受體相互作用的能力。
圖9示出抗B7-H5抗體2D3抑制異體T細胞應答的能力。
圖10A和圖10B示出在植入人類PBMC的NSG小鼠中,在脾臟(圖10A)和外周血(圖10B)中,在活化的(CD45RO+)人類T細胞中,抗人類B7-H5抗體對CD28H+細胞的百分比的影響。
圖11A和圖11B示出在植入人類PBMC的NSG小鼠中,在脾臟(圖11A)和外周血(圖11B)中,在原初(CD45RO-)人類T細胞中,抗人類B7-H5抗體對CD28H+細胞的百分比的影響。
圖12A-12C示出重組抗人類B7-H5嵌合抗體(2D3和18C3)的結合特性。圖12A-12C示出已經從它們的鼠IgG同種型重組地轉化為人類IgG4同種型的抗人類B7-H5抗體(2D3和18C3)結合由CHO細胞表達的人類B7-H5的能力。
圖13(小圖A-C)示出重組抗人類B7-H5嵌合抗體(2D3和18C3)完全阻滯CD28H融合蛋白至CHO B7-H5轉染子的結合的能力。用對照上清液(小圖A)或重組嵌合體2D3(小圖B)和18C3上清液(小圖C)預孵育人類B7-H5 FL CHO轉染子,并且隨后用生物素酰化的CD28HhIg融合蛋白進行染色。
圖14A-14B示出抗人類B7-H5抗體(2D3和18C3)的表位識別位點。圖14A和圖14B示出2D3和18C3識別B7-H5的第一IgV結構域。圖14C示出B7-H5 IgV結構域介導B7-H5與CD28H的相互作用。
圖15比較了抗體2D3和18C3結合如表達在CHO細胞的表面上的人類B7-H5的親和力。
圖16A-16B示出內源B7-H5:CD28H相互作用對TT特異性記憶T細胞的召回的影響。圖16A示出在存在阻滯抗體2D3(小圖B)或對照Ig(小圖A)的B7-H5:CD28H相互作用時,TT疫苗誘導的T細胞增殖。圖16B示出與這種應答關聯的表達的細胞因子(小圖A)和BrdU-陽性細胞(小圖B)的水平。
圖17A-17B示出通過2D3的內源B7-H5:CD28H相互作用的阻滯抑制了人源化NSG小鼠中CD8+(圖17A,小圖A-B)和CD4+(圖17B,小圖A-B)T細胞二者的異體增殖應答。
圖18示出在刺激后30min,TCR和B7-H5融合蛋白的同時交聯誘導AKT磷酸化,同時TCR交聯單獨誘導最小的AKT磷酸化。重要地,B7-H5抗體2D3的包含阻止了AKT活化,表明B7-H5共刺激利用了AKT通路來促進T細胞應答。
圖19示出通過誘餌受體融合蛋白CD28HIg阻滯B7-H5-CD28H通路抑制了異體CD8T細胞針對B7-H5轉染的624Mel黑色素瘤細胞系的細胞毒性殺傷活性,表明B7-H5-CD28H通路促進CD8T細胞對靶細胞的細胞毒性殺傷活性。
圖20A-B示出在可溶性重組人類IL-2存在時,自然殺傷細胞(NK)上的CD16和B7-H5融合蛋白的同時交聯誘導NK活化和脫粒(CD107a表面上調),而單獨CD16接合并不誘導顯著的NK脫粒。觀察到B7-H5融合蛋白劑量依賴性NK活化(圖20A)。重要地,B7-H5抗體2D3的包含阻止了NK活化(圖20B),表明B7-H5共刺激NK活化。
發明詳細說明:
本發明涉及抗體和它們的抗原結合片段,并且涉及能夠免疫特異性地結合B7-H5:CD28H通路的B7-H5配體的其他分子,并且涉及此類分子在治療和診斷自身免疫性疾病、移植排斥和其他炎癥疾病中的用途。
B7-H5:CD28H通路是涉及配體B7-H5及其反受體CD28H的細胞免疫通路(圖1)。B7-H5表達在抗原呈遞細胞上;它組成型地表達在巨噬細胞上并且在樹突細胞上是可誘導的(圖2,小圖A-J)。CD28H特別表達于原初T細胞、NK細胞、和漿細胞樣樹突細胞(尤其是在脾臟、淋巴結和胸腺)上,并且它的表達在成熟的或活化的細胞上被下調。它并不表達在γδT細胞或B細胞上(圖3),但是表達在Tn、TCM、TEM、和TEMRA T細胞亞群上。人類臍帶血T細胞表達CD28H,而CD4+、CD8+和CD4+/CD8+胸腺細胞也是如此。B7-H5與CD28H反受體相互作用,以刺激免疫系統,由此促進增強的免疫應答。已經發現CD28H的下調在體內損害了活化的T細胞/記憶T細胞存活。因此,對于體內天然T細胞引發和活化的T細胞/記憶T細胞存活,B7-H5和CD28H之間的相互作用是重要的。還見到在長期抗原暴露的/疲憊的T細胞中,CD28H下調。CD28H組成型地表達在自然殺傷細胞(NK)上。在NK活化信號,例如CD16交聯存在時,B7-H5-CD28H通路促進NK活化和脫粒。
本發明部分地反映了對以下的識別:分子例如免疫特異性地結合B7-H5的抗體及其抗原結合片段(“抗B7-H5抗體”),并且具體地是阻滯B7-H5:CD28H相互作用以便損害(即阻止或弱化)B7-H5結合CD28H的能力的抗B7-H5抗體或誘餌受體融合蛋白CD28HIg,能夠損害B7-H5經由CD28H相互作用促進增強的免疫應答的能力,并且因此能夠用作T細胞增殖和細胞因子產生以及HK活化的拮抗劑。此類分子能夠介導免疫系統活化中的生理學下降,并且因此具有在治療炎癥疾病和自身免疫性疾病中的效用。具體地,此類抗體能夠降低體內活化的T細胞和NK細胞的百分比。
A.B7-H5
發現B7-H5氨基酸序列類似于先前發現的人類基因,HHLA2(人類內源性逆轉錄病毒-H長末端重復相關蛋白2)(HHLA2);梅格(Mager),D.L.等人(1999)“內源性逆轉錄病毒提供了針對兩個新人類基因(HHLA2和HHLA3)的初級聚腺苷酸化信號(Endogenous Retroviruses Provide The Primary Polyadenylation Signal For Two New Human Genes(HHLA2And HHLA3)”,基因組學(Genomics)59:255-263),HHLA2不具有已知功能(弗萊尼克(Flajnik),M.F.等人(2012)“B7家族的演化:B7H6和Nkp30的共演化,新B7家族成員B7H7的鑒定,以及B7與MHC的歷史關系的鑒定(Evolution Of The B7 Family:Co-Evolution Of B7H6 And Nkp30,Identification Of A New B7 Family Member,B7H7,And Of B7’s Historical Relationship With The MHC)”,免疫遺傳學(Immunogenetics)64:571-590)。B7-H5在此和其他地方還稱為B7-H7。相應地,術語B7-H5和B7-H7是在此可互換地使用。
已經發現B7-H5序列在雞、負鼠、有蹄哺乳動物(例如馬、豬)、鮭魚、和鯊魚中具有同系物。然而,迄今僅在嚙齒動物(小鼠以及大鼠)中鑒定了擬基因。此類基因的氨基酸序列在所有物種中揭示了一個類似的域結構,具有針對Ig超家族域的典型殘基的保守性。
人類B7-H5多肽長度是414個氨基酸,并且已經報道,它包含以下:信號序列、具有3個免疫球蛋白樣(Ig樣)結構域的胞外結構域、跨膜結構域、和胞質結構域。具體而言,該人類B7-H5多肽已被報導包含Ig樣V-類型1結構域、Ig樣C-1類型結構域、以及Ig樣V-類型2結構域。存在B7-H5的多個天然存在的變體(例如登錄號Q9UM44-1(智人)、NP_009003(GI:5901964,智人)、以及AAD48396(GI:15726285,智人);參見WO 2011/020024)。
術語“天然B7-H5”(也稱為“天然B7-H7”)是指任何天然存在的B7-H5氨基酸序列,包括不成熟的或前體的以及成熟的形式。代表性人類B7-H5的氨基酸序列,登錄號Q9UM44-1,是(SEQ ID NO:1):
已經報道人類B7-H5包含以下:大致在SEQ ID NO:1的氨基酸殘基1至22的信號序列、大致在SEQ ID NO:1的氨基酸殘基61至131的Ig樣V型1結構域(以上下劃線示出)、大致在SEQ ID NO:1的氨基酸殘基138至222的Ig樣C-1型結構域、大致在SEQ ID NO:1的氨基酸殘基235至328的Ig樣V型2結構域、和大致在SEQ ID NO:1的氨基酸殘基345至365的跨膜結構域。針對人類B7-H5多肽的預測的二聚體界面是SEQ ID NO:1的氨基酸殘基141-144、156、158、160、162、193-196、198、200、201、224、和225。針對人類B7-H5多肽的預測的N-連接的糖基化位點是SEQ ID NO:1的氨基酸殘基90、103、和318。人類B7-H5多肽的自然變異包括BOT、N344K、和S346R(UniProt Q9UM44)(參見WO 2011/020024,將其針對人類B7-H5的結構和序列的傳授內容,通過引用以其全文結合在此)。
編碼人類B7-H5(SEQ ID NO:1)的DNA序列是(SEQ ID NO:2):
代表性人類B7-H5IgV結構域人類IgG4融合蛋白的氨基酸序列是(SEQ ID NO:3)(以黑體字示出B7-H5序列;下劃線示出IgG4序列):
融合蛋白可以另外包括N末端前導序列(SEQ ID NO:1的此類殘基1-22,即天然存在的B7-H5前導序列(SEQ ID NO:4)):
MKAQTALSFF LILITSLSGS QG
編碼天然存在的B7-H5前導序列的DNA序列是(SEQ ID NO:5):
atgaaggccc agaccgccct gtccttcttc ctgatcctga tcacctccct
gtccggcagc caggga
雖然根據本發明,已經示出B7-H5序列融合至人類IgG4區域,但是此類序列可以可替代地融合至任何Ig同種型,或確實融合至任何其他蛋白。
編碼人類B7-H5IgV-hIgG4(SEQ ID NO:3)的DNA序列是(SEQ ID NO:6):
包括B7-H5的胞外結構域的代表性人類B7-H5人類IgG4P融合蛋白的氨基酸序列是(SEQ ID NO:24)(B7-H5ECD-hIgG4P,其中B7-H5 ECD aal-340加有下劃線,并且絲氨酸228至脯氨酸的突變加有雙下劃線)
IFPLAFFIYVPMNEQIVIGRLDEDIILPSSFERGSEVVIHWKYQDSYKVHSYYKGSDHLESQDPRYANRTSLFYNEIQNGNASLFFRRVSLLDEGIYTCYVGTAIQVITNKVVLKVGVFLTPVMKYEKRNTNSFLICSVLSVYPRPIITWKMDNTPISENNMEETGSLDSFSINSPLNITGSNSSYECTIENSLLKQTWTGRWTMKDGLHKMQSEHVSLSCQPVNDYFSPNQDFKVTWSRMKSGTFSVLAYYLSSSQNTIINESRFSWNKELINQSDFSMNLMDLNLSDSGEYLCNISSDEYTLLTIHTVHVEPSQETESKYGPPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSPG
信號序列可以是天然信號序列(SEQ ID NO:29)
MKAQTALSFFLIL工TSLSGSQG
融合蛋白可以是由核酸序列(SEQ ID NO:25)編碼
atgaaggcccagaccgccctgtccttcttcctgatcctgatcacctccctgtccggcagccagggaatcttccctctggccttcttcatctacgtgcccatgaacgagcagatcgtgatcggccggctggacgaggatattatcctgccctccagcttcgagcggggctccgaggtcgtgatccactggaagtaccaggactcctacaaggtgcactcctactacaagggctccgaccacctggaatcccaggaccccagatacgccaaccggaccagcctgttctacaacgagatccagaacggcaacgcctccctgttcttccggcgagtgtccctgctggatgagggcatctacacctgttacgtgggcaccgccatccaagtgatcaccaacaaggtggtgctgaaagtgggcgtgttcctgacccccgtgatgaagtacgagaagcggaataccaactctttcctgatctgctccgtgctgtccgtgtaccctcggcccatcatcacctggaagatggacaacacccccatctccgagaacaacatggaagagacaggctccctggactccttctccatcaactcccccctgaacattaccggctccaactcctcctacgagtgcaccatcgagaactccctgctgaagcagacctggaccggcagatggactatgaaggacggcctgcacaagatgcagtccgagcacgtgtccctgtcctgccagcccgtgaacgactacttcagccccaaccaggacttcaaagtgacctggtcccggatgaagtccggcaccttcagcgtgctggcctactacctgtccagctcccagaacaccatcatcaacgagtcccggttctcctggaacaaagagctgatcaaccagtccgacttctccatgaacctgatggacctgaacctgtccgacagcggcgagtacctgtgcaacatctccagcgacgagtacaccctgctgaccatccacaccgtgcacgtggaaccctcccaggaaaccgagtctaagtacggccctccctgcccaccttgtcccgcccctgaatttctgggcggaccctctgtgttcctgttccccccaaagcccaaggacaccctgatgatctcccggacccccgaagtgacatgcgtggtggtggatgtgtcccaggaagatcccgaggtgcagttcaattggtacgtggacggcgtggaagtgcacaacgccaagaccaagcccagagaggaacagttcaactccacctaccgggtggtgtctgtgctgaccgtgctgcaccaggactggctgaacggcaaagagtacaagtgcaaggtgtccaacaagggcctgcccagctccatcgaaaagaccatctccaaggccaagggccagccccgggaaccccaggtgtacacactgcctccaagccaggaagagatgaccaagaaccaggtgtccctgacttgcctcgtgaagggcttctacccctccgatatcgccgtggaatgggagtccaacggccagcctgagaacaactacaagaccaccccccctgtgctggactccgacggctctttcttcctgtactcccgcctgaccgtggacaagtccagatggcaggaaggcaacgtgttctcctgcagcgtgatgcacgaggccctgcacaaccactacacccagaagtccctgagcctgtcccccggctga
相比于被廣泛表達的人類B7-H4,發現人類B7-H5展現更受限的表達(例如,表達于腸、腎、肺、上皮細胞和淋巴細胞中)。人類HHLA2發現于靠近B7.1以及B7.2的染色體3q13.33上。B7-H5組成型地表達于巨噬細胞上并且在樹突細胞(DC)上是可誘導的。
B.CD28H
CD28H,在此和其他地方還稱為H7CR,是針對B7-H5的反受體。相應地,術語CD28H和H7CR是在此可互換地使用的。如在此使用,術語“天然CD28H”(還稱為“天然H7CR”)是指B7-H5的天然存在的反受體、或其變體。T細胞、NK細胞、和漿細胞樣樹突細胞表達CD28H。在文獻/數據庫中,人類CD28H多肽另外稱為含跨膜結構域和免疫球蛋白結構域2(TMIGD2)(拉希米(Rahimi),N.等人(2012年3月14日電子出版)“鑒定IGPR-1為血管發生中涉及的新穎粘附分子(Identification Of IGPR-1As A Novel Adhesion Molecule Involved In Angiogenesis)”,分子生物學和細胞生物學(Molec.Biol.Cell.)23(9):1646-1656),但是CD28H的功能并未在先前解釋。針對此類天然CD28H分子的氨基酸序列的登錄號的非限制性實例包括:Q96BF3-1(智人)、Q96BF3-2(智人)、NP_653216.1(GI:21389429;智人)和NP_653216.2(GI:281306838;智人)。以下提供了天然CD28H分子的代表性氨基酸序列(Q96BF3-2),為SEQ ID NO:7:
編碼人類CD28H(SEQ ID NO:7)的DNA序列是(SEQ ID NO:8):
C.定義
如此處使用的,如果這種結合展現一種抗體結合至其同源抗原的特異性以及親和力的話,則稱一種分子能夠“免疫特異性地結合”一種第二分子。如果這種結合涉及免疫球蛋白分子的抗原識別位點的話,則稱抗體能夠“免疫特異性地結合”至抗原(并且特別是抗原B7-H5)的靶區域或構造(“表位”)。免疫特異性地結合到具體的抗原的抗體可以按更低的親和力結合到其他抗原,前提是如果該其他抗原具有由如通過例如免疫測定、測定、或本領域中已知的其他測定確定的抗原識別位點所識別的一些序列或構造相似性的話,但不會結合至完全不相關的抗原。然而,優選地,抗體(及其抗原結合片段)將不與其他抗原發生交叉反應。抗體也可以按非免疫特異性的方式結合到其他分子,諸如結合到FcR受體,憑借該分子的不涉及該抗原識別位點的其他區域/域中的結合結構域,諸如Fc區。
如在結合或展現的效果的背景下使用的術語“基本上”旨在表示所觀察到的效果是生理學或治療相關的。因此,例如,如果阻滯的程度是生理學或治療相關的話(例如如果這種程度大于完全阻滯的60%,大于完全阻滯的70%,大于完全阻滯的75%,大于完全阻滯的80%,大于完全阻滯的85%,大于完全阻滯的90%,大于完全阻滯的95%,或大于完全阻滯的97%),一種分子能夠基本上阻滯B7-H5的活性。類似地,如果此類免疫特異性以及表征是大于60%相同的,大于70%相同的,大于75%相同的,大于80%相同的,大于85%相同的,大于90%相同的,大于95%相同的,或大于97%相同的,則稱一種分子與另一種分子具有基本上相同的免疫特異性和/或表征)。
如此處使用的,術語“受試者”旨在表示一種哺乳動物,諸如非靈長類(例如,母牛、豬、馬、貓、狗、大鼠等)以及靈長類(例如,猴以及人),最優選是人。術語“患者”旨在表示接受用于診斷、治療或預防目的的本發明組合物的受試者。
如此處使用的,術語“抗體”旨在表示具有“可變區”抗原識別位點的免疫球蛋白分子。術語“可變區”旨在將該免疫球蛋白的這種域與抗體廣泛共享的域(例如抗體Fc域)區分。該可變區包括“高變區”,該高變區的殘基負責抗原結合。高變區包括來自“互補決定區”或“CDR”的氨基酸殘基(即典型地,在輕鏈可變結構域中,大致在殘基24-34(L1)、50-56(L2)和89-97(L3)處,并且在重鏈可變結構域中,大致在殘基27-35(H1)、50-65(H2)和95-102(H3)處;卡巴特(Kabat)等人,具有免疫學興趣的蛋白的序列(Sequences of Proteins of Immunological Interest),第5版,公共衛生署,美國國立衛生研究院,貝塞斯達,馬里蘭州,(1991))和/或來自“高變環”的那些殘基(即在輕鏈可變結構域中,殘基26-32(L1)、50-52(L2)和91-96(L3),和在重鏈可變結構域中殘基26-32(H1)、53-55(H2)和96-101(H3);喬西亞(Chothia)和Lesk(萊斯克),1987,分子生物學雜志(J.Mol.Biol.)196:901-917)。“框架區”或“FR”殘基是除了如在此定義的高變區殘基以外的那些可變結構域殘基。術語抗體包括單克隆抗體、多特異性抗體、人類抗體、人源化抗體、合成抗體、嵌合抗體、駱駝化抗體(參見例如謬德曼斯(Muyldermans)等人,2001,生物化學科學趨勢(Trends Biochem.Sci.)26:230;納托爾(Nuttall)等人,2000,當今藥物生物技術(Cur.Pharm.Biotech.)1:253;賴克曼(Reichmann)和謬德曼斯(Muyldermans),1999,免疫學方法雜志(J.Immunol.Meth.),231:25;國際公開號WO 94/04678和WO 94/25591;美國專利號No.6,005,079)、單鏈Fv(scFv)(參見例如,參見單克隆當體的藥物學中的普朗克塞(Pluckthun in The Pharmacology of Monoclonal Antibodies),卷113,羅森堡(Rosenburg)和摩爾(Moore)編輯,施普林格出版公司,紐約,269-315頁(1994))、單鏈抗體、二硫化物連接的Fv(sdFv)、胞內抗體、和抗個體基因型(抗Id)抗體(包括披露的B7-H5抗體的抗Id和抗-抗Id抗體)。具體地,此類抗體包括任何類型的免疫球蛋白分子(例如IgG、IgE、IgM、IgD、IgA、以及IgY)、類別(例如IgG1、IgG2、IgG3、IgG4、IgA1、以及IgA2)或子類。
如在此使用,術語抗體的“抗原結合片段”是指抗體中的包括抗體的互補決定區(“CDR”)和任選地含抗體的“可變區”抗原識別位點的框架殘基的、并且展現出免疫特異性地結合抗原的能力的一個或多個部分。此類片段包括Fab',F(ab')2,Fv,單鏈(ScFv),及其突變體,天然存在的變體,以及包括該抗體的“可變區”抗原識別位點以及一種異源蛋白(例如,毒素、針對不同抗原的抗原識別位點、酶、受體或受體配體等)的融合蛋白。如此處使用的,術語“片段”是指一種肽或多肽,該肽或多肽包括至少5個連續的氨基酸殘基、至少10個連續的氨基酸殘基、至少15個連續的氨基酸殘基、至少20個連續的氨基酸殘基、至少25個連續的氨基酸殘基、至少40個連續的氨基酸殘基、至少50個連續的氨基酸殘基、至少60個連續的氨基殘基、至少70個連續的氨基酸殘基、至少80個連續的氨基酸殘基、至少90個連續的氨基酸殘基、至少100個連續的氨基酸殘基、至少125個連續的氨基酸殘基、至少150個連續的氨基酸殘基、至少175個連續的氨基酸殘基、至少200個連續的氨基酸殘基、或至少250個連續的氨基酸殘基的氨基酸序列。
抗人類B7-H5抗體的人類、嵌合或人源化衍生物對于在人體內使用是特別優選的,然而,可有利地采用鼠抗體或其他物種的抗體用于許多用途(例如,體外或原位檢測測定,急性體內使用等)。在一個或多個非人類CDR中,人源化抗體可以包括氨基酸殘基取代、缺失或添加。當與非衍生物人源化抗體相比時,人源化抗體衍生物可以具有基本上相同的結合、更強的結合或更弱的結合。在特定實施例中,該CDR的一、二、三、四、或五個氨基酸殘基已被取代、缺失或添加(即,突變)。完全人類抗體對于人類受試者的治療性治療是特別令人希望的。
人類抗體可以通過在本領域中已知的多種方法來制造,包括使用衍生自人類免疫球蛋白序列的抗體文庫的上述的噬菌體展示方法(參見美國專利號4,444,887和4,716,111;以及國際公開號WO 98/46645、WO 98/50433、WO 98/24893、WO 98/16654、WO 96/34096、WO 96/33735、和WO 91/10741)。人類抗體可以使用轉基因小鼠來產生,這些轉基因小鼠不能表達功能內源性免疫球蛋白,但是可以表達人類免疫球蛋白基因。例如,可以隨機地或通過同源重組將人類重鏈和輕鏈免疫球蛋白基因復合物引入到小鼠胚胎干細胞之中。可替代地,除了人類重鏈和輕鏈基因之外,還可以將人類可變區、恒定區和多樣區(diversity region)引入到小鼠胚胎干細胞之中。可以單獨使小鼠重鏈和輕鏈免疫球蛋白基因無功能,或在引入人類免疫球蛋白基因座的同時通過同源重組來使這些免疫球蛋白基因無功能。具體地說,JH區的純合缺失防止內源性抗體產生。修飾的胚胎干細胞擴增并且微注射到胚囊中以便產生嵌合小鼠。然后使嵌合小鼠繁殖以便產生表達人類抗體的純合子代。使用常規方法學,用選擇的抗原(例如,B7-H5多肽的全部或一部分)來對轉基因小鼠免疫。針對抗原的單克隆抗體可以使用常規的雜交瘤技術從免疫的轉基因小鼠獲得(參見例如美國專利號5,916,771)。轉基因小鼠所具有的人類免疫球蛋白轉基因在B細胞分化過程中重排,并且隨后進行類別轉換和體細胞突變。因此,使用這種技術,可能產生治療有用的IgG、IgA、IgM以及IgE抗體。為了綜述用于產生人類抗體的此技術,參見倫博格(Lonberg)和胡薩爾(Huszar)(1995,免疫學國際綜述(Int.Rev.Immunol.)13:65-93,將其通過引用以其全文結合在此)。為了詳細討論用于產生人類抗體和人類單克隆抗體的此技術和用于產生此類抗體的方案,參見例如國際公開號WO 98/24893、WO 96/34096、和WO 96/33735;和美國專利號5,413,923、5,625,126、5,633,425、5,569,825、5,661,016、5,545,806、5,814,318、以及5,939,598,將其通過引用以其全文結合在此。此外,公司諸如安根尼克斯(Abgenix)公司(弗里蒙特(Freemont),加利福尼亞州)以及梅達瑞克斯(Medarex)(普林斯頓(Princeton),新澤西州)能夠參與使用類似于上述的技術針對選擇的抗原提供人類抗體。
“嵌合抗體”是其中抗體的不同部分衍生自不同的免疫球蛋白分子的分子,如具有衍生自一種非人類抗體的可變區和人類免疫球蛋白恒定區的抗體。產生嵌合抗體的方法在本領域中是已知的。參見例如莫里森(Morrison),1985,科學(Science)229:1202;維(Oi)等人,1986,生物技術(BioTechniques)4:214;吉利斯(Gillies)等人,1989,免疫學方法雜志(J.Immunol.Methods)125:191-202;和美國專利號6,311,415、5,807,715、4,816,567、和4,816,397。可以使用本領域已知的多種多樣的技術,例如CDR移植(EP 239,400;國際公開號WO 91/09967;和美國專利號5,225,539、5,530,101、以及5,585,089),鑲合(veneering)或表面重修(EP 592,106、EP 519,596;巴丹(Padlan),1991,分子免疫學(Molecular Immunology)28(4/5):489-498;斯塔德尼卡(Studnicka)等人,1994,蛋白工程(Protein Engineering)7:805;以及羅古斯卡(Roguska)等人,1994,美國國家科學院院刊(Proc.Natl.Acad.Sci.USA)91:969),以及鏈改組(美國專利號5,565,332),來產生包括來自非人類物種的一個或多個CDPvS和來自人類免疫球蛋白分子的框架區的嵌合抗體。
本發明具體地涉及“人源化抗體”(參見例如歐洲專利號EP 239,400、EP 592,106、和EP 519,596;國際公開號WO 91/09967和WO 93/17105;美國專利號5,225,539、5,530,101、5,565,332、5,585,089、5,766,886、和6,407,213;以及巴丹(Padlan),1991,分子免疫學(Molecular Immunology)28(4/5):489-498;斯塔德尼卡(Studnicka)等人,1994,蛋白工程(Protein Engineering)7(6):805-814;羅古斯卡(Roguska)等人,1994,美國國家科學院院刊(PNAS)91:969-973;譚(Tan)等人,2002,免疫學雜志(J.Immunol)169:1119-1125;卡爾達(Caldas)等人,2000,蛋白工程(Protein Eng.)13:353-360;摩里亞(Morea)等人,2000,方法(Methods)20:267-79;巴卡(Baca)等人,1997,生物化學雜志(J.Biol.Chem.)272:10678-10684;羅古斯卡(Roguska)等人,1996,蛋白工程(Protein Eng.)9:895-904;庫托(Couto)等人,1995,癌癥研究(Cancer Res.)55(23增刊):5973s-5977s;庫托(Couto)等人,1995,癌癥研究(Cancer Res.)55:1717-22;桑德胡(Sandhu),1994,基因(Gene)150:409-10;佩德森(Pedersen)等人,1994,分子生物學雜志(J.Mol.Biol.)235:959-973;瓊斯(Jones)等人,1986,自然(Nature)321:522-525;賴克曼(Reichmann)等人,1988,自然(Nature)332:323-329;以及普雷斯塔(Presta),1992,結構生物學新見(Curr.Op.Struct.Biol.)2:593-596)。如在此使用,術語“人源化抗體”是指包括人類框架區和來自非人類(通常是小鼠或大鼠)免疫球蛋白的一個或多個CDR的免疫球蛋白。提供CDR的非人類免疫球蛋白稱為“供體”,并且提供框架的人類免疫球蛋白稱為“受體”。并不需要存在恒定區,但是如果它們存在,它們必須與人類免疫球蛋白恒定區基本上一致,即至少約85%-90%、優選約95%或更多地一致。因此,除了可能地CDR外,人源化免疫球蛋白的所有部分基本上與天然人類免疫球蛋白序列的相應部分相同。人源化抗體是包括人源化輕鏈的和人源化重鏈的免疫球蛋白的抗體。例如,人源化抗體將不涵蓋典型的嵌合抗體,因為例如嵌合抗體的完整可變區是非人類的。有人說,通過“人源化(humanization)”的過程供體抗體被“人源化”,因為預期所得到的人源化抗體結合到與提供該CDR的供體抗體針對的相同的抗原上。對于大部分,人源化抗體是人類免疫球蛋白(受體抗體),其中該受體的高變區殘基被來自具有希望的特異性、親和力、以及能力的非人類物種(供體抗體)諸如小鼠、大鼠、兔或非人類靈長動物的高變區殘基替代。在一些情況下,人類免疫球蛋白的框架區(FR)殘基被相應的非人類殘基替代。此外,人源化抗體可以包括在受體抗體或供體抗體中未發現的殘基。進行這些修飾以便使抗體性能進一步改進。通常,人源化抗體將基本上都包括至少一個、并且典型地兩個可變結構域,其中所有或基本上所有的高可變區對應于非人類免疫球蛋白的那些,并且所有或基本上所有的FR是具有人類免疫球蛋白序列的那些。人源化抗體任選地還將包括免疫球蛋白恒定區(Fc)的至少一部分,典型地是免疫特異性地結合到Fc RIIB多肽的、已經通過引入氨基酸殘基取代、缺失或添加(即突變)改變的人類免疫球蛋白的那部分。
編碼優選的人類受體框架序列的DNA序列包括但不限于來自人類種系VH區段VH1-18和JH6以及人類種系VL區段VK-A26和JK4的FR區段。在特定實施例中,使用常規重組DNA技術將這些CDR中的一個或多個插入框架區內。框架區可以是天然存在的或共有的框架區、并且優選是人類框架區(參見例如喬西亞(Chothia)等人,1998,“免疫球蛋白可變結構域的序列中的結構確定(Structural Determinants In The Sequences Of Immunoglobulin Variable Domain)”,分子生物學雜志(J.Mol.Biol.)278:457-479中的人類框架區列表)。
人源化或嵌合的B7-H5抗體基本上包括至少一個、并且典型地兩個可變結構域的全部,其中所有或基本上所有的CDR區對應于非人類免疫球蛋白(即,供體抗體)的那些,并且所有或基本上所有的框架區是具有人類免疫球蛋白共有序列的那些。優選地,B7-H5抗體還包括免疫球蛋白恒定區(Fc)的至少一部分,典型地是人類免疫球蛋白的那部分。可相對于所提出的B7-H5抗體的功能(具體而言可能需要的效應子功能)來選擇該抗體的恒定結構域。在一些實施例中,B7-H5抗體的恒定結構域是(或包括)人類IgA、IgD、IgE、IgG或IgM結構域。在特定實施例中,當人源化B7-H5抗體是旨在用于治療用途并且需要抗體效應子功能(例如抗體依賴性細胞介導的細胞毒性(ADCC)和補體依賴性細胞毒性(CDC)活性)時,使用人類IgG恒定結構域,尤其是IgG1和IgG3同種型的人類IgG恒定結構域。在替代實施例中,當B7-H5抗體是旨在用于治療目的并且不要求抗體效應子功能時,使用IgG2和IgG4同種型。本發明涵蓋包括改變抗體效應子功能(例如美國專利申請公開號2005/0037000和2005/0064514中披露的那些)的一個或多個氨基酸修飾的Fc恒定結構域。
在一些實施例中,B7-H5抗體包含輕鏈連同至少重鏈的可變結構域二者。在其他實施例中,B7-H5抗體可以進一步包括重鏈的CH1、絞鏈、CH2、CH3、和CH4區中的一個或多個。抗體可以選自任何類別的免疫球蛋白(包括IgM、IgG、IgD、IgA和IgE)以及任何同種型(包括IgG1、IgG2、IgG3和IgG4)。在一些實施例中,恒定結構域是補體固定恒定結構域,其中希望抗體展示細胞毒性活性,并且該類別典型地是IgG1。在其他實施例中,在這種細胞毒性活性不是令人希望的情況下,恒定結構域可以是IgG2類別的。B7-H5抗體可以包括來自多于一個類別或同種型的序列,并且選擇具體的恒定結構域來優化希望的效應子功能是在本領域普通技術內的。
人源化抗體的框架區和CDR區不需要精確地對應于親本序列,例如,供體CDR或共有框架可以通過至少一個殘基的取代、插入或缺失來進行誘變,以使得在那個位點處的CDR或框架殘基不對應于共有抗體或供體抗體。然而,此類突變優選不是廣泛的。通常,人源化抗體殘基的至少75%將對應于親本框架區(FR)和CDR序列的那些,更通常90%、并且最優選大于95%。可以使用本領域已知的多種多樣的技術來產生人源化抗體,這些技術包括但不限于CDR移植(歐洲專利號EP 239,400;國際公開號WO 91/09967;和美國專利號5,225,539、5,530,101、和5,585,089),鑲合或表面重修(歐洲專利號EP 592,106和EP 519,596;巴丹(Padlan),1991,分子免疫學(Molecular Immunology)28(4/5):489-498;斯塔德尼卡(Studnicka)等人,1994,蛋白工程(Protein Engineering)7(6):805-814;和羅古斯卡(Roguska)等人,1994,美國國家科學院院刊(Proc.Natl.Acad.Sci.)91:969-973),鏈改組(美國專利號5,565,332),和在例如以下中披露的技術:美國專利號6,407,213、5,766,886、5,585,089,國際公開號WO 9317105,譚(Tan)等人,2002,免疫學雜志(J.Immunol)169:1119-1125;卡爾達(Caldas)等人,2000,蛋白工程(Protein Eng.)13:353-360;摩里亞(Morea)等人,2000,方法(Methods)20:267-79;巴卡(Baca)等人,1997,生物化學雜志(J.Biol.Chem.)272:10678-84;羅古斯卡(Roguska)等人,1996,蛋白工程(Protein Eng.)9:895-904;庫托(Couto)等人,1995,癌癥研究(Cancer Res.)55(23增刊):5973s-5977s,庫托(Couto)等人,1995,癌癥研究(Cancer Res.)55:1717-22,桑德胡(Sandhu),1994,基因(Gene)150:409-10;佩德森(Pedersen)等人,1994,分子生物學雜志(J.Mol.Biol.)235:959-973;瓊斯(Jones)等人,1986,自然(Nature)321:522-525;賴克曼(Reichmann)等人,1988,自然(Nature)332:323;以及普雷斯塔(Presta),1992,結構生物學新見(Curr.Op.Struct.Biol.)2:593-5966。通常,框架區中的框架殘基將用來自CDR供體抗體的對應殘基來取代以便改變、優選地改進抗原結合。這些框架取代是通過本領域熟知的方法鑒定的,例如通過對CDR和框架殘基的相互作用建模以鑒定對抗原結合重要的框架殘基,并且通過序列比較以鑒定在特定位置上的不尋常框架殘基。參見例如奎因(Queen)等人,美國專利號5,585,089;美國公開號2004/0049014和2003/0229208;美國專利號6,350,861;6,180,370;5,693,762;5,693,761;5,585,089;以及5,530,101和賴克曼(Riechmann)等人,1988,自然(Nature)332:323)。
用于本發明的方法中的抗體可以是單特異性的。還感興趣的是雙特異性的抗體、三特異性的抗體或具有更大的多特異性的抗體,這些抗體展現對除B7-H5外的不同靶標(諸如免疫系統的其他分子)的特異性。例如,此類抗體可結合到B7-H5和如下的一種抗原兩者上,該抗原對將該抗體靶標至具體的細胞類型或組織是重要的(例如,靶標至與正治療的腫瘤的癌抗原關聯的一種抗原)。在另一實施例中,這種多特異性抗體結合至替代的或補充的免疫調節通路中涉及的分子(受體或配體),例如CTLA4、TIM3、TIM4、OX40、CD40、GITR、4-1-BB、CD27/CD70、ICOS、B7-H4、LIGHT、PD-1或LAG3,以便減弱,進一步調節免疫調節作用。此外,該多特異性抗體可以結合至效應子分子,例如細胞因子(例如IL-7、IL-15、IL-12、IL-4TGF-β、IL-10、IL-17、IFNg、Flt3、BLys)和趨化因子(例如CCL21),這對于下調急性以及慢性免疫應答兩者可能是特別相關的。
本發明的抗體可通過本領域中已知的對于產生多肽有用的任何方法產生,這些方法是例如體外合成、重組DNA生產等。優選地,通過重組DNA技術來產生抗體。可以使用重組免疫球蛋白表達技術來產生B7-H5抗體。免疫球蛋白分子(包括人源化抗體)的重組產生描述于美國專利號4,816,397(博斯(Boss)等人)、美國專利號6,331,415和4,816,567(都屬于加比利(Cabilly)等人)、英國專利GB 2,188,638(溫特(Winter)等人)、和英國專利GB 2,209,757。免疫球蛋白重組表達技術(包括人源化免疫球蛋白)也可見于戈德爾(Goeddel)等人,酶學基因表達技術方法(Gene Expression Technology Methods in Enzymology)第185卷學術出版社(Academic Press)(1991),以及博勒巴克(Borreback),抗體工程(Antibody Engineering),W.H.弗里曼(Freeman)(1992)。涉及重組抗體的產生、設計以及表達的另外信息可以發現于梅福思(Mayforth),設計抗體(Designing Antibodies),學術出版社(Academic Press),圣地亞哥(1993)。
用于產生重組嵌合B7-H5抗體的示例性工藝可以包括以下:a)通過常規分子生物學方法,構建編碼并表達抗體重鏈的表達載體,其中鼠抗人類B7-H5單克隆抗體的CDR和可變區被融合到源自人類免疫球蛋白的Fc區,由此產生用于表達嵌合抗體重鏈的載體;b)通過常規分子生物學方法,構建編碼并表達鼠抗人類B7-H5單克隆抗體的抗體輕鏈的表達載體,由此產生用于表達嵌合抗體輕鏈的載體;c)通過常規分子生物學方法將表達載體轉移至宿主細胞,以產生用于表達嵌合抗體的經轉染的宿主細胞;并且d)通過常規細胞培養技術,培養該轉染細胞,以產生嵌合抗體。
用于產生重組人源化B7-H5抗體的示例性工藝可以包括以下:a)通過常規分子生物學方法,構建編碼和表達抗人類B7-H5重鏈的表達載體,其中要求保持供體抗體結合特異性的CDR和可變區框架的最小部分源自非人類免疫球蛋白,例如鼠抗人類B7-H5單克隆抗體,并且抗體的剩余部分源自人類免疫球蛋白,由此產生用于表達人源化抗體重鏈的載體;b)通過常規分子生物學方法,構建編碼并表達抗體輕鏈的表達載體,其中要求保持供體抗體結合特異性的CDR和可變區框架的最小部分源自非人類免疫球蛋白,例如鼠抗人類B7-H5單克隆抗體,并且抗體的剩余部分源自人類免疫球蛋白,由此產生用于表達人源化抗體輕鏈的載體;c)通過常規分子生物學方法將這些表達載體轉移至宿主細胞,以產生用于表達人源化抗體的經轉染的宿主細胞;并且d)通過常規細胞培養技術,培養該轉染細胞,以產生人源化抗體。
關于任一示例性方法,可以用此類表達載體共轉染宿主細胞,這些表達載體可以包含不同的選擇性標記,但是除了重鏈的和輕鏈的編碼序列,優選地是相同的。這一程序提供了重鏈多肽和輕鏈多肽的等同表達。可替代地,可以使用編碼重鏈多肽和輕鏈多肽二者的單個載體。重鏈和輕鏈的編碼序列可以包括cDNA或基因組DNA或二者。用于表達重組B7-H5抗體的宿主細胞可以是細菌細胞,例如大腸桿菌,或更優選地是真核細胞(例如中國倉鼠卵巢(CHO)細胞或HEK-293細胞)。對表達載體的選擇取決于對宿主細胞的選擇,并且可以如此選擇以在所選擇的宿主細胞中具有希望的表達以及調節特性。可以使用的其他細胞系包括但不限于CHO-K1、NSO、和PER.C6(Crucell公司,萊頓市,荷蘭)。
可以使用本領域普通技術人員熟知的技術,使用任何上述抗體來產生抗獨特型抗體(參見例如格林斯潘(Greenspan),N.S.等人(1989)“獨特型:結構和免疫原性(Idiotypes:Structure And Immunogenicity)”,美國實驗生物學會聯合會會志(FASEB J.)7:437-444;和伊斯諾夫(isinoff,A.)(1991)“獨特型:概念和應用(Idiotypes:Concepts And Applications)”,免疫學雜志(J.Immunol.)147(8):2429-2438)。
如果希望的話,任何以上抗體的結合特性可通過對展現此類希望的特性的變體進行篩選而進一步改進。例如,可以使用本領域已知的不同噬菌體展示方法來產生此類抗體。在噬菌體展示方法中,將功能抗體結構域展示在噬菌體顆粒的表面上,這些顆粒攜帶對其進行編碼的多核苷酸序列。在一個具體實施例中,此類噬菌體可用于展示從全范圍或組合抗體文庫(例如,人類或鼠類)表達的抗原結合結構域,例如Fab和Fv或二硫鍵穩定的Fv。表達結合所感興趣的抗原的抗原結合域的噬菌體可以用抗原來選擇或鑒別,例如,使用標記的抗原或結合或捕獲于固體表面或珠粒上的抗原。在這些方法中使用的噬菌體典型地是絲狀噬菌體,包括fd以及M13。這些抗原結合域被表達為一種重組地與噬菌體基因III或基因VIII蛋白融合的蛋白。可以用于制造本發明的免疫球蛋白或其片段的噬菌體展示方法的實例包括在以下中披露的那些,布林克曼(Brinkman),U.等人(1995)“二硫化物穩定化的Fv片段的噬菌體展示(Phage Display Of Disulflde-Stabilized Fv Fragments)”,免疫學方法雜志(J.Immunol.Methods)182:41-50,1995;阿梅斯(Ames),R.S.等人(1995)“將分離自組合噬菌體展示文庫的鼠Fab轉化至全長免疫球蛋白(Conversion Of Murine Fabs Isolated From A Combinatorial Phage Display Library To Full Length Immunoglobulins)”,免疫學方法雜志(J.Immunol.Methods)184:177-186;凱特伯拉夫(Kettleborough),C.A.等人(1994)“使用來自這些抗體片段的全抗體的噬菌體-抗體文庫和重構,從免疫小鼠分離腫瘤細胞特異性單鏈Fv(Isolation Of Tumor Cell-Specific Single-Chain Fv From Immunized Mice Using Phage-Antibody Libraries And The Re-Construction Of Whole Antibodies From These Antibody Fragments)”,歐洲免疫學雜志(Eur.J.Immunol),24:952-958,1994;佩爾西克(Persic),L.等人(1997)“在從噬菌體展示文庫選擇后抗體或其片段的真核表達的整合載體系統(An Integrated Vector System For The Eukaryotic Expression Of Antibodies Or Their Fragments After Selection From Phage Display Libraries)”,基因(Gene),187:9-18;伯頓(Burton),D.R.等人(1994)“來自組合文庫的人類抗體(Human Antibodies From Combinatorial Libraries)”,免疫學進展(Adv.Immunol.)57:191-280;PCT公開案WO 92/001047;WO 90/02809;WO 91/10737;WO 92/01047;WO 92/18619;WO 93/11236;WO 95/15982;WO 95/20401;和美國專利號5,698,426;5,223,409;5,403,484;5,580,717;5,427,908;5,750,753;5,821,047;5,571,698;5,427,908;5,516,637;5,780,225;5,658,727;5,733,743和5,969,108。
如上文參考文獻中所述,在噬菌體選擇之后,來自噬菌體的抗體編碼區可以被分離并且用于產生包括人源化抗體的全抗體或任何其他所希望的片段,并且表達在任何所希望的宿主之中,包括哺乳動物細胞、昆蟲細胞、植物細胞、酵母、以及細菌,例如如下文詳細描述的。例如,重組地產生Fab、Fab’以及F(ab’)2片段的技術還可以使用本領域中已知的方法來加以采用(這些技術例如是披露于以下中的那些:PCT公開案WO 92/22324;馬利納克斯(Mullinax),R.L.等人(1992)“在一個克隆步驟中,異源二聚體Fab抗體蛋白的表達(Expression Of A Heterodimeric Fab Antibody Protein In One Cloning Step)”,生物技術(BioTechniques),12(6):864-869;和沙懷(Sawai)等人(1995)“使用聚合酶鏈式反應和cDNA表達載體直接產生源自精子固定抗體的Fab片段(Direct Production Of The Fab Fragment Derived From The Sperm Immobilizing Antibody Using Polymerase Chain Reaction And cDNA Expression Vectors)”,美國生殖免疫學雜志(Am.J.Reprod.Immunol.)34:26-34;和貝特爾(Better),M.等人(1988)“活性嵌合抗體片段的大腸桿菌分泌(Escherichia coli Secretion Of An Active Chimeric Antibody Fragment)”,科學(Science)240:1041-1043)。可以用于產生單鏈Fv和抗體的技術的實例包括描述于以下中的那些:美國專利號4,946,778和5,258,498;休斯頓(Huston),J.S.等人(1991)“單鏈Fv類似物和融合蛋白的蛋白工程化(Protein Engineering Of Single-Chain Fv Analogs And Fusion Proteins)”,酶學方法(Methods in Enzymology)203:46-88;舒(Shu),L.等人,“來自骨髓瘤細胞的單基因編碼免疫球蛋白的分泌(Secretion Of A Single-Gene-Encoded Immunoglobulin From Myeloma Cells)”,美國國家科學院院刊(Proc.Natl.Acad.Sci.(USA))90:7995-7999;和斯蓋拉(Skerra).A.等人(1988)“大腸桿菌中功能免疫球蛋白Fv片段的組裝(Assembly Of A Functional Immunoglobulin Fv Fragment In Escherichia coli)”,科學(Science)240:1038-1040。
噬菌體展示技術可以用于增加抗體對B7-H5的親和力。此技術在獲得可被用于披露的這些組合方法的高親和力抗體中是有用的。被稱為親和力成熟的技術采用誘變或者CDR步移和重選擇,使用此類受體或配體(或它們的細胞外域)或其抗原片段來鑒別當與初始抗體或親本抗體比較時以更高親和力結合到該抗原的抗體(參見,例如,格拉澤(Glaser),S.M.等人(1992)“在絲狀噬菌體載體系統中通過基于密碼子的誘變進行的抗體工程化(Antibody Engineering By Codon-Based Mutagenesis In A Filamentous Phage Vector System)”,免疫學雜志(J.Immunol.)149:3903-3913)。誘變整個密碼子而不是單個核苷酸產生了氨基酸突變的半隨機譜。可構建由一組變體克隆所組成的文庫,每一克隆都在單個CDR中相差單個氨基酸改變,并且這些克隆包含代表了每個CDR殘基的每個可能氨基酸取代的變體。可以通過使固定的突變體與標記的抗原接觸,來篩選具有針對抗原的增加的結合親和力的突變體。本領域中已知的任何篩選方法(例如ELISA)可以用于鑒定具有對抗原的增加的親合力的突變體抗體(參見例如吳(Wu),H.等人(1998)“Vitaxin,一種Alphavβ3特異性人源化Mab的逐步體外親和力成熟(Stepwise In Vitro Affinity Maturation Of Vitaxin,An Alphav Beta3-Specific Humanized Mab)”,美國國家科學院院刊(Proc.Natl.Acad.Sci.(USA))95(11):6037-6042;耶爾頓(Yelton),D.E.等人(1995)“通過基于密碼子的誘變的BR96抗癌抗體的親和力成熟(Affinity Maturation Of The BR96 Anti-Carcinoma Antibody By Codon-Based Mutagenesis)”,免疫學雜志(J.Immunol.)155:1994-2004)。可以可能地使用使輕鏈隨機化的CDR步移(參見希爾(Schier)等人(1996)“通過在抗體結合位點的中心中的互補決定區的分子演化的抗C-Erbb-2單鏈Fv的皮摩爾親和力的分離(Isolation Of Picomolar Affinity Anti-C-Erbb-2 Single-Chain Fv By Molecular Evolution Of The Complementarity Determining Regions In The Center Of The Antibody Binding Site)”,分子生物學雜志(J.Mol.Biol.)263:551-567)。
因此,本發明考慮了使用隨機誘變來鑒定改進的CDR。噬菌體展示技術可以可替代地用于增加(或降低)CDR親和力。這一技術(稱為親和力成熟),采用了誘變或“CDR步移”和重選擇,使用靶抗原或其抗原片段,以鑒別當與初始或親本抗體比較時,以更高(或更低)親和力結合到抗原的CDR的抗體(參見例如格拉澤(Glaser),S.M.等人(1992)“在絲狀噬菌體載體系統中通過基于密碼子的誘變的抗體工程化(Antibody Engineering By Codon-Based Mutagenesis In A Filamentous Phage Vector System)”,免疫學雜志(J.Immunol.)149:3903-3913)。誘變整個密碼子而不是單個核苷酸產生了氨基酸突變的半隨機譜。可構建由一組變體克隆所組成的文庫,每一克隆都在單個CDR中相差單個氨基酸改變,并且這些克隆包含代表了每個CDR殘基的每個可能氨基酸取代的變體。可以通過使固定的突變體與標記的抗原接觸,來篩選具有針對抗原的增加的(或降低的)結合親和力的突變體。本領域中已知的任何篩選方法(例如ELISA)可以用于鑒定具有對抗原的增加(或降低的)的親合力的突變體抗體(參見吳(Wu),H.等人(1998)“Vitaxin,一種Alphavβ3特異性人源化Mab的逐步體外親和力成熟(Stepwise In Vitro Affinity Maturation Of Vitaxin,An Alphav Beta3-Specific Humanized Mab)”,美國國家科學院院刊(Proc.Natl.Acad.Sci.(USA))95(11):6037-6042;耶爾頓(Yelton,D.E.)等人(1995)“通過基于密碼子的誘變的BR96抗癌抗體的親和力成熟(Affinity Maturation Of The BR96 Anti-Carcinoma Antibody By Codon-Based Mutagenesis)”,免疫學雜志(J.Immunol.)155:1994-2004)。可以可能地使用使輕鏈隨機化的CDR步移(參見希爾(Schier)等人(1996)“通過在抗體結合位點的中心中的互補決定區的分子演化的抗C-Erbb-2單鏈Fv的皮摩爾親和力的分離(Isolation Of Picomolar Affinity Anti-C-Erbb-2 Single-Chain Fv By Molecular Evolution Of The Complementarity Determining Regions In The Center Of The Antibody Binding Site)”,分子生物學雜志(J.Mol.Biol.)263:551-567)。
用于完成此類親和力成熟的方法描述于以下中,例如:克勞斯(Krause),J.C.等人(2011)“扭曲抗體結合位點構造的插入突變增強了人類抗體的功能(An Insertion Mutation That Distorts Antibody Binding Site Architecture Enhances Function Of A Human Antibody)”,MBio.2(1)pii:e00345-10.doi:10.1128/mBio.00345-10;寬(Kuan),C.T.等人(2010)“靶向惡性膠質瘤和黑色素瘤的親和力成熟的抗糖蛋白NMB重組免疫毒素(Affinity-Matured Anti-Glycoprotein NMB Recombinant Immunotoxins Targeting Malignant Gliomas And Melanomas)”,國際癌癥雜志(Int.J.Cancer)10.1002/ijc.25645;哈克爾(Hackel),B.J.等人(2010)“穩定性和CDR組成偏移豐富了結合物功能景觀(Stability And CDR Composition Biases Enrich Binder Functionality Landscapes)”,分子生物學雜志(J.Mol.Biol.)401(1):84-96;蒙哥馬利(Montgomery),D.L.等人(2009)“針對HIV-1gp41的人類單克隆抗體的親和力成熟和表征(Affinity Maturation And Characterization Of A Human Monoclonal Antibody Against HIV-1gp41)”,MAbs 1(5):462-474;古斯查那(Gustchina),E.等人(2009)“通過源自合成原初人類抗體文庫并且針對Gp41的內部三聚卷曲螺旋的單克隆Fab的CDR-H2環的靶向多樣化的親和力成熟產生了一組具有改進的HIV-1中和效力和幅度的Fab(Affinity Maturation By Targeted Diversification Of The CDR-H2 Loop Of A Monoclonal Fab Derived From A Synthetic Naive Human Antibody Library And Directed Against The Internal Trimeric Coiled-Coil Of Gp41 Yields A Set Of Fabs With Improved HIV-1 Neutralization Potency And Breadth)”,病毒學(Virology)393(1):112-119;芬利(Finlay),W.J.等人(2009)“用于抗RAGE治療的人源化大鼠抗體的親和力成熟:全面誘變揭示在互補決定區內外同時存在的高水平的突變可塑性(Affinity Maturation Of A Humanized Rat Antibody For Anti-RAGE Therapy:Comprehensive Mutagenesis Reveals A High Level Of Mutational Plasticity Both Inside And Outside The Complementarity-Determining Regions)”,分子生物學雜志(J.Mol.Biol.)388(3):541-558;博斯特倫(Bostrom),J.等人(2009)“改進抗體結合親和力和特異性用于治療開發(Improving Antibody Binding Affinity And Specificity For Therapeutic Development)”,分子生物學方法(Methods Mol.Biol.),525:353-376;施泰德爾(Steidl),S.等人(2008)“通過靶向的CDR多樣化的人類GM-CSF抗體的體外親和力成熟(In Vitro Affinity Maturation Of Human GM-CSF Antibodies By Targeted CDR-Diversification)”,分子免疫學(Mol.Immunol.)46(1):135-144;和班德拉斯(Barderas),R.等人(2008)“通過計算機建模輔助的抗體的親和力成熟(Affinity maturation of antibodies assisted by in silico modeling)”,美國國家科學院院刊(Proc.Natl.Acad.Sci.(USA))105(26):9029-9034。
本發明具體地考慮了任何上述抗體及其抗原結合片段的“衍生物”的產生和用途。
術語“衍生物”是指免疫特異性地結合到一種抗原的一種抗體或其抗原結合片段,但其相對于“親本”(或野生型)分子包括一、二、三、四、五個或更多個氨基酸取代、添加、缺失或修飾。此類氨基酸取代或添加可引入天然存在(即,DNA-編碼的)或非天然存在的氨基酸殘基。術語“衍生物”包含例如,抗體1.3、4.5或7.8中任一個的嵌合或人源化變體,連同具有改變的CH1、鉸鏈、CH2、CH3或CH4區域的變體,以形成例如具有展現增強或受損的效應子或結合特性的變體Fc區的抗體等。術語“衍生物”另外包含非氨基酸修飾,例如氨基酸可通過已知的保護/阻滯基團、蛋白質水解裂解而被糖基化(例如,具有改變的甘露糖、2-N-乙酰葡糖胺、半乳糖、果糖、葡萄糖、唾液酸、5-N-乙酰神經氨酸、5-二醇神經氨酸等內容物)、乙酰化、聚乙二醇化、磷酸化、酰胺化、衍生化,連接至細胞配體或其他蛋白等。在一些實施例中,改變的碳水化合物修飾調節了以下中的一個或多個:抗體的溶解、抗體的亞細胞轉運和分泌的促進、抗體組裝的促進、構象完整性、和抗體介導的效應子功能。在一個特定實施例中,相對于缺少該碳水化合物修飾的抗體,該改變的碳水化合物修飾增強了抗體介導的效應子功能。導致改變的抗體介導的效應子功能的碳水化合物修飾是本領域熟知的(例如參見希爾茲(Shields),R.L等人(2002)“人類IgGN連接的寡糖上海藻糖的缺乏改進了至人類γRIII的結合和抗體依賴的細胞毒性(FcLack Of Fucose On Human IgG N-Linked Oligosaccharide Improves Binding To Human Fcgamma RIII And Antibody-Dependent Cellular Toxicity)”,生物化學雜志(J.Biol.Chem.)277(30):26733-26740;戴維斯(Davies)J.等人(2001)“重組抗CD20CHO生產細胞系中的GnTIII的表達:具有改變的糖形的抗體的表達導致通過對FCγRIII的更高親和力的ADCC中的增加(Expression Of GnTIII In A Recombinant Anti-CD20 CHO Production Cell Line:Expression Of Antibodies With Altered Glycoforms Leads To An Increase In ADCC Through Higher Affinity For FC Gamma RIII)”,生物技術&生物工程(Biotechnology&Bioengineering)74(4):288-294)。改變碳水化合物內容物的方法是本領域普通技術人員已知的,參見例如華力克(Wallick),S.C.等人(1988)“針對α(1-6)右旋糖酐的單克隆抗體的VH殘基的糖基化增加了其對抗原的親和力(Glycosylation Of A VH Residue Of A Monoclonal Antibody Against Alpha(1-6)Dextran Increases Its Affinity For Antigen)”,實驗醫學雜志(J.Exp.Med.)168(3):1099-1109;陶(Tao),M.H.等人(1989)“由人類IgG恒定區介導的結構和效應子功能中的糖基化合物的無糖基化的嵌合小鼠-人類IgG作用的研究(Studies Of Aglycosylated Chimeric Mouse-Human IgG.Role Of Carbohydrate In The Structure And Effector Functions Mediated By The Human IgG Constant Region)”,免疫學雜志(J.Immunol.)143(8):2595-2601;勞特利奇(Routledge),E.G.等人(1995)“無糖基化對人源化治療性CD3單克隆抗體的免疫原性的影響(The Effect Of Aglycosylation On The Immunogenicity Of A Humanized Therapeutic CD3 Monoclonal Antibody)”,移植(Transplantation)60(8):847-53;艾略特(Elliott),S.等人(2003)“通過糖工程的治療性蛋白體內活性的增強(Enhancement Of Therapeutic Protein In Vivo Activities Through Glycoengineering)”,自然生物技術(Nature Biotechnol.)21:414-21;希爾茲(Shields),R.L等人(2002)“人類IgGN連接的寡糖上海藻糖的缺乏改進了至人類FcγRIII的結合和抗體依賴的細胞毒性(Lack Of Fucose On Human IgG N-Linked Oligosaccharide Improves Binding To Human Fcgamma RIII And Antibody-Dependent Cellular Toxicity)”,生物化學雜志(J.Biol.Chem.)277(30):26733-26740)。
在一些實施例中,人源化抗體是衍生物。這種人源化抗體包括在一個或多個非人類CDR中的氨基酸殘基取代、缺失或添加。當與非衍生物人源化抗體相比時,人源化抗體衍生物可以具有基本上相同的結合、更好的結合或更差的結合。在特定實施例中,該CDR的一、二、三、四、或五個氨基酸殘基已被取代、缺失或添加(即,突變)。
一種衍生物抗體或抗體片段可使用本領域的普通技術人員已知的技術通過化學修飾進行修飾,這些技術包括但不限于,特異性的化學裂解、乙酰化、配制、衣霉素的代謝合成等。在一個實施例中,抗體衍生物將具有與親本抗體類似的或相同的功能。在另一個實施例中,抗體衍生物將展現相對于親本抗體改變的活性。例如,相比于親本抗體,衍生物抗體(或其片段)可更緊密地結合到其表位或對蛋白水解更加耐受。
衍生化抗體可用于改變哺乳動物(優選人類)中的親本抗體的半衰期(例如,血清半衰期)。優選地,此類改變將導致超過15天、優選超過20天、超過25天、超過30天、超過35天、超過40天、超過45天、超過2個月、超過3個月、超過4個月、或超過5個月的半衰期。本發明的人源化抗體或其片段在哺乳動物(優選人類)中的增加的半衰期導致所述抗體或抗體片段在該哺乳動物中的更高血清滴度,并且因此降低了給予所述抗體或抗體片段的頻率,和/或降低了待給予的所述抗體或抗體片段的濃度。可以通過本領域普通技術人員已知的技術來產生具有增加的體內半衰期的抗體或其片段。例如,具有增加的體內半衰期的抗體或其片段可以通過修飾(例如,取代、缺失或添加)多個鑒別為涉及到Fc域與FcRn受體之間的相互作用中的氨基酸殘基來產生。人源化B7-H5抗體可被工程化以增加生物半衰期(參見,例如美國專利號6,277,375)。例如,人源化B7-H5抗體可在Fc-鉸鏈域中被工程化以具有增加的體內或血清半衰期。
具有增加的體內半衰期的抗體或其片段可以通過將多聚體分子諸如高分子量聚乙二醇(PEG)附接至所述抗體或抗體片段來產生。PEG可以在存在或不存在多官能連接子的情況下,通過PEG與所述抗體或抗體片段的N末端或C末端的位點特異性軛合或經由賴氨酸殘基上存在的ε-氨基基團附接到所述抗體或抗體片段。將使用導致生物活性最少損失的線性或分支的聚合物衍生化。可通過SDS-PAGE和質譜密切監測軛合的程度,以確保PEG分子與抗體的正確軛合。可以通過例如尺寸排除或離子交換色譜來從抗體PEG軛合物中分離未反應的PEG。
還可以通過由戴維斯(Davis)等人(參見美國專利號4,179,337)描述的方法和偶聯劑來修飾B7-H5抗體,以便提供可以被注射進哺乳動物循環系統而基本上不具有免疫原性應答的組合物。
一個實施例涵蓋人源化B7-H5抗體的框架殘基的修飾。框架區中的框架殘基可以用來自CDR供體抗體的相應殘基來取代以便改變,優選地改進抗原結合。這些框架取代是通過本領域熟知的方法鑒定的,例如通過對CDR和框架殘基的相互作用建模以鑒定對抗原結合重要的框架殘基,并且通過序列比較以鑒定在特定位置上的不尋常框架殘基。(參見美國專利號5,585,089;和賴克曼(Riechmann)L.等人(1988)“將用于治療的人類抗體再成形(Reshaping Human Antibodies For Therapy)”,自然(Nature)332:323-327)。
又另一實施例涵蓋重組地融合至或化學軛合(包括共價軛合和非共價軛合二者)至異源分子(即無關分子)的抗人類B7-H5抗體(并且更優選人源化抗體)及其抗原結合片段。融合并非必須是直接的,而可以通過接頭序列來發生。
在一個實施例中,此類異源分子是具有至少10個、至少20個、至少30個、至少40個、至少50個、至少60個、至少70個、至少80個、至少90個或至少100個氨基酸的多肽。此類異源分子可以可替代地是酶、激素、細胞表面受體、藥物部分,諸如:毒素(例如相思豆毒素、蓖麻毒素A、假單胞菌外毒素(即PE-40)、白喉毒素、蓖麻毒素、白樹毒素、或美洲商陸抗病毒蛋白),蛋白質(例如腫瘤壞死因子、干擾素(例如α-干擾素、β-干擾素)、神經生長因子、血小板衍生的生長因子、組織纖溶酶原激活劑或凋亡劑(例如腫瘤壞死因子-α、腫瘤壞死因子-β)),生物反應調節劑(例如像淋巴因子(例如白介素-1(“IL-1”)、白介素-2(“IL-2”)、白介素-6(“IL-6”))、粒細胞巨噬細胞集落刺激因子(“GM-CSF”)、粒細胞集落刺激因子(“G-CSF”)、或巨噬細胞集落刺激因子(“M-CSF”))、或生長因子(例如生長激素(“GH”))),細胞毒素(例如細胞抑制劑或殺細胞劑,如紫杉醇、細胞松弛素B、短桿菌肽D、溴化乙錠、吐根堿、絲裂霉素、依托泊苷、替尼泊苷(tenoposide)、長春新堿、長春堿、秋水仙堿、阿霉素、道諾霉素、二羥基炭疽菌素二酮、米托蒽醌、光輝霉素、放線菌素D、1-去氫睪酮、糖皮質激素、普魯卡因、丁卡因、利多卡因、普萘洛爾、和嘌呤霉素及其類似物或同系物),抗代謝物(例如甲氨蝶呤、6-巰基嘌呤、6-硫鳥嘌呤、阿糖胞苷、5-氟尿嘧啶達卡巴嗪(5-fluorouracil decarbazine)),烷基化劑(例如氮芥、苯丁酸氮芥、美法侖、(卡莫司汀;BSNU)和洛莫司汀(CCNU)、環磷酰胺(cyclothosphamide)、白消安、二溴甘露醇、鏈脲霉素、絲裂霉素C、和順二氯二氨鉑(II)(DDP)順鉑),蒽環類(例如道諾霉素(原名正定霉素)和阿霉素),抗體(例如更生霉素(原名放線菌素)、博來霉素、光輝霉素、和安曲霉素(AMC)),或抗有絲分裂劑(例如長春新堿和長春堿)。
用于將此類治療部分軛合至抗體的技術是熟知的;參見例如阿爾農(Arnon)等人,“用于癌癥治療中的藥物的免疫靶向的單克隆抗體(Monoclonal Antibodies For Immunotargeting Of Drugs In Cancer Therapy)”單克隆抗體和癌癥治療(MONOCLONAL ANTIBODIES AND CANCER THERAPY),賴斯費爾德(Reisfeld)等人(編輯),1985,243-56頁,艾倫R.利斯有限公司(Alan R.Liss,Inc.);赫爾斯特倫(Hellstrom)等人,“用于藥物遞送的抗體(Antibodies For Drug Delivery)”,受控藥物遞送(CONTROLLED DRUG DELIVERY),(第2版),魯濱遜(Robinson)等人(編輯),1987,623-53頁,馬塞爾德克有限公司(Marcel Dekker,Inc.);索普(Thorpe),“癌癥治療中細胞毒性劑的抗體載體:綜述(Antibody Carriers Of Cytotoxic Agents In Cancer Therapy:A Review)”,單克隆抗體‘84:生物學的和臨床的應用(MONOCLONAL ANTIBODIES‘84:BIOLOGICAL AND CLINICAL APPLICATIONS),平查(Pinchera)等人(編輯),1985,475-506頁);“癌癥治療中放射標記抗體的治療用途的分析、結果和未來展望(Analysis,Results,And Future Prospective Of The Therapeutic Use Of Radiolabeled Antibody In Cancer Therapy)”,用于癌癥檢測和治療的單克隆抗體(MONOCLONAL ANTIBODIES FOR CANCER DETECTION AND THERAPY),鮑德溫(Baldwin)等人(編輯),1985,第303-16頁,學術出版社(Academic Press);和索普(Thorpe)等人(1982)“抗體毒素軛合物的制備和細胞毒性特性(The Preparation And Cytotoxic Properties Of Antibody-Toxin Conjugates)”,免疫學綜述(Immunol.Rev.)62:119-158。
在一個實施例中,B7-H5抗體或B7-H5融合分子包括Fc部分。此類分子的Fc部分可按照同種型或子類而不同,可以是嵌合體或雜合體,和/或可經過修飾以便例如改進效應子功能、控制半衰期、組織可接近性、增進生物物理特性例如穩定性,并且改進產生效率(并且成本更小)。在披露的融合蛋白的構造和用于制造它們的方法中有用的很多修飾是本領域已知的,參見例如米勒(Mueller),J.P.等人(1997)“具有嵌合IgG2/G4恒定區的人源化豬VCAM特異性單克隆抗體阻滯人類白細胞結合豬內皮細胞(Humanized Porcine VCAM-Speciflc Monoclonal Antibodies With Chimeric IgG2/G4Constant Regions Block Human Leukocyte Binding To Porcine Endothelial Cells)”,分子免疫學(Mol.Immun.)34(6):441-452,斯旺(Swann),P.G.(2008)“對治療的單克隆抗體的開發的考慮(Considerations For The Development Of Therapeutic Monoclonal Antibodies)”,免疫學新見(Curr.Opin.Immun.)20:493-499(2008),和普雷斯塔(Presta),L.G.(2008)“治療性抗體的分子工程化和設計(Molecular Engineering And Design Of Therapeutic Antibodies)”,免疫學新見(Curr.Opin.Immun.)20:460-470。在一些實施例中,Fc區是天然IgG1、IgG2、或IgG4Fc區。在一些實施例中,Fc區是雜合體,例如由IgG2/IgG4Fc恒定區組成的嵌合體。對Fc區的修飾包括但不限于修飾IgG4以阻止結合Fcγ受體和補體,修飾IgG1以改進與一種或多種Fcγ受體的結合,修飾IgG1以最小化效應子功能(氨基酸改變),IgG1具有改變的聚糖/不具有聚糖(典型地通過改變表達宿主),以及IgG1具有與FcRn的改變的pH依賴性結合,以及IgG4在絞鏈區的氨基酸殘基#228處的絲氨酸改變為脯氨酸(S228P)以增強穩定性。Fc區可以包括整個絞鏈區,或不足整個鉸鏈區。
用利妥昔單抗(針對CD20的嵌合小鼠/人類IgG1單克隆抗體)治療患者的非霍奇金氏淋巴瘤或瓦爾登斯特倫氏巨球蛋白血癥的治療結果與Fcγ受體的等位變體的個體表達相關,這些Fcγ受體對人類IgG1的Fc結構域具有不同的內在親和力。具體而言,具有低親和力激活型Fc受體CD16A(FcγRIIIA)的高親和力等位基因的患者顯示更高的反應率,并且在非霍奇金氏淋巴瘤的情況下顯示改進的無進展生存期。在另一個實施例中,Fc域可含有一個或多個氨基酸插入、缺失或取代,這些插入、缺失或取代減少與低親和力抑制性Fc受體CD32B(FcγRIIB)的結合并且保持野生型水平的與低親和力活化Fc受體CD16A(FcγRIIIA)的結合或增強與之的結合。
另一實施例包括IgG2-4雜合體和IgG4突變體,它們具有降低的與FcR的結合,這增加了它們的半衰期。代表性IgG2-4雜合體和IgG4突變體描述于安蓋爾(Angal),S.等人(1993)“單個氨基酸取代消除了嵌合的小鼠/人(Igg4)抗體的異質性(A Single Amino Acid Substitution Abolishes The Heterogeneity Of Chimeric Mouse/Human(Igg4)Antibody)”,分子免疫學(Molec.Immunol.)30(1):105-108;穆勒(Mueller),J.P.等人(1997)“具有嵌合的Igg2/G4恒定區的人源化豬VCAM特異性單克隆抗體阻滯人白細胞結合到豬內皮細胞(Humanized Porcine VCAM-Specific Monoclonal Antibodies With Chimeric IgG2/G4Constant Regions Block Human Leukocyte Binding To Porcine Endothelial Cells)”,分子免疫學(Mol.Immun.)34(6):441-452;以及美國專利號6,982,323。在一些實施例中,該IgG1和/或IgG2結構域是缺失的,例如,安蓋爾(Angal),s.等人描述了絲氨酸241替換為脯氨酸的IgG1和IgG2。
在衍生化的抗體中的取代、添加或缺失可在該抗體的Fc區并且可由此起作用以修飾該抗體至一個或多個Fc R的結合親和力。用于修飾抗體(具有修飾的至一個或多個Fc R的結合)的方法在本領域中是已知的,參見例如PCT公開號WO 04/029207、WO 04/029092、WO 04/028564、WO 99/58572、WO 99/51642、WO 98/23289、WO 89/07142、WO 88/07089、以及美國專利號5,843,597以及5,642,821。在一個具體實施例中,對Fc區的修飾得到如下的一種抗體,該抗體具有改變的抗體介導的效應子功能、改變的與其他Fc受體(例如,Fc激活受體)的結合、改變的抗體依賴性細胞介導的細胞毒性(ADCC)活性、改變的C1q結合活性、改變的補體依賴性細胞毒性活性(CDC)、吞噬細胞活性、或其任何組合。
在一些實施例中,本發明涵蓋Fc區將已經被修飾的抗體,這樣使得該分子將展示改變的Fc受體(FcR)結合活性,例如,展現降低的朝向活化受體(例如FcγRIIA或FcγRIIIA)的活性,或增加的朝向抑制性受體(例如FcγRIIB)的活性。優選地,此類抗體將展現降低的抗體依賴性細胞介導的細胞毒性(ADCC)或補體依賴性細胞毒性(CDC)活性(相對于野生型Fc受體)。
影響Fc介導的效應子功能的修飾是本領域熟知的(參見美國專利號6,194,551和WO 00/42072;斯塔文哈根(Stavenhagen),J.B.等人(2007)“治療的抗體的Fc優化增強了它們經由低親和力活化Fcγ受體在體外殺死腫瘤細胞并且在體內控制腫瘤擴張的能力(Fc Optimization Of Therapeutic Antibodies Enhances Their Ability To Kill Tumor Cells In Vitro And Controls Tumor Expansion In Vivo Via Low-Affinity Activating Fcgamma Receptors)”,癌癥研究(Cancer Res.)57(18):8882-8890;希爾茲(Shields),R.L等人(2001)“人類IgG1上針對FcγRI、FcγRII、FcγRIII、和FcRn的結合位點的高分辨作圖和具有至FcγR的改進的結合的IgG1變體的設計(High Resolution Mapping of the Binding Site on Human IgG1 for FcγRI,FcγRII,FcγRIII,and FcRn and Design of IgG1Variants with Improved Binding to the FcγR)”,生物化學雜志(J.Biol.Chem.)276(9):6591-6604)。具有至FcγRIIA或FcγRIIIA的降低結合但是具有至FcγRIIB的不變的或增強的結合的人類IgG1Fc結構域的示例性變體包括S239A、H268A、S267G、E269A、E293A、E293D、Y296F、R301A、V303A、A327G、K322A、E333A、K334A、K338A、A339A、D376A。
在一些實施例中,本發明涵蓋Fc區將已經被缺失的抗體(例如Fab或F(ab)2等)。
本發明的任何分子可以融合至標記序列,例如肽,以協助純化。在優選的實施例中,標記氨基酸序列是一種六-組氨酸肽,即血球凝集素“HA”標簽,其對應于源自于流感血球凝集素蛋白的表位(威爾遜(Wilson),I.A.等人(1984)“抗原決定簇在蛋白中的結構(The Structure Of An Antigenic Determinant In A Protein)”,細胞,37:767-778)并且“flag”標簽(克納皮克(Knappik),A.等人(1994)“基于FLAG肽的改進的親和力標簽用于重組抗體片段的檢測以及純化(An Improved Affinity Tag Based On The FLAG Peptide For The Detection And Purification Of Recombinant Antibody Fragments)”,生物技術17(4):754-761)。
本發明還涵蓋軛合至一種診斷或治療劑的抗體或其抗原結合片段或任何其他希望血清半衰期增加的分子。這些抗體可診斷地使用(體內、原位或體外)以例如作為一個臨床測試程序的部分監測一種疾病、失調或感染的發展或進展,例如以確定給定治療方案的效力。通過使抗體偶聯到可檢測物質上可以促進檢測。可檢測物質的實例包括各種酶、輔基、熒光物質、發光物質、生物發光物質、放射性材料、正電子發射金屬以及非放射性順磁金屬離子。該可檢測物質可被直接偶聯或軛合至該抗體,或使用本領域中已知的技術間接通過中間體(諸如,例如本領域中已知的接頭)進行。參見例如美國專利號4,741,900關于可以軛合至根據本發明的抗體用作診斷劑的金屬離子。可通過將抗體與可檢測物質偶聯完成這種診斷和檢測,所述可檢測物質包括但不限于各種酶,酶包括但不限于辣根過氧化物酶、堿性磷酸酶、β-半乳糖苷酶、或乙酰膽堿酯酶;輔基復合體,諸如但不限于抗生蛋白鏈菌素/生物素以及抗生物素蛋白/生物素;熒光材料,諸如但不限于傘形酮、熒光素、異硫氰酸熒光素、若丹明、二氯三喚胺熒光素、丹磺酰氯或藻紅蛋白;發光材料,諸如但不限于發光胺;生物發光材料,諸如但不限于熒光素酶、熒光素、以及水母發光蛋白;放射性材料,諸如但不限于鉍(213Bi),碳(14C),鉻(51Cr),鈷(57Co),氟(18F),釓(153Gd,159Gd),鎵(68Ga,67Ga),鍺(68Ge),鈥(166Ho),銦(115In,113In,112In,111In),碘(131I,125I,123I,121I),鑭(140La),鎦(177Lu),錳(54Mn),鉬(99Mo),鈀(103Pd),磷(32P),鐠(142Pr),钷(149Pm),錸(186Re,188Re),銠(105Rh),釕(97Ru),釤(153Sm),鈧(47Sc),硒(75Se),鍶(85Sr),硫(35S),锝(99Tc),鉈(201Ti),錫(113Sn,117Sn),氚(3H),氙(133Xe),鐿(169Yb,175Yb),釔(90Y),鋅(65Zn);使用不同正電子發射斷層掃描以及非放射性順磁金屬離子的正電子發射金屬。
本發明的這些分子可以軛合至第二抗體,以形成抗體雜軛合物,如由西格爾(Segal)在美國專利號4,676,980中所述。此類雜軛合物抗體可以另外結合到半抗原(例如熒光素、等),或結合到細胞標記物(例如PD-1、4-1-BB、B7-H4、B7-H5、CD4、CD8、CD14、CD25、CD27、CD40、CD68、CD163、CTLA4、GITR、LAG-3、OX40、TIM3、TIM4、TLR2、LIGHT、等),或結合到細胞因子(例如IL-7、IL-15、IL-12、IL-4TGF-β、IL-10、IL-17、IFNg、Flt3、BLys)或趨化因子(例如CCL21),等。
本發明的這些分子可被附接至固相支撐體,其對于靶標抗原或能夠結合到靶標抗原的其他分子的免疫測定或純化是特別有用的,該靶標抗原已通過結合到本發明的一種抗體或抗原結合片段而固定到支撐體上。此類固體支撐體包括但不限于玻璃、纖維素、聚丙烯酰胺、尼龍、聚苯乙烯、聚氯乙烯或聚丙烯。
本發明另外包括編碼任何此類抗體、融合蛋白或片段的核酸分子(DNA或RNA),連同能夠在細胞系中傳遞或復制此類核酸分子并且表達此類抗體、融合蛋白或片段的載體分子(例如質粒)。這些核酸可以是單鏈的、雙鏈的,可包含單鏈以及雙鏈部分兩者。
D.本發明的優選調節劑組合物
如此處使用的術語“調節”涉及改變效果或結果的能力。具體地,本發明涉及多肽(這些多肽包括免疫特異性地結合人類B7-H5的抗人類B7-H5抗體或任何其抗原結合片段)或生理特異性地結合B7-H5的分子(這些分子能夠調節B7-H5及其同源配體之間的結合和/或能夠調節由于B7-H5同源反受體結合而發生的信號傳導)。另外,多特異性抗B7-H5抗體、抗B7-H5抗原結合片段及其代表性融合產物(它們具有增加的結合CD28H或其他細胞配體或受體的能力)在協助將表達此類配體或受體的細胞共定位至表達CD28H的細胞中具有特別的效用。
本發明涉及抗體、或其片段、或包括此類抗體或片段的融合分子,它們免疫特異性地結合至B7-H5并且能夠在體外、或在接受者受試者或患者中基本上阻滯B7-H5與CD28H的相互作用。如在此使用,如通過在此披露的任何測定測量的,“能夠基本上阻滯B7-H5與CD28H的相互作用”的分子是指提供此類分子將B7-H5-CD28H相互作用衰減了多于50%、更優選多于60%、多于70%、多于80%、多于90%、多于95%、多于99%,或最優選完全衰減此類相互作用。此類抗體、片段以及融合分子在衰減B7-H5-CD28H相互作用的生物效應上具有特別的效用。
本發明因此具體地涉及此類實施例的分子,這些實施例涉及人源化抗體和片段或人類抗體和片段。
最優選地,當以內源濃度表達并且排列于受試者的細胞的表面時,此類分子將具有能夠結合到B7-H5的足夠親和力以及親合力。術語“內源濃度”是指如下的水平,在此水平一種分子在正常的、癌癥或病原體感染的細胞中是天然表達的(即,在不存在表達載體或重組啟動子的情況下)。
(1)優選的抗人類B7-H5抗體及其CDR
根據本發明,此類分子可以通過以下方式產生:篩選雜交瘤系中產生免疫特異性針對人類B7-H5的抗體的那些,并且然后在此類系中任選地篩選展現調節活性(例如中和活性、激動活性、改變的信號傳導活性、等)的那些。本發明具體地提供了倉鼠抗人類B7-H5克隆:2D3和18C3。抗體2D3和18C3能夠結合至人類B7-H5且基本上能夠阻滯B7-H5與CD28H的相互作用。在治療炎癥疾病和自身免疫性疾病中,基本上能夠阻滯B7-H5與CD28H的相互作用的抗體具有特別用途。在診斷學中,基本上不能阻滯B7-H5與CD28H的相互作用的抗體具有特別用途,因為此類抗體可以用于檢測B7-H5:CD28H相互作用的存在、位置和流行率。
對由能夠阻滯B7-H5與CD28H的相互作用的抗人類B7-H5克隆表達的抗體進行測序,以揭示它們的可變結構域。這些可變域的CDR序列以加粗和加下劃線示出:
抗人類B7-H5克隆2D3
重鏈可變區(SEQ ID NO:9):
編碼重鏈可變區的多核苷酸(SEQ ID NO:10):
輕鏈可變區(SEQ ID NO:11):
編碼輕鏈可變區的多核苷酸(SEQ ID NO:12):
抗人類B7-H5克隆18C3
重鏈可變區(SEQ ID NO:13):
編碼重鏈可變區的多核苷酸(SEQ ID NO:14):
輕鏈可變區(SEQ ID NO:15):
編碼輕鏈可變區的多核苷酸(SEQ ID NO:28):
(2)抗人類B7-H3的共有CDR
阻滯B7-H5:CD28H相互作用的本發明的抗體
對所鑒定的抗體的CDR進行分析,以鑒定共有CDR序列以及可能的會提供類似結合屬性的變體CDR序列。使用Blosum62.iij分析根據表1計算此類變體CDR。表1呈現出Blosum62.iij取代得分。得分越高取代越保守,并且因此更加可能地,該取代將不會影響功能。
本發明允許具有1、2、3、4、5或6個變體CDR的新穎抗體和抗原結合片段的形成。因為本發明的方法已經鑒定了相當數量的不同CDR,所以本發明允許在具體鑒定的CDR中任何變體中可能要求的CDR殘基的識別。在表2和表3的黑體字中示出了此類殘基。對于那些被發現在比較的CDR中變化的殘基,表1的取代得分提供了用于確定被允許的取代的身份的手段。例如,如果具體CDR的具體殘基被發現變化為R或S,那么由于R和S具有-1的取代得分,R或S的具有-1或更大的取代得分的任何取代很可能作為觀察變體(R或S)(或比R或S更多可能性)以建立具有與該具體的CDR的結合屬性充分地類似的結合屬性的變體CDR,以允許該變體CDR的替代使用,以形成一種功能性抗B7-H5抗體或抗原結合片段。對于每個位置,具有更高取代得分的殘基的選擇的優選性超過了具有更低取代得分的殘基的選擇。
表2呈現了抗B7-H5抗體的重鏈CDR的分析并且提供了本發明的觀察的和優選的變體輕鏈(“LC”)抗B7-H5CDR的共有序列。
表3呈現了抗B7-H5抗體的輕鏈CDR的分析并且提供了本發明的觀察的和優選的變體抗B7-H5重鏈(“HC”)CDR的共有序列。
因此,除了具有抗B7-H5抗體2D3和13C3的CDR的抗體及其抗原結合片段,本發明另外提供了擁有具有上述輕鏈和/或重鏈共有序列的CDR的抗體及其抗原結合片段。
本發明涵蓋包括與通過任何以上克隆產生的倉鼠單克隆抗體的可變重鏈和/或輕鏈的氨基酸序列至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、或至少99%一致的可變重鏈和/或可變輕鏈的氨基酸序列的、并且展現免疫特異性地結合至B7-H5的抗體或其片段。本發明進一步涵蓋包括與以上列出的克隆的CDR的氨基酸序列至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、或至少99%一致的CDR的、并且展現免疫特異性地結合至B7-H5的抗體或其片段。
兩種氨基酸序列的百分比一致性的確定可以由BLAST蛋白比較來確定。
在一個優選實施例中,抗體是包括一個、兩個或三個輕鏈CDR和一個、兩個或三個重鏈CDR(最優選是三個輕鏈CDR和三個重鏈CDR)的免疫球蛋白分子(例如抗體、雙抗體、融合蛋白、等),其中輕鏈CDR包括:
(1)抗人類B7-H5抗體2D3/18C3的輕鏈CDR1;
(2)抗人類B7-H5抗體2D3或抗人類B7-H5抗體18C3的輕鏈CDR2或此類抗體的CDR2的共有序列;以及
(3)抗人類B7-H5抗體2D3/18C3的輕鏈CDR3;
在一個替代優選實施例中,免疫球蛋白分子包括一個、兩個或三個輕鏈CDR和一個、兩個或三個重鏈CDR(最優選是三個輕鏈CDR和三個重鏈CDR),其中重鏈CDR包括:
(1)抗人類B7-H5抗體2D3/18C3的重鏈CDR1;
(2)抗人類B7-H5抗體2D3/18C3的重鏈CDR2;以及
(2)抗人類B7-H5抗體2D3/18C3的重鏈CDR3;
在一個具體實施例中,本發明的抗體或其抗原結合片段將包括上述優選抗體中的一個、兩個、三個、四個、五個、或更優選全部6個CDR,并且將展現結合至人類B7-H5的能力。
(3)CD28H融合蛋白
已經發現,CD28融合蛋白可以是B7-H5和CD28H之間信號傳導的拮抗劑。因此,還披露了CD28H融合蛋白及使用它以下調免疫系統的方法。因此,受體融合多肽典型地阻滯配體結合跨膜CD28H的能力,并且誘導或維持B7-H5:CD28H介導的信號傳導。
在此披露的CD28H融合多肽具有第一融合伴侶,該第一融合伴侶包括(i)直接融合至第二多肽的,或(ii)任選地融合至接頭肽序列(該接頭肽序列融合至第二多肽)的CD28H多肽的全部或一部分。此類融合蛋白可以形成二聚體或多聚體。肽/多肽接頭結構域可以是分開的結構域,或可替代地,可以被包含在融合蛋白的其他結構域(CD28H多肽或第二多肽)之一內。類似地,起作用以便使融合蛋白二聚化或多聚化的這個結構域可為單獨的結構域,或可替代地可包含于融合蛋白的一個其他結構域(CD28H多肽、第二多肽或肽/多肽接頭結構域)中。在一個實施例中,二聚化/多聚化結構域和肽/多肽接頭結構域是相同的。
在此披露的融合蛋白具有式I:N-R1-R2-R3-C,其中“N”表示融合蛋白的N末端,“C”表示融合蛋白的C末端。在優選實施例中,“R1”是CD28H多肽,“R2”是任選的肽/多肽接頭結構域,并且“R3”是第二多肽。可替代地,R3可以是CD28H多肽并且R1可以是第二多肽。
a.第一融合伴侶
受體融合蛋白可以包括全長CD28H多肽,或可以包含全長CD28H的片段或變體。在優選實施例中,第一融合伴侶是CD28H的可溶片段,例如CD28H的胞外結構域的一部分或全部,或其變體。可以使用任何哺乳動物序列CD28H。作為實例,在以上序列中提供了人類序列,連同其已知亞型或變體。在一些實施例中,其他哺乳動物序列,例如小鼠序列,是本領域中已知的并且可以使用。在披露的融合蛋白中有用的人類CD28H多肽可以具有與SEQ ID NO:7具有至少60%、65%、70%、75%、80%、85%、90%、95%、99%、或100%序列一致性的氨基酸序列,或優選具有與SEQ ID NO:7的胞外結構域具有60%、65%、70%、75%、80%、85%、90%、95%、99%、或100%序列一致性的氨基酸序列。在披露的融合蛋白中有用的人類CD28H多肽可以由與SEQ ID NO:8具有至少60%、65%、70%、75%、80%、85%、90%、95%、99%、或100%序列一致性的核酸序列編碼,或優選由與SEQ ID NO:8的核酸序列編碼的胞外結構域具有60%、65%、70%、75%、80%、85%、90%、95%、99%、或100%序列一致性的核酸序列編碼。
b.第二融合伴侶
CD28H多肽可以融合至第二多肽。第二多肽的存在可以改變融合多肽的溶解性、穩定性、親和力和/或化合價(valency)。如在此使用,“化合價”是指每個分子可供使用的結合位點的數目。在一個實施例中,第二多肽是來自不同來源或不同蛋白的多肽。
在一個實施例中,第二多肽包含免疫球蛋白重鏈恒定區的一個或多個結構域,該免疫球蛋白重鏈恒定區優選具有與人類免疫球蛋白Cγ1鏈的鉸鏈、CH2和CH3區對應的、或與鼠免疫球蛋白Cγ2a鏈的鉸鏈、CH2和CH3區對應的氨基酸序列。
在一個優選的二聚體融合蛋白中,二聚體由兩個Ig重鏈的鉸鏈區中的Cys殘基的共價鍵結產生,這些Cys殘基是二聚化的正常Ig重鏈中以二硫鍵連接的相同Cys殘基。此類蛋白可以稱為CD28H-Ig。
在一個實施例中,免疫球蛋白恒定域可含有增強CD28H多肽、其融合蛋白或片段的與具體細胞類型的結合、增加其生物利用度或增加其穩定性的一個或多個氨基酸插入、缺失或取代。適合的氨基酸取代包括如上所述的保守以及非保守取代。
在另一個實施例中,第二多肽可具有軛合結構域,通過該軛合結構域另外的分子可結合至這些CD28H融合蛋白。在一個這樣的實施例中,軛合分子能夠將融合蛋白靶向至具體的器官或組織。在另一個這樣的實施例中,軛合分子是可以增強或增加CD28H融合蛋白的效果的另一免疫調節劑。在另一個實施例中,軛合分子是聚乙二醇(PEG)。
融合蛋白的Fc部分可按照同種型或子類而不同,可以是嵌合體或雜合體,和/或可經過修飾以便例如改進效應子功能、控制半衰期、組織可接近性、增進生物物理特性例如穩定性,并且改進產生效率(并且成本更小)。在構建所披露的融合蛋白中有用的許多修飾以及制備它們的方法在本領域是已知的,參見例如穆勒(Mueller)等人,分子免疫學(Mol.Immun.),34(6):441-452(1997),斯旺(Swann)等人,免疫學當前觀點(Cur.Opin.Immun.),20:493-499(2008),以及普雷斯塔(Presta),免疫學當前觀點(Cur.Opin.Immun.)20:460-470(2008)。在一些實施例中,Fc區是天然IgG1、IgG2、或IgG4Fc區。在一些實施例中,Fc區是雜合體,例如由IgG2/IgG4Fc恒定區組成的嵌合體。該Fc區的修飾包括但不局限于:IgG4被修飾以阻止與Fcγ受體和補體的結合,IgG1被修飾以改進與一種或多種Fcγ受體的結合,IgG1被修飾以最小化效應因子功能(氨基酸變化),IgG1具有改變的/不具有聚糖(典型地通過改變表達宿主),以及IgG1具有與FcRn的改變的pH-依賴性結合。Fc區可以包括整個絞鏈區,或不足整個鉸鏈區。
在用利妥昔單抗(一種針對CD20的嵌合小鼠/人類IgG1單克隆抗體)治療患者的非霍奇金氏淋巴瘤或瓦爾登斯特倫氏巨球蛋白血癥的治療成果與個體的Fcγ受體的等位基因變體的表達相關,這些變體對于人類IgG1的Fc域具有不同的內在親和力。具體而言,具有低親和力激活型Fc受體CD16A(FcγRIIIA)的高親和力等位基因的患者顯示更高的反應率,并且在非霍奇金氏淋巴瘤的情況下顯示改進的無進展生存期。在另一個實施例中,Fc域可含有一個或多個氨基酸插入、缺失或取代,這些插入、缺失或取代減少與低親和力抑制性Fc受體CD32B(FcγRIIB)的結合并且保持野生型水平的與低親和力活化Fc受體CD16A(FcγRIIIA)的結合或增強與之的結合。
另一個實施例包括IgG2-4雜合體和IgG4突變體,它們具有降低的與FcR的結合,這增加了它們的半衰期。代表性IG2-4雜合體和IgG4突變體描述于安蓋爾(Angal),S.等人,分子免疫學(Molecular Immunology),30(1):105-108(1993);穆勒(Mueller),J.等人,分子免疫學,34(6):441-452(1997);以及王(Wang)等人的美國專利號6,982,323中。在一些實施例中,該IgG1和/或IgG2結構域是缺失的,例如,安蓋爾等人描述了絲氨酸241替換為脯氨酸的IgG1和IgG2。
在一個優選實施例中,Fc結構域包含增強與CD16A的結合的氨基酸插入、缺失或取代。在人類IgG1的Fc結構域內增加與CD16A的結合并且減少與CD32B的結合的大量取代在本領域是已知的并且描述于斯塔文哈根(Stavenhagen)等人,癌癥研究(Cancer Res.),57(18):8882-90(2007)中。具有降低的與CD32B的結合和/或增加的與CD16A的結合的人類IgG1Fc結構域的示例性變體包含F243L、R929P、Y300L、V305I或P296L取代。這些氨基酸取代可按任何組合存在于人類IgG1Fc結構域中。在一個實施例中,該人類IgG1Fc結構域變體含有F243L、R929P以及Y300L取代。在另一個實施例中,該人類IgG1Fc結構域變體含有F243L、R929P、Y300L、V305I以及P296L取代。在另一個實施例中,人類IgG1Fc結構域變體包含N297Q取代,因為這個突變消除了FcR結合。
c.肽的或多肽接頭結構域
披露的CD28H融合蛋白任選地包含將CD28H多肽與第二多肽分開的肽或多肽接頭結構域。
1.抗體的鉸鏈區
在一個實施例中,接頭結構域包含免疫球蛋白的鉸鏈區。在一個優選實施例中,鉸鏈區是源自人類免疫球蛋白。可以作為鉸鏈來源的適合的人類免疫球蛋白包括IgG、IgD和IgA。在一個優選實施例中,鉸鏈區是源自人類IgG。免疫球蛋白鉸鏈區和其他結構域的氨基酸序列是本領域熟知的。
2.其他肽或多肽接頭結構域
其他適合的肽/多肽接頭結構域包含天然存在或非天然存在的肽或多肽。肽接頭序列長度是至少2個氨基酸。優選地,肽或多肽結構域是柔性肽或多肽。“柔性接頭”在此是指包含由一個或多個肽鍵連接的兩個或更多個氨基酸殘基的肽或多肽,這為由此連接的兩個多肽提供了比在該柔性接頭不存在下這兩個被連接的多肽將具有的轉動自由度增加的轉動自由度。這種轉動自由度允許由該柔性接頭連接的兩個或更多個抗原結合位點各自更有效地接近一個或多個靶抗原。示例性柔性肽/多肽包括但不限于氨基酸序列Gly-Ser、Gly-Ser-Gly-Ser(SEQ ID NO:16)、Ala-Ser、Gly-Gly-Gly-Ser(SEQ ID NO:17)、(Gly4-Ser)3(SEQ ID NO:18)和(Gly4-Ser)4(SEQ ID NO:19)。另外的柔性肽/多肽序列是本領域熟知的。
在一個實施例中,第一融合伴侶是CD28H的片段。在一個優選實施例中,融合蛋白包括融合至Ig Fc區的CD28H的胞外結構域、或其片段。如先前所述(查波瓦爾(Chapoval)等人,分子醫學方法(Methods Mol.Med.),45:247-255(2000)),可以通過將神經氈蛋白或叢蛋白的編碼區或其片段融合至人類IgG1或小鼠IgG2a的Fc區、或其他適合的Ig結構域,來制備重組CD28H-Ig融合蛋白。
d.示例性融合蛋白
代表性人類CD28H-Ig融合蛋白的氨基酸序列是(SEQ ID NO:20),CD28H-hIgG4(CD28H ECD aa23-140,輕鏈κ信號肽:CD28H序列以黑體字示出;突變的人類IgG4Fc序列加下劃線示出,絲氨酸228至脯氨酸的突變加雙下劃線):
YGPPCPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSPGK
融合蛋白可以另外包括N末端前導序列(輕鏈κ前導序列)(SEQ ID NO:21的此類殘基1-20),
MSVPTQVLGLLLLWLTDARC
或天然存在的CD28H前導序列,例如(SEQ ID NO:22):
MGSPGMVLGLLVQIWALQEASS
雖然根據本發明,已經示出CD28H序列融合至人類IgG4區域,但是此類序列可以可替代地融合至任何Ig同種型,或確實融合至任何其他蛋白。
編碼包括SEQ ID NO:21的信號序列的SEQ ID NO:20的人類CD28H-Ig的DNA序列是(SEQ ID NO:23):
ATGTCCGTGCCCACCCAGGTGCTGGGATTGCTGCTGCTGTGGCTGACCGACGCCAGATGCCTGTCTGTGCAGCAGGGCCCTAACCTGCTGCAAGTGCGGCAGGGCTCTCAGGCTACACTCGTGTGTCAGGTGGACCAGGCCACCGCCTGGGAGAGACTGAGAGTGAAGTGGACCAAGGACGGCGCCATCCTGTGCCAGCCCTACATCACCAACGGCTCCCTGTCCCTGGGCGTGTGTGGACCTCAGGGCAGACTGTCTTGGCAGGCCCCTTCTCACCTGACCCTGCAGCTGGACCCTGTGTCCCTGAATCACTCCGGCGCCTACGTGTGTTGGGCCGCTGTGGAAATCCCCGAGCTGGAAGAGGCCGAGGGCAACATCACCCGGCTGTTCGTGGACCCTGACGACCCTACCCAGGAATCTAAGTACGGCCCTCCCTGCCCTCCTTGCCCAGCCCCTGAATTTCTGGGCGGACCCTCCGTGTTCCTGTTCCCCCCAAAGCCCAAGGACACCCTGATGATCTCCCGGACCCCCGAAGTGACCTGCGTGGTGGTGGATGTGTCCCAGGAAGATCCCGAGGTGCAGTTCAATTGGTACGTGGACGGCGTGGAAGTGCACAACGCCAAGACCAAGCCCAGAGAGGAACAGTTCAACTCCACCTACCGGGTGGTGTCCGTGCTGACCGTGCTGCACCAGGATTGGCTGAACGGCAAAGAGTACAAGTGCAAGGTGTCCAACAAGGGCCTGCCCAGCTCCATCGAAAAGACCATCTCCAAGGCCAAGGGCCAGCCCCGGGAACCCCAGGTGTACACACTGCCTCCAAGCCAGGAAGAGATGACCAAGAACCAGGTGTCACTGACCTGTCTCGTGAAGGGCTTCTACCCCTCCGATATCGCCGTGGAATGGGAGTCCAACGGCCAGCCTGAGAACAACTACAAGACCACCCCCCCTGTGCTGGACTCCGACGGCTCCTTCTTCCTGTACTCCCGCCTGACCGTGGACAAGTCCAGATGGCAGGAAGGCAACGTGTTCTCCTGCTCCGTGATGCACGAGGCCCTGCACAACCACTACACCCAGAAGTCCCTGAGCCTGTCCCCCGGCAAGTGA
E.本發明的優選組合物的治療的和預防的用途
如此處使用的,術語“治療(treat、treating、treatment)”以及“治療用途”是指消除、減少或改善將從增加或降低的免疫應答受益的一種疾病或失調的一個或多個癥狀。如此處使用的,“治療有效量”是指一種治療劑足夠介導改變的免疫應答并且更優選臨床上相關的改變的免疫應答、足夠介導一種疾病或病癥的癥狀的減少或改善的量。如果一種效果的幅度足以影響接受者受試者的健康或預后的話,則該效果是臨床上相關的。治療有效量可以指足以減少或最小化疾病進展,例如延遲或最小化自身免疫應答或炎癥反應或移植排斥的治療劑的量。治療有效量還指在疾病的治療或管理中,提供治療益處的治療劑的量。進一步地,針對治療劑、B7-H5抗體或B7-H5融合蛋白或CD28H融合蛋白的治療有效量意指治療劑單獨或與其他療法組合在疾病的治療或管理中提供治療益處的量,該治療益處是例如,足以增強治療性抗體的治療效力,足以治療或管理疾病。
如此處使用的,術語“預防劑”是指可在檢測到失調或疾病的任何癥狀之前在預防這種失調或疾病中使用的藥劑。“預防有效”量是足夠介導這種保護的預防劑的量。預防有效量還指在疾病的預防中,提供預防益處的預防劑的量。另外,關于預防劑的預防有效量是指預防劑單獨或與其他藥劑相組合在疾病的預防中提供預防益處的量。
在此提供的給藥劑量和頻率是涵蓋在術語治療有效和預防有效內的。典型地,將取決于給予的具體治療劑或預防劑,癌癥的嚴重性和類型,給藥途徑,連同患者的年齡、體重、反應和既往病史,根據特異性針對每一患者的因素,來進一步改變劑量和頻率。適宜的方案可以由本領域的普通技術人員通過考慮到此類因素并且通過遵循例如文獻中所報道的以及在醫師手冊(Physician's Desk Reference)(第56版,2002)中所推薦的劑量進行選擇。
本發明涉及多個分子,例如抗B7-H5抗體(和結合至B7-H5的此類抗體的片段)或CD28H Ig,這些分子通過結合至B7-H5和/或通過結合至CD28H而拮抗(即衰減或損害)B7-H5功能,并且因此衰減或損害T細胞增殖和/或細胞因子產生。將此類分子給予受試者下調了該受試者的免疫系統。
在治療炎癥疾病和自身免疫性疾病和移植排斥中,免疫系統的這種下調是令人希望的。可通過給予本發明的這些抗體治療的自身免疫失調的實例包括但不限于斑形脫發、強直性脊柱炎、抗磷脂綜合征、自身免疫性阿狄森氏病、腎上腺的自身免疫性疾病、自身免疫性溶血性貧血、自身免疫性肝炎、自身免疫性卵巢炎以及睪丸炎、自身免疫性血小板減少癥、白塞氏病、大皰性類天皰瘡、心肌病、乳糜瀉性皮炎(celiac sprue-dermatitis)、慢性疲勞免疫功能紊亂綜合征(CFIDS)、慢性發炎性脫髓鞘性多發性神經病、丘-施二氏綜合征(Churg-Strauss syndrome)、瘢痕性類天皰瘡、CREST綜合征、冷凝集素病、克羅恩氏疾病、盤狀狼瘡、原發性混合型冷球蛋白血癥、纖維肌痛-纖維性肌炎、腎小球腎炎、格拉夫疾病、格林-巴利綜合征(guillain-barre)、橋本氏甲狀腺炎(hashimoto's thyroiditis)、特發性肺纖維化、特發性血小板減少性紫癜(ITP)、IgA神經病、幼年型關節炎、扁平苔癬、紅斑狼瘡、美尼爾氏病、混合結締組織病、多發性硬化癥、視神經脊髓炎(NMO)、1型或免疫介導的糖尿病、重癥肌無力、尋常天皰瘡、惡性貧血、結節性多動脈炎、多發性軟骨炎、多腺體綜合征、風濕性多肌痛、多發性肌炎以及皮膚肌炎、原發性無丙種球蛋白血癥、原發性膽汁性肝硬化、牛皮癬、牛皮癬性關節炎、雷諾氏現象(Raynaud'sphenomenon)、賴特氏綜合征(Reiter's syndrome)、類風濕性關節炎、類肉瘤病、硬皮病、修格連氏綜合征(Sj gren’s syndrome)、僵人綜合征、全身性紅斑狼瘡、紅斑狼瘡、高安氏動脈炎(Takayasu arteritis)、顳動脈炎/巨細胞性動脈炎、潰瘍性結腸炎、葡萄膜炎、血管炎如皰疹樣皮炎血管炎、白癜風以及韋格納氏肉芽腫(Wegener's granulomatosis)。
可以用披露的抗B7-H5抗體及其抗原結合片段和CD28H融合蛋白,具體地CD28H-Ig融合蛋白預防、治療或管理的炎癥疾病的實例包括但不限于哮喘、腦炎、發炎性腸病、慢性阻塞性肺病(COPD)、過敏性失調、敗血性休克、肺纖維化、未分化的脊椎關節病(undifferentitated spondyloarthropathy)、未分化的關節病、關節炎、炎性骨質溶解以及慢性病毒性或細菌性感染所致的慢性炎癥。
可以采用抗B7-H5抗體來產生B7-H5的抗獨特型肽或抗體(沃爾曼(Wallmann),J.等人(2010)“過敏癥中的抗Id:古典概念的時效性(Anti-Ids in Allergy:Timeliness of a Classic Concept)”,世界過敏癥組織雜志(World Allergy Organiz.J)3(6):195-201;納迪(Nardi),M.等人(2000)“在HIV-1-ITP患者中,針對血小板抗GpIII的抗獨特型抗體有助于調節血小板減少(Antiidiotype Antibody Against Platelet Anti-GpIIIa Contributes To The Regulation Of Thrombocytopenia In HIV-1-ITP Patients)”,實驗醫學雜志(J.Exp.Med.)191(12):2093-2100)或模擬物(臧(Zang),Y.C.等人(2003)“在髓鞘堿性蛋白反應性T細胞中,對應于常見CDR3序列基序的TCR肽誘導的人類抗獨特型T細胞(Human Anti-Idiotypic T Cells Induced By TCR Peptides Corresponding To A Common CDR3 Sequence Motif In Myelin Basic Protein-Reactive T Cells)”,國際免疫學(Int.Immunol.)15(9):1073-1080;洛亞諾(Loiarro),M.等人(2010年4月8日電子出版)“人類疾病中的靶向的TLR/IL-1R信號傳導(Targeting TLR/IL-1R Signalling In Human Diseases)”,炎癥介導物(Mediators Inflamm.)2010:674363)。此類分子用作B7-H5的替代物,并且因此向受試者給予它們,通過接合CD28H反受體并且防止它結合內源B7-H5受體而下調該受試者的免疫系統。在移植物抗宿主疾病、炎癥疾病、和自身免疫性疾病的治療中,此類分子具有效用。
因此,在移植物抗宿主疾病、炎癥疾病和自身免疫性疾病的治療中,本發明的抗體和抗原結合片段和融合蛋白具有效用。
類似地,增強此類抗體和此類受體/配體之間的結合的激動劑抗體,以及其他受體激動劑(例如B7-H5融合蛋白)具有作為B7-H5信號傳導的激動劑的效用,并且因此在癌癥和感染性疾病的治療中具有效用。相應地,本發明還涉及CD28H激動劑分子,例如B7-H5-Ig融合蛋白,這些分子通過結合至CD28H,激動CD28H功能(即信號傳導)和/或通過結合至B7-H5,并且因此增加或刺激T細胞增殖和/或細胞因子產生。將此類分子給予受試者上調受試者的免疫系統,并且可以用于治療患有癌癥或感染性疾病的受試者。因為在T細胞活化中涉及B7-H5通路,所以當結合疫苗時,此類分子是特別有用的。
在此所提供的CD28H激動劑在體內和離體中作為免疫應答刺激治療劑通常是有用的。例如,對于通過給予受試者一個量的CD28H激動劑,刺激或增強宿主中的免疫應答,以便治療癌癥,CD28H激動劑是有用的。可以用提供的組合物和方法治療的癌癥的類型包括但不限于以下項:膀胱癌、腦癌、乳癌、宮頸癌、大腸癌、食道癌、腎癌、肝癌、肺癌、鼻咽癌、胰腺癌、前列腺癌、皮膚癌、胃癌、子宮癌、卵巢癌、睪丸癌和血液癌。
根據腫瘤起源的組織的胚胎起源,在此將可以治療的惡性腫瘤分類。癌瘤(carcinomas)是起源自內胚層組織或外胚層組織,例如皮膚或內臟器官和腺體的上皮層的腫瘤。肉瘤,它不太經常出現,是源自中胚層結締組織,例如骨骼、脂肪、和軟骨。白血病和淋巴瘤是骨髓的造血細胞的惡性腫瘤。白血病作為單細胞增殖,而淋巴瘤傾向于作為腫瘤團塊生長。惡性腫瘤可以在身體的多個器官或組織上顯現,以建立癌癥。
可以給予CD28H激動劑,用于治療局部的或全身的病毒感染,包括但不限于免疫缺陷(例如HIV)、乳頭狀瘤(例如HPV)、皰疹(例如HSV)、腦炎、流感(例如人類流感病毒A)、以及普通感冒(例如人類鼻病毒)病毒感染。可以局部地給予包括CD28H激動劑組合物的藥物配制品,以治療病毒性皮膚病,例如皰疹損傷或帶狀皰疹、或生殖器疣。還可以給予CD28H激動劑組合物的藥物配制品,以治療全身性病毒疾病,包括但不限于AIDS、流感、普通感冒、或腦炎。
可以治療的代表性感染包括但不限于由微生物引起的感染,這些微生物包括但不限于放線菌屬,魚腥藻屬,芽胞桿菌屬,擬桿菌屬,蛭弧菌屬,博代氏桿菌屬,疏螺旋體屬,彎曲菌屬,柄桿菌屬,衣原體,綠菌屬,著色菌屬,梭菌屬,棒桿菌屬,噬細胞菌屬,異常球菌屬,埃希氏桿菌屬,弗朗西斯氏菌屬,鹽桿菌屬,螺桿菌屬,嗜血桿菌屬,B型流感嗜血桿菌(HIB),組織胞漿菌屬,生絲微菌屬,軍團菌屬,利什曼原蟲屬,鉤端螺旋體,李斯特菌屬,腦膜炎球菌A、B和C,甲烷桿菌屬,微球菌屬,分支桿菌屬,支原體屬,粘球菌屬,奈瑟氏菌屬,硝化菌屬,顫藻屬,原綠藻,變形桿菌屬,假單胞菌屬,紅螺菌屬,立克次氏體,沙門氏菌屬,志賀氏菌屬,螺菌屬,螺旋體屬,葡萄球菌屬,鏈球菌屬,鏈霉菌屬,硫化葉菌屬,熱原體屬,硫桿菌屬,和密螺旋體屬,弧菌屬,耶爾森菌屬,新型隱球菌,莢膜組織胞漿菌,白色念珠菌,熱帶假絲酵母,星狀諾卡氏菌,立氏立克次氏體,斑疹傷寒立克次氏體,肺炎支原體,鸚鵡熱衣原體,沙眼衣原體,惡性瘧原蟲,間日瘧原蟲,布氏錐蟲,痢疾變形蟲,鼠弓形體,陰道毛滴蟲以及曼氏血吸蟲。
可以單獨地或者結合任何其他適合的治療,來給予披露的CD28H激動劑或編碼它的核酸。在一個實施例中,可以結合疫苗組合物,或作為疫苗組合物的組分,來給予CD28H激動劑。疫苗組合物的適合的組分,抗原和/或佐劑。可以在給予疫苗之前、同時、或之后來給予披露的CD28H激動劑。在一個實施例中,在給予疫苗的同時來給予CD28H激動劑組合物。
可以結合預防疫苗、或治療疫苗來給予披露的CD28H激動劑組合物,這些疫苗可以用于啟動或增強受試者對預先存在的抗原,例如患有癌癥的受試者中的腫瘤抗原的免疫應答。
根據本領域熟知的原理,預防的、治療的、或脫敏的免疫應答的希望的結果可以根據疾病來變化。類似地,針對癌癥、過敏原或感染性病原體的免疫應答可以完全地治療疾病,可以減輕癥狀,或可以是針對疾病的整體治療性干預的一個方面。例如,針對癌癥的免疫應答的刺激可以偶聯外科的、化學療法的、放射的、激素的和其他免疫的方法來影響治療。
F.給予方法
不同遞送系統是己知的并且可以用于給予治療的或預防的組合物,例如,封裝在脂質體、微粒、微膠囊中,能夠表達抗體或融合蛋白的重組細胞,受體介導的內吞作用(參見(例如)吳(Wu)和吳(Wu),1987,生物化學雜志(J.Biol.Chem.)262:4429-4432),將核酸構建為逆轉錄病毒或其他載體的一部分,等等。
給予抗體和融合蛋白的方法包括但不限于:腸胃外給予(例如,真皮內的、肌內的、腹膜內的、靜脈內的以及皮下的),硬膜外給予,以及粘膜給予(例如,鼻內途徑和口腔途徑)。在一個具體實施例中,肌內地、靜脈內地、或皮下地給予抗體或融合蛋白。可以通過任何方便的途徑給予這些組合物,例如通過輸注或單次快速靜脈注射(bolus injection)、通過經由上皮或皮膚粘膜內層(例如口腔粘膜、直腸和腸道粘膜,等等)吸收,并且可以將其與其他生物活性劑一起給予。給予可以是全身性的或局部的。此外,也可以例如通過使用吸入器或霧化器以及具有霧化劑的配制品而采用肺部給予。參見,例如美國專利號6,019,968;5,985,20;5,985,309;5,934,272;5,874,064;5,855,913;5,290,540;以及4,880,078;以及PCT公開號WO 92/19244;WO 97/32572;WO 97/44013;WO 98/31346;以及WO 99/66903。在一個具體實施例中,會希望將藥用組合物局部地給予至需要治療的區域;這可以通過例如以下方式實現,但不僅限于這些方式:局部輸注,通過注射、或借助植入物,所述植入物是多孔的、非多孔的或凝膠狀材料,包括膜,如硅橡膠膜(sialastic membrane)、或纖維。優選地,當給予抗體或融合蛋白時,必須小心,要使用不吸收抗體或融合蛋白的材料。
在一些實施例中,將抗體和或融合蛋白配制在脂質體中,用于抗體或融合蛋白的靶向遞送。脂質體是由封裝水相的同心有序的磷脂雙分子層組成的囊泡。脂質體典型地包括不同類型的脂質、磷脂、和/或表面活性劑。脂質體的組分是以雙分子層構型安排的,類似于生物膜的脂類安排。脂質體是特別優選的遞送運載體,部分歸因于其生物相容性、低免疫原性、以及低毒性。用于制備脂質體的方法是本領域已知的,并且涵蓋在本發明內,參見例如愛潑斯坦(Epstein)等人,1985,美國國家科學院院刊(Proc.Natl.Acad.Sci.USA)82:3688;黃(Hwang)等人,1980美國國家科學院院刊(Proc.Natl.Acad.Sci.USA),77:4030-4;美國專利號4,485,045和4,544,545。
用于制備具有延長的血清半衰期(即增強的循環時間)的脂質體的方法,例如披露于美國專利號5,013,556中的那些,可以用于制造脂質體-抗體組合物。優選的脂質體并不從循環中迅速清除,即并不被攝取進單核巨噬細胞系統(MPS)中。本發明涵蓋使用本領域普通技術人員已知的普通方法制備的立體穩定脂質體。雖然并不旨在受具體作用機制的束縛,但是立體穩定脂質體包含具有體積大并且高度柔性的親水部分的脂質組分,這些組分減少了脂質體與血清蛋白的不想要的反應,減少了血清組分的調理作用,并且減少了被MPS識別。優選使用聚乙二醇來制備立體穩定脂質體。關于制備脂質體和立體穩定脂質體,參見例如本達斯(Bendas)等人,2001生物藥物(BioDrugs),15(4):215-224;艾倫(Allen)等人,1987歐洲生化學會聯合會快報(FEBS Lett.)223:42-6;克利巴諾夫(Klibanov)等人,1990歐洲生化學會聯合會快報(FEBS Lett.)268:235-7;布盧姆(Blum)等人,1990,生物化學與生物物理學報(Biochim.Biophys.Acta.),1029:91-7;托基林(Torchilin)等人,1996,脂質體研究雜志(J.Liposome Res.)6:99-116;里辛格爾(Litzinger)等人,1994,生物化學與生物物理學報(Biochim.Biophys.Acta.),1190:99-107;丸山(Maruyama)等人,1991,化學與藥學通報(Chem.Pharm.Bull.),39:1620-2;克利巴諾夫(Klibanov)等人,1991,生物化學與生物物理學報(Biochim.Biophys.Acta.),1062;142-8;艾倫(Allen)等人,1994,先進藥物遞送評論(Adv.Drug Deliv.Rev),13:285-309。本發明還涵蓋適配為用于特定器官靶向(參見例如美國專利號4,544,545)、或特定細胞靶向(參見例如美國專利申請公開號2005/0074403)的脂質體。可以通過用包括磷脂酰膽堿、膽固醇、和PEG衍生化磷脂酰乙醇胺(PEG-PE)的脂質組合物的反相蒸發方法,來產生用于披露的組合物和方法的特別有用的脂質體。通過限定孔徑大小的過濾器擠出脂質體,以生成具有希望的直徑的脂質體。在一些實施例中,可以使用先前描述的方法,將抗體的片段例如F(ab’)軛合至脂質體,參見例如馬丁(Martin)等人,1982,生物化學雜志(J.Biol.Chem.)257:286-288。
還可以將B7-H5抗體、或B7-H5或CD28H融合蛋白配制為免疫脂質體。免疫脂質體是指脂質體組合物,其中抗體或其片段被共價地或非共價地連接至脂質體表面。連接抗體至脂質體表面的化學是本領域已知的,并且涵蓋在本發明內,參見例如美國專利號6,787,153;艾倫(Allen)等人,1995,隱形脂質體(Stealth Liposomes)博卡拉頓:CRC出版社,233-44;漢森(Hansen)等人,1995,生物化學與生物物理學報(Biochim.Biophys.Acta.),1239:133-144。在最優選的實施例中,用于披露的方法和組合物的免疫脂質體進一步被立體穩定化。優選地,抗體或融合蛋白共價地或非共價地連接至疏水錨,該錨穩定地扎根于脂質體的脂質雙分子層中。疏水錨的實例包括但不限于磷脂,例如磷脂酰乙醇胺(PE)、磷脂酰肌醇(PI)。為了實現抗體和疏水錨之間的共價鍵,可以使用本領域中任何已知的生物化學策略,參見例如托馬斯奧格斯格(J.Thomas August)編輯,1997,基因治療:藥理學進展(Gene Therapy:Advances in Pharmacology),40卷,學術出版社(Academic Press),圣迭戈,加利福尼亞州,399-435頁。例如,抗體分子上的官能團可以與關聯脂質體的疏水錨上的活性基團反應,例如抗體上的賴氨酸側鏈的氨基可以偶聯至關聯脂質體的用水溶性碳二亞胺活化的N-戊二酰-磷脂酰乙醇胺;或經由硫醇反應性錨,例如吡啶基巰基丙酰基磷脂酰乙醇胺,還原的抗體的硫醇基可以偶聯至脂質體。參見例如迪特里希(Dietrich)等人,1996,生物化學(Biochemistry),35:1100-1105;羅貴爾(Loughrey)等人,1987,生物化學與生物物理學報(Biochim.Biophys.Acta.),901:157-160;馬丁(Martin)等人,1982,生物化學雜志(J.Biol.Chem.)257:286-288;馬丁(Martin)等人,1981,生物化學(Biochemistry),20:4429-38。雖然并不旨在受具體作用機制的束縛,但是包括抗體或融合蛋白的免疫脂質體配制品作為治療劑是特別有效的,因為它們遞送抗體或融合蛋白至靶細胞(即包括抗體或融合蛋白結合的受體的細胞)的細胞質。免疫脂質體優選具有血液(確切地靶細胞)中增加的半衰期,并且可以內化進靶細胞的細胞質中,由此避免了治療劑的損失或被內吞溶酶體通路降解。
免疫脂質體組合物包括一種或多種囊泡形成脂質、抗體或其片段或衍生物或融合蛋白,和任選地,親水聚合物。囊泡形成脂質優選是具有兩個烴鏈,例如酰基鏈和極性頭基的脂質。囊泡形成脂質的實例包括磷脂,例如磷脂酰膽堿、磷脂酰乙醇胺、磷脂酸、磷脂酰肌醇、鞘磷脂、和糖脂,例如腦苷脂、神經節苷脂。在配制品中有用的另外的脂質是本領域普通技術人員已知的并且涵蓋在本發明內。在一些實施例中,免疫脂質體組合物進一步包括親水聚合物,例如聚乙二醇、和神經節苷脂GM1,這些親水聚合物增加了脂質體的血清半衰期。將親水聚合物軛合至脂質體的方法是本領域熟知的并且涵蓋在本發明內。關于免疫脂質體和用于制備它們的方法的綜述,參見例如美國專利申請號2003/0044407;PCT國際公開號WO 97/38731,溫格霍茨(Vingerhoeads)等人,1994,免疫方法(Immunomethods),4:259-72;丸山(Maruyama),2000,生物與藥學通報(Chem.Pharm.Bull.)23(7):791-799;阿布拉(Abra)等人,2002,脂質體研究雜志(Journal of Liposome Research),12(1和2):1-3;帕克(Park),2002,生物科學報道(Bioscience Reports),22(2):267-281;本達斯(Bendas)等人,2001生物藥物(BioDrugs),14(4):215-224;托馬斯奧格斯格(J.Thomas August)編輯,1997,基因治療:藥理學進展(Gene Therapy:Advances in Pharmacology),40卷,學術出版社(Academic Press),圣迭戈,加利福尼亞州,399-435頁。
可以將抗體和融合蛋白包裝在指明抗體的量的密封容器中,例如安瓿或小藥囊。在一個實施例中,這些抗體是作為一種處于密封容器中的干燥的無菌凍干粉或無水濃縮物來提供,并且可以用水或鹽水重構至用于給予受試者的適當濃度。優選地,這些抗體或融合蛋白是作為一種干燥的無菌凍干粉在密封容器中按以下單位劑量提供的:至少5mg、更優選地至少10mg、至少15mg、至少25mg、至少35mg、至少45mg、至少50mg、或至少75mg。凍干的抗體或融合蛋白應在2℃與8℃之間在其原始容器中儲存,并且這些抗體在重構之后應在12小時內,優選地6小時內、5小時內、3小時內、或1小時內給予。在一個可替代實施例中,抗體或融合蛋白是以液體形式在指明該抗體、融合蛋白、或軛合分子的量和濃度的密封容器中提供的。優選地,液體形式的抗體或融合蛋白是在密封容器中以至少1mg/ml、更優選至少2.5mg/ml、至少5mg/ml、至少8mg/ml、至少10mg/ml、至少15mg/kg、至少25mg/ml、至少50mg/ml、至少100mg/ml、至少150mg/ml、至少200mg/ml的抗體或融合蛋白提供。
配制品中采用的精確劑量還將取決于給藥途徑和病癥的嚴重性,并且應當根據執業醫師的判斷和每一患者的情況來決定。可以根據源自體外或動物模型測試系統的劑量反應曲線推斷有效劑量。對于抗體和融合蛋白,給予至患者的劑量典型地是0.0001mg/kg至100mg/kg患者體重。優選地,給予患者的劑量是在0.0001mg/kg和20mg/kg、0.0001mg/kg和10mg/kg、0.0001mg/kg和5mg/kg、0.0001和2mg/kg、0.0001和1mg/kg、0.0001mg/kg和0.75mg/kg、0.0001mg/kg和0.5mg/kg之間、0.0001mg/kg至0.25mg/kg、0.0001至0.15mg/kg、0.0001至0.10mg/kg、0.001至0.5mg/kg、0.01至0.25mg/kg或0.01至0.10mg/kg患者體重。通常,人類抗體在人體內相比其他物種具有更長的半衰期,歸因于對外來多肽的免疫應答。因此,更低劑量的人類抗體以及更小頻率給予常常是合適的。進一步,給予抗體或其片段或融合蛋白的劑量和頻率可通過增強這些抗體或融合蛋白的攝取以及組織滲透性(通過修飾諸如,例如脂化)來減少。
在又另一個實施例中,可以在控制釋放或持續釋放系統中遞送這些組合物。可以使用本領域普通技術人員已知的任何技術來產生包括一種或多種抗體或融合蛋白的持續釋放配制品。參見例如美國專利號4,526,938;PCT公開案WO 91/05548;PCT公開案WO 96/20698;寧(Ning)等人,1996,“使用持續釋放凝膠的人類結腸癌異種移植物的瘤內放射免疫治療(Intratumoral Radioimmunotheraphy of a Human Colon Cancer Xenograft Using a Sustained-Release Gel)”,放射治療&腫瘤學(Radiotherapy&Oncology)39:179-189;宋(Song)等人,1995,“長循環乳劑的抗體介導的肺靶向(Antibody Mediated Lung Targeting of Long-Circulating Emulsions)”,制藥科學和技術的PDA雜志(PDA Journal of Pharmaceutical Science and Technology)50:372-397;克里克(Cleek)等人,1997,“用于心血管應用的bFGF抗體的生物可降解聚合物載體(Biodegradable Polymeric Carriers for a bFGF Antibody for Cardiovascular Application)”,控制脂肪生物活性材料的國際討論會的會議記錄(Pro.Int’l.Symp.Control.Rel.Bioact.Mater.)24:853-854;和拉姆(Lam)等人,1997,“用于局部遞送的重組人源化單克隆抗體的微膠囊化(Microencapsulation of Recombinant Humanized Monoclonal Antibody for Local Delivery)”,控制脂肪生物活性材料的國際討論會的會議記錄(Pro.Int’l.Symp.Control.Rel.Bioact.Mater.)24:759-760。在一個實施例中,可以將泵用于控制釋放系統(參見蘭格(Langer),同上;塞夫頓(Sefton),1987,生物醫學工程CRC關鍵參考(CRC Crit.Ref.Biomed.Eng.)14:20;布赫瓦爾德(Buchwald)等人,1980,外科學(Surgery)88:507;和索德克(Saudek)等人,1989,新英格蘭醫學雜志(N.Engl.J.Med.)321:574)。在另一實施例中,聚合物材料可以用于實現抗體的控制釋放(參見例如控制釋放的醫學應用(Medical Applications of Controlled Release),蘭格(Langer)和懷斯(Wise)(編輯),CRC出版社(CRC Pres.),波卡拉頓,佛羅里達州(1974);控制的藥物生物利用率、藥物產物涉及和性能(Controlled Drug Bioavailability,Drug Product Design and Performance),斯莫倫(Smolen)和鮑爾(Ball)(編輯),威利出版社(Wiley),紐約(1984);蘭杰(Ranger)和帕帕斯(Peppas),1983,大分子科學綜述和大分子化學雜志(J.,Macromol.Sci.Rev.Macromol.Chem.)23:61;還參見利維(Levy)等人,1985,科學(Science)228:190;迪蘭(During)等人,1989,神經學年報(Ann.Neurol.)25:351;霍華德(Howard)等人,1989,神經外科雜志(J.Neurosurg.)71:105);美國專利號5,679,377;美國專利號5,916,597;美國專利號5,912,015;美國專利號5,989,463;美國專利號5,128,326;PCT公開號WO 99/15154;和PCT公開號WO 99/20253)。在持續釋放制劑中使用的聚合物的例子包括但不限于,聚(2-羥乙基甲基丙烯酸酯)、聚(甲基丙烯酸甲酯)、聚(丙烯酸)、聚(乙烯共乙酸乙烯酯)、聚(甲基丙烯酸)、聚乙交酯(PLG)、聚酐、聚(N-乙烯吡咯烷酮)、聚(乙烯醇)、聚丙烯酰胺、聚(乙二醇)、聚丙交酯(PLA)、聚(丙交酯共乙交酯)(PLGA)和聚原酸酯。在又另一個實施例中,可以將控制釋放系統放置在治療靶(例如肺)附近,因此僅要求一部分的全身性劑量(參見例如古德森(Goodson),控制釋放的醫學應用(Medical Applications of Controlled Release),同上,2卷,115-138頁(1984))。在另一個實施例中,根據鄧恩(Dunn)等人,使用作為控制釋放植入物有用的聚合物組合物(參見U.S.5,945,155)。這一具體方法是基于來自聚合物系統的生物活性材料的原位控制釋放的治療效果。通常,植入發生在需要治療性治療的患者的身體內的任何地方。在另一實施例中,使用非聚合物持續遞送系統,由此受試者體內的非聚合物植入物被用作藥物遞送系統。當在體內植入時,植入物的有機溶劑將從組合物消散、分散、或浸入至周圍組織液,并且非聚合物材料將逐步凝結或沉淀以形成固體、微孔基質(參見U.S.5,888,533)。在蘭格(Langer)的綜述(1990,科學(Science)249:1527-1533)中討論了控制釋放系統。可以使用本領域普通技術人員已知的任何技術來產生包括一種或多種治療劑,即B7-H5抗體或CD28H融合蛋白的持續釋放配制品。參見例如美國專利號4,526,938;國際公開號WO 91/05548和WO 96/20698;寧(Ning)等人,1996,放射治療&腫瘤學(Radiotherapy&Oncology)39:179-189;宋(Song)等人,1995,制藥科學和技術的PDA雜志(PDA Journal of Pharmaceutical Science and Technology)50:372-397;克里克(Cleek)等人,1997,控制脂肪生物活性材料的國際討論會的會議記錄(Pro.Int’l.Symp.Control.Rel.Bioact.Mater.)24:853-854;和拉姆(Lam)等人,1997,控制脂肪生物活性材料的國際討論會的會議記錄(Pro.Int’l.Symp.Control.Rel.Bioact.Mater.)24:759-760。
在一個具體實施例中,其中治療的或預防的組合物是編碼B7-H5抗體或其抗原結合片段的核酸,或編碼CD28H融合蛋白(例如CD28H-Ig融合蛋白)的核酸,可以在體內給予該核酸,以促進其編碼的抗體或融合體的表達,這是通過構建它為適當核酸表達載體的一部分并且給予它使得它變為細胞內的來實現的,例如通過使用逆轉錄病毒載體(參見美國專利號4,980,286)實現,或通過直接注射實現,或通過使用微粒轟擊(例如基因槍,Biolistic,杜邦公司(Dupont))實現,或通過涂覆脂質或細胞表面受體或轉染劑實現,或通過將其連接到已知進入細胞核的同源框樣肽來給予它實現(參見例如約里奧(Joliot)等人,1991,美國國家科學院院刊(Proc.Natl.Acad.Sci.USA)88:1864-1868)等。可替代地,核酸可以引入細胞內且通過同源重組整合入宿主細胞DNA內用于表達。
使用治療有效量的或預防有效量的抗體或融合蛋白對受試者進行的治療可以包括單一治療、或優選地可以包括一系列治療。
G.藥用組合物
這些組合物包括在藥用組合物的制造中有用的散裝藥物組合物(例如不純的或非無菌的組合物)以及可用于單位劑型的制備的藥用組合物(即適合于給予受試者或病人的組合物)。這樣的組合物包括在此披露的預防或治療有效量的預防和/或治療劑或那些藥劑與藥學上可接受的載體的組合。優選地,披露的組合物包括預防有效量的或治療有效量的抗體或融合蛋白和藥學上可接受的載體。
在一個特定的實施例中,術語“藥學上可接受的”是指由聯邦政府或州政府的監管機構批準的或在美國藥典或其他普遍認可的藥典中列出的,用于在動物體內并且更特別地在人體內使用。術語“載體”是指與治療劑一起給予的稀釋劑、佐劑(如弗氏佐劑(完全和不完全的))、賦形劑或運載體。此類藥物載體可以為無菌液體,如水和油,包括石油、動物、植物或合成來源的油,如花生油、豆油、礦物油、芝麻油等。當靜脈內給予藥用組合物時,水是優選的載體。還可以將鹽水溶液、水性右旋糖和甘油溶液用作液體載體,特別是用于注射溶液。適合的藥用賦形劑包括淀粉、葡萄糖、乳糖、蔗糖、明膠、麥芽、米、面粉、白堊、硅膠、硬脂酸鈉、單硬脂酸甘油酯、滑石、氯化鈉、脫脂奶粉、甘油、丙烯、二醇、水、乙醇以及類似物。如果希望的話,該組合物還可包含少量濕潤劑或乳化劑或pH緩沖劑。這些組合物可以采取以下形式:溶液、懸浮液、乳液、片劑、丸劑、膠囊、粉劑、持續釋放配制品以及類似物。
一般地,組合物的成分分開或混合在一起以單位劑型提供,例如,作為在密封容器中的干燥的凍干粉或無水濃縮劑,所述密封容器例如是指明活性劑的量的安瓿或小藥囊。在通過輸注給予組合物時,可以用含有無菌藥用級水或鹽水的輸液瓶配制。在通過注射給予組合物時,可以提供無菌注射用水或鹽水的安瓿,使得可以在給藥前將這些成分混合。
可以將這些組合物配制為中性形式或鹽形式。藥學上可接受的鹽包括但不限于由陰離子形成的那些,例如來源于鹽酸、磷酸、乙酸、草酸、酒石酸等的那些,以及由陽離子形成的那些,例如來源于鈉、鉀、銨、鈣、鐵的氫氧化物,異丙胺,三乙胺,2-乙氨基乙醇,組氨酸,普魯卡因等的那些。
H.試劑盒
一個實施例提供了包括一個或多個填充有抗體或融合蛋白的容器的藥物包或試劑盒。另外,對于治療疾病有用的一種或多種其他預防劑或治療劑也可以包括在藥物包或試劑盒中。一個實施例提供了包括填充有一種或多種藥用組合物的成分的一個或多個容器的藥物包或試劑盒。可任選地,與這樣一個或多個容器相關聯的可以是由管理藥物或生物制品的制造、使用或銷售的政府機構規定的形式的公告,所述公告反映該機構針對人類給予,對制造、使用或銷售的許可。
本發明提供了可以在以上方法中使用的試劑盒。在一個實施例中,試劑盒包括一種或多種抗體或融合蛋白。在另一實施例中,試劑盒進一步包括在一個或多個容器中,對治療癌癥有用的一種或多種其他預防劑或治療劑。在另一實施例中,試劑盒進一步包括結合與癌癥有關的一種或多種癌癥抗原的一種或多種細胞毒性抗體。在某些實施例中,其他預防劑或者治療劑是化學治療劑。在其他實施例中,預防劑或治療劑是生物治療劑或激素治療劑。
I.診斷方法
B7-H5抗體及其抗原結合片段可以用于診斷目的,例如檢測、診斷、或監測與B7-H5表達有關的疾病、失調或感染。本發明提供了對于疾病、失調或感染,特別是自身免疫性疾病的檢測或診斷,包括:(a)使用免疫特異性地結合至此類抗原的一種或多種抗體(或其片段),測定在受試者的細胞或組織樣品中B7-H5的表達;并且(b)將該抗原的水平與對照水平(例如,在正常組織樣品中的水平)進行比較,借此相比于該抗原的對照水平而言該抗原的測定水平的增加或降低指示該疾病、失調或感染。在免疫測定,諸如酶聯免疫吸附測定(ELISA)、放射性免疫測定(RIA)以及熒光激活的細胞分選(FACS)中優選采用此類抗體以及片段。
一個實施例涉及將此類抗體以及片段、并且特別是結合到人B7-H5的此類抗體以及片段用于體外或原位組織樣品或體內細胞中的IHC分析的試劑。因此,本發明的這些抗體以及片段在檢測以及診斷人的疾病、失調、或感染中具有效用。在一個實施例中,此類診斷包括:a)將有效量的免疫特異性地結合到B7-H5的標記的抗體或抗原結合片段給予至受試者(例如,經腸胃外、皮下、或腹膜內);b)在給藥后等待一個時間間隔以允許該標記的分子優先集中在受試者中B7-H5表達的部位(并且未結合的標記的分子被清除至背景水平);c)確定背景水平;并且d)檢測受試者中的標記抗體,使得高于背景水平的標記抗體的檢測指示該受試者患有疾病、失調、或感染。根據此實施例,用成像部分標記該抗體,該成像部分可使用本領域的普通技術人員已知的成像系統檢測到。背景水平可以通過不同方法確定,這些方法包括將所檢測到的標記的分子的量與之前針對具體系統測定的標準值進行對比。
本領域將理解的是,受試者和使用的成像系統的大小將決定產生診斷圖像所需的成像部分的量。在以下項中描述了體內腫瘤成像:S.W.布切爾(Burchiel)等人,“放射標記的抗體及其片段的免疫藥代動力學(Immunopharmacokinetics of Radiolabeled Antibodies and Their Fragments)”,(腫瘤成像,第13章:癌癥的生物化學檢測(TUMOR IMAGING:THE RADIOCHEMICAL DETECTION OF CANCER),S.W.布切爾(Burchiel)和B.A.羅德(Rhodes)編輯,馬森出版公司(Masson Publishing Inc.)(1982)。
依賴于若干變量,包括所使用的標記的類型以及給予模式,在給藥后用以允許該標記的分子優先集中在受試者的部位并且未結合的標記的分子被清除至背景水平的一個時間間隔是6至48小時或6至24小時或6至12小時。在另一個實施例中,給藥后的時間間隔是5至20天或5至10天。
在一個實施例中,通過重復用于診斷疾病、失調或感染的方法對該疾病、失調或感染進行監測,例如,初次診斷一個月之后,初次診斷六個月之后,初次診斷一年之后等。
可以使用本領域中已知的用于體內掃描的方法在受試者中檢測該標記的分子的存在。這些方法依賴于所使用的標記的類型。技術人員將能夠確定用于檢測具體的標記的適當的方法。可用于這些披露的診斷方法的方法以及裝置包括但不限于計算機斷層攝影(CT)、全身掃描諸如正電子發射體層攝影(PET)、磁共振成像(MRI)、以及超聲檢查。
在一個特定實施例中,該分子是用放射性同位素標記的,并且在患者中使用輻射響應外科儀器檢測(瑟斯頓(Thurston)等人,美國專利號5,441,050)。在另一個實施例中,該分子是用熒光化合物標記的,并且在患者中使用熒光響應的掃描儀器檢測。在另一個實施例中,該分子是用正電子發射金屬標記的,并且在患者中使用正電子發射斷層攝影檢測。在又另一個實施例中,該分子是用順磁標記來標記的,并且在患者中使用磁共振成像(MRI)檢測。
目前總體上已經描述了本發明,其內容可以通過參考下面的實例更容易理解,這些實例是以說明的方式提供,而并非旨在限制本發明,除非特別指明。
實例1
抗人類B7-H5抗體的分離和表征
通過用B7-H5免疫倉鼠,并且分離表達B7-H5免疫反應性抗體的雜交瘤,獲得抗人類B7-H5抗體。分離產生抗體的克隆2D3和18C3。圖4A-4B示出由克隆2D3和18C3產生的抗體結合由CHO轉染子表達的人類B7-H5的能力。
通過在此類抗體的存在下孵育表達人類B7-H5的CHO轉染子,并且增加CD28H Ig(SEQ ID NO:20)和抗人類Ig PE的濃度,來確定分離的抗體阻滯B7-H5:CD28H相互作用的能力。
在這樣一個實驗中,在非阻滯抗體的存在下孵育的細胞能夠結合CD28H Ig(參見如第二遷移峰)(圖5A-5B)。發現抗體2D3和18C3阻滯B7-H5:CD28H相互作用。
針對其阻滯B7-H5:CD28H相互作用的能力,測試本發明的抗B7-H5抗體。制備B7-H5Ig融合體并且發現它能夠結合CD28H并且由此能夠刺激T細胞應答(圖6)。融合蛋白是融合至鼠IgG2a序列的B7-H5的胞外結構域(SEQ ID NO:26)。
IFPLAFFIYVPMNEQIVIGRLDEDIILPSSFERGSEVVIHWKYQDSYKVHSYYKGSDHLESQDPRYANRTSLFYNEIQNGNASLFFRRVSLLDEGIYTCYVGTAIQVITNKVVLKVGVFLTPVMKYEKRNTNSFLICSVLSVYPRPIITWKMDNTPISENNMEETGSLDSFSINSPLNITGSNSSYECTIENSLLKQTWTGRWTMKDGLHKMQSEHVSLSCQPVNDYFSPNQDFKVTWSRMKSGTFSVLAYYLSSSQNTIINESRFSWNKELINQSDFSMNLMDLNLSDSGEYLCNISSDEYTLLTIHTVHVEPSQET
IgG2a序列可以是(SEQ ID NO:27)
EPRGPTIKPCPPCKCPAPNLLGGPSVFIFPPKIKDVLMISLSPIVTCVVVDVSEDDPDVQISWFVNNVEVHTAQTQTHREDYNSTLRVVSALPIQHQDWMSGKEFKCKVNNKDLPAPIERTISKPKGSVRAPQVYVLPPPEEEMTKKQVTLTCMVTDFMPEDIYVEWTNNGKTELNYKNTEPVLDSDGSYFMYSKLRVEKKNWVERNSYSCSVVHEGLHNHHTTKSFSRTPGK
mIgG2a并不要求S->P修飾(在以下更詳細討論并且如SEQ ID NO:20中示出)來穩定Fab臂或不要求缺失C末端Lys。還可以用其他Ig序列,例如人類IgG4來制造融合蛋白。對于人類IgG4,它可以優選包括S->P修飾和/或缺失最后的Lys殘基,如在以上討論的示例性hIgG4蛋白中說明。
融合蛋白表達自編碼CD33信號肽(不是天然信號肽)的載體。
圖7示出B7-H5 Ig誘導細胞因子(IL-2、IFN-γ和IL-10)表達的能力,由此確認該分子刺激免疫系統的能力。抗B7-H5抗體2D3的提供抑制了這種刺激(圖8)。還發現該抗體能夠抑制異體T細胞應答(圖9)。這些結果指示能夠結合B7-H5從而阻滯B7-H5的與其CD28H反受體相互作用的能力的本發明的那些抗體能夠介導免疫系統活化中的生理學下降。
實例2
抗人類B7-H5抗體降低體內活化T細胞的百分比
為了研究抗人類B7-H5抗體的體內作用,將2000萬個外周血單核細胞(PBMC)注入NOD scid IL2受體γ鏈敲除(NSG)小鼠的腹膜腔中(參見例如艾奧恩斯(Iorns),E.等人(2012年10月31日電子出版)“用于研究人類乳癌轉移的新小鼠模型(A New Mouse Model For The Study Of Human Breast Cancer Metastasis)”,公共科學圖書館-(PLoS One)7(10):e47995;米沙林(Misharin),A.V.等人(2012)“開發新人源化小鼠模型來研究急性炎癥性關節炎(Development Of A New Humanized Mouse Model To Study Acute Inflammatory Arthritis)”轉化醫學雜志(J.Transl.Med.)10:190:沃爾德倫(Waldron)-林奇(Lynch)等人(2012年8月17日電子出版)“用人源化小鼠中的小鼠皮膚移植模型分析人類生物學(Analysis Of Human Biologies With A Mouse Skin Transplant Model In Humanized Mice)”,美國移植雜志(Amer.J.Transplant.)12(10):2652-2662;沃爾克(Volk),A.等人(2012)“用于T細胞過繼轉移的三個人源化小鼠模型的比較(Comparison Of Three Humanized Mouse Models For Adoptive T Cell Transfer)”,基因醫學雜志(J.Gene Med.)14(8):540-548;萊基(Racki),W.J.等人(2010)“人類皮膚移植和同種異體移植排斥的小鼠模型(NOD-scid IL2rgamma(null)Mouse Model Of Human Skin Transplantation And Allograft Rejection)”,移植(Transplantation)89(5):527-536)。將磷酸鹽緩沖鹽水(PBS)或抗人類B7-H5抗體(2D3)注入動物的尾靜脈并且確定CD45RO+細胞中CD28H+細胞的百分比。
如圖10A和圖10B中示出,當用抗人類B7-H5抗體進行治療時,在脾臟(圖10A)和外周血(圖10B)中,活化的(CD45RO+)人類T細胞中的CD28H+細胞的百分比降低。因此用B7-H5抗體進行治療降低了體內活化T細胞的百分比。相比之下,這種治療對原初(CD45RO-)T細胞群體(圖11A和圖11B)僅具有有限的作用。
實例3
重組抗人類B7-H5抗體保持了抗原特異性
IgG4抗體具有獨特的結構的和功能的特性并且在體內經歷“半抗體交換”,生成由兩個不同結合特異性組成的重組抗體(尼如拉(Nirula),A.等人(2011)“什么是Igg4?獨特的免疫球蛋白亞型的生物學的綜述(What Is Igg4?A Review Of The Biology Of A Unique Immunoglobulin Subtype)”,風濕病學新見(Curr.Opin.Rheumatol.)23(1):119-124;阿爾伯斯(Aalberse),R.C.等人(2009)“免疫球蛋白G4:古怪的抗體(Immunoglobulin G4:An Odd Antibody)”臨床和實驗過敏癥(Clin.Exp.Allergy)39(4):469-477)。將Ser228突變為Pro以穩定該臂。嵌合hIgG4P并不做“半抗體交換”。
將本發明的人類B7-H5結合抗體(抗體2D3和18C3)從其天然倉鼠同種型重組地轉化為人類IgG4P同種型。然后在重組抗體的存在下,孵育表達人類B7-H5的CHO轉染子。如圖12A-C中示出,發現人類IgG4P衍生抗體都保持了其朝向人類B7-H5的免疫特異性結合能力并且阻滯了破壞B7-H5-CD28H相互作用的能力(圖13,小圖A-C)。圖14A-14B示出抗體2D3和18C3識別B7-H5的第一IgV結構域,該結構域介導了B7-H5與CD28H的相互作用(圖14C)。圖15比較了抗體2D3和18C3結合至如表達在CHO細胞的表面上的人類B7-H5的親和力。
實例4
B7-H5:CD28H相互作用的阻滯抑制破傷風類毒素(TT)特異性T細胞應答
為了確定B7-H5:CD28H相互作用對記憶特異性T細胞的召回的影響,用破傷風類毒素(“TT”)疫苗來免疫用人類PBMC加上自體樹突細胞重構的NSG小鼠。在同一天,用對照Ig、或抗人類B7-H5抗體2D3治療小鼠。七天后,收獲腹膜腔中的細胞,并且用TT抗原重新刺激。通過BrdU摻入來分析T細胞分裂。用人類Thl/Th2CBA試劑盒來檢查培養上清液中的細胞因子。
在圖16A-16B中示出此類研究的結果。如這些圖中示出,對于TT特異性記憶T細胞的召回,內源B7-H5:CD28H相互作用顯現是重要的,因為用阻滯mAb 2D3的B7-H5注射小鼠顯著抑制了TT疫苗引發的T細胞增殖,如通過BrdU摻入所指示的(圖16A,小圖A-B)。其結果是,包括IFN-γ、IL-5和IL-10的培養上清液中的細胞因子都基本上被2D3mAb降低(圖16B,小圖A-B)。綜上,結果表明B7-H5:CD28H相互作用在記憶T細胞的召回中起到重要作用。
實例5
B7-H5:CD28H相互作用的阻滯抑制異體T細胞應答
為了確定B7-H5:CD28H相互作用對體內異體應答的作用,用異體人類巨噬細胞來激發人源化NSG小鼠。在同一天,用對照或2D3mAb接種每一小鼠。在第7天,收獲脾細胞并且通過細胞內染色,用Ki-67表達來評估異體CD4和CD8T細胞增殖。
在圖17中示出此類研究的結果。如在圖17中所示,對于異體T細胞應答,內源B7-H5:CD28H相互作用顯現是重要的,因為用阻滯mAb 2D3的B7-H5注射小鼠顯著抑制了CD8+(圖17A)和CD4+(圖17B)T細胞增殖,如通過Ki-67表達所指示的。
實例6
B7-H5:CD28H相互作用的阻滯抑制人類T細胞中的AKT活化
在圖18中示出此類研究的結果。如在圖18中所示,對于存在TCR信號的AKT通路活化,內源B7-H5:CD28H相互作用顯現是重要的。在刺激后30min,TCR和B7-H5融合蛋白的同時交聯誘導AKT磷酸化,同時TCR交聯單獨誘導最小的AKT磷酸化。阻滯抗體2D3的B7-H5的包含阻止AKT活化,指示B7-H5阻滯可以阻滯T細胞AKT通路活化。
實例7
B7-H5:CD28H相互作用的阻滯抑制針對腫瘤細胞的細胞毒性T淋巴細胞殺傷
在圖19中示出此類研究的結果。如在圖19中所示,腫瘤相關B7-H5與細胞毒性T細胞表達的CD28H的相互作用共刺激細胞毒性殺傷活性,因為在若干效應子與靶(E:T)的比率條件下,通過誘餌受體融合蛋白阻滯B7-H5-CD28H通路抑制了CTL殺傷。
實例8
B7-H5:CD28H相互作用的阻滯抑制自然殺傷細胞活化
在圖20A-B中示出此類研究的結果。如在圖20中示出,在可溶性重組人類IL-2的存在下,自然殺傷細胞(NK)上的CD16和B7-H5融合蛋白的同時交聯誘導NK活化和脫粒(CD107a表面上調),而單獨CD16接合并不誘導顯著的NK脫粒。通過B7-H5抗體2D3阻滯B7-H5-CD28H通路抑制了NK脫粒(圖20B),指示B7-H5共刺激NK活化。
本說明書提到的所有公開和專利均通過引用結合在此,引用程度就如同每個單獨公開或專利申請特定地并且單獨地指示通過引用以其全文結合在此一般。盡管已經聯系其具體實施例描述了本發明,但是將理解,它能夠進一步修改,并且本申請旨在覆蓋按照本發明的一般原理,本發明的任何變化、用途、或改編,并且包括本披露的此類偏離,只要其落入本發明從屬領域內的已知的或常規的實踐內,并且可以適用于在此以上列出的基本特征。
- 還沒有人留言評論。精彩留言會獲得點贊!