介導整合的HIV?1前病毒基因敲除的鋅指核酸內切酶及其制法和應用的制造方法與工藝
介導整合的HIV-1前病毒基因敲除的鋅指核酸內切酶及其制法和應用技術領域本發明屬于生物技術領域,具體地,本發明涉及介導整合的HIV-1前病毒基因敲除的鋅指核酸內切酶及其制法和應用。
背景技術:
獲得性免疫缺陷綜合征(AIDS)是由HIV感染引起的一種嚴重危害人們生命健康的傳染性疾病。據WHO統計,全球艾滋病患者己超過5000萬,每年新增患者500萬,而每年死于艾滋病的人數約為300萬。目前,艾滋病臨床治療方法主要是高效抗逆傳錄病毒療法(Highlyactiveantiretroviraltherapy,HAART),該療法不僅控制HIV復制,并且能重建AIDS患者的免疫功能,為AIDS的治療打開了希望之門。但該療法僅能抑制病毒復制,不能徹底清除病毒,其原因在于HIV感染細胞后,即可整合在宿主靶細胞染色體上形成前病毒(provirus),并能隨染色體的復制而遺傳,不僅為病毒轉錄提供穩定模板,也為其逃脫機體免疫系統及藥物攻擊提供了避風港。如何靶向清除整合在宿主靶細胞染色體上的HIV前病毒是目前HIV/AIDS治療研究領域最富有挑戰性、亟待解決的重大科學問題。目前本領域還沒有針對該問題的有效手段,因此,本領域迫切需要開發一種定向清除靶細胞染色體上的HIV前病毒的方法,從而從根本上解決HIV/AIDS的治療問題。
技術實現要素:
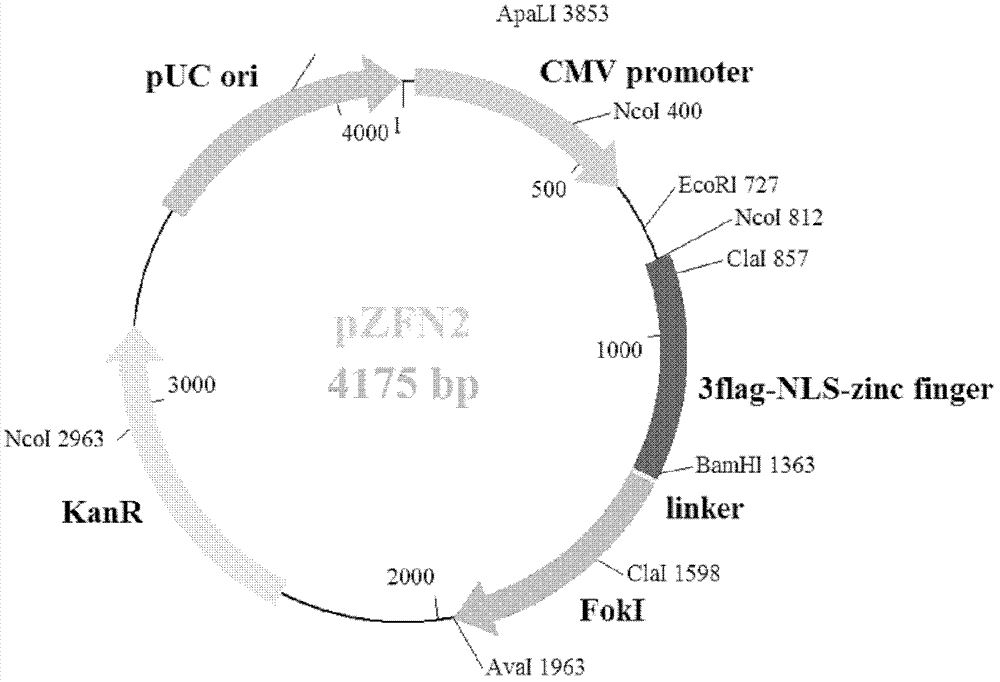
本發明的目的就是提供一種介導整合HIV-1前病毒基因敲除的鋅指核酸內切酶及其制法和應用。在本發明的第一方面,提供了一種鋅指核酸內切酶,所述的鋅指核酸內切酶特異性地識別并切割整合于宿主染色體的HIV前病毒。在另一優選例中,所述的宿主為人或非人哺乳動物細胞。在另一優選例中,所述的鋅指核酸內切酶為單體形式或二聚體形式,其中所述二聚體由二個鋅指核酸內切酶單體所構成;較佳地所述的二聚體是異二聚體。在另一優選例中,所述單體包括單體1和單體2,每個單體都具有識別元件和切割元件,并且所述單體1的識別元件識別HIV前病毒SEQIDNO.:2所示的序列,所述單體2的識別元件識別HIV前病毒SEQIDNO.:3所示的序列。在另一優選例中,單體1的識別元件具有如SEQIDNO.:10所示的氨基酸序列,和/或單體1的切割元件具有如SEQIDNO.:6所示的氨基酸序列;和/或單體2的識別元件具有如SEQIDNO.:11所示的氨基酸序列,和/或單體2的切割元件具有如SEQIDNO.:7所示的氨基酸序列。在另一優選例中,所述鋅指核酸內切酶的單體還包括連接識別元件和切割元件的肽接頭。在另一優選例中,所述肽接頭的長度為1-30個氨基酸殘基,較佳地2-15個氨基酸殘基,更佳地3-5個氨基酸殘基。在另一優選例中,所述的鋅指核酸內切酶單體1和單體2是相同的或不同的。在另一優選例中,在另一優選例中,所述的鋅指核酸內切酶是異二聚體,所述的異二聚體能特異識別并切割整合于宿主基因組上的HIV前病毒的5′-LTR和3′-LTR序列。在本發明的第二方面,提供了一種分離的多核苷酸,所述的多核苷酸編碼本發明第一方面所述的鋅指核酸內切酶。在本發明的第三方面,提供了一種載體,它含有本發明的第二方面所述的多核苷酸。在另一優選例中,所述的載體還含有編碼3Flag肽的核苷酸序列和/或編碼核定位信號的核苷酸序列。在另一優選例中,所述的載體為pUC表達質粒。在另一優選例中,所述的載體具有如SEQIDNO.:4或SEQIDNO.:5所示的序列。在本發明的第四方面,提供了一種宿主細胞,所述的宿主細胞含有本發明的第三方面所述的載體或基因組中整合有本發明的第二方面所述的多核苷酸。在另一優選例中,所述宿主細胞為真核細胞,較佳地,所述宿主細胞為:Jurkat細胞、CHO細胞、COS細胞、293T細胞、RSF細胞等,更佳地為HIV感染的Jurkat細胞(較佳地HIV-1感染的Jurkat細胞)、293T細胞、T淋巴細胞、單核細胞、巨嗜細胞、少突膠質細胞,造血干細胞,樹突狀細胞。在本發明的第五方面,提供了一種產生本發明第一方面所述鋅指核酸內切酶的方法,包括步驟:在適合表達的條件下,培養本發明的第四方面所述的宿主細胞,從而表達出第一方面所述的鋅指核酸內切酶;和分離所述鋅指核酸內切酶。在本發明的第六方面,提供了第一方面所述鋅指核酸內切酶的用途,用于制備:(a)治療艾滋病的藥物,或(b)切割整合于宿主染色體的HIV前病毒的組合物。在本發明的第七方面,提供了一種藥物組合物,所述組合物含有:(a)活性成分以及(b)藥學上可接受的載體,所述活性成分(a)選自:(i)本發明第一方面所述的鋅指核酸內切酶;或(ii)用于表達所述鋅指核酸內切酶(i)的核苷酸或載體。在本發明的第八方面,提供了一種分離的核酸分子,所述核酸分子為任選自下組的多核苷酸:(1)序列如SEQIDNO.:1所示的多核苷酸;(2)序列如SEQIDNO.:2所示的多核苷酸;(3)序列如SEQIDNO.:3所示的多核苷酸;(4)與(1)-(3)任一所述的多核苷酸互補的多核苷酸。在另一優選例中,所述的核酸分子來源于HIV病毒的5’LTR和/或3’LTR。在本發明的第九方面,提供了本發明的第八方面所述核酸分子的用途,用于提供鋅指核酸內切酶識別并切割的靶位點。在本發明的第十方面,提供了一種體外非治療性的、切割和清除整合于宿主細胞染色體內的HIV前病毒的方法,包括步驟:將含有本發明第一方面所述的鋅指核酸內切酶與宿主細胞接觸,或將用于表達所述鋅指核酸內切酶的核苷酸或載體導入宿主細胞,從而切割和清除整合于宿主細胞染色體內的HIV前病毒。在本發明的第十一方面,提供了一種切割和清除整合于宿主的染色體內的HIV前病毒的方法,包括步驟:給需要的對象施用本發明第七方面所述的藥物組合物。應理解,在本發明范圍內中,本發明的上述各技術特征和在下文(如實施例)中具體描述的各技術特征之間都可以互相組合,從而構成新的或優選的技術方案。限于篇幅,在此不再一一累述。附圖說明下列附圖用于說明本發明的具體實施方案,而不用于限定由權利要求書所界定的本發明范圍。圖1顯示了重組質粒pZFN1結構示意圖。圖2顯示了重組質粒pZFN2結構示意圖。圖3顯示了重組質粒pZFN1的全序列,735bp-803bp為編碼3flag肽段的核苷酸序列;804bp-869bp為編碼核定位信號的核苷酸序列;870bp-1364bp為編碼鋅指結構域的序列;1365bp-1376bp為接頭;1377bp-1976bp為編碼內切酶FokI的序列。圖4顯示了重組質粒pZFN2的全序列,813bp-881bp為編碼3flag肽段的核苷酸序列;882bp-947bp為編碼核定位信號的核苷酸序列;948bp-1355bp為編碼鋅指結構域的序列;1356bp-1367bp為接頭;1368bp-1961bp為編碼內切酶FokI的序列。圖5顯示一對ZFN(pZFN1和pZFN2)在HIV感染細胞介導前病毒基因切除的顯微鏡觀察結果。圖6顯示一對ZFN(pZFN1和pZFN2)在HIV感染細胞介導前病毒基因切除的PCR擴增結果。圖7顯示一對ZFN(pZFN1和pZFN2)在HIV感染細胞介導前病毒基因切除的PCR產物序列分析結果,顯示了有三種DNA切除后連接形式。圖8顯示pZFN1和pZFN2在HIV-1慢病毒FUGW感染的293T細胞內介導HIV-1重組PCR產物序列分析結果示意圖。圖9顯示pZFN1和pZFN2在HIV-1慢病毒FUGW感染的293T細胞內介導重組前后gag基因的拷貝數。具體實施方式本發明人經過廣泛而深入的研究,經過大量的HIV病毒的序列篩選,獲得了一種在HIV病毒中高度保守的、可供鋅指核酸內切酶特異性識別的靶序列,本發明還提供了特異性識別所述靶序列并專一性切割靶序列相應位點的鋅指核酸內切酶。試驗表明,本發明的鋅指核酸酶可高效專一地清除整合于宿主基因組內的HIV-1前病毒,可用于HIV的基因治療。在此基礎上完成了本發明。術語如本文所用,術語“鋅指核酸酶”、“鋅指核酸內切酶”、“zincfingernuclease”、“ZFN”、“鋅指蛋白核酸酶”,可以互換使用,都是指一種人工改造的核酸內切酶。所述核酸內切酶為單體形式或二聚體形式,其中所述二聚體由二個鋅指核酸內切酶單體所構成。較佳地,所述的鋅指核酸內切酶包括單體1和單體2,每個單體都具有識別元件和切割元件。其中,DNA識別元件賦予鋅指核酸酶的特異性,使鋅指核酸酶在DNA特定位點結合,而非特異性核酸內切酶元件(切割元件)具有剪切功能,使得鋅指核酸酶可在DNA特定位點進行定點斷裂。當鋅指結構識別并結合到其特異的靶標位點時,兩個融合核酸酶結構域相互靠近,當兩個互補的ZFN分子間相距適當的距離時(6~8bp),對雙鏈進行切割,形成雙鏈斷裂缺口(doublestrandbreak,DSB)。當細胞內源的非同源末端連接或者通過DNA同源重組對這一損傷進行修復時,目的基因的有效敲除就可以實現。鋅指核酸酶中DNA識別域(識別元件)是由一系列Cys2-His2鋅指蛋白串聯組成,每個鋅指蛋白識別并結合3′到5′方向DNA鏈上一個特異的三聯體堿基以及5′到3′方向的一個堿基。與鋅指蛋白組相連的非特異性核酸內切酶來自FokI羧基端96個氨基酸殘基組成的DNA剪切域,FokI是來自海床黃桿菌的一種限制性內切酶,只在二聚體狀態時才有酶切活性,每個FokI單體與一個鋅指蛋白組相連構成一個ZFN,識別特定的位點。本發明提供了一種特異性介導HIV-1病毒基因敲除的鋅指核酸內切酶ZFN單體和二聚體,所述的鋅指核酸內切酶單體能夠專一性識別HIV-15’LTR和3’LTR中的保守序列:CCAGATCTGAGCCTGGGAgctctCTGGCTAACTAGGGA(SEQIDNO.:1)。由于該序列在300多種HIV-1的亞型中的保守程度高達90%以上,因此本發明的鋅指核酸內切酶對各種HIV-1均有良好的識別效果。具體地,該保守序列與上述5’LTR和3’LTR位置關系如表1:表1本領域的普通技術人員可以使用通用的方法設計針對特定位點的鋅指核酸內切酶。在獲知了待切割的靶位點后,就能夠獲得一個或多個識別結構的氨基酸序列,如可以參考表2進行鋅指蛋白的設計,例如,如果目的核苷酸位點為TTT,則與其識別的鋅指蛋白須具有SPNGLII的氨基酸序列,如目的核苷酸位點為AGC,則與其識別的鋅指蛋白須具有ERSHLRE的氨基酸序列。由于核苷酸和氨基酸具有對應關系及密碼子的簡并性,由獲得的氨基酸序列可以得到一個或多個核苷酸序列。表2注:上標為1的數據來源于參考文獻1;上標為1的數據來源于參考文獻2。在本發明的一個優選例中,鋅指核酸內切酶單體ZFN1識別元件的氨基酸序列為:FQCRICMRNFSRSDHLSTHIRTHTGEKPFACDICGRKFADSSARKKHTKIHTGSQKPFQCRICMRNFSRSDALSEHIRTHTGEKPFACDICGKKFATSSSRKKHTKIHTGSQKPFQCRICMRNFSRSDNLSQHIRTHTGEKPFACDICGRKFAASNDRKKHTKIH(SEQIDNO.:10)ZFN2識別元件的氨基酸序列為:FQCRICMRKFAQSGHLSRHTKIHTGEKPFQCRICMRNFSRSDNLSTHIRTHTGEKPFACDICGRKFADRSNRKTHTKIHTGSQKPFQCRICMRNFSQSSDLSRHIRTHTGEKPFACDICGRKFARRDALLMHTKIH(SEQIDNO.:11)鋅指核酸酶還包括切割結構域(切割元件)FokI,FokI是來自海床黃桿菌的一種限制性內切酶,只在二聚體狀態時才有酶切活性。ZFN1中典型的切割元件FokI的氨基酸序列為:qlvkseleekkselrhklkyvpheyielieiarnstqdrilemkvmeffmkvygyrgkhl60ggsrkpdgaiytvgspidygvivdtkaysggynlpigqademeryveenqtrdkhlnpne120wwkvypssvtefkflfvsghfkgnykaqltrlnhitncngavlsveelliggemikagtl180tleevrrkfnngeinfrs198SEQIDNO.:6ZFN2中典型的切割元件FokI的氨基酸序列為:qlvkseleekkselrhklkyvpheyielieiarnstqdrilemkvmeffmkvygyrgkhl60ggsrkpdgaiytvgspidygvivdtkaysggynlpigqademqryvkenqtrnkhinpne120wwkvypssvtefkflfvsghfkgnykaqltrlnrktncngavlsveelliggemikagtl180tleevrrkfnngeinf196SEQIDNO.:7切割結構域和識別結構域之間還可以具有連接序列(肽接頭),在本發明的一個優選例中,所述肽接頭的長度為1-30個氨基酸殘基,較佳地2-15個氨基酸殘基,更佳地3-5個氨基酸殘基。一個典型的肽接頭的編碼序列為:CTGCGGGGATCC。根據本文所述的核苷酸序列,本技術領域人員可方便地用各種已知方法制得本發明的核酸序列。這些方法例如但不限于:PCR,DNA人工合成等,具體的方法可參見J.薩姆布魯克,《分子克隆實驗指南》。作為本發明的一種實施方式,可通過分段合成核苷酸序列再進行重疊延伸PCR的方法來構建本發明的編碼核酸序列。本發明還提供了一種表達載體,包含編碼本發明的鋅指核酸酶的序列以及與之操作性相連的表達調控序列。所述的“操作性相連”或“可操作地連于”指這樣一種狀況,即線性DNA序列的某些部分能夠調節或控制同一線性DNA序列其它部分的活性。例如,如果啟動子控制序列的轉錄,那么它就是可操作地連于編碼序列。優選地,所述的表達調控序列可以是3flag肽,或用于定位的和定位信號(NLS)。表達載體可采用市售的例如但不限于:pUC18、pIRES、pDR等可用于真核細胞系統表達的載體。本領域技術人員可以根據宿主細胞來選擇合適的表達載體。根據已知空載表達載體的酶切圖譜,本領域技術人員可按照常規方法通過限制性酶剪切與拼接,將本發明的鋅指核酸酶編碼序列插入合適的限制性位點,制得本發明的重組表達載體。本發明還提供了表達本發明融合蛋白的宿主細胞,其中含有本發明的鋅指核酸酶的編碼序列。所述的宿主細胞可原核細胞和真核細胞,優選的是真核細胞,例如但不限于Jurkat細胞,CHO,COS細胞,293T細胞,RSF細胞等。作為本發明的優選方式,所述的細胞是HIV(較佳地HIV-1)感染的Jurkat細胞或293T細胞,其可良好地表達本發明的鋅指核酸酶,可獲得結合活性良好,穩定性良好的鋅指核酸酶。本發明還提供一種用重組DNA制備本發明鋅指核酸酶的方法,包括步驟:1)提供編碼本發明鋅指核酸酶的核苷酸序列;2)將1)的核苷酸序列插入到合適的表達載體,獲得重組表達載體;3)將2)的重組表達載體導入合適的宿主細胞;4)在適合表達的條件下培養轉化宿主細胞;5)收集上清液,并純化鋅指核酸酶產物。將所述編碼序列導入宿主細胞可采用本領域的多種已知技術,例如但不限于:磷酸鈣沉淀,原生質體融合,脂質體轉染,電穿孔,微注射,反轉錄法,噬菌體轉導法,堿金屬離子法,腺病毒載體,腺相關病毒載體,慢病毒載體。有關宿主細胞的培養和表達采用常規方法。當采用分泌表達時,可通過離心去除懸浮液中的細胞和殘渣,收集清液。還可通過瓊脂糖凝膠電泳等技術進行鑒定。可將上述制備獲得的鋅指核酸酶純化為基本均一的性質,例如在SDS-PAGE電泳上呈單一條帶。例如,當鋅指核酸酶為分泌表達時,可以采用商品化的超濾膜來分離所述蛋白,例如采用Millipore、Pellicon等公司產品對表達上清進行濃縮。濃縮液可采用凝膠層析的方法進一步純化,或采用離子交換層析的方法純化。例如陰離子交換層析(DEAE等)或陽離子交換層析。凝膠基質可為瓊脂糖、葡聚糖、聚酰胺等常用于蛋白純化的基質。Q-或SP-基團是較為理想的離子交換基團。最后,還可用羥基磷灰石吸附層析,金屬螯合層析,疏水相互作用層析和反相高效液相色譜(RP-HPLC)等方法對上述純化產物進一步精制純化。上述所有純化步驟可利用不同的組合,最終使蛋白純度達到基本均可利用含有所述鋅指核酸酶的特異性抗體、受體或配體的親和層析柱對表達的鋅指核酸酶進行純化。根據所使用的親和柱的特性,可利用常規的方法,如高鹽緩沖液、改變pH等方法洗脫結合在親和柱上的融合性多肽。可選擇地,所述的鋅指核酸酶的氨基端或羧基端還可含有一個或多個多肽片段,作為蛋白標簽。任何合適的標簽都可以用于本發明。例如,所述的標簽可以是FLAG,HA,HA1,c-Myc,6-His或8-His等。這些標簽可用于對鋅指核酸酶進行純化。藥物組合物及施用方法本發明還提供了一種組合物,它含有有效量(如0.000001-90wt%;較佳的0.1-50wt%;更佳的,5-40wt%)的本發明的鋅指核酸內切酶單體或二聚體,以及藥學上可接受的載體。通常,可將本發明的鋅指核酸內切酶單體或二聚體配制于無毒的、惰性的和藥學上可接受的水性載體介質中,其中pH通常約為5-8,較佳地,pH約為6-8。如本文所用,術語“有效量”或“有效劑量”是指可對人和/或動物產生功能或活性的且可被人和/或動物所接受的量。如本文所用,“藥學上可接受的”的成分是適用于人和/或哺乳動物而無過度不良副反應(如毒性、刺激和變態反應)的,即具有合理的效益/風險比的物質。術語“藥學上可接受的載體”指用于治療劑給藥的載體,包括各種賦形劑和稀釋劑。本發明的藥物組合物含有安全有效量的鋅指核酸內切酶單體或二聚體以及藥學上可接受的載體。這類載體包括(但并不限于):鹽水、緩沖液、葡萄糖、水、甘油、乙醇、及其組合。通常藥物制劑應與給藥方式相匹配,本發明的藥物組合物可以被制成針劑形式,例如用生理鹽水或含有葡萄糖和其他輔劑的水溶液通過常規方法進行制備。所述的藥物組合物宜在無菌條件下制造。活性成分的給藥量是治療有效量。本發明的藥物制劑還可制成緩釋制劑。本發明所述的鋅指核酸內切酶單體或二聚體的有效量可隨給藥的模式和待治療的疾病的嚴重程度等而變化。優選的有效量的選擇可以由本領域普通技術人員根據各種因素來確定(例如通過臨床試驗)。所述的因素包括但不限于:鋅指核酸內切酶單體或二聚體的藥代動力學參數例如生物利用率、代謝、半衰期等;患者所要治療的疾病的嚴重程度、患者的體重、患者的免疫狀況、給藥的途徑等。通常,當本發明的融合蛋白每天以約0.00001mg-50mg/kg動物體重(較佳的0.0001mg-10mg/kg動物體重)的劑量給予,能得到令人滿意的效果。例如,由治療狀況的迫切要求,可每天給予若干次分開的劑量,或將劑量按比例地減少。本發明的主要優點在于:(1)本發明的鋅指核酸酶對所有HIV亞型調控區LTR上的靶位點具有很高的特異性和專一性;(2)本發明的鋅指核酸酶可以高效地切除整合于宿主基因組內的各亞型HIV-1前病毒,能更廣泛應用于HIV/AIDS臨床治療。下面結合具體實施例,進一步闡述本發明。應理解,這些實施例僅用于說明本發明而不用于限制本發明的范圍。下列實施例中未注明具體條件的實驗方法,通常按照常規條件如Sambrook等人,分子克隆:實驗室手冊(NewYork:ColdSpringHarborLaboratoryPress,1989)中所述的條件,或按照制造廠商所建議的條件。實施例1確定鋅指核酸內切酶在HIV前病毒中的識別位點由于HIV-1的易變性和復雜性,導致其很容易逃避免疫系統、藥物和疫苗的攻擊,所以鋅指核酸內切酶識別位點的確定是關鍵步驟。在本實施例中,發明人仔細比對了344種HIV-1亞型,最終確定了以下序列作為識別位點序列:CCAGATCTGAGCCTGGGAgctctCTGGCTAACTAGGGA(SEQIDNO.:1)該序列在HIV-15’LTR和3’LTR中非常保守,在344種HIV-1亞型中,該序列在HIV-15’LTR和3’LTR保守序列的保守程度高達93%以上。實施例2構建一對ZFN-LTR質粒(pZFN1質粒和pZFN2質粒)在本實施例中,發明人制備了一對攜帶編碼鋅指核酸內切酶(ZFN1或者ZFN2)核苷酸序列的pUC質粒,即識別CCAGATCTGAGCCTGGGA(SEQIDNO.:2)位點的pZFN1和識別CTGGCTAACTAGGGA(SEQIDNO.:3)位點的pZFN2。pZFN1和pZFN2質粒的制法如下:合成3flag-NLS-zincfinger-FokI段寡核苷酸序列,并于5’和3’端分別引入NcoI和AvaI酶切位點,寡核苷酸片段及pZFN骨架質粒分別經NcoI和AvaI雙酶切后連接,轉化受體菌,卡那霉素抗性(KanR)平板篩選單克隆,抽提質粒,酶切鑒定,進一步序列分析確認。圖1、圖2為分別一對ZFN-LTR質粒pZFN1和pZFN2的結構示意圖。圖3為重組質粒pZFN1的全序列,其中,735bp-803bp為編碼3flag肽段的核苷酸序列;804bp-869bp為編碼核定位信號的核苷酸序列;870bp-1364bp為編碼鋅指結構域的序列;1365bp-1376bp為編碼連接肽(linker)的序列;1377bp-1976bp為編碼內切酶ForkI的序列。圖4為重組質粒pZFN2的全序列,其中,813bp-881bp為編碼3flag肽段的核苷酸序列;882bp-947bp為編碼核定位信號的核苷酸序列;948bp-1355bp為編碼鋅指結構域的序列;1356bp-1367bp為編碼連接肽(linker)的序列;1368bp-1961bp為編碼內切酶ForkI的序列。實施例3ZFN-LTR在HIV-1感染細胞內介導整合的HIV前病毒重組切除HIV-1感染Jurkat細胞的構建制備:用攜帶EGFP報告基因的HIV-1假病毒pNL4-3-EGFP(pNL4-3-EGFP購自美國國立衛生院AIDS試劑分發中心)感染市售的常規的人T淋巴細胞Jurkat株,通過細胞分選獲得表達GFP陽性和陰性細胞群。其中GFP陽性細胞群作為HIV感染的細胞模型用于后續實驗。攜帶EGFP報告基因的HIV感染細胞模型培養鋪板,Nucleofector核轉染或脂質體轉染不同劑量的ZFN-LTR表達質粒,以轉染ZFN空質粒或未轉染的細胞作為陰性或空白對照,轉染后2,3,4,5,6天分別收集細胞,流式細胞儀檢測在ZFN導入HIV感染細胞模型后GFP陽性細胞比例,GFP陰性細胞作為ZFN切除HIV前病毒的細胞,計算細胞水平前病毒基因缺失的效率。同時,提取細胞基因組DNA。為了鑒定切除后重組,在LTR上ZFN靶位點的上下游或HIV整合位點基因組上下游分別設計引物,引物序列如下:F-LTR:5’-GATCCTTGATCTGTGGATCTACCA-3’SEQIDNO.:8;和R-LTR:5’-ACACTGACTAAAAGGGTCTGAGGG-3’SEQIDNO.:9。結果表明,在ZFN-LTR處理組中,通過共聚焦顯微鏡觀察,許多感染細胞(簡稱為“IN感染細胞”)熒光消失(圖5)。未做任何處理組(Mock)和轉入ZFNemptyvector的IN感染細胞都沒有擴增出任何條帶,而轉入ZFN-LTR的IN細胞擴增出585bp左右的條帶,說明ZFN-LTR在IN細胞內介導了重組(圖6)。為了確定這種熒光的消失確實是由于ZFN-LTR將HIV剪切后產生的,發明人將PCR產物進行測序,發現IN感染細胞內HIV基因確實發生了重組,而且有3種不同的重組方式(圖7)。結果說明,ZFN-LTR質粒轉入細胞內,可以借助細胞的轉錄翻譯系統表達出有活性的ZFN1和ZFN2蛋白,ZFN1和ZFN2蛋白單體識別結合位點形成二聚體(ZFN-LTR)后,與ZFN蛋白相連的FokI發揮內切酶活性,從而將整合在基因組內的HIV-1前病毒DNA剪切掉。實施例4ZFN-LTR在基于HIV-1慢病毒感染的293T細胞中介導內介導整合的HIV前病毒切除為了確認實施例2制備的ZFN-LTR不止在一種HIV-1感染陽性細胞中發揮作用,本實施例采用基于HIV-1慢病毒感染的293T細胞作為HIV-1陽性細胞。該感染的293T細胞的來源或制備方法:用攜帶EGFP報告基因的HIV-1假病毒(pNL4-3-EGFP)(pNL4-3-EGFP購于美國國立衛生院AIDS試劑分發中心)感染人293T細胞株,通過細胞分選獲得表達GFP陽性和陰性細胞群,其中GFP陽性細胞群作為HIV感染的細胞模型。將ZFN-LTR電轉入HIV-1慢病毒感染的293T細胞內,3天后,抽提293T細胞的基因組DNA,根據設計的引物進行PCR擴增,將擴增產物連到T載體上,進行DNA測序分析。引物序列同實施例3。結果發現HIV-1慢病毒感染293T細胞內HIV-1基因發生了重組(圖8)。通過realtimePCR檢測在ZFN-LTR轉染后細胞內gag基因拷貝數的變化來確定ZFN-LTR的重組效率,從圖9中可以看到,ZFN-LTR的重組效率可以達到43.75%。實施例5藥物組合物的制備利用本領域技術人員熟知的常規技術,混合以下組分,制得終濃度為1wt%鋅指核酸內切酶二聚體溶液,其配方如下:鋅指核酸內切酶二聚體10mg生理鹽水加至10ml調節pH至6.8-7.1。在本發明提及的所有文獻都在本申請中引用作為參考,就如同每一篇文獻被單獨引用作為參考那樣。此外應理解,在閱讀了本發明的上述講授內容之后,本領域技術人員可以對本發明作各種改動或修改,這些等價形式同樣落于本申請所附權利要求書所限定的范圍。參考文獻:1.MaederML,Thbodeau-BegannyS,OsiakA,WrightDA,AnthonyRM,EichtingerM,JaingT,FoleyJE,WinfreyRJ,TownsendJA,Unger-WallanceE,SanderJD,Muller-LerchF,FuFL,PearlbergJ,GobelC,DassieJP,Pruett-MillerSM,PorteusMH,SgroiDC,IafrateAJ,DobbsD,McCrayPB,CathomenT,VoytasDF,JoungJKRapid“open-source”engineeringofcustomizedzinc-fingernucleasesforhighlyefficientgenemodificationMolCell,2008,31(2):294-3012.WrightDA,Thibodeau-BegannyS,SanderJD,WinfreyRJ,HirshAS,EichtingerM,FuFL,PorteusMH,DobbsD,VoytasDF,JoungJK.StandardizedreagentsandprotocolsforengineeringzincfingernucleasesbymodularassemblyNatProtoc,2006,1(3):1637-1652
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1
- 基于CRISPR/Cas9技術的單子葉植物基因敲除載體及其應用的制作方法與工藝
- 一種T1R2基因過表達慢病毒載體、慢病毒及其構建方法與流程
- 一種Gα基因過表達慢病毒載體、慢病毒及其構建方法與流程
- 弱毒力CMV載體表達抗性基因增強植物抗重金屬性能的應用的制作方法與工藝
- 豬ApoE基因敲除載體及其構建方法與應用與流程
- 基于CRISPR/Cas9技術的單子葉植物基因敲除載體及其應用的制作方法與工藝
- 敲除衣藻內源基因和表達外源基因的載體構建方法及應用與流程
- 一種能夠快速構建植物基因定點敲除載體的新反應體系的制造方法與工藝
- 介導整合的HIV?1前病毒基因敲除的鋅指核酸內切酶及其制法和應用的制造方法與工藝
- 病毒載體、細胞及構建體的制造方法與工藝