一種高純度鉬酸的制備方法與流程
本發明涉及鉬酸制備技術領域,具體涉及一種高純度鉬酸的制備方法。
背景技術:
高純度鉬酸是近年來興起的一種新產品,由于它是三氧化鉬的酸酐,它的組成成分和高純三氧化鉬幾乎相同,其組分可以理解為一個三氧化鉬分子加上一份子的水組成。所以在物理化學性質上和高純三氧化鉬有異曲同工之效。通過對鉬酸的物理學性質進行研究得知,鉬酸屬于弱酸,其失去酸酐結晶水所需要的能量較小,很容易就實現形成三氧化鉬,研究發現,在150攝氏度條件下,鉬酸中的結晶水可以失去95%以上。
從鉬酸的加工過程來看,普通鉬酸的加工比較簡單,采用對鉬酸鹽溶液進行酸化的方法進行,但是這樣生產出的鉬酸雜質較高,不能適應行業對高純度鉬酸的要求。
高純鉬酸作為一種產品相當于省去了生產鉬酸鹽和焙燒高純三氧化鉬的過程,從成本上來看鉬酸直接替代氧化鉬具有成本上的優勢,從物化性質上來說兩種產品極其相近。
技術實現要素:
本發明的目的是提供一種高純度鉬酸的制備方法,解決了現有方法制備得到的鉬酸雜質高的問題。
本發明所采用的技術方案是,一種高純度鉬酸的制備方法,向鉬酸鹽溶液中加入片狀氫氧化鈉進行預處理后蒸發,當出現結晶體后用純水溶解,再加入硝酸酸化后固液分離、烘干,得到高純度鉬酸。
本發明的特點還在于,
具體按照以下步驟實施:
步驟1,將鉬酸鹽溶液加入至蒸發釜中保持溫度為20-30℃,加入片狀氫氧化鈉,直至鉬酸鹽溶液的pH值達到14,進行過濾;
步驟2,對步驟1過濾后得到的上清液進行常壓蒸發,當出現結晶體后加純水溶解至溶液變成澄清狀態;
步驟3,向步驟2得到的澄清溶液中加入硝酸,加入過程中控制溶液的溫度在70-80℃,溶液的pH值達到1且溶液呈微黃時,攪拌4-6min;
步驟4,對步驟3得到的經過固液分離、烘干、篩分,得到高純度鉬酸。
步驟1中鉬酸鹽溶液為鉬酸鈉母液或鉬酸銨溶液。
步驟1中片狀氫氧化鈉采用少量多次的方式加入,鉬酸鹽和片狀氫氧化鈉的質量比4-6:1。
步驟3中硝酸的濃度為96-98%。
步驟4中烘干是將固液分離后的物料在溫度為100-120℃下干燥4-5h,然后進行破碎后再在100-120℃下干燥1.5-2.5h,最后用40目篩網進行過篩。
本發明的有益效果是,本發明高純度鉬酸的制備方法,利用片狀氫氧化鈉對鉬酸鹽溶液進行預處理,不僅使溶液中的銨根離子和氨氣全部被置換出來,還可以對一些金屬雜質離子進行除雜如鈣離子;然后對溶液進行酸化處理,溶液中的鉬酸根經過酸化成為沉淀,其他雜質離子在強酸環境下溶解在溶液中,使產品得到了凈化。
本發明工藝簡便易行,成本小,不需要增加專用設備,利用本工藝生產的產品純度可達到國內同類產品的最高水平。
附圖說明
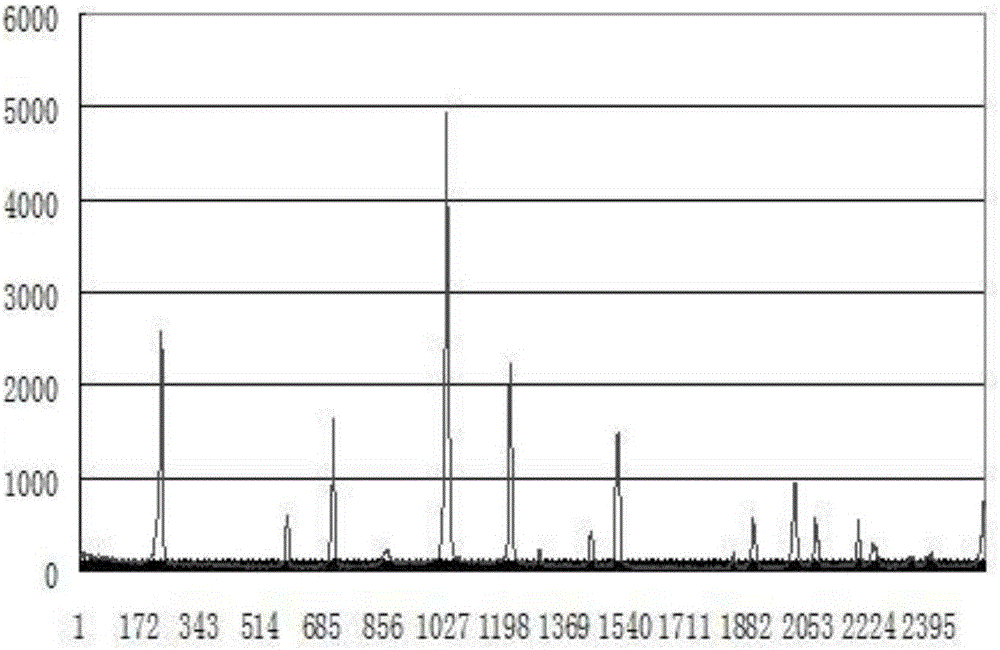
圖1是本發明制備方法得到的鉬酸的衍射圖譜;
圖2是國內某廠商生產的鉬酸的衍射圖譜;
圖3是是本發明制備方法得到的鉬酸的電鏡掃描圖;
圖4國內某廠商生產的鉬酸的電鏡掃描圖。
具體實施方式
下面結合附圖和具體實施方式對本發明進行詳細說明。
本發明高純度鉬酸的制備方法,向鉬酸鹽溶液中加入片狀氫氧化鈉進行預處理后蒸發,當出現結晶體后用純水溶解,再加入硝酸酸化后固液分離、烘干,得到高純度鉬酸。
具體按照以下步驟實施:
步驟1,將鉬酸鹽溶液(鉬酸鹽溶液為鉬酸鈉母液或鉬酸銨溶液)加入至蒸發釜中保持溫度為20-30℃,少量多次加入片狀氫氧化鈉(鉬酸鹽和片狀氫氧化鈉的質量比4-6:1),直至鉬酸鹽溶液的pH值達到14,進行過濾;
步驟2,對步驟1過濾后得到的上清液進行常壓蒸發,當出現結晶體后加純水溶解至溶液變成澄清狀態;
步驟3,向步驟2得到的澄清溶液中加入濃度為96-98%的硝酸,加入過程中控制溶液的溫度在70-80℃,溶液的pH值達到1且溶液呈微黃時,攪拌4-6min;
步驟4,對步驟3得到的經過固液分離、將固液分離后的物料在溫度為100-120℃下干燥4-5h,然后進行破碎后再在100-120℃下干燥1.5-2.5h,最后用40目篩網進行過篩,得到高純度鉬酸。
本發明方法首先利用片狀氫氧化鈉對鉬酸鹽溶液進行預處理,可以達到兩個目的,(一)使溶液中的銨根離子和氨氣全部被置換出來,(二)對一些金屬雜質離子進行除雜如鈣離子。然后對溶液進行酸化處理,溶液中的鉬酸根經過酸化成為沉淀,其他雜質離子在強酸環境下溶解在溶液中,使產品得到了凈化。
分別對本發明制備方法得到的鉬酸和國內某廠商生產的鉬酸進行測試,圖1和圖2分別為本發明制備方法得到的鉬酸和國內某廠商生產的鉬酸的衍射圖譜,從圖1和圖2可以看出,兩種晶體在相同的衍射角度出現峰值的位置基本相同,說明兩種產品的切合度比較高,從產品宏觀角度來看,屬于同一種物質,根據晶體尺寸的計算公式D=K*λ/Cosθ*β,在結晶角度相同的情況下,結晶強度與晶體尺寸成反比,圖1的晶體尺寸較大一些。
圖3和圖4分別為本發明制備方法得到的鉬酸和國內某廠商生產的鉬酸的電鏡掃描圖,從圖3和圖4的微觀電鏡圖可以看到,圖3的產品粒度比較均勻,產品晶體尺寸大,晶型穩定,說明經過結晶生產體系的能量釋放和吸收平衡,適合晶體生產環境;圖4的產品晶體尺寸小,晶型紊亂,晶體發生了團聚,說明結晶生產體系能量失衡,導致晶體進行團聚保持能量均衡,晶體生產環境不理想。
分別為國內某廠商生產的鉬酸和本發明制備方法得到的鉬酸的各元素進行測定,結果如表1所示。
表1鉬酸的各元素測定結果
表1中MS-1為國內某廠商生產的鉬酸,MS-2為本發明制備方法得到的鉬酸,表1中本發明制備方法制得產品各個主要的化學指標均比國內廠商的指標高出一個數量級,說明產品的生產環境和方式得到根本性的改變,才使產品的品質變化很大。
實施例1
步驟1,將鉬酸鈉母液加入至蒸發釜中保持溫度為20℃,少量多次加入片狀氫氧化鈉(鉬酸鹽和片狀氫氧化鈉的質量比6:1),直至鉬酸鹽溶液的pH值達到14,進行過濾;
步驟2,對步驟1過濾后得到的上清液進行常壓蒸發,當出現結晶體后加純水溶解至溶液變成澄清狀態;
步驟3,向步驟2得到的澄清溶液中加入濃度為96%的硝酸,加入過程中控制溶液的溫度在70℃,溶液的pH值達到1且溶液呈微黃時,攪拌5min;
步驟4,對步驟3得到的經過固液分離、將固液分離后的物料在溫度為100℃下干燥4h,然后進行破碎后再在100℃下干燥2.5h,最后用40目篩網進行過篩,得到高純度鉬酸。
實施例2
步驟1,將鉬酸銨溶液加入至蒸發釜中保持溫度為25℃,少量多次加入片狀氫氧化鈉(鉬酸銨和片狀氫氧化鈉的質量比5:1),直至鉬酸鹽溶液的pH值達到14,進行過濾;
步驟2,對步驟1過濾后得到的上清液進行常壓蒸發,當出現結晶體后加純水溶解至溶液變成澄清狀態;
步驟3,向步驟2得到的澄清溶液中加入濃度為98%的硝酸,加入過程中控制溶液的溫度在75℃,溶液的pH值達到1且溶液呈微黃時,攪拌4min;
步驟4,對步驟3得到的經過固液分離、將固液分離后的物料在溫度為120℃下干燥4.5h,然后進行破碎后再在120℃下干燥2h,最后用40目篩網進行過篩,得到高純度鉬酸。
實施例3
步驟1,將鉬酸鈉母液加入至蒸發釜中保持溫度為30℃,少量多次加入片狀氫氧化鈉(鉬酸鹽和片狀氫氧化鈉的質量比4:1),直至鉬酸鹽溶液的pH值達到14,進行過濾;
步驟2,對步驟1過濾后得到的上清液進行常壓蒸發,當出現結晶體后加純水溶解至溶液變成澄清狀態;
步驟3,向步驟2得到的澄清溶液中加入濃度為97%的硝酸,加入過程中控制溶液的溫度在80℃,溶液的pH值達到1且溶液呈微黃時,攪拌6min;
步驟4,對步驟3得到的經過固液分離、將固液分離后的物料在溫度為110℃下干燥5h,然后進行破碎后再在110℃下干燥1.5h,最后用40目篩網進行過篩,得到高純度鉬酸。
實施例4
步驟1,將鉬酸銨溶液加入至蒸發釜中保持溫度為28℃,少量多次加入片狀氫氧化鈉(鉬酸銨和片狀氫氧化鈉的質量比4.5:1),直至鉬酸鹽溶液的pH值達到14,進行過濾;
步驟2,對步驟1過濾后得到的上清液進行常壓蒸發,當出現結晶體后加純水溶解至溶液變成澄清狀態;
步驟3,向步驟2得到的澄清溶液中加入濃度為98%的硝酸,加入過程中控制溶液的溫度在75℃,溶液的pH值達到1且溶液呈微黃時,攪拌6min;
步驟4,對步驟3得到的經過固液分離、將固液分離后的物料在溫度為115℃下干燥4.5h,然后進行破碎后再在115℃下干燥1.8h,最后用40目篩網進行過篩,得到高純度鉬酸。
- 還沒有人留言評論。精彩留言會獲得點贊!