一種三維氧缺陷銅錳氧納米微球及制備和應用的制作方法
本發明涉及一種鋰電負極材料的制備方法,特別是涉及一種三維氧缺陷CuMn2O4-x(0<x≤2)納米微球及制備和應用。
背景技術:
鋰離子電池是目前世界上最為理想的可充電電池,它不僅具有能量密度大、循環壽命長、無記憶效應及污染小等優點。隨著技術的進步,鋰離子電池將廣泛應用于電動汽車、航空航天及生物醫藥等領域,因此,研究與開發動力用鋰離子電池及相關材料具有重大的意義。對于動力用鋰離子電池而言,其關鍵是提高功率密度和能量密度,而功率密度和能量密度提高的根本是電極材料,特別是負極材料的改善。
碳材料是最早為人們所研究并應用于鋰離子電池商品化的材料,至今仍是大家關注和研究的重點之一,但是碳負極材料存在一些缺陷:電池化成時,與電解液反應形成SEI膜,導致電解液的消耗和較低的首次庫倫效率;電池過充時,可能會在碳電極表面析出金屬鋰,形成鋰枝晶造成短路,導致溫度升高,電池爆炸;另外,鋰離子在碳材料中的擴散系數較小,導致電池不能實現大電流充放電,從而限制了鋰離子電池的應用范圍。
CuMn2O4是一種尖晶石結構的復合氧化物,是一種廣泛應用的磁性材料,目前也可以作為鋰離子電池負極材料,通過轉化和合金化反應具有較高的Li+儲存容量。該材料被認為是一種具有前途的鋰離子負極材料。
技術實現要素:
為克服現有技術的不足,本發明提供一種三維氧缺陷銅錳氧納米微球及制備和應用。
一種三維氧缺陷銅錳氧納米微球的制備方法,其特征在于,該方法的具體步驟為:
(1)將銅箔置于20 mL濃度為1~2 mol/L的堿溶液中,靜止0.5~1 h,然后轉入反應釜160~180℃反應6~8h,將產物用乙醇和去離子水洗滌數次,80~100℃烘箱烘干,得A;
(2)將上述A浸漬于濃度為1~2 mol/L的酸溶液中,靜止10~30 min,將銅箔從酸溶液中取出,乙醇和去離子水洗滌數次,80~100℃烘箱烘干,得B;
(3)將B在馬弗爐中以2~5℃/min的升溫速率500~600℃煅燒3~5 h,得到摻雜Cu+的CuO;
(4)將摻雜Cu+的CuO浸漬在1-2 mol/L的錳鹽溶液中,轉入反應釜,80-100℃反應6~8 h,得C;
(5)將C用乙醇和去離子水洗滌烘干后,置于馬弗爐中,500~600℃煅燒2-5 h,得純CuMn2O4;
(6)將純CuMn2O4置于氫氣氣氛中,以1~2℃/min的升溫和降溫速率在350~450℃煅燒1~2 h,得CuMn2O4-x(0<x≤2)。
所述的堿溶液為氫氧化鈉溶液或是氫氧化鉀溶液中的一種或其組合。
所述的酸溶液為鹽酸、硝酸、硫酸中的一種或其組合。
所述的錳鹽為硝酸錳、醋酸錳或草酸錳中的一種或其組合。
一種三維氧缺陷銅錳氧納米微球,其特征在于,根據上述任一所述方法制備得到。
一種三維氧缺陷銅錳氧納米微球作為鋰電負極材料的應用。
本發明提供了一種三維氧缺陷CuMn2O4-x(0<x≤2)納米微球的制備方法,本發明利用電化學腐蝕、以水熱輔助高溫固相法制備三維氧缺陷CuMn2O4-x(0<x≤2)納米微球。三維的納米微球結構具有較大的比表面積,能夠與電解液充分接觸;同時,缺氧型缺陷對提高材料的導電性起著很重要的作用,進而可以提高材料的電化學性能。首次放電比容量為1221 mAh/g,經過50次循環放電比容量為392 mAh/g。
附圖說明
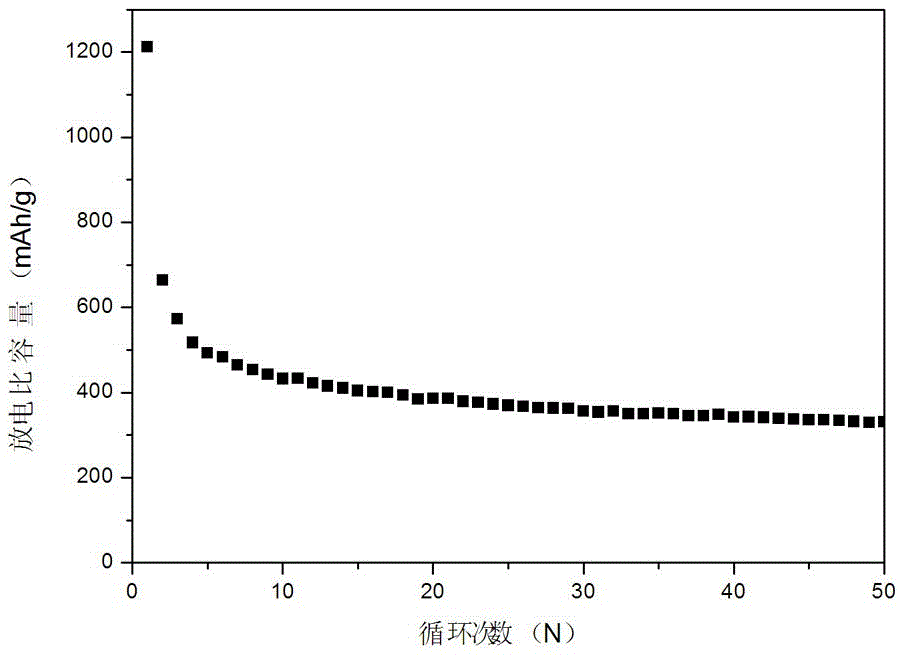
圖1為實施例1三維氧缺陷CuMn2O3.6納米微球的循環壽命圖。
圖2為實施例2三維氧缺陷CuMn2O3.3納米微球的循環壽命圖。
具體實施方式
本發明通過下面具體實例進行詳細的描述,但是本發明的保護范圍不受限于這些實施例子。
實施例一:
將銅箔置于20 mL濃度為1 mol/L的氫氧化鈉溶液中,靜止0.5 h,然后轉入反應釜160 ℃反應8 h,得A。將A用乙醇和去離子水洗滌數次,80 ℃烘箱烘干;將上述A浸漬于濃度為1 mol/L的鹽酸溶液中,靜止10 min,將銅箔從鹽酸溶液中取出,乙醇和去離子水洗滌數次,80 ℃烘箱烘干,得B;將B在馬弗爐中以2 ℃/min的升溫速率500 ℃煅燒3 h,得到摻雜Cu+的CuO;將摻雜Cu+的CuO浸漬在1 mol/L的醋酸錳溶液中,轉入反應釜,80 ℃反應6 h,得C;將C用乙醇和去離子水洗滌烘干后,置于馬弗爐中,500 ℃煅燒5 h,得純CuMn2O4;將純CuMn2O4置于氫氣氣氛中,以1 ℃/min的升溫和降溫速度在350 ℃煅燒1 h,得CuMn2O3.6。圖1是三維氧缺陷CuMn2O3.6納米微球的循環壽命圖,首次放電比容量為1230 mAh/g,經過50次循環后其放電比容量為285 mAh/g。
實施例二:
將銅箔置于20 mL濃度為1 mol/L的氫氧化鉀溶液中,靜止0.5 h,然后轉入反應釜180 ℃反應6 h,得A。將A用乙醇和去離子水洗滌數次,80 ℃烘箱烘干;將上述A浸漬于濃度為1 mol/L的硝酸溶液中,靜止10 min,將銅箔從硝酸溶液中取出,乙醇和去離子水洗滌數次,80 ℃烘箱烘干,得B;將B在馬弗爐中以2 ℃/min的升溫速率500 ℃煅燒3 h,得到摻雜Cu+的CuO;將摻雜Cu+的CuO浸漬在1 mol/L的硝酸錳溶液中,轉入反應釜,100 ℃反應8 h,得C;將C用乙醇和去離子水洗滌烘干后,置于馬弗爐中,500 ℃煅燒5 h,得純CuMn2O4;將純CuMn2O4置于氫氣氣氛中,以1 ℃/min的升溫和降溫速度在400 ℃煅燒2 h,得CuMn2O3.3。圖2是三維氧缺陷CuMn2O3.3納米微球的循環壽命圖,首次放電比容量為1221 mAh/g,經過50次循環后其放電比容量為392 mAh/g;與實施例一中的CuMn2O3.6相比,其電化學性能有所提高,這主要是由于缺氧型缺陷對提高材料的導電性起著很重要的作用,進而可以提高材料的電化學性能。
實施例三:
將銅箔置于20 mL濃度為1 mol/L的氫氧化鉀溶液中,靜止0.5 h,然后轉入反應釜180 ℃反應8 h,得A。將A用乙醇和去離子水洗滌數次,100 ℃烘箱烘干;將上述A浸漬于濃度為1 mol/L的硝酸溶液中,靜止10 min,將銅箔從硝酸溶液中取出,乙醇和去離子水洗滌數次,80 ℃烘箱烘干,得B;將B在馬弗爐中以2 ℃/min的升溫速率500 ℃煅燒3 h,得到摻雜Cu+的CuO;將摻雜Cu+的CuO浸漬在1 mol/L的硝酸錳溶液中,轉入反應釜,100 ℃反應8 h,得C;將C用乙醇和去離子水洗滌烘干后,置于馬弗爐中,500 ℃煅燒5 h,得純CuMn2O4;將純CuMn2O4置于氫氣氣氛中,以1 ℃/min的升溫和降溫速度在450 ℃煅燒2 h,得CuMn2O3.1 。
- 還沒有人留言評論。精彩留言會獲得點贊!