一類化合物在作為含能材料方面的用途的制作方法
本發明涉及含能材料領域。具體地說,涉及鈣鈦礦型化合物在作為含能材料方面的用途。
背景技術:
含能化合物是一類具有高能量密度的爆炸物質。最早的含能材料是公元九世紀出現的中國黑火藥,由硫磺、硝酸鉀和木炭粉混合制成,效果差并且性能表現不穩定。到了近代,硝酸甘油最初作為一種醫藥產品被發現,隨后的生產中人們發現它是一種烈性炸藥。硝酸甘油的性能比黑火藥先進的多,但是感度很高,生產和運輸非常危險。阿爾弗雷德·貝恩哈德·諾貝爾在不懈的生產和研究中發現硅藻土可以吸附硝酸甘油,雖然犧牲了一定的爆炸性能,但有效地提高了產品的安全性,由此將硝酸甘油順利的推向了工業應用。步入現代社會以后,比硝酸甘油更高性能的炸藥被不斷發現并投入應用。著名的有三硝基甲苯(TNT)以及比TNT爆炸性能更強的有機含能材料黑索金(RDX)和奧托金(HMX),這三者廣泛存在于世界各國的武器彈藥之中。近年性能更加優秀但昂貴復雜的有機炸藥六硝基六氮雜異伍茲烷(CL-20)的工業化流程被我國科學家探索出來,推動了我國軍事彈藥更新的前景。近年來,一些帶有含能基團的金屬有機骨架化合物(如:Angew.Chem.Int.Ed.2013,52,14031;Chem.Eur.J.2013,19,1706)頗受關注,這類化合物具有豐富的基團可調控性以及經由理論計算指出的高爆熱性能,被視作下一代炸藥開發的重要方向。
現代炸藥的開發進展中,不同的炸藥除了有各個方面的性能進步也同時不可避免的有各自的缺陷。例如:具有爆炸性的高氯酸鉀曾經用作閃光彈助氧劑,但由于撞擊感度高,易在運輸途中爆炸而被最終棄用(參見《High Energy Materials:Propellants,Explosives and Pyrotechnics》第347頁,Jai Prakash Agrawal編著,Wiley-VCH出版社,2010)。現有的有機含能材料以及尚處在基礎研究階段的金屬有機骨架含能材料,雖然不乏爆炸性能優異者,但絕大多數存在合成工藝復雜,步驟多,價格較為昂貴,以及對撞擊、摩擦等十分敏感等諸多缺點,因而難以得到實用。因此,如何設計并合成同時具有低成本、高能量密度、低敏感度(高安全性)等優點的鈍感高能含能材料,是含能材料領域的一個經久不衰的追求。
技術實現要素:
本發明的目的之一在于提供一類新的含能材料。
本發明的目的之二在于提供一類具有良好安全性能的含能材料。
本發明的目的之三在于提供一類爆炸性能良好的含能材料。
本發明的目的之四在于提供一類能量密度高的含能材料。
在含能材料領域,本發明首次應用了鈣鈦礦型化合物作為含能材料,并突破性地發現其作為含能材料使用時具有尤其適用的性能。
所述的鈣鈦礦性化合物具有含能基團,例如,ClO4-含能基團。該類含能材料可以作為,但不限于作為炸藥使用。例如,其還可以作為推進劑、火箭燃料或安全氣囊的氣體發生劑進行使用。
鈣鈦礦型化合物是指與鈦酸鈣(CaTiO3)具有相似晶體結構的一類固態化合物,它們具有相同的化學通式ABX3。其中,A和B是不同尺寸的陽離子,而X是陰離子;其理想的結構屬于高對稱性的立方晶系,結構特征可以描述為:每個B位陽離子與6個相鄰的X陰離子相連,每個X陰離子與兩個相鄰的B位陽離子相連,進而形成由立方體籠狀單元組成的三維陰離子骨架;A位陽離子則填充在這些立方體籠狀單元的孔穴中。其中,A是至少一種陽離子,B是至少一種陽離子,而X是至少一種陰離子。當鈣鈦礦包括多于一種的A陽離子時,不同的A陽離子可以以有序的或無序的方式分布在A位點上。當鈣鈦礦包括多于一種的B陽離子時,不同的B陽離子可以以有序的或無序的方式分布在B位點上。當鈣鈦礦包括多于一種X陰離子時,不同的X陰離子可以以有序的或無序的方式分布在X位點上。
目前鈣鈦礦型化合物一般作為鐵電材料、光電材料、電磁材料等而研究和應用。
作為本發明的一個發現,A陽離子比B陽離子大的鈣鈦礦型化合物中,X為含能陰離子基團,由此形成的立體結構使得化合物在帶來含能材料作用的同時,能克服一些已有含能材料的缺陷,例如,根據發明人推測,其結構特點因其結晶于立方高對稱性空間群的原因而賦予了其低感度的特點,克服了現有技術的炸藥因感度過高而帶來的不安全性;同時,其結構特點因富含含能基團且這些氧化性含能陰離子與還原性有機陽離子在空間中相間排列的特征而賦予了這類化合物在引爆時的優良的瞬間能量。存放時的低感度特點及引爆時的瞬間能量爆發特點,這兩個看似矛盾的特點由于鈣鈦礦型空間立體結構特點而被得以集合于一身,這使得這類化合物尤其適合作為含能材料例如鈍感高能炸藥而使用。
含能基團是指具有爆炸性的基團,但并非所有含有爆炸性基團的化合物都具有爆炸性,一種化合物是否具有爆炸性取決于其整個分子結構而不是某單個基團(參見《炸藥學》第3頁,張華祝等著,北京:兵器工業出版社,2004)。常見的具有爆炸性的基團有ClO3-、ClO4-、NO3-、ONC-、偶氮基團、疊氮離子、硝基等基團。
本發明的X是至少一種陰離子含能基團,優選一價陰離子含能基團;更優選為一價的含鹵組分的含能基團。優選的陰離子含能基團(X)可以是:ClO4-、BrO4-、IO4-中的一種、兩種或多種。
本發明的A是至少一種有機陽離子。
優選地,A是至少一種含氮雜環有機陽離子;
更優選地,A是至少一種含六元環含氮雜環有機陽離子;
作為可選的實施方式,A選自以下有機陽離子母體及它們的衍生物中的一種、兩種或多種:
A組分有機陽離子的衍生物指的是有機陽離子本體中的氫原子同時或不同時地被取代基取代,常見的取代基有甲基、乙基、異丙基、叔丁基、羥基、羰基、羧基、鹵素、巰基、過氧基、偶氮基和硝基等。
本發明的B是至少一種一價陽離子。
作為可選的實施方式,B選自以下陽離子的一種、兩種或多種:
堿金屬離子、NH4+。
所述的堿金屬離子優選地選自Na+、K+、Rb+、Cs+中的一種、兩種或多種。
優選地,A選自1,4-二氫-1,4-二氮雜二環[2.2.2]辛烷銨離子、1-羥基-4-氫-1,4-二氮雜二環[2.2.2]辛烷銨離子、1,4-二羥基-1,4-二氮雜二環[2.2.2]辛烷銨離子及它們的衍生物中的一種、兩種或多種;更優選地,A選自有機陽離子1,4-二氫-1,4-二氮雜二環[2.2.2]辛烷銨離子、1,4-二羥基-1,4-二氮雜二環[2.2.2]辛烷銨離子中的一種或兩種;
優選地,B選自Na+、K+、NH4+中的一種、兩種或多種;更優選地,B選自Na+、NH4+中的一種或兩種;更優選地,B選自NH4+;
更優選地,X選自ClO4-、IO4-中的一種或兩種;更優選地,X選自ClO4-。
作為進一步優選的實施例,本發明的ABX3中:
A選自有機陽離子1,4-二氫-1,4-二氮雜二環[2.2.2]辛烷銨離子、1,4-二氫-吡嗪銨離子、1,4-二氫-哌嗪銨離子、1-羥基-4-氫-1,4-二氮雜二環[2.2.2]辛烷銨離子、1,4-二羥基-1,4-二氮雜二環[2.2.2]辛烷銨離子中的一種、兩種或多種;
B選自Na+、K+、Rb+、NH4+中的一種、兩種或多種;
X選自ClO4-、IO4-中的一種或兩種。
作為更進一步優選的實施例,本發明的ABX3中:
A選自有機陽離子1,4-二氫-1,4-二氮雜二環[2.2.2]辛烷銨離子、1-羥基-4-氫-1,4-二氮雜二環[2.2.2]辛烷銨離子、1,4-二羥基-1,4-二氮雜二環[2.2.2]辛烷銨離子中的一種、兩種或多種;
B選自Na+、K+、Rb+、NH4+中的一種、兩種或多種;
X選自ClO4-。
作為更進一步優選的實施例,本發明的ABX3中:
A選自有機陽離子1,4-二氫-1,4-二氮雜二環[2.2.2]辛烷銨離子、1,4-二羥基-1,4-二氮雜二環[2.2.2]辛烷銨離子中的一種或兩種;
B選自Na+、K+、Rb+、NH4+中的一種、兩種或多種;
X選自ClO4-。
作為更尤其優選的實施例,本發明的ABX3中:
A選自有機陽離子1,4-二氫-1,4-二氮雜二環[2.2.2]辛烷銨離子、1,4-二羥基-1,4-二氮雜二環[2.2.2]辛烷銨離子中的一種或兩種;
B選自Na+、K+、NH4+中的一種、兩種或多種;
X選自ClO4-。
作為最尤其優選的實施例,本發明的ABX3中:
A選自有機陽離子1,4-二氫-1,4-二氮雜二環[2.2.2]辛烷銨離子;
B選自Na+、NH4+中的一種或兩種;
X選自ClO4-。
作為特別的實施例,本發明的ABX3中:
A選自有機陽離子1,4-二氫-1,4-二氮雜二環[2.2.2]辛烷銨離子、1,4-二氫-吡嗪銨離子、1,4-二氫-哌嗪銨離子、1-羥基-4-氫-1,4-二氮雜二環[2.2.2]辛烷銨離子、1,4-二羥基-1,4-二氮雜二環[2.2.2]辛烷銨離子及它們的衍生物中的一種、兩種或多種;
X選自ClO4-、BrO4-、IO4-的一種、兩種或多種;
B選自NH4+;
當B選擇NH4+時,此時化合物在完全爆炸后不殘留金屬鹽固體物質,單位摩爾數所產生的氣體量可高達15.25摩爾。這個性質更有利于作為炸藥、火箭燃料、推進劑和安全氣囊的氣體發生劑等。尤其特別適合于對氣體產生量具有高要求的應用領域,例如作為火箭燃料。
ABX3可以通過將A組分、B組分和X組分以任意順序加入到液態反應體系中,反應獲得;液態反應體系優選可溶解A組分、B組分和X組分的極性溶劑。或借鑒已知的合成方法獲得。反應溫度無特別限制,可在極大范圍內調節,例如0~100℃。
作為一種實施方案本發明提供了其制備方法,包括以下步驟:
1)將A組分加入到極性溶劑中,再加入X組分,攪拌均勻;
2)將B組分溶于極性溶劑;
3)將步驟1)和步驟2)的溶液混合,充分攪拌,過濾,用乙醇洗滌濾渣,真空干燥,得到白色粉末狀含能化合物。
所述A組分為1,4-二氮雜二環[2.2.2]辛烷或其衍生物、吡嗪或其衍生物、哌嗪或其衍生物、1-氧化-1,4-二氮雜二環[2.2.2]辛烷或其衍生物、1,4-二氧化-1,4-二氮雜二環[2.2.2]辛烷或其衍生物、含1,4-二氫-1,4-二氮雜二環[2.2.2]辛烷銨離子或其衍生物的有機鹽、含1,4-二氫-吡嗪銨離子或其衍生物的有機鹽、含1,4-二氫-哌嗪銨離子或其衍生物的有機鹽、含1-羥基-4-氫-1,4-二氮雜二環[2.2.2]辛烷銨離子或其衍生物的有機鹽、含1,4-二羥基-1,4-二氮雜二環[2.2.2]辛烷銨離子或其衍生物的有機鹽中至少的一種。
優選的,所述B組分的陽離子選自堿金屬離子、NH4+中的一種、兩種或多種;B組分為含銨離子鹽、含鈉離子鹽、含鉀離子鹽、含銣離子鹽、含銫離子鹽、含銨離子堿、含鈉離子堿、含鉀離子堿、含銣離子堿、含銫離子堿中的至少一種。
所述X組分為含鹵含能基團的酸、含鹵含能基團的鹽中至少的一種。
所述的極性溶劑選自水、乙醇、甲醇中的一種、兩種或多種。
作為非限制性的例子,所述含1,4-二氫-1,4-二氮雜二環[2.2.2]辛烷銨離子的有機鹽為1,4-二氮雜二環[2.2.2]辛烷的鹽酸鹽;
所述含1,4-二氫-1,4-二氮雜二環[2.2.2]辛烷銨離子衍生物的有機鹽為2-羥基-1,4-二氮雜二環[2.2.2]辛烷的鹽酸鹽、2-羰基-1,4-二氮雜二環[2.2.2]辛烷的鹽酸鹽、2-甲基-1,4-二氮雜二環[2.2.2]辛烷的鹽酸鹽中至少的一種;
所述含1,4-二氫-吡嗪銨離子的有機鹽為吡嗪的鹽酸鹽;
所述含1,4-二氫-吡嗪銨離子衍生物的有機鹽為2-羥基-吡嗪的鹽酸鹽、2-甲基-吡嗪的鹽酸鹽中至少的一種;
所述含1,4-二氫-哌嗪銨離子的有機鹽為哌嗪的鹽酸鹽;
所述含1,4-二氫-哌嗪銨離子衍生物的有機鹽為2-羥基-哌嗪的鹽酸鹽、2-甲基-哌嗪的鹽酸鹽中至少的一種;
所述含1-羥基-4-氫-1,4-二氮雜二環[2.2.2]辛烷銨離子的有機鹽為1-氧化-1,4-二氮雜二環[2.2.2]辛烷的鹽酸鹽;
所述含1-羥基-4-氫-1,4-二氮雜二環[2.2.2]辛烷銨離子衍生物的有機鹽為2-羥基-1-氧化-1,4-二氮雜二環[2.2.2]辛烷的鹽酸鹽、2-羰基-1-氧化-1,4-二氮雜二環[2.2.2]辛烷的鹽酸鹽中至少的一種;
所述含1,4-二羥基-1,4-二氮雜二環[2.2.2]辛烷銨離子的有機鹽為1,4-二氧化-1,4-二氮雜二環[2.2.2]辛烷的鹽酸鹽;
所述含1,4-二羥基-1,4-二氮雜二環[2.2.2]辛烷銨離子衍生物的有機鹽為2-羥基-1,4-二氧化-1,4-二氮雜二環[2.2.2]辛烷的鹽酸鹽、2-羰基-1,4-二氧化-1,4-二氮雜二環[2.2.2]辛烷的鹽酸鹽中至少的一種;
所述含銨離子鹽為高氯酸銨、四氟硼酸銨、高碘酸銨、高錸酸銨、碳酸銨、硝酸銨、磷酸銨、氯化銨、氟化銨中至少的一種;
所述鈉鹽為高氯酸鈉、四氟硼酸鈉、高碘酸鈉、高錸酸鈉、碳酸鈉、硝酸鈉、磷酸鈉、氯化鈉、氟化鈉中的至少一種;
所述鉀鹽為高氯酸鉀、四氟硼酸鉀、高碘酸鉀、高錸酸鉀、碳酸鉀、硝酸鉀、磷酸鉀、氯化鉀、氟化鉀中的至少一種;
所述銣鹽為高氯酸銣、四氟硼酸銣、高碘酸銣、高錸酸銣、碳酸銣、硝酸銣、磷酸銣、氯化銣、氟化銣中的至少一種;
所述銫鹽為高氯酸銫、四氟硼酸銫、高碘酸銫、高錸酸銫、碳酸銫、硝酸銫、磷酸銫、氯化銫、氟化銫中的至少一種。
所述含銨離子堿為氨水;
所述含鈉離子堿為氫氧化鈉;
所述含鉀離子堿為氫氧化鉀;
所述含銣離子堿為氫氧化銣;
所述含銫離子堿為氫氧化銫;
優選地所述X組分為含高氯酸根的物質。例如優選為高氯酸。
所述極性溶劑為水、乙醇、甲醇中的至少一種。
本發明具有突出的有益效果:
(1)本發明的含能化合物的爆熱高,能量密度高,理論爆熱可高達1.53kcal/g,晶體密度處于1.8~2.5g/cm3的范圍,相應的能量密度可高達3.11kcal/cm3;
(2)本發明的含能化合物的爆速高,根據Kamlet-Jacob公式計算,理論爆速可高達8.85km/s;
(3)本發明的含能化合物的爆壓高,根據Kamlet-Jacob公式計算,理論爆壓可高達37.3GPa;
(4)本發明的含能化合物的安全性能良好,其撞擊感度、摩擦和靜電感度極低,熱感度爆發點溫度可達340℃;
(5)本發明的含能化合物無揮發性,可長期儲存不分解,不吸濕;
(6)本發明的含能化合物的室溫結晶性單一,原材料便宜易得,生產工藝簡單,可以安全大量地制備。
附圖說明
圖1為含能化合物DAP-1的結構示意圖。
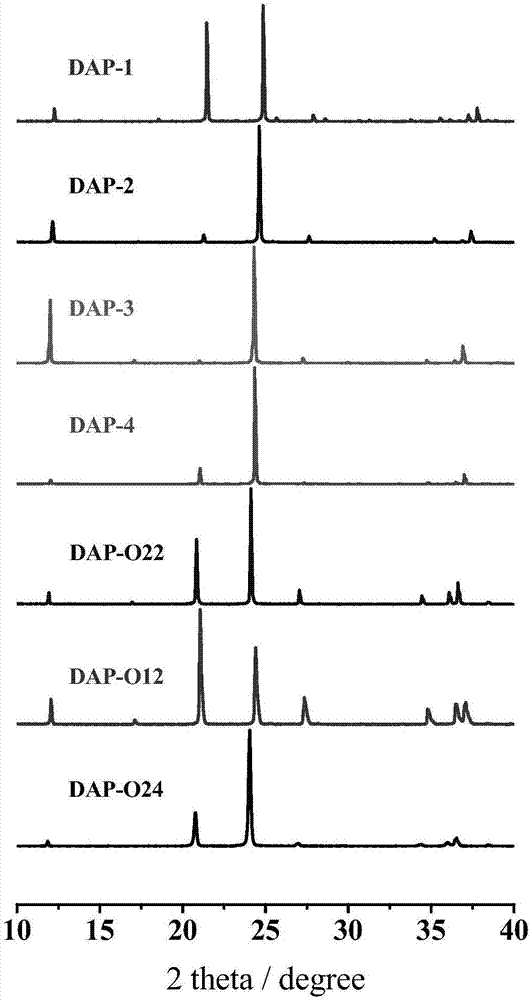
圖2為實施例1~7的含能化合物的粉末X射線衍射圖。
圖3為實施例1的含能化合物DAP-1的紅外圖譜。
圖4為實施例1的含能化合物DAP-1的熱重分析圖譜。
圖5為實施例1的含能化合物DAP-1的差示掃描量熱分析圖譜。
圖6為實施例2的含能化合物DAP-2的熱重分析圖譜。
圖7為實施例2的含能化合物DAP-2的差示掃描量熱分析圖譜。
圖8為實施例3的含能化合物DAP-3的熱重分析圖譜。
圖9為實施例3的含能化合物DAP-3的差示掃描量熱分析圖譜。
圖10為實施例4的含能化合物DAP-4的熱重分析圖譜。
圖11為實施例4的含能化合物DAP-4的差示掃描量熱分析圖譜。
圖12為實施例5的含能化合物DAP-O22的熱重分析圖譜。
圖13為實施例5的含能化合物DAP-O22的差示掃描量熱分析圖譜。
圖14為實施例7的含能化合物DAP-O24的差示掃描量熱分析圖譜。
具體實施方式
發明人設計了系列具有含能基團的鈣鈦礦型化合物,并首次對它們用于含能領域作為一種新型高性能爆炸物的前景進行了相關實驗研究。在本發明中我們提出這樣一類具有含能基團的鈣鈦礦型含能化合物(ABX3,在以下實施例中對應于縮寫DAP并予以分別的編號),通過實驗和計算我們指出了其能量密度和爆炸性能可以和現役高性能軍用炸藥RDX、HMX媲美,并且安全性能優異,不具有揮發性,不吸濕,原材料便宜易得,合成過程簡單,是在含能領域具有實用價值的一類新型含能化合物。
ABX3的合成可根據本發明的合成方法進行。也可借鑒Z.M.Jin等公開的一種鈣鈦礦化合物(C6H14N2)[K(ClO4)3]的合成方法(Z.M.Jin,Y.J.Pan,X.F.Li,M.L.Hu,L.Shen,Journal of Molecular Structure,2003,660,67)。
本發明進行了包括粉末X射線衍射鑒定、單晶結構表征測試、紅外光譜表征、熱穩定性表征、差示掃描量熱分析(DSC)、感度表征、爆熱/爆壓/爆速值計算在內的多種鑒定和表征方法。
其中,室溫條件下的粉末X射線衍射數據是在Bruker D8Advance衍射儀上收集,采用Cu-Kα射線,掃描方式:θ:2θ聯動,步進掃描,2θ步長為0.02°。單晶X射線衍射數據是在Oxford Gemini S Ultra CCD衍射儀上收集,石墨單色器,用Mo-Kα射線,以ω掃描方式收集數據,吸收校正采用SADABS程序。利用直接法進行解析,然后用差值傅立葉函數法和最小二乘法求出全部非氫原子坐標,最后用最小二乘法對結構進行修正。化合物的有機氫原子通過理論加氫法得到。計算工作在PC機上使用Olex2和SHELX程序包完成。紅外光譜數據是在IR Tensor27儀器上收集,將干燥樣品與KBr壓制成透明薄片測試樣品。熱重分析是在TA Q50儀器上收集,氮氣氣氛,掃描速度為5℃/min。DSC曲線是在TA DSC Q2000儀器上收集,氮氣氣氛,掃描速度為5℃/min。
感度表征根據中華人民共和國國家軍用標準GJB772A-97標準進行撞擊、摩擦、熱感度測試。撞擊感度用601.1爆炸概率法;摩擦感度用602.1爆炸概率法;熱感度測試為方法606.1-爆發點5秒延滯期法。靜電感度測試方法為WJ/T 9038.3-2004工業火工藥劑試驗方法第3部分:靜電火花感度測試。
室溫下,高氯酸根基團在紅外吸收光譜的特征峰位于1070~1100cm-1(對應不對稱伸縮振動)以及617~637cm-1(對應不對稱彎曲振動)。
在一個優選的實施例中,采用作為含能材料的化合物為(C6H14N2)[Na(ClO4)3](記為DAP-1),其在223K下結晶于立方晶系的Pa-3空間群,晶胞長度為其在室溫下的粉末X射線衍射(Cu-Kα射線)發生在衍射角度2θ約為:12.26±0.2°,21.46±0.2°,24.86±0.2°,27.89±0.2°,35.55±0.2°,37.25±0.2°之處。熱穩定性分析結果顯示其爆炸溫度可高達360℃;差示掃描量熱分析結果顯示360℃分解放出的熱量達4398J/g;安全性能表征結果顯示DAP-1在撞擊感度、摩擦感度以及靜電火花感度測試中均表現為鈍感,DAP-1的爆發點高達340℃(5s延滯期法)。密度泛函DFT理論得到含能化合物的爆熱、爆速和爆壓值分別為1.53kcal/g、8.85km/s和37.31GPa。
在另一個優選的實施例中,采用作為含能材料的化合物為(C6H14N2)[K(ClO4)3](記為DAP-2),其在223K下結晶于立方晶系的Pa-3空間群,晶胞長度為其在室溫下的粉末X射線衍射(Cu-Kα射線)發生在衍射角度2θ約為:12.15±0.2°,21.27±0.2°,24.63±0.2°,27.64±0.2°,35.20±0.2°,36.89±0.2°之處。熱穩定性分析結果顯示其爆炸溫度可高達362℃;差示掃描量熱分析結果顯示377℃分解放出的熱量達4076J/g。密度泛函DFT理論得到含能化合物的爆熱、爆速和爆壓值分別為1.46kcal/g、8.64km/s和35.73GPa。
在另一個優選的實施例中,采用作為含能材料的化合物為(C6H14N2)[Rb(ClO4)3](記為DAP-3),其在223K下結晶于立方晶系的Pa-3空間群,晶胞長度為其在室溫下的粉末X射線衍射(Cu-Kα射線)發生在衍射角度2θ約為:12.01±0.2°,21.00±0.2°,24.31±0.2°,27.26±0.2°,34.73±0.2°,36.40±0.2°之處。熱穩定性分析結果顯示其爆炸溫度可高達343℃。差示掃描量熱分析結果顯示369℃分解放出的熱量達3797J/g。密度泛函DFT理論得到含能化合物的爆熱、爆速和爆壓值分別為1.33kcal/g、8.43km/s和35.14GPa。
在另一個優選的實施例中,采用作為含能材料的化合物為(C6H14N2)[NH4(ClO4)3](記為DAP-4),其在223K下結晶于立方晶系的Pa-3空間群,晶胞長度為其在室溫下的粉末X射線衍射(Cu-Kα射線)發生在衍射角度2θ約為:12.03±0.2°,21.05±0.2°,24.35±0.2°,27.34±0.2°,34.81±0.2°,36.48±0.2°之處。熱穩定性分析結果顯示其爆炸溫度可高達370℃;差示掃描量熱分析結果顯示364℃分解放出的熱量達5177J/g。
在另一個優選的實施例中,采用作為含能材料的化合物為(C6H14N2O2)[K(ClO4)3](記為DAP-O22),其在298K下結晶于立方晶系的Fm-3c空間群,晶胞長度為其在室溫下的粉末X射線衍射(Cu-Kα射線)發生在衍射角度2θ約為:11.93±0.2°,20.84±0.2°,24.13±0.2°,27.05±0.2°,34.45±0.2°,36.09±0.2°之處。熱穩定性分析結果顯示其爆炸溫度可高達354℃;差示掃描量熱分析結果顯示358℃分解放出的熱量達5424J/g。
在另一個優選的實施例中,采用作為含能材料的化合物為(C6H14N2O)[K(ClO4)3](記為DAP-O12)。其在室溫下的粉末X射線衍射(Cu-Kα射線)發生在衍射角度2θ約為:12.06±0.2°,21.06±0.2°,24.41±0.2°,27.34±0.2°,34.79±0.2°,36.49±0.2°之處。
在另一個優選的實施例中,采用作為含能材料的化合物為(C6H14N2O2)[NH4(ClO4)3](記為DAP-O24)。其在室溫下的粉末X射線衍射(Cu-Kα射線)發生在衍射角度2θ約為:11.86±0.2°,20.76±0.2°,24.05±0.2°,26.98±0.2°,34.37±0.2°,36.01±0.2°之處。差示掃描量熱分析結果顯示357℃分解放出的熱量達4632J/g。
實施例1
(C6H14N2)[Na(ClO4)3]的合成及測試
合成方法:
1)將112.88g 1,4-二氮雜二環[2.2.2]辛烷加入100mL水中,再加入360.00g質量分數為70%~72%的高氯酸溶液,常溫攪拌5分鐘;
2)將140.52g一水合高氯酸鈉加入50mL水中,常溫攪拌溶解;
3)將步驟1)和步驟2)的溶液混合,攪拌30分鐘,過濾,用乙醇洗滌濾渣三次,真空干燥,得白色粉末狀固體,經鑒定為鈣鈦礦型化合物(C6H14N2)[Na(ClO4)3](編號為DAP-1),產率約為80%。
粉末X射線衍射鑒定圖譜:
室溫下粉末X射線衍射圖見圖2,其特征峰值如表1所示。
表1 DAP-1的粉末X射線衍射特征峰值
單晶結構表征測試:
詳細的晶體測定數據見表2。三維晶體結構示意圖見圖1。如圖1可見:處于B位點的Na+離子與6個相鄰的處于X位點的ClO4-陰離子相連,每個ClO4-陰離子與兩個相鄰的Na+離子相連,進而形成由立方體籠狀單元組成的三維陰離子骨架;處于A位點的有機陽離子1,4-二氫-1,4-二氮雜二環[2.2.2]辛烷銨離子(C6H14N22+)填充在每個立方體籠狀單元的孔穴中。
表2 DAP-1的單晶結構測定數據
[a]R1=Σ||Fo|-|Fc||/Σ|Fo|,[b]wR2={Σw[(Fo)2-(Fc)2]2/Σw[(Fo)2]2}1/2
DAP-1的紅外光譜表征:
DAP-1的紅外光譜圖如圖3所示。由圖3可知:有機組分所具有的特征峰是-CH2-基團的伸縮振動峰3452、3188、3055、3013、2924、2795、2706cm-1;NH+的伸縮振動峰是2606cm-1;高氯酸根所具有的特征峰是其不對稱伸縮振動1078cm-1以及不對稱彎曲振動627cm-1。
DAP-1的熱穩定性表征:
DAP-1的熱重曲線如圖4所示。由圖4可知:在裝樣量為3.291mg,升溫速率為5℃/min的情況下,實施例1的含能化合物DAP-1在360℃處發生爆炸。
DAP-1的差示掃描量熱分析:
DAP-1的DSC曲線如圖5所示。由圖5可知:實施例1的非裝藥狀態粉末態的含能化合物DAP-1在360℃處分解并放出大量的熱(約4398J/g)。
DAP-1的撞擊、摩擦、熱感度、靜電感度表征:
根據GJB772A-97標準進行撞擊、摩擦、熱感度。撞擊感度用601.1爆炸概率法,測試中(10kg錘重,500mm落高),TNT的爆炸概率為9/25,而DAP-1爆炸概率為0%;摩擦感度用602.1爆炸概率法,測試中(2.45MPa、80°擺角),太恩(PETN)的爆炸概率為2/25,而DAP-1爆炸概率為0%;熱感度測試為方法606.1-爆發點5秒延滯期法,測得DAP-1在340℃發生劇烈爆炸,表明DAP-1的爆發點為340℃。靜電感度測試方法為WJ/T 9038.3-2004工業火工藥劑試驗方法第3部分:靜電火花感度測試,25mg試樣的半發火電壓V50為4.77kV(標準偏差0.21kV),半發火能量E50為0.53J,即DAP-1的靜電火花感度為21.2J。
密度泛函(DFT)理論得到含能化合物DAP-1的爆熱、爆壓、爆速值:
DAP-1的分解熱值(分解焓值⊿Hdet)用密度泛函(DFT)理論計算(J.Am.Chem.Soc.2012,134,1422)約為1.53kcal/g,高于現役含能材料HMX(1.26kcal/g)、RDX(1.27kcal/g);按照223K時的晶體密度換算得能量密度分別是3.11kcal/cm3,也高于現役含能材料HMX(2.38kcal/cm3)、RDX(2.29kcal/cm3)。根據Kamlet-Jacob公式計算DAP類化合物的爆速約為8.85km/s,爆壓約為37.31GPa。與現役含能材料的相應值(HMX:爆速9.10km/s,爆壓39.50GPa;RDX:爆速8.80km/s,爆壓33.80GPa)相當。
單位摩爾數DAP-1產生的氣體量
關于無氧環境中含能材料完全爆炸的產物判斷,根據文獻(J.Am.Chem.Soc.2012,134,1422;J.Phys.Chem.A.2014,118,4575;Chem.Eur.J.2016,22,1141),其分解產物最終為:氮氣、鹵化氫、水和二氧化碳等氣態物質,以及金屬的氯化鹽和單質碳(如果氧原子不足于將所有碳原子完全轉化為二氧化碳的話)等固態物質。因此,1摩爾DAP-1無氧環境下完全爆炸之后可產生12摩爾氣體物質,并殘留3摩爾單質碳和1摩爾氯化鈉固態。在混入足夠氧化劑(如常用的NH4ClO4)的情況下,1摩爾DAP-1完全爆炸后存在1摩爾氯化鈉固體殘留物。
實施例2
(C6H14N2)[K(ClO4)3]的合成及測試
合成方法:
1)將2.24g 1,4-二氮雜二環[2.2.2]辛烷加入100mL水中,再加入5.74g質量分數為70%~72%的高氯酸溶液,常溫攪拌5分鐘;
2)將2.77g高氯酸鉀加入100mL水中,加熱攪拌溶解;
3)將步驟1)和步驟2)的溶液混合,攪拌30分鐘,過濾,用乙醇洗滌濾渣三次,真空干燥,得白色粉末狀固體,經鑒定為鈣鈦礦型化合物(C6H14N2)[K(ClO4)3](編號為DAP-2),產率約為90%。
粉末X射線衍射鑒定圖譜:
室溫下粉末X射線衍射圖見圖2,其特征峰值如表3所示。
表3 DAP-2的粉末X射線衍射特征峰值
單晶結構表征測試:
詳細的晶體測定數據見表4。
表4 DAP-2的單晶結構測定數據
[a]R1=Σ||Fo|-|Fc||/Σ|Fo|,[b]wR2={Σw[(Fo)2-(Fc)2]2/Σw[(Fo)2]2}1/2
DAP-2的熱穩定性表征:
DAP-2的熱重曲線如圖6所示。由圖6可知:在裝樣量為6.65mg,升溫速率為5℃/min的情況下,實施例2的含能化合物DAP-2在362℃處發生爆炸。
DAP-2的差示掃描量熱分析:
DAP-2的DSC曲線如圖7所示。由圖7可知:實施例2的非裝藥狀態粉末態的含能化合物DAP-2在377℃處分解并放出大量的熱(約4076J/g)。
密度泛函(DFT)理論得到含能化合物DAP-2的爆熱、爆壓、爆速值:
DAP-2的分解熱值(分解焓值⊿Hdet)用密度泛函(DFT)理論計算(J.Am.Chem.Soc.2012,134,1422)約為1.46kcal/g,高于現役含能材料HMX(1.26kcal/g)、RDX(1.27kcal/g);按照223K時的晶體密度換算得能量密度分別是3.01kcal/cm3,也高于現役含能材料HMX(2.38kcal/cm3)、RDX(2.29kcal/cm3)。根據Kamlet-Jacob公式計算DAP類化合物的爆速約為8.64km/s,爆壓約為35.73GPa。
單位摩爾數DAP-2產生的氣體量
關于無氧環境中含能材料完全爆炸的產物判斷,根據文獻(J.Am.Chem.Soc.2012,134,1422;J.Phys.Chem.A.2014,118,4575;Chem.Eur.J.2016,22,1141),其分解產物最終為:氮氣、鹵化氫、水和二氧化碳等氣態物質,以及金屬的氯化鹽和單質碳(如果氧原子不足于將所有碳原子完全轉化為二氧化碳的話)等固態物質。因此,1摩爾DAP-2無氧環境下完全爆炸之后可產生12摩爾氣體物質,并殘留3摩爾單質碳和1摩爾氯化鉀固態。在混入足夠氧化劑(如常用的NH4ClO4)的情況下,1摩爾DAP-2完全爆炸后存在1摩爾氯化鉀固體殘留物。
實施例3
(C6H14N2)[Rb(ClO4)3]的合成及測試
合成方法:
1)將2.24g 1,4-二氮雜二環[2.2.2]辛烷加入100mL水中,再加入5.74g質量分數為70%~72%的高氯酸溶液,常溫攪拌5分鐘;
2)將3.70g高氯酸銣加入100mL水中,加熱攪拌溶解;
3)將步驟1)和步驟2)的溶液混合,攪拌30分鐘,過濾,用乙醇洗滌濾渣三次,真空干燥,得白色粉末狀固體,經鑒定為鈣鈦礦型化合物(C6H14N2)[Rb(ClO4)3](編號為DAP-3),產率約為85%。
粉末X射線衍射鑒定圖譜:
室溫下粉末X射線衍射圖見圖2,其特征峰值如表5所示。
表5 DAP-3的粉末X射線衍射特征峰值
單晶結構表征測試:
詳細的晶體測定數據見表6。
表6 DAP-3的單晶結構測定數據
[a]R1=Σ||Fo|-|Fc||/Σ|Fo|,[b]wR2={Σw[(Fo)2-(Fc)2]2/Σw[(Fo)2]2}1/2
DAP-3的熱穩定性表征:
DAP-3的熱重曲線如圖8所示。由圖8可知:在裝樣量為4.45mg,升溫速率為5℃/min的情況下,實施例3的含能化合物DAP-3在343℃處發生爆炸。
DAP-3的差示掃描量熱分析:
DAP-3的DSC曲線如圖9所示。由圖9可知:實施例3的非裝藥狀態粉末態的含能化合物DAP-3在369℃處分解并放出大量的熱(約3797J/g)。
密度泛函(DFT)理論得到含能化合物DAP-3的爆熱、爆壓、爆速值:
DAP-3的分解熱值(分解焓值⊿Hdet)用密度泛函(DFT)理論計算(J.Am.Chem.Soc.2012,134,1422)約為1.33kcal/g,高于現役含能材料HMX(1.26kcal/g)、RDX(1.27kcal/g);按照223K時的晶體密度換算得能量密度分別是2.92kcal/cm3,也高于現役含能材料HMX(2.38kcal/cm3)、RDX(2.29kcal/cm3)。根據Kamlet-Jacob公式計算DAP類化合物的爆速約為8.43km/s,爆壓約為35.14GPa。
單位摩爾數DAP-3產生的氣體量
關于無氧環境中含能材料完全爆炸的產物判斷,根據文獻(J.Am.Chem.Soc.2012,134,1422;J.Phys.Chem.A.2014,118,4575;Chem.Eur.J.2016,22,1141),其分解產物最終為:氮氣、鹵化氫、水和二氧化碳等氣態物質,以及金屬的氯化鹽和單質碳(如果氧原子不足于將所有碳原子完全轉化為二氧化碳的話)等固態物質。因此,1摩爾DAP-3無氧環境下完全爆炸之后可產生12摩爾氣體物質,并殘留3摩爾單質碳和1摩爾氯化銣固態。在混入足夠氧化劑(如常用的NH4ClO4)的情況下,1摩爾DAP-3完全爆炸后存在1摩爾氯化銣固體殘留物。
實施例4:
(C6H14N2)[NH4(ClO4)3]的合成及測試
合成方法:
1)將2.24g 1,4-二氮雜二環[2.2.2]辛烷加入5mL水中,再加入5.74g質量分數為70%~72%的高氯酸溶液,常溫攪拌5分鐘;
2)將2.35g高氯酸銨加入10mL水中,常溫攪拌溶解;
3)將步驟1)和步驟2)的溶液混合,攪拌10分鐘,過濾,用乙醇洗滌濾渣三次,真空干燥,得白色粉末狀固體,經鑒定為鈣鈦礦型化合物(C6H14N2)[NH4(ClO4)3](DAP-4),產率約為90%。
粉末X射線衍射鑒定圖譜:
室溫下粉末X射線衍射圖見圖2,其特征峰值如表7所示。
表7 DAP-4的粉末X射線衍射特征峰值
單晶結構表征測試:
詳細的晶體測定數據見表8。
表8 DAP-4的晶體測定數據
[a]R1=Σ||Fo|-|Fc||/Σ|Fo|,[b]wR2={Σw[(Fo)2-(Fc)2]2/Σw[(Fo)2]2}1/2
DAP-4的熱穩定性表征:
DAP-4的熱重曲線如圖10所示。由圖10可知:在裝樣量為4.825mg,升溫速率為5℃/min的情況下,實施例4的含能化合物DAP-4在370℃處發生爆炸。
DAP-4的差示掃描量熱分析:
DAP-4的DSC曲線如圖11所示。由圖11可知:實施例4的非裝藥狀態粉末態的含能化合物DAP-4在364℃處分解并放出大量的熱(約5177J/g)。
單位摩爾數DAP-4產生的氣體量
關于無氧環境中含能材料完全爆炸的產物判斷,根據文獻(J.Am.Chem.Soc.2012,134,1422;J.Phys.Chem.A.2014,118,4575;Chem.Eur.J.2016,22,1141),其分解產物最終為:氮氣、鹵化氫、水和二氧化碳等氣態物質,以及單質碳(如果氧原子不足于將所有碳原子完全轉化為二氧化碳的話)固態物質。因此,1摩爾DAP-4無氧環境下完全爆炸之后可產生14.25摩爾氣體物質,并殘留3.75摩爾單質碳。在混入足夠氧化劑(如常用的NH4ClO4)的情況下,DAP-4完全爆炸后無固體殘留物。
實施例5
(C6H14N2O2)[K(ClO4)3]的合成及測試
合成方法:
1)將1.01g 1,4-二氮雜二環[2.2.2]辛烷置于燒杯中,逐漸加入6g質量分數為30%的雙氧水,充分反應,得到1,4-二氧化-1,4-二氮雜二環[2.2.2]辛烷的水溶液,再加入2.64g質量分數為70%~72%的高氯酸溶液,攪拌20分鐘;
2)將0.42g高氯酸鉀加入20mL水中,加熱至沸騰攪拌溶解;
3)將步驟1)和步驟2)的溶液混合攪拌10分鐘,靜置逐漸產生晶體。過濾,用乙醇洗滌濾渣三次,真空干燥,得白色粉末狀固體,經鑒定為鈣鈦礦型化合物(C6H14N2O2)[K(ClO4)3](DAP-O22),產率約為55%。
粉末X射線衍射鑒定圖譜:
室溫下粉末X射線衍射圖見圖2,其特征峰值如表9所示。
表9 DAP-22的粉末X射線衍射特征峰值
單晶結構表征測試:
詳細的晶體測定數據見表10。
表10 DAP-O22的晶體測定數據
[a]R1=Σ||Fo|-|Fc||/Σ|Fo|,[b]wR2={Σw[(Fo)2-(Fc)2]2/Σw[(Fo)2]2}1/2
DAP-O22的熱穩定性表征:
DAP-O22的熱重曲線如圖12所示。由圖12可知:在裝樣量為4.175mg,升溫速率為5℃/min的情況下,實施例5的含能化合物DAP-O22的分解溫度是354℃。
DAP-O22的差示掃描量熱分析:
DAP-O22的DSC曲線如圖13所示。由圖13可知:實施例5的非裝藥狀態粉末態的含能化合物DAP-O22在358℃處分解并放出大量的熱(約5424J/g)。
單位摩爾數DAP-O22產生的氣體量
關于無氧環境中含能材料完全爆炸的產物判斷,根據文獻(J.Am.Chem.Soc.2012,134,1422;J.Phys.Chem.A.2014,118,4575;Chem.Eur.J.2016,22,1141),其分解產物最終為:氮氣、鹵化氫、水和二氧化碳等氣態物質,以及金屬的氯化鹽和單質碳(如果氧原子不足于將所有碳原子完全轉化為二氧化碳的話)等固態物質。因此,1摩爾DAP-O22無氧環境下完全爆炸之后可產生13摩爾氣體物質,并殘留2摩爾單質碳和1摩爾氯化鉀固態。在混入足夠氧化劑(如常用的NH4ClO4)的情況下,1摩爾DAP-O22完全爆炸后存在1摩爾氯化鉀固體殘留物。
實施例6:
(C6H14N2O)[K(ClO4)3]的合成及測試
合成方法:
1)將1.01g 1,4-二氮雜二環[2.2.2]辛烷置于燒杯中持續冰浴,緩慢逐漸加入2g質量分數為30%的雙氧水,得到1-氧化-1,4-二氮雜二環[2.2.2]辛烷的水溶液,再加入2.64g質量分數為70%~72%的高氯酸溶液,攪拌20分鐘;
2)將0.42g高氯酸鉀加入20mL水中,加熱至沸騰攪拌溶解;
3)將步驟1)和步驟2)的溶液混合攪拌10分鐘,靜置逐漸產生晶體。過濾,用乙醇洗滌濾渣三次,真空干燥,得白色粉末狀固體,經鑒定為鈣鈦礦型化合物(C6H14N2O)[K(ClO4)3](DAP-O12),產率約為30%。
粉末X射線衍射鑒定圖譜:
室溫下粉末X射線衍射圖見圖2,其特征峰值如表11所示。
表11 DAP-12的粉末X射線衍射特征峰值
單位摩爾數DAP-O12產生的氣體量
關于無氧環境中含能材料完全爆炸的產物判斷,根據文獻(J.Am.Chem.Soc.2012,134,1422;J.Phys.Chem.A.2014,118,4575;Chem.Eur.J.2016,22,1141),其分解產物最終為:氮氣、鹵化氫、水和二氧化碳等氣態物質,以及金屬的氯化鹽和單質碳(如果氧原子不足于將所有碳原子完全轉化為二氧化碳的話)等固態物質。因此,1摩爾DAP-O12無氧環境下完全爆炸之后可產生12.5摩爾氣體物質,并殘留2.5摩爾單質碳和1摩爾氯化鉀固態。在混入足夠氧化劑(如常用的NH4ClO4)的情況下,1摩爾DAP-O12完全爆炸后存在1摩爾氯化鉀固體殘留物。
實施例7:
(C6H14N2O2)[NH4(ClO4)3]的合成及測試
合成方法:
1)將0.34g 1,4-二氮雜二環[2.2.2]辛烷置于燒杯中,常溫下緩慢逐漸加入0.69g質量分數為30%的雙氧水,得到1,4-二氧化-1,4-二氮雜二環[2.2.2]辛烷的水溶液,再加入0.86g質量分數為70%~72%的高氯酸溶液,攪拌20分鐘;
2)將0.41g高氯酸銨加入20mL水中攪拌溶解;
3)將步驟1)和步驟2)的溶液混合攪拌10分鐘,靜置逐漸產生晶體。過濾,用乙醇洗滌濾渣三次,真空干燥,得白色粉末狀固體,經鑒定為鈣鈦礦型化合物(C6H14N2O2)[NH4(ClO4)3](DAP-O24),產率約為30%。
粉末X射線衍射鑒定圖譜:
室溫下粉末X射線衍射圖見圖2,其特征峰值如表12所示。
表12 DAP-24的粉末X射線衍射特征峰值
DAP-O24的差示掃描量熱分析:
DAP-O24的DSC曲線如圖14所示。由圖14可知:實施例7的非裝藥狀態粉末態的含能化合物DAP-O24在357℃處分解并放出大量的熱(約4632J/g)。
單位摩爾數DAP-O24產生的氣體量
關于無氧環境中含能材料完全爆炸的產物判斷,根據文獻(J.Am.Chem.Soc.2012,134,1422;J.Phys.Chem.A.2014,118,4575;Chem.Eur.J.2016,22,1141),其分解產物最終為:氮氣、鹵化氫、水和二氧化碳等氣態物質,以及單質碳(如果氧原子不足于將所有碳原子完全轉化為二氧化碳的話)固態物質。因此,1摩爾DAP-O24無氧環境下完全爆炸之后可產生15.25摩爾氣體物質,并殘留2.75摩爾單質碳。在混入足夠氧化劑(如常用的NH4ClO4)的情況下,DAP-O24完全爆炸后無固體殘留物。
本發明的鈣鈦礦型含能化合物的爆熱高,能量密度高,爆速高,爆壓高,安全性能良好,對撞擊、摩擦和靜電等感度極低,不具有揮發性,可長期存放不分解,不吸濕,原材料便宜易得,合成過程簡單,無副產物,可以大批量制備。
本發明的鈣鈦礦型含能化合物用作炸藥之類的含能材料其效果是現有技術預期不到的。雖然高氯酸根是含能基團,但目前絕大部分含高氯酸根的化合物由于各種缺點而不能作為實用的含能材料(參見《High Energy Materials:Propellants,Explosives and Pyrotechnics》第28頁,Jai Prakash Agrawal編著,Wiley-VCH出版社,2010),比如高氯酸鈉和高氯酸鋰等常見的高氯酸鹽本身吸濕性極強,而高氯酸鉀曾被用于閃光彈氧化劑,但后來發現其撞擊感度過高,易在運輸途中爆炸;當前仍被列為爆炸物的高氯酸銨的理論爆熱僅1972J/g,遠不及本發明的含能化合物的爆熱水平。然而本發明的鈦礦型化合物即使含有如此的爆炸性基團,卻仍能保持極低的感度以及不吸濕的特點,成為安全性極強和易于存放的含能材料。同時,由于其富含含能基團且這些氧化性含能陰離子與還原性有機陽離子在空間上相間排列,晶體密度大,瞬間能量爆發力強,能量密度高,爆熱、爆壓、爆速水平均高,其作為炸藥使用的性能優越性與現有技術相比帶來了飛躍性的進步。
上述實施例為本發明較佳的實施方式,但本發明的實施方式并不受上述實施例的限制,其他的任何未背離本發明的精神實質與原理下所作的改變、修飾、替代、組合、簡化,均應為等效的置換方式,都包含在本發明的保護范圍之內。
- 還沒有人留言評論。精彩留言會獲得點贊!