蛛絲蛋白的堿性純化的制作方法
蛛絲蛋白的堿性純化
1.相關申請
2.本技術要求2018年11月28日提交的美國臨時專利申請第62/772,588號的優先權,其內容通過引用以其整體并入本文。
3.序列表
4.本技術包含序列表,其已通過efs-web提交并通過引用以其整體并入本文。所述ascii副本創建于20xx年xx月,命名為xxxxxus_sequencelisting.txt,文件大小為x,xxx,xxx字節。
背景技術:
5.蜘蛛的絲多肽為大(》150kda,》1000個氨基酸)多肽,其可以分解成三個結構域:n-末端非重復性結構域(ntd)、重復性結構域(rep)和c-末端非重復性結構域(ctd)。ntd和ctd相對較小(分別為約150、約100個氨基酸),研究充分,并且據信賦予多肽水穩定性(aqueous stability)、ph值敏感性和聚集后的分子排列。ntd也具有強預測性分泌標簽,該標簽往往在異源表達過程中被除去。重復區域占天然多肽的約90%,并折疊成結晶和無定形區域,這些區域分別賦予絲纖維強度和柔韌性。
6.絲多肽來自多種來源,包括蜜蜂、蛾、蜘蛛、螨和其他節肢動物。一些生物體制造出多種具有特定序列、結構元素和力學性質的絲纖維。例如,圓形織網(orb weaving)蜘蛛具有六種產生不同絲多肽序列的獨特類型的腺體,這些絲多肽序列可聚合成適合環境或生命周期微環境(niche)的纖維。該纖維以其來源的腺體命名,多肽則用腺體縮寫(例如“ma”)和蛛絲蛋白(蜘蛛絲心蛋白的簡稱)的“sp”標記。在圓形織網蛛中,這些類型包括大壺狀腺(masp,也稱為拖絲)、小壺狀腺(misp)、鞭狀腺(flag)、葡萄狀腺(acsp)、管狀腺(tusp)和梨狀腺(pysp)。這種跨纖維類型、結構域以及不同生物體屬和物種間變異的多肽序列組合產生可通過重組纖維的商業生產加以利用的各種潛在特性。迄今為止,大部分關于重組絲的工作集中于大壺狀腺蛛絲蛋白(masp)。
7.目前,重組絲纖維不能商購獲得(除了少數例外),在大腸埃希菌(escherichia coli)和其他革蘭陰性原核生物之外的微生物中無法產生。迄今為止生產的重組絲主要由聚合的短絲序列基序或原始重復結構域的片段組成,所述原始重復結構域有時與ntd和/或ctd組合在一起。這導致使用細胞內表達進行重組絲多肽的小規模生產(實驗室規模下為毫克,生物加工規模下為千克),并通過層析或本體沉淀進行純化。這些方法無法產生能夠與現有技術和紡織纖維的價格競爭的可行的商業可擴展性。已經用于制造絲多肽的另外的生產宿主包括轉基因山羊、轉基因蠶和植物。這些宿主尚未能進行絲的商業規模生產,可能是工程化周期緩慢和可擴展性不良所致。
8.此外,重組絲多肽在生產和純化過程中形成不合需要的不溶性聚集體。純化期間重新增溶肽的方法往往會使蛋白質降解,導致纖維的收率較低,纖維的韌性低,手感較差。此外,標準蛋白增溶方法需要使用離液劑(chaotrope),諸如尿素、鹽酸胍或硫氰酸胍,這些離液劑在蛋白質分離后必須被收集起來并加以適當處置。因此,需要改良的方法以在可持
續且環境友好的工藝中純化這些多肽。
技術實現要素:
9.在一個方面,本文提供了從宿主細胞培養物中分離出重組蛛絲蛋白的方法,其包括:獲得細胞培養物,其中所述細胞培養物包含宿主細胞和生長培養基,其中所述宿主細胞表達重組蛛絲蛋白;收集所述細胞培養物的包含所述重組蛛絲蛋白的部分;在堿性條件下將所述細胞培養物的所述部分在水溶液中孵育,從而將所述重組蛛絲蛋白增溶在所述水溶液中;以及從所述水溶液中分離出重組蛛絲蛋白,從而產生分離的重組蛛絲蛋白樣品。
10.在一些實施方案中,堿性條件包括9至14的堿性ph值。在一個實施方案中,堿性ph值是11至12。
11.在一些實施方案中,分離的重組蛛絲蛋白是全長重組蛛絲蛋白。在一個實施方案中,分離的重組蛛絲蛋白樣品包含相對于總的分離的重組蛛絲蛋白的至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%或至少95%的全長重組蛛絲蛋白。在一個實施方案中,全長重組蛛絲蛋白的百分比是用蛋白質印跡法測量的。在另一個實施方案中,全長重組蛛絲蛋白的百分比是用尺寸排阻色譜法測量的。
12.在一些實施方案中,分離的重組蛛絲蛋白的純度為5-10%、10-15%、15-20%、20-25%、25-30%、30-35%、35-40%、45-50%、50-55%、55-60%、60-65%、65-70%、70-75%、75-80%、80-85%、85-90%、90-95%或95-100%。在一些實施方案中,分離的重組蛛絲蛋白的收率相對于通過尿素或硫氰酸胍法分離的重組蛛絲為至少50-55%、55-60%、60-65%、65-70%、70-75%、75-80%、80-85%、85-90%、90-95%或95-100%。
13.在一些實施方案中,分離重組蛛絲蛋白包括通過改變所述水溶液的所述堿性條件來沉淀重組蛛絲蛋白。在一個實施方案中,改變所述堿性條件包括將所述細胞培養物的所述部分的堿性ph值調節至從4至10的降低的ph值。在一個實施方案中,降低的ph值為4、5、6、7、8、9或10的ph值。在一個實施方案中,降低的ph值為從6至7的ph值。
14.在一些實施方案中,調節堿性ph值包括向水溶液中加入酸。在一個實施方案中,酸是h2so4。
15.在一些實施方案中,所述細胞培養物的所述部分包含上清液、全細胞肉湯或細胞團塊。在一些實施方案中,收集所述細胞培養物的所述部分包括從所述生長培養基中移出所述宿主細胞并在所述水溶液中重構所述宿主細胞。
16.在一些實施方案中,收集所述細胞培養物的所述部分包括裂解所述宿主細胞。在許多實施方案中,裂解包括熱處理、剪切破壞、物理勻質化、超聲或化學勻質化。
17.在一些實施方案中,所述細胞培養物的所述部分包含所述宿主細胞和來自所述細胞培養物的所述生長培養基。
18.在各種實施方案中,所述水溶液包含稀釋的生長培養基。
19.在一些實施方案中,其中在堿性條件下孵育所述細胞培養物的所述部分10至120分鐘。在一些實施方案中,在堿性條件下孵育所述細胞培養物的所述部分至少10分鐘、至少15分鐘、至少30分鐘、至少45分鐘、至少60分鐘、至少75分鐘、至少90分鐘、至少105分鐘或至少120分鐘。在一些實施方案中,在堿性條件下孵育所述細胞培養物的所述部分15至30分
鐘。
20.在各種實施方案中,在堿性條件下孵育所述細胞培養物的所述部分進一步包括攪拌所述細胞培養物的所述部分。
21.在各種實施方案中,所述方法進一步包括在堿性條件下從所述水溶液中除去未被增溶的生物質。在一些實施方案中,除去未被增溶的生物質包括過濾、離心、重力沉降、吸附(adsorption)、透析或相分離。在一些實施方案中,過濾是超濾、微濾或透析過濾。在一些實施方案中,其中除去未被增溶的生物質被重復至少一次。
22.在各種實施方案中,所述方法進一步包括在分離重組蛛絲蛋白之前或者在分離重組蛛絲蛋白之后除去雜質。在一些實施方案中,除去雜質包括過濾、離心、重力沉降、吸附、透析或相分離。在各種實施方案中,過濾是超濾、微濾或透析過濾。在一些實施方案中,離心是超速離心或透析離心(diacentrifugation)。在一個實施方案中,吸附是炭吸附。在一些實施方案中,雜質去除被重復至少一次。
23.在各種實施方案中,所述方法進一步包括濃縮分離的重組蛛絲蛋白以產生濃縮的蛛絲蛋白。在一些實施方案中,濃縮包括沉淀、過濾、超濾、離心、透析、蒸發或凍干。
24.在各種實施方案中,所述方法進一步包括干燥分離的重組蛛絲蛋白。
25.在各種實施方案中,所述方法進一步包括由分離的重組蛛絲產生絲纖維。在一個實施方案中,所述絲纖維包括至少19cn/tex的韌性。
26.在一些實施方案中,所述重組蛛絲蛋白為18b或p0。
27.在一些實施方案中,細胞培養物包括真菌細胞、細菌細胞或酵母細胞。
28.在一些實施方案中,酵母細胞是巴斯德畢氏酵母(pichia pastoris)細胞。
29.在另一個方面,本文提供了分離重組蛛絲蛋白的方法,所述方法包括:獲得細胞培養物,其中所述細胞培養物包含宿主細胞和生長培養基,其中所述宿主細胞表達重組蛛絲蛋白;收集所述細胞培養物的包含所述重組蛛絲蛋白的部分;在堿性條件下將所述細胞培養物的所述部分在水溶液中孵育,從而將所述重組蛛絲蛋白增溶在所述水溶液中;調節水溶液至非堿性ph值,從而沉淀所述被增溶的重組蛛絲蛋白;以及從細胞培養物的所述部分中分離出重組蛛絲蛋白,從而產生分離的重組蛛絲蛋白。
30.在另一個方面,本文提供了組合物,其包含通過所公開的方法中的任一種產生的重組蛛絲蛋白。
31.在一些實施方案中,重組蛛絲包含至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或100%的全長重組蛛絲。
32.在另一個方面,本文提供了絲纖維,其包含通過所公開的方法中的任一種產生的重組蛛絲蛋白。
33.在一些實施方案中,絲纖維包括至少19cn/tex的韌性。
34.在另一個方面,本文提供了組合物,其包含在堿性緩沖液中的細胞培養物,所述細胞培養物包含生長培養基和宿主細胞,所述宿主細胞包含重組蛛絲蛋白。
35.在一個實施方案中,堿性緩沖液的ph值為9至14。在另一個實施方案中,ph值為11至12。
36.在一些實施方案中,蛛絲蛋白為18b或p0。在一些實施方案中,細胞培養物包括真菌細胞、細菌細胞或酵母細胞。在一個實施方案中,細菌細胞為大腸埃希菌細胞。在一個實
press,cold spring harbor,n.y.(1990);taylor和drickamer,introduction to glycobiology,oxford univ.press(2003);worthington enzyme manual,worthington biochemical corp.,freehold,n.j.;handbook of biochemistry:section aproteins,第i卷,crc press(1976);handbook of biochemistry:section a proteins,第ii卷,crc press(1976);essentials of glycobiology,cold spring harbor laboratory press(1999)。
51.本文提到的所有公布、專利和其他參考文獻均通過引用以其整體并入本文。
52.以下術語,除非另有規定,否則應被理解為具有以下含義:
53.如本文所用的術語“發酵的”和“發酵”描述了在用于產生期望產物的條件下培養宿主細胞,所述條件包括但不限于宿主細胞生長的條件。
54.如本文所用的術語“發酵肉湯”是指在發酵過程中用于培養宿主細胞的水性培養基。
55.如本文所用的術語“接種物”是指加入到發酵肉湯中以啟動發酵的一定量的宿主細胞。
56.如本文所用的術語“凈化(clarifying)”是指除去宿主細胞生物質的方法,所述宿主細胞生物質諸如全細胞、裂解的細胞、細胞膜、脂質、細胞器、細胞核、非蛛絲蛋白,或任何其他不需要的細胞部分或產物,或細胞培養物的任何其他不需要的部分。凈化也可指從部分純化或分離的蛛絲組合物中除去雜質。雜質可包括但不限于非蛛絲蛋白、降解的蛛絲蛋白、蛋白質的大聚集體、純化和分離過程中使用的化學品,或任何其他不合需要的材料。
57.如本文所用的術語“純度”是指全長的分離的重組蛛絲蛋白在樣品(諸如經提取的樣品)中所有分離出來的組分中所占的百分比,所述所有分離出來的組分諸如部分或降解的分離的重組蛛絲蛋白、脂質、蛋白質、細胞膜或其他分子。
58.如本文所用的術語“收率”是指從細胞培養物中分離出的全長重組蛛絲蛋白的量相對于對照樣品中的全長絲蛋白或總絲蛋白的量的百分比。所述百分比可參照細胞裂解液、粗堿性提取液、部分純化或過濾的堿性提取液、經受堿性提取方法的純化溶液或經受對照提取方法(諸如本文所述的尿素或gdscn)的純化溶液中的全長蛛絲蛋白的總量。
59.術語“多核苷酸”或“核酸分子”是指長度為至少10個堿基的核苷酸的聚合形式。該術語包括dna分子(例如,cdna或基因組dna或合成dna)和rna分子(例如,mrna或合成rna),以及含有非天然核苷酸類似物、非原始核苷間鍵或兩者的dna或rna的類似物。核酸可以呈任何拓撲構象。例如,核酸可以是單鏈、雙鏈、三鏈、四鏈、部分雙鏈、具支鏈、發夾型、環狀或呈掛鎖(padlocked)構象。
60.除非另有規定,并且作為本文中以通用格式“seq id no:”描述的所有序列的實例,“包含seq id no:1的核酸”是指這樣的核酸,其至少一部分具有以下序列:(i)seq id no:1的序列,或者(ii)與seq id no:1互補的序列。兩者之間的選擇由上下文決定。例如,如果核酸被用作探針,則兩者之間的選擇取決于探針與期望靶標互補的要求。
[0061]“分離的”rna、dna或混合聚合物是這樣的rna、dna或混合聚合物,其和與其天然宿主細胞中原始多核苷酸天然伴隨的其他細胞成分,例如與其天然相關聯的核糖體、聚合酶和基因組序列基本分離。
[0062]
術語“重組體”是指這樣的生物分子(例如基因或多肽),其:(1)已從其天然存在的
環境中移出,(2)與在自然界中發現該基因的多核苷酸的全部或部分不相關聯,(3)與在自然界中未和其連接的多核苷酸可操作地連接,或者(4)在自然界中不存在。術語“重組體”可以針對克隆的dna分離物、化學合成的多核苷酸類似物或由異源系統生物合成的多核苷酸類似物以及由此類核酸編碼的多肽和/或mrna使用。
[0063]
如本文所用,如果異源序列與內源核酸序列相鄰放置,使得該內源核酸序列的表達發生改變,則生物體基因組中的該內源核酸序列(或該序列的編碼多肽產物)在本文中被視為“重組體”。在這種背景下,異源序列是與內源核酸序列天然不相鄰的序列,無論該異源序列本身是內源的(源自同一宿主細胞或其后代)還是外源的(源自不同宿主細胞或其后代)。舉例來說,對于宿主細胞的基因組中基因的原始啟動子而言,啟動子序列可以被取代(例如,通過同源重組),使得該基因具有改變的表達模式。該基因現在將變成為“重組體”,因為它和與其自然側接的序列中的至少一些序列分離。在實施方案中,異源核酸分子不與該生物體同源。在進一步的實施方案中,異源核酸分子是通過同源或隨機整合而整合到宿主染色體中的質粒或分子。
[0064]
如果核酸含有基因組中的相應核酸中不會天然存在的任何修飾,則該核酸也被視為“重組體”。例如,如果內源編碼序列含有人工引入,例如通過人為干預引入的插入、刪除或點突變,則該內源編碼序列被視為“重組體”。“重組核酸”還包括在異源位點整合到宿主細胞染色體中的核酸和作為附加體存在的核酸構建體。
[0065]
在核酸序列的背景下,術語“序列同一性百分比”是指當進行最大對應比對時兩個序列中殘基比對的定量值。序列同一性比較的長度可能在一段至少約9個核苷酸,通常至少約20個核苷酸,更通常至少約24個核苷酸,通常至少約28個核苷酸,更通常至少約32個核苷酸,并且優選至少約36個或更多個核苷酸上。本領域已知有許多不同的算法可用于測量核苷酸序列同一性。例如,多核苷酸序列可以使用fasta、gap或bestfit進行比較,它們是genetics computer group(gcg),madison,wis的wisconsin package第10.0版中的程序。fasta提供在查詢序列和搜索序列之間最佳重疊的區域的比對和序列同一性百分比。pearson,methods enzymol.183:63-98(1990)(在此通過引用的方式整體并入)。例如,核酸序列之間的序列同一性百分比可以使用fasta以其默認參數(字長為6以及評分矩陣為nopam因子)或使用如gcg第6.1版(通過引用的方式并入本文)中提供的gap以其默認參數來確定。或者,可以使用計算機程序blast(altschul等人,j.mol.biol.215:403-410(1990);gish和states,nature genet.3:266-272(1993);madden等人,meth.enzymol.266:131-141(1996);altschul等人,nucleic acids res.25:3389-3402(1997);zhang和madden,genome res.7:649-656(1997)),尤其是blastp或tblastn(altschul等人,nucleic acids res.25:3389-3402(1997))對序列進行比較。
[0066]
當涉及核酸或其片段時,術語“實質同源性”或“實質相似性”表示,當與另一種核酸(或其互補鏈)的適當核苷酸插入或刪除作最佳比對時,根據任何公認的序列同一性算法如前面討論的fasta、blast或gap所測量,在至少約76%、80%、85%,優選至少約90%,并且更優選至少約95%、96%、97%、98%或99%的核苷酸堿基上存在核苷酸序列同一性。
[0067]
核酸(也稱為多核苷酸)可包括rna、cdna、基因組dna和前述的合成形式以及混合聚合物的有義鏈與反義鏈。如本領域技術人員將容易理解的,它們可被化學或生物化學修飾或可含有非天然或衍生的核苷酸堿基。此類修飾包括例如標記,甲基化,一個或多個天然
存在的核苷酸被類似物置換,核苷酸間修飾如不帶電荷的連接鍵(例如,甲基膦酸酯類、磷酸三酯類、氨基磷酸酯類、氨基甲酸酯類等)、帶電荷的連接鍵(例如,硫代磷酸酯類、二硫代磷酸酯類等)、懸垂部分(例如,多肽類)、嵌入劑(例如,吖啶、補骨脂素等)、螯合劑、烷基化劑和經修飾的連接鍵(例如,α異頭核酸等)。還包括了通過氫鍵和其他化學相互作用模擬多核苷酸結合至指定序列的能力的合成分子。此類分子是本領域已知的,并且包括例如其中肽連接鍵替代分子主鏈中的磷酸酯連接鍵的那些。其他修飾可以包括,例如,其中核糖環含有橋聯部分或其他結構的類似物,諸如在“鎖定”核酸中發現的修飾。
[0068]
術語“突變的”,當被應用于核酸序列時,是指核酸序列中的核苷酸與參考核酸序列相比可能被插入、刪除或改變。可以在基因座進行單一改變(點突變),或者可以在單個基因座處插入、刪除或改變多個核苷酸。此外,可以在核酸序列內任何數量的基因座處進行一個或多個改變。核酸序列可以通過本領域已知的任何方法進行突變,包括但不限于誘變技術,例如“易錯pcr”(一種在dna聚合酶的復制保真度較低的條件下進行pcr,從而在pcr產物的整個長度上獲得高點突變率的過程;參見例如leung等人,technique,1:11-15(1989)和caldwell&joyce,pcr methods applic.2:28-33(1992));以及“寡核苷酸定向誘變”(一種使得位點特異性突變能夠在任何感興趣的克隆dna節段中產生的過程;參見例如,reidhaar-olson and sauer,science241:53-57(1988))。
[0069]
如本文所用,術語“載體”意指這樣的核酸分子,其能夠運輸已與其連接的另一個核酸。一類載體是“質粒”,其通常是指額外的dna節段可連接到其中的環狀雙鏈dna環,但也包括線性雙鏈分子,例如通過聚合酶鏈反應(pcr)擴增或用限制酶處理環狀質粒而得到的那些。其他載體包括粘粒、細菌人工染色體(bac)和酵母人工染色體(yac)。另一類載體是病毒載體,其中額外的dna節段可被連接到病毒基因組中(在下文中更詳細地討論)。某些載體能夠在引入它們的宿主細胞中自主復制(例如具有在宿主細胞中起作用的復制起點的載體)。其他載體在引入到宿主細胞后可以被整合到宿主細胞的基因組中,從而與宿主基因組一起被復制。此外,某些優選的載體能夠指導與它們可操作地連接的基因的表達。此類載體在本文中被稱為“重組表達載體”(或簡稱為“表達載體”)。
[0070]
如本文所用的術語“表達系統”包括用于使宿主細胞中的基因表達的媒介物或載體以及使基因穩定整合到宿主染色體中的媒介物或載體。
[0071]“操作性地連接的(operatively linked)”或“可操作地連接的(operably linked)”表達控制序列是指其中表達控制序列與感興趣的基因緊鄰以控制感興趣的基因的連接,以及以反式或在一定距離內作用來控制感興趣的基因的表達控制序列。
[0072]
如本文所用的術語“表達控制序列”是如本文所用指影響與它們可操作地連接的編碼序列的表達所必需的多核苷酸序列。表達控制序列是控制核酸序列的轉錄、轉錄后事件和翻譯的序列。表達控制序列包括適當的轉錄起始、終止、啟動子和增強子序列;有效的rna處理信號,例如剪接和聚腺苷酸化信號;穩定細胞質mrna的序列;提高翻譯效率的序列(例如,核糖體結合位點);提高多肽穩定性的序列;以及在需要時,提高多肽分泌的序列。此類控制序列的性質根據宿主生物體的不同而不同;在原核生物中,此類控制序列通常包括啟動子、核糖體結合位點和轉錄終止序列。術語“控制序列”旨在至少包括其存在對于表達是必不可少的所有組分,并且還可以包括其存在是有利的另外的組分,例如前導序列和融合伴侶序列。
biomedical applications,cell.mol.life sci.,68:2,第169-184頁(2011);以及humenik,m.等人,spider silk:understanding the structure-function relationship of a natural fiber,prog.mol.biol.transl.sci.,103,第131-85頁(2011)。例如:
[0084]
葡萄狀腺(acsp)絲趨于具有高韌性,這是適當高的強度與適當高的延展性結合的結果。acsp絲的特征在于大嵌段(“整體重復”)尺寸,其常常摻有聚絲氨酸和gpx的基序。管狀腺(tusp或圓柱形)絲趨于具有大直徑,具有適度的強度和高延展性。tusp絲的特征在于它們的聚絲氨酸和聚蘇氨酸含量,以及短束的聚丙氨酸。大壺狀腺(masp)絲趨于具有高強度和適度的延展性。masp絲可以是兩個亞型:masp1和masp2中的一種。masp1絲的延展性一般比masp2絲小,并且masp1絲的特征在于聚丙氨酸、gx和ggx基序。masp2絲的特征在于聚丙氨酸、ggx和gpx基序。小壺狀腺(misp)絲趨于具有適度的強度和適度的延展性。misp絲的特征在于ggx、ga和poly a基序,且往往含有約100個氨基酸的間隔元件。鞭毛腺(flag)絲趨于具有很高的延展性和適度的強度。flag絲的特征通常在于gpg、ggx和短間隔基序。
[0085]
每個絲類型的特性可以因物種的不同而不同,并且具有不同生活方式(例如,定居紡足目(sedentary web spinner)與漫游獵蛛(vagabond hunter))或進化上更古老的蜘蛛可產生特性與前文描述不同的絲(關于蜘蛛多樣性和分類的描述,參見hormiga,g.和griswold,c.e.,systematics,phylogeny,and evolution of orb-weaving spiders,annu.rev.entomol.59,第487-512頁(2014);以及blackedge,t.a.等人,reconstructing web evolution and spider diversification in the molecular era,proc.natl.acad.sci.u.s.a.,106:13,第5229-5234頁(2009))。然而,與原始絲蛋白的重復結構域具有序列相似性和/或氨基酸組成相似性的合成嵌段共聚物多肽可以用于按商業規模制造重現了相應天然絲纖維的特性的一致的絲狀纖維。
[0086]
絲核苷酸和肽序列
[0087]
可以通過在genbank中檢索相關術語,例如“蛛絲蛋白(spidroin)”、“絲心蛋白(fibroin)”、“masp”來匯編假定絲序列的列表,并且可以將那些序列與通過獨立測序工作獲得的另外的序列匯集在一起。然后將序列翻譯成氨基酸,過濾重復的條目,并手動拆分成結構域(ntd、rep、ctd)。在一些實施方案中,候選氨基酸序列被反向翻譯成經優化用于例如在巴斯德畢氏酵母(巴斯德駒形氏酵母(komagataella pastoris))或大腸埃希菌中進行微生物表達的dna序列。將dna序列各自克隆到表達載體中,并轉化為微生物,諸如巴斯德畢氏酵母(巴斯德駒形氏酵母)或大腸埃希菌。在一些實施方案中,隨后以組合方式組裝顯示出成功表達與分泌的各種絲結構域,以構建能夠形成纖維的絲分子。
[0088]
絲多肽特征性地由側接于非重復區域(例如,c-末端和n-末端結構域)的重復結構域(rep)組成。重復結構域顯示出層次架構。重復結構域包含一系列嵌段(也稱為重復單元)。所述嵌段在整個絲重復結構域中是重復的,有時完美重復,有時不完美重復(構成準重復結構域)。嵌段的長度和組成在不同的絲類型之間以及不同的物種之間有所不同。表1列出了來自所選物種和絲類型的嵌段序列的實例,以下文獻中給出了進一步的實例:rising,a.等人,spider silk proteins:recent advances in recombinant production,structure-function relationships and biomedical applications,cell mol.life sci.,68:2,第169-184頁(2011);以及gatesy,j.等人,extreme diversity,conservation,and convergence of spider silk fibroin sequences,science,291:5513,第2603-2605
頁(2001)。在一些情況下,嵌段可以按規則模式排列,形成在絲序列的重復結構域中出現多次(通常2至8次)的較大宏觀重復體。重復結構域或宏觀重復體內的重復嵌段,以及重復結構域內重復的宏觀重復體,可以由間隔元件分開。嵌段序列可包含富含甘氨酸的區域,其后面是poly a區域。短(約1-10個)氨基酸基序可在嵌段內出現多次。圖1中描繪了通常觀察到的基序的子集。就本發明的目的而言,可以在不參考環狀排列的情況下選擇來自不同天然絲多肽的嵌段(即,絲多肽之間的鑒定出的其他方面相似的嵌段可能因環狀排列而不能對準)。因此,例如,就本發明的目的而言,sgagg的“嵌段”與gsgag相同,并且與gggsa相同;它們全部僅是彼此的環狀排列。針對給定絲序列選擇的特定排列可能尤其由方便性(通常以g開始)決定。從ncbi數據庫獲得的絲序列可以劃分為嵌段和非重復區域。
[0089]
表1:嵌段序列的樣本
[0090]
[0091]
[0092]
[0093]
[0094][0095]
根據本發明某些實施方案的來自嵌段和/或宏觀重復結構域的成纖嵌段共聚物多肽在國際公布第wo/2015/042164號(通過引用的方式并入)中有描述。按照結構域(n-末端結構域、重復結構域和c-末端結構域)對從蛋白質數據庫(例如genbank)或通過從頭測序得到的天然絲序列進行解散。選擇用于合成并且組裝成纖維的n-末端結構域和c-末端結構域序列包括天然氨基酸序列信息和本文所述的其他修飾。重復結構域被分解成重復序列,該重復序列含有代表性的嵌段,該嵌段根據絲的類型,通常為1至8個,該嵌段捕獲關鍵的氨基酸信息,同時將編碼氨基酸的dna的尺寸減小成容易合成的片段。在一些實施方案中,適當形成的嵌段共聚物多肽包含至少一個含有至少1個重復序列的重復結構域,并且任選地側接n-末端結構域和/或c-末端結構域。
[0096]
在一些實施方案中,重復結構域包含至少一個重復序列。在一些實施方案中,重復序列是150至300個氨基酸殘基。在一些實施方案中,重復序列包含多個嵌段。在一些實施方案中,重復序列包含多個宏觀重復體。在一些實施方案中,嵌段或宏觀重復體被分割到多個重復序列中。
[0097]
在一些實施方案中,重復序列以甘氨酸開始,并且不能以苯丙氨酸(f)、酪氨酸(y)、色氨酸(w)、半胱氨酸(c)、組氨酸(h)、門冬酰胺(n)、甲硫氨酸(m)或門冬氨酸(d)結束,以滿足dna組裝要求。在一些實施方案中,重復序列中的一些與原始序列相比可以改變。在一些實施方案中,可以例如通過向多肽的c-末端添加絲氨酸(以避免終止于f、y、w、c、h、n、m或d)來改變重復序列。在一些實施方案中,可通過在不完全嵌段中填充來自另一個嵌段的同源序列來修飾重復序列。在一些實施方案中,可通過重排嵌段或宏觀重復體的順序來修飾重復序列。
[0098]
在一些實施方案中,可以選擇非重復性n-末端結構域和c-末端結構域用于合成。在一些實施方案中,n-末端結構域可以是通過去除例如,如通過signalp(peterson,t.n.等人,signalp 4.0:discriminating signal peptides from transmembrane regions,nat.methods,8:10,第785-786頁(2011)鑒定的前導信號序列。
[0099]
在一些實施方案中,n-末端結構域、重復序列或c-末端結構域序列可以來自漏斗網蜘蛛(agelenopsis aperta)、aliatypus gulosus、哥斯大黎加斑馬腳(aphonopelma seemanni)、短牙蛛某些種(aptostichus sp.as217)、短牙蛛某些種(aptostichus sp.as220)、十字園蛛(araneus diadematus)、貓臉蜘蛛(araneus gemmoides)、大腹圓蛛(araneus ventricosus)、悅目金蛛(argiope amoena)、銀色金蛛(argiope argentata)、橫紋金蛛(argiope bruennichi)、三帶金蛛(argiope trifasciata)、atypoides riversi、巴西黃斑粉趾(avicularia juruensis)、加州陷門蛛(bothriocyrtum californicum)、巨眼蛛(deinopis spinosa)、灰色迪格蛛(diguetia canities)、黑捕魚蛛(dolomedes tenebrosus)、euagrus chisoseus、苗圃網絡蜘蛛(euprosthenops australis)、乳突棘旗蛛(gasteracantha mammosa)、hypochilus thorelli、kukulcania hibernalis、黑寡婦蜘蛛(latrodectus hesperus)、megahexura fulva、metepeira grandiosa、金圓網蛛(nephila antipodiana)、棒絡新婦(nephila clavata)、絡新婦蛛(nephila clavipes)、馬達加斯加新婦(nephila madagascariensis)、斑絡新婦(nephila pilipes)、近絡新婦屬蛛(nephilengys cruentata)、帕拉威夏雙條紋蛛(parawixia bistriata)、綠色猞猁蜘蛛(peucetia viridans)、原始肉食蛛(plectreurys tristis)、印度華麗雨林蛛(poecilotheria regalis)、長爪綠色突光蝴蛛(tetragnatha kauaiensis)或全異嫵蛛(uloborus diversus)。
[0100]
在一些實施方案中,絲多肽核苷酸編碼序列可以與α交配因子核苷酸編碼序列操作性地連接。在一些實施方案中,絲多肽核苷酸編碼序列可以與另一種內源或異源分泌信號編碼序列操作性地連接。在一些實施方案中,絲多肽核苷酸編碼序列可以與3x flag核苷酸編碼序列操作性地連接。在一些實施方案中,絲多肽核苷酸編碼序列與其他親和標記諸如6至8個his殘基操作性地連接。
[0101]
分泌信號
[0102]
從細胞分泌的蛋白質的量在各蛋白質間明顯不同,并且部分依賴于分泌信號,所述分泌信號可操作地連接于其新生狀態的蛋白質。許多分泌信號是本領域已知的,有些信號常用于生產分泌的重組蛋白,包括巴斯德畢氏酵母和釀酒酵母(saccharomyces cerevisiae)的微生物分泌信號。這些中突出的是釀酒酵母的α-交配因子(αmf)的分泌信號,其由n-末端19個氨基酸的信號肽(本文中也稱為pre-αmf(sc)),隨后為70個氨基酸的前
導肽(本文中也稱為pro-αmf(sc))組成。釀酒酵母的αmf的分泌信號中pro-αmf(sc)的納入(本文中也稱為pre-αmf(sc)/pro-αmf(sc))已被證明對實現蛋白質的高分泌收率至關重要。向除pre-αmf(sc)以外的信號肽中添加pro-αmf(sc)或其功能變體也已經作為實現重組蛋白分泌的手段而被探索,但顯示出不同程度的有效性,增加某些重組宿主細胞中某些重組蛋白的分泌,但對其他重組蛋白無影響或減少其他重組蛋白的分泌。
[0103]
如美國申請15/724,196中所述,使用多種不同的分泌信號可以改善宿主細胞(諸如巴斯德畢氏酵母)中產生的重組蛋白的分泌收率。與包含多個編碼僅與一個分泌信號(例如,pre-αmf(sc)/pro-αmf(sc))可操作地連接的重組蛋白的多核苷酸序列的重組宿主細胞相比,包含相同數量的編碼與至少2個不同分泌信號可操作地連接的重組蛋白的多核苷酸序列的重組宿主細胞產生較高的重組蛋白分泌收率。不希望受理論束縛,使用至少2種不同的分泌信號可能允許重組宿主細胞參與不同的細胞分泌途徑以實現重組蛋白的有效分泌,從而防止任何一種分泌途徑過飽和。
[0104]
至少一個不同的分泌信號包括可從表2或表3選擇的信號肽,或者是與選自表2或3的信號肽有至少80%氨基酸序列同一性的功能變體。在一些實施方案中,功能變體是選自表2或3的信號肽,其包含一個或兩個取代的氨基酸。在一些此類實施方案中,功能變體與選自表2或3的信號肽有至少85%、至少90%、至少95%或至少99%的氨基酸序列同一性。在一些實施方案中,信號肽在翻譯后介導新生重組蛋白易位至er中(即,蛋白質合成先于易位,使得新生重組蛋白在易位至er中之前就存在于細胞質中)。在其他實施方案中,信號肽在共翻譯時介導新生重組蛋白易位至er中(即,蛋白質合成和易位至er中同時發生)。使用介導向er中的共翻譯易位的信號肽的優點是防止容易快速折疊的重組蛋白呈現阻礙易位至er中并從而阻礙分泌的構象。
[0105]
表2-分泌信號
[0106][0107]
表3-重組分泌信號
[0108][0109][0110]
表達載體
[0111]
本發明的表達載體可以結合本領域已知的技術根據本說明書的教示內容生產。序列(例如載體序列或編碼轉基因的序列)可從諸如integrated dna technologies,coralville,ia或atum,menlo park,ca的公司商購。本文中舉例說明了指導嵌合絲多肽的高水平表達的表達載體。
[0112]
本發明中使用的多核苷酸的另一個標準來源是從生物體(例如,細菌)、細胞或所選組織中分離出的多核苷酸。來自所選來源的核酸可通過標準程序分離,所述標準程序通常包括連續的苯酚和苯酚/氯仿提取,接著為乙醇沉淀。沉淀后,可用限制性內切核酸酶處理多核苷酸,該酶將核酸分子裂解成片段。所選尺寸的片段可通過包括瓊脂糖或聚丙烯酰胺凝膠電泳或脈沖場凝膠電泳(care等人(1984)nuc.acid res.12:5647-5664;chu等人(1986)science 234:1582;smith等人(1987)methods in enzymology 151:461)在內的多種技術進行分離,以提供適當尺寸的起始物料用于克隆。
[0113]
另一種獲取表達載體或構建體的核苷酸組分的方法是pcr。macpherson等人在pcr:a practical approach,(irl press at oxford university press,(1991))中教示了pcr的一般程序。每個應用反應的pcr條件可通過經驗確定。許多參數影響反應的成功。這
些參數當中有退火溫度和時間,延伸時間(extension time),mg2+和atp濃度,ph值以及引物、模板和脫氧核糖核酸酶的相對濃度。下面在實施例中描述了示例性引物。在擴增后,由此得到的片段可先用瓊脂糖凝膠電泳,接著用溴化乙錠染色和紫外照射顯影進行檢測。
[0114]
另一種獲取多核苷酸的方法是通過酶消化。例如,核苷酸序列可用適宜的識別限制性內切酶消化適當的載體來生成。限制性裂解的片段可通過使用標準技術,在四種脫氧核苷酸三磷酸(dntp)存在下用大腸埃希菌dna聚合酶i(klenow)的大片段處理來鈍端化(blunt ended)。
[0115]
使用本領域眾所周知的方法將多核苷酸插入適宜的骨架,例如,質粒中。例如,插入片段和載體dna可在適宜的條件下與限制性內切酶接觸,以在每個分子上產生可以彼此配對并可用連接酶接合的互補端或鈍端。替代地,合成核酸接頭可連接至多核苷酸的末端。這些合成接頭可含有對應于載體dna中特定限制位點的核酸序列。其他手段是本領域已知和可用的。組分多核苷酸可以使用多種來源。
[0116]
在一些實施方案中,將含有r、n或c序列的表達載體轉化至宿主生物體中用于表達和分泌。在一些實施方案中,表達載體包含分泌信號。在一些實施方案中,表達載體包含終止子信號。在一些實施方案中,表達載體被設計為整合到宿主細胞基因組中,并且包含:靶基因組的同源區域、啟動子、分泌信號、標簽(例如,flag標簽)、終止/polya信號、畢氏酵母的可選擇標記物、大腸埃希菌的可選擇標記物、大腸埃希菌的復制起點以及用于釋放感興趣的片段的限制位點。
[0117]
宿主細胞轉化體
[0118]
提供了用核酸分子或表達蛛絲多肽的載體轉化的宿主細胞及其后代。這些細胞還可以在載體上攜帶本發明的核酸序列,所述載體可以是但不必是自由復制的載體。在本發明的其他實施方案中,核酸已被整合到宿主細胞的基因組中。
[0119]
在一些實施方案中,能夠大規模產生本發明嵌段共聚物多肽的微生物或宿主細胞包括以下的組合:1)產生大(》40kda)多肽的能力;2)在細胞外分泌多肽并規避昂貴的下游細胞內純化的能力;3)大規模地抵抗污染物(諸如病毒和細菌污染物)的能力;以及/或者4)用于生長和處理生物體的現有技術是大規模(1-2000m3)的生物反應器。
[0120]
多種宿主生物體可以被工程化/轉化為包含嵌段共聚物多肽表達系統。用于表達重組絲多肽的優選生物體包括酵母菌、真菌、革蘭氏陰性菌和革蘭氏陽性細菌。在某些實施方案中,宿主生物體為食腺嘌呤芽生葡萄孢酵母(arxula adeninivorans)、棘孢曲霉(aspergillus aculeatus)、泡盛曲霉(aspergillus awamori)、無花果曲霉(aspergillus ficuum)、煙曲霉(aspergillus fumigatus)、日本曲霉(aspergillus japonicus)、構巢曲霉(aspergillus nidulans)、黑曲霉(aspergillus niger)、米曲霉(aspergillus oryzae)、醬油曲霉(aspergillus sojae)、塔賓曲霉(aspergillus tubigensis)、嗜堿芽孢桿菌(bacillus alkalophilus)、解淀粉芽孢桿菌(bacillus amyloliquefaciens)、炭疽芽孢桿菌(bacillus anthracis)、短芽孢桿菌(bacillus brevis)、環狀芽胞桿菌(bacillus circulans)、凝結芽孢桿菌(bacillus coagulans)、燦爛芽孢桿菌(bacillus lautus)、遲緩芽孢桿菌(bacillus lentus)、地衣芽孢桿菌(bacillus licheniformis)、甲醇芽孢桿菌(bacillus methanolicus)、嗜熱脂肪芽孢桿菌(bacillus stearothermophilus)、枯草芽孢桿菌(bacillus subtilis)、蘇云金芽孢桿菌(bacillus thuringiensis)、博伊丁假絲酵
母(candida boidinii)、拉克淖金孢子菌(chrysosporium lucknowense)、大腸埃希菌、禾谷鐮刀菌(fusarium graminearum)、鐮孢霉(fusarium venenatum)、乳酸克魯維酵母(kluyveromyces lactis)、馬克思克魯維酵母(kluyveromyces marxianus)、嗜熱毀絲霉(myceliopthora thermophila)、粗糙鏈孢霉(neurospora crassa)、漢遜酵母(ogataea polymorpha)、沙門柏干酪青霉(penicillium camemberti)、變灰青霉(penicilliumcanescens)、產黃青霉(penicillium chrysogenum)、埃默森青霉(penicillium emersonii)、繩狀青霉(penicillium funiculosum)、灰玫瑰青霉(penicillium griseoroseum)、產紫青霉(penicillium purpurogenum)、婁地青霉(penicillium roqueforti)、白腐真菌(phanerochaete chrysosporium)、安格斯畢氏酵母(pichia angusta)、甲醇畢氏酵母(pichia methanolica)、巴斯德畢氏酵母(巴斯德駒形氏酵母)、多形畢氏酵母(pichia polymorpha)、樹干畢氏酵母(pichia stipitis)、米赫根毛霉(rhizomucor miehei)、微小根毛霉(rhizomucor pusillus)、少根根霉(rhizopus arrhizus)、變鉛青鏈霉(streptomyces lividans)、釀酒酵母(saccharomyces cerevisiae)、西方許旺酵母(schwanniomyces occidentalis)、哈茨木霉(trichoderma harzianum)、里氏木霉(trichoderma reesei)或耶氏解脂酵母(yarrowia lipolytica)。
[0121]
在優選的方面,所述方法涉及培養宿主細胞以使其直接分泌產物,以便容易回收而不需要提取生物質。在一些實施方案中,嵌段共聚物多肽被直接分泌到培養基中以進行收集和處理。
[0122]
工程化宿主細胞系
[0123]
任何適當的宿主細胞系均可用于生產重組蛋白。甲基營養型酵母巴斯德畢氏酵母被廣泛用于重組蛋白的生產。巴斯德畢氏酵母生長至高細胞密度,提供受嚴格控制的甲醇誘導的轉基因表達,并在確定成分培養基(defined media)中高效地分泌異源蛋白質。但是,在巴斯德畢氏酵母菌株的培養過程中,重組表達蛋白可能在其被收集之前被降解,導致產生包含重組表達蛋白質片段的蛋白質混合物以及全長重組蛋白質的收率降低。另一種廣泛使用的重組蛋白生產用細胞系是細菌大腸埃希菌。
[0124]
在一些實施方案中,本文所述的具有降低的蛋白酶活性的經修飾菌株重組表達絲狀多肽序列。在一些實施方案中,絲狀多肽序列是1)通過混合和匹配來源于絲多肽序列的重復結構域而產生的嵌段共聚物多肽組合物,和/或2)由工業可放大的微生物分泌的用于形成有用纖維的具有足夠大尺寸(約40kda)的嵌段共聚物多肽的重組表達。由絲重復結構域片段工程改造的大(約40kda至約100kda)嵌段共聚物多肽(包括來自蜘蛛絲多肽的幾乎所有公布的氨基酸序列的序列)可以在本文所述的經修飾的微生物中表達。在一些實施方案中,絲多肽序列被匹配并設計用于生產能夠形成纖維的高度表達和分泌的多肽。在一些實施方案中,宿主修飾菌株中蛋白酶基因的敲除或蛋白酶活性的降低減少了絲狀多肽的降解。
[0125]
在一些實施方案中,為了減弱巴斯德畢氏酵母中的蛋白酶活性,使編碼這些酶的基因失活或突變以降低或消除活性。這可以通過對所述基因本身進行突變或插入或者通過對基因調節元件進行修飾來完成。這可以通過標準酵母遺傳學技術來實現。此類技術的實例包括通過雙重同源重組進行的基因替代,其中將側接待失活基因的同源區域克隆在側接可選擇標記基因(例如抗生素抗性基因或補充酵母菌株的營養缺陷體的基因)的載體中。
[0126]
替代地,可以對同源區域進行pcr擴增,并將其通過重疊pcr連接至可選擇標記基因。隨后,通過本領域已知的方法例如電穿孔,將此類dna片段轉化為巴斯德畢氏酵母。然后通過標準技術(例如在基因組dna上的pcr或southern印跡),分析在選擇性條件下生長的轉化子以進行基因破壞事件。在替代實驗中,基因失活可以通過單一同源重組來實現,在這種情況下,例如,將所述基因的orf的5'末端克隆在還含有可選擇標記基因的無啟動子載體上。在通過用僅切割靶基因同源片段中載體的限制酶消化來將此類載體線性化后,此類載體被轉化為巴斯德畢氏酵母。通過在基因組dna上的pcr或southern印跡,確認了靶基因位點處的整合。通過這種方式,在基因組中實現載體上克隆的基因片段的復制,生成靶基因基因座的兩個拷貝:第一個拷貝,其中orf不完整,從而導致了縮短的無活性蛋白質的表達(如果有表達的話);以及第二個拷貝,其沒有用于驅動轉錄的啟動子。
[0127]
替代地,使用轉座子誘變來使靶基因失活。可以通過pcr針對靶基因中的插入事件來對此類突變體的文庫進行篩選。
[0128]
工程化/敲除菌株的功能性表型(即缺陷)可以使用本領域已知的技術進行評估。例如,工程化菌株在蛋白酶活性方面的缺陷可以使用本領域已知的多種方法中的任一種,例如生色蛋白酶底物的水解活性的測定、所選蛋白酶的底物蛋白的譜帶位移等來探知。
[0129]
本文所述的蛋白酶活性的減弱可以通過敲除突變以外的機制來實現。例如,期望蛋白酶可通過如下方式經由氨基酸序列變化來減弱:改變核酸序列,將基因置于活性較低的啟動子的控制下,向下調節,表達靶向感興趣的基因的干擾rna、核酶或反義序列,或本領域已知的任何其他技術。在優選的菌株中,在pas_chr4_0584(yps1-1)和pas_chr3_1157(yps1-2)處編碼的蛋白酶的蛋白酶活性通過上述方法中的任一種方法來減弱。在一些方面中,本發明涉及甲基營養型酵母菌株,尤其是其中yps1-1和yps1-2基因已失活的巴斯德畢氏酵母菌株。在一些實施方案中,另外的蛋白酶編碼基因也可以按照本文中提供的方法敲除,以進一步降低該菌株表達的期望蛋白質產物的蛋白酶活性。
[0130]
在某些實施方案中,本文公開的巴斯德畢氏酵母菌株已被修飾以表達絲狀多肽。wo 2015/042164,尤其是第114至134段(通過引用并入本文),提供了生產絲狀多肽的優選實施方案的方法。本文公開了基于源自例如來自于物種橫紋金蛛(argiope bruennichi)的masp2的重組蛛絲蛋白片段序列的合成蛋白質類共聚物。描述了絲狀多肽,其包括兩個至二十個重復單元,其中每個重復單元的分子量大于約20kda。在共聚物的每個重復單元內有超過約60個被組織成許多“準重復單元”的氨基酸殘基。在一些實施方案中,本公開中描述的多肽的重復單元與masp2拖絲蛋白序列具有至少95%的序列同一性。
[0131]
生產和純化重組蛋白的方法
[0132]
本文提供的方法包括在合適的發酵條件下,在合適的發酵肉湯和合適的發酵容器中發酵本文提供的重組宿主細胞的接種物,以生產期望累積收率和/或累積滴度和/或累積生產率的重組蛋白。
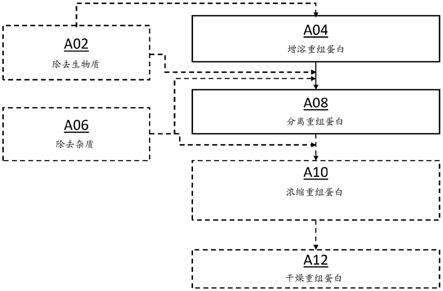
[0133]
在一些實施方案中,重組宿主細胞分泌重組蛋白。在各種實施方案中,重組宿主細胞可為不分泌重組蛋白的原核生物。在具體實施方案中,重組宿主細胞為大腸埃希菌。
[0134]
在各種實施方案中,重組宿主細胞可為分泌重組蛋白的真核生物或分泌重組蛋白的原核生物,諸如革蘭氏陰性細菌或革蘭氏陽性細菌。在一些實施方案中,重組宿主細胞為巴斯德畢氏酵母。在具體實施方案中,重組宿主細胞為一種或多種蛋白酶的活性喪失(例
如,通過功能性敲除)的巴斯德畢氏酵母菌株。此外,下面討論的特定實施方案適合于生產重組疏水性或部分疏水性蛋白,諸如絲蛋白。
[0135]
通過引用并入本文的美國專利9,963,554,“methods and compositions for synthesizing improved silk fibers”公開了合成嵌段共聚物的組合物、用于它們的生產的重組微生物以及包含所述蛋白質的合成纖維。通過引用并入本文的美國專利申請15/724,196,“modified strains for the production of recombinant silk”公開了被選擇為或被基因工程化為減少由酵母細胞表達的重組蛋白的降解的工程化巴斯德畢氏酵母細胞,以及培養酵母細胞用于生產有用的化合物的方法。可以培養包括大腸埃希菌在內的其他適當的微生物菌株并將其用于生產有用的化合物。
[0136]
發酵
[0137]
在一些實施方案中,重組宿主細胞的接種物可以源自種子菌株(即一系列用于產生適當數量的重組宿主細胞的體積不斷增大的發酵物)。根據該實施方案,種子的數量范圍可為2-7、3-7、3-6或3-5個種子。
[0138]
在一些實施方案中,重組宿主細胞的接種物每升培養基的干細胞重量(dcw)為至少0.2g/l、至少0.5g/l、至少0.7g/l、至少0.8g/l、至少1g/l、至少2g/l、至少3g/l、至少4g/l或至少5g/l;在0.2g/l和3g/l之間、0.2g/l和2g/l之間或0.2g/l和1g/l之間;在0.5g/l和3g/l之間、0.5g/l和2g/l之間或0.5g/l和1g/l之間;在1g/l和3g/l之間、1g/l和2g/l之間或0.5g/l和1g/l之間;或在3g/l和1g/l之間。dcw可用生物光度計(例如,eppendorf bio photometer d30)測定。
[0139]
在大多數實施方案中,接種物的量將取決于發酵容器的尺寸。在發酵容器尺寸小于150l的實施方案中,dcw可在0.1g/l-0.5g/l的范圍內。在發酵容器尺寸大于150l的實施方案中,dcw可在2-4g/l的范圍內。
[0140]
根據具體實施方案,合適的發酵肉湯是其中重組宿主細胞可以生存(即維持生長和/或活力)的任何發酵肉湯。合適的發酵肉湯的非限制性實例包括包含重組宿主細胞的生長和/或活力所需的營養物的水性培養基。此類營養物的非限制性實例包括碳源、氮源、磷酸鹽源、鹽類、礦物質、堿、酸、維生素(例如,生物素)、氨基酸和金屬(例如,鐵、鋅、鈣、銅、鈉、鉀、鈷、鎂、錳)。
[0141]
在一些實施方案中,可以限制以上營養物中的任一種以抑制細胞生長并改善重組蛋白的生產率、收率或滴度。碳源可為能夠被重組宿主細胞發酵的任何碳源。合適的碳源的非限制性實例包括單糖、二糖、多糖、醋酸鹽、乙醇、甲醇、甲烷及其組合。單糖的非限制性實例包括右旋糖(葡萄糖)、果糖、半乳糖、木糖、阿拉伯糖及其組合。二糖的非限制性實例包括蔗糖、乳糖、麥芽糖、海藻糖、纖維二糖及其組合。多糖的非限制性實例包括淀粉、糖原、纖維素及其組合。
[0142]
氮源可為能夠被重組宿主細胞同化(即,代謝)的任何氮源。合適的氮源的非限制性實例包括富含空氣或氧氣的無水氨、硫酸銨、硝酸銨、磷酸二銨、磷酸一銨、多聚磷酸銨、硝酸鈉、尿素、蛋白胨、蛋白水解物、酵母提取物和以上任一種。
[0143]
在一些實施方案中,任何或所有營養物在添加到發酵肉湯中之前,都可利用熱量或臭氧化進行滅菌,目的是減少或消除微生物污染。例如,碳源可在添加到發酵肉湯中之前用熱量進行焦糖化或滅菌。類似地,碳源可在添加到發酵肉湯中之前進行臭氧化。dziugan
等人“ozonation as an effective way to stabilize new kinds of fermentation media used in biotechnological production of liquid fuel additives,biotechnology for biofuels,9:150(2016)”中討論了臭氧化的合適方法。
[0144]
發酵肉湯可包含酸或堿以調節和/或維持ph值。在一些此類實施方案中,ph值在4.0和8.0、7.5、7.0、6.5、6.0、5.5、5.0或4.5之間;在4.5和8.0、7.5、7.0、6.5、6.0、5.5或5.0之間;在5.0和8.0、7.5、7.0、6.5、6.0或5.5之間;在5.5和8.0、7.5、7.0、6.5或6.0之間;在6.0和8.0、7.5、7.0或6.5之間;在6.5和8.0、7.5或7.0之間;在7.0和8.0或7.5之間;或在7.5和8.0之間。
[0145]
合適的酸的非限制性實例包括門冬氨酸、醋酸、鹽酸和硫酸。合適的堿的非限制性實例包括氫氧化鈉、氫氧化鉀、氫氧化鈣、氫氧化銨、碳酸鈣、氨和磷酸二銨。在一些實施方案中,使用強酸或強堿限制發酵肉湯的稀釋。
[0146]
在一些實施方案中,發酵肉湯包含使期望攝氧速率(our)得以達到和/或維持的此類營養物或此類量的此類營養物。在一些此類實施方案中,期望our為至少40mmol o2/l/hr、至少80mmol o2/l/hr、至少100mmol o2/l/hr、至少105mmol o2/l/h、至少110mmol o2/l/h、至少115mmol o2/l/h、至少120mmol o2/l/hr,or at least 140mmol o2/l/hr、至少160mmol o2/l/hr、至少180mmol o2/l/hr、至少200mmol o2/l/hr或至少220mmol o2/l/hr;在40mmol o2/l/hr和220mmol o2/l/hr之間、60mmol o2/l/hr和220mmol o2/l/hr之間、80mmol o2/l/hr和220mmol o2/l/hr之間或100mmol o2/l/hr和220mmol o2/l/hr之間;在100mmol o2/l/hr和140mmol o2/l/hr之間、100mmol o2/l/hr和135mmol o2/l/hr之間、100mmol o2/l/hr和130mmol o2/l/hr之間或100mmol o2/l/hr和125mmol o2/l/hr之間;在110mmol o2/l/hr和125mmol o2/l/hr之間或110mmol o2/l/hr和120mmol o2/l/hr之間;或在115mmol o2/l/hr和120mmol o2/l/hr之間。our可由本領域的普通技術人員利用bioreaction engineering principles第3版,2011,spring science+business media,第449頁中描述的直接法進行計算。
[0147]
在一些實施方案中,發酵肉湯包含使重組宿主細胞的重組蛋白產量相對于副產物的產量增加的此類營養物或此類量的營養物。此類副產物的非限制性實例包括乙醇。在一些實施方案中,在72小時的發酵中,重組宿主細胞產生乙醇的累積收率低于0.1g/l、低于1g/l、低于5g/l、低于10g/l或低于15g/l;在0.1g/l和15g/l之間、1g/l和15g/l之間、5g/l和15g/l之間、10g/l和15g/l之間或0.5g/l和15g/l之間;或在0.1g/l和1.5g/l之間、0.2g/l和1.5g/l之間、0.5g/l和1.5g/l之間、0.7g/l和1.5g/l之間或1.0g/l和之間1.5g/l之間。
[0148]
在一些實施方案中,發酵肉湯包含使期望溶氧(do)含量得以達到和/或維持的此類營養物或此類量的此類營養物。在一些此類實施方案中,期望do含量為至少2%、5%、10%、20%、30%、40%、50%、60%、70%、80%或100%;或在2%和40%之間、2%和5%之間、5%和40%之間、2%和20%之間、5%和20%之間、2和15%之間或5%和15%之間。
[0149]
在一些實施方案中,發酵肉湯包含使期望呼吸商(rq;即,產生的二氧化碳與消耗的氧氣的比率)得以達到和/或維持的此類營養物或此類量的此類營養物。在一些此類實施方案中,期望rq為低于2、低于1.75、低于1.5或低于1.25;或在1和1.1之間、1和1.2之間、1和1.3之間、1和1.4之間或1和1.5之間。
[0150]
在一些實施方案中,發酵肉湯包含使期望的重組宿主細胞倍增時間得以達到和/
或維持的此類營養物或此類量的此類營養物。在某些此類實施方案中,期望的倍增時間為至少4小時、8小時、12小時、16小時、18小時、22小時、26小時、30小時、34小時或36小時;或者在4小時和12小時之間、4小時和10小時之間、4小時和8小時之間、6小時和12小時之間、6小時和10小時之間或6小時和8小時之間。
[0151]
在一些實施方案中,發酵肉湯包含一種或多種補充蛋白質。在重組宿主細胞分泌重組蛋白的實施方案中,此類補充蛋白的添加可起到使蛋白酶活性從重組宿主細胞產生的重組蛋白上轉移出去的作用。補充蛋白質的非限制性實例包括:牛血清白蛋白(bsa)和酪蛋氨基酸。其他補充蛋白質為本領域眾所周知。
[0152]
營養物可以一次大劑量、遞增地或連續地添加到發酵肉湯中。在連續添加營養物的實施方案中,它們可以按快、慢或指數速度添加。
[0153]
在向發酵肉湯中連續添加營養物的實施方案中,可以通過連續添加含有營養物的培養基來添加營養物。在這些實施方案中,可將等體積的來自發酵肉湯的水性培養基從發酵物中除去,以使發酵肉湯的總體積保持不變。在一些實施方案中,可將重組宿主細胞從發酵肉湯中移出,并重新添加到含有所述營養物的培養基中,之后添加到發酵肉湯中。
[0154]
合適的發酵容器是其中重組宿主細胞可以生存(維持生長和/或活力)的任何發酵容器。合適的發酵容器的非限制性實例包括培養板、小瓶、燒瓶或發酵罐。合適的發酵罐的非限制性實例包括攪拌釜發酵罐、氣升式發酵罐、鼓泡塔反應器、固定床生物反應器及其任何組合。
[0155]
合適的發酵條件是重組宿主細胞可以生存(維持生長和/或活力)的任何條件。此類發酵條件的非限制性實例包括發酵肉湯的合適體積、發酵肉湯的合適ph值、發酵肉湯中合適的do、合適的溫度、合適的氧合、合適的重組宿主細胞攪動和合適的發酵持續時間。
[0156]
在各種實施方案中,合適的溫度可為適合于重組宿主細胞的生長和/或活力以及/或者重組蛋白生產的任何溫度。在一些實施方案中,所述溫度為至少15℃、20℃、25℃、30℃、35℃;在15℃至35℃之間、15℃至25℃之間、15℃至20℃之間、20℃至35℃之間、20℃至30℃之間、20℃至25℃之間、25℃至35℃之間或25℃至30℃之間。
[0157]
合適的氧合可為適合于重組宿主細胞的生長和/或活力以及/或重組宿主細胞生產的任何氧合。此類氧合可通過為發酵容器和/或發酵肉湯提供合適的曝氣(aeration)和/或合適的攪拌來實現。在一些實施方案中,所述合適的曝氣為至少1.5vvm、至少1.6vvm、至少1.7vvm、至少1.8vvm、至少1.9vvm或至少2vvm;在1.5vvm和2vvm之間、1.5vvm和1.9vvm之間、1.5vvm和1.8vvm之間、1.5vvm和1.7vvm之間、1.5vvm和1.6vvm之間、1.6vm和2vvm之間、1.7vvm和2vvm之間、1.8vvm和2vvm之間或1.7vvm和1.9vvm之間。
[0158]
根據實施方案和發酵類型,發酵肉湯中重組宿主蛋白的合適攪拌可以改變。
[0159]
根據實施方案,可使用鼓泡塔進行曝氣。鼓泡塔的復雜性可基于具體實施方案而改變(例如,可為單相或多相),并且可以提供各種氣體速度。合適的氣體速度的非限制性實例包括但不限于0.003-0.08m/s。鼓泡式反應器的非限制性實例參見kantarci等人“bubble column reactors,process biochemistry 40:2263
–
2283(2005)”。
[0160]
在一些實施方案中,發酵肉湯包含用于在發酵過程中減少泡沫的劑(“消泡劑”)。如本文所定義的泡沫是氣體在位于發酵容器頂部或頂部附近的連續液相中的分散體。根據實施方案,消泡劑可被選擇并優化為減少與任何重組蛋白產物的相互作用。消泡劑的非限
制性實例包括基于硅的油、乳液和聚合物;聚丙二醇;基于聚乙二醇的消泡劑;基于聚亞烷基二醇的消泡劑;二官能環氧乙烷/環氧丙烷(eo/po)嵌段共聚物;基于脂肪酸的消泡劑;基于聚酯的消泡劑、基于油的消泡劑以及前述的任何組合。junker“foam and its mitigation in fermentation systems,biotechnol.prog.,23:767-784(2007)”中討論了合適的消泡劑。在重組蛋白為疏水性蛋白質(諸如絲蛋白)的實施方案中,消泡劑可被選擇為使得它增溶或不增溶疏水性蛋白質。
[0161]
重組蛋白的期望累積收率可為促成低生產成本的任何累積收率。如本文所用,累積收率計算為生產的重組蛋白的質量占發酵過程中重組宿主細胞代謝的碳源質量的百分比(即,提供的碳源質量減去發酵肉湯中剩余的碳源質量;例如,如果向重組宿主細胞中提供100克葡萄糖,并且在發酵結束時生產了25克重組蛋白,并剩余10克葡萄糖,則重組蛋白的累積收率為27.7%)。假定所有其他指標相等,則較高的累積收率與較低的累積收率相比提供較低的生產成本。在一些實施方案中,發酵72小時后按碳源計重組絲蛋白的累積收率為至少1%、至少5%、至少30%或至少100%;在1%和5%之間、5%和10%之間、10%和35%之間、35%和50%之間或50%和100%之間。
[0162]
重組蛋白的期望累積滴度可為促成低生產成本的任何累積滴度。如本文所用的累積滴度計算為發酵過程中每升發酵肉湯生產的重組蛋白克數(即,g/l)。假定所有其他指標相等,則較高的累積滴度與較低的累積滴度相比提供較低的生產成本。在一些實施方案中,發酵72小時后重組蛋白的累積滴度為至少2g/l、至少5g/l、至少15g/l或至少30g/l;在1g/l和100g/l、5g/l、15g/l或30g/l之間;在10g/l和100g/l、80g/l或75g/l之間;或在5g/l和30g/l之間。
[0163]
重組蛋白的期望累積生產率可為促成低生產成本的任何累積生產率。如本文所用,累積生產率計算為發酵過程中每小時每升發酵肉湯生產的重組蛋白克數(即,g/l/hr)。假定所有其他指標相等,則較高的累積生產率與較低的累積生產率相比提供較低的生產成本。在一些實施方案中,重組蛋白的累積生產率為至少0.001g/l/hr、至少0.025g/l/hr、至少0.05g/l/hr、至少0.1g/l/hr或至少0.2g/l/hr;在0.001g/l/hr和0.5g/l/hr之間。
[0164]
本文提供的方法可在任何發酵規模和/或根據本領域已知的任何發酵程序執行。發酵程序可為分批進料、分批、連續或其任何組合。在一些實施方案中,所述方法從一個或多個分批發酵開始,隨后進行一個或多個連續發酵,其中重組宿主細胞的接種物、合適的發酵肉湯、合適的發酵容器和/或一個或多個合適的發酵條件在一個或多個分批發酵和/或一個或多個連續發酵之間可能不同。在一些實施方案中,分批發酵的溫度高于連續發酵的溫度。在一些此類實施方案中,分批發酵的溫度高于27℃,而連續發酵的溫度低于27℃。
[0165]
在一些實施方案中,發酵為分階段進行。此類階段可包括生長階段、生產階段和/或回收階段。在一些實施方案中,各階段在重組宿主細胞的接種物、合適的發酵肉湯、合適的發酵容器和/或一個或多個合適的發酵條件方面彼此不同。
[0166]
分離重組蛋白的方法
[0167]
根據實施方案,可使用各種方法分離和回收感興趣的重組蛋白。如以上所討論,這些方法中的一些而不是全部特定于分泌感興趣的重組蛋白的重組宿主細胞。此外,這些方法中一些方法特定于疏水性的感興趣重組蛋白。
[0168]
圖1描繪了根據本發明的一個實施方案的分離重組蛋白的工藝流程。本領域的技
術人員將理解,圖1中所示的一些步驟可以交替順序和/或重復執行。本領域的技術人員將認識到,所公開的實施方案并不打算限制本文所提供方法的范圍,并且所述方法可以基于所使用的重組宿主細胞、期望累積收率、累積滴度和/或累積生產率或其他因素而變化。
[0169]
在可選步驟a02中,從包含重組宿主細胞的發酵物中除去生物質(即完整或被破壞的重組宿主細胞和細胞碎片)。在各種實施方案中,除去生物質還可以包括除去不溶性發酵雜質(諸如,例如,消泡劑和蛋白質增溶過程中可能已沉淀的其他發酵肉湯組分)。
[0170]
在各種實施方案中,除去生物質可基于尺寸、重量、密度或其組合而完成。基于尺寸除去生物質可使用例如壓濾機、燭式過濾機或其他工業上使用的分子量截留值小于重組宿主細胞尺寸的過濾系統通過過濾來完成。基于重量或密度除去生物質可使用例如沉降器、低g力傾析式離心機、碟片分離器(disk stack separator)、2相噴嘴離心機、固體噴射離心機或旋液分離器通過重力沉降或離心來完成。如本文所公開的除去生物質產生包含蛋白質的離心液(即,輕相或透明的細胞肉湯)和包含生物質及不溶性發酵雜質的固體(重相)。可使用本領域已知的方法來確定用于除去生物質的合適條件(例如,g-力、沉降時間、離心時間、離心機輸入物中的固體%、離心機進料速率),旨在盡可能減少透明細胞肉湯中的生物質和不溶性發酵雜質。在一些實施方案中,除去生物質提供了濕填充固體體積低于5%、低于1%、低于0.5%或低于0.1%的透明細胞肉湯。在一些實施方案中,除去生物質提供了包含蛋白質的濃度在1g/l和50g/l之間的透明細胞肉湯。在一些實施方案中,使透明細胞肉湯經受精密(polishing)離心以除去剩余固體。在一些實施方案中,使由除去生物質獲得的固體再經受至少一輪的蛋白質增溶和生物質去除,其中最終合并所有離心液以根據本文提供的方法進行進一步處理。
[0171]
根據實施方案,步驟a02可在步驟a04之前和/或之后執行。步驟a02可執行數次。例如,可在步驟a04之前和/或之后執行數輪離心和/或過濾以除去生物質。
[0172]
在步驟a04中,對重組蛋白質增溶。在一些未執行步驟a02的實施方案中,重組蛋白可在增溶前與重組宿主細胞一起分離,方法是將重組宿主細胞和與重組宿主細胞相關聯的重組蛋白離心成生物質團塊(以下簡稱“細胞團塊”)并棄去上清液。這個步驟在重組蛋白不能溶解和/或與自身和/或重組宿主細胞聚集和/或粘附至重組宿主細胞表面上的情況下可能是有益的。在其他實施方案中,在全細胞肉湯中增溶重組蛋白。在一些實施方案中,將重組蛋白增溶在通過執行步驟a02產生的透明細胞肉湯中。
[0173]
在一些實施方案中,增溶重組蛋白可通過添加增溶劑至全細胞肉湯、透明細胞肉湯或細胞團塊中來完成。合適的增溶劑的非限制性實例包括表面活性劑、助水溶物、sds、尿素、半胱氨酸、硫氰酸胍、水解多糖的酶(例如,葡聚糖酶、溶細胞酶、甘露糖酶、甲殼酶)、高ph值水(ph值為11-12的h2o),或其他已知離液劑。不同類型的重組蛋白可選擇不同的增溶劑。增溶蛋白質的合適條件(例如,提取劑的類型和量、溫度、孵育時間、攪拌和ph值)可使用本領域已知的方法來確定,旨在使重組蛋白的收率最大化并使重組宿主細胞的裂解和雜質的增溶最小化。如上所討論,在重組蛋白不能溶解和/或與自身聚集和/或聚集在重組宿主細胞中或附近的特定實施方案中,可對重組宿主細胞進行離心并且可丟棄上清液,然后才將增溶劑添加至團塊中。
[0174]
在一些實施方案中,可使用各種技術對重組宿主細胞的細胞膜進行穿孔或透化,以便在增溶和/或沉淀之前從細胞膜中除去過量的蛋白質。此類方法包括化學破壞、機械破
壞或超聲。細胞膜的機械破壞包括勻質化、剪切力、冷凍/解凍、加熱、加壓、超聲和過濾。化學破壞包括洗滌劑(諸如triton、十二烷基硫酸鈉)或離液劑(諸如尿素和胍)。其他方法為本領域眾所周知。
[0175]
在具體實施方案中,使用尿素作為增溶劑來增溶重組蛋白并防止破壞重組宿主細胞。可以改變尿素濃度以防止重組宿主細胞被破壞。根據實施方案,尿素濃度的量可在4m至10m的范圍內。在各種實施方案中,可將重組宿主細胞和重組蛋白與尿素一起孵育1-2小時、1-3小時或1-4小時。根據實施方案,使用其他已知的離液劑諸如硫氰酸胍來增溶重組蛋白。
[0176]
在具體實施方案中,使用高ph值h2o或水性緩沖液增溶重組蛋白并防止破壞重組宿主細胞。可以改變高ph值h2o或水性緩沖液的ph值以防止重組宿主細胞被破壞。根據實施方案,高ph值h2o的ph值范圍可為ph 10至ph 12.5、ph 10.5至ph 12.5、ph 11至ph 12.5、ph 11.5至ph 12.5、ph 12至ph 12.5、ph 10至ph 12、ph 10.5至ph 11.0、ph 10.5至ph 11.5、ph 10.5至ph 12、ph 10.5至ph 12.5、ph 11至ph 11.5,ph 11至ph 12、ph 11.5至ph 12.5或ph 12至ph12.5。在各種實施方案中,可將重組宿主細胞和重組蛋白與高ph值h2o一起孵育至少10分鐘、至少15分鐘、至少30分鐘、至少45分鐘、至少60分鐘、至少75分鐘、至少90分鐘、至少115分鐘或至少120分鐘。
[0177]
在具體實施方案中,使用勻質化來裂解宿主細胞。勻質化壓力(psi)可在5,000-100,000psi之間、5,000-10,000psi之間、10,000-20,000psi之間、20,000-30,000psi之間、30,000-40,000psi之間、40,000-50,000psi之間、50,000-60,000psi之間、60,000-70,000psi之間、70,000-80,000psi之間、80,000-90,000psi之間、90,000-100,000psi之間。勻質化可為單次通過或多次通過。在一些實施方案中,勻質化為一次通過、兩次通過、三次通過、四次通過或五次通過。
[0178]
在步驟a06中,從發酵物中除去雜質。步驟a06可在步驟a04和/或步驟a08之前和/或之后執行。步驟a06可重復任何次數。從發酵物中除去雜質可通過過濾、吸收(absorption)(例如炭吸收或固態吸收)、透析和通過凝聚或使用各種化學品誘導的相分離來完成。在通過凝聚誘導相分離的實施方案中,可通過將發酵物冷卻至足以誘導相分離的溫度來誘導凝聚。在其他實施方案中,可通過添加結構制造劑(cosmotrope)和/或用于使蛋白質從溶液中沉淀出來的化合物來化學誘導相分離。下面針對圖c描述了使用相分離去除雜質的詳細實施方案。在其中重組蛋白具有熱穩定性的一些實施方案中,其他蛋白質可通過使發酵物經受高溫以使其他蛋白質變性并離心以使變性的蛋白與溶液中的蛋白質分離來除去。
[0179]
在一些實施方案中,使用過濾、微量過濾、透析過濾和/或超濾(例如,針對去離子水)除去雜質。適合于微量過濾的膜可包括0.1um至1um。合適的超濾用膜的非限制性實例包括具有以下分子量截留值的疏水性膜(例如,pes、ps、醋酸纖維素):在50kda和800kda之間、100kda和800kda之間、200kda和800kda之間、300kda和800kda之間、400kda和800kda之間、500kda和800kda之間、600kda和800kda之間,700kda和800kda之間、100kda和700kda之間、200kda和700kda之間、300kda和700kda之間、400kda和700kda之間、500kda和700kda之間、600kda和700kda之間或500kda和600kda之間。在一些實施方案中,超濾可得到作為保留物的在水中的重組蛋白漿液以及包含雜質的滲透物。合適的超濾條件(例如,膜、溫度、體積置換)可使用本領域已知的方法來確定,旨在使滲透物密度最大化。在一些實施方案中,超濾
提供了密度在1g/ml和30g/ml之間的保留物。在一些實施方案中,超濾包括濃縮步驟(其產生濃縮保留物),接著為透析過濾步驟(其除去雜質并產生在水中的懸浮蛋白漿液)。在一些此類實施方案中,濃縮保留物具有體積相對于起始體積減小介于2倍和12倍之間的濃縮因子。在一些實施方案中,透析過濾提供介于3倍和10倍之間的恒定體積置換。
[0180]
根據實施方案和待除去的雜質類型,除去雜質的方法可能不同。從分離的重組蛋白中除去脂質雜質可通過本領域已知的方法來完成。此類方法的非限制性實例包括對炭或其他特異性地結合脂質的吸收介質的吸收。從分離的重組蛋白中除去多糖雜質可通過本領域已知的方法來完成。此類方法的非限制性實例包括用水解多糖的酶處理,接著除去通過超濾產生的小糖類。此類酶的非限制性實例包括葡聚糖酶、溶細胞酶、甘露糖酶和甲殼酶。
[0181]
在步驟a08中,分離被增溶的重組蛋白質。對重組蛋白質增溶。被增溶的重組蛋白可用多種不同的方法來分離,所述方法包括使用提取緩沖液、尺寸排阻色譜法、凝膠過濾、超聲蛋白提取和離子交換色譜法。在其中在可選步驟a02中未除去生物質的一些實施方案中,重組蛋白可與重組宿主細胞一起分離。
[0182]
在一些實施方案中,重組蛋白是作為單個分離步驟或作為單個分離步驟外加其他分離步驟來沉淀。沉淀被增溶的重組蛋白可通過向發酵物中添加沉淀劑來完成。此類沉淀劑的非限制性實例包括硫酸根離子(例如,硫酸銨、硫酸鈉、硫酸)或枸櫞酸根離子(例如,枸櫞酸鈉)。在一些實施方案中,沉淀劑為酸。在一些實施方案中,沉淀劑為鹽。在一個實施方案中,沉淀劑為h2so4。
[0183]
可使用任何適當的酸來調節或改變包含被增溶的重組蛋白的溶液的ph值。適宜的酸包括礦物酸,諸如鹽酸(hcl)、硫酸(h2so4)、硝酸(hno3)、硼酸(h3bo3)、磷酸(h3po4)、氫氟酸(hf)、氫溴酸(hbr)、高氯酸(hclo4)、氫碘酸(hi);有機酸,諸如檸檬酸、甲酸、乙酸、丙酸、丁酸、戊酸(valeric acid)、己酸(caprioc acid)、草酸、乳酸、蘋果酸、苯甲酸、碳酸、尿酸、牛磺酸、對甲苯磺酸、三氟甲磺酸、氨甲基膦酸和2,2,2,-三氯乙酸(tca);或其任何組合或本領域已知的其他適宜的酸。還可以使用上面所公開的酸中任一種酸的酸鹽。
[0184]
在一些實施方案中,重組蛋白是在ph 4-10的條件下沉淀的。在一些實施方案中,沉淀在ph 4、5、6、7、8、9或10下進行。在一些實施方案中,沉淀在至少ph 4、至少ph 4.5、至少ph 5、至少ph5.5、至少ph 6、至少ph 6.5、至少ph 7、至少ph 7.5、至少ph 8、至少ph 8.5、至少ph 9、至少ph 9.5、至少ph 10下進行。在一個實施方案中,沉淀在ph 7下進行。在一些實施方案中,沉淀在ph 4-5、ph 5-6、ph 6-7、ph 7-8、ph 8-9或ph 9-10下進行。
[0185]
沉淀可根據需要重復一次、兩次或許多次。在一些實施方案中,執行超過一個沉淀步驟,并且每次沉淀的ph值相同。在其他實施方案中,執行超過一個沉淀步驟,并且每次沉淀的ph值不同。例如,第一次沉淀可在ph 4下執行,然后第二次沉淀可在ph 7下執行。
[0186]
如本文所公開,分離沉淀的重組蛋白可基于尺寸、重量、密度或其組合來完成。在一些實施方案中,此類分離提供了作為保留物的懸浮的重組蛋白漿液和包含廢棄物的滲透物。用于沉淀重組蛋白(例如,添加二價陰離子前的稀釋、二價陰離子的類型和量、孵育溫度、孵育時間)和分離沉淀的重組蛋白的合適條件可使用本領域已知的方法來確定,旨在將懸浮的重組蛋白漿液中重組蛋白的收率最大化。在一些實施方案中,懸浮的絲蛋白漿液中沉淀的重組蛋白的收率在20%和99%之間。在一些實施方案中,懸浮的絲蛋白漿液具有介于30%和65%之間的濕填充固體含量。在一些實施方案中,懸浮的絲蛋白漿液包含絲蛋白,
其濃度介于10g/l和50g/l之間。在一些實施方案中,沉淀絲蛋白和分離沉淀絲蛋白的步驟至少重復一次(使用相同或不同的工藝條件)以進一步洗去水溶性雜質。
[0187]
在可選步驟a10中,濃縮分離的重組蛋白。濃縮分離的重組蛋白可通過在高溫和/或減壓(例如,部分真空)下蒸發來完成。用于濃縮分離的重組蛋白的合適條件(例如,溫度、壓力、持續時間)可使用本領域已知的方法來確定,旨在獲取具有增加的干固體含量的分離的重組蛋白。在一些實施方案中,濃縮提供了原始體積的介于20%和70%之間的體積減小。在一些實施方案中,濃縮提供了包含介于3%和20%之間的干固體的濃縮的分離重組蛋白。
[0188]
在可選步驟a12中,干燥分離的重組蛋白。干燥懸浮的絲蛋白漿液以獲得絲蛋白粉末可通過噴霧干燥、滾筒干燥器、凍干或流化床干燥來完成。在一些實施方案中,該粉末具有小于10%、小于9%、小于8%、小于6%、小于5%、小于4%、小于3%、小于2%或小于1%的水分含量。
[0189]
圖2描繪了根據本發明的一個實施方案的分離重組蛋白的工藝流程。本領域的技術人員將理解,圖2所示的一些步驟可以按照交替順序和/或重復進行。本領域的技術人員將認識到,所公開的實施方案并不打算限制本文所提供方法的范圍,并且所述方法可以基于所使用的重組宿主細胞、期望累積收率、累積滴度和/或累積生產率或其他因素而變化。
[0190]
在步驟b05中,裂解和/或以其他方式破壞重組宿主細胞,以使得重組宿主細胞的內容物釋放到發酵物中。根據實施方案,重組宿主細胞可使用各種不同的方法進行破壞。裂解和/或破壞宿主細胞的合適方法包括:使用熱量諸如高溫短時(htst)方法、高剪切細胞破壞、物理勻質化和化學勻質化等。
[0191]
在可選步驟b04中,如上面針對步驟a04所描述的那樣對重組蛋白進行增溶。步驟b04可在步驟b05之前或之后執行。在一些實施方案中,步驟b04可以在步驟b05之前和之后執行。
[0192]
在可選步驟b02中,如上面針對步驟a02所描述的那樣除去生物質。此外,在對重組蛋白進行增溶的情況下,從裂解和/或被破壞的細胞中除去生物質的其他方法可包括離心和過濾。
[0193]
在可選步驟b06中,如上面針對步驟a06所描述的那樣除去雜質。步驟b02和b06可在其他步驟之前或之后執行,并且可重復執行。在一些實施方案中,步驟b06可以在步驟b08之前和之后執行。
[0194]
在步驟b08中,分離重組蛋白。上文針對步驟a08描述了用于分離重組蛋白的合適方法。此外,用于分離重組蛋白的方法還可以包括在過濾和/或脫膠中使用額外的膜以除去磷脂。
[0195]
在可選步驟b10中,如上面針對步驟a10所描述的那樣濃縮重組蛋白。在可選步驟b12中,如上面針對步驟b10所描述的那樣干燥重組蛋白。
[0196]
圖3描繪了根據本發明的一個實施方案的重組蛋白純化的工藝流程。本領域的技術人員將理解,圖3所示的一些步驟可以按照交替順序和/或重復進行。本領域的技術人員將認識到,所公開的實施方案并不打算限制本文所提供方法的范圍,并且所述方法可基于各種因素而改變。
[0197]
在步驟c02中,通過利用強離液劑使重組蛋白變性來制備水性兩相溶液。合適的離液劑包括但不限于:硫氰酸胍(gd-scn)、鹽酸胍(gd-hcl)、碘化胍、尿素、高氯酸鋰、醋酸鋰、
氯化鎂、十二烷基硫酸鈉(sds)、碘化鉀(ki)或其任何組合。根據實施方案,可加熱離液劑和蛋白質以促進蛋白質變性。
[0198]
在一些實施方案中,向所述溶液中加入結構構造劑(kosmotrope)(本文中也稱為“沉淀劑”)以促進相分離。合適的結構構造劑包括上面提及的沉淀劑。在其他實施方案中,使用高起始濃度的離液劑使重組蛋白變性,然后緩慢地稀釋離液劑的濃度以便獲得相分離。
[0199]
在步驟c04中,獲得相分離的粘性層。根據相分離的類型,可使用各種方法獲得粘性層,諸如傾析/提取非粘性層或使用hamilton針頭或移液器提取粘性層。其他方法將為本領域的技術人員已知。
[0200]
作為步驟c06,進一步處理相分離的粘性層以除去雜質。合適的透析劑包括雙蒸h2o或低濃度的gd-scn。根據實施方案,可執行各種透析方法,包括卡式透析(cassette dialysis)或本領域已知的其他合適方法。在一些實施方案中,使用正切向流動過濾(tff)透析粘性層。
[0201]
在一些實施方案中,分離的重組蛛絲蛋白為至少60%、至少為65%、至少為70%、至少為75%、至少為80%、至少為85%、至少為90%、至少為95%或至少為99%的全長重組蛛絲蛋白。
[0202]
在一些實施方案中,分離的重組蛛絲蛋白的純度為5-10%、10-15%、15-20%、20-25%、25-30%、30-35%、35-40%、45-50%、50-55%、55-60%、60-65%、65-70%、70-75%、75-80%、80-85%、85-90%、90-95%或95-100%。在一些實施方案中,分離的重組蛛絲蛋白的純度為至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或至少100%。
[0203]
在一些實施方案中,測量或定量了全長重組蛛絲蛋白。可使用任何適宜的方法測量或定量全長重組蛋白的量,所述方法包括但不限于尺寸排阻色譜法(sec)、sds-page、免疫印跡(蛋白質印跡)、高效液相色譜法(hplc)、液相色譜-質譜法(lc-ms),或快速蛋白液相色譜法(fplc),或本領域已知的任何其他適宜的方法,或其任何組合。在一個實施方案中,使用蛋白質印跡法測定了全長重組蛛絲蛋白的量。在另一個實施方案中,使用尺寸排阻色譜法(sec)測量了全長重組蛛絲蛋白的量。
[0204]
實施例
[0205]
下文是用于執行本發明的具體實施方案的實施例。這些實施例的提供僅為了進行示意性的說明,不旨在以任何方式限制本發明的范圍。對于所使用的數字(例如,量、溫度等),已盡力確保精確度,但是當然應該允許一些實驗誤差和偏差。
[0206]
除非另外指明,否則本發明的實踐將利用本領域的技術范圍內的蛋白質化學、生物化學、重組dna技術和藥理學的常規方法。此類技術在文獻中有全面的解釋。參見,例如,t.e.creighton,proteins:structures and molecular properties(w.h.freeman and company,1993);a.l.lehninger,biochemistry(worth publishers,inc.,現行版);sambrook等人,molecular cloning:a laboratory manual(第2版,1989);methods in enzymology(s.colowick和n.kaplan,編者,academic press,inc.);remington's pharmaceutical sciences,第18版(easton,pennsylvania:mack publishing company,1990);carey和sundberg advanced organic chemistry第3版(plenum press)a卷和b卷
(1992)。
[0207]
實施例1:使用單步堿性條件進行18b純化
[0208]
使用高ph值溶液增溶重組蛋白而不破壞分泌重組蛋白的宿主細胞。測試ph值緩沖液濃度和孵育時間,以確定巴斯德畢氏酵母(p.pastoris)中表達的帶有c-末端3x flag標簽(seq id no:40)的橫紋金蛛(argiope bruennichi)masp2嵌段(“18b”,seq id no:38)的重組蛛絲蛋白的溶解度。flag標簽是用甘氨酸殘基(g)接頭連接在18b肽序列的c末端。
[0209]
具體而言,給細胞培養物發酵肉湯接種表達18b重組蛋白的巴斯德畢氏酵母(pichia pastoris),并孵育以允許表達18b蛋白。離心培養物以收獲細胞,并將細胞團塊以1:1(等量的細胞團塊和水)或1:3(一份細胞團塊和兩份水)的比例重懸于蒸餾水中。用2-10m naoh將細胞團塊懸浮液的ph值調節至最終ph值11.8-11.9。將細胞團塊懸浮液在室溫下在攪拌下孵育15-30分鐘。孵育期間用naoh調節ph值以維持ph值為11.8-11.9。離心細胞團塊懸浮液,并收集含有重組蛋白的上清液。將上清液凍干以濃縮18b蛋白,并如下所述的那樣通過尺寸排阻色譜法(sec)評估回收的18b蛋白量(圖4a和4b)。
[0210]
使用尺寸排阻色譜法(sec)分析高分子量雜質、低分子量雜質和中等分子量雜質、單體18b和聚集體18b的相對含量。將18b粉末溶解于5m硫氰酸胍(gdscn)中,并進樣至yarra sec-3000sec-hplc色譜柱上以根據分子量分離成分。將折光率用作檢測模式。對18b聚集體、18b單體、低分子量(1-8kda)雜質、中等分子量雜質(8-50kda)和高分子量雜質(110-150kda)進行了定量。相關組成是以質量%和面積%報告的。使用bsa作為一般蛋白標準品,假設所有蛋白質中》90%的蛋白質顯示出dn/dc值(折光率的響應因子)在彼此的約7%范圍內。使用聚(環氧乙烷)作為保留時間標準品,并使用bsa校準品作為檢查標準品,以確保該方法具有一致的表現。作為對照品,還評估了使用尿素増溶18b蛋白所純化的樣品。
[0211]
在ph 11.9下從巴斯德畢氏酵母細胞團塊中進行18b的堿性提取,得到針對使用5m gdscn分離的18b蛋白量歸一化的70-75%的全長18b蛋白提取收率。使用提取的18b蛋白的sec面積%計算樣品的純度。堿性提取物中18b單體的純度為約35%單體面積、35%中等分子量雜質面積和28%低分子量雜質面積%(圖4a和4b)。相比之下,用10m尿素増溶18b蛋白導致18b蛋白的收率較低,約為26%單體面積、27%中等分子量雜質面積和45%低分子量雜質面積。這些數據表明,堿性增溶和提取方法導致18b收率較大以及分離的18b蛋白的純度較高。
[0212]
實施例2:分離的絲多肽的進一步純化
[0213]
為進一步純化18b蜘蛛蛋白,使用750k mw過濾器和8個透析體積(diavolume)的水,對從以上堿性提取中分離出的18b樣品進行超濾和正切向流動過濾。如前所述的那樣,通過sec評估包含未經過濾的蛋白、經超濾的蛋白以及在1、3、6和8個透析體積的水后的蛋白的樣品。每種樣品中18b單體、中等分子量雜質、低分子量雜質和高分子量雜質的sec%面積在圖5中示出。最左側的棒上示出了未經過濾的蛋白樣品(“未經調節的進料”),左側第二個棒上示出了經超濾的蛋白樣品(“未經調節的ufr”),1、3、6或8個透析體積的樣品分別在中左、中右、從右側數第二個和最右側棒中示出(圖5)。洗滌的透析體積增加導致18b單體的%面積增加以及低分子量雜質的%面積減少。
[0214]
實施例3:使用兩步堿性提取進行18b純化
[0215]
為了增加細胞中18b蛋白質的回收率,還執行了兩步提取工藝。用2m naoh作為第
一個堿性提取步驟,將表達18b的巴斯德畢氏酵母細胞的全細胞肉湯的ph值調節至ph 11.8并孵育30-60分鐘。將表達18b的巴斯德畢氏酵母細胞的全細胞肉湯的對照樣品與5mgdscn一起孵育約15分鐘,以增溶和提取18b蛋白。使細胞形成團塊并收集上清液。作為第二個提取步驟,通過以1:1、1:2或1:3的團塊:水比例添加ph 11.8的水來對來自第一個堿性提取步驟的剩余團塊進行再提取。收集含有重組18b蛋白的第一次和第二次堿性提取的上清液。凍干上清液以濃縮18b蛋白,并按照先前實施例1中所述的那樣通過sec評估樣品。示出了每個提取條件和gdscn對照的兩次單獨實驗運行(圖6a)。增加堿性水的量(1:2和1:3的比例)增加了回收的18b蛋白的量。然而,雙重提取18b單體蛋白的純度在單次提取時最高。隨著第二次提取中使用的堿性水相對于團塊的增加,18b單體的純度也增加(圖6b)。
[0216]
然后,如前所述的那樣使用750k mw過濾器和最高8個透析過濾體積的水,通過超濾和正切向流動過濾純化來自提取的樣品。通過sec評估由此獲得的絲多肽組合物的純度(圖7a和7b)。圖7a示出了18b單體、中等分子量雜質和低分子量雜質的%面積。正切向流動過濾期間透析體積增加導致18b單體峰面積增加。圖7b示出了每種樣品、起始物料(“sm”)、經超濾的保留物(“uf r”)和正切向流動過濾透析體積樣品1、2、3、4、6和8(df 1、2、3、4、6、8)的sec峰。
[0217]
實施例4:通過改變ph值從堿性提取物中進一步分離出絲多肽
[0218]
通過調節提取物的ph值,使來自堿性提取物的18b重組蛋白從堿性提取物中沉淀出來。在此實驗中,從全細胞培養肉湯進行的堿性提取首先通過加入naoh調節全細胞培養肉湯的ph值至最終ph11.8-11.9,從而產生堿性細胞懸液來執行。將細胞懸液在室溫下在攪拌下孵育15-30分鐘。孵育后,離心細胞懸液,收集含有被增溶的18b蛋白的堿性上清液以產生18b堿性提取物。
[0219]
然后,用不同ph條件處理18b堿性提取物樣品以使18b蛋白沉淀。向堿性提取物樣品中加入h2so4至最終ph值為4、5、6、7、8、9或10。然后,從堿性提取物中分離出含有18b重組蛋白的沉淀。如前所述的那樣通過sec評估沉淀樣品。圖8示出了每種ph值條件下高分子量(hmw)峰、18b單體和聚集體峰、中等分子量(imw)峰和低分子量(lmw)峰的sec%面積純度。圖9示出了在測試的每種沉淀劑ph值下18b蛋白的收率%。在所有條件中,在初始堿性提取18b蛋白后,發現單階段沉淀法的沉淀步驟ph值為7最有效,其中約70%的%面積表明純度約為70%。圖10示出了在ph 6下18b沉淀物的sec圖譜。
[0220]
除透析離心外,還執行了tff(正切向流動過濾)以分離出堿性提取物。然而,透析離心在去除雜質方面比tff更有效,并且一般達到60-70%的蛋白回收率和》70%的18b蛋白純度。
[0221]
將在ph 6下獲得的18b蛋白沉淀凍干,濕紡成纖維,并對其進行韌性測量。將凍干的18b蛋白溶解于甲酸中至最終蛋白量為36wt%。將溶解的蛋白以40μl/min擠出至100%乙醇凝結浴中以產生纖維。通過該方法生產的18b纖維具有19.4cn/tex的韌性。
[0222]
實施例5:使用堿性條件進行的p0回收與使用鹽沉淀進行的p0回收的對比
[0223]
測試ph值緩沖液濃度和孵育時間,以確定它們在大腸埃希菌細胞裂解液中增溶p0(seq id no:39)重組絲蛋白用于從細胞培養物中提取方面的用途。
[0224]
給細胞培養發酵肉湯接種表達具有c末端6x-his標簽的p0重組蛋白的大腸埃希菌,并孵育以允許表達p0蛋白。將培養物以15,000rcf離心以使細胞形式團塊。除去上清液,
以1:4(細胞團塊:緩沖液)或1:9(細胞團塊:緩沖液)的比例將細胞團塊重懸于h2o中,并孵育15-60分鐘。用naoh將重懸細胞團塊的ph值調節至最終ph 9、10、10.5或11。作為對照,也將重懸的細胞團塊樣品與5m硫氰酸胍(gdscn)一起孵育并超聲處理1.5分鐘。渦旋樣品,并使用rotisserie混合器勻質化。通過以15,000rcf離心5分鐘來凈化裂解物,并保留經凈化的含有p0蛋白的上清液。使用0.25μm過濾上清液,并通過bca、elisa和免疫印跡進行分析。
[0225]
將樣品針對1mg/ml蛋白濃度作歸一化,并使用抗his抗體通過免疫印跡法評估每種樣品中被增溶的p0量(圖11)。泳道h1是在5mgdscn中通過超聲裂解的對照樣品。泳道b1-b4是以1:4細胞團塊:緩沖液(ph 9、ph 10、ph 10.5和ph 11)的比例混合的樣品,泳道b7-b10是以1:9細胞團塊:緩沖液(ph 9、ph 10、ph 10.5和ph 11)的比例混合的樣品。泳道c2-c4是與gdscn一起孵育15、30或60分鐘的樣品。
[0226]
在示例性方法中,給細胞培養物發酵肉湯接種表達p0重組蛋白的大腸埃希菌,并孵育以使p0蛋白表達。將培養物以15,000rcf離心以使細胞形式團塊。將細胞團塊以1:1或1:3的細胞團塊:液體比重懸于h2o中,并將細胞懸液在10,000至40,000psi下勻質化,以裂解大腸埃希菌細胞。通過離心凈化裂解液,并保留含有不溶性p0的細胞團塊。將細胞團塊重懸于h2o中,并用2-10m naoh調節細胞團塊懸浮液的ph值至最終ph 11.5。將細胞團塊懸浮液在室溫下在攪拌下孵育15-60分鐘。用naoh調節ph值,以使孵育期間的ph值保持在11.5。孵育后,離心細胞懸液,收集含有重組p0蛋白的上清液。
[0227]
作為額外的方法,還可以使用含10m尿素的堿性緩沖液從細胞團塊中提取不溶性p0。在用h2o重懸細胞團塊后,用2-10m naoh調節細胞團塊懸浮液的ph值至最終ph值為11.5,并添加尿素至尿素的最終濃度為10m。將細胞團塊懸浮液在室溫下在攪拌下孵育15-60分鐘。
[0228]
在所有方法中,分離的重組p0蛋白可通過額外的凈化步驟諸如過濾、離心、沉淀或層析來進一步純化。
[0229]
等效方案
[0230]
雖然已經參考優選的實施方案和各種替代實施方案對本發明進行特別展示和描述,但相關領域的技術人員應理解,在不脫離本發明的精神和范圍的情況下可對其做出形式和細節上的改變。
[0231]
本說明書的正文中引用的所有參考文獻、已授權的專利和專利申請,都通過引用以其整體并入本文用于所有目的。
[0232]
非正式序列表
[0233]
[0234]
相關技術
網友詢問留言
已有1條留言
-
 68187530... 來自[中國] 2023年04月24日 17:19牛牛牛
68187530... 來自[中國] 2023年04月24日 17:19牛牛牛
1